Práctica de Laboratorio-Espectros de líneas, ensayo de la llama
Anuncio

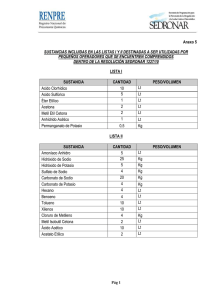
Licenciatura en Gestión Ambiental Curso: Radiaciones, Medio Ambiente y Ser Humano PRÁCTICA DE LABORATORIO Conceptos Básicos 2: Espectros de líneas, ensayo de la llama LoengridBethencourt Setiembre2014 0 1. OBJETIVOS Reconocer la presencia de elementos como sodio, potasio, calcio, hierro y cobre en sales, por el color que imparten a la llama de un mechero. Identificar el catión presente en una muestra problema. 2. INTRODUCCIÓN Algunos de los sorprendentes colores de los fuegos artificiales son colores de las llamas de metales alcalinos (Li, Na, K, Rb y Cs) y alcalinotérreos (Ca, Sr y Ba). Merece la pena destacar que los fuegos artificiales fueron monocromos hasta el siglo XIX, ya que se utilizaba el sodio casi en exclusiva. Se necesitaron determinados adelantos químicos para producir los vivos colores que vemos hoy en día. Así, la introducción del color rojo se encuentra estrechamente ligada a la historia del descubrimiento de los elementos químicos, concretamente del estroncio, que es, aún en la actualidad, uno de los componentes básicos en la fabricación de estos productos. Estos colores de los fuegos artificiales están relacionados con las estructuras electrónicas de los átomos metálicos. Las diferentes energías entre los orbitales s y p de la capa de valencia de los metales del grupo I A y II A corresponden a las longitudes de onda de la luz visible. Por ese motivo, cuando se calientan en una llama los compuestos de algunos metales de este tipo se producen colores característicos, que son debidos a que los átomos del metal pasan a estados energéticos excitados al absorber energía de la llama; los átomos que han sido excitados pueden perder su exceso de energía por emisión de luz de una longitud de onda característica. Es necesario resaltar que los compuestos de estos elementos contienen a los átomos metálicos en forma de iones positivos en el estado sólido, no obstante, cuando se calientan a la elevada temperatura de una llama se disocian dando átomos gaseosos y no iones. De aquí que los compuestos confieran a la llama los mismos colores característicos que los elementos. Por ejemplo, cuando el NaCl se vaporiza en una llama, ocurre lo siguiente: ‐ Se obtienen los átomos gaseosos Na (g) y Cl (g). ‐ Los átomos de Na (g) se excitan a energías altas, generando un estado excitado Na* (g). ‐ Cuando estos átomos excitados Na* (g) vuelven a adquirir sus configuraciones electrónicas del estado fundamental, se emite luz con una longitud de onda de 589 nm y por eso la llama se verá de color amarillo. Lo anterior puede resumirse con el esquema que se presenta a continuación: NaCl (g) → Na (g) + Cl (g) Na (g) → Na* (g) Estado fundamental Estado excitado 1 [Ne] 3s [Ne] 3p1 Na* (g) → Na (g) + hν (589 nm) Energía En la tabla siguiente se muestran los colores característicos de algunos elementos metálicos: 1 Elemento Color de la llama Intensidad (nm) Ba Verde Claro Baja 515 Ca Rojo ‐ Anaranjado Media 606 Cu Azul verde ‐ intenso Media 579 – 585 Cr Amarillo Media 579 – 585 Cs Rojo Claro Media 652 – 694 In Violeta ‐ Rosado Media 451 K Violeta Alta 404,4 Li Rojo ‐ Intenso Alta 671 Na Amarillo Muy Alta 589,0 – 589,6 Sr Rojo Media 662 – 688 Esta propiedad que tienen los vapores de ciertos elementos de impartir un color característico a la llama es usada en la identificación de varios elementos metálicos. Para un elemento particular, la coloración de la llama es siempre la misma, independientemente de si el elemento se encuentra en estado libre o combinado con otros. Adicionalmente, en una mezcla cada elemento exhibe a la llama su propia coloración, independientemente de los demás componentes. Por lo tanto, el color a la llama para una mezcla de elementos estará compuesto por todos los colores de sus componentes. Ciertos colores sin embargo, son más intensos y más brillantes, enmascarando a aquellos de menor intensidad. El color amarillo del sodio, por ejemplo, opacará parcialmente a todos los demás. Por esto un ensayo a la llama ordinario no resulta de mucha utilidad en la identificación de las mezclas. En estos casos es recomendable usar filtros de color, o un espectroscopio. Usualmente, la interferencia del sodio, en una mezcla donde los componentes sean sales de sodio y potasio, puede ser eliminada por medio de un vidrio azul de cobalto, el cual absorbe la luz amarilla pero transmite la luz violeta del potasio. Por medio de ese filtro es posible detectar la llama violeta del potasio aún en presencia del sodio. En esta práctica de laboratorio se reconocerá la presencia de elementos como sodio, potasio, calcio y cobre en sales, por el color que imparten a la llama de un mechero. Adicionalmente, se identificará el catión presente en una muestra problema. 3. PARTEEXPERIMENTAL 3.1. Reactivos/sustancias ‐ Agua destilada ‐ Sales de distintos compuestos: Na, K, Ca y Cu 3.2. Materiales ‐ Alambre de cromo‐níquel ‐ Mechero Bunsen ‐Solución de ácido clorhídrico 2 3.3. Procedimiento 1. Preparar una disolución saturada de cada sal (con unos pocos miligramos es suficiente) en unos 10 mL de agua destilada. 2. Guardar cada una de las disoluciones en botellas debidamente etiquetadas para no confundirlas. 3. Tomar un alambre de cromo‐níquel y verificar que está limpio introduciéndolo en la llama; si se observa alguna coloración es debido a la contaminación del alambre. Lavarlo bien y repitir el ensayo: el alambre limpio no debe producir ningún color cuando se somete a la llama. 4. Sumergir el alambre en una porción de la muestra y someterlo a la llama. 5. Observar los colores obtenidos en la llama para cada caso. 6. Identificar la muestra problema en función de las observaciones realizadas. 4. REPORTEDELABORATORIO Compuesto NaCl KCl CaCl2 CuSO4 Muestra problema Color que emite Longitud de onda (nm) Catión presente en la muestra problema: ___________________________ 5. REFERENCIAS ‐ Universidad Nacional Experimental del Táchira, Departamento de Química y Biología. Manual de Laboratorio de Química General I. Venezuela, 2004. ‐ Universidad de Cantabria, Departamento de Física Aplicada. Introducción a la Física Experimental. Guía de la Experiencia. Espectros de Emisión Atómicos. España, 2005. ‐ Álvarez, M., Duarte, R. y Rodríguez, E. Manual de Laboratorio. Versión para el Alumno. Introducción a la Física Moderna II. Universidad de Sonora, Departamento de Física. México, 2012. ‐ Skoog, D. y Leary, J. Análisis Instrumental, 4ª Edición, McGraw‐Hill, 1994. ‐ Chang, R. Química, 7ª Edición, McGraw‐Hill, 2002. 3