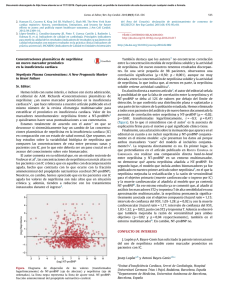
Fragmentos circulantes de propéptidos natriuréticos tipo B N
Anuncio

Clinical Chemistry 59:10 1523–1531 (2013) Medicina basada en la evidencia y la utilización de prueba Fragmentos circulantes de propéptidos natriuréticos tipo B N-terminal en el plasma de pacientes con insuficiencia cardiaca Jared Yong Yang Foo,1† Yunxia Wan,1† Benjamin L. Schulz,2† Karam Kostner,3,4 John Atherton,3,5 Justin Cooper-White,1,6 Goce Dimeski,3,7 y Chamindie Punyadeera1,6,8* ANTECEDENTES: El uso de los análisis del propéptido natriurético tipo B N-terminal (NT-proBNP) no estándar puede contribuir al diagnóstico incorrecto de la insuficiencia cardiaca (IC). Asimismo, aún debe establecerse un consenso común respecto de las formas circulantes del NT-proBNP en uso en los análisis actuales. Intentamos caracterizar y cuantificar las diferentes formas del NT-proBNP en la circulación de los pacientes con IC. CONCLUSIONES: En el plasma obtenido de los pacientes con IC, se observó NT-proBNP inmunoreactivo en forma de múltiples fragmentos truncados en los extremos N y C de la molécula de NT-proBNP completa. La inmunodetección del NT-proBNP se mejoró considerablemente con el uso de anticuerpos no dirigidos a esas regiones terminales. Estas conclusiones respaldan el desarrollo de un análisis de NT-proBNP de última generación dirigido a epı́topos no terminales y que evita la región glucosilada central de esta molécula. MÉTODOS: © 2013 American Association for Clinical Chemistry Se obtuvieron muestras de plasma de pacientes con IC (n ⫽ 20) en reposo y se almacenaron a ⫺80 °C. Se enriqueció el NT-proBNP del plasma de pacientes con IC mediante el uso de inmunoprecipitación seguida de análisis espectrométrico de masas. Se desarrollaron y validaron inmunoanálisis AlphaLISA® no competitivos homogéneos a medida para cuantificar 6 fragmentos de NT-proBNP. RESULTADOS: La espectrometrı́a de masas identificó la presencia de varias formas procesadas en los extremos N y C del NT-proBNP circulante, con proteólisis fisiológica entre Pro2-Leu3, Leu3-Gly4, Pro6-Gly7 y Pro75-Arg76. Acorde con este resultado, los inmunoanálisis AlphaLISA demostraron que los anticuerpos dirigidos a los extremos N o C terminales midieron una baja concentración aparente de NT-proBNP circulante. La aparente concentración de NT-proBNP circulante se aumentó con anticuerpos dirigidos a los epı́topos no glucosilados y no terminales (P ⬍ 0.05). 1 The Australian Institute for Bioengineering and Nanotechnology (Instituto Australiano de Bioingenierı́a y Nanotecnologı́a); 2 School of Chemistry and Molecular Biosciences (Facultad de Quı́mica y Biociencias Moleculares); y 3 School of Medicine, the University of Queensland (Facultad de Medicina de la Universidad de Queensland), Brisbane, Queensland, Australia; 4 Department of Cardiology (Departamento de Cardiologı́a), Mater Adult Hospital, Brisbane, Queensland, Australia; 5 Department of Cardiology (Departamento de Cardiologı́a), Royal Brisbane and Women’s Hospital, Brisbane, Queensland, Australia; 6 School of Chemical Engineering, the University of Queensland (Facultad de Ingenierı́a Quı́mica de la Universidad de Queensland), Brisbane, Queensland, Australia; 7 Chemical Pathology (Patologı́a Quı́mica), Princess Alexandra Hospital, Brisbane, Queensland, Australia; 8 Afiliaciones actuales: Saliva Translational Research Group, The University of Queensland Diamantina Institute (Universidad de Queensland Diamantina Institute), Woolloongabba, Australia. La insuficiencia cardiaca (IC)9 es un problema sanitario mundial, asociado con resultados clı́nicos deficientes y una carga económica considerable en los sistemas sanitarios de todo el mundo (1 ). Aproximadamente 23 millones de personas en todo el mundo conviven con la IC y es probable que esta cifra aumente en el futuro cercano debido a la población que envejece y aumenta (2 ). Se ha demostrado que la medición del péptido natriurético tipo B (BNP) en plasma o el fragmento N-terminal del propéptido natriurético cerebral (NTproBNP) mejoran la exactitud del diagnóstico en pacientes con sospecha de IC (3–5 ) Sin embargo, la utilidad de estos péptidos para la IC está limitada por amplias variaciones de un paciente a otro, la presencia de varias formas del péptido NTproBNP en la sangre (3 ) y grandes diferencias en la imprecisión entre los métodos de detección utilizados. El último punto ad- † Jared Yong Yang Foo, Yunxia Wan y Benjamin L. Schulz contribuyeron de igual manera al trabajo y deberı́an considerarse como primeros autores. * Dirigir correspondencia para estos autores a: Saliva Translational Research Group, The University of Queensland Diamantina Institute, Level 6, TRI | 37 Kent St. |, Woolloongabba, QLD 4102, Australia. Fax ⫹61-(0)7-3443-6966; correo electrónico: [email protected]. Recibido para la publicación el lunes, 26 de noviembre de 2012; acceptado para la publicación el miércoles, 12 de junio de 2013. Previously published online at DOI: 10.1373/clinchem.2012.200204 9 Abreviaturas no estándar: IC, insuficiencia cardiaca; BNP, péptido natriurético tipo B; NT-proBNP, propéptido natriurético tipo B N-terminal; NYHA, New York Heart Association (Asociación del Corazón de Nueva York); IP, inmunoprecipitación; LC, cromatografı́a de lı́quidos; MS/MS, espectrometrı́a de masas en tándem; LOD, lı́mite de detección. 1523 quiere particular importancia cuando los pacientes obtienen acceso a diferentes servicios de laboratorio que utilizan plataformas de diagnóstico diferentes (4, 5 ). Asimismo, tampoco hay consenso acerca de los fragmentos circulantes del NT-proBNP derivado del proBNP preliminar segregado por el tejido cardiaco durante la IC. Esta falta de consenso se complica aún más por la creciente evidencia que indica que los inmunoanálisis de NT-proBNP pueden detectar proBNP en la sangre de pacientes con IC, causado por la falta de procesamiento del proBNP preliminar por la conversión de la proteasa furina y corina presente en la circulación (6 – 8 ). A fin de evaluar las diferencias en el desempeño analı́tico y los resultados clı́nicos de los inmunoanálisis de BNP y NT-proBNP, se llevó a cabo un programa de pruebas de capacidad, denominado CardioOrmoCheck, por parte de Clerico y cols. para determinar la imprecisión de la medición (8.7 %) en las concentraciones de NT-proBNP mediante el uso de 3 inmunoanálisis de NT-proBNP que utilizan anticuerpos y normas para el diagnóstico de Roche (9 ). También resulta evidente a partir del estudio CardioOrmoCheck que la mayorı́a de los laboratorios italianos utilizaron el NTproBNP en lugar del BNP. Los análisis de NT-proBNP de Roche utilizan diferentes anticuerpos (policlonales y monoclonales) dirigidos a diferentes epı́topos de NTproBNP (10 ). Ala-Kopsala y cols. han demostrado que existen variantes (truncamientos en los extremos amı́nicos y carboxı́licos) del NT-proBNP circulante en el plasma obtenido de pacientes con IC (11 ), lo que origina diferentes moléculas de NT-proBNP inmunoreactivas menores que el fragmento completo de 76 aminoácidos. Sin embargo, este estudio no se concentró en la cuantificación e identificación de las formas de NT-proBNP circulante en pacientes con IC. Es probable que la cuantificación y alcanzar una opinión consensuada sobre las principales formas moleculares del NT-proBNP en la circulación conduzcan a una mejora en la exactitud del análisis de NT-proBNP respecto del diagnóstico y el tratamiento de los pacientes con IC. Los propósitos de este estudio fueron la identificación y cuantificación de la principal forma de circulación del NT-proBNP en el plasma obtenido de pacientes con IC; dicha información puede usarse para brindar asesoramiento sobre el desarrollo de análisis de diagnóstico de última generación. Materiales y métodos PARTICIPANTES Y OBTENCIÓN DE MUESTRAS Esta investigación fue aprobada por el University of Queensland Medical Ethical Institutional Board (Comité Institucional Ético Médico de la Universidad de 1524 Clinical Chemistry 59:10 (2013) Queensland) y el Mater Hospital Medical Ethical Review Board (Comité de Revisión Ético del Hospital Mater). Todos los participantes eran mayores de 18 años y otorgaron consentimiento informado por escrito antes de donar las muestras para nuestro estudio. Reclutamos pacientes con IC sintomáticos [n ⫽ 20; clase funcional 3 de New York Heart Association (Asociación del Corazón de Nueva York, NYHA)] con una fracción de expulsión del ventrı́culo izquierdo ⬍ 40 % de un departamento de cardiologı́a general. El diagnóstico de IC fue confirmado por el cardiólogo del Mater Adult Hospital (Hospital Mater de Adultos) conforme a las directrices para la prevención, la detección y el tratamiento de la IC crónica en Australia (12 ). Se solicitó a todos los participantes del estudio abstenerse de realizar ejercicios 24 h antes de la obtención de las muestras. Los participantes eran de origen europeo, africano y asiático, y no presentaban sı́ntomas de fiebre ni de infección respiratoria. Las muestras de sangre se obtuvieron en tubos de AEDT (Greiner Vacuette®; Greiner Bioone) para minimizar la degradación in vitro del NT-proBNP y a continuación se centrifugaron de inmediato a 500 g a 4 °C durante 10 min. Las muestras se dividieron en partes y se almacenaron a ⫺80 °C. PURIFICACIÓN Y CARACTERIZACIÓN POR ESPECTROMETRÍA DE MASAS DEL NT-proBNP ENDÓGENO Para identificar los principales productos proteolı́ticos del NT-proBNP en la circulación, se utilizó el plasma de pacientes con IC (n ⫽ 4) para las reacciones de inmunoprecipitación (IP). En resumen, el anticuerpo monoclonal NT-proBNP (dirigido a los aminoácidos 13–20) se conectó quı́micamente a Dynabeads® M-270 Epoxy (Invitrogen) mediante quı́mica EDS-NHS [1-etil-3-(3-dimetilaminopropil)-carbodiimida y Nhidroxisuccinimida] conforme a las instrucciones del fabricante. El NT-proBNP de plasma enriquecido se digirió con tripsina en 50 mmol/l Tris-HCl pH 7.5 con 10 mmol/l ditiotreitol a 37 °C durante 16 h; se quitó la sal con C18 ZipTips (Millipore) y se analizó mediante cromatografı́a de lı́quidos (LC)-ionización por electronebulización– espectrometrı́a de masas en tándem (MS/MS) con un sistema Prominence nanoLC (Shimadzu) en un espectrómetro de masas TripleTof 5600 con una interfaz Nanospray III (AB SCIEX), como se describió anteriormente (13 ). Se quitó la sal de aproximadamente 2 g de péptido mediante captura Agilent C18 (tamaño de orificio de 300-Å, tamaño de partı́cula de 5-m, diámetro interior de 0.3-mm ⫻ 5 mm) a un caudal de 30 l/min durante 3 min, y luego se realizó la separación en una columna Vydac EVEREST de fase inversa C18 HPLC (tamaño de orificio de 300-Å, tamaño de partı́cula de 5-m, diámetro interior de Evaluación de LMPGs NACB con AGREE II Figura 1. Diagrama esquemático que ilustra los puntos de unión de anticuerpos en los 6 fragmentos del NT-proBNP glucosilado y la cobertura de péptidos de espectrometrı́a de masas del NT-proBNP enriquecido mediante inmunoprecipitación del plasma. (A), Los 6 inmunoanálisis usan anticuerpos monoclonales de diagnóstico para detectar NT-proBNP1–20, NT-proBNP13– 45, NT-proBNP1– 45, NT-proBNP28 –76, NT-proBNP13–76 y NT-proBNP1–76. Los sitios de proteólisis en los extremos N y C detectados por nuestro análisis de espectrometrı́a de masas se muestran con lı́neas verticales rojas. * Par de anticuerpos que aportó la mayor concentración de NT-proBNP aparente. (B). Las secuencias correspondientes a los péptidos identificados con una confianza ⬎ 99 % están en negrita. Los puntos de división no tripsı́nicos se muestran con lı́neas rojas verticales (consulte la Tabla 2). 150-m ⫻ 150 mm) a un caudal de 1 l/min. Los péptidos se separaron con un gradiente del 10 % al 60 % de amortiguador B (80 % de acetonitrilo con 0.1 % de ácido fórmico) durante 45 min, con amortiguador A (1 % de acetonitrilo y 0.1 % de ácido fórmico) y amortiguador B. Se realizó el ajuste de las configuraciones del gas y la tensión según lo dispuesto. Se realizó un análisis de MS TOF (espectrometrı́a de masas de tiempo de vuelo) de 350 a 1800 m/z durante 0.5 s seguido de la adquisición de espectrometrı́a de masas en tándem dependiente de la información con selección de electroforesis capilar automatizada de los 20 principales péptidos de 40 m/z a 1800 durante 0.05 s por espectro. Se identificaron las proteı́nas mediante Protein Pilot (AB SCIEX) y la búsqueda se realizó en la base de datos LudwigNR (descargada en http://www.wehi. edu.au/faculty/advanced_research_technologies/proteomics/ wehi_systems_biology_mascot_server conforme a la actualización del 27 de enero de 2012; 16 818 973 secuencias; 5 891 363 821 residuos) con los siguientes ajustes estándar: tipo de muestra, identificación; alquilación de cisteı́na, ninguna; instrumento, TripleTof 5600; especie, sin restricción; objetivo de identificación, modificaciones biológicas; enzima, tripsina; tarea de búsqueda, identificación exhaustiva. Se realizó el análisis de tasa de detección de falsos positivos mediante ProteinPilot en todas las búsquedas. Se incluyeron los péptidos identificados con ⬎ 99 % de confianza y con una tasa de detección falsa local ⬍1% para su posterior análisis, y se inspeccionaron manualmente los espectros de fragmentación de espectrometrı́a de masas en tándem. Los cromatogramas de iones extraı́dos se obtuvieron mediante PeakView 1.1. INMUNOANÁLISIS AlphaLISA DE NT-proBNP EN PLASMA Medimos la inmunoreactividad del NT-proBNP con 6 inmunoanálisis AlphaLISA con diferentes especificidades de epı́topos (Fig. 1A). Todos los anticuerpos fueron de origen monoclonal y se compraron a Hy Test (http://www.hytest.fi) excepto por 11D1, de My Biosource (MBS311067; http://www.mybiosource.com). La especificidad de estos anticuerpos monoclonales se probó y validó ampliamente por parte de los fabricantes y también se utilizó de forma correcta para investigar la inmunodetección del NT-proBNP glucosilado Clinical Chemistry 59:10 (2013) 1525 circulante en la sangre humana (14 ). Asimismo, se probó de forma exhaustiva la especificidad de estos anticuerpos monoclonales mediante Hy Test y My Biosource en análisis no competitivos como anticuerpos de detección y captura para el uso con muestras en suero/plasma de pacientes con IC ası́ como para analitos de proBNP y NT-proBNP no glucosilados expresados de forma recombinante. Los 6 inmunoanálisis de NT-proBNP presentan una denominación conforme al primer aminoácido al que se une al anticuerpo de captura en la molécula del NT-proBNP y el último aminoácido al que se une el anticuerpo de detección en la molécula del NTproBNP de los aminoácidos 1 a 76: NT-proBNP1–20 (5B61–12 y 13G1213–20); NT-proBNP13– 45 (18H513–20 y 11D128 – 45); NT-proBNP1– 45 (5B61–12 y 11D128 – 45); NT-proBNP28 –76 (11D128 – 45 y 28F867–76); NTproBNP13–76 (18H513–20 y 28F867–76); NT-proBNP1–76 (5B61–12 y 28F867–76). Cada análisis AlphaLISA de NTproBNP se preparó mediante el uso de un par de anticuerpos monoclonales, con un anticuerpo biotinilado y unido a las microesferas del donante con recubrimiento de estreptavidina (5B6, 11D1, o 18H5) y el segundo anticuerpo conjugado con las microesferas del receptor (11D1, 13G12 o 28F8) (15 ) (16 –19 ). El analito del NT-proBNP se compró a PerkinElmer. Las normas del NT-proBNP se prepararon mediante el uso de mezclas de plasmas obtenidas de voluntarios sanos (n ⫽ 10) y la combinación con amortiguador del inmunoanálisis High Block en una proporción de 50 %:50 %. Esto nos permitió superar los efectos de la matriz que comúnmente se encuentran al desarrollar los inmunoanálisis en plasma. BIOTINILACIÓN DE ANTICUERPOS MONOCLONALES DE NT-proBNP PARA INMUNOANÁLISIS Se agregó N-hidroxisuccinimida-ChromaLink-biotina (2 g/l) (9007–105K, Solulink) al anti-NT-proBNP respectivo a una proporción molar de 30:1 y se incubó durante 2 h a temperatura ambiente. Se utilizaron columnas Zeba Spin Desalting Columns (89882; Thermo Scientific Pierce) para eliminar la biotina sin ligar y purificar el anticuerpo NT-proBNP biotinilado después de la incubación. El anticuerpo NT-proBNP biotinilado se almacenó a 4 °C. ACOPLAMIENTO DE ANTICUERPOS NT-proBNP A LAS MICROESFERAS DEL RECEPTOR AlphaLISA Se agregó disolución amortiguadora de fosfato (250 l) a las 50 l de microesferas del receptor AlphaLISA (6772003; PerkinElmer) y se centrifugó a 16 000g durante 15 min, y se desechó el supernadante. Se agregó al sedimento de microesferas del receptor 0.1 mg de anticuerpo NT-proBNP, 1.25 l del 10 % de Tween-20, 25 g de NaBH3CN y PBS (0.13 mol/l, pH 7.4, Gibco®; 1526 Clinical Chemistry 59:10 (2013) Life Technologies) para lograr un volumen final de reacción de 200 l, que se incubó durante 24 h a 37 °C. Luego se agregó 10 l de carboximetoxilamina a la reacción con 1 h de incubación a 37 °C. El anticuerpo monoclonal NT-proBNP conjugado se purificó por centrifugación a 16 000 g durante 15 min; se desechó el supernadante y el sedimento de microesferas se resuspendió en 1 ml de 0.1 mol/l de Tris- HCl (pH 8). El paso de purificación se repitió 3 veces y luego se realizó la sonicación (20 pulsos por segundo). Las microesferas conjugadas se almacenaron a 4 °C. INMUNOANÁLISIS AlphaLISA DE NT-proBNP CON DESARROLLO INTERNO En resumen, el inmunoanálisis AlphaLISA utiliza un par de anticuerpos NT-proBNP. Un anticuerpo se biotiniliza y se une a las microesferas del donante con recubrimiento de estreptavidina mientras que un segundo anticuerpo se conjuga a las microesferas del receptor. Las microesferas entran en contacto directo en presencia del NT-proBNP. La estimulación de las microesferas del donante promueve la liberación de moléculas simples de oxı́geno que desencadenan la transferencia de una cascada de energı́a a las microesferas del receptor, lo que origina un aumento marcado de emisión de luz a 615 nm (18 ). Las muestras se analizaron por triplicado en 384 pocillos ProxiPlatesTM (PerkinElmer®). La única excepción al protocolo del fabricante fue reducir el volumen de reacción total de 50 l a 10 l. En resumen, el análisis consistió en una muestra/analito (1 l), anticuerpo biotinilado (25 mmol/l) y mezcla de microesferas del receptor (25 ng/l), y microesferas del donante de estreptavidina (80 ng/l). Para todos los inmunoanálisis, la concentración final de microesferas del receptor fue de 10 g/ml y la concentración final del anticuerpo biotinilado fue de 1 nmol/l. El tiempo total de incubación fue de 1.5 h a temperatura ambiente en la oscuridad y la lectura de placas se realizó con el lector EnSpire™. CARACTERÍSTICAS DE DESEMPEÑO DE LOS ANÁLISIS DE NT-proBNP AlphaLISA A fin de evaluar la idoneidad del análisis AlphaLISA para medir el NT-proBNP en plasma, agregamos 2 concentraciones conocidas del analito del NT-proBNP en mezclas de plasmas de sujetos sanos. Tanto las muestras enriquecidas como las no enriquecidas se midieron en el mismo inmunoanálisis AlphaLISA. Los porcentajes de recuperación de las 2 muestras de plasma enriquecidas se calcularon con referencia a las correspondientes mezclas de plasmas no enriquecidas en un único análisis AlphaLISA, mediante el uso de la siguiente ecuación (20 ): Evaluación de LMPGs NACB con AGREE II Porcentaje de recuperación 共%兲 Table 1. Caracterı́sticas de los pacientes con IC. ⫽ 兵共关NT-proBNP]plasma agregado ⫺ 关NT-proBNP]plasma sin agregar兲/ Parámetro Edad, años, media (SD) 关NT-proBNP]agregado} ⫻ 100. Pacientes con IC (n ⴝ 20) 73 (10.9) Sexo, M:F, n Las muestras de plasma por triplicado se realizaron en un único análisis AlphaLISA y en 3 análisis AlphaLISA independientes (20 ). Evaluamos el lı́mite de detección (LOD) de los análisis mediante el uso de 12 blancos (sin NT-proBNP) por triplicado en 1 serie. Se realizó la lectura del LOD a partir de una curva de respuesta según la dosis sigmoidal basada en la señal (21 ): 11:09 Índice de masa corporal, kg/m2, media (SD) Clasificación de NYHA 29.9 (6.19) Todos los pacientes eran de clase 3 Presión arterial sistólica, mmHg, media (SD) 124 (3.81) Presión arterial diastólica, mmHg, media (SD) 75 (4.83) Recuento de señales del LOD ⫽ 共promedio de recuento de señales de blancos兲 ⫹ 关3 ⫻ 共SD de señal de blancos)]. ANÁLISIS ESTADÍSTICO Todos los análisis estadı́sticos se realizaron con el software GraphPad Prism 5 versión 5.03 (GraphPad Software). Se generó una curva estándar mediante el gráfico de las cifras “brutas” de AlphaLISA en comparación con los criterios del NT-proBNP con una ecuación logı́stica de 4 parámetros (curva de respuesta según la dosis sigmoidal con pendiente variable) y ponderación de datos 1/y2 (minimiza las distancias relativas al cuadrado). Antes de los análisis estadı́sticos, se realizó la prueba de normalidad general de D’Agostino y Pearson en las concentraciones de NT-proBNP en plasma (variables continuas) de los 6 fragmentos en los que se probó la distribución normal. Para comparar los valores sin distribución normal, se llevó a cabo la prueba de pares equiparados de Wilcoxon sobre la base de los datos de 2 grupos equiparados. Las diferencias entre los 2 grupos se consideraron estadı́sticamente significativas a P ⬍ 0.05. Se calcularon los coeficientes de correlación de Spearman para investigar la relación entre 2 grupos de variables continuas sin distribuciones normales. Resultados caron varios péptidos semi tripsı́nicos, en los cuales un extremo del péptido no fue resultado de la división en un sitio de reconocimiento tripsı́nico bajo acuerdo general. La abundancia relativa de estos péptidos obtenidos con tripsina total y parcial del NT-proBNP de cada individuo se determinó mediante la cuantificación relativa de la intensidad de los cromatogramas de iones extraı́dos de cada forma del péptido. Los grupos de los extremos N y C de los péptidos se normalizaron de forma individual, y ası́ se obtuvo una medición semi cuantitativa de la abundancia de fragmentos de división de los extremos N y C del NT-proBNP en la circulación de los pacientes con IC. Esto demostró que las proporciones relativas de las formas de procesamiento diferenciado del NT-proBNP fueron similares de forma sustancial entre los pacientes y que el NTproBNP circulante se encuentra sujeto a un alto grado de procesamiento proteolı́tico de los extremos N y C (Fig. 2). Table 2. Péptidos NT-proBNP obtenidos con tripsina total y parcial identificados después de la inmunoprecipitación del plasma. Posicióna 1–21 Reclutamos pacientes con IC en la etapa 3 de la clasificación de NYHA y las caracterı́sticas de los pacientes se incluyen en la Tabla 1. Los péptidos de NT-proBNP se confirmaron en las fracciones de elución luego de la inmunoprecipitación de las muestras de pacientes con IC mediante el uso de anticuerpos especı́ficos para NT-proBNP (Tabla 2). Estos péptidos cubrieron las porciones de los extremos N y C de la proteı́na madura de NT-proBNP prevista (acceso UniProtKB P16860). Sin embargo, se identifi- Péptidob m/z z ⌬masa HPLGSPGSASDLETSGLQEQR.N 722.68 3 ⫺0.003 3–21 P.LGSPGSASDLETSGLQEQR.N 966.46 2 ⫺0.004 4–21 L.GSPGSASDLETSGLQEQR.N 909.92 2 ⫺0.005 7–21 P.GSASDLETSGLQEQR.N 789.36 2 ⫺0.004 67–76 K.MVLYTLRAPR 407.23 3 0.001 67–75 K.MVLYTLRAP.R 532.3 2 0.002 67–73 K.MVLYTLR.A 448.25 2 0.001 a Posición del aminoácido en la proteı́na madura de NT-proBNP. Las divisiones no tripsı́nicas se muestran en negrita; las divisiones erróneas se muestran subrayadas. b Clinical Chemistry 59:10 (2013) 1527 issue10). El desempeño del análisis de NT-proBNP AlphaLISA se resume en la Tabla 3. En las muestras de plasma con IC, se utilizaron anticuerpos dirigidos al NT-proBNP completo ası́ como 5 pares de anticuerpos dirigidos a diferentes partes de la molécula para medir las concentraciones de NT-proBNP. La concentración de NT-proBNP1–20 estuvo comprendida entre 2182 y 19 808 ng/l, con una mediana de 8885 ng/l (RIC, 4166 –14 204 ng/l). Las concentraciones de NT-proBNP1– 45 estuvieron comprendidas entre 91.6 y 2645 ng/l, con una mediana de 448.3 ng/l (RIC, 195.2– 860.3 ng/l). La concentración de NT-proBNP13– 45 estuvo comprendida entre 165.1 y 14 164 ng/l, con una mediana de 2151 ng/l (RIC, 840.5– 3969 ng/l). La concentración de NT-proBNP13–76 estuvo comprendida entre 969.2 y 91 458 ng/l, con una mediana de 14 705 ng/l (RIC, 5045–28 999 ng/l). La concentración de NT-proBNP28 –76 estuvo comprendida entre 140.8 y 2995 ng/l, con una mediana de 600.5 ng/l (RIC, 369.2–1339 ng/l). La concentración de NTproBNP1–76 estuvo comprendida entre 399.7 y 16 091 ng/l, con una mediana de 4201 ng/l (RIC, 1370 – 8244 ng/l). El par de anticuerpos que reconoció el fragmento de NT-proBNP13–76 aportó la mayor concentración en comparación con los pares de anticuerpos que reconocieron las otras partes de la molécula (P ⬍ 0.05) (Fig. 3A). Las correlaciones entre NT-proBNP13–76 y los 5 fragmentos se muestran en la Fig. 3, B–F. Figura 2. Proporción relativa de péptidos obtenidos con tripsina total y parcial por los extremos N y C del NT-proBNP purificados por IP de pacientes individuales. (A) Péptidos del extremo N: negro, H1-R21; blanco, L3-R21; gris, G4-R21; a rayas, G7-R21. (B) Péptidos del extremo C: negro, M67-R76; blanco, M67-P75. Realizamos una comparación (n ⫽ 28) entre el análisis diagnóstico de Roche y nuestro NT-proBNP13–76 con desarrollo interno (correlación de Spearman de r ⫽ 0.69 y P ⬍ 0.05) (consulte la Fig. 1 de los Datos complementarios que acompañan la versión en lı́nea de este artı́culo en http://www.clinchem.org/content/vol59/ Análisis Empleamos una combinación de análisis de espectrometrı́a de masas e inmunoanálisis AlphaLISA para caracterizar las formas de circulación del NT- Table 3. Caracterı́sticas de desempeño de nuestros inmunoanálisis de NT-proBNP. Inmunoanálisis AlphaLISA NT-proBNP1–20 Recuperación, % 300 ng/l % 3000 ng/l/ Variabilidad intranalı́tica, % Variación interanalı́tica, % (ES) LOD, ng/l 101.9 6.55 (0.88) 8.78 (0.56) 90.7 9.14 (0.76) 6.69 (0.70) 52.4 7.58 (1.09) 7.13 (0.65) 26.4 7.34 (0.62) 9.59 (1.03) 168 7.30 (0.69) 6.32 (0.88) 147 5.39 (0.75) 4.46 (0.59) 82.6 NT-proBNP13–45 81 80 NT-proBNP1–45 77.8 76 NT-proBNP28–76 96.7 78.8 NT-proBNP13–76 88.1 121 NT-proBNP1–76 71.5 70.2 1528 Clinical Chemistry 59:10 (2013) 45.3 Evaluación de LMPGs NACB con AGREE II Figura 3. Comparación y correlación de las concentraciones de NT-proBNP13–76 en plasma (la mayor concentración aparente) en comparación con NT-proBNP1–20, NT-proBNP13– 45, NT-proBNP1– 45, NT-proBNP28 –76 y NT-proBNP1–76 en plasma de pacientes con IC (n ⴝ 20). (A) Los porcentiles 25, 50 (mediana) y 75 se indican en los gráficos de caja y bigotes. * Notablemente diferente de la concentración de NT-proBNP13–76 al nivel P ⬍ 0.05. Se calculó la correlación de Spearman entre las concentraciones de NT-proBNP13–76 y (B) NT-proBNP1–20 en plasma, Spearman r ⫽ 0.890, P ⬍ 0.0001; (C) NT-proBNP13– 45, Spearman r ⫽ 0.859, P ⬍ 0.0001; (D) NT-proBNP1– 45, Spearman r ⫽ 0.788, P ⬍ 0.0001; (E) NT-proBNP28 –76, Spearman r ⫽ 0.908, P ⬍ 0.0001; y (F) NT-proBNP1–76, Spearman r ⫽ 0.946, P ⬍ 0.0001. proBNP en el plasma de pacientes con IC. Los 6 inmunoanálisis AlphaLISA desarrollados en forma interna demostraron buena sensibilidad analı́tica para la cuantificación de los fragmentos del NT-proBNP. Controlamos los efectos de la matriz mediante la mezcla de plasmas de sujetos sanos (n ⫽ 10) y la adición de concentraciones conocidas del analito de NT-proBNP, y obtuvimos recuperaciones de entre el 70.2 % y 121 %. Estas recuperaciones constituyen una buena señal de que los inmunoanálisis de NT-proBNP son adecuados para el uso con muestras de plasma. Estos análisis luego se usaron para cuantificar y comparar diferentes fragmentos de NT-proBNP en el plasma de pacientes con IC, y para identificar el par de anticuerpos que aportaron la mayor concentración aparente de NT-proBNP en la circulación. Nuestros resultados de la espectrometrı́a de masas identificaron varios péptidos semi tripsı́nicos, en los cuales un extremo del péptido no fue resultado de la división en un sitio de reconocimiento tripsı́nico bajo acuerdo general. Estos péptidos semi tripsı́nicos respondieron con mayor probabilidad a la división fisiológica en los extremos N o C del NT-proBNP circulante antes de la inmunoprecipitación (22 ). No está clara la identidad de las proteasas responsables de estas actividades de división en el NT-proBNP ası́ como tampoco Clinical Chemistry 59:10 (2013) 1529 está claro si las actividades de división ocurren antes o después de la división del proBNP en NT-proBNP y BNP. Nuestros análisis de espectrometrı́a de masas no detectaron péptidos de BNP, lo que sugiere que los péptidos identificados se originaron a partir de NTproBNP y no de proBNP. Sin embargo, es posible que parte del proBNP esté presente en las muestras luego de la inmunoprecipitación. No se detectaron péptidos semi tripsı́nicos que pudieran ser resultado de la división interna, lo que sugirió que estos sitios de división no tripsı́nicos no se debieron a artefactos de procesamiento sino que representaron formas diferentes del NT-proBNP con varios alcances del procesamiento proteolı́tico en los extremos N o C (Fig. 1B). Asimismo, los datos de la espectrometrı́a de masas indicaron que una fracción considerable del NT-proBNP circulante estuvo sometida al truncamiento en ambos extremos N y C (Tabla 2, Figs. 1 y 2). Esto sugirió que los pares de anticuerpos para la medición de la concentración del NT-proBNP circulante idealmente no deberı́an dirigirse a los extremos N o C terminales del péptido. Evaluamos si este era el caso al comparar las concentraciones aparentes de NT-proBNP mediante el uso de pares de anticuerpos dirigidos a diferentes segmentos de NT-proBNP. El par de anticuerpos dirigido al NTproBNP13–76 aportó una mayor concentración que el NT-proBNP1–76 y el par de anticuerpos dirigido al NTproBNP13– 45 aportó una mayor concentración que el NT-proBNP1– 45 (Fig. 3). Estos resultados coinciden con el truncamiento en el extremo N del NT-proBNP (Tabla 2, Fig. 1), lo que limita la unión del anticuerpo monoclonal 5B6(1–12) a esta sección de la molécula, y conduce a una menor concentración aparente de NTproBNP. De forma similar, el par de anticuerpos que reconoció el NT-proBNP1–20 aportó una mayor concentración que el NT-proBNP1–76 (Fig. 3), coincidente con el truncamiento del extremo C (Tabla 2, Fig. 1), lo que limitó la unión del anticuerpo monoclonal 28F8(67–76). Estas conclusiones confirman los datos de nuestra espectrometrı́a de masas que indican que la mayor parte del NT-proBNP circulante está truncado en sus extremos N y C, y también coinciden con las previas descripciones de las diversas formas del NTproBNP circulante (4, 11 ). También se ha informado la interferencia de la glucosilación de la región central del NT-proBNP con la inmunodetección (14, 23 ). La concentración aparente del NT-proBNP que utilizó el par de anticuerpos dirigido al NT-proBNP1–20 fue mayor que cuando se utilizaron los pares de anticuerpos dirigidos al NTproBNP1– 45, NT-proBNP13– 45 o NT-proBNP28 –76 (Fig. 3). Esto coincide con la glucosilación de la región central del NT-proBNP que causa una unión débil de los anticuerpos a esta región, lo que corrobora las conclusiones previas (7, 14, 23 ). En forma conjunta, estos 1530 Clinical Chemistry 59:10 (2013) datos sugieren que un inmunoanálisis ideal de NTproBNP no deberı́a dirigirse a las regiones de los extremos N y C terminales de la molécula del NT-proBNP y además deberı́a evitarse la región glucosilada. Anteriormente, realizamos la validación de nuestro NT-proBNP1–76 AlphaLISA mediante el uso de 37 muestras de plasma a las que también se realizaron mediciones de las concentraciones de NT-proBNP mediante el análisis de Roche Diagnostics. Se observó una correlación significativa entre nuestro análisis y el de Roche (r 2 ⫽ 0.78 y P ⬍ 0.001) (consulte la Fig. 1 complementaria en lı́nea) (15 ). El actual análisis de NT-proBNP de segunda generación de Roche Diagnostics se basa en 2 anticuerpos monoclonales que reconocen epı́topos dentro de los aminoácidos 27–31 y 42– 46 del NT-proBNP (Ficha técnica de Roche Diagnostics; consulte http://www.aacc.org/publications/cln/ 2008/July/Pages/newproducts7_0708.aspx). En contraste, en este estudio comprobamos que, de los pares de anticuerpos que evaluamos, el par dirigido al NTproNBP13–76 aportó la mayor concentración aparente en las muestras de plasma obtenidas de pacientes con IC. Sin embargo, nuestros resultados sugirieron que un inmunoanálisis de NT-proBNP ideal no deberı́a usar un anticuerpo dirigido a los aminoácidos 67–76, debido al truncamiento del extremo C del NT-proBNP (Figs. 1 y 2) que reduce su concentración aparente (Fig. 3). Serı́a preferible un anticuerpo alternativo dirigido a una sección del NT-proBNP entre su región central O-glucosilada y sus extremos C truncados, pero que evite ambas regiones. Sin embargo, no hay un anticuerpo como tal disponible actualmente. Asimismo, los anticuerpos dirigidos al NT-proBNP13–76 aportaron una variabilidad relativamente alta entre individuos. Por lo tanto, serı́a interesante determinar en un amplio estudio clı́nico si es preferible la detección del fragmento de NT-proNBP13–76 en las muestras de plasma a los fragmentos actuales detectados por los análisis de diagnóstico comerciales. Una limitación de nuestro estudio fue que usamos una pequeña cohorte de pacientes con IC clasificada como de clase 3 funcional por NYHA. Un trabajo reciente de Semenov y cols. indicó que los pacientes con IC tienden a presentar un mecanismo ineficiente de conversión del proBNP (molécula precursora) mediante la conversión de la furina en NTproBNP y BNP tras la secreción de cardiomiocitos en la circulación (7 ). Sin embargo, nuestro análisis de espectrometrı́a de masas no identificó fragmentos del proBNP en la circulación de los pacientes con IC (n ⫽ 4), quizás debido al anticuerpo que elegimos para la inmunoprecipitación. Katrukha y cols. demostraron previamente que los anticuerpos especı́ficos para el lugar no podı́an acceder a la región altamente glucosilada Evaluación de LMPGs NACB con AGREE II del NT-proBNP28 – 45 en plasma de pacientes con IC a la que estaban dirigidos, y esto también se corroboró posteriormente mediante la eliminación enzimática de las moléculas oligosacáridas O-glucosiladas de estas regiones que ocasionaron un importante aumento (P ⬍ 0.05) en las concentraciones de NT-proBNP posteriores a la desglucosilación (24 ). Por lo tanto, los resultados de nuestro estudio se compararon con las conclusiones anteriores, en las cuales los anticuerpos NTproBNP28 – 45 monoclonales no pudieron unirse a las regiones O-glucosiladas del NT-proBNP humano. Las correlaciones relativamente estrechas de las concentraciones de NT-proBNP13–76 (región no glucosilada) en plasma con NT-proBNP13– 45 y NT-proBNP28 –76 sugirieron que las concentraciones de O-glucosilación (no glucosiladas en comparación con las glucosiladas) en el NT-proBNP endógeno son comparativamente constantes en un grupo seleccionado de pacientes con IC crónica (Fig. 3, C y E). Esto está respaldado por el trabajo de Nishikimi y cols., que recientemente informaron que los cocientes de formas glucosiladas y no glucosiladas de NT-proBNP en plasma son constantes en todos los pacientes con IC (clase 1– 4 de NYHA) (25 ). Se ha informado la presencia de moléculas de oligosacáridos unidas por oxı́geno en los residuos Ser y Thr en la región del NT-proBNP28 – 45 humano en la documentación para mantener la estabilidad del NTproBNP en la circulación (26 ). Por lo tanto, es probable que los anticuerpos monoclonales dirigidos a los sitios no glucosilados entre NT-proBNP28 – 45 [es decir, NT-proBNP30 –35 (Glu-Leu-Gln-Val-Glu-Gln motif)] excluyan los efectos de la O-glucosilación en la medición del NT-proBNP en plasma. Esto, junto con los anticuerpos monoclonales dirigidos al NTproBNP13–20, puede proporcionar una medición más estandarizada del NT-proBNP en plasma para los futuros inmunoanálisis no competitivos. Nuestros datos indican que si bien el NT-proBNP inmunoreactivo estuvo presente en el plasma humano en forma de múltiples fragmentos de la molécula del NT-proBNP completa, los epı́topos especı́ficos del péptido parecen ser más abundantes, lo que proporciona objetivos ideales para el desarrollo de análisis de diagnóstico de última generación para uso clı́nico. En resumen, hemos proporcionado evidencia que indica que un inmunoanálisis ideal para detectar el NT-proBNP en plasma no deberı́a dirigir las regiones de los extremos N y C terminales del NT-proBNP, debido a los truncamientos proteolı́ticos endógenos en estos sitios, y además no deberı́a dirigirse a la sección central O-glucosilada de la proteı́na. Estos resultados serán importantes para el desarrollo de los inmunoanálisis de NT-proBNP de última generación para fines de diagnóstico. Nuestras conclusiones allanarán el camino para el desarrollo de un inmunoanálisis de NTproBNP de tercera generación comercial más estandarizado a fin de detectar la presencia de IC. Contribuciones de los autores: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han cumplido con los siguientes 3 requerimientos: (a) contribuciones significativas a la concepción y el diseño, la adquisición de datos o el análisis e interpretación de estos; (b) redacción o revisión del artı́culo en relación con su contenido intelectual; y (c) aprobación final del artı́culo publicado. Declaración de los autores o posibles conflictos de interés: Tras la presentación del manuscrito, todos los autores completaron el formulario de declaración del autor. Declaraciones o posibles conflictos de interés: Empleo o liderazgo: No se declara. Papel del consultor o asesor: No se declara. Propiedad de acciones: No se declara. Honorarios: No se declara. Financiamiento de la investigación: B.L. Schulz, Beca de National Health and Medical Research Council Project Grant 631615 y National Health and Medical Research Council Career Development Fellowship APP1031542; C. Punyadeera, Programa de becas de Queensland Government Smart Futures Fellowship Programme (QGSFF), Fondos para la investigación de University of Queensland New Staff Research Funds (UQNSRSF 601252), Programa de premios a la excelencia de University of Queensland Foundation Research Excellence Award Scheme y donaciones de anticuerpos NTproBNP monoclonales de Perkin Elmer (EE. UU.). Testimonio de expertos: No se declara. Patentes: No se declara. Papel del patrocinador: Las organizaciones patrocinadoras no jugaron papel alguno en el diseño del estudio, la selección de los pacientes inscriptos, la revisión e interpretación de los datos ni la preparación o aprobación del manuscrito. Agradecimientos: Los autores agradecen la ayuda de Fairuz Jamaluddin con las pipetas Zip-Tip en cuatro muestras de plasma de los pacientes con IC para el análisis de espectrometrı́a de masas. Referencias 1. Dunlay SM, Shah ND, Shi Q, Morlan B, VanHouten H, Long KH, Roger VL. Lifetime costs of medical care after heart failure diagnosis. (Costos de la atención médica de por vida después del diagnóstico de insuficiencia cardiaca). Circ Cardiovasc Qual Outcomes 2011;4:68 –75. 2. Cheng S, Vasan RS. Advances in the epidemiol- ogy of heart failure and left ventricular remodeling. (Avances en la epidemiologı́a de la insuficiencia cardiaca y reajuste del ventrı́culo izquierdo). Circulation 2011;124:e516 –9. 3. Collinson PO, Barnes SC, Gaze DC, Galasko G, Lahiri A, Senior R. Analytical performance of the N terminal pro B type natriuretic peptide (NT- proBNP) assay on the Elecsys 1010 and 2010 analysers. [Desempeño analı́tico del análisis del propéptido natriurético tipo B N-terminal (NTproBNP) en los analizadores Elecsys 1010 y 2010]. Eur J Heart Fail 2004;6:365– 8. 4. Mair J. Biochemistry of B-type natriuretic peptide: where are we now? (Bioquı́mica del péptido na- Clinical Chemistry 59:10 (2013) 1531 5. 6. 7. 8. 9. 10. 11. triurético tipo B: ¿dónde nos encontramos?). Clin Chem Lab Med 2008;46:1507–14. Melanson SE, Lewandrowski EL. Laboratory testing for B-type natriuretic peptides (BNP and NTproBNP): clinical usefulness, utilization, and impact on hospital operations. [Pruebas de laboratorio de los péptidos natriuréticos tipo B (BNP y NT-proBNP): utilidad clı́nica, uso e impacto en las intervenciones hospitalarias]. Am J Clin Pathol 2005;124(Suppl):S122– 8. Dong N, Chen S, Yang J, He L, Liu P, Zheng D y cols. Plasma soluble corin in patients with heart failure. (Corina soluble en plasma en pacientes con insuficiencia cardiaca). Circ Heart Fail 2010;3:207–11. Semenov AG, Tamm NN, Seferian KR, Postnikov AB, Karpova NS, Serebryanaya DV y cols. Processing of pro-B-type natriuretic peptide: furin and corin as candidate convertases. (Procesamiento del propéptido natriurético tipo B: furina y corina como candidatos de conversión). Clin Chem 2010;56:1166 –76. Clerico A, Vittorini S, Passino C. Measurement of the pro-hormone of brain type natriuretic peptide (proBNP): methodological considerations and pathophysiological relevance. [Medición de la pro hormona del péptido natriurético cerebral (proBNP): consideraciones metodológicas e importancia fisiopatológica]. Clin Chem Lab Med 2011;49:1949 –54. Clerico A, Zaninotto M, Prontera C, Giovannini S, Ndreu R, Franzini M y cols. State of the art of BNP and NT-proBNP immunoassays: the CardioOrmoCheck study. (Conocimientos actuales sobre inmunoanálisis de BNP y NT-proBNP: el estudio CardioOrmoCheck). Clin Chim Acta 2012;414C: 112–9. Thygesen K, Mair J, Mueller C, Huber K, Weber M, Plebani M y cols. Recommendations for the use of natriuretic peptides in acute cardiac care: a position statement from the Study Group on Biomarkers in Cardiology of the ESC Working Group on Acute Cardiac Care. (Recomendaciones para el uso de los péptidos natriuréticos en la atención cardiaca aguda: documento de posición del Grupo de estudio sobre biomarcadores en cardiologı́a del grupo de trabajo de ESC sobre la atención cardiaca aguda). Circ Heart Fail 2012;33:2001– 6. Ala-Kopsala M, Magga J, Peuhkurinen K, Leipala J, Ruskoaho H, Leppaluoto J, Vuolteenaho O. Molecular heterogeneity has a major impact on the measurement of circulating N-terminal fragments of A- and B-type natriuretic peptides. (La heterogeneidad molecular tiene un impacto prin- 1532 Clinical Chemistry 59:10 (2013) 12. 13. 14. 15. 16. 17. 18. 19. cipal en la medición de los fragmentos circulantes del extremo N terminal de los péptidos natriuréticos tipo A y B). Clin Chem 2004;50:1576 – 88. Krum H, Jelinek MV, Stewart S, Sindone A, Atherton J. 2011 update to National Heart Foundation of Australia and Cardiac Society of Australia and New Zealand Guidelines for the prevention, detection and management of chronic heart failure in Australia, 2006. (Actualización de 2011 de las Directrices de la Fundación Nacional del Corazón de Australia y la Sociedad Cardiaca de Australia y Nueva Zelanda para la prevención, la detección y el tratamiento de la insuficiencia cardiaca crónica en Australia, 2006). Med J Aust 2011;194:405–9. Bailey UM, Jamaluddin MF, Schulz BL. Analysis of congenital disorder of glycosylation-Id in a yeast model system shows diverse site-specific underglycosylation of glycoproteins. (El análisis de identificación del trastorno congénito de la glucosilación en un sistema de modelo de levaduras demuestra una diversa glucosilación inferior de glucoproteı́nas especı́fica para el lugar). J Proteome Res 2012;11:5376 – 83. Seferian KR, Tamm NN, Semenov AG, Tolstaya AA, Koshkina EV, Krasnoselsky MI y cols. Immunodetection of glycosylated NT-proBNP circulating in human blood. (Inmunodetección del NTproBNP glucosilado en circulación en sangre humana). Clin Chem 2008;54:866 –73. Foo JY, Wan Y, Kostner K, Arivalagan A, Atherton J, Cooper-White J y cols. NT-proBNP levels in saliva and its clinical relevance to heart failure. (Niveles de NT-proBNP en la saliva y su importancia clı́nica para la insuficiencia cardiaca). PLoS One 2012;7:e48452. Mohamed R, Campbell JL, Cooper-White J, Dimeski G, Punyadeera C. The impact of saliva collection and processing methods on CRP, IgE, and myoglobin immunoassays. (El impacto de los métodos de la obtención y el procesamiento de la saliva en inmunoanálisis de mioglobina, PCR e IgE). Clin Transl Med 2012;1:19. Pfaffe T, Cooper-White J, Beyerlein P, Kostner K, Punyadeera C. Diagnostic potential of saliva: current state and future applications. (Diagnóstico potencial de la saliva: estado actual y futuras aplicaciones). Clin Chem 2011;57:675– 87. Punyadeera C, Dimeski G, Kostner K, Beyerlein P, Cooper-White J. One-step homogeneous C-reactive protein assay for saliva. (Análisis homogéneo de un paso de la proteı́na C reactiva en la saliva). J Immunol Methods 2011;373:19 –25. Topkas E, Keith P, Dimeski G, Cooper-White J, Punyadeera C. Evaluation of saliva collection devices for the analysis of proteins. (Evaluación de 20. 21. 22. 23. 24. 25. 26. dispositivos de obtención de saliva para el análisis de proteı́nas). Clin Chim Acta 2012;413: 1066 –70. Jaedicke KM, Taylor JJ, Preshaw PM. Validation and quality control of ELISAs for the use with human saliva samples. (Validación y control de calidad de ensayos ELISA para el uso con muestras de saliva humana). J Immunol Methods 2012;377:62–5. Armbruster DA, Pry T. Limit of blank, limit of detection and limit of quantitation. (Lı́mite de blanco, lı́mite de detección y lı́mite de cuantificación). Clin Biochem Rev 2008;29(Suppl 1): S49 –52. Bailey UM, Punyadeera C, Cooper-White JJ, Schulz BL. Analysis of the extreme diversity of salivary alpha-amylase isoforms generated by physiological proteolysis using liquid chromatography-tandem mass spectrometry. (Análisis de la extrema diversidad de isoformas alfa-amilasas salivales generadas por proteólisis fisiológica con cromatografı́a de lı́quidos y espectrometrı́a de masas en tándem). J Chromatography B 2012;911:21–6. Hughes D, Talwar S, Squire IB, Davies JE, Ng LL. An immunoluminometric assay for N-terminal pro-brain natriuretic peptide: development of a test for left ventricular dysfunction. (Un análisis inmunoluminométrico del propéptido natriurético cerebral N-terminal: desarrollo de una prueba para la disfunción ventricular izquierda). Clin Sci 1999;96:373– 80. Katrukha A, Semenov A, Seferian K, Postnikov A, Koshkina E, Krasnoselsky M y cols. Glycosylation of NT-proBNP molecules and NT-proBNP immunoassays [Abstract]. (Gucosilación de moléculas NT-proBNP e inmunoanálisis de NT-proBNP [Resumen]). Clin Chem 2007;53(6 Suppl):A23. También consulte http://www.hytest.fi/poster-aacc2007-glycosylation-nt-probnp-molecules-and-ntprobnp-immunoassays. Nishikimi T, Ikeda M, Takeda Y, Ishimitsu T, Shibasaki I, Fukuda H y cols. The effect of glycosylation on plasma N-terminal proBNP-76 levels in patients with heart or renal failure. (El efecto de la glucosilación en 76 niveles del propéptido natriurético tipo B N-terminal en plasma de pacientes con insuficiencia cardiaca o renal). Heart 2012;98:152– 61. Seferian KR, Tamm NN, Semenov AG, Tolstaya AA, Koshkina EV, Krasnoselsky MI y cols. Immunodetection of glycosylated NT-proBNP circulating in human blood. (Inmunoodetección de NTproBNP glucosilado en circulación en sangre humana). Clin Chem 2008;54:866 –73.