República Bolivariana de Venezuela Ministerio del Poder Popular
Anuncio

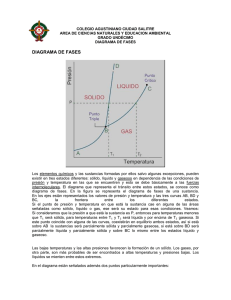
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Universitaria Universidad Nacional Experimental “Rafael María Baralt” Programa: Ingeniería y Tecnología Proyecto: Mantenimiento Mecánico INTEGRANTES: Deivis Arraiz C.I.: 20.742.959 Enmanuel Ocanto C.I.:23.781.606 Cristhofer Ortiz C.I.: 20.859.780 Jose Herrera C.l.: 24.606.587 Robert Quiroz C.I.: 24.894.052 Paola Colina C.I.: 23.862.826 Sección: 1 Profesor: Roger Chirinos Ciudad Ojeda, Noviembre de 2012 Introducción En física y química se observa que, para cualquier sustancia o elemento material, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con las fuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen. Todos los estados de agregación poseen propiedades y características diferentes, los más conocidos y observables cotidianamente son cinco, las llamadas fases sólida, líquida, gaseosa, plasmática y condensado de Bose-Einstein. DESARROLLO Los elementos químicos y las sustancias formadas por ellos salvo algunas excepciones, pueden existir en tres estados diferentes: sólido, líquido y gaseoso en dependencia de las condiciones de presión y temperatura en las que se encuentren y esto se debe básicamente a las fuerzas intermoleculares. El diagrama que representa el tránsito entre estos estados, se conoce como diagrama de fases. Estado sólido Los objetos en estado sólido se presentan como cuerpos de forma compacta y precisa; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros y resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión. En los sólidos cristalinos, la presencia de espacios intermoleculares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada. Las sustancias en estado sólido suelen presentar algunas de las siguientes características: Cohesión elevada. Forma definida. Incompresibilidad. Resistencia a la fragmentación. Fluidez muy baja o nula. Algunos de ellos se subliman. Estado líquido. Si se incrementa la temperatura, el sólido va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. El estado líquido presenta las siguientes características: Movimiento energía cinética. No poseen forma definida. Toma la forma de la superficie o el recipiente que lo contiene. En el frío se contrae (exceptuando el agua). Posee fluidez a través de pequeños orificios. Cohesión menor. Puede presentar difusión. Volumen constante Estado gaseoso. Incrementando aún más la temperatura, se alcanza el estado gaseoso. Las moléculas del gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. El estado gaseoso presenta las siguientes características: Cohesión casi nula. No tienen forma definida. Su volumen es variable DIAGRAMA DE FASES Punto triple En este punto en la sustancia coexisten en equilibrio los tres estados, está parcialmente solida, parcialmente líquida y parcialmente gaseosa. Obsérvese que para valores de presión o temperatura más bajas que el punto triple la sustancia en cuestión no puede existir en estado líquido y solo puede pasar desde sólido a gaseoso en un proceso conocido como sublimación Punto crítico El punto C indica el valor máximo de temperatura en el que pueden coexistir en equilibrio dos fases, y se denomina punto crítico. Representa la temperatura máxima a la cual se puede licuar el gas simplemente aumentando la presión. Gases a temperaturas por encima de la temperatura del punto crítico no pueden ser licuados por mucho que se aumente la presión. En otras palabras, por encima del punto crítico, la sustancia solo puede existir como gas. Punto de ebullición El punto de ebullición de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y gaseoso a determinada presión. Los diferentes puntos de ebullición para las diferentes presiones corresponderían a la curva BC. Punto de fusión El punto de fusión de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y sólido a determinada presión. Los diferentes puntos de fusión para las diferentes presiones corresponderían a la curva BD Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico. Más allá de este punto, la materia se presenta como un fluido supe crítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado. Es preciso anotar que, en el diagrama P-T del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la presión el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida. Diagrama de fase de una sustancia pura Los diagramas de fase más sencillos son los de presión - temperatura de una sustancia pura, como puede ser el del agua. En el eje de ordenadas se coloca la presión y en el de abscisas la temperatura. Generalmente, para una presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes zonas: Punto triple: En este punto del diagrama coexisten los estados sólido, líquido y gaseoso. Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termómetros. Los pares (presión, temperatura) que corresponden a una transición de fase entre: Dos fases sólidas: Cambio alotrópico; Entre una fase sólida y una fase líquida: fusión - solidificación; Entre una fase sólida y una fase vapor (gas): sublimación deposición (o sublimación inversa); Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción). Diagrama de fase binario Cuando aparecen varias sustancias, la representación de los cambios de fase puede ser más compleja. Un caso particular, el más sencillo, corresponde a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en masa. En un diagrama binario pueden aparecer las siguientes regiones: Sólido puro o disolución sólida Mezcla de disoluciones sólidas peritectoide) Mezcla sólido - líquido (eutéctica, eutectoide, peritéctica, Únicamente líquido, ya sea mezcla de líquidos inmiscibles (emulsión), ya sea un líquido completamente homogéneo. Mezcla líquido - gas Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones da altitud). Hay punto y líneas en estos diagramas importantes para su caracterización: Línea de líquidos, por encima de la cual solo existen fases líquidas. Línea de sólidos, por debajo de la cual solo existen fases sólidas. Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar transformaciones eutécticas y eutectoides, respectivamente. Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de A y B deja de ser soluble para transformarse en (α)+ sustancia pura (A ó B). Concentraciones definidas, en las que tienen lugar transformaciones a temperatura constante: Eutéctica Eutectoide Peritéctica Peritectoide Monotéctica Monotectoide Sintéctica Catatéctica Diferentes diagramas de equilibrio Existen diferentes diagramas de equilibrio según los materiales sean totalmente solubles en estado sólido y líquido o sean miscibles a que sean insolubles. También pueden darse casos particulares. Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades y donde afecta claramente la concentración y las diferentes cristalizaciones que puede darse en el hierro estando en estado sólido y a diferentes temperaturas. Dos metales (A, B) a temperaturas superiores a sus respectivos En ciencia de materiales se utilizan ampliamente los diagramas de fase binarios, mientras que en termodinámica se emplean sobre todo los diagramas de fase de una sustancia pura. Puntos de fusión (TA, TB) se encuentran en estado líquido pudiéndose disolver y conformar así una fase única líquida. Esto quiere decir que no podemos establecer diferencias de comportamiento u observación entre las distintas partes del líquido y que los metales en las proporciones mezcladas tienen la propiedad de miscibilidad. Si la mezcla líquida, XA + XB, la sometemos a un proceso de solidificación, mediante enfriamiento, llegamos a obtener el producto que se denomina aleación de los metales A y B. DIAGRAMA DE FASE La línea de puntos muestra el comportamiento anómalo del agua. La línea verde marca el punto de congelación y la línea azul, el punto de ebullición. Se muestra cómo varían con la presión. CONCLUSION Es conocido que las aleaciones mejoran las características de los metales puros. Realmente debería decirse que introducen variables que diferencian el comportamiento de los metales puros que las componen, porque en algunas circunstancias pueden perjudicar sus propiedades. Obviamente, conformar una aleación es uno de los medios más primitivos que la ingeniería ha dispuesto para actuar sobre las propiedades de los metales puros, incluso históricamente la aleación es predecesora como lo justifica el bronce, Edad del bronce.