Práctica 2: Cararterización potenciométrica de
Anuncio

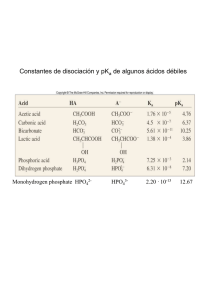
Práctica 2: Cararterización potenciométrica de sistemas nivelados y no nivelados ácid-base. Graficas pH= f(V(agre.)) Marín Medina Alejandro| Baeza Reyes Alex | Facultad de Química-UNAM Monitoreo potenciométrico durante la valoración de ácidos con NaOH, F= 0.1 mol/L. Tabla 1: Valores experimentales del pH para cada volumen de NaOH agregado. Procesamiento de datos: Construcción de las gráficas pH = f (Vagregado) 14.00 13.00 12.00 11.00 10.00 9.00 pH 8.00 Agua 7.00 HCl 6.00 CH3COOH 5.00 NH3NO3 4.00 HBCl 3.00 Fenol Cr2O72- 2.00 1.00 0.00 0.0 1.0 2.0 3.0 4.0 5.0 V[mL] 6.0 7.0 8.0 9.0 10.0 Figura 1: Gráfica pH = f (Vagregado) para cada sistema ensayado. Contrucción de la gráfica pKa= f (pH(1/2(Vp.e.exp)) pKa • Proponer una escala de reactividad ácido-base (preliminar). Tabla 2: Valores de pKa y pH(1/2(Vp.e.exp) 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 pKa = 1.1899pH - 1.2036 R² = 0.9596 0 1 2 3 4 5 6 7 8 9 10 11 pH Gráfica 2: pKa = f (pH(1/2(Vp.e.exp)) 12 13 Contrucción de la gráfica pKa= f (pH(1/2(Vp.e.exp)) 14 13 12 pKa = 0.8485pH + 1.3146 R² = 0.9981 11 10 9 pKa 8 7 6 Tabla 3: Valores de pKa y pH(1/2(Vp.e.exp) 5 4 3 2 1 0 0 1 2 3 4 5 6 7 pH 8 9 10 11 Gráfica 3: pKa = f (pH(1/2(Vp.e.exp)) 12 13 14 Escala de reactividad ácido-base experimental (preliminar): H+ CH3COOH NH3 OH+ Cr2O7 2- NH4 + Ø-OH H2O pKa/n 4.20 H2O CH3 COO- 6.40 6.60 NH2OH- 2(CrO42-) 9.25 NH3- 9.40 Ø-O- OH- Proponer una escala de reactividad ácido-base • Determinando el pKa(exp) a partir de la función de Gran. 12.00 pKa = 0.8953pKa(exp) + 0.8489 R² = 0.9971 10.00 pKa 8.00 Tabla 4: Valores de pKa y pKa(exp) 6.00 4.00 2.00 0.00 0 2 4 6 pKa(exp) 8 Gráfica 3: pKa = f (pKa(exp)) 10 12 Escala de reactividad ácido-base experimental : H+ CH3COOH NH3 OH+ Cr2O7 2- NH + 4 Ø-OH H2O pKa/n 4.47 H2O CH3 COO- 5.77 6.65 NH2OH- 2(CrO42-) 9.47 NH3 10.17 Ø-O- OH-