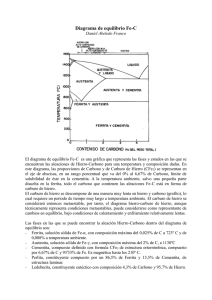
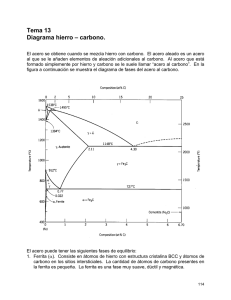
Tema1.DiagramaFeC.2
Anuncio

INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN EN EL DIAGRAMA Fe-C METAESTABLE La adición de otros elementos aleantes (Cr, Ni, Ti, etc.), a parte del C, puede cambiar drásticamente el diagrama de fases binario hierrocarburo de hierro (Fe-Fe3C). La magnitud de las alteraciones de las posiciones de los límites de fases y la forma de los campos de fases dependen del elemento de aleación y de su concentración. Uno de los cambios importantes es el desplazamiento de la posición del punto eutectoide con respecto a la temperatura y a la concentración de carbono. LOS ELEMENTOS DE ALEACIÓN SE DIVIDEN EN: Moderadamente γ-genos: γ-genos (estabilizan la fase γ, Feγ) Muy γ-genos: Carburígenos: C (Carburígeno →Induce la formación de carburos. Tiene apetencia por el C) No carburígenos: N, Zn, Cu, Au Carburígenos: Mn (No forma carburos pero aumenta el poder carburígeno de otros elementos que si los forman) No carburígenos: Ni, Co (no muy usado por ser tóxico) α-genos (estabilizan la fase α : Feδ y Feα ) Carburígenos: (antigrafitizantes favorecen la formación de carburos, ya sea porque los forman ellos o porque su presencia lo facilita, pero en todo caso evitan la formación de grafito): Cr, W, V, Mo, Ti No carburígenos: Si, P, Al, Sn, Sb, As (grafitizantes) TE E ELEMENTOS GAMMÁGENOS Existen elementos que, al igual que el carbono, ESTABILIZAN LA FASE GAMMA. Tienden a ampliar el campo de estabilidad del Fe(γ) 1.-Con elementos gammágenos en solución sólida, la transformación Fe(δ) Fe(γ) tiene lugar por encima de 1394 °C, siendo más elevada la temperatura de transformación A4 cuanto mayor sea el contenido en elementos gammágenos que presenta el hierro en solución sólida 2.-La transformación Fe(γ) Fe(α) , se inicia por debajo de 912 °C, siendo la temperatura de transformación A3 tanto más pequeña cuanto mayor sea el contenido en elementos gammágenos de la austenita. Cambios sobre las temperaturas: • • • • A4 sube moderadamente A3, A1 bajan Acm sigue su tendencia. Marca el mismo límite de solubilidad de C en γ (precipitación de cementita) A3 baja Composiciones: • • Cγmax ≈2.11 % (el límite máximo de saturación en carbono de la austenita, permanece inalterado cualquiera que sea el contenido en Mn ,en Ni o en Co, probablemente por la escasa distorsión de la celda de austenita al sustituir átomos de Fe por átomos de Mn, de Ni o de Co) Ce baja TE E El Mn sustituye al azar El punto eutectoide baja y se desplaza hacia la izquierda. El bucle + baja en paralelo Efectos sobre el diagrama de enfriamiento del hierro puro 1394 °C 912 °C Diagrama Fe-Mn (Figura 1) El Mn, elemento fuertemente gammágeno, hace desaparecer la transformación A3 (gamma alfa) para contenidos en Mn superiores al 30 %. Además, para esos porcentajes, la solidificación del ferromanganeso tiene lugar directamente en fase gamma sin aparición de fase alfa. De modo análogo al Mn se comportan otros elementos gammágenos tales como el Ni, Co, N, Zn, Cu, Au. La influencia de estos elementos en el diagrama Fe-C viene cuantificada por las secciones de los diagramas ternarios Fe-C-Elementos gammágenos. Como puede apreciarse en la figura 2 el punto A3, para un mismo contenido en carbono, se presenta a temperaturas más bajas (consecuentemente con el carácter gammágeno) cuanto mayor es el contenido en Mn solubilizado en la austenita. Por su parte, el punto eutectoide baja y se desplaza hacia la izquierda, tanto más cuanto mayor es el contenido en Mn. Diagrama Fe-Mn 30 % Figura 1 Secciones simplificadas del diagrama Fe-C-Mn E Adicionando gran cantidad de Mn el bucle de γ o la zona bifásica α+γ puede extenderse hasta la temperatura ambiente Figura 2 Las temperaturas a las que se presenta la transformación eutectoide y los contenidos en C de la austenita eutectoide Fe-CMn varían en el sentido señalado por las curvas debidas a Bain. Y dado que el punto eutectoide presenta menores contenidos en carbono y menores temperaturas, cuando el tanto por ciento de Mn [o de Ni] crece, se deriva de ello entre otras, la siguiente consecuencia micrográfica: (i).- Si los contenidos en Mn o en Ni son muy elevados (Mn>30 %), puede ocurrir que la temperatura eutectoide se presente por debajo de la temperatura ambiente, obteniéndose aceros austeníticos a dicha temperatura. Para porcentajes en gammágenos que no impidan la transformación eutectoide a temperaturas superiores a la ambiental, la estructura micrográfica de un acero hipoeutectoide normalizado (es decir, enfriado al aire desde el estado austenítico) seguirá siendo de ferrita y perlita. La disminución de A3 origina un AFINO DE GRANO DE LA FERRITA PROEUTECTOIDE y, por otro lado, para igual contenido en carbono, la proporción de perlita varía en el mismo sentido que el manganeso: aumenta cuando el % de Mn es mayor. Mn Influencia de la concentración de varios elementos aleantes γ–genos y -genos sobre la temperatura y composición ( % C en peso) eutectoide del acero ELEMENTOS GAMMÁGENOS El Mn puede estabilizar la fase γ a temperatura ambiente dando aceros Hadfield. El acero austenítico al manganeso fue desarrollado por Sir Robert Hadfield en 1882, por lo que fue denominado acero Hadfield (1 %C, 12 %Mn). Son aleaciones no magnéticas EXTREMADAMENTE TENACES en las cuales la transformación martensítica de endurecimiento ha sido suprimida por una combinación de alto contenido de manganeso y carbono, y la precipitación de carburos por una alta velocidad de enfriamiento desde las temperaturas de austenización. Endurecen por transformación alotrópica (se transforman en martensita de bajo impacto). Estos aceros están caracterizados por sus propiedades mecánicas como son: alta resistencia a la tracción y a la compresión, alta ductilidad, muy tenaces (Estructura FCC) y excelente resistencia al desgaste. El acero Hadfield es el único que combina alta resistencia y ductilidad con gran capacidad de endurecimiento por deformación (se endurece al impacto) y, usualmente, buena resistencia al desgaste. Originalmente se usaron en cruzamientos de vías y tienen gran aplicación minera (pica de palas de excavadoras): cuanto más se trabaja con el más se endurece. Microestructura acero Hadfield grado A, atacada con picral 4% 100X. Se observan granos de austenita (claro) con carburos precipitados (oscuro) Figura 2. Microestructura acero Hadfield grado A, atacada con picral 4% 200X. Se observan carburos precipitados rodeados de carburos laminares. Figura 3. Microestructura acero Hadfield grado A, tratada térmicamente a 1065°C y enfriada en agua, atacada con picral 4% 500X. Se observa la capa de martensita formada durante la deformación como resultado de la decarburación de la austenita ELEMENTOS GAMÁGENOS / IMPLICACIONES TECNOLOGICAS 1.- Si el punto eutectoide (E) se desplaza hacia la izquierda, se tiene que aumenta el % de perlita, quedando diluida (menos rica en carbono para contenidos crecientes en Mn). Aumenta la carga de rotura del acero. La carga de rotura de un acero hipoeutectoide con estructura ferritoperlítica puede estimarse que es, aproximadamente, igual a la suma de dos productos: % de ferrita multiplicado por la carga de rotura de la ferrita aleada, y % de perlita multiplicado por la carga de rotura de ésta [Carga de rotura de la perlita (800 MPa > Carga rotura ferrita (300 Mpa)]. Y puesto que al aumentar en Mn aumenta, al menos, el % de perlita, la carga de rotura del acero será más elevada que la del acero sin manganeso (Por otra parte, al entrar el Mn en solución sólida en la ferrita, aumenta también la carga de rotura de la ferrita proeutectoide). Mn % perlita ( P ) f v ( P ) Rm (ac) 2.- La perlita resulta diluida El acero se hace más tenaz 3.- La presencia de Mn da lugar a la disminución de A3, que origina un afino de grano de la ferrita proeutectoide. Produce algo similar al aumento de la velocidad de enfriamiento. Con el afino de grano (dα) mejora el límite elástico. Además hay distorsión de las celdas, lo que hace que también aumente el límite elástico por solución sólida. ↑ Mn ↓ dα(tamaño de grano ferrita proeutectoide) ↑ Re (↑σy) PERLITA DILUIDA. PROPIEDADES QUE IMPLICA Para contenidos crecientes de Mn el punto eutectoide presenta menores contenidos en carbono y menores temperaturas. Estudiemos la fracción de perlita proeutectoide de un acero con un contenido en carbono del C0 % cuando aumenta el contenido en Mn : %Mn=0→fw(perlita-proeutectoide) = OA/Ae %Mn=a →fw(perlita-proeutectoide) = OA/Ae´ Ae >Ae´>Ae´´, luego %Mn=b (b>a) →fw(perlita-proeutectoide) = OA/Ae´´ ↑ Mn ↑ fw(perlita) %Mn=0 %Mn=a La ferrita de la perlita en el caso de que el acero contenga Mn es mayor que si %Mn=0. OA 6.67 Ce ' OA 6.67 0.77 perlitica(% Mn a) 100 perlitica (% Mn 0) 100; ya que Ce ' 0.77 %; Ae Ae' Ae ' 6.67 0.0218 Ae 6.67 0.0218 Otra forma de explicarlo (Partiendo del mismo C inicial, T=Cte y Fe3C = Cte, con independencia del contenido en Mn): Al aumentar el contenido en Mn, sube fv(perlita), luego disminuye el contenido en ferrita proeutectoide [ fv(-pro)] Baja la cantidad de α–proeutectoide Sube la cantidad de α–eutectoide (el de la perlita). La cementita se mantiene constante La perlita se diluye. Debido al ´ al interior de las láminas de la perlita trasvase de α–proeutectoide que se produce Perlita diluida Luego S0´> S0, aumenta a expensas solo de la ferrita. Factor de dilución, fD S fD 0 ; t S´ f D´ 0 ; t f D´ f D ; t t´ aT Cte y Fe3C Cte fv ( pro) fv ( )e fv ( Fe3C )e Cte; f v ( pro) f v ( )e f v ( Fe3C )e Cte; f v ( pro) f v ( perlita) Cte f v ( pro) y f v ( )e para mantener igualdad : f v ( pro) f v ( eutectoide) k´ (i).- La carga de rotura de un acero ferritoperlítico es aproximadamente: Rm(acero) = 300 fw(α)+800 fw(p) Rm(acero) ↑ cuando aumenta fw(p) fw(α)+ fw(p)=1 ↑ Mn ↑ fw(p) ↑ Rm(acero) (ii).- ↑ Mn A3 (disminuye la temperatura a la que comienza la formación de ferrita) ↓ dα(tamaño de grano ferrita proeutectoide), mayor capacidad de absorber esfuerzos ↑ Re (↑σy); Rm, AT, ITT ( tenacidad) (iii).- ↑ Mn Ce ↑ fw(p) S0 Rm y aumento de la tenacidad (iv).- ↑ fw(p) ↑ AT (v).- ↑ Mn Distorsión de la red de Fe() Rm y HB Si hay una grieta en el bastón de Fe3C, la vibración se amortigua La perlita diluida es más tenaz ELEMENTOS GAMÁGENOS / IMPLICACIONES TECNOLOGICAS 4.- Estos materiales son más propensos al SOBRECALENTAMIENTO. La propensión al sobrecalentamiento indica la tendencia del material a que tenga un tamaño de grano muy grande, lo cual es malo, ya que merma sus propiedades. 0.53 %C La propensión al sobrecalentamiento se mide mediante el valor de TS – T (TS = Temperatura solidus). Cuanto mayor sea el valor de TS – T menor es la propensión al sobrecalentamiento y cuanto mas cerca TS estemos de TS mayor propensión al sobrecalentamiento (Quemado de la aleación: aumenta la proporción de O2, que se combina con el Fe dando óxidos que no se pueden regenerar, es inutilizable). En los aceros hipoeutectoides la propensión al sobrecalentamiento baja cuando lo hace el %C (hasta T 0.53 %), ya que aumenta el valor de la temperatura TS). En este caso, el valor de TS – T también puede aumentarse al hacerlo el %C, ya que disminuye la temperatura de la transformación . De 0.53 a 0.77 %C la temperatura TS disminuye y también la temperatura de la transformación (esta última a un ritmo menor). El valor de TS – T disminuye pero se mantiene en valores adecuados. En los aceros hipereutectoides la propensión al sobrecalentamiento aumenta cuando lo hace el %C (Disminuye TS). Si aumenta el % de Mn, la propensión al crecimiento de grano aumentará. Al bajar A3 aumenta la propensión a que crezca el grano La modificación del punto A3 tiene otras consecuencias industriales: para un mismo tanto por ciento de carbono, los contenidos crecientes en manganeso disminuyen la temperatura A3 y permiten CONFORMAR EL ACERO (POR EJEMPLO: LAMINACIÓN, FORJA) EN ESTADO AUSTENÍTICO HASTA TEMPERATURAS MÁS BAJAS QUE LAS CORRESPONDIENTES AL ACERO SIMPLEMENTE BINARIO SIN MN; también el temple de aceros con Mn puede hacerse desde temperaturas mas bajas. Si se toma una misma temperatura de austenización (para conformación o para temple) para dos aceros del mismo % C, uno sin Mn y otro con Mn, el acero con Mn presenta más propensión al sobrecalentamiento. ADVERTENCIAS • En el rango de contenidos en carbono del 0.70 % al desplazarse el punto eutectoide a la izquierda (baja su contenido en C), podemos convertir en hipereutectoide un acero hipoeutectoide al añadir elementos gammageno. • Riesgos se sobrecalentamiento, si se realiza un tratamiento térmico de austenización completa, dando lugar a un embastecimiento del grano. • Si no se tiene en consideración la existencia de Mn y se realiza el tratamiento indicado a la izquierda de la figura se obtendrá un tamaño de grano grande, con lo que durante el enfriamiento se obtendría una estructura tipo Widmanstätten DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS Algunos elementos de aleación presentan un carácter contrario al gammágeno. Elementos como Si, P, Al, Be, Sn, Sb, As, Ti, Nb, V, Ta, Mo, W, Cr, etc., son elementos estabilizadores del hierro en su forma cúbica centrada en el cuerpo [Fe(α) y Fe(δ)], y reciben el nombre de ALFÁGENOS. Pueden ser carburígenos y no carburígenos. En la figura 1 puede verse cómo varía el bucle gamma para aleaciones Fe-Si, en función del contenido en Si (elemento alfágeno no carburígeno). La influencia del contenido en Si sobre los porcentajes en C que saturan a la austenita a alta temperatura se indica en la figura 2. Disminuye el bucle y aumenta el + TE E Figura 2.- Secciones simplificadas del diagrama Fe-C-Si (Sato) Figura 1 Diagrama Fe-Si DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS Vamos a estudiar el diagrama metaestable Fe-C influenciado por el contenido de Si (% Si) [Alfageno no carburígeno. Como regla general los no carburígenos son grafitizantes]. Al aumentar el % de Si, el campo de cristalización de γ se hace cada vez más pequeño, llegando casi hasta desaparecer. Para un mismo contenido de C, A3 se presenta a una temperatura más alta conforme aumenta el contenido de Si. El punto eutectoide aparece a una temperatura (T) más alta y para un menor contenido de C cuando aumenta el % de Si. Aceros binarios que sin Si serían hipoeutectoides (por ejemplo, C = 0.6 %) serían eutectoides si Si = 2 % e hipereutectoides para un contenido mayor de Si. En cuanto al contenido en carbono que satura a la austenita eutéctica (2.11% C a la temperatura de 1148 ° C, en los aceros binarios), su porcentaje decrece con el aumento en Si. Ello se debe a la distorsión producida por el Si en la red de la austenita al entrar en solución sólida. El silicio —como otros elementos alfágenos— no cristaliza en el sistema cúbico centrado en caras y, por tanto, sólo puede formar soluciones sólidas parciales, no totales, en el Fe(γ). A su vez la temperatura de máxima solubilidad de la austenita (γ) crece. Efecto sobre las temperaturas de los elementos alfagenos: A4 y A5 bajan La zona δ+γ será más estable a mayor temperatura A3 y A1 suben Hace que los aceros 100 % γ sean más caros y con mayor propensión al sobrecalentamiento A3 Temperaturas de forja → Más costosa la forja Riesgos de recocidos de austenización incompleta si no se tiene en cuenta que aumenta A3 (tratamientos térmicos defectuosos) Acm fv de los carburos y para un % de C fijo (Facilidad precipitación de carburos). Aumenta la temperatura de redisolución de los carburos (Dificultad redisolver carburos) Composiciones: • • Cγmax (el límite máximo de saturación en carbono de la austenita disminuye) Ce (se desplaza hacia la izquierda Da más cantidad de perlita y además diluida Tenacidad y Rm) También se modifica la temperatura necesaria para lograr la solubilidad máxima en la austenita: aumenta, según puede verse en las figuras, para los elementos alfágenos silicio [No carburígeno], molibdeno , titanio y cromo [Carburígenos. . Como regla general los carburígenos serán antigrafitizantes] Efecto sobre las composiciones de los puntos críticos: Cγmax baja Pasamos de aceros hipereutectoides a fundiciones blancas Ce baja Pasamos de aceros hipoeutectoides (0.6 %C) a eutectoides o hipereutectoides. Mayor propensión a que los aceros hipo presenten estructuras hiper, así un acero con 0.7 %C potencialmente hipoeutectoide acaba presentando estructuras hipereutectoideas por lo que se dice que el desplazamiento de Acm acentua la precipitación de carburos. Ce Ce DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS El Cr es un tanto singular como elemento alfágeno. Por lo que respecta a la transformación δ γ resulta siempre alfágeno, como puede verse en el diagrama Fe-Cr. En cambio, en la transformación γ α, el Cr sólo es alfágeno, propiamente dicho, para contenidos superiores al 7 % (Cr < 7% se comporta como gammágeno). Cuando las proporciones de cromo en una aleación binaria Fe-Cr son superiores al 13 % el carácter alfageno del cromo llega a suprimir las transformaciones Delta Gamma Alfa. Bucle Para porcentajes inferiores a 12 %Cr los ferrocromos, pueden ser plenamente austenizados Para contenidos inferiores al 5 % de Cr, su influencia en aceros de contenido bajo en C es gammágena (figura 2). Es gammágeno para A3 y levemente alfágeno para A4, por lo que domina el carácter gammágeno -Cr 7 % Gammágeno δ γ → TAlfageno γ α → TGammageno -7 < Cr 13 % Alfágeno -Cr > 13 Totalmente alfágeno Figura 2.- Secciones del bucle gamma, proyectadas sobre el plano 0 % de Cr, para diversos % de Cr. ►Límites de - saturación de C en la austenita (%C, T ºC) o “eutectoides perliticos (%C, T ºC) Figura 1.- Diagrama Fe-Cr El campo gamma -que se va cerrando al aumentar el cromo- llega a reducirse a un punto, N, para 18 % de Cr y 0,6% C. DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS Se ha intentado evaluar A3 y Ae en función del contenido de los elementos de aleación La temperatura eutectoide, Ae, en función de la composición del acero es, aproximadamente, según Andrews: Ae (C ) 727 10.7 % Mn 16.9 % Ni 29.1 % Si 16.9 % Cr 290 % As 6.38 % W En cuanto a la temperatura A3c, teniendo en cuenta el carácter alfágeno y el gammágeno de los elementos: A3c (º C) 912 203 C 30(% Mn) 15.2(% Ni ) 11(%Cr ) 20(%Cu ) 44.7 % Si 31.5 % Mo 13.1(%W ) 104(%V ) 120(% As ) 400(%Ti ) 400(% Al ) 700(% P ) En el valor de A3c los elementos gamágenos (C, Mn, Ni, Co, N, Zn, Cu, Au) restan. Elementos alfágenos: Cr, W, V, Mo, Ti (Antigrafitizantes) , Si, P, Al, Sn, Sb, As (Grafitizantes) suman. Destacan el P y el C por sus altos coeficientes. El P muy alfágeno y el C gammágeno. Esta fórmula recoge el carácter gammágeno del Cr para bajos contenidos de éste ( < 7 %Cr), y evidentemente, no sirve para aceros altamente aleados. Para los elevados porcentajes en Cr de los aceros inoxidables ferríticos (17 % Cr, C 0.003%) y aceros refractarios (25-30 % Cr, C 0.35%), estas aleaciones Fe-C-Cr solidifican en forma de hierro delta, que continúa siendo cúbico centrado en el cuerpo hasta la temperatura ambiente. Quedan suprimidas las transformaciones Ferrita delta Austenita Ferrita alfa, y se producen sólo transformaciones por pérdida de solubilidad para formar carburos por nucleación y crecimiento. A3c (º C) 727 10.7(% Mn) 29.1Si % Si 19.6(%Cr ) 290(% As ) 6.38(% W) DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS Entre los elementos alfágenos son carburígenos -o formadores de carburos- el Ti, Zr, Nb, V, Ta, W, Mo, Cr (siendo este mismo el orden creciente de estabilidad de los carburos). Otros elementos aleantes no carburígenos, con nula o negativa afinidad con el C, tienen carácter grafitizante: Si, P Al, Ni, Cu (en orden decreciente de capacidad de grafitización). Tienden a favorecer la formación aislada de Fe(γ), o Fe(α) y grafito: impidiendo -por un efecto de dilución y de afinidad- la reacción entre átomos de Fe y de C para dar cementita. Por ello las fundiciones férreas con un adecuado contenido en Si (superior a 1.5 %) solidifican sin formación de ledeburita, dando un agregado eutéctico de austenita y grafito (fundiciones grises). (2.11 % C ) Fe C (6.67 % C ) Reacción eutéctica: Liq(4.3 % C ) 1148 ºC 3 LEDEBURITA Durante el enfriamiento de una fundición gris, una vez solidificada, los elementos grafitizantes también favorecen -si su cuantía es suficiente- las transformaciones "de tipo estable" de la austenita: dando como constituyentes ferrita y grafito en lugar de formar cementita. La proporción de elementos grafitizantes produce siempre un compromiso entre solidificación estable (fundición gris) y metaestable (fundición blanca), que a veces se resuelve con la presencia simultánea de grafito y ledeburita (fundiciones atruchadas). Otro tanto ocurre en el enfriamiento: la austenita de una fundición gris puede transformarse en ferrita y grafito, o en cementita y perlita (fundiciones grises de matriz perlítica). NOTA: El carácter carburígeno no es exclusivo de los elementos alfágenos. Algunos elementos gammágenos, como el Mn, son ligeramente carburígenos. DIAGRAMA Fe-C / ELEMENTOS ALFÁGENOS Los elementos en el diagrama Fe-C, tanto sean elementos gammágenos como alfágenos, dan lugar a: • ENDURECIMIENTO DE LA FERRITA CUANDO FORMAN CON ELLA SOLUCIONES SÓLIDAS. • EL ENDURECIMIENTO ES NOTABLEMENTE MAYOR EN LAS SOLUCIONES SÓLIDAS DE INSERCIÓN (C y N) QUE EN LAS DE SUSTITUCIÓN. El carácter endurecedor, de más a menos, resulta ser: C (El mayor carácter endurecedor), N, P, Sn, Si, Cu, Mn, Mo. El Ni y el Al apenas endurecen la ferrita. El Cr, posiblemente debido a la remoción de solutos intersticiales, aparentemente ablanda la ferrita. El aumento de dureza va acompañado, en general, de pérdida de tenacidad. El N y el P elevan notablemente la temperatura de transición dúctil-frágil y, en consecuencia, aumentan la fragilidad de la ferrita de modo importante. Para un 1 % de N en solución sólida la temperatura de transición dúctil-frágil se elevaría en 700 °C. Un 1 % de P elevaría 400 °C aquella temperatura. Para 1 % de Sn la temperatura de transición sube 150 ° C y para 1% Si, 44 °C. El Cu, Mn, Mo, Cr disueltos en la ferrita, apenas afectan a la tenacidad. ELEMENTOS ALFÁGENOS NO CARBURÍGENOS Los elementos alfágenos no carburígenos se dividen en grafitizantes (Si, P, Al) y el resto (Bi, Pb, Sb,…). Modifican el diagrama Fe-C Mo–Alfageno carburígeno (Antigrafitizante) Efecto sobre las temperaturas de los elementos alfágenos no carburígenos: Común a los alfágenos: ↑A3 , ↑A1 (↑Ae ), ↑Acm (), ↓A4 Específico de los grafitizantes: ↓A5 (disminuye la posición de δ+γ), ↑TE , ↓TL , ↓TS Efecto sobre las composiciones de los puntos críticos: Comunes: ↓ Cγmax Pasamos de aceros hipereutectoides a fundiciones blancas ↓ Ce Da perlita diluida [ ↑ Tenacidad y ↑ Rm (ac)] Efecto de los grafitizantes: ↓CE ; CPERITECTICO; Deja de existir Fe3C Si – Alfageno no carburígeno (Grafitizante) Cuando el diagrama Fe-C metaestable (Fe-Fe3C) se transforma en el Fe- C(Grafito) se dice que las condiciones que facilitan la grafitización del C son: -Lentísimas velocidades de enfriamiento (mucho más lentas que el enfriamiento de equilibrio) -Añadir Si, P o Al (son grafitizantes): con esto se consigue que la velocidad de enfriamiento no tenga que ser tan lenta. Estos elementos rompen las preagrupaciones de Fe y C en el estado liquido, bajando la afinidad de estos no formándose carburos. El C al no reaccionar con el Fe dará grafito (C-C). Existe mayor afinidad C-C que Fe-C. Por ello, las fundiciones férreas con un adecuado contenido en Si (más del 1.5 %) solidifican sin formar ledeburita, dando agregado eutéctico de γ y grafito (fundiciones grises). El Si permite con velocidades de enfriamiento similares a las del diagrama metaestable se puede tener el estable. 1.- La temperatura eutectica (TE) aumenta pasando de 1148 ºC a 1154 ºC. 2.- La eutectica cambia su composición, pasa de 4.3 % a 4.25 % (ya no aparece ledeburita porque no hay cementita) 3.- El límite máximo de solubilidad de C en γ pasa de 2.11 a 2.09. 4.- La reacción eutectoide se verifica a mayor temperatura (738 ºC frente a los 727 ºC). 5.- El tanto por ciento en C de la eutectoide pasa de 0.77 a 0.68 %. Diferencias entre el diagrama estable (Rojo) y el metaestable (Negro). PARÁMETRO DIAGRAMA MESTESTABLE DIAGRAMA ESTABLE TEUTECTICA (ºC) 1148 1154 CEUTECTICA (ºC) 4.3 4.25 C MAX (%C) 2.11 2.09 TEUTECTOIDE (%C) 727 738-739 CEUTECTOIDE (%C) 0.77 Cementita 0.68 Grafito