1 - SAM
Anuncio

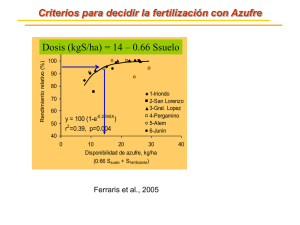
Jornadas SAM 2000 - IV Coloquio Latinoamericano de Fractura y Fatiga, Agosto de 2000, 1-6 IMPORTANCIA DE THIOBACILLUS CALDUS EN LA LIXIVIACIÓN DE SULFUROS METÁLICOS M. Semenza, G. Curutchet, M. Viera y E. Donati Centro de Investigación y Desarrollo de Fermentaciones Industriales (CINDEFI-CONICET), 47 y 115 (1900) La Plata, Argentina RESUMEN En este trabajo se comprobó que las células de Thiobacillus caldus pueden participar en los procesos de biolixiviación a través de la generación de ácido sulfúrico. Además, esta bacteria solo es capaz de lixiviar eficazmente sulfuros metálicos puros cuando son suficientemente solubles; de este modo, se lograron elevadas solubilizaciones de sulfuro de cinc pero las biolixiviaciones de sulfuro de níquel y sulfuro de cobre alcanzaron recuperaciones semejantes a los controles estériles. El mecanismo de ataque es, probablemente semejante al de Thiobacillus thiooxidans, consistiendo fundamentalmente en un primer ataque ácido abiótico sobre el sulfuro generando especies sulfuradas solubles que son oxidadas por la bacteria hasta azufre elemental. Palabras claves Thiobacillus caldus, Biolixiviación, Sulfuros Puros, Azufre INTRODUCCION El género Thiobacillus comprende a bacterias capaces de obtener energía de la catálisis oxidativa de compuestos reducidos de azufre utilizando oxígeno como último aceptor electrónico. De este género, algunas especies acidófilas (resisten muy bajos valores de pH), mesófilas (actúan a temperaturas intermedias) y autotróficas (utilizan CO2 como fuente de carbono), tales como Thiobacillus ferrooxidans y Thiobacillus thiooxidans, han mostrado sistemáticamente una acción importante en la solubilización de metales a partir de minerales sulfurados de baja ley. Esta acción se produce por ataque directo sobre la matriz sulfurada o, en el primer caso, por un mecanismo indirecto que implica la generación de un oxidante como hierro(III) el cuál luego actúa abióticamente sobre el sulfuro [1,2]. Recientemente se ha aislado una nueva especie de Thiobacillus, denominada Thiobacillus caldus, que se encuentra asociada esencialmente a minerales sulfurados de baja ley [1,3-5]. Esta especie, al igual que otras habitualmente reconocidas por su acción lixiviante tales como Thiobacillus ferrooxidans o Thiobacillus thiooxidans, es quimiolitotrófica, autotrófica y acidófila pero el rango de temperaturas óptimo para su crecimiento es ligeramente mayor al de aquellas. La presencia de grandes poblaciones de T. caldus en explotaciones comerciales, sugiere que su relevancia en la lixiviación de sulfuros es mayor a la supuesta hasta el momento. Previamente, T. caldus solo ha sido utilizado en experiencias de biolixiviación en cultivos mixtos junto a bacterias hierro-oxidantes y siempre en presencia de hierro de modo que se genere un agente oxidante como el hierro(III) capaz de atacar abióticamente a los sulfuros [4]. 1 Semenza, Curutchet, Viera y Donati En este trabajo, analizamos el crecimiento de poblaciones puras de T. caldus sobre azufre elemental y el efecto biolixiviante de estos microorganismos sobre sulfuros metálicos puros en diferentes densidades de pulpa y en ausencia de hierro adicionado. PARTE EXPERIMENTAL Las células de T. caldus fueron cultivadas en frascos agitados y termostatizados a 40 o C. La cepa utilizada recibe la denominación ATCC 51756. El medio de cultivo utilizado es una modificación del medio 9 K [6] y está compuesto por (NH4 )2 SO4 (3,0 g/l) Na2 SO4 .10H2 O (3,2 g/l), KCl (0,1 g/l), KH2 PO4 (0,05 g/l), MgSO4 .7H2 O (0,5 g/l) de pH inicial igual a 2,5 y con 10 % p/v de azufre elemental como fuente de energía. Los inóculos para las diversas experiencias fueron obtenidos por filtración para eliminar el azufre residual, posterior centrigufación y re-suspensión en medio estéril. La población bacteriana presente en las suspensiones utilizadas como inóculo estuvo comprendida entre 2,1-2,7x108 células/ml. En las experiencias de biolixiviación, se utilizaron como sustratos sulfuros sintéticos puros en tamaño de polvo (CuS, NiS y ZnS) a tres densidades de pulpa diferentes, 0,10, 0,25 y 0,5 % p/v. Los cultivos fueron realizados en frascos de 500 ml con 150 ml del medio estéril descripto, previamente inoculado al 10 % v/v. El pH inicial fue 2,5 y no fue controlado durante la experiencia. Los frascos fueron agitados a 180 rpm y termostatizados a 40 o C. Los controles estériles se prepararon reemplazando el inóculo por medio estéril. En muestras periódicas, se determinó la concentración del metal respectivo por espectrofotometría de absorción atómica y la concentración de sulfatos por turbidimetría, el pH y la población bacteriana en suspensión. RESULTADOS En la figura 1 se muestra una cinética representativa de un cultivo de T. caldus sobre azufre elemental. 6e+8 2 3e+8 24 2e+8 1e+8 450 0 100 200 1 300 Tiempo (horas) 16 300 Concentración de sulfato (g.l -1 ) -1 Concentración de protones (mmoles.l ) 4e+8 pH Células por ml 5e+8 600 150 8 0 0 50 100 150 200 250 300 Tiempo (horas) Figura 1: Crecimiento de T. caldus sobre azufre elemental: evolución de protones y sulfatos (gráfico externo) y población bacteriana en suspensión y pH (gráfico interno) 2 Jornadas SAM 2000 - IV Coloquio Latinoamericano de Fractura y Fatiga En esta figura se observan que cualquiera de los cuatro parámetros indicados, concentración de protones y sulfatos (gráfico externo), pH y población bacteriana libre en suspensión (gráfico interno), puede utilizarse como descriptiva de la evolución del cultivo. En controles estériles semejantes a los sistemas inoculados pero en los cuales fue reemplazado el inóculo por medio estéril, las concentraciones de sulfatos y de protones se mantuvieron prácticamente constantes durante la experiencia. En la figura 2 se han graficado los resultados obtenidos durante la biolixiviación de sulfuro de cinc. En ella puede observarse que la solubilización en los sistemas inoculados fue claramente superior a los controles estériles. En el gráfico interno puede comprobarse que la solubilización de cinc ha sido acompañada por un crecimiento de la población bacteriana. -8 Celulas por ml (x10 ) 3000 -1 Concentracion de cinc(II) (mg.l ) 2500 2000 8 0,50 % p/v 4 0,25 % p/v 0,10 % p/v 0 0 200 400 Tiempo (horas) 1500 Inoculados (simbolos rellenos en negro) Esteriles (simbolos no rellenos) 1000 500 0 0 100 200 300 400 500 Tiempo (horas) Figura 2: Biolixiviación de sulfuro de cinc para tres densidades de pulpa diferentes utilizando células de T. caldus: evolución de la concentración de cinc en solución (gráfico externo) y evolución de la población bacteriana en suspensión (gráfico interno) En las biolixiviaciones de sulfuro de níquel y de cobre, la acción bacteriana no fue significativa tal cual puede observarse en la figura 3. En ella se han volcado los porcentajes de recuperación de níquel y de cobre en los sistemas inoculados y en los controles respectivos luego de 15 días de lixiviación. 3 Semenza, Curutchet, Viera y Donati 35 Porcentaje de recuperacion del metal 30 CuS (Inoc) CuS (Est) NiS (Inoc) 0,10 % 0,25 % 0,50 % NiS (Est) 25 20 0,10 % 0,25 % 0,50 % 15 10 5 0 Figura 3: Recuperaciones de níquel y cobre durante las biolixiviaciones de sulfuro de níquel y sulfuro de cobre utilizando células de T. caldus. DISCUSION En la figura 1 puede apreciarse que en un cultivo de T. caldus sobre azufre elemental, la evolución de las concentraciones de protones y sulfatos es prácticamente paralela, en especial durante las primeras 150 hs. En este período, la relación entre la producción de protones y la de sulfatos se mantuvo en aproximadamente 2,5 lo que es algo superior a la relación estequiométrica esperada (molesH+ /molesSO4 2-= 2) para la oxidación de azufre. Esta menor producción de sulfatos puede justificarse con mecanismos de oxidación de azufre semejantes a los aceptados para otras especies del género Thiobacillus ya que la producción de protones se produce esencialmente en las primeras etapas de oxidación de azufre (con la formación de compuestos intermediarios tales como sulfito o tiosulfato entre otros) y, en una segunda etapa de produce la oxidación de estas especies a sulfato prácticamente sin que haya consumo o liberación de protones. Esto concuerda con la tendencia de aquella relación a acercarse al valor teórico (es decir, a 2) en los últimos tramos del crecimiento donde, debido al gran consumo de azufre (superior al 80 %), las bacterias comienzan a consumir los compuestos intermediarios acumulados en el cultivo. Esta capacidad de T. caldus de producir ácido sulfúrico a partir de azufre elemental muestra dos de los roles que puede cumplir esta bacteria durante los procesos de biolixiviación: la acidificación permanente del medio que facilita la solubilización de los metales y el consumo de azufre que puede acumularse sobre los minerales por ataques oxidantes como los producidos por hierro(III), en general, producido por la acción oxidante de bacterias como T. ferrooxidans o L. ferrooxidans. Este segundo 4 Jornadas SAM 2000 - IV Coloquio Latinoamericano de Fractura y Fatiga proceso permite la liberación de la superficie de los minerales y la continuidad de los procesos de solubilización de los minerales. En las biolixiviaciones solo se observó una acción bacteriana significativa cuando el sustrato fue sulfuro de cinc puro. Una inmediata explicación a este fenómeno, es la diferencia en solubilidad de los sulfuros utilizados, que muestra solo actividad bacteriana en la solubilización solo en el caso del sulfuro mas soluble. El mecanismo sería entonces semejante al reportado previamente para T. thiooxidans (un microorganismo muy semejante a T. caldus salvo que su temperatura óptima de crecimiento es más baja) [7] y consistiría en una primera disolución química del sulfuro en el medio de cultivo, generando HS - y H2 S (ecuación 1) y la oxidación bacteriana de estas especies (ecuación 2) permitiendo el desplazamiento permanente del equilibrio de disolución del sulfuro. El azufre formado puede ser finalmente oxidado por la bacteria de acuerdo a la ecuación 3. ZnS + 2 H+ → Zn2+ + H2 S (1) H2 S + → S (2) → H2 SO4 ½ O2 S + 3/2 O2 + H2 O + H2 O (3) La evolución del pH concuerda con este mecanismo ya que se observa un ligero ascenso inicial (producto de la disolución ácida) y un posterior descenso (debido a la producción de ácido a partir de la oxidación del azufre). En los controles estériles, se observa un ascenso constante del pH hasta valores cercanos a 2,6 coincidiendo con el máximo de solubilización que fue entre el 7 y el 25 % (creciendo con la densidad de pulpa). Las solubilizaciones de cinc fueron superiores al 85 % para las tres densidades de pulpa (y cercana al 100 % a la densidad mas baja), con velocidades promedios de solubilización de 181, 103 y 44 ppm/día para 0,50 %, 0,25 y 0,10 % de densidad de pulpa respectivamente. Las recuperaciones alcanzadas, si bien bastante elevadas, fueron menores a las alcanzadas en cultivos similares de T. ferrooxidans o de T. thiooxidans a 30 o C [7] e incluso, aunque la temperatura fue mayor en este caso, las velocidades de disolución fueron bastante menores (T. ferrooxidans y T. thiooxidans alcanzaron velocidades medias de solubilización de 233 y 270 ppm/día respectivamente). Por otro lado, las poblaciones bacterianas alcanzadas en este caso fueron mayores que las reportadas para las otras especies de Thiobacillus, sugiriendo que T. caldus tiene mayor afinidad por el azufre (ecuación 3) y que, probablemente, esto disminuya la velocidad del proceso indicado en la ecuación 2 y, por ende, la del proceso de solubilización de cinc (ecuación 1). En la figura 3, se observa que no hubo prácticamente catálisis bacteriana de la disolución del sulfuro de níquel. Sin embargo, se observó un pequeño crecimiento de la población bacteriana en suspensión, especialmente a la menor densidad de pulpa. Paralelamente, se comprobó un elevado ascenso del pH en el sistema de mayor densidad de pulpa que pudo haber inhibido la actividad bacteriana. Los resultados en el caso del sulfuro de cobre fueron similares. El mecanismo indicado a través de las ecuaciones 1-3, es semejante aunque con algunas modificaciones al que recientemente ha sido publicado por otros investigadores [8]. Sin embargo, estos investigadores proponen que ese ataque es semejante en las biolixiviaciones con bacterias del género Thiobacillus, si el hierro no está presente y si los sulfuros utilizados son aquellos cuyo producto primario durante los procesos de disolución es azufre. De acuerdo 5 Semenza, Curutchet, Viera y Donati a ello, cabría esperar procesos semejantes de disolución de sulfuro de cobre y sulfuro de níquel por T. caldus aunque con velocidades menores a las observadas para sulfuro de cinc. Nuestros resultados no concuerdan con estas expectativas ya que no se observaron diferencias significativas entre sistemas inoculados y estériles aun a tiempos largos. Previamente ha sido comprobado que situaciones semejantes se producen cuando se utilizan células de T. thiooxidans [9]; en este caso, se ha sugerido que las diferencias se deban a que la biolixiviación de sulfuros muy insolubles, exige una adherencia sobre el sustrato y una acción directamente sobre la superficie [10] que parece no ser posible para ninguna de las especies de Thiobacillus excepto para T. ferrooxidans. CONCLUSIONES Los resultados de este trabajo muestran que, de modo semejante a lo observado para T. thiooxidans, T. caldus es capaz solo de lixiviar sulfuros no demasiado insolubles, como sulfuro de cinc, a velocidades algo menores a las alcanzadas por aquel microorganismo. Sin embargo, no es capaz de incrementar la solubilización de sulfuros más insolubles como los de cobre y níquel. De este modo, su contribución en los procesos de biolixiviación, se reduce a la oxidación de los depósitos de azufre sobre minerales liberando la superficie de los mismos y en la acidificación del medio a través de la generación de ácido sulfúrico. REFERENCIAS 1. D.E. Rawlings. Biomining: theory, microbes and industrial processes, Springer-Verlag, Berlin, 1997. 2. E. Donati, G. Curutchet, C. Pogliani, H. Tedesco. Bioleaching of covellite using pure and mixed cultures of Thiobacillus ferrooxidans and Thiobacillus thiooxidans, Proc. Biochem., 31, 129-134, 1996. 3. K.H. Hallberg, M. Dopson, E.B. Lindstrom. Reduced sulfur compound oxidation by Thiobacillus caldus, J. Bacteriol., 178, 6-11, 1996. 4. M.D. Dopson, E. B. Lindstrom. Potential role of Thiobacillus caldus in arsenopyrite bioleaching, Appl. Env. Microbiol., 65, 36-40, 1999. 5. D.E. Rawlings, N.J. Coram, M.N. Gardner, S.M. Deane. Thiobacillus caldus and Leptospirillum ferrooxidans are widely distributed in continuous flow biooxidation tanks used to treat a variety of metal containing ores and concentrates. Proceedings of the International Biohydrometallurgy Symposium, Madrid, España, 777-786, 1999. 6. M.P. Silverman, D.G. Lundgren. Studies on the chemoautotrophic iron bacterium Thiobacillus ferooxidans. I. An improved medium and a harvesting procedure for securing high cellular yields, J. Bacteriol., 77, 642-647, 1959. 7. M. Pistorio, G. Curutchet, E. Donati, H. Tedesco. Direct zinc sulphide bioleaching by Thiobacillus ferrooxidans and Thiobacillus thiooxidans, Biotechn. Lett., 16, 419-424, 1994. 8. A. Schippers, W. Sand. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur. Appl. Env. Microbiol., 65, 319-321, 1999. 9. S. Porro , S. Ramírez, C. Reche, G. Curutchet, S. Alonso, E. Donati. Bacterial attachment: its role in bioleaching processes, Proc. Biochem., 32, 573-578, 1997. 10. C. Pogliani, G. Curutchet, E. Donati, H. Tedesco. A need for direct contact with particle surfaces in the bacterial oxidation of covellite in the absence of a chemical lixiviant, Biotechn. Lett., 12, 515-518, 1990. 6