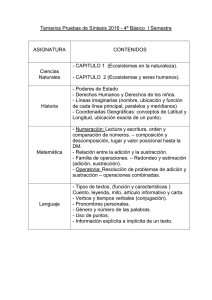
Compuestos 1,5-difuncionalizados
Anuncio
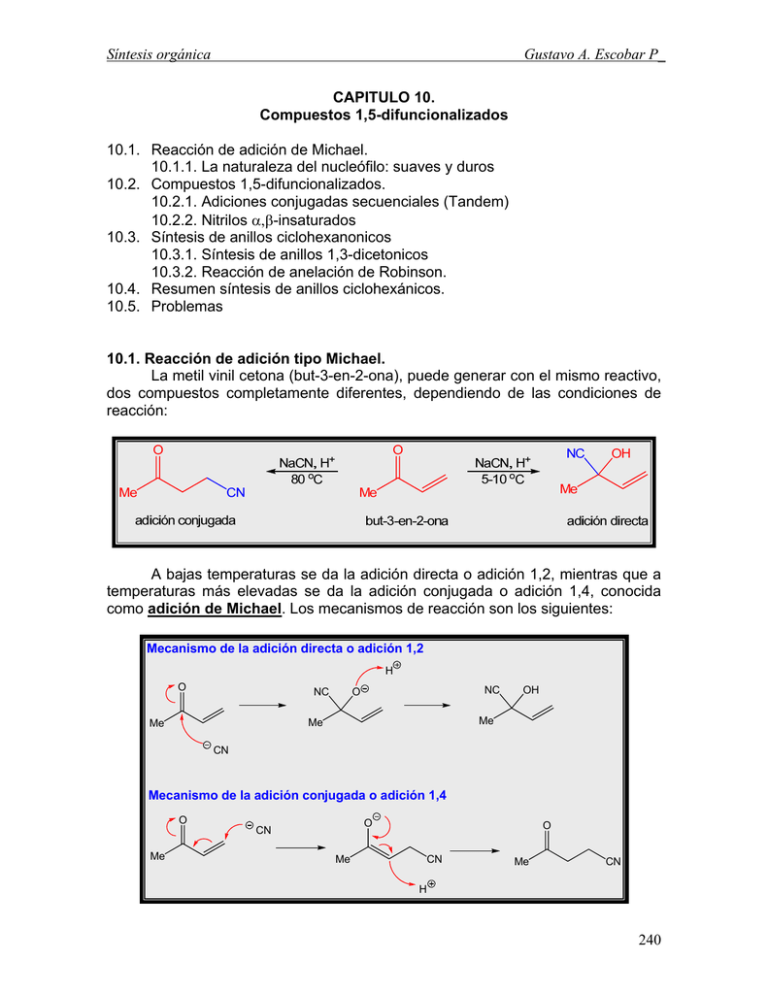
Síntesis orgánica Gustavo A. Escobar P_ CAPITULO 10. Compuestos 1,5-difuncionalizados 10.1. Reacción de adición de Michael. 10.1.1. La naturaleza del nucleófilo: suaves y duros 10.2. Compuestos 1,5-difuncionalizados. 10.2.1. Adiciones conjugadas secuenciales (Tandem) 10.2.2. Nitrilos α,β-insaturados 10.3. Síntesis de anillos ciclohexanonicos 10.3.1. Síntesis de anillos 1,3-dicetonicos 10.3.2. Reacción de anelación de Robinson. 10.4. Resumen síntesis de anillos ciclohexánicos. 10.5. Problemas 10.1. Reacción de adición tipo Michael. La metil vinil cetona (but-3-en-2-ona), puede generar con el mismo reactivo, dos compuestos completamente diferentes, dependiendo de las condiciones de reacción: A bajas temperaturas se da la adición directa o adición 1,2, mientras que a temperaturas más elevadas se da la adición conjugada o adición 1,4, conocida como adición de Michael. Los mecanismos de reacción son los siguientes: Mecanismo de la adición directa o adición 1,2 H O NC NC O Me Me Me OH CN Mecanismo de la adición conjugada o adición 1,4 O Me O CN Me O CN Me CN H 240 Síntesis orgánica Gustavo A. Escobar P_ La reacción entre el ion cianuro y el carbonilo es rápida, generando el producto cinético (adición 1,2), sin embargo a altas temperaturas se forma el producto termodinámico (adición conjugada 1,4 o adición tipo Michael) tema previamente visto en el capítulo 4. La adición conjugada solo es posible cuando hay dobles enlaces adyacentes a grupos electrón atrayentes (carbonilos, nitrilos y nitros). Un carbonilo con un doble enlace adyacente se le conoce como carbonilos α,β-insaturados y en general se les llama enonas o enal, dependiendo si es cetona o aldehído y algunos de ellos tienen nombres triviales: En el capítulo 8 tratamos los alquenos como nucleófilos, sin embargo cuando están adyacentes de un grupo electrón atrayente como lo es un carbonilo, la reactividad cambia drásticamente y se convierten en electrófilos, reaccionando con diferentes nucleófilos (ion cianuro, alcoholes, aminas, sulfuros, HBr, HCl): 241 Síntesis orgánica Gustavo A. Escobar P_ Ahora bien, supongamos que a iguales condiciones de reacción (temperatura y tiempo) el nucleófilo atacara a la enona de manara directa o conjugada dependiendo del carácter electrofílico del carbonilo. Los aldehídos y cetonas reaccionan de forma directa (1,2), mientras que los esteres y amidas lo hacen de manera conjugada (1,4): En estos casos se habla de electrófilos duros, es decir aquellos que tiene una muy baja densidad electrónica sobre el carbono del carbonilo, por ejemplo los haluros de ácido, aldehídos y cetonas y electrófilos blandos, cuya densidad electrónica es un poco más alta, como los carbonilos de ácidos, esteres, amidas. 10.1.1. La naturaleza del nucleófilo: suaves y duros El concepto de nucleófilo duro y nucleófilo suave, se introdujo como consecuencia de que algunos nucleófilos reaccionan directamente con el carbonilo (adición 1,2), mientras que otros lo hacen de manera conjugada 1,4. Al igual que con los carbonilos, la naturaleza dura o suave tiene que ver con la densidad electrónica sobre el átomo nucleofílico, por ejemplo los nucleófilos duros son los que tiene una alta densidad electrónica y tienden a reaccionar con carbonilos duros (baja densidad electrónica), mientras que los nucleófilos suaves presentan una menor densidad electrónica y tienden a reaccionar con electrófilos suaves. Veamos la siguiente tabla (los nucleófilos más utilizados en negrita): Nucleófilos duros Nucleófilos intermedios Nucleófilos suaves N3-, CN-, RNH2, RR’NH, I-, RS-, RSe-, S2-, RSH, F-, OH-, RO-, SO42-, Cl-, H2O, ROH, ROR’, RCOR’, BrRSR’, R3P, alquenos, anillos aromaticos NH3, RMgBr, RLi Tabla No 1. El agua (nucleófilo duro) reacciona con aldehídos (electrófilo duro) para formar hidratos o hemiacetales, mientras que no tiende a reaccionar con el ion 242 Síntesis orgánica Gustavo A. Escobar P_ bromuro (nucleófilo suave), sin embargo este si reacciona con alquenos (nucleófilo suave). Las reacciones entre especies “duras” son dominadas por cargas y efectos electrostáticos, mientras que reacciones entre especies “suaves” son dominadas por efectos orbitalarios. En cuanto a la adición conjugada, los nucleófilos duros tienden a reaccionar con el carbonilo (duro), mientras que los nucleófilos suaves lo hacen con el carbono β (adición conjugada). Un interesante ejemplo de adición conjugada se presenta en algunos de los medicamentos empleados contra el cáncer, los cuales contienen dentro de su estructura un carbonilo α,β-insaturado, como la vernoleptina. Este compuesto inactiva la DNA polimerasa, enzima usada por las células cancerígenas para su proliferación. El mecanismo implica un ataque nucleofílico de un tiol (nucleófilo blando) presente en la enzima, con el carbonilo α,β-insaturado del medicamento: Como previamente se ha establecido (tabla No 1) los organometálicos de Mg y Li (nucleófilos fuertes) se adicionan de manera directa a carbonilos α,βinsaturados para generar alcoholes, sin embargo cuando se adiciona al medio de reacción una pequeña cantidad de una sal de cobre (I) la reactividad cambia de manera dramática y lo que se observa es la formación del producto de adición conjugada: 243 Síntesis orgánica Gustavo A. Escobar P_ El cobre reacciona con el Grignard mediante una reacción de transmetalación para generar un organocuprato. Estos compuestos son nucleófilos suaves, ya que el cobre es más electronegativo que el magnesio y el litio, disminuyendo la densidad electrónica del nucleófilo, favoreciendo la adición conjugada. Solo se requieren cantidades catalíticas de cobre, ya que una vez reacciona el organocuprato con el carbonilo α,β-insaturado se libera sal de cobre que nuevamente reacciona con el Grignard. Realmente la estructura del organocuprato que se forma de la reacción entre el cobre y el Mg (Grignard) no está bien establecida, a diferencia de la que se forma entre el cobre y un organolitiado, ya que se necesitan dos moles del litiado por mol de cobre. Frecuentemente se adiciona cloruro de trimetilsilano (Me3SiCl) para atrapar el enolato que se forma una vez ha reaccionado el organocuprato, mejorando el rendimiento hacia la adición conjugada: 244 Síntesis orgánica Gustavo A. Escobar P_ 10.2. Compuestos 1,5-difuncionalizados. Un compuesto carbonílico 1,5-difuncionalizado se puede desconectar del modo que se indica a continuación: Desconexion de un compuesto 1,5-difuncionalizado O R1 O 3 1 5 4 2 O O 1,5-diCO R2 3 1 R1 5 4 2 R2 Los respectivos equivalentes sintéticos serian: La desconexión se basa en la adición conjugada tipo Michael de un anión enolato a una enona (carbonílicos α,β-insaturados). O R1 + H-OH R1 R1 anión enolato O R1 O O O OH adición Michael O O R2 H-OH R2 R1 5 O 4 3 2 1 R2 + OH nuevo enlace Los enoles son nucleófilos suaves y por lo tanto generan productos de adición conjugada. 245 Síntesis orgánica Gustavo A. Escobar P_ El capitulo 9 dedicó buena parte a la síntesis de enoles, enolatos, enaminas y aza-enolatos, los cuales serán indispensables en este capítulo. A continuación se indica la desconexión de un compuesto 1,5-dicarbonílico: La síntesis sería la siguiente: Una de las ventajas de emplear ester malónicos (malonato de dietilo) es que una vez adicionados pueden modificarse vía hidrólisis y descarboxilación: Los β-ceto-ácidos (1,3) que para este caso es un 1,3-diácido, descarboxilan (pierden CO2) fácilmente (página 212): El mecanismo de deshidratación, para generar el anhídrido es el siguiente: 246 Síntesis orgánica Gustavo A. Escobar P_ Veamos la retrosíntesis de la siguiente tricetona, clave en la síntesis de esteroles: Esta desconexión genera la metil-vinil-cetona comercial y la 2-metilciclohexa-1,3-diona que se puede seguir desconectando a la 1,3-ciclohexadiona, la cual de nuevo se desconecta via 1,3-diCO para generar un éster que desconecta 1,5-diCO. La síntesis sería la siguiente: 247 Síntesis orgánica Gustavo A. Escobar P_ Una síntesis alternativa para la 1,3-ciclohexadiona, seria mediante la reacción de Refortmasky: Las enaminas (capitulo 9) se adicionan de manera conjugada (1,4), lo que implica que son nucleófilos suaves, aunque se les considera mejor nucleófilos que los enoles. Otra ventaja es que se obtienen de manera cuantitativa, simplemente calentando los reactivos: 248 Síntesis orgánica Gustavo A. Escobar P_ Los sílil enol éter son otra excelente alternativa, ya que se adicionan de manera conjugada a los carbonilos α,β-insaturados: Veamos la retrosíntesis de la siguiente molécula, mediante el uso de sílil enol éteres: La síntesis comienza por la formación del sílil enol éter de la acetofenona, la cual reacciona con acetona en presencia de tetracloruro de titanio: Recuerde que los esteres también generan enoles con Me3SiCl en medio básico, conocidos como sílil cetena acetal, los cuales adicionan de manera conjugada a carbonilos α,β-insaturados con la ayuda de TiCl4 como catalizador: 249 Síntesis orgánica Gustavo A. Escobar P_ Veamos el siguiente ejemplo: O O OH O MeO O IGF MeO 1,5-diCO MeO O OH IGF 1,1 C-C O + O Br + H La síntesis comienza entre el Grignard de isopropilo y el acronal. Tenga en cuenta que los Grignard son nucleófilos duros que reaccionan con el aldehído (electrófilo duro) de manera directa (1,2) y no conjugada, luego se oxida el alcohol a cetona (Swern o PCC) el cual finalmente reacciona con en sílil cetena acetal: 250 Síntesis orgánica Gustavo A. Escobar P_ 10.2.1. Adiciones conjugadas secuenciales (Tandem) La reacción de un sílil cetena acetal en una adición conjugada genera otro sílil enol éter, el cual puede ser aprovechado en una nueva reacción aldólica. Usualmente se emplea tritilperclorato (Ph3C+ClO4-) como catalizador, en lugar de un ácido Lewis, ya que es una buena fuente de cationes PhC+: El mecanismo comienza con la adición conjugada del sílil cetena acetal a la ciclohexenona, generando un sílil enol éter el cual presenta una reacción aldólica con el benzaldehído por la cara menos impedida (trans): Me3Si O O O SiMe3 Ph MeO MeO2C O Me3SiO Ph MeO2C OH O H3O+ O Ph MeO2C De manera alternativa y con varias modificaciones se pudo sintetizar este compuesto utilizando el correspondiente organocuprato en lugar de la sílil cetena acetal, sin embargo la síntesis plantea muchas desventajas y no compite, ni en lo económico ni en lo intelectual con la anterior propuesta: 251 Síntesis orgánica Gustavo A. Escobar P_ Si bien el organocuprato no fue útil para esta reacción, existen otros casos en donde resulta completamente necesario, por ejemplo cuando se desea una adición conjugada de una molécula no enolizable (compuestos aromáticos, cadenas alquilicas, vinílicas, acetilenos etc.) como en el anterior ejemplo en donde se adiciono con un alcohol protegido. De nuevo, la molécula objetivo “selecciona” los reactivos y los métodos de síntesis. 10.2.2. Nitrilos α,β-insaturados. Los carbonilos α,β-insaturados no son los únicos compuestos adicionan de manera conjugada, ya que los nitrilos α,β-insaturados también presentan este tipo de reacciones, con la enorme ventaja de que el nitrilo puede ser oxidado a ácidos carboxílicos (capitulo 2) (o esteres) o ser reducidos a una amina (capitulo 4): Veamos el siguiente ejemplo: 252 Síntesis orgánica Gustavo A. Escobar P_ La síntesis comienza con la mezcla entre el Grignard de fenilo y el oxido de propilo, seguida de la oxidación (Swern o Dess-Martin Periodinano) del alcohol formado y generación del enol termodinámico para que reaccione con el acrilonitrilo y posterior etanolisis: El mecanismo de etanolisis de nitrilos es el siguiente: 253 Síntesis orgánica Gustavo A. Escobar P_ mecanismo de etanolisis de nitrilos H H EtO EtO R C R N C Et N R H C O R H C O Et NH2 NH H+ R O C H2N O H Et Et R C H3N O O Et Et R C O OEt R C OEt O + Et EtNH2 + H+ NH3 Las fuertes condiciones de reacción (temperatura y tiempos prolongados) para la esterificación de nitrilos, limitan su uso sobre moléculas complejas. Los nitros α,β-insaturados son mas reactivos frente a la adición conjugada que los nitrilos y carbonilos, por lo tanto se dedicara un capitulo a la química de los nitrocompuestos ya que han recobrado vigencia como herramienta útil en síntesis orgánica. Veamos el siguiente ejemplo: Este interesante ejemplo presenta dos posibilidades de adición conjugada de la enamina al grupo nitro o al éster. La reacción genero un solo producto, indicando el fuerte efecto electrón atrayente que ejerce el grupo nitro, muy superior al que pudiera tener el carbonilo de un éster. La coccinelline (9), es un compuesto exudado en las articulaciones de la mariquita (Epilachna varivestris) como mecanismo de defensa contra otros insectos. La desconexión implica la formación de una amina primaria que proviene de una cetona (11) en donde probablemente sea mejor dejar los grupos protectores acetalicos durante las manipulaciones. La cetona (11) es simétrica de tal manera que se puede emplear en una desconexión 1,3 diCO (12) a la cual sigue la adición de un grupo activante CO2Et. 254 Síntesis orgánica Gustavo A. Escobar P_ Esta estrategia se basa en una autocondensación del material de partida (13). Si se remueve los grupos acetalicos, podemos efectuar una desconexión 1,5 diCO (14) lo que conducirá al malonato de dietilo y a la acroleína como materiales de partida. Análisis retrosintético: O N N N IGF (9) N wittig IGF CH2 CH3 CH3 O N AGF 1,3 diO NH2 CO2Me CO2Et CO2Me CHO NH2 IGF CH(OMe)2 CH(OMe)2 CHO O (10) CO2Et CO2Et C-N O CH(OMe)2 AGF CH(OMe)2 O CH(OMe)2 1,3 diO CH(OMe)2 CH(OMe)2 (12) CO2Et C-O 1,5 diCO (14) acetal CHO (13) O CO2Et + CH2 H 255 Síntesis orgánica Gustavo A. Escobar P_ Síntesis: Los químicos orgánicos sintéticos decidieron proteger el aldehído inmediatamente después de la reacción de Michael, para evitar reacciones colaterales, dada la alta reactividad de este grupo, y obtuvieron la amina por medio de una aminación reductiva (tema 3) empleando cianoborohidruro de sodio (NaCNBH3) como agente reductor. Note la facilidad con la que se efectúa las descarboxilaciones (NaCl, DMF húmeda) cuando el éster es necesario. 256 Síntesis orgánica Gustavo A. Escobar P_ El producto de la adición conjugada de un enol a un carbonilo α,βinsaturado es un compuestos 1,5 dicarbonílico. Sin embargo en ocasiones es posible que uno de estos carbonilos vuelva a enolizar para reaccionar con el otro carbonilo formando un anillo de seis miembros. 10.3. Síntesis de anillos ciclohexánicos: El producto de reacción depende de la naturaleza del grupo R, si es un buen grupo saliente (OR, Cl etc), el producto que se forma es un anillo 1,3dicetonico. Por el contrario si R no es un grupo saliente (alquil o aril) el producto de reacción es un anillo cetónico α,β-insaturado, es decir se da la deshidratación: 10.3.1. Síntesis de anillos 1,3-dicetonicos. Como acabamos de observar la síntesis de anillos de seis miembros con 1,3-dicarbonilos, conocidos como dimedonas, dependen del grupo R. En general se suele trabajar con malonatos o acetoacetatos de etilo (reacción de 257 Síntesis orgánica Gustavo A. Escobar P_ Knoevenagel) a los cuales finalmente se suele descarboxilar uno de sus grupos éster: El mecanismo comienza con la formación del enolato del malonato de dietilo, el cual adiciona de manera conjugada a la cetona α,β-insaturada: La segunda etapa es el ataque de la base al protón mas acido (α al diéster), el cual podría atacar intramolecularmente a la cetona formando un ciclo de 4 miembros totalmente inestable, revertiendo al enolato original. La base entonces captura el protón que le sigue en acidez: el protón α a la cetona, favoreciendo la formación del enolato cinético: El enolato ataca intramolecularmente a cualquiera de los dos esteres formando la dimedona (anillo 1,3-dicetonico): 258 Síntesis orgánica Gustavo A. Escobar P_ Finalmente solo resta hidrolizar el éster para obtener un β-ceto-éster que descarboxila fácilmente: 10.3.2. Reacción de anelación de Robinsón La formación de anillos se le conoce como anelación o anulación. La anelación de Robinsón consiste en una reacción de adición de un enol o enolato a una enona de manera conjugada (Michael 1,4) seguida de una reacción aldólica intramolecular para formar un anillo ciclohexenónico. El mecanismo combina dos importantes reacciones (adición conjugada y aldólica intramolecular) e implica tres etapas claramente diferenciables: 1. Formación del enolato estable y adición conjugada: 259 Síntesis orgánica Gustavo A. Escobar P_ Note que el enolato que se forma de la adición conjugada puede atacar uno de los carbonilos en rojo, formando un anillo de cuatro miembros inestable, el cual revierte el equilibrio hacia el enol, que termina finalmente reaccionando con el ácido conjugado de la base. 2. Formación del enolato cinético y reacción intramolecular: 3. reacción de deshidratación: La deshidratación se da mediante un mecanismo E1cB y es quien finalmente decanta todos los equilibrios anteriores, ya que un carbonilo α,βinsaturado es termodinámicamente más estable que una β-hidroxi-cetona. Las enaminas también se emplean de manera satisfactoria en la anelación de Robinsón. 260 Síntesis orgánica Gustavo A. Escobar P_ Por ultimo veamos la síntesis de un importante medicamento descrito como un antagonista dopa-minergico: 10.4. Resumen síntesis de anillos ciclohexánicos El siguiente es el resumen de las reacciones que se han visto hasta ahora en el curso y que permiten la síntesis de anillos ciclohexánicos: 1º Reacción de Diels-Alder 2º. Reacción de anelación de Robinson 3º. Adición Michael/condensación de Claisen 261 Síntesis orgánica Gustavo A. Escobar P_ La reacción de reducción de Birch (pagina 39) estrictamente no crea el anillo ciclohexánico como los otros tres métodos anteriores. Sin embargo, puede ser un método muy útil para la preparación de determinados compuestos ciclohexanónicos con la estructura general indicada en el siguiente esquema. 4º Reducción de Birch Problema 10.1: Síntesis del compuesto bicíclico 33. El compuesto 33 se ha empleado en una aproximación sintética al precapnelladieno. Este compuesto esta considerado como el precursor biogenético de las estructuras tricíclicas de capnellenos y capnellenoles. Los cuales son productos de origen marino aislados del coral Capnella imbricata. Presentan una estructura de cicloocteno poco común en productos naturales, que también se ha observado en otros productos sesquiterpénicos como el dactilol. H O H HO 33 dactilol precapnelladieno Análisis retrosintético: O O Wittig OH O C-O COOMe éster 33 35 34 O 1,1 O COOMe C-C 1,5 diCO COOMe + 36 262 Síntesis orgánica Gustavo A. Escobar P_ La desconexión del doble enlace en el compuesto 33, conduce a la lactona 34, que por desconexión del enlace lactónico proporciona el hidroxiéster 35. La desconexión de la cadena vinílica lleva al cetoéster 36, que presenta una relación 1,5-dicarbonílica que permite su desconexión a la ciclopentanona y al acrilato de metilo. Síntesis: Reactivos y condiciones: a) LDA, THF, -78 °C; b) bromuro de vinilmagnesio, -78°C; c) Cp2TiCH2AlClMe2, -15°C a temperatura ambiente. La adición de Michael de la ciclopentanona al acrilato de metilo proporcionó el cetoéster 36. La adición quimioselectiva de bromuro de vinil magnesio al carbonilo cetónico generó el correspondiente alcóxido, que ataco intramolecularmente al grupo metoxicarbonilo para formar in situ la lactona 34. La reacción de metilenación empleando el reactivo de Tebbe6 permitió la obtención del compuesto 33. Problema 10.2: síntesis del tricetoéster 42. Análisis retrosintético: El compuesto 42 se podría obtener por oxidación del sistema de β-hidroxiéster presente en el compuesto 43. Este compuesto posee un sistema 1,3-dioxigenado que se puede desconectar, mediante una reacción de tipo aldólico, al aldehído 44. La desconexión del doble enlace en el aldehído α,β-insaturado 44, lleva al compuesto tricarbonílico 45 cuya relación 1,5dicarbonílica permite su desconexión a la 2-metil-l,3-ciclopentanodiona y a la acroleína. 263 Síntesis orgánica Gustavo A. Escobar P_ Síntesis: Reactivos y condiciones: a) acroleína, H2O, temp. amb.; b) Ph3P=CHCHO, benceno, reflujo; c) Zn, BrCH2COOtBu, THF, reflujo; d) MnO2, CH2Cl2, temp. amb. La adición de Michael de la 2-metil-l,3-ciclopentanodiona a la acroleína proporcionó el compuesto tricarbonílico 45. El aldehído α,β-insaturado presente en el compuesto 44 se consiguió mediante reacción Wittig entre el compuesto 45 y el fosforano Ph3P=CHCHO. La adición nucleofílica del acetato de t-butilo al aldehído 44 se efectuó mediante la reacción de Reformatsky. Para ello se trató el bromoacetato de t-butilo con Zn, y el aldehído 44 se añadió a la disolución que contenía el reactivo organometálico generando el β-hidroxiéster 43. Finalmente, la oxidación del hidroxilo alílico del compuesto 43 con MnO2 produjo el tricetoéster 42. 264 Síntesis orgánica Gustavo A. Escobar P_ Problema 10.3. Síntesis del compuesto bicíclico 56. El compuesto 56 es un intermedio en la preparación de la ptilocaulina, guanidina cíclica con potente actividad antimicrobiana y citotóxica, que ha sido aislada de la esponja del caribe Ptilocaulis aff. P. spiculifer Análisis retrosintético: La desconexión del sistema enónico del compuesto 56 conduce al cetoaldehído 57. La funcionalidad de este compuesto es similar a la del compuesto 52 del problema anterior. Por tanto aplicando la misma estrategia de desconexión se accede a la enona 58 y al sintón organometálico 54. La desconexión del sistema enónico del compuesto 58 proporciona el cetoaldehído 59, que mediante su relación 1,5-dicarbonílica se desconecta a la cetona 60 y al crotonaldehído 61. Síntesis: El equivalente sintético de la cetona 60 se obtuvo mediante la síntesis acetilacética, empleando acetoacetato de t-butilo y yoduro de nbutilo como agente alquilante. El (3-cetoéster 62 resultante de la reacción anterior se adicionó de forma conjugada al crotonaldehído para proporcionar el compuesto tricarbonílico 63. La condensación aldólica 265 Síntesis orgánica Gustavo A. Escobar P_ intramolecular, la hidrólisis y la descarboxilación del compuesto 63 se consiguió en una sola etapa sintética mediante la reacción de este compuesto en una mezcla de AcOH-H2O-HCl (100:1:10). En estas condiciones se obtuvo una mezcla inseparable de cetonas epiméricas 58. Como equivalente sintético del fragmento organometálico 54 se empleó el reactivo de Grignard derivado del 2-(2-bromoetil)-l,3-dioxano. La adición conjugada del reactivo organometálico al sistema enónico de 58 se consiguió en presencia de CuBr-SMe2 y proporcionó el compuesto 64. Finalmente, la reacción del compuesto 64 con HCl acuoso provocó la desprotección del acetal y la condensación aldólica intramolecular proporcionando la enona bicíclica 56 como mezcla de epímeros, fácilmente separables por cromatografía. Reactivos y condiciones: a) Na (M), n-BuI, dioxano; b) MeONa, acronal, 0°C, temp. amb.; c) AcOH-H2O-HCl (100:1:10), 25°C; d) bromuro de 2-(1,3-dioxan-2il)etilmagnesio, CuBr-SMe2, THF, -78°C; HCl 5N, DME, 45°C. 266 Síntesis orgánica Gustavo A. Escobar P_ Problema 10.4. Síntesis del epoxicompuesto 75. Este compuesto intermedio en la preparación de los merosesquiterpenos zonarol e isozonarol, productos naturales de origen marino con una importante actividad antifúngica. Análisis retrosintético: La desconexión del anillo oxiránico del compuesto 75, conduce compuesto olefínico 76. El doble enlace se podría generar mediante deshidratación del alcohol terciario 77, que a su vez se podría obtener mediante la adición de un reactivo de tipo metil-metálico a la cetona 78. Este compuesto se podría obtener a partir de la enona 79, que desconecta, mediante una anelación de Robinson a la 2-metil-l,3-ciclohexanodiona y a la metil vinil cetona. Síntesis: 267 Síntesis orgánica Gustavo A. Escobar P_ Reactivos y condiciones: a) i. KOH, MeOH, ii. pirrolidina, H2O; b) i. NaBH4, EtOH, ii. Ac2O, piridina; c) i. t-BuOK, t-BuOH, CH3I, ii. KOH, EtOH; d) H2, Pd/C, EtOH; e) NH2NH2, KOH, dietilenglicol, calefacción; f) CrO3, H2SO4, H2O, acetona; g) CH3Li, éter, 0°C; h) DMSO, 155°C; i) mCPBA, Na2HPO4, CHCl3. La anelación de Robinson entre la 2-metil-1,3-ciclohexanodiona y la metil vinil cetona proporcionó el compuesto 79. En este punto de la síntesis se protegió el carbonilo de la cetona no conjugada mediante reducción quimioselectiva con NaBH4 y esterificación subsiguiente del hidroxilo secundario con Ac2O. La enolización termodinámica del compuesto 80 con t-BuOK generó un dienolato potásico que por alquilación con exceso de Mel y saponificación del acetato proporcionó el compuesto 81. La fusión trans de los anillos se consiguió mediante la hidrogenación estereoselectiva del compuesto 81. El hidrógeno se aproxima al doble enlace desde la cara opuesta al metilo angular y al metilo axial del sistema gemdimetílico. La reducción de Wolff-Kishner transformó la hidroxicetona 82 en el compuesto 83, que se oxidó con CrO3 a la octalona 78. La adición de MeLi al carbonilo cetónico genero el alcohol terciario 77, que se deshidrató regioselectivamente por calentamiento en DMSO anhidro para dar la olefina trisustituida 76. El empleo de reactivos como SOCl2 en piridina, POCl3 en piridina, yodo en benceno o H2SO4 en pentano a fin de efectuar la deshidratación, provocó, en 268 Síntesis orgánica Gustavo A. Escobar P_ todos los casos, la generación de la olefina tetrasustituida resultante del proceso de transposición catiónica: Finalmente, la epoxidación del doble enlace con mCPBA proporcionó el compuesto 75. 269