química orgánica ii (1413) 2014 -‐ 2
Anuncio
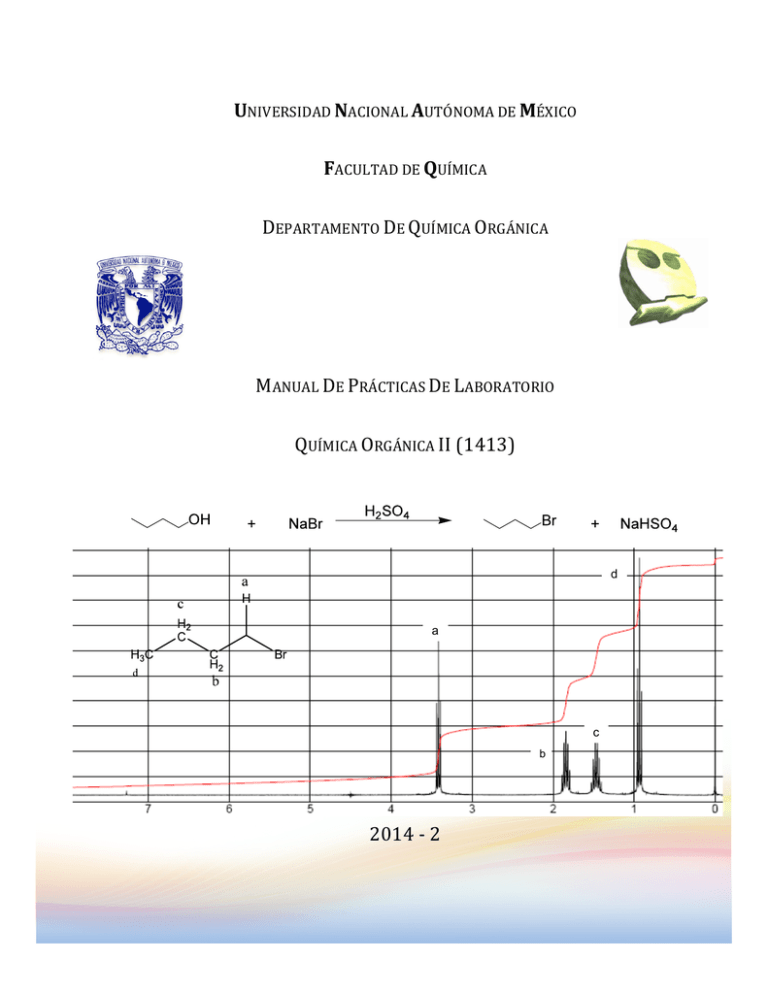
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE QUÍMICA ORGÁNICA MANUAL DE PRÁCTICAS DE LABORATORIO QUÍMICA ORGÁNICA II (1413) d a c b 2014 -­‐ 2 PRÓLOGO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G PRÓLOGO Dadas las necesidades del cambio al nuevo plan de estudios para la Carrera de Químicos, en la Facultad de Química de la UNAM. Fue necesario hacer modificaciones a las prácticas de Química Orgánica II (clave 1413), utilizando los manuales del antigüo plan de estudios: el de Compuestos con Carbono, Hidrógeno y Halógenos clave 1435 y el de Compuestos con Carbono, Hidrógeno, Oxígeno, Nitrógeno y Azufre clave 1535. Con ellos, los nuevos programas y la colaboración de los maestros que han impartido la teoría y el laboratorio en dicha química desde el año 2007 a la fecha, se logra obtener el presente manual de prácticas del nuevo plan de estudios. Estas modificaciones estuvieron a cargo de la jefa de laboratorio Dra. María del Consuelo Socorro Sandoval García, con la colaboración de la alumna Noemy Bolaños Méndez en el año 2007. Tomando como base los manuales elaborados por el Dr. José Gustavo Ávila Zárraga (clave 1435) y la M en C Ana Adela Sánchez Mendoza (clave 1535) en el año 2004. Los datos de los compuestos, así como los diagramas de tratamiento de residuos y desechos, fueron capturados de los datos elaborados por la Dra. Irma Cruz Gavilán García posteriormente se han incrementado y se han realizado modificaciones por la M en C. Gema Susana Cano Díaz. 2 PROGRAMA TEÓRICO EXPERIMENTAL Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G FACULTAD DE QUÍMICA PROGRAMA TEORICO EXPERIMENTAL PARA LA MATERIA “QUÍMICA ORGÁNICA II” (1413) DEPARTAMENTO DE QUÍMICA ORGÁNICA 0 Horas acumuladas en el laboratorio 4 1 8 2 12 3 16 4 20 5 24 6 7 8 9 10 11 12 28 32 36 40 44 48 48 42 13 50 45 ---- ----- Semana Horas acumuladas en teoría 1 3 2 6 3 9 4 12 5 15 6 18 7 8 9 10 11 12 13 21 24 27 30 33 36 39 14 15 Unidad SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA SUSTITUCIÓN NUCLEOFÍLICA AROMÁTICA HALOGENUROS DE ALQUILO ALCOHOLES Y FENOLES ÉTERES SE A Experimento 3 Plan de trabajo en el laboratorio Medidas de seguridad, reglamentos de laboratorio Sustitución electrofílica aromática (1ª parte) Nitrobenceno m-Dinitrobenceno o y p-Nitrofenol (2da parte) 2,4-Dinitroclorobenceno Sustitución nucleofílica aromática 2,4-dinitrofenilanilina 2,4-dinitrofenilhidracina Halogenuros de alquilo. Obtención de: Bromuro de n-butilo SN2 Cloruro de ter-butilo SN1. Su hidrólisis para determinar la constante de velocidad de la reacción Reacción de Grignard Preparación de compuesto organometálico (1ª parte) Obtención del alcohol (2da parte) Reducción de carbonilos con microondas y en estado sólido Oxidación n-butanol Identificación y caracterización de alcoholes y fenoles Síntesis de Williamson Síntesis de Friedel-Crafts o Sulfonación de dodecilbenceno Entrega de calificaciones a los alumnos así como su firma de enterados y la entrega de calificaciones a la sección ------ SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO OBJETIVO Conocer una reacción de sustitución electrofílica aromática y aprender a aplicar los conceptos de la sustitución al desarrollo experimental de la nitración de benceno. Aprender a controlar las condiciones experimentales que favorecen la monosustitución y a utilizar las propiedades de los grupos orientadores a la posición meta del anillo aromático para sintetizar un derivado disustituido. En esta práctica la mitad de grupo de los alumnos preparará nitrobenceno y la otra mitad mdinitrobenceno. ANTECEDENTES 1. Sustitución electrofílica aromática: nitración 2. Reactividad del anillo bencénico en la sustitución electrofílica aromática. 3. Mecanismo de nitración 4. Variaciones de las condiciones experimentales en una nitración y sus consecuencias 5. Cálculo del rendimiento de la reacción considerando la estequiometría de la misma a. OBTENCIÓN DE NITROBENCENO REACCIÓN NO2 H2SO4 / HNO3 60oC, 40 min MATERIAL 1 Adaptador (tapón de hule con tubo de vidrio) 1 Bandeja de plástico 1 Barra magnética 1 Embudo de filtración rápida 2.5 cm φ 1 Embudo de separación con tapón 1 Embudo de sólidos 1 Espátula 1 Manguera de vacío 1 Matraz balón de fondo plano de 25 ml 1 Matraces balón de 10 ml 1 Matraz bola de 2 bocas de 25 ml 2 Matraz Erlenmeyer de 25 ml SUSTANCIAS Cantidad 3 ml Ácido nítrico fumante 3.75 ml Ácido sulfúrico concentrado 2.5 ml Benceno 2.5 g Cloruro de calcio anhidro Cantidad 2g 20 ml 2.5 g 4 1 3 1 1 1 1 2 1 1 1 1 Parrilla de agitación Pinzas de tres dedos con nuez Porta termómetro Probeta de 10 ml Refrigerante con mangueras Refrigerante de aire “T” de destilación “T” de vacío Termómetro de -10 a 400 ºC Vaso de precipitado de 50 ml Vial con junta esmerilada de 5 ml Cloruro de sodio Hidróxido de sodio en solución Sulfato de sodio anhidro SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G PROCEDIMIENTO Coloque en el matraz balón de dos bocas 3 ml de HNO3 concentrado más una barra magnética. Y adapte en una de las bocas el embudo de separación con 3.75 ml de H2SO4 concentrado. Sumerja el matraz en un baño de hielo e inicie la adición de H2SO4 conc., poco a poco y con agitación. Mantenga la temperatura de la mezcla sulfonítrica entre 20°- 30°C. Al término de la adición, coloque un porta termómetro con el termómetro (1) Retire el baño de hielo y adicione lentamente (2) con agitación vigorosa (3) 2.5 ml de benceno, cuide que la temperatura de la reacción se mantenga entre 40°- 55°C (enfríe exteriormente con un baño de hielo sí es necesario) Al finalizar la adición del benceno continúe la agitación hasta que cese la reacción exotérmica y en este momento adapte a la boca principal del matraz balón un refrigerante de agua en posición de reflujo (4). Poner sobre la parilla el matraz balón de dos bocas, (adapte el siguiente sistema, Esquema 1) caliente hasta alcanzar la temperatura de 60°C por 40 minutos; es conveniente que durante el calentamiento la agitación sea vigorosa para asegurar el contacto entre las dos capas inmiscibles (9). NaOH solución diluida Esquema 1 Posteriormente retire el matraz balón del calentamiento, deje enfriar y colóquelo en un baño de agua con hielo hasta tener una temperatura de 20°C (ahora en dos fases, fase superior corresponde al nitrobenceno y la fase inferior a la mezcla sulfonítrica residual, transfiérala al embudo de separación y deseche la fase inferior. Lave el nitrobenceno (5) dos veces con 4 ml de agua fría y después con solución de NaOH al 10% (2.5 ml cada vez), hasta pH 7 (6) y finalmente lave una vez con agua. Seque el nitrobenceno húmedo en un matraz Erlenmeyer de 25 ml con sulfato de sodio o cloruro de calcio anhídro (7) y transfiéralo por decantación a una bola de destilación de 10 ml. Adapte al matraz bola de 10 ml el equipo necesario para destilar (8) el nitobenceno (Destilación a Presión Reducida), utilice el refrigerante de aire. El nitrobenceno tiene un p. eb. de 210-211°C/ 760 mm Hg y 196-197°C/ 585 mm Hg. Colecte la fracción que destila por debajo de 150°. Mida el volumen obtenido y calcule el rendimiento. 5 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G b) OBTENCIÓN DE m-DINITROBENCENO REACCIÓN NO2 H2SO4 / HNO3 100oC, 45 min 1 1 1 1 1 1 1 1 1 1 1 1 MATERIAL Adaptador (tapón de hule con tubo de vidrio) Agitador de vidrio Bandeja de plástico Barra de agitación magnética Colector Embudo Buchner con adaptador de hule Embudo de filtración rápida Embudo de separación con tapón Embudo de filtración rápida Embudo de sólidos Espátula Matraz erlenmeyer de 25 ml 1 1 1 2 1 1 1 1 1 1 1 1 NO2 Matraz bola de 2 bocas de 25 ml de fondo plano Matraz Kitazato de 50 ml con manguera Parrilla con agitación Pinzas de tres dedos con nuez Porta termómetro Probeta de 10 ml Refrigerante con mangueras “T” de destilación Termómetro de -10 a 400 ºC Vaso de precipitado de 50 ml Vaso de precipitado de 25 ml Vidrio de reloj PROCEDIMIENTO Coloque en el matraz balón de dos bocas 3 ml de HNO3 concentrado más una barra magnética y adapte en una de las bocas el embudo de separación con 3.75 ml de H2SO4 concentrado. Sumerja el matraz en un baño de hielo e inicie la adición de H2SO4 conc., poco a poco y con agitación Mantenga la temperatura de la mezcla sulfonítrica entre 20° - 30°C. Al término de la adición, coloque un porta termómetro con el termómetro (1) Retire el baño de hielo y adicione lentamente (2) con agitación vigorosa (3) 1.25 ml de benceno, cuide que la temperatura de la reacción se mantenga entre 40°C (enfríe exteriormente con un baño de hielo si es necesario) Al finalizar la adición del benceno continúe la agitación hasta que cese la reacción exotérmica y en este momento adapte a la boca principal del matraz balón un refrigerante de agua en posición de reflujo (4). Adapte en una parrilla el matraz balón de dos bocas, caliente hasta alcanzar la temperatura de 100 °C por 45 minutos (ver Esquema 1); es conveniente que durante el calentamiento la agitación sea vigorosa para asegurar el contacto entre las dos capas inmiscibles (9), Transcurrido el tiempo de reflujo, vierta lentamente (con agitación) la mezcla de reacción en 35 g de hielo Colecte el m-dinitrobenceno crudo en un embudo buchner y recristalice en etanol, separe el sólido recristalizado por filtración al vacío, seque y pese el m-dinitrobenceno. Calcule rendimiento en base a la reacción. El m-dinitrobenceno tiene un p.f. de 89.5°C. 6 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G NOTAS (1) El bulbo del termómetro debe estar en contacto con la mezcla de reacción. (2) Agregue el benceno a la mezcla sulfonítrica en porciones de 1-2 ml (3) Debido a que el benceno es poco soluble en la mezcla sulfonítrica se requiere agitación vigorosa. De esta agitación depende el éxito de la nitración (4) Colocar en el refrigerante una trampa con (NaOH lenteja) y canalice a un vaso de precipitado que contenga solución de sosa o potasa. (5) Investigue la densidad del nitrobenceno y del agua, antes de eliminar cualquiera de las fases (6) En caso de que al final de los lavados del nitrobenceno con solución de NaOH al 10%, éste quedará básico, lave con agua hasta pH 7 (7) Caliente a baño María hasta que aclare el nitrobenceno. Elimine el sulfato de sodio o cloruro de calcio anhidro por decantación o filtración (8) Precaución, no destile hasta sequedad, debido a que pueden existir algunos productos de polinitración que sean explosivos. (9) El éxito de la práctica depende de la agitación BIBLIOGRAFÍA R. Q. Brewster y C. A. Vander Werf., Curso Práctico de Química Orgánica, 3ª. Edición, Editorial Alambra, España (1970), Páginas 178-179 J. A. Moore y D. L. Dalrymple, Experimental Methods in Organic Chemistry. 2a. Edición, W. B. Saunders Company, U.S.A. (1976), Páginas 188-194 A. I. Vogel, Text Book Practical Organic Chemistry, 3ª. Edición, Editorial Longmans, Londres (1962), Páginas: 523-527 B. J. Hazzard (Traducción) Organicum. Practical Handbook of Organic Chemistry, 1ª. Edición. Addison-Wesley Publishing Company, Inc., U.S.A., (1973), pp. 306-315 R. T. Morrison y R. N. Boyd., Química Orgánica 3a Edición, Fondo Educativo Interamericano, S. A. México (1976), Páginas: 348-358, 366-374 J. D. Roberts, M. E. Caserio, Química Orgánica, Fondo Educativo Interamericano, S. A. México, (1974), Páginas: 522-526, 531-535 7 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G 8 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA NITROBENCENO y m-DINITROBENCENO Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G m-DINITROBENCENO 1) Agregar H2SO4 gota HNO3 conc. en a gota con agitación baño de hielo 2) Manter T = 20-30oC 1.25 ml de con agitación vigoroza. MEZCLA SULFONÍTRICA Colocar refrigerante NITROBENCENO, en posición de reflujo MEZCLA SULFONÍTRICA T = 100oC, t = 45 min T = 40oC m-DINITROBENCENO Y MEZCLA SULFONÍTRICA 1)vertir sobre 35 g hielo, lentamente 2)Filtrar al vacío q Lí do ui o lid ó S m-DINITROBENCENO MEZCLA SULFONÍTRICA Recristalizar en CH3CH2OH D4 Lí o id qu o lid ó S m-DINITROBENCENO recristalizado Aguas madres D5 9 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA o, p-NITROFENOL Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G o y p-NITROFENOL OBJETIVO Ilustrar la orientación y reactividad de los anillos bencénicos monosustituidos en la sustitución electrófilica aromática Usar métodos de purificación e identificación para los productos obtenidos ANTECEDENTES 1. Sustitución electrofílica aromática. 2. Condiciones experimentales necesarios para realizar la nitración. 3. Variación de las condiciones experimentales en una nitración y sus consecuencias. 4. Métodos de purificación e identificación de los productos aislados. 5. Propiedades físicas de reactivos y productos. REACCIÓN OH OH NO2 HNO3 diluido 45oC, OH 15 min p.f. = 45oC MATERIAL 1 Adaptador (tapón de hule con tubo de vidrio) 1 Agitador de vidrio 1 Anillo metálico 1 Bandeja de plástico 1 Barra de agitación magnética 1 Colector 1 Embudo buchner con adaptador de hule 1 Embudo de filtración rápida 1 Embudo de separación con tapón 1 Espátula 1 Matraz Erlenmeyer de 25 ml 2 Matraz Erlenmeyer de 125 ml 1 Matraz Kitazato de 50 ml con manguera 1 Mechero con manguera 2 Pinzas cuatro dedos con nuez 1 1 1 1 2 1 1 1 1 1 1 1 1 1 + NO2 p.f. = 114oC Pipeta graduada de 5 ml Probeta de 10 ml Recipiente para baño María Refrigerante con mangueras Tapones de hule bihoradado para matraz de 125 ml Tela de alambre con asbesto Termómetro de -10 a 400 ºC Tubo de vidrio de 80 cm Tubo de vidrio en “U” de 40 cm Tubo de vidrio en ángulo de 75º Vaso de precipitado de 50 ml Vasos de precipitado de 25 ml Vasos de precipitado de 10 ml Vidrio de reloj SUSTANCIAS Cantidad 1.5 ml Ácido nítrico concentrado 0.2 g Carbón activado 1.13 g Fenol PROCEDIMIENTO Coloque en un matraz Erlenmeyer de 125 ml, 5 ml de agua y agregue poco a poco 1.5 ml de ácido nítrico concentrado, resbalando por las paredes del matraz y agitando suavemente. Ponga a enfriar en baño de hielo. 10 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA o, p-NITROFENOL Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G En un vaso de precipitado de 10 ml pese 1.13 g de fenol, fúndalo a B.M. y adiciónelo gota a gota a la solución de HNO3, agite por 5 minutos dejando que la temperatura llegue a 25 °C. Caliente en B. M. a 45 °C durante 15 minutos agitando constantemente; agregue 6.25 ml de agua. Transfiera la mezcla de reacción a un embudo de separación y separe las fases orgánica y acuosa (1). Destile la fase orgánica por arrastre de vapor hasta que se observe que condensa solamente agua. Enfríe el destilado en hielo y separe por filtración al vacío los cristales de o-nitrofenol formados (2). Determine punto de fusión y calcule rendimiento. Purifique el isómero p-nitrofenol empleando carbón activado. Separe los cristales por filtración al vacío, determine punto de fusión y haga cálculos de rendimiento (3). NOTAS: (1) Tome en cuenta la densidad de las dos fases. Durante todo el proceso de nitración, sea cuidadoso. Use lentes de protección (2) Los cristales de o-nitrofenol pueden secarse en estufa a 30 °C (3) Use poco carbón activado (0.125 g aproximadamente). Los cristales de p-nitrofenol pueden secarse en estufa a 60 °C . BIBLIOGRAFÍA J. A. Moore y D. L. Dalrymple, Experimental Methods in Organic Chemistry. 2a. Edición, W. B. Saunders Company, Philadelphia (1976), pag. 188 Organicum. Practical Handbook of Organic Chemistry, Becker H. et al, English translation by B. J. Hazzard. Pergamon Press Ltd. N.Y. (1973), pag. 312 The Merck Index, 8th Edition. P. G. Steder editor. Merck & Co. Inc. Rahway N. J. U.S.A., 1968. 11 SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA o, p-NITROFENOL Química Orgánica II (1413) Coordinadora Dra. Ma. del Consuelo S. Sandoval G NOTA: LAS CANTIDADES DE TODO REACTIVO QUE APARECE EN EL DIAGRAMA SERA ENTRE CUATRO ESTO ES SE TRABAJARA CON LA CUARTA PARTE. 12






