II - Equilibrio de fases en substancias puras
Anuncio

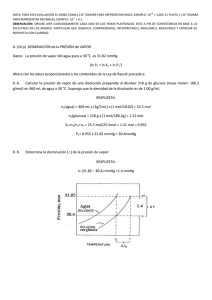
II - EQUILIBRIO DE FASES EN SUBSTANCIAS PURAS Equilibrio de fases en sustancias puras. Equilibrio de fases. Cambios de estado y calor latente. Ecuación de Clapeyron. Presión de vapor. 1) La presión de vapor del líquido A es 6000 Pa a 460C; esta presión de vapor es 50 Pa más grande que Ia del sólido A a la misma temperatura. A 450C, la presión de vapor del liquido es 100 Pa mayor que la del sólido. ∆Hvap es 38 kJ/mol. a) Estimar el punto de fusión de A. b) Calcular el calor de fusión de A y su calor de sublimación. 2) El punto de fusión del CCl4 (P.M. 156 g/mol) es -220C. A esta temperatura la presión de vapor es 10 mm de Hg; los calores de fusión y vaporización son 0,650 y 7,20 kcal/mol, respectivamente; las densidades del liquido y del sólido son 1,63 y 1,80 g/cm, respectivamente. a) Trazar un diagrama de fases cualitativo para el CC14, en escala semilogarítmica; usando dos o tres puntos especificos como guía, indicar las regiones líquido, sólido y vapor. b) Calcular el calor de sublimación. c)Calcular el cambio en el punto de fusión por aplicación de una presión de 10 atm. NOTA: considerar que la presión de vapor en el punto triple es de 10 mm Hg. 3) El punto de fusión del ácido acético glacial es 160C a 1 atm. Calcular el punto de fusión bajo su propia presión de vapor (o sea casi cero de P aplicada). El calor de fusión es 2700 cal/mol, las densidades para el ácido acético líquido y sólido son 1.05 y 1.10 g/cm3, respectivamente y la masa molar es 60. El punto de ebullición normal del ácido acético es 118°C. Mostrar como estimar el calor de sublimación del ácido acético sólido (obtenga un resultado numérico). Haga uso de Ia correlación empirica conocida como regla de Trouton que indica que, para un grupo de solventes orgánicos, el cociente de la entalpia de vaporización y la temperatura de ebullición es: ∆Hvap/Tc = 21 cal/mol.K ó 88 J/mol.K. 4) ∆H es 0.07 kcal/mol para la transición S(rómbico) S(monoclínico). El azufre monoclínico está en equilibrio con la forma rómbica a 1 atm y 115°C y , a 100 atm, los dos coexisten a 1200C. Demostrar cuál de los dos polimorfos es más denso. COMPLEMENTARIOS 1.- La paracloroanilina tiene tiene un punto de fusión normal de 70°C. La presión de vapor a esa temperatura es de 5 Torr y, a 100°C, es de 20 Torr. El calor molar de fusión vale 4,7 Kcal/mol, Ia densidad del sólido a Ia temperatura de fusión es 1,45 g/czn3 y Ia densidad del líquido a Ia misma temperatura es 1,15 g/cm3. a) calcule el calor molar de vaporización y estime Ia temperatura normal de ebullición y el calor molar de sublimación. b) Indiquc si el punto de fusión a 100 atm será superior o inferior a 70°C. c) Suponiendo que Ia temperatura de fusión es igual a la del punto triple, calcule Ia temperatura a Ia cual Ia presion dc vapor del sólido es menor que 10-5 Torr. 2.- Debajo del punto triple (-56.2 ° C) la presión de vapor del CO2 (s) está dada por Ia siguiente expresión: ln P(atm) = 3116/T + 16,01 a) Calcular la presión del punto triple b) Calcular el calor molar de sublimación a –56,2°C c) Si el calor molar de fusión es 8330 J/mol, calcular la presión de vapor del CO2 a 25°C. 3.-Para el equilibrio Iíquido-vapor de una sustancia X se dispone de la siguiente información ln PV (atm) = 43,552 – 5622,7/T – 4,70504 ln T ∆HV (750C) = 31602 J/mol VV (750C) = 31,38 L/mol MX = 100 g/mol Calcular Ia densidad del líquido a 75°C. 4. Las densidades del plomo sólido y del plomo líquido a la temperatura normal de fusión (327°C) son, respectivamente: 10,94 y 10,65 g/cm3. Calcular Ia presión que debe aplicarse al Pb para aumentar su temperatura de fusión en 20°C. ∆HF = 4810 J/mol APb = 207 g/mol 5. La sustancia X presenta el siguiente diagrama de equilibrio de fases: P (mm Hg) T(K) 1) 100 350 2) 10 300 3) 5 298 a) Calcular ∆H y ∆S para los siguientes equilibrios, a 300 K: X(l) ↔ X(g) ; X(s) ↔ X(g) Suponer cPl = cPv = cPs. b) ¿Qué signo tendrá Vl – Vs? . Justificar P L S V T