el tinidazol induce roturas de simple cadena en leucocitos de ratón
Anuncio

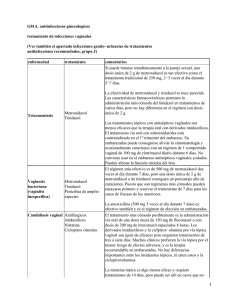
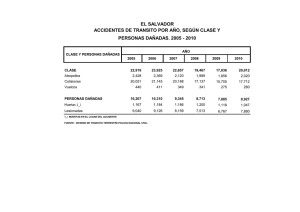
Anuario Toxicología 2001;1(1):57-64 Centro de Investigaciones Biomédicas. ICBP “Victoria de Girón” EL TINIDAZOL INDUCE ROTURAS DE SIMPLE CADENA EN LEUCOCITOS DE RATÓN Lic. Gisell Rodríguez Ferreiro,1 Lic. Lourdes Cancino Badías,2 Dr. Elio A. Prieto González2 y Dr. Javier Espinosa Aguirre2 RESUMEN: Se estudió la capacidad del tinidazol de inducir roturas de simple cadena y sitios sensibles al álcali en leucocitos de rratón, atón, por el ensa aciones de 1100, 00, 250 ensayyo cometa. In vitr vitroo concentr concentraciones g/mLL incrementan el porcentaje de células dañadas, describiendo una relación dosis y 500 µ g/m respuesta. Para observar este efecto no es necesaria la reducción del grupo nitro. A los 30 min de reparación el daño en los leucocitos se mantiene, mientras que a los 60 min sólo es reparado el daño producido por la mayor concentración. In vivo se pudo observar que una dosis de 100 mg/kg de peso es capaz de inducir daño en el ADN de los leucocitos de ratón. Este efecto es observado 24 y 48 h después del tratamiento con una dosis 3 veces superior a la dosis terapéutica. El tinidazol al igual que otros nitroimidazoles es capaz de inducir alteraciones cromosómicas. AZOL; TEST S DE MUT AD/métodos; ENS AY O COMET A/métodos; REP ADeCS: TINID TINIDAZOL; TESTS MUTA GENICIDAD/métodos; ENSA COMETA/métodos; REPA A GENICID CION DEL ADN; LEUCOCIT OS; RA TONES. RACION LEUCOCITOS; RAT RA La infección con bacterias es común en poblaciones humanas, fundamentalmente en los países del tercer mundo. Puede causar desnutrición y a más largo plazo cáncer. De los agentes antimicrobianos desarrollados y empleados en el tratamiento de estas afecciones se encuentran los nitroimidazoles.1,2 Entre ellos se destacan el metronidazol, el ornidazol y el tinidazol, con estructura similar y equivalentes en su actividad terapéutica y espectro antimicrobiano.3 El tinidazol (1-[2-(etil sulfonil) etil]-2metil-5 nitroimidazol) se aplica en infeccio- nes causadas por Trichomona vaginalis, Entamoeba histolítica y Giardia lamblia4 y en la profilaxis de infecciones perioperatorias de cirugías digestivas y ginecológicas.2 también se utiliza en infecciones causadas por Helicobacter pilori5 Éste antiinfeccioso después de ser metabolizado,6,7 interacciona con el ADN de la célula bacteriana y produce muerte celular.8 Su acción antiparasitaria radica en su rápida captación por el parásito, en la luz intestinal y en los tejidos, que conduce a la lisis de la estructura celular parasitaria.9 1 Departamento de Biología Molecular y Celular. Centro de Investigaciones Biomédicas. Instituto Superior de Ciencias Médicas de La Habana. 2 Departamento de Genética y Toxicología Ambiental. Instituto de Investigaciones Biomédicas. Universidad Autónoma de México. 57 En Cuba se utiliza el tinidazol en pacientes de todas las edades y en ocasiones se realiza su uso indiscriminado. Diferentes estudios han demostrado que este fármaco actúa como un mutágeno de sustitución de pares de bases 6,7 y a concentraciones elevadas induce corrimiento del marco de lectura.7 También, Leal-Garza y cols., en 1984 10 encontraron una inducción de micronúcleos en eritrocitos de ratones tratados con esta droga. Sin embargo, no existen muchos trabajos dirigidos al esclarecimiento de los mecanismos involucrados en estos efectos. Se ha investigado fundamentalmente el metronidazol como patrón de los nitroimidazoles.1,11 El ensayo Cometa consiste en el análisis de células individuales que son lisadas y se someten a una electroforesis, para así lograr que los fragmentos de cromosomas corran hacia el ánodo y se revelen como la cola de un cometa.12 Esta prueba se utiliza para la evaluación genotóxica de diferentes sustancias extrañas al organismo, monitoreo genético, animales centinelas y para determinar la capacidad de reparación del ADN ante el daño provocado por un xenobiótico. Es objetivo de este trabajo conocer la capacidad del tinidazol de inducir rupturas de simple cadena en leucocitos de ratón, utilizando el ensayo cometa. Además, se estudiará la capacidad reparativa de estas células in vitro y después de un tratamiento con una dosis 3 veces superior a la dosis terapéutica. (BDH); ciclofosfamida (Pras-Farma, S.A); agarosa de punto de fusión normal (APFN), agarosa de bajo punto de fusión (ABPF), NaOH, lauril sarcosinato de Na, DMSO, bromuro de etidio, tripan azul (Sigma); NaCl (Fluka); liquemine (Roche). Métodos Una dosis de 100 mg de tinidazol/kg de peso se inoculó por vía intraperitoneal, utilizando a cada animal como su propio control. La ciclofosfamida a una dosis de 100 mg/kg de peso fue el control positivo del experimento. La muestra de sangre se tomó a las 24 y 48 h después de la inoculación. Animales Ratones machos de la línea Balb/c con un peso corporal de 27 ± 3 g fueron utilizados en ambos experimentos. Se mantuvieron en condiciones controladas: ciclos de luz y oscuridad (12 x 12 h), agua y comida ad libitum. Esquema experimental IN VITRO 80 µ L de sangre del plexo orbital se ensayan con 3 concentraciones de tinidazol (100, 250 y 500 µ g/mL). Las muestras se incubaron durante 30 min, a 37 °C y posteriormente se centrifugaron a 15 000 rpm, durante 10 seg. Las células reconstituidas con 80 mL de PBS se utilizaron en el ensayo. Para medir la reparación, la suspensión celular fue incubada a 37 °C, durante 30 y 60 min. Se utilizó el peróxido de hidrógeno (350 mM) como control positivo. IN VIVO Reactivos PBS (libre de Ca2+ y Mg2+), EDTA, Tris, Tritón X-100, peróxido de hidrógeno 58 Ensayo cometa Procesamiento estadístico 10 µ L de la suspensión celular y 75 mL de ABPF (0,5 %) se extendieron en láminas portaobjetos, previamente preparadas con 150 µ L de APFN (0,5 %).12 Se añadió la tercera capa de ABPF (75 µ L) y las láminas fueron sumergidas durante 1 h a 4 °C, en solución de lisis (2,5 M NaCl, 100 mM EDTA, 10 mM tris, lauril sarcosinato de Na al 1 %, pH 10; tritón X 100 al 1 %, DMSO al 10 %). El desenrollamiento se realizó a 4 °C, durante 20 min (300 mM de NaOH, 1 mM EDTA, pH 12,6) y se corrió la electroforesis a 25 V y 250 mA, durante 30 min. Se realizaron 3 lavados con amortiguador de neutralización (0,4 M Tris, pH 7,5) y los núcleos se tiñeron con bromuro de etidio (20 ug/mL). Se utilizó un microscopio de fluorescencia (zeiss) con objetivo 40 x /0,65 seco, filtro de excitación 515-560 nm y filtro barrera 590 nm. Se analizaron 200 células por tratamiento y se expresó el daño al ADN como los porcentajes de células dañadas y en cada nivel de daño. Se consideraron células no dañadas aquellas que no tenían cola y para los niveles de daño se consideraron 5 categorías arbitrarias: nivel 0, no migración del material genómico; nivel 1, migración corta; nivel 2, migración media; nivel 3, migración larga y como nivel 4, al núcleo no definido. Ambos parámetros se expresaron como el número de células con colas entre el total de células analizadas multiplicado por 100. La viabilidad celular se midió utilizando la técnica de exclusión con tripan azul, considerando como un efecto citotóxico marcado cuando se afecta la viabilidad celular por encima de un 10 %. Los grupos fueron comparados entre sí por la prueba t de Student, para un 95 y un 99 % de significación, utilizando el paquete estadístico MICROSTAT. Resultados y discusión Ensayo Cometa in vitro Los nitrocompuestos junto a los hidrocarburos policíclicos aromáticos y aminas aromáticas son reconocidos como importantes carcinógenos del medio ambiente y las alteraciones estructurales del ADN se relacionan con los eventos de iniciación del cáncer.13 El tinidazol indujo la formación de roturas de cadenas a las concentraciones ensayadas, se encontró un aumento significativo del daño relacionado con la dosis, que se observa con el incremento del porcentaje de células dañadas (fig. 1.) Akintowa y cols. en 1988,14 reportaron que la concentración de 500 mg/mL es tóxica, sin embargo estos resultados no están relacionados con efectos citotóxicos del compuesto, como se demostró en el ensayo con tripan azul. Porcentaje células dañadas 120 90 60 30 0 0 100 250 Tinidazol (ug/ml) 500 30 min FIG. 1. Efecto genotóxico del tinidazol en leucocitos a los 30 min de exposición (media de 2 experimentos, p < 0,05). 59 Al igual que para el metronidazol,3 la formación de un metabolito hidroxilado por la acción de nitrorreductasas de bacterias y mamíferos, potencia la actividad mutagénica de la molécula parental.6,7 Sin embargo, el tinidazol a altas concentraciones induce sustituciones de pares de bases en ausencia de activación metabólica, en el ensayo de Ames.7 Estos resultados demuestran que este fármaco no necesita de activación metabólica para generar rupturas de simple cadena en leucocitos de ratón, porque aunque en los linfocitos se expresan algunas enzimas que participan en el metabolismo de xenobióticos, ellos sólo representan del 20 al 30 % de la población total. Igualmente el metronidazol y el dimetridazol, 2 medicamentos que pertenecen a la misma familia y con estructura similar al tinidazol, inducen roturas de simple cadena, en linfocitos humanos en ausencia de la fracción S9, en condiciones aerobias.1 La toxicidad obtenida en estas condiciones parece estar relacionada con la reducción de un electrón de la molécula parental y la producción de un radical nitro, que en presencia de oxígeno es reoxidado y genera especies reactivas,1 como ya fue demostrado para el 1-metil-2-nitroimidazol.15 El porcentaje de células en cada nivel de daño es un método semicuantitativo indicativo de la cantidad de ADN migrado y por consiguiente de la extensión del daño. Este es el parámetro más descriptivo, sólo superado por los procedimientos basados en el procesamiento digital de la imagen,12 100 y 250 µ g/mL de tinidazol muestran un incremento significativo del porcentaje de células con migración media, con respecto al control (fig. 2). La mayor concentración indujo un aumento significativo de células con migración corta, los que se corresponden con una disminución significativa de células sin migración del ADN para todas las concentraciones estudiadas, confirmando los resultados obtenidos para el porcentaje de células dañadas. En las concentraciones no se observó un incremento significativo del porcentaje de células con migración larga y migración completa, lo que representa un mayor daño al ADN. Sin embargo, en el ensayo alcalino la cola del cometa es creada por lazos relajados del ADN, el número de lazos en la cola indica el número de roturas, con el incremento del daño la intensidad de la cola se incrementa, por lo que existen agentes con alta actividad genotóxica que producen colas cortas y densas.12 La longitud de la cola está directamente relacionada con el tamaño de los fragmentos y se pudiera suponer que es proporcional a la extensión del daño en el ADN, pero no representa exactamente el número de rupturas en el ADN, sino depende del desenrollamiento de la hebra.16 Reparación Se puede definir la reparación como un conjunto de respuestas celulares asociadas con la restauración del ADN. Daños en algunos genes que participan en la repa- Porcentaje de células 90 60 30 0 0 Control 1 2 3 Niveles de daño T 100 T 250 4 T 500 FIG. 2. Porcentaje de células en cada nivel de daño a los 30 min de exposición (media de 2 experimentos, p < 0,05). 60 100 Porcentaje de células 80 60 40 20 0 0 1 2 3 Niveles de daño T 100 T 250 Control 4 T 500 FIG. 3. Ensayo cometa in vitro. Porcentaje reparación ( T: concentraciones de tinidazol en µg/mL). 80 60 Porcentaje de células ración han sido asociados a ciertas enfermedades. 17 Durante la reparación por escisión de bases y nucleótidos se generan rupturas, que pueden ser también causa de la migración del ADN en el ensayo cometa.12 Después de 30 min no ha sido reparado el daño generado por el tinidazol, para las concentraciones del ensayo (fig. 3). Se observaron incrementos significativos del porcentaje de células dañadas, este aumento de la cantidad de células en el nivel 1 (migración corta) se corresponde con una disminución significativa en el nivel 0. A los 60 min, no existen diferencias significativas con respecto al control para el porcentaje de células no dañadas y en los diferentes niveles de daño solo para 500 µ g/mL (fig. 4). En las concentraciones de 100 y 250 µ g/mL la cantidad de células sin cola es men o r significativamente del control (P = 7,14 . 10-4 y P = 0,034, respectivamente) y se observó un aumento significativo de células en el nivel 1 (P = 6,44 × 10 4 y P = 0,0456, respectivamente. Sólo a 250 µ g/ mL se encuentran diferencias significativas con respecto al control por un incremento de células en el nivel 2 (P = 0,0468). Los resultados sugieren la necesidad de un tiempo mayor para que el daño inducido por este principio activo sea completamente reparado, aunque otros mecanismos median para que a la mayor concentración se haya reparado el daño completamente a los 60 min. Dependiendo de la concentración del xenobiótico y la magnitud del daño, funcionan uno o más mecanismos de reparación, algunos de los cuales se expresan constitutivamente, mientras otros son inducidos.17 Cuando se compromete la vida de la célula, se dispara el mecanismo de reparación SOS y los fragmentos son reparados aunque se pierda la fidelidad de la secuencia original. El tinidazol induce diferentes tipos de daños relacionados con la dosis, 6,7,10 por lo que la inducción de diferentes mecanismos de reparación, dependiendo de la concentración, puede explicar estos resultados. 40 20 0 0 1 2 3 4 Niveles de daño Control T 100 T 250 T 500 FIG. 4 Ensayo cometa in vitro. Porcentaje de células en cada nivel de daño a los 60 min de reparación. (T: concentraciones de tinidazol en µg7mL). 61 Ensayo cometa in vivo tras que antes del tratamiento el mayor porcentaje de células se encontró en la categoría de no migración. A diferencia del estudio in vitro, el tinidazol in vivo indujo la formación de colas largas (nivel 3). La formación de un metabolito hidroxilado que potencia la actividad mutagénica del tinidazol, 6 , 7 puede también ser la causa de un daño mayor en los leucocitos de ratones tratados con el fármaco. A las 48 h después del tratamiento se observaron diferencias solamente para los niveles 0 y 1, con respecto a los datos obtenidos antes del tratamiento. Se puede pensar que hay una recuperación del daño, aunque no completamente. Una aplicación muy útil que tiene este ensayo es en el área de la genética toxicológica para evaluar los efectos genotóxicos in vitro o in vivo de sustancias químicas.12 Se observaron incrementos significativos después del tratamiento con tinidazol a los diferentes tiempos de muestreo (tablas 1 y 2). Se observaron diferencias significativas con respecto al control para los niveles 0, 1, 2 y 3, 24 h, después del tratamiento (tabla 1). La mayor cantidad de células se encuentra con migración corta, media y larga, mien- TABLA 1. Porcentajes de células no dañadas y dañadas para el tratamiento con tinidazol (100 mg/kg). Ensayo Cometa in vivo Muestreo Animales no dañadas 0 horas dañadas 1 2 3 4 5 X ± ES 43 ,37 73,07 61,54 69,31 58,33 62,13 ± 4,3 51,63 26,92 38,46 30,69 41,67 37,88 ± 4,3 24 horas no dañadas dañadas 25,03 7,92 22 17,31 38,32 22,12 ± 4,9** 77,88 48 horas no dañadas dañadas 74,96 92,07 78 82,69 61,68 ± 3,4 ** 39,15 43,53 45,07 44,44 27 35,71 ± 3,4 * 60,85 56,46 54,92 55,56 73 64,29 ± 3,4 * p = 0,05*; p = 0,01** (X ± ES): media ± error estándar de la media. TABLA 2. Tinidazol (100 mg/kg): porcentaje de células en cada nivel de daño a los diferentes tiempos de muestreo, ensayo Cometa in vivo Muestreo Animales 0 horas 1 2 3 4 5 X ± ES 1 2 3 4 5 X ± ES 1 2 3 4 5 X ± ES 24 horas 48 horas Nivel 0 Nivel 1 48,37 43,32 73,07 26,92 61,54 15,38 69,31 14,96 58,33 29317 62,13 ± 4,3 25,95 ± 5,2 25,03 51,66 7,92 55,1 22 38 17,31 62,69 38,32 50,36 22,12 ± 4,9** 51,57 ± 4,0** 43,53 44,39 45,07 48,92 44,44 51,85 27 64,33 35,71 51,9 * 39,15 ± 3,5 52,28 ± 2,3** p = 0,05*; p = 0,01** (X ± ES): media ± error estándar de la media. 62 Nivel 2 Nivel 3 Nivel 4 7,7 0 0 0 0 0 15,38 0 7,69 9,17 0 7,45 12,50 0 0 8,95 ± 2,6 0 3,03± 1,85 12,45 10,85 0 29,23 7,69 0 22 18 0 19,23 5,77 0 7,48 3,85 0 ** 18,08 ± 3,8 9,23 ± 2,5 0 3,45 1,72 6,9 6 0 0 3,7 0 0 8,66 0 0 10,53 0 1,85 6,47 ± 1,4 0,34 ± 0,3 1,75 ± 1,3 En estos resultados se observa que el tinidazol es capaz de dañar el ADN a nivel de los cromosomas, a dosis 3 veces mayor que la dosis terapéutica (2 g x día), aunque ya a dosis de 50 mg/kg de peso se induce la formación de micronúcleos en ratones.10 Sin embargo, no se puede concluir que este efecto sería similar en humanos, ya que para el metronidazol un medicamento similar a éste, existen resultados aún contradictorios. Se ha demostrado que este fármaco produce anafases anormales en células CHO, alteraciones cromosómicas en linfocitos e induce la formación de micronúcleos.18 También, Re y cols., en 19971, demostraron su capacidad de inducir rupturas de cadenas in vitro y la inducción de carcinogénesis en roedores,19 pero Fahrig y Engelke, en 199811 no encontraron inducción de alteraciones cromosómicas en pacientes tratados con la droga. Estudios de la actividad genotóxica del dimetridazol, revelan que este compuesto químico produce sustituciones de pares de bases en Salmonella typhimurium 3 y rupturas de cadenas en linfocitos humanos,1 pero estos hallazgos no han sido comprobados in vivo. que incluyen: reparación por escisión de bases y nucleótidos, roturas producidas por el ataque de un compuesto químico o radiaciones, escisión seguida de la unión de agentes intercalantes, aductos del ADN, acción de las endonucleasas o topoisomerasas y la acción de hidrolasas.20 El ensayo cometa reveló que el tinidazol induce roturas de simple cadena en leucocitos de ratón, in vitro e in vivo, pero no se ha estudiado cuál de estos mecanismos puede ser el responsable del efecto clastogénico de esta droga . Otros estudios deben ser objetivo de investigaciones futuras, en las que se esclarezcan la contribución del metabolito hidroxilado en esta actividad, la relevancia de enzimas antioxidantes, la contribución de las roturas inducidas por los mecanismos de reparación y cómo se comporta este efecto en células humanas. Agradecimientos Al Centro de Inmunología Molecular, por permitirnos el uso de equipamiento indispensable para realizar el estudio y a la Lic. Aida Leiva González por sus valiosos comentarios. Conclusiones Las rupturas de simple cadena son el resultado de diferentes tipos de reacciones SUMMARY: The capacity of tinidazole to induce single strand breaks and sites sensitive to alk ali in mouse leucoc ytes w as studied bbyy using the comet assa ations alkali leucocytes was assayy. In vitr vitroo concentr concentrations of 100, 250 and 500 mg/m mg/mLL increase the percentage of damaged cells, describing a doseresponse rrelationship. elationship. TToo observ eduction of the nitr oobservee this effect, it is not necessary the rreduction nitrogr oup. 30 minutes after the rrepair epair oc ytes is still pr esent, wher eas at 60 group. epair,, the damage of the leuk leukoc ocytes present, whereas min, only the damage produced by the highest concentration is repaired. It was possible to observe in vivo that a dose of 100 mg/kg of weight may induce damage in the DNA of the mouse leucocytes. This effect is observed 24 and 48 h after the treatment with a dose three times that of the therapeutic dose. Tinidazole as other nitroimidazoles is able to induce chromosomal alterations. AGENICITY TEST S/methods; COMET ASS AY/methods; DNA Subject headings: TINID TINIDAZOLE; MUTA TESTS/methods; ASSA AZOLE; MUT AIR; LEUK OC YTES; MICE. REPAIR; LEUKOC OCYTES; REP 63 Referencias bibliográficas 12. 1. Re JL, De Méo MP, Lagel M, Gulraad H, Castegnare M, Vanelle P, Dument G. Evaluation of the genotoxic activity of metronidazole and dimetridazole in human lymphocytes by the Comet assay. Mutation Research 1997;375(2):147-55. 2. Brismar B, Edlund C, Malmborg A, Nord N. Ecological impact of antimicrobial prophylaxis on intestinal microflora in patients undergoing colorectal surgery. Scand Journal Infection Diseases 1990;70:25-30. 3. De Méo M, Laget M, Castegnaro M, Dumenil G. Genotoxic activity of potassium permanganate in acidic solution. Mutation Research 1991;260:295-306. 4. Saurina G, De Méo L, McComack WM. Cure of metronidazole and tinidazole resistant. Trichomoniasis with use of high dose oral and intravaginal tinidazole. Clinical Infection Disease 1998;26(5):1238-9. 5. Oderda J, Ponzetto A, Boero M, Bellis D, Forni M, Vaira D, Ansaldi N. Family treatment of symptomatic children with Helicobacter pylori infection. Ital J. Gastroenterol Hepatol 1997;29(6):509-14. 6. Gupta RL, Vats V, Juneja TR. Activation of tinidazole, analogous antiprotozoal drug to a mutagen by mammalian liver S9. Mutation Research 1996;370:195-201. 7. Espinosa JJ, Torre RA, Lares I, Rubio J, Dorado V, Wong M, Hernández JJ. Bacterial mutagens in the urine of patients under tinidazole treatment. Mutation Research 1996;359:133-40. 8. Kedderis GL, Argenbright LS, Miwa GL. Covalent interaction of 5-nitroimidazoles with DNA and protein in vitro: Mechanism of reductive activation. Chemical Research Toxicology 1989;2:146-49. 9. DEF: Diccionario de Especialidades Farmacéuticas (1992). Edición 38ª, p. 1209. 10. Leal Garza C, Montes De Oca R, Baca S, Garza-Chapa R. Tinidazole and emetine cytogenetic effects evaluated by the micronucleus test in mice. Arch Invest Med 1984;15:311-6. 11. Fahirig R, Engelke M. Reinvestigation of in vivo genotoxicity studies in man: 1. No induction of DNA strand breaks in peripheral 13. 14. 15. 16. 17. 18. 19. 20. lymphocytes after metronidazole therapy. Mutation Research 1997,395(2,3):215-21. Tice R. The single cell gel/Comet assay: a microgel electrophoretic technique for detection of DNA damage and repair in individual cells. In: Phillips D.H., Venitt, S. (eds): “Environmental Mutagenesis”. Oxford, U.K.: Bios., p. 1315-39, 1995. Klauning JE, Xu Y, Isenberg JS, Bachowski S, Kolaja KL, Jiang J, et al. The role of oxidative stress in Chemical Carcinogenesis. Environmental Health Perspectives 1998;106(1):289-95. Akintonwa A, Orissakwe O. The adsorption of metronidazole and tinidazole to actived charcoal and effect of magnesium sulfate. Vet Human Toxicology 1988;30(6):556-8. Brezden CB, Horn L, McClelland RA, Rauth AM. Oxidative stress and 1-methyl-2nitroimidazole cytotoxicity. Biochemical Pharmacology 1998;56(3):335-44. Olive PL. DNA damage and repair in individual cells: applications of the comet assay in radiobiology. Int Journal Radiat Biol 1999;75(4):395-405. Yu Z, Chen J, Ford BN, Brackley ME, Glickman BW. Human DNA Repair Systems: An Overview. Environmental and Molecular Mutagenesis 1999;33:3-20. Mudry M, Carballo M, Labal de Vinuesa M, González M, Larripa I. Mutagenic bioassay of certain pharmacological drugs: III. Metronidazole (MTZ). Mutation Research 1994;305:127-31. Dobia L, Cerna M, Rossner P, Sram R. Genotoxicity and Carcinogenicity of Metronidazole. Mutation Research 1994;317(3):177-94. Horváthová, E, Slamenová, D, Hlincikková, L, Kumar, T, Gaveloba, A, Collins, A. The nature and origen of DNA single strand breaks determined with the comet assay. Mutation Research 1998;409:163-71. Recibido: 29 de mayo del 2001. Aprobado: 30 de junio del 2001. Lic. Gisell Rodríguez Ferreiro. Centro de Investigaciones Biomédicas ISCM-H. Ave. 146 esquina a 31, Playa, Ciudad de La Habana, Cuba. 64