aspectos moleculares y celulares de la metastasis
Anuncio

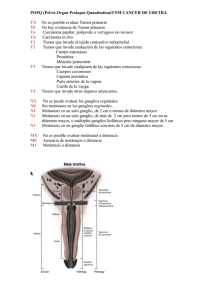
REVISION (Biología Celular) Acta Científica Venezolana, 52: 304–312, 2001 ASPECTOS MOLECULARES Y CELULARES DE LA METASTASIS CANCEROSA Francisco Arvelo y Marie-France Poupon Laboratorio de Cultivo de Tejidos y Biología de Tumores, Instituto de Biología Experimental, Facultad de Ciencias, U.C.V., Apartado 47114, Caracas- Venezuela, 1041-A. 2 Laboratorio de Citogenética Molecular y Oncología, Instituto Curie, 26 rue d’Ulm, 75005, Paris- France 1 Recibido: 11/09/01; Revisado: 11/10/01; Aceptado: 31/10/01 RESUMEN: La diseminación metastásica es un proceso que conduce a las células del tumor primario tanto a migrar e infiltrar tejidos vecinos como formar focos tumorales secundarios a distancia. Esta evolución clínica, que se expresa como consecuencia de la historia natural del cáncer, es consecuencia de la aparición de nuevas potencialidades en las células tumorales, confiriéndole a un pequeño número de ellas un potencial invasivo y metastásico. Esta diseminación es posible por múltiples factores entre los que destacan la perdida de cohesión entre las células del tejido tumoral, formación de nuevos vasos sanguíneos, resistencia a la “anoïkis” y la posterior implantación de células tumorales en un sitio heterotípico. La alteración de los sistemas celulares de cohesión, síntesis de enzimas proteolíticas, motilidad celular, modificación de señales inducidas por factores de crecimiento y/o los sustratos de adhesión ambientales y la ausencia de reconocimiento inmunitario por el sistema inmunológico, contribuyen a la formación de metástasis. Un medio ambiente o “ecosistema permisivo” es necesario para la implantación de las células tumorales en órganos blanco tales como hígado, pulmón y medula ósea; este ambiente especial, que favorece la metástasis, suministra un estroma, sistemas adhesivos, factores de crecimiento y vascularización. Es importante señalar que la adquisición de la capacidad metastásica es precedida de cambios genéticos que hacen posible la adaptación de las células malignas a un nuevo microambiente. Palabras clave: Metástasis, infiltración, ecosystem, adhesión intercelular, anoïkis, angiogénesis, proteasas, motilidad, invasividad, factores de crecimiento. MOLECULAR AND CELULAR ASPECTS OF THE CANCER METASTASIS ABSTRACT: The metastasic dissemination is a process which leads to a primary tumor cells to migrate, infiltrate host tissues and form a secondary tumor focus at distance. This clinic evolution is a consequence of the cancer natural history and is due to the appeareance of new potentialities in tumoral cells, providing to a small quantity of them an invasive and metastatic capability. This dissemination is possible by many factors; among them the lack of cohesion in tumor tissue cells, forming new blood vessels, resistence to anoikis and posterior implantation of tumoral cells in a heterotypic site. The change of cohesion in cell systems, synthesis of proteolytic enzymes, cell motility, modification of signals induced by growth factors, or the substratum for environment adhesion, and lack immune recognition by the immunologic system, are the main contributors to the appeareance of metastasis. A permissive ecosystem is necessary to implant tumoral cells in target organs such as : liver, lung and bone marrow. This special environment, which is more favorable to metastasis, supplies an stroma, adhesive systems, growth factors and neo-vascularization. It is important to point out that the development of a metastasis is preceded by some genetic changes which make possible the adaptation of malign cells to a new microenvironment. Key Words: Metastasis, infiltration, ecosystem, intercellular adhesion, anoikis, angiogenesis, proteases, motility, invasiveness, growth factors. INTRODUCCION La metástasis se puede definir como la capacidad que tienen las células malignas de abandonar el tumor primario, migrar e implantarse en los tejidos de un órgano a distancia, proliferando y formando nuevos focos tumorales. La diseminación metastásica está asociada a la infiltración o invasividad tisular local de las células tumorales, caracterizada por su propiedad de penetrar e invadir el tejido normal vecino al tumor; aun cuando es propia de los tumores malignos, ciertas células normales poseen capacidad de abandonar su tejido de origen42 , como puede observarse en el embrión en el curso de la migración de las células hacia el timo, y en los adultos luego de una reacción inmunitaria, donde se manifiesta una migración y proliferación de células linfocíticas en los ganglios. Sin embargo, estos eventos que conducen a la proliferación de células normales en sitios particulares, obedecen señales de control de la proliferación, vinculados la mayoría de las veces a la diferenciación o al fenómeno de la apoptosis, mientras que las células malignas escapan a estos controles, proliferan- do en los órganos blanco y formando focos secundarios que frecuentemente son múltiples. HISTORIA CLINICA, MICROMETASTASIS, METASTASIS Y PROGRESION TUMORAL La diseminación metastásica es un evento clave en la historia natural del cáncer, ya que ella transforma una enfermedad circunscrita y potencialmente curable por un tratamiento local, en una enfermedad generalizada cuyo tratamiento es sistémico. En la historia de un cáncer se pueden describir tres fases (Figura 1) : a) La fase de crecimiento local, caracterizada por la transformación de una o varias células de un tejido a partir de la selección de un clon que origina el tumor primario. Aquí la noción de clon es relativa, ya que en el momento de la detección, el tumor es heterogéneo por numerosos caracteres, sin descartar que sea posible encontrar elementos genéticos que prueben el origen común de las células; b) una segunda fase, constituida por la diseminación micrometastásica o migra- 305 Aspectos de la metástasis cancerosa ción de células tumorales aisladas o en pequeños grupos, originadas del tumor primario, que pueden permanecer latentes o proliferar y formar metástasis de inmediato, a mediano o corto plazo. La característica de esta fase es la de presentar la dificultad para descubrir las células tumorales aisladas o en micro grupos en órganos que no son siempre los blancos de metástasis, como es el caso de la médula ósea en el cáncer de colon; c) una tercera fase, caracterizada por la proliferación de células tumorales en órganos distantes del tumor primario. Las células tumorales de un foco metastásico pueden migrar y formar nuevos, constituyendo una cascada metastásica; estos focos secundarios son formados a partir de células tumorales que hacen suponer que son particulares, ya que han sufrido una fuerte selección, en la que su velocidad de proliferación puede ser diferente a la del tumor primario. Así la proliferación puede ser lenta, ya que los nuevos focos aparecen después de un determinado tiempo de latencia que permite una evolución genética diferente a la del tumor primario; el crecimiento puede ser rápido y la velocidad de proliferación puede ser tal que lleve a la muerte del paciente en poco tiempo, sin dar tiempo a que el tumor primario alcance un tamaño que se pueda detectar o incluso que pueda haber desaparecido, lo que puede llamarse metástasis sin punto de partida conocido. La diseminación metastásica ocurre esencialmente por dos vías: la sanguínea y la linfática, habiendo preferencias por una u otra vía de acuerdo al órgano y tejido donde se origina el tumor primario. Punto a considerar es la distancia entre los ganglios invadidos y el tumor primario, que distingue clínicamente diferentes potenciales evolutivos en ciertos tipos de cáncer, pero sin dejar de considerar, desde un punto de vista biológico, que la invasión a un ganglio proximal es una metástasis. MULTIPLICIDAD DE LOS DETERMINANTES MOLECULARES IMPLICADOS EN EL PROCESO METASTÁSICO El proceso metastásico se desarrolla como se muestra en la Figura 2, donde consideramos: 1. Perdida de Cohesión Intercelular Un tumor sólido primario está constituido de células cohesivas, por lo que la perdida de adhesión intercelular es una etapa necesaria para el proceso de migración celular. La adhesión celular está asegurada por estructuras complejas tales como los desmosomas y/o determinantes moleculares, entre los que destaca la E-cadherina, del tejido epitelial, siendo el prototipo de los sistemas adhesivos intercelulares56 . Esta es una molécula de transmembrana, que en presencia de calcio, se une a una estructura idéntica presente en la célula vecina; se ha demostrado que la perdida de función adhesiva esta asociada al potencial metastásico en numerosos tipos de cáncer33;46;55;2 y ello está ligada a diferentes alteraciones como lo es una mutación, disminución o perdida de expresión y la alteración de la interacción cadherina/catenina. En efecto, la parte intracitoplamática de la E-cadherina hace parte de un complejo catenina asociando las subunidades y y la proteína APC, responsable de la poliposis familiar y estando mutada en numerosos cánceres de colon48 . Las alteraciones cualitativas y cuantitativas de estas moléculas ocasionan indirectamente una perdida de función de la E-cadherina, lo cual es observado en muchos tumores agresivos; por otra parte, la E-cadherina es considerada como un supresor de la metástasis36;37 e igualmente forma parte de una familia de moléculas, las moléculas de adhesión celular o CAM (Cell Adhesión Molecules)6 . 2. Síntesis de Enzimas Proteolíticas La liberación de las células tumorales no está solamente relacionada a la perdida de conexiones intercelulares, sino también a la síntesis de enzimas líticas, que por un efecto de degradación del ambiente celular contribuye al desprendimiento de las células metastásicas. Numerosas enzimas han sido identificadas y están relacionadas al potencial metastásico de las células tumorales (figura 3) , muchas de las cuales son sintetizadas por las células tumorales, tales como las metaloproteasas MMP, (figura 4) , las catepsinas y las glicosilasas. Las MMP tienen en común un núcleo de Zinc (Zn) , el cual corresponde a un sitio catalítico responsable de su función enzimático y una extremidad “pro” que permite la transición bajo una señal catalítica de una pro-enzima no activa en enzima activa. Otros tipos de enzima son sintetizadas por las células normales del hospedador bajo la influencia de las células tumorales, tales como estromelisina-3 y la urokinasa4;14 . Cultivos de fibroblastos y células epiteliales de carcinomas mamarios han permitido identificar varios factores solubles capaces de estimular la producción de la colagenasa-3; de éstos, la interleukina-1 y el factor de crecimiento TGF , una vez sintezados y secretados por las células epiteliales tumorales, inducen la expresión de la colagenasa-3 en las células estromales adyacentes al tumor58 . Estas enzimas liberadas al medio extracelular se acoplan a receptores presentes en las células tumorales invasivas y esta unión desencadena la reacción de lisis. Por ejemplo, el sitio receptor de la MMP2 es una integrina 3, en el cual el fragmento terminal PEX de la MMP2, desprovisto de sitio catalítico, bloquea esta reacción, como se muestra en la Figura 5; estas interacciones están implicadas en la migración de las células endoteliales en el curso de la angiogénesis.9 Las enzimas señaladas son relativamente especificas de un sustrato determinado, como lo es por ejemplo la colagenasa, que degrada específicamente el colágeno, pero su activación genera la activación de otras enzimas en el punto de contacto de la lisis, lo que constituye un proceso de lisis en cascada. Algunas MMP pueden regular la formación de nuevos vasos escindiendo el plasminógeno y generando angiostatina, un potente inhibidor de la angiogénesis, por lo que se origina un efecto inhibidor de la 306 metástasis43 ; igualmente, ellas están implicadas en el crecimiento de las células metastásicas. Los inhibidores de las proteasas desempeñan una función esencial en la regulación de la actividad proteolítica, siendo producidas por el organismo hospedador o por la misma célula tumoral, siendo capaces de bloquear su acción, por lo que pudiesen funcionar como proteínas supresoras de la metástasis. La importancia de los inhibidores de proteasas que impiden la progresión d los tumores malignos ha sido apreciada por la propia naturaleza al dotar a los organismos de una amplia batería de inhibidores endógenos. Hay que señalar que existen inhibidores específicos de las distintas subfamilias de proteasas, como las serpinas, que bloquean la actividad de la serín-proteasa; cistatinas que actúan sobre la cistein-proteasas; los TIMP (Tissue Inhibitors of Metalloproteinases) , inhibidores de las metaloproteasas, habiéndose observado que su adición a cultivo de células de melanomas o fibrosarcomas bloquea la capacidad invasiva de estas células, tanto en sistemas in vitro como in vivo62 . También se ha demostrado que la sobre-expresión de estos inhibidores en fibroblastos transformados por el oncogén ras, reduce la velocidad de crecimiento de los tumores e inhibe su capacidad invasiva.3 . Se ha postulado que los TIMPs podrían ser definidos como genes supresores tumorales: primero por su acción inhibitoria directa sobre las metaloproteinasas activas; y segundo en forma indirecta, debido a las consecuencias del microambiente celular alterado: Dentro de un modelo estocástico, la disminución de los niveles de TIMP-1 no solo iniciaría la oncogénesis, sino también predispondría a la célula a cambios posteriores en la expresión génica conducentes a la progresión tumoral27 . De gran interés es la capacidad de degradación enzimática que depende de un equilibrio entre las enzimas proteolíticas y sus inhibidores, por lo cual la cuantificación o detección de enzimas e inhibidores podrían servir de marcadores de pronóstico de malignidad y la base para futuros desarrollos terapéuticos. 3. Migración y Motilidad Numerosas células, entre ellas las tumorales, están dotadas de motilidad, poseyendo factores que estimulan esta propiedad, tal como lo es el factor autocrino de motilidad o factor “scatter”51 , que fue aislado a partir de células en cultivo y presenta la propiedad de favorecer la dispersión, acoplándose a un receptor de membrana que es el mismo producido por el oncogén Cmet. Otro factor importante es el de necrosis tumoral (TNF) , el cual actúa también como factor de motilidad de las células tumorales e interacciona con un receptor específico. Destaca el factor de crecimiento de fibroblastos (FGF) , sintetizado por numerosos tipos celulares -entre ellas las células endoteliales-, presentando efecto “scatter”, movilizando las células y haciéndolas invasivas31 . La migración de las células es un fenómeno complejo en el cual se necesita la intervención de moléculas de adhesión, tal como lo es la 5; también de factores de de- Arvelo y Poupon gradación, como el activador del plasminógeno63 . Aquí es importante destacar que fragmentos de la matriz extracelular, liberados de la degradación enzimática del estroma, estimulan la motilidad celular50;8 4. Células Metastásicas Circulantes La presencia en la circulación sanguínea o linfática de células tumorales ha sido demostrado, siendo un fenómeno posible en la medida que el tumor primario desarrolle una neo-angiogénesis17;41;60 . Las células tumorales producen factores angiogénicos que tienen la capacidad de inducir nuevos vasos sanguíneos, destacando el melanoma, que ilustra perfectamente esta etapa y en la cual su pronóstico depende del tamaño del tumor primario, ya que con un diámetro inferior a 0.76 mm son avasculares y no metastáticos, mientras un diámetro superior a 0.9 mm ya presenta neo-vascularización y la posibilidad de estar asociado a la metástasis es muy alta. Estas observaciones se extienden a otros tumores, tales como el carcinoma in situ de vejiga, riñón y cuello de útero, que permanecen avasculares y de diámetro pequeño durante muchos años. El aumento de crecimiento determina la invasión local y diseminación metastásica, que caracteriza a la etapa maligna; siendo por ello que en carcinomas avanzados es concomitante a la aparición de micrometástasis. Esto hace pensar que el fenómeno de latencia de ciertas metástasis, algunas veces silenciosas durante años, son explicadas por su incapacidad de promover la angiogénesis, aparte de que las células tumorales circulantes presentan una viabilidad y una capacidad de proliferación frecuentemente limitada. El proceso de angiogénesis tumoral es producto de un equilibrio entre la elaboración de varios polipéptidos con acción angiogénica por parte de las células normales y tumorales. Al igual que otras células normales embrionarias y adultas, las células endoteliales realizan fenómenos activos de remodelación de matrices tisulares para crear nuevos vasos sanguíneos. Esta remodelación suele acompañar a aquellas que efectuan las propias células cancerosas durante la invasión tumoral e intravasión. Los nuevos capilares en proliferación tienen membranas basales fragmentadas y son porosos, lo que permite la penetración de las células tumorales con más facilidad que en los vasos maduros. Diversos productos proteicos inducen el crecimiento de las células endoteliales en el seno de una masa neoplásica. El más estudiado de los factores angiogénicos y el que genera la respuesta más prominente es una variante del factor de crecimiento fibroblástico, el bFGF (basic fibroblast growth factor) . Otras moléculas, como EGF (epidermal growth factor) , TGFa (transforming growth factor-) , HGF (hepatocyte growth factor) , PDGF (platelet-derived growth factor) , factor VIII de la coagulación , Interleuquina 4 y VEGF (vascular endotelial growth factor) 18;66;28 Por otra parte es necesario considerar que si las células están adaptadas a un crecimiento en contacto con un sustrato, ellas no crecen en suspensión y su sobrevivencia depende de la capacidad de resistir a las agresiones 307 Aspectos de la metástasis cancerosa mecánicas, como choques debido a la presión sanguínea, elongación y fricción en los capilares sanguíneos. Weiss61 demostró que solo una fracción de células tumorales sobrevive a este tipo de condiciones y que estas células resistentes muestran un elevado potencial metastásico. Aquí resalta que la agregación plaquetaria es aprovechada por las células tumorales tanto para protegerse de las agresiones mecánicas como el adherirse a las paredes de los vasos sanguíneos, además de protegerse de la toxicidad de los linfocitos NK. Estos últimos pueden lisar las células tumorales reconociéndolas como anormales, per se y estar anormalmente presentes en el compartimiento sanguíneo, pensándose que las células metastásicas son por tanto sensibles a la toxicidad por parte de las células NK; ya ha sido demostrado que la estimulación del sistema inmunitario por el interferón reduce la capacidad de formar metástasis21 . 5. Resistencia a la Anoïkis Las células normales, epiteliales y endoteliales, cuando pierden contacto con las proteínas de la matriz extracelular, activan una forma de apoptosis denominada “anoïkis” (figura 6) . Se sabe que la interacción de las integrinas con la matriz extracelular activa kinasas especificas de la placa de adhesión focal FAK (Focal Adhesión Kinase) tal como la tirosinquinasa, lo cual hace que tal fosforilización se oponga al desencadenamiento de señales apoptótica que se generan por la perdida de contacto19 ; haciendo pensar que la sobrevivencia de las células tumorales circulantes es debido a una resistencia al fenómeno de anoïkis. A propósito de este fenómeno hay que señalar que existe una verdadera conexión entre la matriz extracelular y el citoesqueleto celular, a través de un mecanismo conocido como adhesión focal, que es un elemento dinámico de unión. Las adhesiones focales sirven como estructuras de soporte para permitir la unión del filamento terminal de actina intracelular con la matriz extracelular. Además de la actina, en estas uniones participan una serie de proteínas estructurales como la alfa-actinica, vitronectina, vinculina, tensina, talina, que constituyen un complejo receptor integrina que actúa también como unidad señalizadora20;30 . 6. Implantación en un órgano blanco La adhesión de las células metastásicas en los tejidos de un órgano se lleva a cabo en el momento en que mecánicamente exista una disminución del flujo sanguíneo, específicamente dentro de un capilar, permitiendo así a las células tumorales establecer contacto directo con el sustrato, teniendo así acceso realmente a dos tipos diferentes de sustrato: las células endoteliales y la membrana basal subyacente, donde la adhesión heterotípica entre las dos células ínteractuantes se realiza por la presencia de estructuras moleculares presente en una de ellas, mientras que la otra presenta un receptor. Estudiando estos fenómenos se ha puesto en evidencia un alto nivel de expresión del CD44 o receptor del ácido hialurónico en célu- las del cáncer del colon, por lo que se le ha considerado un marcador para el pronóstico de la enfermedad en el paciente26;49 .También se ha encontrado que el antígeno carcinoembriónico (ACE) está implicado en la formación de metástasis hepáticas. Por otra parte, la adhesión de la célula tumoral sobre un sustrato no celular necesita la expresión de una molécula que tenga afinidad por uno de los componentes del sustrato, tal como las integrinas que interactúan con componentes de la membrana basal. Estas integrinas están formadas por dos subunidades y , ambas con un dominio citoplasmático y un dominio extracelular (figura 7) , donde las dos cadenas unidas forman un sitio receptor que interactúa con un péptido RGD (argininaglicina-ácido aspártico) presente en la laminina, fibronectina y la vitronectina, todos componentes de la membrana basal25 ; dentro de estos mecanismos de interacción hay que señalar que también las lectinas pueden servir igualmente como moléculas de adhesión. En la mecánica de estos fenómenos de contacto la interacción entre los residuos de azúcar van a permitir el reconocimiento entre las membranas celulares, destacando por ejemplo la galactosa, que está frecuentemente implicada en la formación de metástasis hepáticas11 . 7. Crecimiento de la Metástasis La proliferación de las células malignas en un órgano invadido puede ocurrir una vez que llegan las células al nuevo ambiente, con una dinámica de proliferación espontánea. Por otra parte, la preferencia de las células tumorales por ciertos órganos32 está relacionada con otros mecanismos o condiciones que hacen posible un ambiente más propicio para el crecimiento de los focos metastásicos, así podemos tener las siguientes dos condiciones: a) vascularización del órgano blanco que asegura un abundante abastecimiento sanguíneo60 ; b) presencia de factores de crecimiento tisulares sintetizados in situ. En contraposición a la proliferación inmediata que se observa en ciertas metástasis contrasta con el retardo de la proliferación metastásica que se observa en ciertos tumores, planteando las dos preguntas siguientes: ¿La ausencia de proliferación es dependiente de factores inhibitorios de crecimiento? ¿La iniciación de la proliferación, después de un largo período de latencia, está relacionada bien sea a una activación de la inhibición o a la activación de un control positivo?. Para dar respuesta a las mismas, debemos considerar que las células tumorales metastásicas son sensibles a numerosos factores de crecimiento, tanto circulantes como tisulares y entre estas tenemos las citoquinas, que estimulan el crecimiento y que pueden originarse en las células endoteliales y macrófagos, tal como es el caso de las interleukinas 1, ó en el caso de los fibroblastos con la interleukina 614 o también pueden producirse en las células del órgano invadido52 . Por otra parte, las citoquinas inhibidoras del crecimiento tales como TGF o TNF podrían influenciar el crecimiento de estas células malignas, manteniéndolas aisladas en forma de micrometástasis. Todos estos conocimientos alcanzados abren 308 perspectivas a todos los niveles, faltando todavía por explorar el papel terapéutico de estas citoquinas, ya que la ambigüedad de sus efectos, algunas veces actuando como estimuladores y otras veces actuando como inhibidores, hacen de estas especies moleculares un instrumento de difícil manejo por ahora. 8. Papel del sistema inmunológico del hospedador El sistema inmunológico juega un papel relevante en la prevención de la metástasis, teniendo como una de sus funciones la eliminación tanto de las células tumorales circulantes como de las micrometástasis; sin embargo y pese a las evidencias de una respuesta hacia las células transformadas, usualmente el crecimiento de los focos tumorales indica que existe una falla de la vigilancia inmunológica1 . Existen muchos problemas por resolver, pero ya se conoce lo suficiente como para saber el papel que juegan algunos de los elementos celulares inmunológicos, comprendiendo los linfocitos T, linfocitos NK y los macrófagos. En el caso de los linfocitos T, por ejemplo, estos reconocen los epitopes (antígenos) celulares cuando ellos están asociados a los antígenos de histocompatibilidad (HLA) y sumado a ello, en la interacción entre la célula tumoral y el linfocito, están implicadas igualmente moléculas de adhesión, tal como es el caso del determinante molecular B747 . Se ha observado que cuando existe una represión en la expresión de HLA ó disminución en la expresión de B7, no hay reconocimiento antigénico por parte de los linfocitos T ; además en el caso de represión de HLA, las células tumorales deben ser reconocidas por los linfocitos NK, sin embargo, las experiencias muestran que la capacidad de lisis por parte de estos linfocitos es muy limitada, con la consecuente formación de metástasis. Además la defectuosa expresión de determinadas moléculas de adhesión, por parte de una célula tumoral, puede tener implicaciones inmunológicas importantes, ya que pueden convertirse en células capaces de evadir los mecanismos normales de linfotoxicidad. Así, las células del linfoma de Burkitt son resistentes a la lisis mediada por linfocitos T citotóxicos debido a la baja expresión del LFA1 (antígeno asociado a función leucocitaria) . En cuanto a los macrófagos, su estimulación, por numerosos agentes, muestran una efectiva capacidad en reducir la formación de metástasis16 . 9. Ambiente o “Ecosistema” Metastásico El sitio de implantación de las células metastásicas depende de algunos factores entre los que destaca la localización del tumor primario y las vías de dispersión, que pueden ser linfáticas o venosas. Las metástasis son más frecuentes en algunos órganos blanco, destacando los más vascularizados, sin embargo, es evidente por los estudios ya establecidos, que este factor no es siempre determinante, ya que las células tumorales circulantes establecerán una colonización metastásica si ellas encuentran, en el sitio de implante, los diferentes factores necesa- Arvelo y Poupon rios para su adhesión y proliferación; de existir estas condiciones, se constituiría un medio ambiente propicio para la proliferación y desarrollo de las células emigrantes que pudiéramos llamar “ecosistema metastásico”7 LA METASTASIS OSEA COMO EJEMPLO DE ESTE FENOMENO Un considerable número de tumores tiene preferencia de formar metástasis en la médula ósea, lo cual pudiera indicar que este ambiente constituye uno de los medios más favorables para el crecimiento de las células tumorales40 , conociéndose también que la médula ósea, sitio donde se realiza la hematopoyesis, es rica en factores de crecimiento. Por otra parte no se conoce, hasta el presente, cuales son los mecanismos biológicos que son determinantes para el señalado tropismo por establecerse en la médula ósea que presentan muchas células tumorales. En el caso del cáncer de mama, las células metastásicas interactúan con los osteoclastos, que son estimulados por la hormona PTH-rP (peptide parathyroid hormonerelated peptide) ; mientras en el caso del cáncer prostático, las células metastásicas estimulan a los osteoblastos con la consecuente formación de hueso. La síntesis de PTHrP, en el hueso, es estimulada por factores de crecimiento, entre los cuales podemos mencionar el TGF- ; en este caso se establece un círculo vicioso en el cual las células tumorales producen la hormona que estimula a las células óseas a sintetizar factor de crecimiento, que aumenta la síntesis de la hormona creando un sistema cerrado de retroalimentación (Figura 8) . Experimentalmente es posible bloquear la síntesis de PTH-rP por parte de las células tumorales, inhibiendo la señalización dependiente de TGF- , transfectando con un vector de expresión portador de un TGF- mutado64 . Por otra parte, dentro de los mecanismos que actúan e interactúan en estos procesos, los osteoclastos son inhibidos por los bisfosfonatos; agentes que ejercen un efecto inhibitorio sobre el crecimiento de las células tumorales. Además, se ha demostrado un efecto potenciador de los bisfosfonatos y un inhibidor de las metaloproteasas MMP265 . Actualmente se están llevando a cabo investigaciones para la búsqueda de marcadores biológicos que indiquen la capacidad de formar metástasis en los huesos a partir de tumores primarios de cánceres de mama y próstata. La BMP2 (Bone Morphogenetic Protein) estimula experimentalmente la síntesis de otros BMP así como de la osteocalcina, osteopontina, BSP (Bone Sialoprotein) y la diferenciación ósea de los osteoblastos fetales39;12 donde la expresión de las BSP está asociada a la capacidad de originar metástasis ósea en el cáncer de la mama5 . GENERACION DEL PROCESO METASTASICO La formación de metástasis necesita de la expresión de un conjunto de propiedades de las células tumorales24 , Aspectos de la metástasis cancerosa generalmente relacionadas a cambios en la expresión de genes y muy excepcionalmente a alteraciones genéticas y que tienen como característica, general, ser redundantes. Inestabilidad Genómica Es probable que en la generación del potencial metastásico intervengan un conjunto de genes -no siendo responsabilidad exclusiva de un solo gen , estando por tanto íntimamente asociado a la inestabilidad genética, siendo característica propia a la transformación maligna. Las bases moleculares de la inestabilidad genómica son objeto de intensas investigaciones, sabiéndose ya, por ejemplo, que ciertos genes, particularmente los antioncogenes, son responsables de una notoria inestabilidad o de una intensificación de la inestabilidad. Tal caso es ejemplarizado por ciertas mutaciones del gen p53, las cuales hacen que no cumple con su papel de guardián del genoma y permite que la célula continué a través del ciclo celular con su ADN alterado34 ; Estas inestabilidades genómicas se traducen en alteraciones cromosómicas que acompañan de una forma constante a la progresión tumoral, como se ha podido constatar por las diferentes investigaciones ya realizadas13 . Inestabilidad Cromosómica El examen de los cariotipos de los tumores sólidos avanzados muestran que la evolución hacia la malignidad se realiza a través de etapas sucesivas de rearreglos cromosómicos como lo son delecciones, endoreduplicaciones y perdida de fragmentos de cromosomas15 . La hipótesis actual postula que la adquisición del potencial metastásico resulta de la combinación de la expresión de diferentes genes en un contexto de acumulaciones de cambios genéticos y celulares; esta hipótesis señala la diversidad de genes activos en el curso del proceso metastásico, que ellos se expresan simultáneamente, y que solo sería suficiente un cambio para que se logre una transición, que haga posible que una célula adquiera capacidad metastásica. La capacidad metastásica en una población de células tumorales se origina espontáneamente y fue Hill29 quien demostró la naturaleza mutacional de la generación del potencial metastásico, demostración que se realizó utilizando el análisis de fluctuación descrita por Luria y Delbrück en 194335 . Este análisis se fundamenta en el principio que expresa que cuando un evento -en este caso la adquisición del potencial metastásico- es poco frecuente, donde además el tamaño de la población celular inicial es pequeño, tal evento es estadísticamente ausente. Si el evento se produce espontáneamente y al azar, debido a una mutación genética, el evento aparece muy temprano en cierto número de células en el curso de su expansión y más tarde en otras, definiendo así una variabilidad de expresión del fenómeno en la descendencia de las células. Así, si se dejan proliferar los clones, estos terminaran siendo metastásicos, poniéndose en evidencia que la adquisición de 309 la capacidad metastásica está determinada por una mutación genética. Por otra parte, también se ha puesto en evidencia que una frecuencia de mutación muy elevada como lo es 10 4 a 10 5 cercano a las frecuencias de amplificación genética, es incompatible con un mecanismo de mutación puntual, donde la frecuencia es de 10 8 a 10 9 . Además, ello ha demostrado que la tasa de mutación espontánea en las líneas metastásicas es más elevada que en las líneas celulares poco metastásicas. Esta demostración ha conducido a evidentes conclusiones para los enfoques clínicos: estadísticamente, para un tipo particular de cáncer, mientras más grande es el tamaño del tumor primario, más grande será el chance de generar variantes metastásicas, mientras que si el tumor es de tamaño pequeño, hay mas probabilidades de encontrarlo localizado. Este modelo de evolución que genera una heterogeneidad tumoral es paralelo al descrito por Goldie con respecto a la aparición de variantes quimioresistentes e igualmente muy relacionado a las mutaciones22;23 . GENES RELACIONADOS CON EL MECANISMOS DE LA METASTASIS La migración de las células cancerosas es un requisito indispensable que sigue a la degradación proteolítica de matrices tisulares en el avance de la cascada metastásica. Muchos modelos de animales de cáncer revelaron la presencia de ciertos factores con la capacidad de estimular o inhibir la motilidad celular. Estos factores con frecuencia se expresan de forma aberrante en los tejidos neoplásicos dando cabida a un terreno fértil para las migraciones celulares que caracteriza la invasión tumoral primaria. Por otra parte se identificó y secuenció una nueva molécula de timosina, la 15 que estimula la motilidad de las células neoplásicas prostáticas. La expresión de esta molécula se correlaciona muy estrechamente con la producción de metástasis experimentales en animales de laboratorio. Además, el bloqueo específico de la síntesis de timosina 15 mediante oligonucleotidos antisentido previene el desarrollo de metástasis. Se reportó que la timosina 15 no se expresa en células epiteliales prostáticas normales ni en neoplasias benignas del mismo origen; por el contrario, su expresión es muy significativa en tejidos malignos38;59 Por otra parte, debido al papel de las distintas proteínas en la diseminación del cáncer, se ha comenzado a reconocer la existencia de verdaderos “ metastogenes”, es decir genes que codifican proteínas y enzimas que promueven la invasión tumoral y metástasis, en lugar de fomentar el crecimiento neoplásico como lo hacen los oncogenes. Como contrapartida, también se han descrito genes supresores de la metástasis, que corresponden a genes normales que codifican proteínas que modulan la adhesión, invasión o migración de las células, adecuándolas a las necesidades orgánicas. Se ha descrito un gen en el brazo corto del cromosoma 11 que cumple con los requisitos para ser aceptado como un gen supresor de la metástasis en células prostáticas. 310 Arvelo y Poupon El nuevo gen es conocido como KAI-1, y el cual introducido en células de carcinoma prostático de rata, reduce significativamente la capacidad metastásica de las mismas cuando son inoculadas en animales. El gen KAI1 se encuentra muy conservado desde el punto de vista evolutivo y su expresión es relevante en muchos órganos y tejidos, particularmente en próstata, pulmón, hígado, riñón, médula ósea y placenta44 El gen nm23 supresor de la metástasis presenta una reducida expresión en células de melanoma altamente metastásicas comparadas con células de bajo potencial metastásico53 . En humanos se han identificado dos genes con propiedades supresoras, nm23-H1 y nm23-H2; células de cáncer de mama transfectadas con nm23-H1 reducen su potencial metastásico54 . tástasis, el cual es el resultado de una coordinación lógica. Algunas observaciones apoyan esta hipótesis, como es el caso del estudio de las MMP, que tienen función enzimática y pueden actuar como factores de crecimiento, estando igualmente implicados en la motilidad interactuando con las integrinas. En la segunda hipótesis, el conjunto de propiedades que llevan a la metástasis sería dirigido por los genes Homeóticos HOX , los cuales funcionan en el curso de la embriogénesis determinando la posición de las células tumorales en el espacio y el tiempo. De esta manera la formación de metástasis podría resultar en una alteración del control de la expresión de los genes HOX45;57;10 . METASTASIS: ¿AZAR O SELECCION? UNA HIPOTESIS PARA LA INTERPRETACION Recientes resultados, de múltiples laboratorios, han demostrado que el microambiente de un órgano en particular puede influenciar profundamente el fenotipo de las células tumorales. Esto apoya la hipótesis de Paget, en la cual el microambiente del órgano (the soil) puede influenciar la invasión, implantación, , supervivencia y crecimiento de células tumorales en particular (the seed) . Además de ello, el proceso metastásico necesita también de una serie de cambios en la biología de las células que implican tanto una o varias mutaciones genéticas, como de la adquisición de nuevas propiedades celulares, más la constitución de un microambiente. A pesar de los grandes avances que se han realizados hasta el presente, se plantean múltiples caminos posibles y numerosas interrogantes en el orden genético, molecular y de mecanismos que puedan llevar a comprender diferentes facetas de la progresión tumoral y conducir a nuevos y necesarios progresos en el ámbito de lo clínico, particularmente definiendo nuevos marcadores pronósticos orientados hacia nuevas vías terapéuticas. La combinación e implicación de genes que permiten a una misma célula cumplir por completo con el proceso metastásico, es particularmente complejo, siendo además un evento raro y un producto del azar29 .El mismo hecho de la frecuencia de aparición de la metástasis sugiere que la asociación de las diferentes propiedades necesarias para el éxito de la implantación a distancia no se realiza al azar, a pesar de que algunos autores defienden la hipótesis estocástica, donde el órgano blanco seleccionaría las células del tumor primario liberadas al azar con la consecuente formación de metástasis (Figura 9) . Actualmente son discutidas otras dos hipótesis, las cuales tienen en cuenta la implicación de determinantes moleculares. La primera de ellas sería la que postula que la activación de un determinante, que activaría secuencialmente otro determinante y por ende la formación de me- CONCLUSION REFERENCIAS 1. Abbas, A.K., Lichtman, A.H. and Pober, J.S. Inmunología Celular y Molecular. Interamericana-McGraw-Hill, 3era Edición, 1999. 2. Anzai, H., Kitadai, Y., Bucana, C.D., Sánchez, R., Omoto, R. and Fidler, I.J. Intratumoral heterogeneity and inverse correlation between expression of E-cadherins and collagenase type IV in human gastric carcinomas. Differentiation 60: 119-127, 1996. 3. 4. An, Z., Wang, X., Willmont, N., Chander, S.K., Tickle, S., Docherty, A.J., Mountain, A and Hoffman, R.M.: Conversion of highly malignant colon cancer from an aggressive to a controlled disease by oral administration of a metalloproteinase inhibitor. Clin. Exper. Metastasis 15: 184-195, 1997. Basset, P., Bellocq, J., Wolf, C., Stoll, I., Hutin, P., Limacher, J., Podhajcer, O., Chenard, M., Rio, M. and Chambon, P. A. novel metalloproteinase gene specifically expressed in stromal cells of breast carcinomas. Nature 348 : 699704, 1990. 5. Bellahcene, A., Krollo, M., Liebens, F. and Castronovo, V. Bone sialoprotein expression in primary human breast cancer is associated with bone metastases Development. J. Bone Min. Res. 11: 665-670, 1996. 6. Beavon, I.R.G. The E-cadherin-catenin complex in tumour metastasis: structure, function and regulation. Eur. J. Cancer 36:1607-1620, 2000. 7. Birchmeier, C., Meyer, D. and Riethmacher, D. Factors controlling growth, motility and morphogenesis of normal and malignant epithelial cells. Int. Rev. Cytol. 160: 221-266, 1995. 8. Boudreau, N. and Bissell, M.J. Extracellular matrix signaling: integration of form and function in normal and malignant cells. Cur. Opinion Cell Biol. 10: 640-646, 1998. 9. Brooks, P.C., Stromblad, S., Sanders, L.C., vonSchalscha, T.L., Aimes, R.T., StetlerStevenson, W.G., Quigley, J.P. and Cheresh, D.A. Localization of matrix metalloproteinase MMP-2 to the surface of invasive cells by interaction with integrin alpha v beta3. Cell 85: 683-693, 1996. 311 Aspectos de la metástasis cancerosa 10. Care, A., Silvani, A., Meccia, E., Mattia, G., Stoppacciaro, A., Parmiani, G., Pesche, C. and Colombo, M. HOXB7 contitutively activates basic fibroblast growth factor in melanomas. Mol. Cell. Biol. 16: 4842-4851, 1996. 26. Gunthert, U., Hoffman, M., Rudy, W., Reber, S., Zöller, M., Haussman, S., Matzu, S., Wenzel, A., Ponta, H. and Herrlich, P. A new variant of glycoprotein CD44 confers metastatic potential to rat carcinome cells. Cell 65:13-24, 1991. 11. Castronovo, V., Luyten, F., Cioce, V., Barker, K. and Sobel, M.E. 31kD y 12kD galactoside binding lectins are cell surface laminin binding proteins in human cancer cells: possible relationship with the 67 kD laminin receptor. J. Cell Biol. 42: 127-133, 1990 27. Gomez, D.E., Alonso, D.F., Yoshiji, H. and Thorgeirsson, U.P. Tissue inhibitors of metalloproteinases: structure, regulation and biological functions. Eur. J. Cell Biol 74: 111-122, 1997. 28. 12. Chen, D., Ji, X., Harris, M.A., Feng, J.Q., Karsenty, G., Celeste, A.J., Rosen, V., Mundy, G.R. and Harris, S.E. Differential roles for bone morphogenetic protein (BMP) receptor type IB and IIA in defferentiation and specification of mesenchymal precursor cells to osteoblast and adipocyte lineages. J. Cell. Biol. 142: 295-305, 1998. Hanahan, D. and Folkman, J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell 86: 353-364, 1996. 29. Hill, R., Chambers, A., Ling, V. and Harris, J. Dynamic heterogeneity: rapid generation of metastatic variants in mouse B16 melanoma cell. Science 224: 998-1001, 1984. 13. Cheng, K.C. and Loeb, L.A. Genomic Stability and Instability: A Working Paradigm Curr. Topics Microbiol. Immunol. 221: 5-18, 1997. 30. Holt, M.R., Critchley, D.R. and Brindle, N.P.J. The focal adhesion phosphoprotein, VASP. Int. J. Biochem. Cell Biol. 30: 307-311, 1998. 14. Curran, S. and Murray, G.I. Matrix metalloproteinases: molecular aspects of their roles in tumour invasion and metastasis. Eur. J. Cancer 36: 1621-1630, 2000. 31. 15. Dutrillaux, B., Gerbault-Seureau, M. and Zafreni, B. Characterization of chromosomal abnormalities in human breast cancer. A comparison of 30 paradiploid cases with few chromosome changes. Cancer Genet. Cytogenet. 49: 203-217, 1990. Jouanneau, J., Moens, G., Bourgeois, Y., Poupon, M.F. and Thiery, J.P. Minority of carcinoma cells producing acidic fibroblast growth factor induces a community effect for tumor progression. Proc. Natl. Acad. Sci. U S A 91: 286290, 1994. 32. Kuo, T.H., Kubota, T., Watanabe, M., Furukawa, T., Teramoto, T., Ishibiki, K., Katajima, M., Moosa, A.R. and Penmam, S. Liver colonization competence governs colon cancer matastasis. Proc. Natl. Acad. Sci. U S A 92: 1208512089, 1995. 33. Kuramochi, H., Ichikawa, T., Nihei, N., Kawana, Y., Suzuky, H., Schalken, J.A., Takeichi, M., Nagafuchi, A., Ito, H. and Shimazaki, J. Suppression of invasive ability of highly metastatic rat prostate cancer by introduction of human chromosome 8. Prostate 31: 14-20, 1997. 34. Lane, D.P. Cancer p53, guardian of the genoma. Nature 358:15-16, 1992. 35. Luria, S. and Delbrück, M. Mutations of bacteria from virus sensitivity to virus resistance. Geneticis 28: 491-511, 1943. 36. Mareel, M., Vleminckx, K., Vermeulen, S., Yan, G., Bracke, M. and vanRoy, F.: Downregulation in vivo of the invasion-suppressor molecule E-cadherin in experimental and clinical cancer. Princess Takamatsu Symposia 24: 6380, 1994. 37. Mareel, M., Boterberg, T., Noe, V., Bruyneel, E. and Bracke, M. Molecular aspect of cancer metastasis: extracellular regulation of the E-cadherin/catenin complex. Int. J. Development Biology Suppl:65S-66S, 1996. 38. Marx, J. New tumor suppressor may rival p53. Science 264: 344-345, 1994. 39. Mundy, G.R. Regulation of bone formation by bone morphogenetic proteins and others growth factors. Clin. Orthopaed. Relat. Res. 234:24-28, 1996. 40. Mundy, G.R. Mechanisms of bone metastasis. Cancer 80: 1546-1556, 1997. 16. Fidler, I.J. Therapy of cancer metastasis by systemic activation of macrophages. Adv. Pharmacol. 30: 271-326, 1994. 17. Folkman, J. Angiogenesis and angiogenesis inhibitor: an overview. EXS 79: 1-8, 1997. 18. Folkman, J. Clinical applications of research on angiogenesis. N. Engl. J. Med. 333: 1757-1763, 1995. 19. Frisch, S.M., Vuori, K., Ruoslahti, E. and Chan-HuiP, Y. Control of adhesion-dependent cell survival by focal adhesion kinase. J. Cell Biol. 134: 793-799, 1996 20. Frisch, S.M. and Ruoslahti, E. Integrins and Anoikis. Cur. Opinion Cell Biol. 9:701-706, 1997. 21. Gilboa, E. The makings of a tumor rejection antigen. Immunity 11: 263-270, 1999. 22. Goldie, J. and Coldman, A. : A mathematical model for relating the drug sensitivity of tumors to their spontaneous mutation rates. Cancer Treat. Report 63: 1727-1733, 1979. 23. Goldie, J.H. Modelling the process of drug resistance. Lung Cancer 10: S91-S96, 1994. 24. Greene, G.F., Kitadai, Y., Petaway, C.A, von Eschenbach, A.C., Bucana, C.D. and Fidler, I.J. Correlation of metastasis-related gene expression with metastatic potential in human prostate carcinoma cells implanted in nude mice using an in situ messenger RNA hybridization technique. Am. J. Pathol. 150: 1571-1582, 1997. 25. Guan, J.L. Role of focal adhesión kinase in integrin signaling. Int. J. Biochem. Cell Biol. 29: 1085-1096, 1997. 312 Arvelo y Poupon 41. Ot’Reilly, M.S., Holmgren, L., Chen, C. and Folkman, J. Angiostatin induces and sustains dormancy of human primary tumors in mice. Nature Medicine 2: 689-692, 1996. 42. 43. 55. Paget, S. Distribution of secondary growths in cancer of the breast. Lancet 1:571-573, 1889. Skoudy, A., Llosas, M. and Garcia De Herreros, A. Intestinal HT-29 cells with dysfuntion of cadherins show increased pp60src activity tyrosine phosphorylation of p20catenin. Biochem. J. 317: 279-284, 1996. 56. Patterson, B.C. and Sang, Q.A. Angiostatin-converting enzyme activities of human matrilysin (MMP-7) and gelatinase B/type IV collagenase (MMP-9) . J. Biol. Chem. 272: 28823-28825, 1997. Takeichi, M. The cadherins: cell-cell adhesion molecules controlling animal morphogenesis. Development 102:639655, 1988. 57. Tiberio, C., Barba, P., Magli, M., Arvelo, F., Chevalier, T.L., Poupon, M.F. and Cillo, C. Hox gene expression in human small cell lung cancers xenografted into nude mice. Int. J. Cancer 58:1-8, 1994. 58. Vandenbunder, B., Wernert, N., Queva, C., Desbiens, X. and Stehelin, D. : Does the transcription factor c-ets take part in the regulation of angiogenesis and tumor invasion. Folia Biologica 40: 301-313, 1994. 59. Vogelstein, B. and Kinzler, K.W. Tumour suppressor genes: X-rays strike p53 again. Nature 370: 174-175, 1994. 60. Weiner, N. and Folkman, J. Tumoral vascularity as a prognostic factor in cancer. Important Adv Oncol. 167-190, 1996. 61. Weiss, L. Principles of metastasis. Academic Press, New York, 1985. pp 85-92 62. Wike, J.A. Overview burgeoning promise in metastasis research. Eur J Cancer. 36: 1589-1594, 2000 63. Yebra, M., Parry, G.C., Stromblad, S., Mackman, N., Rosenberg, S., Mueller, B.M. and Cheresh, D.A. Requirement of receptor-bound urokinase type plasminogen activator for integrin alpha v beta 5 directed cell migration. J. Biol. Chem. 271: 29393-29399, 1996. 64. Yin, J.J., Selander, K., Chirgwin, J.M., Dallas, M., Grubbs, B.G., Wieser, R., Massague, J., Mundy, G.R and Guise, T.A. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. J. Clin. Invest. 103: 197-206, 1999. 65. Yoneda, T., Sasaki, A., Dunstan, C., Williams, P.J., Bauss, F., DeClerck, Y.A and Mundy, G.R. Inhibition of osteolytic bone metastasis of breast cancer by combined treatment with the biphosphonate ibandronate and tissue inhibitor of the matrix metalloproteinase-2. J. Clin. Invest. 99: 2509-2517, 1999. 66. Zetter, B.R. Angiogenesis and tumor metastasis. Ann. Rev. Med. 49: 407-424, 1998. 44. Pennisi, E. New tumor suppressor found twice. Science 275: 1876-1878, 1997. 45. Poupon, M.F. L’evolution des tumeurs malignes. Pour la Science 149: 72-77, 1990. 46. Richmond, P.J., Karayiannakis, A.J., Nagafuchi, A., Kaisary, A.V. and Pignatelli, M. Aberrant E-cadherins and alpha-catenin expression in prostate cancer: correlation with patient survival. Cancer Res. 57: 3189-3193, 1997. 47. Robey, E. and Allison, J. T-cell activation: integration of signals from the antigen receptor and costimulatory molecules. Immunol. Today 16, N Æ 7, 1995. 48. Roy, F. Protein kinase C activation upregulates intercellular adhesion of alpha-catenin negative human colon cancer cell variants via induction of desmosomes. J. Cell Biol. 137: 1103-1116, 1997. 49. Ruoslahti, E. and Pierschbacher, M.D. New Perspectives in cell adhesion: RGD and integrins. Science 238: 491-497, 1987. 50. Shapiro, S.D. Matrix metalloproteinase degradation of extracellular matrix: biological consequences. Cur. Opinion Cell Biol. 10:602-608, 1998. 51. Siletti, S. , Timar, J. , Honn, R. and Raz, A. Autocrine motility factor induces differential 12-lipoxygenase expression and activity in high and low metastatic K1735 melanoma cell variants. Cancer Res. 54: 5752-5756, 1994. 52. Singh, R.K. and Fidler, I.J. Regulation of tumor angiogenesis by organ-specific cytokines. Cur. Topics Microbiol. Immunol. 213: 1-11, 1996. 53. Steeg, P.S., Bevilaqua, G., Kopper, I., Thorgeirsson, U.P., Talmadge, J.E, Liotta, L.A. and Sobel, M.E. Evidence for a novel gene associated with low tumor metastatic potential. J. Natl. Cancer. Inst. 80: 200-204, 1988. 54. Steeg, P.S., Rosa, A.D.L., Flatow, U., Macdonald, N.J., Benedict, M. and Leone, A. nm23 and breast cancer metastasis. Breast Cancer Res. Treatment 25: 175-187, 1993.