Integración Sensório-motora y plasticidad sináptica en la corteza
Anuncio

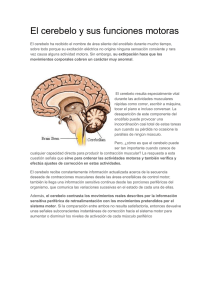
doi:10.3900/fpj.2.2.91.s EISSN 1676-5133 Integración Sensório-motora y plasticidad sináptica en la corteza cerebelar Artículo Original Marlo Cunha Setor de Neuroimagem Funcional, Instituto de Psiquiatria (IPUB) – UFRJ [email protected] Heloisa Veiga Setor de Neuroimagem Funcional, Instituto de Psiquiatria (IPUB) – UFRJ [email protected] Victor Hugo Bastos Programa de Pós-Graduação Stricto Sensu em Ciência da Motricidade Humana da UCB - RJ [email protected] Roberto Piedade Setor de Neuroimagem Funcional, Instituto de Psiquiatria (IPUB) – UFRJ [email protected] Alair Pedro Ribeiro Programa de Pós-Graduação Stricto Sensu em Ciência da Motricidade Humana da UCB - RJ Departamento de Biociências – Escola de Educação Física e Desportos (EEFD) - UFRJ Setor de Neuro imagem Funcional Avenilda Silva Programa de Pós-Graduação Stricto Sensu em Ciência da Motricidade Humana da UCB - RJ [email protected] Vernon Furtado Programa de Pós-Graduação Stricto Sensu em Ciência da Motricidade Humana da UCB - RJ [email protected] CUNHA, M.; BASTOS, V.H.; SILVA, A.; FURTADO, V.; VEIGA, H.; PIEDADE, R.; RIBEIRO, A.P. Integración Sensório-motora y plasticidad sináptica en la corteza cerebelar. Fitness & Performance Journal, v.2, n.2, p. 91-96, 2003. RESUMEN: Lo presente artículo revisa el fenómeno de plasticidad sináptica en el cerebelo estimulada por el proceso de aprendizaje de habilidades motoras complejas (acrobáticas). Inicia con una descripción anatómica y fisiológica del cerebelo que incluye, su división en lobos, relación con otras áreas del sistema nervioso central y un análisis más refinada de sus circuitos internos. La seguir es hecha un abordaje sobre diferentes modelos que intentan explicar como el cerebelo actúa al incorporar nuevos patrones motores al sistema. Por último son reunidos los resultados de diferentes estudios experimentales que investigaron la remodelaje sináptica cerebelar en ratones entrenados con actividades acrobáticas exigiendo alto grado de coordinación y balance. Ellos fueron entonces comparados con otros grupos sometidos la ejercicios de naturaleza simple y el un grupo inactivo, que igualmente a los primeros, habían sido sacrificados y estudiados al microscopio electrónico. Palabras clave: Cerebelo, Integración Sensorio-Motora, Aprendizaje Motora, Plasticidad Sináptica Dirección para correspondencia: Rua Antonio Carlos, 97 – Porto Velho – São Gonçalo – RJ Fecha de Recibimiento: enero / 2003 Fecha de Aprobación: febrero / 2003 Copyright© 2003 por Colégio Brasileiro de Atividade Física, Saúde e Esporte Fit Perf J Rio de Janeiro 2 2 91-96 mar/abr 2003 RESUMO ABSTRACT Integração sensório-motora e plasticidade sináptica no córtex cerebelar Sensory-motor integration and synaptic plasticity in the cerebelar cortex O presente artigo revisa o fenômeno de plasticidade sináptica no cerebelo estimulada pelo processo de aprendizagem de habilidades motoras complexas (acrobáticas). Inicia com uma descrição anatômica e fisiológica do cerebelo que inclui, sua divisão em lobos, relação com outras áreas do sistema nervoso central e uma análise mais refinada dos seus circuitos internos. A seguir é feita uma abordagem sobre diferentes modelos que tentam explicar como o cerebelo atua ao incorporar novos padrões motores ao sistema. Por último são reunidos os resultados de diferentes estudos experimentais que investigaram a remodelagem sináptica cerebelar em ratos treinados com atividades acrobáticas exigindo elevado grau de coordenação e balanço. Eles foram então comparados com outros grupos submetidos a exercícios de natureza simples e a um grupo inativo, que igualmente aos primeiros, foram sacrificados e estudados ao microscópio eletrônico. Palavras-chave: Cerebelo, Integração Sensório-Motora, Aprendizagem Motora, Plasticidade Sináptica The present study aims to investigate the synaptic plasticity in the cerebellum as a result of the learning process of complex (acrobatic) motor skills. It begins with an anatomical and physiological description of the cerebellum, which includes its division into lobes, the relationship with other areas of the Central Nervous System, and a detailed analysis of its internal circuits. Next, an approach regarding disitnct models which attempt to explain how the cerebellum functions as it incorporates new motor patterns to the system is made. Finally, results of different experimental studies which investigated the cerebellar synaptic remodelling in acrobatic trained rats are assembled. The acrobatic training consisted of activities demanding a high level of coordination and balance. The trainned rats were compared to others submitted to simple exercises and to inactive groups. The three groups of rats were sacrificed and studied with an electronic microscope. Keywords: Cerebellum, Sensory-Motor Integration, Motor Learning, Sinaptic Plasticity INTRODUCCIÓN Estudiosos del área de aprendizaje motora encuentran en el cerebelo un objeto de investigación de gran relevo. Hay relatos de que ya en el siglo XIX estudios de lesiones demostraban que el cerebelo es importante para la coordinación de los movimientos (Houk et al., 1996). Otro estudio cita que lesiones en el cerebelo son responsables por romper con la coordinación de los movimientos de los miembros y de los ojos, impedimento del balance y disminución de los tonos muscular (Kandel et al., 1995). Más recientemente se descubrió que el cerebelo no actuaría solamente en el control de los movimientos, pero participaría todavía de funciones mentales del individuo durante tareas motoras de naturaleza superior: lenguaje, aprendizaje de movimientos complejos, ejecución de movimientos con contenido emocional etc. (Lent, 2001). Las consideraciones sobre esa estructura nerviosa no para por ahí, un número de estudios experimentales está demostrando una especie de plasticidad sináptica cerebelar inducida por aprendizaje de habilidades motoras complejas entre modelos animales (Anderson et al., 1996 & Kleim et al., 1998b). Gran atención está siendo atribuida a los mecanismos neurofisiológicos que rigen la referida capacidad plástica que será incorporada como tema principal del regalo trabajo. REPASO DE LA LITERATURA Descripción anatómica del cerebelo El cerebelo consiste en una estructura globosa localizada en la fosa craneal posterior. Él ocupa cerca de una habitación del volumen craneal en el hombre (Lent, 2001). Esa estructura presenta gran analogía con el cerebro: dividido en dos hemisferios, su parte externa es constituida de sustancia ceniza (corteza cerebelar) y la parte interna por sustancia blanca donde son encontrados núcleos nerviosos (los núcleos profundos del cerebelo). La analogía no para por ahí, la corteza cerebelar también está dividida en lobos. Son ellos: el lobo anterior, el lobo posterior y lo lobo floculo-nodular (Kandel et al., 1995). De cada hemisferio del cerebelo hay cuatro núcleos profundos, el núcleo fastigial, los interpuestos (globoso y emboliforme) y el núcleo dentado. Esos núcleos reciben aferen92 cias de partes diferentes de la corteza cerebelar y constituyen las principales vías eferentes del mismo (Kandel, 1995). Análisis de las relaciones conectivas entre los núcleos profundos y la corteza cerebelar relatan que la corteza del lobo floculo-nodular se conecta con los núcleos selectividades localizados en el tronco cerebral. Así, a pesar de esa localización, desde el punto de vista conectivo los núcleos selectividades pueden también ser considerados como núcleos profundos del cerebelo (Lent, 2001). El núcleo fastigial recibe aferencia de la región mediana del cerebelo llamada gusano (debido a su aspecto alargado y segmentado). La región verminal divide el cerebelo en hemisferios derecho e izquierdo y es más prominente en la superficie inferior del lobo posterior (Kandel et al., 1995). Los núcleos interpuestos reciben aferencias de la zona intermediaria situada entre el gusano y la porción más lateral de los hemisferios. En su vez, el núcleo dentado recibe suyas aferencias de las regiones más lateralizadas de los hemisferios (Lent, 2001). De esos análisis resultó la propuesta de uno nueva división en zonas del cerebelo dividiéndolo en cuatro regiones de cada lado: gusano, zona intermediaria, hemisferio lateral y lo lobo floculo-nodular (Lent, 2001). Informaciones variadas del SNC son reunidas en el cerebelo El cerebelo presenta tres circuitos distribuidos que promueven su contacto con todas las partes del sistema nervioso central (corteza cerebral, tronco encefálico y médula espinal). El vestíbulocerebelo consiste en una vía donde es establecida una conexión recíproca entre los núcleos selectividades localizados en el tronco encefálico y lo lobo floculo-nodular (Kandel et al., 1995; Daz & Puelles, 2003). Es atribuida a esa vía la función de controlar el movimiento de los ojos y el mantenimiento de la postura y del equilibrio durante la marcha. El espinocerebelo es otra vía, sus principales inputs se originan de la médula espinal trayendo informaciones sensoriales de la periferia (Krutki & Mrowczynski, 2002). Tales informaciones llegan al cerebelo en las regiones del gusano y zona intermediaria siendo transmitidas a los núcleos fastigial e interpuestos. Estos, prorrogándose al tronco encefálico y Fit Perf J, Rio de Janeiro, 2, 2, 92, mar/abr 2003 al mesencéfalo irán inervar respectivamente los núcleos del sistema descendiente medial (núcleos selectividades, formación reticular y colícuelo superior) y lateral (núcleo rubro). El sistema lateral tiene la importante función de controlar la ejecución de los movimientos de los miembros en tiempo real (Kandel et al., 1995). Por último hay el cerebro-cerebelo que empieza en las áreas frontal, parietal y occipital de la corteza cerebral, se proyectando todas para los núcleos en la base del puente, y dieses, para los hemisferios laterales del cerebelo (Serapide et al., 2001). El núcleo dentado, entonces, recibe y transmite la información a los núcleos ventralanterior y ventral-lateral del tálamo de donde es repasada a las áreas motora y pre-motora de la corteza cerebral (Lent, 2001). Esa vía participa de la planificación y coordinación de movimientos más complejos, integrando las informaciones sensoriales con los comandos de origen mental (cognitiva y emocional). Anatomía refinada y circuitos intrínsecos del cerebelo La corteza cerebelar se encuentra organizado en tres capas que partiendo de la periferia para el interior son: la camada molecular, la camada de Purkinje y la camada granular. De cada una están localizados tipos específicos de células neurales cuyas propiedades funcionales habían sido reveladas a partir de análisis microscópicas más refinadas (Lent, 2001). Son observadas dos vías de entrada para el cerebelo que ocurren a partir de fibras conocidas como musgosas (FM) y trepaderas (FT), las primeras se originan en neuronas en el cuerno medular formando el trato espino-cerebelar y en diversos núcleos del tronco encefálico. Ellas constituyen el principal sistema de input del circuito cerebelar en virtud de la gran diversidad de informaciones que conducen (Takacs & Metzger, 2002). A su vez, las fibras trepaderas se originan en el núcleo olivar inferior (Huesa, 2003; Houk et al., 1996; Lang, 2001). La oliva inferior también emite una proyección colateral para los núcleos cerebelares (Ruigrok & Voogd, 2000). FM y FT secretan el neurotransmisor glutamato ejerciendo, así, influencia excitatória sobre las áreas de contacto inmediato en el cerebelo (Garthwaite & Brobelt, 1990). Fibras musgosas y trepaderas alcanzan el cerebelo en locales distintos y recorren caminos distintos, una en relación a la otra, lo que les confiere propiedades funcionales diferenciadas (Thach, 1998). Las fibras musgosas alcanzan inicialmente la camada granular de la corteza cerebelar pero emiten ramos colaterales para los núcleos profundos (Ito, 2000). En la camada granular ellas se contactan con células granules a partir de zonas especializadas llamadas glomérulos, que propicia alta eficiencia de transmisión eléctrica. El glomérulo es aquí formado por el terminal asonado de las fibras musgosas, terminales inhibitorios de células de Golgi y dendritas de la célula granular. Tal arreglo se presenta circundado por células gliales que promueven el aislamiento de la señal eléctrico y, consecuentemente, una fuerte activación de la célula granular. Esa extenderá suyo axón hasta la camada molecular (más externa) donde irá a formar un sistema de fibras paralelas (FP) que tiene como destino el árbol dendrítica de otro tipo celular, la célula de Purkinje cuyo cuerpo está en la camada rápido abajo (Ito, 2000). Aunque reciba activación excitatória, la célula de Purkinje ejerce actividad de inhibición a partir del neurotransmisor GABA, teniendo como blanco los núcleos profundos del cerebelo (Ito, 2000). Cuánto a las fibras trepaderas, ellas se dirigen para la corteza cerebelar se conectando directamente con las células de Purkinje Fit Perf J, Rio de Janeiro, 2, 2, 93, mar/abr 2003 (Thach, 1998). Cada célula de Purkinje recibe sólo una fibra trepadera que se devana en su cuerpo y en las porciones proximales de las dendritas estableciendo varias sinapsis excitatórias. Una fibra trepadeira puede conectarse con 1-10 células de Purkinge transmitiendo uno fuerte potencial eléctrico y esas emiten suyos axones con actividad inhibitoria para los núcleos profundos. Hay indicación de que análogamente a las fibras musgosas, las fibras trepaderas emitan colaterales excitatórios directamente a los núcleos profundos del cerebelo (Kandel et al., 1995). Según relatos, los inputs de las fibras trepaderas para las células de Purkinje pueden ejercer modulación sobre el efecto de las fibras musgosas, lo que se procesa de una entre dos formas: enfatizando transcientemiente el efecto de los inputs de las fibras musgosas para las células de Purkinje (Marr, 1969) o produciendo una depresión de larga duración de la eficacia de inputs seleccionados de fibras musgosas (Albus, 1971). Ese último aspecto ocurriría mediante una acción heterosináptica, es decir, una alteración en la actividad de una vía debido a la actividad de otra vía (Kandel et al., 1995). Análisis funcional de la corteza cerebelar Surge aquí una cuestión fundamental: ¿Como la corteza cerebelar organiza suyas computaciones internas a fin de regular la vía premotora responsable por los movimientos finos de los miembros? Para responder tal pregunta algunos autores habían adoptado la idea de haber una vía excitatória circulante entre la corteza motor y los núcleos profundos del cerebelo (Tsukahara et al., 1968). Postularon entonces que la corteza motor iniciaba los movimientos de los miembros activando un gran grupo de neuronas corticales que emitían mucho más comandos que los realmente necesarios. La permanencia de esos comandos dependía de la retroalimentación circulante a través de los núcleos profundos. Entonces, cuando las células de Purkinge disparaban, los comandos innecesarios eran eliminados a través de una inhibición de las descargas de los núcleos profundos (Blomfield & Mar, 1970). Ya que los outputs provenientes de la corteza cerebelar son exclusivamente inhibitorios, los núcleos profundos (incluyendo la selectividad), los cuales son inhibidos por las células de Purkinje deben ser regulados también por alguna acción desinhibidota. Podría ser una acción que compita con la activación de la célula de Purkinje o una influencia excitatória provenida de una otra fuente (Houk et al., 1996). En este particular parece importante resaltar que las células de Purkinje reciben inputs inhibitorios a partir de células en cesto y células estrelladas esparcidas por el cerebro. Además, fue relatado que las fibras musgosas y trepaderas que llevan influencia excitatória para las células de Purkinje durante el trayecto emiten ramos colaterales directamente para los núcleos profundos del cerebelo (Kandel et al., 1995). Ambas las propuestas necesitan, todavía, sean analizadas experimentalmente. La participación del cerebelo en el proceso de aprendizaje motora El cerebelo es visado como una estructura del sistema nervioso central, que asociado a otras (oliva inferior, sistema pre-motor, ganglios basales y corteza cerebral), ayuda a crear un ambiente ventajoso para varias formas de aprendizaje motora (Houk, 1996; Hikosaka et al., 2002). La experiencia de los movimientos es capaz de promover alteraciones en los circuitos cerebelares, formando la base del aprendizaje (Kandel et al., 1995). Tales alteraciones motivaron investigadores como Marr (1969) y Albus (1971) la postulen modelos que definen estrategias de aprendizaje 93 motora. El primer autor sugirió un mecanismo de potenciación de larga-duración (PLD) que ocurriría cuando una célula de Purkinje disparase a la vez en que las fibras paralelas fuesen activadas. Eso causaría un aumento de la fuerza sináptica entre fibras paralelas y las respectivas células de Purkinje. La función atribuida a la fibra trepadera fue de activar incondicionalmente la célula de Purkinje favoreciendo el proceso (Houk et al., 1996). Albus propuso el opuesto, que la fuerza sináptica sería disminuida mediante un mecanismo llamado depresión de larga-duración (DLD) que dependería de tres eventos ocurriendo simultáneamente: uno input de la fibra trepadera (señal de entrenamiento), disparo de la célula de Purkinje y la actividad sináptica de las fibras paralelas. Reforzando tal estrategia hallazgos adicionales demostraron que la actividad de fibras trepaderas es modulada durante las fases de aprendizaje, y que esa modulación, mediante inhibición heterosináptica, reduce la fuerza de los inputs de las fibras musgosas para la célula de Purkinje (Kandel et al., 1995). La actividad de la célula de Purkinje cuando reducida permite una desinhibición de los núcleos profundos del cerebelo (vía de salida del circuito), lo que en última instancia, influenciará la ejecución de los patrones de movimiento. Sumariando esas observaciones, parece ser más probable que la actividad de las fibras trepaderas, cuando asociada a otros factores, produzca una DLD a contrapelo de PLD (Ito, 1989). Algunos experimentos están examinando la función de fibras musgosas y trepaderas durante aprendizaje motora. La actividad de esas fibras fue captada en diferentes fases del entrenamiento expresando aspectos particulares de cada una de estas (Striedter, 1998; Thach, 1998). En condición constante y previsible el movimiento fue acompañado por flotaciones estereotipada de picos simples a partir de inputs de fibras musgosas con picos complejos, a partir de las fibras trepaderas, ocurriendo ocasionalmente y de forma intercalada (Thach, 1998). Cuando la condición fue alterada inesperadamente (evocando aprendizaje), la frecuencia de los picos complejos aumentó drásticamente al mismo paso en que la de picos simples disminuyó gradualmente. Tras varios intentos de entrenamiento, con los sujetos (monos) se ajustando a la nueva condición, la frecuencia de los picos complejos retornó a los niveles de control. Sin embargo, los picos simples permanecieron abajo de la línea de base (Kandel et al., 1995). Eso sugiere que la modulación de la actividad de las fibras trepaderas, durante el aprendizaje, reduce por inhibición heterosináptica la fuerza de los inputs de las fibras musgosas para las células de Purkinje, ajustándolas a la nueva condición de movimiento (ver: Barmack & Yakhnitsa, 2002; Ebner, 1998). La señal de entrenamiento de las fibras trepaderas Como descrito anteriormente, las FT surgen de núcleos de oliva inferior y llegan a la corteza cerebelar donde establecen contacto directo con células de Purkinje (Houk et al., 1996). Muchas teorías del cerebelo asumen que esas fibras transmitan informaciones de entrenamiento que guían el proceso de aprendizaje motora (Houk et al., 1996; Striedter, 1998). Sin embargo, hay divergencias entre los modelos teóricos con respecto a la naturaleza específica de esas informaciones. Marr (1969) asumió que, a través de las FT, la oliva inferior transmite instrucciones específicas de la corteza motor, designando cuáles los movimientos elementales necesitan ser ejecutados. Pero tal propuesta no esclarece como la corteza motor adquiere tal conocimiento elaborado sobre un vasto conjunto de movimientos 94 requeridos (Houk et al., 1996). Albus (1971) adoptó que oliva inferior compara retroalimentaciones sensoriales con trayectorias deseadas de movimiento, a fin de señalizar errores en la actuación. Ambas las teorías son cuestionables por no abordar como los patrones internos pueden ser adquiridos (Houk et al., 1996). Más adelante, análisis electrofisiológicas a partir de neuronas de oliva inferior o de suyas FT (axones) posibilitaron informaciones útiles sobre el tipo de información de entrenamiento aquí discutida. En las diferentes regiones de oliva inferior llegan varias combinaciones de fibras sensoriales y ramos colaterales de fibras motoras los cuales traen una especie de copia de las informaciones eferentes que se traducen en respuestas motoras (Bloedel & Courville, 1981). Tal hallado, sumado a otros factores, llevó a la hipótesis de que oliva inferior calcula señales de error oriundos a la copia de la eferencia (Oscarsson, 1980). Sin embargo, tal modelo se presenta limitado cuanto sus posibilidades de demostración. Otra hipótesis atribuye a la corteza motor la función de control de retroalimentaciones simples, recibiendo él mismo las señales de la trayectoria objetivada (a partir de la corteza de asociación) y comparando con informaciones de la trayectoria actual suministradas por retroalimentación sensorial. La diferencia entre trayectorias permite a la corteza motor generar una referencia de error que será propagada a través de oliva inferior, providenciando señal de entrenamiento para el cerebelo (Kawato & Gomi, 1992). Este modelo es cuestionado por desconsiderar la naturaleza sensorial de oliva inferior como sugerido por los análisis electrofisiológicas (Houk et al., 1996). En su modelo generador de patrones ajustabais, Houk y Barto (1992) habían asumido la naturaleza sensorial de oliva inferior señalizando como una base para la generación de información de entrenamiento. Consideraron tal señal de entrenamiento derivado de propiedades somato sensoriales simple, lo que favorece una explicación de como los patrones internos son generados (Houk et al., 1996). Células táctiles responden al contacto sobre un campo receptivo en la superficie del miembro y células propioceptivas responden al movimiento del miembro en una dirección particular. Tais respuestas son reprimidas durante ciertas fases del movimiento, y la represión es atribuida a un mecanismo de refinamiento, por acción inhibitoria, que es controlado por la señal de la copia eferente. Respuestas táctiles son inhibidas justamente tras un mando motor cesar, eliminando respuestas de contacto que, de otra forma, permanecerían hasta el final de uno movimiento necesito. Así, las respuestas pueden ser inhibidas cuando el miembro chocar sin deseo con algún objeto durante el movimiento, constituyendo un simple índice de error motor (Houk et al., 1996). Cuánto a las respuestas táctiles, estas son inhibidas durante el movimiento, lo que es dicho a acontecer solamente en fase primaria del movimiento, quedando la HOLA responsable durante los movimientos correctivos secundarios. Como las neuronas propioceptivos están vueltos para diferentes direcciones de movimiento, diferentes unidades en el sistema detectan diferentes direcciones de movimientos correctivos. Eso posibilita una forma de supervisar la información de entrenamiento en el respectivo modelo (Houk et al., 1996). Aprendizaje motora induciendo plasticidad cerebelar Uno considerable número de experimentos está demostrando el aspecto de plasticidad sináptica en poblaciones adultas de ratones sometidos la tareas motoras complejas que exigen coordinación y balance. La aprendizaje de tareas de esa naturaleza Fit Perf J, Rio de Janeiro, 2, 2, 94, mar/abr 2003 (acrobáticas) es tenida como capaz de producir una profunda remodelaje en la red interconectiva intrínseca a la corteza cerebelar (Kleim et al., 1998). Tal aspecto fue investigado en un área de la corteza cerebelar que recibe inputs somato sensorial y proproceptivo de los miembros anterior y posterior del animal: el lóbulo paramedio (Anderson et al., 1996; Krutki & Mrowczynski, 2002; Klintsova et al., 2002). Hay entre los experimentos aquel que también investigó se alteraciones similares ocurrirían en uno de los blancos primarios de los outputs de ese área, el núcleo dentado, sin embargo, no habían sido encontradas modificación estructurales en el mismo (Kleim et al., 1998a). Tal resultado sugiere, entonces, que las alteraciones sinápticas estructurales relacionadas al cerebelo son selectivas a las regiones corticales y que la participación del núcleo dentado sería la de retransmitir los comandos resultantes de esa posible reorganización cortical. Aplicación de las tareas experimentales En los diversos experimentos los modelos animales son generalmente sometidos la una entre cuatro condiciones de entrenamiento con duración variando entre 15 y 30 días (Anderson et al., 1996 & Kleim et al., 1998). En la condición acrobática (CA) las tareas consisten en atravesar trillas de obstáculos que requieren considerable grado de coordinación y balance como: puentes planas que progresivamente se estrechan, cuerdas en la vertical (escaleras de mano), puente móvil utilizando una corriente (extendida de una punta a la otra), caminos con barreras en suspensión etc. Los obstáculos aumentan en número y grado de dificultad a lo largo del entrenamiento, en un modo que el primer día empieza por una tarea simple y progresa para un total de aproximadamente siete tareas complejas hasta el último día (Anderson et al., 1996). La condición de ejercicio intenso (EH) envolvía una caminada rápida (10m/min.) sobre una esterilla rodante motorizada, iniciando con una duración de 5min. en el primer día y aumentando gradualmente para 60min. en el transcurrir de los días. Otra fue la condición de ejercicio voluntario (EV) con los ratones permaneciendo en jaulas que los posibilitaban se ejerciten en ruedas de corrida. Ellos estuvieron libres para correr durante cualquier momento que quisiesen (Anderson et al., 1996). Finalmente es empleada una condición inactiva (CI) en que los ratones no tenían la oportunidad de aprendizaje o de otros ejercicios además de los posibles dentro de sus jaulas. Variables dependientes comportamentales Una de las variables aquí analizadas se refiere a la cantidad de errores de los animales durante el proceso de aprendizaje de las tareas acrobáticas. Fue constatado un considerable efecto del día de entrenamiento sobre la actuación de los ratones (Jones et al., 1999 & Kleim et al., 1998b). Uno de los estudios relata una media de 20 errores/intento en el primer día de la tarea y menos que 1 error/intento para los períodos finales del entrenamiento (Kleim et al., 1998a). Eso indica una pronunciada cantidad de aprendizaje durante todo el periodo de entrenamiento. Otra variable a ser discutida es el tiempo requerido para completar la tarea (latencia) que análogamente a la primera, sufre una reducción en el transcurrir del entrenamiento (Kleim et al., 1998la; Kleim et al., 1998b & Jones et al., 1999). Registros del primer día de entrenamiento citan una latencia media de 45s para conclusión de la tarea por el grupo de la CA, disminuyendo para menos de 20s al trigésimo día (Kleim et al., 1998b). Otro estudio comparó un grupo de ratones con lesiones producidas en áreas de la corteza sensorio-motora representativas de los miembros anteriores, con el respectivo grupo Fit Perf J, Rio de Janeiro, 2, 2, 95, mar/abr 2003 control. Las reducciones en número de errores y latencia resultantes del entrenamiento de habilidades acrobáticas fueron también a partir de esas observadas (Jones et al., 1999). Variables dependientes celulares Finalizada la fase de entrenamiento el procedimiento subsiguiente pasa a ser la remoción de los lóbulos paramedios izquierdo y derecho en el modelo animal y preparación para análisis al microscopio electrónico. Con el auxilio de una cámara lúcida fue retirada una franja de camada molecular comprendida entre la piamáter y la camada de Purkinje a partir de la cual fue hecha la colecta de dados (Anderson et al., 1996). Variables como: el número total de sinapsis, el número de sinapsis de fibras paralelas y lo número de sinapsis de fibras trepaderas, todas estas estando basadas en el volumen referente a una célula de Purkinje, se habían presentado como las variables más conclusivas para esta parte del estudio. La clasificación de los diferentes tipos sinápticos del cerebelo tiene se realizado por medio de las características morfológicas de los diferentes componentes pre-sinápticos y polvos-sinápticos. Las fuentes primarias más utilizadas son: Palay & Chan-Palay (1974), Larramendi & Victor (1967) y Ecles, Ito & Szengothai (1967). Se relacionando a la clasificación de los componentes presinápticos, surgen los terminales de fibras paralelas que son identificados por su citoplasma claro, 2-3 microtúbulos cortados transversalmente y pequeñas mitocondrias. Tais terminales son de pequeños la medianos en el tamaño y tienen pequeñas vesículas redondas (Anderson et al., 1996). Los terminales de fibras trepaderas tienen grandes vesículas redondas que están densamente agrupadas. Son terminales que frecuentemente contactan varias espinas en un plano de sección. En la categoría inhibitoria hay los terminales de células en cesto que son anchos y presentan muchos neurofilamentos, sus vesículas redondas y elipsoidales están largamente agregadas y la rendija sináptica tiene como máximo el tamaño del espacio intersticial. Por vez, los terminales de células estrelladas poseyendo también vesículas redondas y elipsoidales se diferencian de las últimas con respecto al tamaño de las rendijas, que en este caso, son mayores que los espacios intersticiales usuales. Por último, los terminales de las células de Purkinje contienen vesículas achatadas y redondas a través de anchos terminales (Anderson et al., 1996). Cuánto a la clasificación de los componentes polvos-sinápticos, esto dice respeto a las dendritas de las células de Purkinje y a las dendritas provenientes de interneuronas inhibitorios (Kleim et al., 1998b). Los primeros son intensamente circundados por glías formando un dobladillo y presentan una cisterna submembrana extensiva. A todo esto, las dendritas de los interneuronas son circundados por una pequeña cantidad de glías y suyas cisternas submembranas son intercaladas (Kleim et al., 1998b). Es todavía mencionado que las dendritas a partir de los interneuronas tienen un citoplasma oscuro con una mayor densidad de microtúbulos que las dendritas de las células de Purkinje (Anderson et al., 1996). Los perfiles que no se encajaron en ninguna de las categorías mencionadas tiene como salida sean clasificados como procesos pre o polvos-sinápticos desconocidos. Remodelaje en la corteza cerebelar asociada a la naturaleza de la tarea En consenso, estudios evidenciaron un aumento sustancial en el número de sinapsis de fibras paralelas/células de Purkinje, en el grupo de la CA en relación a los de las condiciones de EH, EV y 95 CI (Anderson et al., 1996 & Kleim et al., 1998b). Cuánto a las sinapsis de fibras trepaderas/células de Purkinje, los estudios presentaron resultados diferenciados. Anderson (1996) observó en su trabajo un considerable aumento en el número de esas sinapsis entre el grupo de la CA, comparado a los de más. Por otro lado, Kleim (1998b) relata no tener observado alteraciones en otro tipo sináptico sin ser el de las fibras paralelas. Una posible explicación para tal discrepancia es que solamente en el trabajo de la primera autora la camada molecular fue observada desde la periferia hasta sus áreas más profundas. Por cuenta de eso, ella puede haber encontrado regiones más ricas en sinapsis de fibras trepaderas, las cuales no pudieron ser observadas a través de las estrategias del segundo experimento (Kleim et al., 1998b). El número total de sinapsis en el volumen de tejido referente a una célula de Purkinje tuvo considerable aumento, sobre todo por cuenta de las sinapsis de fibras paralelas. Ellas representan el tipo más abundante de la corteza cerebelar y su distribución original dentro de la referencia de volumen utilizada representaba 78% de las sinapsis (Anderson et al., 1996). Sinapsis de fibras trepaderas pueden tener contribuido mucho modestamente, ellas que representaban, inicialmente, sólo 2% del total. Aumento en otros tipos sinápticos no habían sido evidenciados (Kleim et al., 1998b & Anderson et al., 1996). CONCLUSIÓN Según los creídos, el cerebelo consiste en una estructura importantemente relacionada con la adquisición de nuevos patrones de movimientos. Sus propiedades integran los aspectos sensoriales y motores en pro de ejecuciones motoras eficaces hacen de él una estructura esencial a las tareas diarias. Además de eso, sus funciones demuestran ser retroalimentadas por la propia ejecución de movimientos con naturaleza particular. Trabajos variados apuntan la posibilidad a través del aprendizaje de habilidades motoras complejas (acrobáticas exigiendo balance y coordinación), pero no las simples, de promover adaptaciones localizadas en la corteza cerebelar. Tales adaptaciones son responsables por perfeccionar el ambiente que conduce las coordinadas sobre los patrones motores sean ejecutados en respuesta a la demanda de las tareas aprendidas. Cuánto a los mecanismos neurofisiológicos de ese aspecto plástico los resultados experimentales indican el aumento del número de contactos sinápticos de fibras paralelas con la célula de Purkinje como el factor responsable. La confirmación de esa hipótesis invalida la idea del aprendizaje motora deberse al aumento en la eficacia de sinapsis individuales como propuesto por Mar y Albus. Finalmente, el aumento del número de sinapsis entre las fibras trepaderas y las células de Purkinje observado en uno de los experimentos es algo a ser mejor investigado. Se confirmado, tal aspecto podría representar un aumento en la velocidad con que nuevos patrones motores son incorporados por el sistema. REFERENCIAS Albus, J. (1971). A theory of cerebellar function. Biosci, 10: 25-61. Anderson, B., Alcântara, A. & Greenough, T. (1996). Motor-skill learning: changes in synaptic organization of the rat cerebellar cortex. Neurobiology of learning and memory, 66: 221-229. Baker, M., Javid, M. & Edgley, S. (2001). Activation of cerebellar climbing fibres to rat cerebellar posterior lobe from motor cortical output pathways. J physiol, 536 (3): 825-839. Barmack, N. & Yakhnitsa, V. (2002). Vestibularly evoked climbing-fiber responses modulate simple spikes in rabbit cerebellar Purkinje neurons. Ann NY acad sci, 978: 237-254. Bloedel, J. & Courville, J (1981). Cerebellar afferent systems. In: J. Brookhart., V. Mountcastle., V. Brooks. & S. Geiger (eds) Handbook of physiology, V. 2. American physiological society, pp 735-829. 96 Blomfield, S. & Marr, D. (1970). How the cerebellum may be used. Nature, 227: 1224-1228. Daz, C. & Puelles, L. (2003). Plurisegmental vestibulocerebellar projections and other hindbrain cerebellar afferents in midterm chick embryos: biotinylated dextranamine experiments in vitro. Neuroscience, 117 (1): 71-82. Ebner, T. (1998). A role for the cerebellum in the control of limb movement velocity. Curr opin neurobiol, 8 (6): 762-769. Eccles, J., Ito, M. & Szengothai, J. (1967). The cerebellum as a neuronal machine. New York: Springer-Verlag. Gartwaite, J. & Brodbelt, A (1990). Glutamate as the principal mossy fibre transmitter in rat cerebellum: pharmacological evidence. Eur j neirosci, 2 (2): 177-180. Houk, J. & Barto, A. (1992). Distributed sensorimotor learning. In: G. Stelmach & J. Requin (eds). Tutorials in motor behavior II. Amsterdam, Elsevier, pp 71-100. Houk, J., Buckingham, J. & Barto, A. (1996). Models of the cerebellum and motor learning. Behavioral and brain sciences, 19 (3): 368-383. Huesa, G., Anadon, R. & Yanez, J. (2003). Afferent and efferent conections of the cerebellum of the chondrostean acipenser baeri: a carbocyanine dye (Dil) tracing study. J. comp neurol, 460 (3): 327-344. Ito, M. (1970). Neurophysiological aspects of the cerebellar motor control system. Int j neurology, 7: 162-176. Ito, M. (1989). Long-term depression. Ann rev neurosc, 12: 85-102. Ito, M. (2000). Mechanisms of motor learning in the cerebellum. Brain research, 886: 237-245. Jones, T., Chu,C., Grande, L. & Gregory, A. (1999). Motor skills training enhances lesioninduced strutural plasticity in the motor cortex of adult rats. The journal of neuroscience, 19 (22): 10153-10163. Kandel, E., Scwartz, J. & Jessell, T. (1995). Essential of neural science and behavior. Rio de Janeiro: Prentice Hall. Kawato, M. & Gomi, H. (1992). A computational model of four regions of the cerebellum based on feedback-errorlearning. Biological cibernetics, 68: 95-103. Kleim, J., Pipitone, M., Czerlanis, C. & Greenough, T. (1998 a). Strutural stability within the lateral cerebellar núcleos of the rat following complex motor learning. Neurobiology of learning and memory, 68: 290-306. Kleim, J., Swain, R., Armstrong, K., Napper, R., Jones, T. & Greenough, W. (1998b). Selective sinaptic plasticity within the cerebellar cortex following complex motor skill learning. Neurobiology of learning and memory, 69: 274-289. Klintsova, A., Scamra, C., Hoffman, M., Napper, R., Goodlett, C. and Greenough, W. (2002). Therapeutic effects of complex motor training on motor performance deficits induced by neonatal binge-like alcohol exposure in rats: II. A quantitative stereological study of synaptic plasticity in female rat cerebellum. Brain research, 937: 83-93. Krutki, P. & Mrowczynski, W. (2002). Afferent input from distal forelimb nerves to branching spinoreticular-spinocerebellar neurones in the cat. Acta neurobiol exp, 62 (4): 271-276. Lang, E. (2001). Organization of olivocerebellar activity in the absence of excitatory glutamatergic input. J neurosci, 21 (5): 1663-1675. Larramendi, L. & Victor, T. (1967). Sinapses on the Purkinje cell spines in the mouse: a electron microscopic study. Brain research, 5: 15-30. Lent, R. (2001). Cem bilhões de neurônios: conceitos fundamentais da neurociência. São Paulo: Atheneu. Marr, D. (1969). A theory of cerebellar cortex. J physiology London, 202: 437-470. Oscarsson, O. (1980). Functional organization of olivary projection to cerebellar anterior lobe. In: J. Courville., C. de Montigney., Y. Lamarre (eds). The inferior olivary nucleus: anatomy and physiology. New York: Raven press, pp 279-289. Palay, S. & Chan- Palay, V. (1974). Cerebellar cortex: citology and organization. New York: Springer-Verlag. Ruigrok, T. & Vood, J. (2000). Organization of projection from the inferior olive to the cerebellar nuclei in the rat. J comp neurol, 426 (2): 209-228. Serapide, M., Panto, M., Parenti, R., Zappala, A. & Cicirata, F. (2001). Multiple zonal projections of the basilar pontine nuclei to the cerebellar cortex of the rat. J comp neurol, 430 (4): 471-484. Striedter, G. (1998). A comparative perspective on motor learning. Neurobiology of learning and memory, 70: 189-196. Takacs, J. & Metzger, F. (2002). Morphological study of organotypic cerebellar cultures. Acta biol hung, 53 (1-2): 187-204. Thach, W. (1998). A role for the cerebellum in learning movement coordination. Neurobiology of learning and memory, 70: 177-188. Tsukahara, N., Korn, H. & Stone, J. (1968). Pontine relay from cerebral cortex to cerebellar cortex and nucleus interpositus. Brain res, 10: 448-453. Ungerleider, L., Doyon, J. and Karni, A. (2002). Imaging brain plasticiy during motor skill learning. Neurobiology of learning and memory, 78: 553-564. Fit Perf J, Rio de Janeiro, 2, 2, 96, mar/abr 2003