CRISTALES IONICOS
Anuncio

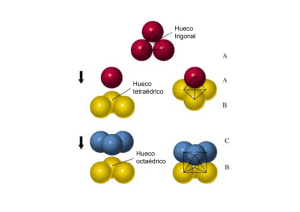
CRISTALES IONICOS Formalismo de empaquetamientos CUBICA SIMPLE HUECO CÚBICO 1 PARTÍCULA : 1 HUECO CUBICA COMPACTA HUECO OCTAEDRICO HUECO TETRAEDRICO 1 PARTÍCULA : 1 HUECO OCTAEDRICO : 2 HUECOS TETRAEDRICOS Estructura del NaCl Na+ en 1 hueco octaédrico Na+ en 1 hueco octaédrico 12 huecos de esta clase en los 1 hueco de esta clase en el centro 12 lados de la celda unidad de la celda unidad (total 3 huecos) Huecos octaédricos en un celda centrada en las caras (total 4) Celda unidad del NaCl Estructura del ZnS Red cúbica centrada en las caras de iones S2- Iones Zn2+ en la mitad de los huecos tetraédricos Estructura del CsCl Radio del Cl-= 181 pm Iones Cl- en cada esquina = 1 ión Cl- neto en la celda unidad Empaquetamiento de iones Cl- y Cs+ en el hueco de la red Radio del Cs+=165 pm Un ión Cs+ en cada esquina del cubo da un ión Cs+ neto en la celda unidad Empaquetamiento de iones Cs+ y Clen el hueco de la red Especies 1:1 Radio Catión Radio Anión Estructura Tipo Número de Coordinación 0,22-0,41 0,41-0,73 0,73-1,00 ZnS (blenda) NaCl CsCl 4 6 8 Estructura del CaF2 Especies 1:2 con r(catión)/r(anión) entre 0,73 y 1,00 Entalpías de red y ciclo de Born-Habber Electro afinidad Energía de red Energía de ionización Energía de ionización Energía de formación Electro afinidad Energía de red CICLO DE BORN-HABER Entalpía de red: NaCl(s) Na+(g) + Cl-(g) HL = +786 kJ/mol Na+ + Cl(g) + e-(g) NaCl(s) Energías reticulares en Kj/mol F- Cl- Br- I- Li+ 1036 853 807 757 Na+ 923 787 747 704 K+ 821 715 682 649 Rb+ 785 689 660 630 Cs+ 740 659 631 604 Energías reticulares en Kj/mol OH- O2- Na+ 900 2481 Mg2+ 3006 3791 Al3+ 5627 15.916