Examen de Reactivo Limitante
Anuncio

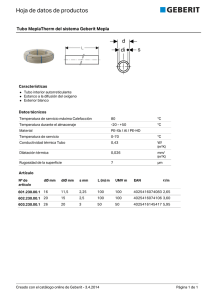
Examen de Reactivo Limitante Alumno: ______________________________________________________________ 1.- ¿Qué volúmenes de soluciones 0.3 M de cromato de potasio y nitrato de plomo necesitaríamos mezclar para obtener 323 mg de cromato de plomo?. Escriba la reacción balanceada. PM: (K2CrO4 = 194gmol-1); (Pb(NO3)2 = 331.2 gmol-1); (PbCrO4 =323.2 gmol-1) 2.- Se tiene la siguiente reacción en el laboratorio: Pb(NO3)2 + K2CrO4 PbCrO4 + 2 KNO3 Se coloca un volumen constante de Pb(NO3)2 0.5M(A) en cada tubo y luego se agregan cantidades diferentes de K2CrO4 1M (B), tal como se muestra en la siguiente tabla. Tubo mLA mLB 1 15 1 2 15 3 3 15 5 4 15 7 5 15 9 6 15 11 7 15 13 8 15 15 9 15 17 10 15 19 11 15 21 12 15 23 a) Calcule el número de moles que reaccionan de cada reactivo en cada tubo, y diga cuál es el reactivo limitante en cada tubo. b) Calcule la cantidad en g de precipitado obtenido para cada tubo. Examen de Reactivo Limitante Alumno: ______________________________________________________________ 1.- ¿Qué volúmenes de soluciones 0.3 M de cromato de potasio y nitrato de plomo necesitaríamos mezclar para obtener 323 mg de cromato de plomo?. Escriba la reacción balanceada. PM: (K2CrO4 = 194gmol-1); (Pb(NO3)2 = 331.2 gmol-1); (PbCrO4 =323.2 gmol-1) 2.- Se tiene la siguiente reacción en el laboratorio: Pb(NO3)2 + K2CrO4 PbCrO4 + 2 KNO3 Se coloca un volumen constante de Pb(NO3)2 0.5M(A) en cada tubo y luego se agregan cantidades diferentes de K2CrO4 1M (B), tal como se muestra en la siguiente tabla. Tubo mLA mLB 1 15 1 2 15 3 3 15 5 4 15 7 5 15 9 6 15 11 7 15 13 8 15 15 9 15 17 10 15 19 11 15 21 12 15 23 a) Calcule el número de moles que reaccionan de cada reactivo en cada tubo, y diga cuál es el reactivo limitante en cada tubo. b) Calcule la cantidad en g de precipitado obtenido para cada tubo.