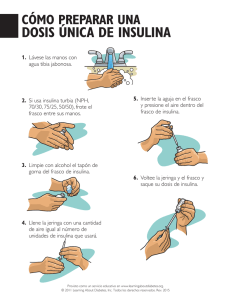
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Anuncio

ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Nombre patentado del medicamento HUMALOG® viales (40 U/ml, 10 ml) 2. Composición cualitativa y cuantitativa HUMALOG® es una solución estéril, clara, incolora y acuosa de insulina lispro ([Lys (B28), Pro (B29)] análogo de la insulina humana (origen rDNA) con un pH ajustado a 7,0 - 7,8. El nombre insulina lispro ha sido aprobado como D.C.I, como BAN en Gran Bretaña y como USAN en Estados Unidos. Principio activo Insulina lispro (origen DNA recombinante producida en E. coli) Cantidad por ml 40U La concentración de insulina lispro es de 1,4 mg de insulina lispro por ml para el producto de 40 U/ml. 3. Forma farmacéutica Solución inyectable en un vial de 10 ml (40 U/ml de insulina lispro) para usar junto con una jeringa adecuada (con marcas para 40 U) para administración parenteral 4. Datos clínicos 4.1. Indicaciones terapéuticas Para el tratamiento de los pacientes con diabetes mellitus que requieren insulina para el mantenimiento de la homeostasia normal de la glucosa. HUMALOG® también está indicado en la estabilización inicial de la diabetes mellitus. HUMALOG® es una insulina, de acción corta, y puede ser utilizada en combinación con una insulina humana de acción prolongada. HUMALOG® está indicado para su administración antes de las comidas. 4.2 Posología y forma de administración La dosis debe ser determinada por el médico, según los requerimientos del paciente. Los preparados de HUMALOG® deben ser administrados por inyección subcutánea y pueden, aunque no es recomendable, ser administrados por inyección intramuscular. La administración subcutánea debe realizarse en la zona superior de los brazos, muslos, nalgas o abdomen. La utilización de estas zonas de inyección debe alternarse, de tal forma que un mismo lugar de inyección no sea utilizado aproximadamente más de una vez al mes. Cuando se utilice HUMALOG®, la inyección se debe realizar teniendo la precaución de que no se haya penetrado un vaso sanguíneo. Después de la inyección, no debe realizarse masaje de la zona de inyección. 4 HUMALOG® actúa con rapidez y tiene una duración de acción más corta (2 a 5 horas) cuando se compara con insulina regular. Este rápido comienzo de acción permite a HUMALOG® ser administrado muy próximo a las comidas. El perfil de acción de cualquier insulina puede variar considerablemente entre diferentes personas o en diferentes momentos dentro de una misma persona. Como sucede con todos los preparados de insulina, la duración de los efectos de HUMALOG® depende de la dosis, lugar de inyección, perfusión sanguínea, temperatura y del ejercicio físico. HUMALOG® puede ser administrado en combinación con una insulina humana de acción prolongada, según criterio facultativo. 4.3. Contraindicaciones Hipoglucemia. Hipersensibilidad a insulina lispro o a alguno de sus excipientes. 4.4. Advertencias y precauciones especiales de empleo La decisión de modificar el tipo o marca de insulina administrada a un paciente, debe tomarse bajo estricta supervisión médica. Los cambios en la concentración, nombre comercial (fabricante), tipo (Regular, NPH, Lenta, etc.), especie (animal, humana, análogo de insulina humana) y/o método de fabricación (técnicas de DNA recombinante frente a insulina de origen animal) pueden dar lugar a la necesidad de un cambio en la dosis. El preparado de acción más corta HUMALOG®, debe introducirse primero dentro de la jeringa para evitar la contaminación del vial por la insulina de acción retardada. La mezcla por adelantado de las insulinas o inmediatamente antes de la inyección dependerá de las indicaciones del médico. Sin embargo, se debe seguir una rutina consecuente. Los pacientes tratados con HUMALOG® pueden requerir un cambio en la dosis con respecto a la utilizada con sus insulinas habituales. Si fuese necesario hacer algún ajuste éste podría producirse con la primera dosis o durante las primeras semanas o meses. Los pacientes cuyo control glucémico está muy mejorado, por ejemplo mediante pautas insulínicas intensificadas, pueden perder alguno o todos los síntomas de alarma de hipoglucemia por lo que deben ser convenientemente informados. Algunos pacientes que han experimentado reacciones hipoglucémicas tras el cambio de insulina animal a insulina humana han comunicado que los síntomas tempranos de alarma de hipoglucemia fueron menos pronunciados o diferentes de los que experimentaban con su insulina previa. La falta de corrección de las reacciones hipoglucémicas o hiperglucémicas puede ser causa de pérdida de conciencia, coma o éxitus. Los requerimientos de insulina pueden disminuir en presencia de un deterioro renal o hepático. Los requerimientos de insulina pueden aumentar durante una enfermedad o por alteraciones emocionales. Puede ser también necesario un ajuste de la dosis de insulina si los pacientes aumentan su actividad física o modifican su dieta habitual. El ejercicio físico realizado inmediatamente después de las comidas puede aumentar el riesgo de hipoglucemia. 5 4.5. Interacciones con otros medicamentos y otras formas de interacción Los requerimientos de insulina pueden aumentar debido a la administración concomitante de medicamentos con actividad hiperglucemiante, tales como los anticonceptivos orales, corticosteroides o tratamiento sustitutivo con hormona tiroidea, danazol, estimulantes beta 2 (ritodrina, salbutamol, terbutalina). Los requerimientos de insulina pueden disminuir en presencia de medicamentos con actividad hipoglucemiante, tales como los hipoglucemiantes orales, salicilatos (por ejemplo, aspirina), sulfamidas y ciertos antidepresivos, ciertos inhibidores del enzima convertidor de angiotensina (captopril, enalapril), betabloqueantes, octreotrida, alcohol. HUMALOG® no debe mezclarse con insulinas animales. El médico debe ser consultado cuando se utilicen otros medicamentos además de HUMALOG®. 4.6. Uso en embarazo y lactancia No hay experiencia significativa sobre el uso de HUMALOG® durante el embarazo. Es esencial mantener un buen control de las pacientes tratadas con insulina (diabetes insulinodependiente o diabetes gestacional), a lo largo de todo el embarazo. Los requerimientos de insulina habitualmente disminuyen durante el primer trimestre y se incrementan durante el segundo y tercer trimestres. Debe aconsejarse a las pacientes con diabetes que informen a sus médicos si están embarazadas o están contemplando la posibilidad de un embarazo. Una cuidadosa monitorización del control glucémico, así como de la salud general, son esenciales en las pacientes embarazadas con diabetes. Las pacientes diabéticas, durante el periodo de lactancia, pueden requerir un ajuste de la dosis de insulina, de la dieta o de ambas. 4.6a. No hay experiencia significativa con HUMALOG® en niños menores de 12 años. 4.7. Efectos sobre la capacidad para conducir y utilizar maquinaria El uso de dosis terapéuticas correctas no tiene efectos conocidos sobre la capacidad para conducir o para la utilización de maquinaria. 4.8. Reacciones adversas La hipoglucemia es la reacción adversa que con más frecuencia puede sufrir un paciente diabético. Una hipoglucemia grave puede conducir a la perdida de conciencia y en casos extremos, a exitus. Ocasionalmente, una alergia local en los pacientes se manifiesta como enrojecimiento, hinchazón y picor en el lugar de inyección de la insulina. En general, esta situación remite al cabo de unos días o semanas. A veces, esta reacción puede ser debida a factores distintos a la insulina, tales como irritantes en el agente limpiador de la piel o a una mala técnica de inyección. La alergia sistémica, menos común pero potencialmente más grave, es una alergia generalizada a la insulina. Puede producir una erupción en todo el cuerpo, dificultad respiratoria, respiración jadeante, disminución de la presión arterial, aceleración del pulso o sudoración. Los casos graves de alergia generalizada pueden poner en peligro la vida del enfermo. Puede aparecer lipodistrofia en el lugar de inyección. 4.9. Sobredosificación 6 Las insulinas no tienen una definición específica de sobredosificación porque las concentraciones séricas de glucosa son el resultado de interacciones complejas entre los niveles de insulina, disponibilidad de glucosa y otros procesos metabólicos. La hipoglucemia puede producirse como resultado de un exceso de insulina o de insulina lispro en relación a la ingesta calórica y al gasto energético. La hipoglucemia puede estar asociada con apatía, confusión, palpitaciones, dolor de cabeza, sudoración y vómitos. Los episodios leves de hipoglucemia responderán a la administración oral de glucosa, azúcar u otros productos azucarados. La corrección de un episodio de hipoglucemia moderadamente grave puede realizarse mediante la administración intramuscular o subcutánea de glucagón, seguida de la administración por vía oral de carbohidratos cuando la recuperación del paciente sea suficiente. Los pacientes que no respondan a glucagón, deben recibir una solución intravenosa de glucosa. Si el paciente está comatoso, debe administrarse glucagón por vía subcutánea o intramuscular. Sin embargo, si no se dispone de glucagón o el paciente no responde a glucagón, debe administrarse una solución de glucosa por vía intravenosa. El paciente debe recibir alimentos tan pronto como recobre la conciencia. 5. Propiedades farmacológicas 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: análogo de insulina humana de acción rápida. La principal acción de insulina lispro es la regulación del metabolismo de la glucosa. Además, las insulinas tienen diversas aciones anabólicas y anti-catabólicas sobre una variedad de diferentes tejidos. Dentro del tejido muscular se incluyen el incremento de glucógeno, ácidos grasos, glicerol, síntesis proteica y captación de aminoácidos, mientras que disminuye la glucogenolisis, gluconeogénesis, cetogénesis, lipolisis, catabolismo proteico y la perdida de aminoácidos. HUMALOG® tiene un comienzo de acción rápido (aproximadamente a los 15 minutos), lo que permite administrarlo más cercano a las comidas (desde cero a 15 minutos de la comida) cuando se compara con insulina regular (30 a 45 minutos antes). Los efectos de HUMALOG® se inician rápidamente y tienen una duración de acción más corta (2 a 5 horas) cuando se comparan con insulina regular. Como con todas los preparados de insulina, el perfil de acción de HUMALOG® puede variar entre diferentes individuos o en diferentes momentos en una misma persona y es dependiente del lugar de inyección, perfusión sanguínea, temperatura y ejercicio físico. El perfil típico de actividad tras la inyección subcutánea se ilustra a continuación. 7 Actividad hipoglucemiante Humalog Humulina Humalog Humulin R Hypoglycemic Activity 0 1 2 3 4 5 6 Time (hours) Tiempo (horas) Esta gráfica indica la cantidad de glucosa, con respecto a tiempo, necesaria para mantener en un individuo la concentración de glucosa en sangre total próxima a los niveles de ayuno, y es un indicador del efecto de estas insulinas en el tiempo sobre el metabolismo de la glucosa. 5.2. Propiedades farmacocinéticas La farmacocinética de HUMALOG® refleja un compuesto que es absorbido rápidamente, y alcanza niveles sanguíneos máximos entre los 30 a 70 minutos tras la inyección subcutánea. Cuando se considera la relevancia clínica de estas cinéticas, es más apropiado examinar las curvas de utilización de glucosa (como se expuso en el apartado Propiedades Farmacodinámicas). 5.3. Datos preclínicos sobre seguridad En tests in vitro, incluyendo estudios de unión a los receptores de insulina y efectos sobre células en crecimiento, HUMALOG® se comportó de una forma muy parecida a la insulina humana. Otros estudios demustran que la disociación de HUMALOG® respecto a la unión al receptor de insulina es equivalente a la de la insulina humana. Los estudios de la toxicología aguda, durante 1 mes, y durante 12 meses no revelaron datos de toxicidad significativos. 6. Datos farmacéuticos 6.1. Lista de excipientes Cada vial y cartucho contendrán insulina lispro y los siguientes excipientes: (a) m-Cresol destilado [3,15 mg/ml] (b); glicerol; (c) fosfato sódico dibásico.7H2O; (d) óxido de zinc; (e) agua para inyección; (f) ácido clorhídrico y (g) hidróxido sódico. 8 Todos ellos se incorporan como: (a) conservante y estabilizador; (b) modificador de la tonicidad del preparado; (c) tampón; (d) estabilizante; (e) disolvente; (f) para ajustar el pH y (g) para ajustar el pH, respectivamente. 6.2. Incompatibilidades Los preparados de HUMALOG® no se deben mezclar con preparados de insulina animal. 6.3. Periodo de validez Dos años, cuando se almacena en condiciones apropiadas. El periodo de validez en uso es de 28 días. 6.4. Precauciones especiales de conservación Los preparados de HUMALOG® se deben conservar en el refrigerador entre 2o y 8o C. Estos preparados no deben congelarse ni exponerse a temperaturas excesivas o a la luz solar. Si no fuera posible su refrigeración, el vial en uso, se puede mantener a la temperatura ambiente hasta 28 días, por debajo de 30o C y apartado de calor y luz directos. 6.5. Naturaleza y contenido del recipiente. La solución se envasa de manera aséptica en viales de vidrio flint Tipo I. El vidrio cumple los requerimientos de la Farmacopea. Europea. Los envases son sellados después con tapones de butilo o halobutilo. Se puede utilizar una emulsión de dimeticona o silicona para tratar los tapones de los viales. Los cierres se aseguran con sellos de aluminio. 6.6. Instrucciones de uso/manipulación a) Preparación de la dosis Inspeccionar el preparado HUMALOG®. Debe aparecer claro e incoloro. No utilizar nunca HUMALOG® si su aspecto es turbio, denso, o ligeramente coloreado o si son visibles partículas sólidas. a) HUMALOG® 1. Lávese las manos. 2. Si utiliza un frasco nuevo, levante la lengüeta protectora de plástico, pero no retire el tapón. 3. Si el régimen terapéutico requiere la inyección de insulina basal y HUMALOG® al mismo tiempo, ambos pueden ser mezclados en la jeringa. Si mezcla insulinas, consulte las normas sobre mezclas que se indican en el apartado. 4. Introduzca aire en la jeringa, en cantidad equivalente a la dosis de HUMALOG® prescrita. Frote la parte superior del frasco con un algodón y alcohol. Introduzca la jeringa a través del tapón de goma del frasco de HUMALOG® e inyecte el aire en su interior. 5. Invierta el frasco y la jeringa. Sujete el frasco y la jeringa firmemente en una mano. 6. Asegúrese de que la punta de la aguja se encuentra dentro de la solución de HUMALOG®, extraiga la dosis exacta con la jeringa. 9 7. Antes de retirar la aguja del frasco, compruebe que no existen burbujas de aire en la jeringa que disminuyan la cantidad de HUMALOG®. En caso de que advierta burbujas, mantenga la jeringa recta y golpee sobre un lado hasta que las burbujas asciendan a la parte superior. Elimínelas presionando el émbolo y extraiga luego la dosis correcta. 8. Retire la aguja del frasco y coloque la jeringa de manera que la aguja no toque nada. b) Mezcla de HUMALOG® con insulinas humanas de acción retardada 1. HUMALOG® se puede mezclar con insulinas humanas de acción retardada sólo por indicación de un médico. 2. Introduzca aire en la jeringa, en una cantidad equivalente a la de la insulina de acción retardada que será utilizada. Introduzca la aguja dentro del frasco de insulina de acción retardada e inyecte el aire. Retire la aguja. 3. A continuación, inyecte aire en el frasco de HUMALOG®, siguiendo el procedimiento anterior, pero no retire la aguja. 4. Invierta el frasco y la jeringa. 5. Compruebe que la punta de la aguja está dentro de la solución de HUMALOG®, y extraiga la dosis correcta de HUMALOG® en la jeringa. 6. Antes de retirar la jeringa del frasco, compruebe que no existen burbujas de aire en la jeringa que disminuyan la cantidad de HUMALOG®. En caso de que advierta burbujas, mantenga la jeringa recta y golpee sobre un lado hasta que las burbujas asciendan a la parte superior. Elimínelas presionando el émbolo y extraiga luego la dosis correcta. 7. Retire la aguja del frasco de HUMALOG® e introdúzcala en el frasco de la insulina de acción retardada. Invierta el frasco y la jeringa. Sujete el frasco y la jeringa firmemente en una mano y agite suavemente. Compruebe que la punta de la aguja está dentro de la solución de insulina, extraiga la dosis de insulina de acción retardada. 8. Retire la aguja y coloque la jeringa de manera que la aguja no toque nada. c) Mezclas de insulinas No se debe mezclar la insulina de los viales con la insulina de los cartuchos. 10 6.7. Nombre y dirección del titular de la autorización de comercialización El titular de la autorización de comercialización será Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. 7. Número de autorización de comercialización 8. Fecha de aprobación/revisión del SPC 11 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Nombre patentado del medicamento HUMALOG®viales (100U/ml, 10 ml) 2. Composición cualitativa y cuantitativa HUMALOG® es una solución estéril, clara, incolora y acuosa de insulina lispro ([Lys (B28), Pro (B29)] análogo de la insulina humana (origen rDNA) con un pH ajustado a 7,0 - 7,8. El nombre insulina lispro ha sido aprobado como D.C.I, como BAN en Gran Bretaña y como USAN en Estados Unidos. Principio activo Insulina lispro (origen DNA recombinante producida en E. coli) Cantidad por ml 100 U La concentración de insulina lispro es de 3,5 mg de insulina por ml para el producto de 100 U/ml. 3. Forma farmacéutica Solución inyectable en vial de 10 ml (100 U/ml de insulina lispro) para usar junto con una jeringa adecuada (con marcas para 100 U) para administración parenteral 4. Datos clínicos 4.1. Indicaciones terapéuticas Para el tratamiento de los pacientes con diabetes mellitus que requieren insulina para el mantenimiento de la homeostasia normal de la glucosa. HUMALOG® también está indicado en la estabilización inicial de la diabetes mellitus. HUMALOG® es una insulina, de acción corta, y puede ser utilizada en combinación con una insulina humana de acción prolongada. HUMALOG® está indicado para su administración antes de las comidas. 4.2 Posología y forma de administración La dosis debe ser determinada por el médico, según los requerimientos del paciente. Los preparados de HUMALOG® deben ser administrados por inyección subcutánea y pueden, aunque no es recomendable, ser administrados por inyección intramuscular. La administración subcutánea debe realizarse en la zona superior de los brazos, muslos, nalgas o abdomen. La utilización de estas zonas de inyección debe alternarse, de tal forma que un mismo lugar de inyección no sea utilizado aproximadamente más de una vez al mes. Cuando se utilice HUMALOG®, la inyección se debe realizar teniendo la precaución de que no se haya penetrado un vaso sanguíneo. Después de la inyección, no debe realizarse masaje de la zona de inyección. 12 HUMALOG® actúa con rapidez y tiene una duración de acción más corta (2 a 5 horas) cuando se compara con insulina regular. Este rápido comienzo de acción permite a HUMALOG® ser administrado muy próximo a las comidas. El perfil de acción de cualquier insulina puede variar considerablemente entre diferentes personas o en diferentes momentos dentro de una misma persona. Como sucede con todos los preparados de insulina, la duración de los efectos de HUMALOG® depende de la dosis, lugar de inyección, perfusión sanguínea, temperatura y del ejercicio físico. HUMALOG® puede ser administrado en combinación con una insulina humana de acción prolongada, según criterio facultativo. 4.3. Contraindicaciones Hipoglucemia. Hipersensibilidad a insulina lispro o a alguno de sus excipientes. 4.4. Advertencias y precauciones especiales de empleo La decisión de modificar el tipo o marca de insulina administrada a un paciente, debe tomarse bajo estricta supervisión médica. Los cambios en la concentración, nombre comercial (fabricante), tipo (Regular, NPH, Lenta, etc.), especie (animal, humana, análogo de insulina humana) y/o método de fabricación (técnicas de DNA recombinante frente a insulina de origen animal) pueden dar lugar a la necesidad de un cambio en la dosis. El preparado de acción más corta HUMALOG®, debe introducirse primero dentro de la jeringa para evitar la contaminación del vial por la insulina de acción retardada. La mezcla por adelantado de las insulinas o inmediatamente antes de la inyección dependerá de las indicaciones del médico. Sin embargo, se debe seguir una rutina consecuente. Los pacientes tratados con HUMALOG® pueden requerir un cambio en la dosis con respecto a la utilizada con sus insulinas habituales. Si fuese necesario hacer algún ajuste éste podría producirse con la primera dosis o durante las primeras semanas o meses. Los pacientes cuyo control glucémico está muy mejorado, por ejemplo mediante pautas insulínicas intensificadas, pueden perder alguno o todos los síntomas de alarma de hipoglucemia por lo que deben ser convenientemente informados. Algunos pacientes que han experimentado reacciones hipoglucémicas tras el cambio de insulina animal a insulina humana han comunicado que los síntomas tempranos de alarma de hipoglucemia fueron menos pronunciados o diferentes de los que experimentaban con su insulina previa. La falta de corrección de las reacciones hipoglucémicas o hiperglucémicas puede ser causa de pérdida de conciencia, coma o éxitus. Los requerimientos de insulina pueden disminuir en presencia de un deterioro renal o hepático. Los requerimientos de insulina pueden aumentar durante una enfermedad o por alteraciones emocionales. Puede ser también necesario un ajuste de la dosis de insulina si los pacientes aumentan su actividad física o modifican su dieta habitual. El ejercicio físico realizado inmediatamente después de las comidas puede aumentar el riesgo de hipoglucemia. 13 4.5. Interacciones con otros medicamentos y otras formas de interacción Los requerimientos de insulina pueden aumentar debido a la administración concomitante de medicamentos con actividad hiperglucemiante, tales como los anticonceptivos orales, corticosteroides o tratamiento sustitutivo con hormona tiroidea, danazol, estimulantes beta 2 (ritodrina, salbutamol, terbutalina). Los requerimientos de insulina pueden disminuir en presencia de medicamentos con actividad hipoglucemiante, tales como los hipoglucemiantes orales, salicilatos (por ejemplo, aspirina), sulfamidas y ciertos antidepresivos, ciertos inhibidores del enzima convertidor de angiotensina (captopril, enalapril), betabloqueantes, octreotrida, alcohol. HUMALOG® no debe mezclarse con insulinas animales. El médico debe ser consultado cuando se utilicen otros medicamentos además de HUMALOG®. 4.6. Uso en embarazo y lactancia No hay experiencia significativa sobre el uso de HUMALOG® durante el embarazo. Es esencial mantener un buen control de las pacientes tratadas con insulina (diabetes insulinodependiente o diabetes gestacional), a lo largo de todo el embarazo. Los requerimientos de insulina habitualmente disminuyen durante el primer trimestre y se incrementan durante el segundo y tercer trimestres. Debe aconsejarse a las pacientes con diabetes que informen a sus médicos si están embarazadas o están contemplando la posibilidad de un embarazo. Una cuidadosa monitorización del control glucémico, así como de la salud general, son esenciales en las pacientes embarazadas con diabetes. Las pacientes diabéticas, durante el periodo de lactancia, pueden requerir un ajuste de la dosis de insulina, de la dieta o de ambas. 4.6a. No hay experiencia significativa con HUMALOG® en niños menores de 12 años. 4.7. Efectos sobre la capacidad para conducir y utilizar maquinaria El uso de dosis terapéuticas correctas no tiene efectos conocidos sobre la capacidad para conducir o para la utilización de maquinaria. 4.8. Reacciones adversas La hipoglucemia es la reacción adversa que con más frecuencia puede sufrir un paciente diabético. Una hipoglucemia grave puede conducir a la perdida de conciencia y en casos extremos, a exitus. Ocasionalmente, una alergia local en los pacientes se manifiesta como enrojecimiento, hinchazón y picor en el lugar de inyección de la insulina. En general, esta situación remite al cabo de unos días o semanas. A veces, esta reacción puede ser debida a factores distintos a la insulina, tales como irritantes en el agente limpiador de la piel o a una mala técnica de inyección. La alergia sistémica, menos común pero potencialmente más grave, es una alergia generalizada a la insulina. Puede producir una erupción en todo el cuerpo, dificultad respiratoria, respiración jadeante, disminución de la presión arterial, aceleración del pulso o sudoración. Los casos graves de alergia generalizada pueden poner en peligro la vida del enfermo. Puede aparecer lipodistrofia en el lugar de inyección. 4.9. Sobredosificación 14 Las insulinas no tienen una definición específica de sobredosificación porque las concentraciones séricas de glucosa son el resultado de interacciones complejas entre los niveles de insulina, disponibilidad de glucosa y otros procesos metabólicos. La hipoglucemia puede producirse como resultado de un exceso de insulina o de insulina lispro en relación a la ingesta calórica y al gasto energético. La hipoglucemia puede estar asociada con apatía, confusión, palpitaciones, dolor de cabeza, sudoración y vómitos. Los episodios leves de hipoglucemia responderán a la administración oral de glucosa, azúcar u otros productos azucarados. La corrección de un episodio de hipoglucemia moderadamente grave puede realizarse mediante la administración intramuscular o subcutánea de glucagón, seguida de la administración por vía oral de carbohidratos cuando la recuperación del paciente sea suficiente. Los pacientes que no respondan a glucagón, deben recibir una solución intravenosa de glucosa. Si el paciente está comatoso, debe administrarse glucagón por vía subcutánea o intramuscular. Sin embargo, si no se dispone de glucagón o el paciente no responde a glucagón, debe administrarse una solución de glucosa por vía intravenosa. El paciente debe recibir alimentos tan pronto como recobre la conciencia. 5. Propiedades farmacológicas 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: análogo de insulina humana de acción rápida. La principal acción de insulina lispro es la regulación del metabolismo de la glucosa. Además, las insulinas tienen diversas aciones anabólicas y anti-catabólicas sobre una variedad de diferentes tejidos. Dentro del tejido muscular se incluyen el incremento de glucógeno, ácidos grasos, glicerol, síntesis proteica y captación de aminoácidos, mientras que disminuye la glucogenolisis, gluconeogénesis, cetogénesis, lipolisis, catabolismo proteico y la perdida de aminoácidos. HUMALOG® tiene un comienzo de acción rápido (aproximadamente a los 15 minutos), lo que permite administrarlo más cercano a las comidas (desde cero a 15 minutos de la comida) cuando se compara con insulina regular (30 a 45 minutos antes). Los efectos de HUMALOG® se inician rápidamente y tienen una duración de acción más corta (2 a 5 horas) cuando se comparan con insulina regular. Como con todas los preparados de insulina, el perfil de acción de HUMALOG® puede variar entre diferentes individuos o en diferentes momentos en una misma persona y es dependiente del lugar de inyección, perfusión sanguínea, temperatura y ejercicio físico. El perfil típico de actividad tras la inyección subcutánea se ilustra a continuación. 15 Actividad hipoglucemiante Humalog Humulina Humalog Humulin R Hypoglycemic Activity 0 1 2 3 4 5 6 Time (hours) Tiempo (horas) Esta gráfica indica la cantidad de glucosa, con respecto a tiempo, necesaria para mantener en un individuo la concentración de glucosa en sangre total próxima a los niveles de ayuno, y es un indicador del efecto de estas insulinas en el tiempo sobre el metabolismo de la glucosa. 5.2. Propiedades farmacocinéticas La farmacocinética de HUMALOG® refleja un compuesto que es absorbido rápidamente, y alcanza niveles sanguíneos máximos entre los 30 a 70 minutos tras la inyección subcutánea. Cuando se considera la relevancia clínica de estas cinéticas, es más apropiado examinar las curvas de utilización de glucosa (como se expuso en el apartado Propiedades Farmacodinámicas). 5.3. Datos preclínicos sobre seguridad En tests in vitro, incluyendo estudios de unión a los receptores de insulina y efectos sobre células en crecimiento, HUMALOG® se comportó de una forma muy parecida a la insulina humana. Otros estudios demustran que la disociación de HUMALOG® respecto a la unión al receptor de insulina es equivalente a la de la insulina humana. Los estudios de la toxicología aguda, durante 1 mes, y durante 12 meses no revelaron datos de toxicidad significativos. 6. Datos farmacéuticos 6.1. Lista de excipientes Cada vial contendrá insulina lispro y los siguientes excipientes: (a) m-Cresol destilado [3,15 mg/ml] (b); glicerol; (c) fosfato sódico dibásico.7H2O; (d) óxido de zinc; (e) agua para inyección; (f) ácido clorhídrico y (g) hidróxido sódico. Todos ellos se incorporan como: (a) conservante y estabilizador; (b) modificador de la tonicidad del preparado; (c) tampón; (d) estabilizante; (e) disolvente; (f) para ajustar el pH y (g) para ajustar el pH, respectivamente. 6.2. Incompatibilidades Los preparados de HUMALOG® no se deben mezclar con preparados de insulina animal. 16 6.3. Periodo de validez Dos años, cuando se almacena en condiciones apropiadas. El periodo de validez en uso es de 28 días. 6.4. Precauciones especiales de conservación Los preparados de HUMALOG® se deben conservar en el refrigerador entre 2o y 8o C. Estos preparados no deben congelarse ni exponerse a temperaturas excesivas o a la luz solar. Si no fuera posible su refrigeración, el vial, en uso, se puede mantener a la temperatura ambiente hasta 28 días, por debajo de 30o C y apartado de calor y luz directos. 6.5. Naturaleza y contenido del recipiente. La solución se envasa de manera aséptica en viales de vidrio flint Tipo I. El vidrio cumple los requerimientos de la Farmacopea. Europea. Los envases son sellados después con tapones de butilo o halobutilo. Se puede utilizar una emulsión de dimeticona o silicona para tratar los tapones de los viales. Los cierres se aseguran con sellos de aluminio. 6.6. Instrucciones de uso/manipulación a) Preparación de la dosis Inspeccionar el preparado HUMALOG®. Debe aparecer claro e incoloro. No utilizar nunca HUMALOG® si su aspecto es turbio, denso, o ligeramente coloreado o si son visibles partículas sólidas. a) HUMALOG® 1. Lávese las manos. 2. Si utiliza un frasco nuevo, levante la lengüeta protectora de plástico, pero no retire el tapón. 3. Si el régimen terapéutico requiere la inyección de insulina basal y HUMALOG® al mismo tiempo, ambos pueden ser mezclados en la jeringa. Si mezcla insulinas, consulte las normas sobre mezclas que se indican en el apartado 4. Introduzca aire en la jeringa, en cantidad equivalente a la dosis de HUMALOG® prescrita. Frote la parte superior del frasco con un algodón y alcohol. Introduzca la jeringa a través del tapón de goma del frasco de HUMALOG® e inyecte el aire en su interior. 5. Invierta el frasco y la jeringa. Sujete el frasco y la jeringa firmemente en una mano. 6. Asegúrese de que la punta de la aguja se encuentra dentro de la solución de HUMALOG®, extraiga la dosis exacta con la jeringa. 17 7. Antes de retirar la aguja del frasco, compruebe que no existen burbujas de aire en la jeringa que disminuyan la cantidad de HUMALOG®. En caso de que advierta burbujas, mantenga la jeringa recta y golpee sobre un lado hasta que las burbujas asciendan a la parte superior. Elimínelas presionando el émbolo y extraiga luego la dosis correcta. 8. Retire la aguja del frasco y coloque la jeringa de manera que la aguja no toque nada. b) Mezcla de HUMALOG® con insulinas humanas de acción retardada 1. HUMALOG® se puede mezclar con insulinas humanas de acción retardada sólo por indicación de un médico. 2. Introduzca aire en la jeringa, en una cantidad equivalente a la de la insulina de acción retardada que será utilizada. Introduzca la aguja dentro del frasco de insulina de acción retardada e inyecte el aire. Retire la aguja. 3. A continuación, inyecte aire en el frasco de HUMALOG®, siguiendo el procedimiento anterior, pero no retire la aguja. 4. Invierta el frasco y la jeringa. 5. Compruebe que la punta de la aguja está dentro de la solución de HUMALOG®, y extraiga la dosis correcta de HUMALOG® en la jeringa. 6. Antes de retirar la jeringa del frasco, compruebe que no existen burbujas de aire en la jeringa que disminuyan la cantidad de HUMALOG®. En caso de que advierta burbujas, mantenga la jeringa recta y golpee sobre un lado hasta que las burbujas asciendan a la parte superior. Elimínelas presionando el émbolo y extraiga luego la dosis correcta. 7. Retire la aguja del frasco de HUMALOG® e introdúzcala en el frasco de la insulina de acción retardada. Invierta el frasco y la jeringa. Sujete el frasco y la jeringa firmemente en una mano y agite suavemente. Compruebe que de insulina de acción retardada. 8. Retire la aguja y coloque la jeringa de manera que la aguja no toque nada. c) Mezclas de insulinas No se debe mezclar la insulina de los viales con la insulina de los cartuchos. 6.7. Nombre y dirección del titular de la autorización de comercialización El titular de la autorización de comercialización será Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. 7. Número de autorización de comercialización 8. Fecha de aprobación/revisión del SPC 18 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. Nombre patentado del medicamento HUMALOG® cartuchos (100U/ml, 1,5 ml) 2. Composición cualitativa y cuantitativa HUMALOG® es una solución estéril, clara, incolora y acuosa de insulina lispro ([Lys (B28), Pro (B29)] análogo de la insulina humana (origen rDNA) con un pH ajustado a 7,0 - 7,8. El nombre insulina lispro ha sido aprobado como D.C.I, como BAN en Gran Bretaña y como USAN en Estados Unidos. Principio activo Insulina lispro (origen DNA recombinante producida en E. coli) Cantidad por ml 100 U La concentración de insulina lispro es de 3,5 mg de insulina por ml para el producto de 100 U/ml. 3. Forma farmacéutica Solución inyectable en cartucho de 1,5 ml (100 U/ml de insulina lispro) para usar en combinación con los dispositivos para inyección tipo pluma: B-D Pen sistema de cartuchos, BD Pen+, (B-D Pen Ultra) y Lilly-Diapen II, para administración subcutánea. 4. Datos clínicos 4.1. Indicaciones terapéuticas Para el tratamiento de los pacientes con diabetes mellitus que requieren insulina para el mantenimiento de la homeostasia normal de la glucosa. HUMALOG® también está indicado en la estabilización inicial de la diabetes mellitus. HUMALOG® es una insulina, de acción corta, y puede ser utilizada en combinación con una insulina humana de acción prolongada. HUMALOG® está indicado para su administración antes de las comidas. 4.2 Posología y forma de administración La dosis debe ser determinada por el médico, según los requerimientos del paciente. Los preparados de HUMALOG® deben ser administrados por inyección subcutánea y pueden, aunque no es recomendable, ser administrados por inyección intramuscular. La administración subcutánea debe realizarse en la zona superior de los brazos, muslos, nalgas o abdomen. La utilización de estas zonas de inyección debe alternarse, de tal forma que un mismo lugar de inyección no sea utilizado aproximadamente más de una vez al mes. Cuando se utilice HUMALOG®, la inyección se debe realizar teniendo la precaución de que no se haya penetrado un vaso sanguíneo. Después de la inyección, no debe realizarse masaje de la zona de inyección. HUMALOG® actúa con rapidez y tiene una duración de acción más corta (2 a 5 horas) cuando se compara con insulina regular. Este rápido comienzo de acción permite a HUMALOG® ser 19 administrado muy próximo a las comidas. El perfil de acción de cualquier insulina puede variar considerablemente entre diferentes personas o en diferentes momentos dentro de una misma persona. Como sucede con todos los preparados de insulina, la duración de los efectos de HUMALOG® depende de la dosis, lugar de inyección, perfusión sanguínea, temperatura y del ejercicio físico. HUMALOG® puede ser administrado en combinación con una insulina humana de acción prolongada, según criterio facultativo. 4.3. Contraindicaciones Hipoglucemia. Hipersensibilidad a insulina lispro o a alguno de sus excipientes. 4.4. Advertencias y precauciones especiales de empleo La decisión de modificar el tipo o marca de insulina administrada a un paciente, debe tomarse bajo estricta supervisión médica. Los cambios en la concentración, nombre comercial (fabricante), tipo (Regular, NPH, Lenta, etc.), especie (animal, humana, análogo de insulina humana) y/o método de fabricación (técnicas de DNA recombinante frente a insulina de origen animal) pueden dar lugar a la necesidad de un cambio en la dosis. Los pacientes tratados con HUMALOG® pueden requerir un cambio en la dosis con respecto a la utilizada con sus insulinas habituales. Si fuese necesario hacer algún ajuste éste podría producirse con la primera dosis o durante las primeras semanas o meses. Los pacientes cuyo control glucémico está muy mejorado, por ejemplo mediante pautas insulínicas intensificadas, pueden perder alguno o todos los síntomas de alarma de hipoglucemia por lo que deben ser convenientemente informados. Algunos pacientes que han experimentado reacciones hipoglucémicas tras el cambio de insulina animal a insulina humana han comunicado que los síntomas tempranos de alarma de hipoglucemia fueron menos pronunciados o diferentes de los que experimentaban con su insulina previa. La falta de corrección de las reacciones hipoglucémicas o hiperglucémicas puede ser causa de pérdida de conciencia, coma o éxitus. Los requerimientos de insulina pueden disminuir en presencia de un deterioro renal o hepático. Los requerimientos de insulina pueden aumentar durante una enfermedad o por alteraciones emocionales. Puede ser también necesario un ajuste de la dosis de insulina si los pacientes aumentan su actividad física o modifican su dieta habitual. El ejercicio físico realizado inmediatamente después de las comidas puede aumentar el riesgo de hipoglucemia. 4.5. Interacciones con otros medicamentos y otras formas de interacción Los requerimientos de insulina pueden aumentar debido a la administración concomitante de medicamentos con actividad hiperglucemiante, tales como los anticonceptivos orales, corticosteroides o tratamiento sustitutivo con hormona tiroidea, danazol, estimulantes beta 2 (ritodrina, salbutamol, terbutalina). Los requerimientos de insulina pueden disminuir en presencia de medicamentos con actividad hipoglucemiante, tales como los hipoglucemiantes orales, salicilatos (por ejemplo, aspirina), sulfamidas y ciertos antidepresivos, ciertos inhibidores del enzima convertidor de angiotensina (captopril, enalapril), betabloqueantes, octreotrida, alcohol. HUMALOG® no debe mezclarse con insulinas animales. 20 El médico debe ser consultado cuando se utilicen otros medicamentos además de HUMALOG®. 4.6. Uso en embarazo y lactancia No hay experiencia significativa sobre el uso de HUMALOG® durante el embarazo. Es esencial mantener un buen control de las pacientes tratadas con insulina (diabetes insulinodependiente o diabetes gestacional), a lo largo de todo el embarazo. Los requerimientos de insulina habitualmente disminuyen durante el primer trimestre y se incrementan durante el segundo y tercer trimestres. Debe aconsejarse a las pacientes con diabetes que informen a sus médicos si están embarazadas o están contemplando la posibilidad de un embarazo. Una cuidadosa monitorización del control glucémico, así como de la salud general, son esenciales en las pacientes embarazadas con diabetes. Las pacientes diabéticas, durante el periodo de lactancia, pueden requerir un ajuste de la dosis de insulina, de la dieta o de ambas. 4.6a. No hay experiencia significativa con HUMALOG® en niños menores de 12 años. 4.7. Efectos sobre la capacidad para conducir y utilizar maquinaria El uso de dosis terapéuticas correctas no tiene efectos conocidos sobre la capacidad para conducir o para la utilización de maquinaria. 4.8. Reacciones adversas La hipoglucemia es la reacción adversa que con más frecuencia puede sufrir un paciente diabético. Una hipoglucemia grave puede conducir a la perdida de conciencia y en casos extremos, a exitus. Ocasionalmente, una alergia local en los pacientes se manifiesta como enrojecimiento, hinchazón y picor en el lugar de inyección de la insulina. En general, esta situación remite al cabo de unos días o semanas. A veces, esta reacción puede ser debida a factores distintos a la insulina, tales como irritantes en el agente limpiador de la piel o a una mala técnica de inyección. La alergia sistémica, menos común pero potencialmente más grave, es una alergia generalizada a la insulina. Puede producir una erupción en todo el cuerpo, dificultad respiratoria, respiración jadeante, disminución de la presión arterial, aceleración del pulso o sudoración. Los casos graves de alergia generalizada pueden poner en peligro la vida del enfermo. Puede aparecer lipodistrofia en el lugar de inyección. 21 4.9. Sobredosificación Las insulinas no tienen una definición específica de sobredosificación porque las concentraciones séricas de glucosa son el resultado de interacciones complejas entre los niveles de insulina, disponibilidad de glucosa y otros procesos metabólicos. La hipoglucemia puede producirse como resultado de un exceso de insulina o de insulina lispro en relación a la ingesta calórica y al gasto energético. La hipoglucemia puede estar asociada con apatía, confusión, palpitaciones, dolor de cabeza, sudoración y vómitos. Los episodios leves de hipoglucemia responderán a la administración oral de glucosa, azúcar u otros productos azucarados. La corrección de un episodio de hipoglucemia moderadamente grave puede realizarse mediante la administración intramuscular o subcutánea de glucagón, seguida de la administración por vía oral de carbohidratos cuando la recuperación del paciente sea suficiente. Los pacientes que no respondan a glucagón, deben recibir una solución intravenosa de glucosa. Si el paciente está comatoso, debe administrarse glucagón por vía subcutánea o intramuscular. Sin embargo, si no se dispone de glucagón o el paciente no responde a glucagón, debe administrarse una solución de glucosa por vía intravenosa. El paciente debe recibir alimentos tan pronto como recobre la conciencia. 5. Propiedades farmacológicas 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: análogo de insulina humana de acción rápida. La principal acción de insulina lispro es la regulación del metabolismo de la glucosa. Además, las insulinas tienen diversas aciones anabólicas y anti-catabólicas sobre una variedad de diferentes tejidos. Dentro del tejido muscular se incluyen el incremento de glucógeno, ácidos grasos, glicerol, síntesis proteica y captación de aminoácidos, mientras que disminuye la glucogenolisis, gluconeogénesis, cetogénesis, lipolisis, catabolismo proteico y la perdida de aminoácidos. HUMALOG® tiene un comienzo de acción rápido (aproximadamente a los 15 minutos), lo que permite administrarlo más cercano a las comidas (desde cero a 15 minutos de la comida) cuando se compara con insulina regular (30 a 45 minutos antes). Los efectos de HUMALOG® se inician rápidamente y tienen una duración de acción más corta (2 a 5 horas) cuando se comparan con insulina regular. Como con todas los preparados de insulina, el perfil de acción de HUMALOG® puede variar entre diferentes individuos o en diferentes momentos en una misma persona y es dependiente del lugar de inyección, perfusión sanguínea, temperatura y ejercicio físico. El perfil típico de actividad tras la inyección subcutánea se ilustra a continuación. 22 Actividad hipoglucemiante Humalog Humulina Humalog Humulin R Hypoglycemic Activity 0 1 2 3 4 5 6 Time (hours) Tiempo (horas) Esta gráfica indica la cantidad de glucosa, con respecto a tiempo, necesaria para mantener en un individuo la concentración de glucosa en sangre total próxima a los niveles de ayuno, y es un indicador del efecto de estas insulinas en el tiempo sobre el metabolismo de la glucosa. 5.2. Propiedades farmacocinéticas La farmacocinética de HUMALOG® refleja un compuesto que es absorbido rápidamente, y alcanza niveles sanguíneos máximos entre los 30 a 70 minutos tras la inyección subcutánea. Cuando se considera la relevancia clínica de estas cinéticas, es más apropiado examinar las curvas de utilización de glucosa (como se expuso en el apartado Propiedades Farmacodinámicas). 5.3. Datos preclínicos sobre seguridad En tests in vitro, incluyendo estudios de unión a los receptores de insulina y efectos sobre células en crecimiento, HUMALOG® se comportó de una forma muy parecida a la insulina humana. Otros estudios demustran que la disociación de HUMALOG® respecto a la unión al receptor de insulina es equivalente a la de la insulina humana. Los estudios de la toxicología aguda, durante 1 mes, y durante 12 meses no revelaron datos de toxicidad significativos. 6. Datos farmacéuticos 6.1. Lista de excipientes Cada cartucho contendrá insulina lispro y los siguientes excipientes: (a) m-Cresol destilado [3,15 mg/ml] (b); glicerol; (c) fosfato sódico dibásico.7H2O; (d) óxido de zinc; (e) agua para inyección; (f) ácido clorhídrico y (g) hidróxido sódico. Todos ellos se incorporan como: (a) conservante y estabilizador; (b) modificador de la tonicidad del preparado; (c) tampón; (d) estabilizante; (e) disolvente; (f) para ajustar el pH y (g) para ajustar el pH, respectivamente. 23 6.2. Incompatibilidades Los preparados de HUMALOG® no se deben mezclar con preparados de insulina animal. 6.3. Periodo de validez Dos años, cuando se almacena en condiciones apropiadas. El periodo de validez en uso es de 28 días. 6.4. Precauciones especiales de conservación Los preparados de HUMALOG® se deben conservar en el refrigerador entre 2o y 8o C. Estos preparados no deben congelarse ni exponerse a temperaturas excesivas o a la luz solar. Si no fuera posible su refrigeración, el cartucho, en uso, se pueden mantener a la temperatura ambiente hasta 28 días, por debajo de 30o C y apartados de calor y luz directos. Una vez introducido el cartucho dentro de la pluma, el cartucho y la pluma no deben ser refrigerados. 6.5. Naturaleza y contenido del recipiente. La solución se envasa de manera aséptica en cartuchos de vidrio flint Tipo I. El vidrio cumple los requerimientos de la Farmacopea. Europea. Los envases son sellados después con tapones de butilo o halobutilo o con un precinto de sellado y con un embolo. Se puede utilizar una emulsión de dimeticona o silicona para tratar los émbolos del cartucho y/o el cartucho de vidrio. Los cierres se aseguran con sellos de aluminio. 6.6. Instrucciones de uso/manipulación a) Preparación de la dosis Inspeccionar el preparado HUMALOG®. Debe aparecer claro e incoloro. No utilizar nunca HUMALOG® si su aspecto es turbio, denso, o ligeramente coloreado o si son visibles partículas sólidas. Para cargar el cartucho, el ajuste de la aguja y la administración de la inyección de insulina, deben seguirse las normas de los fabricantes de las plumas B-D Pen sistema de cartuchos, B-D Pen+, (B-D Pen Ultra), Lilly-Diapen I o Lilly-Diapen II. A continuación se ofrece una descripción general, si bien deben seguirse las instrucciones del fabricante con cada una de las plumas. b) Inyección de la dosis 1. Lávese las manos. 2. Elija el lugar de inyección. 3. Limpie la piel con un algodón y alcohol. 4. Retire el capuchón externo que cubre la aguja. 5. Estabilice la piel estirándola o pellizque un área amplia. Introduzca la aguja siguiendo las instrucciones. 6. Oprima el botón. 7. Retire la aguja y aplique una presión suave sobre la zona de inyección durante algunos segundos. No dar masaje en la zona. 24 .8. Utilizando el capuchón externo, desenrosque la aguja y deséchela en un lugar seguro. 9. Las zonas de inyección deben alternarse de tal forma que un mismo lugar de inyección no sea utilizado aproximadamente más de una vez al mes. c) Mezclas de insulinas No se debe mezclar la insulina de los viales con la insulina de los cartuchos. 6.7. Nombre y dirección del titular de la autorización de comercialización El titular de la autorización de comercialización será Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. 7. Número de autorización de comercialización 8. Fecha de aprobación/revisión del SPC 25 ANEXO II AUTORIZACIÓN DE FABRICACIÓN Y CONDICIONES QUE RIGEN LA AUTORIZACIÓN DE COMERCIALIZACIÓN 26 A. TITULAR(ES) DE LA(S) AUTORIZACIÓN(ES) DE FABRICACIÓN (artículo 16 de la Directiva 75/319/CEE del Consejo modificada) • La empresa propone al siguiente fabricante de la substancia activa: • a) Fermentación y aislamiento de gránulos: Dista Products Limited, Fleming Road, Speke Liverpool, L24 9LN, Reino Unido b) Responsable de la importación después de la purificación: Lilly France S.A., rue du Colonel Lilly, 67640 Fergersheim, Francia La empresa propone los centros siguientes para la fabricación del producto terminado: Viales: a) Formulación, rellenado del producto terminado en viales sin etiquetar: Lilly France S.A., rue du Colonel Lilly, 67640 Fergersheim, Francia b) Etiquetado, embalaje y responsable de la certificación de lotes: Lilly Deutschland GmbH, Teichweg 3, 35396 Giessen, Alemania Las autoridades francesas expidieron el certificado de buenas prácticas de fabricación el 28 de abril de 1993 y las autoridades alemanas, el 23 de junio de 1993. Cartuchos: Formulación, llenado de los cartuchos, etiquetado, acabado en embalaje "blister" y certificación de lotes: Lilly France S.A., rue du Colonel Lilly, 67640 Fergersheim, Francia Las autoridades francesas expidieron el certificado de buenas prácticas de fabricación el 28 de abril de 1993. B. CONDICIONES O RESTRICCIONES DE DESPACHO Y UTILIZACIÓN (artículos 2 y 3 de la Directiva 92/26/CEE del Consejo) Medicamento sujeto a prescripción médica renovable. C. OBLIGACIONES ESPECÍFICAS PARA EL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN La empresa, tras haber sido consultada (CPMP/785/95 de 7 de noviembre de 1995), se compromete a cumplir la obligación de comunicar a la EMEA la información adicional sobre el expediente farmacéutico dentro de los plazos siguientes: 1. La empresa ofrecerá una relación y una revisión de las especificaciones de la substancia activa y del producto terminado. La empresa presentará dicha información un año después de la concesión de la autorización de comercialización, a no ser que se hayan fabricado menos de 10 lotes de las formas del producto terminado. En tal caso, la empresa informará de inmediato a la EMEA en cuanto se hayan fabricado 10 lotes de cada una de las formas finales (viales de 40 y 10 UI y cartuchos de 100 UI). 27 2. A más tardar el 1 de abril de 1996, la empresa presentará los datos actualizados de los estudios de estabilidad de 24 meses actualmente en curso. Por otra parte, por razones de salud pública y hasta tanto no se haya armonizado al nivel comunitario la concentración de insulina, para comercializar los viales de insulina en aquellos Estados miembros en los que no se dispensen ambas concentraciones (40 U.I. y 100 U.I.), la empresa deberá determinar previamente y de acuerdo con las autoridades nacionales competentes las condiciones y el calendario de la comercialización eventual de la otra concentración. 28 ANEXO III ETIQUETA Y PROSPECTO PARA EL USUARIO 29 A. ETIQUETA 30 Humalog® 40 U insulina lispro (prb) Lote: Cad: Humalog® 40 U (1,4 mg/ml) RESERVED AREA FOR BAR CODE P.V.P...........................Ptas. P.V.P. IVA 4..............Ptas. Humalog® 40 U (1,4 mg/ml) RESERVED AREA FOR BRAILLE TEXTS Humalog® 40 U (1,4 mg/ml) (1,4 mg/ml) (C.N.) (symbols) co.7H2O, oxido de zinc, agua para (Logo) Nº Registro CE: 1 Vial de 10 ml VL7514 40 U/ml (1,4 mg/ml) 40 unidades por ml Humalog® 40 U insulina lispro (prb) (origen rDNA) Vía subcutánea Solución inyectable 10 ml VL-7514 40 unidades por ml Humalog® 40 U insulina lispro (prb) (origen rDNA) IMPORTANTE : LEA EL PROSPECTO ADJUNTO 31 (Logo) Lote: Cad: Consérvese entre 2 y 8°C. Evítese la congelación Eli Lilly Nederland B.V. Krijtwal 17-23 3432 ZT, Nieuwegein Holanda (C.N.) (Symbols) Nº Registro CE: 10 ml VL-7514 100 unidades por ml Humalog® 40 U insulina lispro (prb) (origen rDNA) Vía subcutánea 40 U/ml (1,4 mg/ml) 32 Humalog® 100 U (3,5 mg/ml) Humalog® 100 U insulina lispro (prb) Lote: Cad: Humalog® 100 U Humalog® 100 U (3,5 mg/ml) (3,5 mg/ml) (C.N.) RESERVED AREA FOR BAR CODE P.V.P...........................Ptas. P.V.P. IVA 4..............Ptas. RESERVED AREA FOR BRAILLE TEXTS Humalog® 100 (symbols) COMPOSICIÓN: Cada ml contiene: Insulin (prb) 100 U Excipientes: glicerol, fosfato sódico dibásico.7H2O, oxido de para inyección Manténgase fuera del alc niños Ver prospecto adjunto. Consérvese en refrigerad 8°C Vía subcutánea Evítese la congelación Solución inyectable Con receta médica Eli Lilly Nederland BV., 23 NL-3432 ZT Nieuweg Holanda 10 ml VL-7510 100 unidades por ml Humalog® 100 U insulina lispro (prb) (origen rDNA) IMPORTANTE: LEA EL PROSPECTO ADJUNTO 33 (Logo) Lote: Cad: Consérvese entre 2 y 8°C. Evítese la congelación (Symbols) Nº Registro CE: 10 ml VL-7510 100 unidades por ml Humalog® 100 U insulina lispro (prb) (origen rDNA) Vía subcutánea Eli Lilly Nederland B.V. Krijtwal 17-23 3432 ZT, Nieuwegein Holanda (C.N.) 100 U/ml (3,5 mg/ml) 34 CARTON TEXT PROPOSED FOR HUMALOG 100 U, 5 CARTRIDGES Cad: 1,5 ml 1,5 ml (C.N.) (symbols) (Logo) Nº Registro CE: 5 cartuchos de 1,5 ml VL-7515 100 Unidades por ml Humalog® 100 U insulina lispro (prb) (origen rDNA) Vía subcutánea Solución inyectable 1,5 ml 1,5 ml RESERVED AREA FOR BRAILLE TEXTS Consérvese en refrigerador entre 2 y 8°C Evítese la congelación Con receta médica P.V.P............Ptas. P.V.P. IVA 4......... ..Ptas. 100 U/ml (3,5 mg/ml) RESERVED AREA FOR BAR CODE Eli Lilly Nederland BV Krijtwal 17-23 3432 ZT Nieuwegein Holanda (Logo) Manténgase fuera del alcance de los niños Ver prospecto adjunto COMPOSICIÓN: Cada ml contiene: Insulina lispro (prb) 100 U Excipientes: m-cresol, glicerol, fosfato sódico dibásico.7H2O, oxido de zinc, agua para inyección 1,5 ml 100 U/ml 5 cartuchos de 1,5 ml (3,5 mg/ml) 100 unidades por ml (Logo) Humalog® 100 U insulina lispro (prb) 35 (Logo) (C.N.) (Symbols) 1,5 ml 100 unidades por ml Humalog® VL-7515 Nº Registro CE: 100 U insulina lispro (prb) (origen rDNA) Vía subcutánea Lote/Cad 2-8°C 100 U/ml (3,5 mg/ml) 36 B. PROSPECTO PARA EL USUARIO 37 Humalog® (insulina lispro) 40U/ml en viales de 10 ml ¿Qué debe saber sobre los frascos (viales) de Humalog®? Por favor, lea este prospecto con atención antes de empezar a utilizar Humalog®. No contiene toda la información sobre Humalog® que usted necesita conocer; por ello, plantee a su médico, farmacéutico o ATS especializado en diabetes cualquier pregunta que le surja. Este prospecto sólo se refiere a los viales de Humalog®. ¿Qué contiene Humalog®? El nombre de su medicamento es Humalog® y se emplea para tratar la diabetes. Su principio activo es insulina lispro. Se trata de una insulina humana fabricada de forma industrial. Funciona de un modo más rápido que la insulina humana normal porque la molécula de insulina se ha cambiado ligeramente. Normalmente, Humalog® se utiliza 15 minutos antes de las comidas. Su actividad es de 40 unidades por mililitro (U-40) y cada frasco contiene 400 unidades (10 mililitros). Humalog® también contiene ingredientes inactivos: m-cresol, glicerol, fosfato sódico dibásico.7H2O, óxido de zinc y agua para inyección. Se puede haber usado hidróxido sódico y/o ácido clorhídrico durante la fabricación para ajustar el pH. . FOTOGRAFÍA DEL PAQUETE En la farmacia compruebe siempre que el estuche y la etiqueta del frasco correspondan al nombre y tipo de insulina que solicita. Asegúrese de que se lleva el Humalog® que le ha recetado su médico. Humalog® se fabrica en el laboratorio por un proceso de “tecnología del ADN recombinante”. Es una forma modificada de la insulina humana y, por tanto, difiere del resto de las insulinas humanas y de las insulinas de origen animal. La insulina humana, con la que está estrechamente relacionada, es una hormona natural que produce el páncreas. Humalog® está fabricado por Lilly Deutschland GmbH, Teichweg 3, 35396 Giessen, Alemania. La licencia del producto es de Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. ¿Por qué Humalog®? Se tiene diabetes cuando el páncreas no fabrica insulina suficiente como para controlar el nivel de glucosa de su sangre. Humalog® es un sustitutivo de su propia insulina; cuando usted sufre diabetes se utiliza para controlarla a largo plazo. Activa muy rápidamente y durante menos tiempo que una insulina soluble. Puede que el médico le recomiende utilizar Humalog® con una insulina humana de acción más prolongada. Cada una de ellas viene acompañada de su propio prospecto con información específica. No cambie su insulina a menos que su médico o ATS así se lo indiquen. Tenga mucho cuidado cuando cambie de insulina. 38 Antes de inyectarse Humalog® Asegúrese de que el uso de Humalog® no le supone ningún riesgo. - SI CREE QUE ESTÁ EMPEZANDO UNA HIPOGLUCEMIA -EN ADELANTE “HIPO”- (BAJADA DE AZÚCAR EN SANGRE), NO SE INYECTE HUMALOG® y no conduzca. En la parte posterior de este prospecto se indica cómo resolver una “hipo” leve. -Si en alguna ocasión ha tenido una reacción alérgica a Humalog® (vea el punto D, en la parte posterior de este prospecto), dígaselo a su médico, farmacéutico o ATS especializado. - Si sus niveles de azúcar en sangre están bien controlados con su terapia actual de insulina, puede que no perciba los síntomas de alerta (vea la parte posterior de este prospecto) que le avisan de que el azúcar en sangre le está bajando demasiado. Debe controlar con atención cuándo debe comer, cuándo hacer ejercicio y hasta que punto puede hacerlo. También tiene que vigilar cuidadosamente los niveles de azúcar en sangre haciéndose con frecuencia los análisis de glucosa en sangre. -Determinados pacientes, que han sufrido “hipos” después de cambiar la insulina animal por la humana, han comentado que cada vez los primeros síntomas de la bajada (hipoglucemia) eran menos evidentes o diferentes. Si tiene frecuentes “hipos” o dificultades para reconocerlas, no deje de comentárselo a su médico. Si contesta de forma afirmativa a alguna de las siguientes preguntas, coménteselo a su médico, farmacéutico o ATS especializado en diabetes. -¿Hace poco que se ha puesto enfermo? -¿Está tomando algún otro medicamento? Sus necesidades de insulina pueden cambiar si está tomando anticonceptivos, esteroides, terapia sustitutiva de hormona tiroidea, hipoglucemicos orales, aspirina, antibióticos sulfa, octreotrida, estimulantes beta 2 (p.e. ritodrina, salbutamol, terbutalina) y algunos antidepresivos. -¿Tiene problemas de hígado o riñón? -¿Está haciendo más ejercicio de lo habitual? -¿Está embarazada o piensa estarlo? ¿ está dando el pecho? Las necesidades de insulina normalmente disminuyen durante los tres primeros meses de embarazo y aumentan durante los siguientes. Si está dando el pecho puede necesitar ajustar la dosis de insulina y/o la dieta. -¿El paciente es un niño menor de 12 años? Sus necesidades de insulina pueden variar si bebe alcohol. Si está pensando en irse al extranjero debe decírselo a su médico, farmacéutico o ATS especializado en diabetes. La diferencia horaria entre algunos países puede obligarle a adoptar un horario para las inyecciones y comidas distinto al que está llevando ahora. No deje de leer la parte posterior de este prospecto. 39 ¿Qué debe saber sobre los frascos de Humalog®? - continuación Utilización de Humalog® äDosis Normalmente, debe inyectarse Humalog® 15 minutos antes de cada comida. Sin embargo, su médico le habrá indicado exactamente la cantidad que tiene que utilizar, cuándo ponérsela y con qué frecuencia. Estas instrucciones son específicas para Vd. Sígalas con exactitud y vaya con frecuencia a su clínica de diabetes. * Si cambia el tipo de insulina que utiliza (por ejemplo de insulina animal o humana a Humalog®), tendrá que utilizar una cantidad mayor o menor que antes. Puede que sólo sea así desde la primera inyección o puede que requiera un cambio gradual que dure varias semanas o meses. * Inyecte Humalog® debajo de la piel. Sólo se lo inyectará en un músculo si su médico así se lo indica. äCómo preparar Humalog® * Humalog® viene ya disuelto en agua, por lo que no necesita mezclarlo. Sin embargo, sólo debe utilizarlo si su apariencia es como la del agua. Tiene que estar claro, no tener color ni contener partículas sólidas. Compruebe que ésto es así antes de ponerse cada inyección. äCómo inyectarse Humalog® * En primer lugar lávese las manos. * Limpie bien la piel de la zona donde va a inyectarse. Limpie el tapón de goma del frasco, pero no le quite. * Utilice una jeringuilla limpia y estéril y pinche con la aguja el tapón de goma hasta sacar la cantidad de Humalog® que necesita. Su médico o el personal de su clínica le enseñarán cómo se hace. No comparta ni las agujas ni las jeringuillas. * Inyéctese en la piel, tal como le han enseñado. No se inyecte directamente en la vena. No se frote la zona donde se acabe de inyectar. Asegúrese de haberse inyectado a 1cm por lo menos de donde lo hizo por última vez y de que “rota” los lugares donde se inyecta, tal como le han explicado. * Su médico le indicará si tiene que mezclar Humalog® con alguna otra insulina humana. Si tiene que inyectarse una mezcla, meta en la jeringuilla Humalog® antes de introducir la insulina de acción prolongada. Inyéctese el líquido tan pronto como lo haya mezclado. Haga lo mismo cada vez. Normalmente, no tendrá que mezclar Humalog® con ninguna de las insulinas del tipo Humulina Mezclas. No mezcle nunca Humalog® con insulinas animales. * Emergencias y sobredosis: Si su azúcar en sangre está baja, tome tabletas de glucosa o azúcar seguida de fruta o galletas y descanse después. De esta forma se suele poder superar una “hipo” ligera o sobredosis pequeñas de insulina. Si se pone peor y su respiración es poco profunda y la piel se le pone pálida, llame inmediatamente al médico. Las hipoglucemias serias pueden tratarse con una inyección de glucagón. Después de la inyección de glucagón hay que tomar glucosa o azúcar. Si no responde al glucagón, deberá ser tratado en un hospital. Pida a su médico que le informe sobre el glucagón. Si no se tratan adecuadamente, las “hipos” e hiperglucemias -en adeante “hiper”- (véase A y B) pueden ser muy graves y provocar dolor de cabeza, náuseas, vómitos, deshidratación, pérdida de conocimiento, coma e incluso causar la muerte. 40 * Tenga siempre jeringuillas y frascos de Humalog® adicionales. * Lleve siempre consigo algún distintivo que avise de su condición de diabético. * Lleve siempre consigo algo de azúcar. Cuando esté utilizando insulina Problemas corrientes de la diabetes A. Hipoglucemia Significa (“hipo”: bajo nivel de azúcar en la sangre) que no tiene suficiente azúcar en la sangre. Puede ser causado porque: * se haya puesto demasiado Humalog® o cualquier otro tipo de insulina; * se haya saltado una comida, la haya retrasado o haya cambiado su dieta; * haya trabajado mucho o hecho demasiado ejercicio inmediatamente después de una comida; * tenga una infección o esté enfermo (especialmente diarrea o vómitos); * se hayan producido cambios en sus necesidades de insulina; o * esté peor de una afección renal o hepática. El alcohol y determinados medicamentos pueden afectar a sus niveles de azúcar en sangre. Los primeros síntomas de bajada del nivel de azúcar suelen presentarse de improviso y están acompañados de: - cansancio, - palpitaciones - nerviosismo y temblores - náusea - dolor de cabeza - sudores fríos B. Hiperglucemia y cetoacidosis diabética Hiperglucemia (“hiper”: demasiada azúcar en la sangre) significa que el cuerpo no tiene suficiente insulina. Puede estar causada porque: * no se haya puesto Humalog® o cualquier otro tipo de insulina; * se haya puesto menos insulina que la que le haya recetado el médico; * haya comido más de lo que su dieta le permite; o * tenga fiebre, alguna infección o tensión emocional. La hiperglucemia puede terminar en cetoacidosis diabética. Los primeros síntomas se presentan lentamente, durante muchas horas o varios días y están acompañados de: - somnolencia, - falta de apetito - enrojecimiento facial - aliento con olor a fruta - sed - sentimiento de estar enfermo. Cuando los síntomas se agravan la respiración es pesada y el pulso rápido. Hay que llamar inmediatamente a un médico. C. Enfermedades Si está enfermo, especialmente si está mareado o vomita, sus necesidades de insulina pueden variar. Aunque no esté comiendo como siempre, tiene necesidad de recibir insulina. Hágase los análisis de orina o sangre, siga las indicaciones que le hayan dado para cuando esté enfermo y llame a su médico. D. Alergia a la insulina Alergias locales: A algunas personas la zona donde se ha inyectado la insulina se les enrojece, se hincha o sienten picor. Esta situación suele pasar en unos cuantos días o unas semanas. Si le sucede, coméntelo con su médico. 41 Alergia sistémica: Esta alergia a la insulina no es corriente. Los síntomas son: - erupción por todo el cuerpo, - bajada de tensión - dificultad para respirar - fuertes palpitaciones - respiración silbante - sudor Si cree que está sufriendo este tipo de alergia con Humalog®, hable inmediatamente con su médico. E. Lipodistrofia Si observa que, en los lugares donde se pone las inyecciones, su piel se hace más gruesa o se le forma una especie de hoyo, coménteselo a su médico. Si advierte estos u otros efectos secundarios, coménteselo a su médico. Cómo guardar Humalog® Guarde Humalog® en el frigorífico, a una temperatura de entre 2° y 8°C. No lo deje cerca de ninguna fuente de calor ni al sol. Humalog® no se puede congelar. Cuando no pueda guardar Humalog® en la nevera, puede conservarlo hasta 28 días a la temperatura ambiente de una habitación (que no supere los 30°C). Guarde los medicamentos donde los niños no puedan verlos ni cogerlos. No lo utilice después de la fecha de caducidad. Recuerde: Este medicamento es para usted. Nunca se lo de a los demás. Puede ser perjudicial aunque sus síntomas sean semejantes a los que usted tiene. Fecha en que fue redactado este prospecto: 42 Humalog® (insulina lispro) 100U/ml en viales de 10 ml ¿Qué debe saber sobre los frascos (viales) de Humalog®? Por favor, lea este prospecto con atención antes de empezar a utilizar Humalog®. No contiene toda la información sobre Humalog® que usted necesita conocer; por ello, plantee a su médico, farmacéutico o ATS especializado en diabetes cualquier pregunta que le surja. Este prospecto sólo se refiere a los viales de Humalog®. ¿Qué contiene Humalog®? El nombre de su medicamento es Humalog® y se emplea para tratar la diabetes. Su principio activo es insulina lispro. Se trata de una insulina humana fabricada de forma industrial. Funciona de un modo más rápido que la insulina humana normal porque la molécula de insulina se ha cambiado ligeramente. Normalmente, Humalog® se utiliza 15 minutos antes de las comidas. Su actividad es de 100 unidades por mililitro (U-100) y cada frasco contiene 1.000 unidades (10 mililitros). Humalog® también contiene ingredientes inactivos: m-cresol, glicerol, fosfato sódico dibásico.7H2O, óxido de zinc y agua para inyección. Se puede haber usado hidróxido sódico y/o ácido clorhídrico durante la fabricación para ajustar el pH. FOTOGRAFÍA DEL PAQUETE En la farmacia compruebe siempre que el estuche y la etiqueta del frasco correspondan al nombre y tipo de insulina que solicita. Asegúrese de que se lleva el Humalog® que le ha recetado su médico. Humalog® se fabrica en el laboratorio por un proceso de “tecnología del ADN recombinante”. Es una forma modificada de la insulina humana y, por tanto, difiere del resto de las insulinas humanas y de las insulinas de origen animal. La insulina humana, con la que está estrechamente relacionada, es una hormona natural que produce el páncreas. Humalog® está fabricado por Lilly Deutschland GmbH, Teichweg 3, 35396 Giessen, Alemania. La licencia del producto es de Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. ¿Por qué Humalog®? Se tiene diabetes cuando el páncreas no fabrica insulina suficiente como para controlar el nivel de glucosa de su sangre. Humalog® es un sustitutivo de su propia insulina; cuando usted sufre diabetes se utiliza para controlarla a largo plazo. Activa muy rápidamente y durante menos tiempo que una insulina soluble. Puede que el médico le recomiende utilizar Humalog® con una insulina humana de acción más prolongada. Cada una de ellas viene acompañada de su propio prospecto con información específica. No cambie su insulina a menos que su médico o ATS así se lo indiquen. Tenga mucho cuidado cuando cambie de insulina. 43 Antes de inyectarse Humalog® Asegúrese de que el uso de Humalog® no le supone ningún riesgo. - SI CREE QUE ESTÁ EMPEZANDO UNA HIPOGLUCEMIA -EN ADELANTE “HIPO”- (BAJADA DE AZÚCAR EN SANGRE), NO SE INYECTE HUMALOG® y no conduzca. En la parte posterior de este prospecto se indica cómo resolver una “hipo” leve. -Si en alguna ocasión ha tenido una reacción alérgica a Humalog® (vea el punto D, en la parte posterior de este prospecto), dígaselo a su médico, farmacéutico o ATS especializado. - Si sus niveles de azúcar en sangre están bien controlados con su terapia actual de insulina, puede que no perciba los síntomas de alerta (vea la parte posterior de este prospecto) que le avisan de que el azúcar en sangre le está bajando demasiado. Debe controlar con atención cuándo debe comer, cuándo hacer ejercicio y hasta que punto puede hacerlo. También tiene que vigilar cuidadosamente los niveles de azúcar en sangre haciéndose con frecuencia los análisis de glucosa en sangre. -Determinados pacientes, que han sufrido “hipos” después de cambiar la insulina animal por la humana, han comentado que cada vez los primeros síntomas de la bajada (hipoglucemia) eran menos evidentes o diferentes. Si tiene frecuentes “hipos” o dificultades para reconocerlas, no deje de comentárselo a su médico. Si contesta de forma afirmativa a alguna de las siguientes preguntas, coménteselo a su médico, farmacéutico o ATS especializado en diabetes. -¿Hace poco que se ha puesto enfermo? -¿Está tomando algún otro medicamento? Sus necesidades de insulina pueden cambiar si está tomando anticonceptivos, esteroides, terapia sustitutiva de hormona tiroidea, hipoglucemicos orales, aspirina, antibióticos sulfa, octreotrida, estimulantes beta 2 (p.e. ritodrina, salbutamol, terbutalina) o algunos antidepresivos. -¿Tiene problemas de hígado o riñón? -¿Está haciendo más ejercicio de lo habitual? -¿Está embarazada o piensa estarlo? ¿ está dando el pecho? Las necesidades de insulina normalmente disminuyen durante los tres primeros meses de embarazo y aumentan durante los siguientes. Si está dando el pecho puede necesitar ajustar la dosis de insulina y/o la dieta. -¿El paciente es un niño menor de 12 años? Sus necesidades de insulina pueden variar si bebe alcohol. Si está pensando en irse al extranjero debe decírselo a su médico, farmacéutico o ATS especializado en diabetes. La diferencia horaria entre algunos países puede obligarle a adoptar un horario para las inyecciones y comidas distinto al que está llevando ahora. No deje de leer la parte posterior de este prospecto. 44 ¿Qué debe saber sobre los frascos de Humalog®? - continuación Utilización de Humalog® äDosis Normalmente, debe inyectarse Humalog® 15 minutos antes de cada comida. Sin embargo, su médico le habrá indicado exactamente la cantidad que tiene que utilizar, cuándo ponérsela y con qué frecuencia. Estas instrucciones son específicas para Vd. Sígalas con exactitud y vaya con frecuencia a su clínica de diabetes. * Si cambia el tipo de insulina que utiliza (por ejemplo de insulina animal o humana a Humalog®), tendrá que utilizar una cantidad mayor o menor que antes. Puede que sólo sea así desde la primera inyección o puede que requiera un cambio gradual que dure varias semanas o meses. * Inyecte Humalog® debajo de la piel. Sólo se lo inyectará en un músculo si su médico así se lo indica. äCómo preparar Humalog® * Humalog® viene ya disuelto en agua, por lo que no necesita mezclarlo. Sin embargo, sólo debe utilizarlo si su apariencia es como la del agua. Tiene que estar claro, no tener color ni contener partículas sólidas. Compruebe que ésto es así antes de ponerse cada inyección. äCómo inyectarse Humalog® * En primer lugar lávese las manos. * Limpie bien la piel de la zona donde va a inyectarse. Limpie el tapón de goma del frasco, pero no le quite. * Utilice una jeringuilla limpia y estéril y pinche con la aguja el tapón de goma hasta sacar la cantidad de Humalog® que necesita. Su médico o el personal de su clínica le enseñarán cómo se hace. No comparta ni las agujas ni las jeringuillas. * Inyéctese en la piel, tal como le han enseñado. No se inyecte directamente en la vena. No se frote la zona donde se acabe de inyectar. Asegúrese de haberse inyectado a 1cm por lo menos de donde lo hizo por última vez y de que “rota” los lugares donde se inyecta, tal como le han explicado. * Su médico le indicará si tiene que mezclar Humalog® con alguna otra insulina humana. Si tiene que inyectarse una mezcla, meta en la jeringuilla Humalog® antes de introducir la insulina de acción prolongada. Inyéctese el líquido tan pronto como lo haya mezclado. Haga lo mismo cada vez. Normalmente, no tendrá que mezclar Humalog® con ninguna mezcla de insulina humana. No mezcle nunca Humalog® con insulinas animales. * Emergencias y sobredosis: Si su azúcar en sangre está baja, tome tabletas de glucosa o azúcar seguida de fruta o galletas y descanse después. De esta forma se suele poder superar una “hipo” ligera o sobredosis pequeñas de insulina. Si se pone peor y su respiración es poco profunda y la piel se le pone pálida, llame inmediatamente al médico. Las hipoglucemias serias pueden tratarse con una inyección de glucagón. Después de la inyección de glucagón hay que tomar glucosa o azúcar. Si no responde al glucagón, deberá ser tratado en un hospital. Pida a su médico que le informe sobre el glucagón. 45 Si no se tratan adecuadamente, las “hipos” e hiperglucemias -en adeante “hiper”- (véase A y B) pueden ser muy graves y provocar dolor de cabeza, náuseas, vómitos, deshidratación, pérdida de conocimiento, coma e incluso causar la muerte. * Tenga siempre jeringuillas y frascos de Humalog® adicionales. * Lleve siempre consigo algún distintivo que avise de su condición de diabético. * Lleve siempre consigo algo de azúcar. Cuando esté utilizando insulina Problemas corrientes de la diabetes A. Hipoglucemia Significa (“hipo”: bajo nivel de azúcar en la sangre) que no tiene suficiente azúcar en la sangre. Puede ser causado porque: * se haya puesto demasiado Humalog® o cualquier otro tipo de insulina; * se haya saltado una comida, la haya retrasado o haya cambiado su dieta; * haya trabajado mucho o hecho demasiado ejercicio inmediatamente después de una comida; * tenga una infección o esté enfermo (especialmente diarrea o vómitos); * se hayan producido cambios en sus necesidades de insulina; o * esté peor de una afección renal o hepática. El alcohol y determinados medicamentos pueden afectar a sus niveles de azúcar en sangre. Los primeros síntomas de bajada del nivel de azúcar suelen presentarse de improviso y están acompañados de: - cansancio, - palpitaciones - nerviosismo y temblores - náusea - dolor de cabeza - sudores fríos B. Hiperglucemia y cetoacidosis diabética Hiperglucemia (“hiper”: demasiada azúcar en la sangre) significa que el cuerpo no tiene suficiente insulina. Puede estar causada porque: * no se haya puesto Humalog® o cualquier otro tipo de insulina; * se haya puesto menos insulina que la que le haya recetado el médico; * haya comido más de lo que su dieta le permite; o * tenga fiebre, alguna infección o tensión emocional. La hiperglucemia puede terminar en cetoacidosis diabética. Los primeros síntomas se presentan lentamente, durante muchas horas o varios días y están acompañados de: - somnolencia, - falta de apetito - enrojecimiento facial - aliento con olor a fruta - sed - sentimiento de estar enfermo. Cuando los síntomas se agravan la respiración es pesada y el pulso rápido. Hay que llamar inmediatamente a un médico. 46 C. Enfermedades Si está enfermo, especialmente si está mareado o vomita, sus necesidades de insulina pueden variar. Aunque no esté comiendo como siempre, tiene necesidad de recibir insulina. Hágase los análisis de orina o sangre, siga las indicaciones que le hayan dado para cuando esté enfermo y llame a su médico. D. Alergia a la insulina Alergias locales: A algunas personas la zona donde se ha inyectado la insulina se les enrojece, se hincha o sienten picor. Esta situación suele pasar en unos cuantos días o unas semanas. Si le sucede, coméntelo con su médico. Alergia sistémica: Esta alergia a la insulina no es corriente. Los síntomas son: - erupción por todo el cuerpo, - bajada de tensión - dificultad para respirar - fuertes palpitaciones - respiración silbante - sudor Si cree que está sufriendo este tipo de alergia con Humalog®, hable inmediatamente con su médico. E. Lipodistrofia Si observa que, en los lugares donde se pone las inyecciones, su piel se hace más gruesa o se le forma una especie de hoyo, coménteselo a su médico. Si advierte estos u otros efectos secundarios, coménteselo a su médico. Cómo guardar Humalog® Guarde Humalog® en el frigorífico, a una temperatura de entre 2° y 8°C. No lo deje cerca de ninguna fuente de calor ni al sol. Humalog® no se puede congelar. Cuando no pueda guardar Humalog® en la nevera, puede conservarlo hasta 28 días a la temperatura ambiente de una habitación (que no supere los 30°C). Guarde los medicamentos donde los niños no puedan verlos ni cogerlos. No lo utilice después de la fecha de caducidad. Recuerde: Este medicamento es para usted. Nunca se lo de a los demás. Puede ser perjudicial aunque sus síntomas sean semejantes a los que usted tiene. Fecha en que fue redactado este prospecto: 47 Humalog® (insulina lispro) 100U/ml en cartuchos de 1,5 ml ¿Qué debe saber sobre los cartuchos de Humalog®? Por favor, lea este prospecto con atención antes de empezar a utilizar Humalog®. En él no se contiene toda la información sobre Humalog® que usted necesita conocer; por ello, plantee a su médico, farmacéutico o ATS especializado en diabetes cualquier pregunta que le surja. Este prospecto sólo se refiere a los cartuchos de Humalog®. ¿Qué contiene Humalog®? El nombre de su medicamento es Humalog® y se emplea para tratar la diabetes. Su principio activo es insulina lispro. Se trata de una insulina humana fabricada de forma industrial. Funciona de un modo más rápido que la insulina humana normal porque la molécula de insulina se ha cambiado ligeramente. Normalmente, Humalog® se utiliza 15 minutos antes de las comidas. Su actividad es de 100 unidades por mililitro (U-100) y cada cartucho contiene 150 unidades (1,5 mililitros). Humalog® también contiene ingredientes inactivos: m-cresol, glicerol, fosfato sódico dibásico.7H2O, óxido de zinc y agua para inyección. Se puede haber usado hidróxido sódico y/o ácido clorhídrico durante la fabricación para ajustar el pH. FOTOGRAFÍA DEL PAQUETE En la farmacia compruebe siempre que el estuche y la etiqueta del frasco correspondan al nombre y tipo de insulina que solicita. Asegúrese de que se lleva el Humalog® que le ha recetado su médico. Humalog® se fabrica en el laboratorio por un proceso de “tecnología del ADN recombinante”. Es una forma modificada de la insulina humana y, por tanto, difiere del resto de las insulinas humanas y de las insulinas de origen animal. La insulina humana, con la que está estrechamente relacionada, es una hormona natural que produce el páncreas. Humalog® está fabricado por Lilly France, S.A., rue du Colonel Lilly, 67640 Fegersheim, Francia. La licencia del producto es de Eli Lilly Nederland B.V., Krijtwal 17-23, 3432 ZT Nieuwegein, Holanda. ¿Por qué Humalog®? Se tiene diabetes cuando el páncreas no fabrica insulina suficiente como para controlar el nivel de glucosa de su sangre. Humalog® es un sustitutivo de su propia insulina; cuando usted sufre diabetes se utiliza para controlarla a largo plazo. Activa muy rápidamente y durante menos tiempo que una insulina soluble. Puede que el médico le recomiende utilizar Humalog® con una insulina humana de acción más prolongada. Cada una de ellas viene acompañada de su propio prospecto con información específica. No cambie su insulina a menos que su médico o ATS se lo indiquen. Tenga mucho cuidado cuando cambie de insulina. 48 Antes de inyectarse Humalog® Asegúrese de que el uso de Humalog® no le supone ningún riesgo. - SI CREE QUE ESTÁ EMPEZANDO UNA HIPOGLUCEMIA -EN ADELANTE “HIPO”- (BAJADA DE AZÚCAR EN SANGRE), NO SE INYECTE HUMALOG® y no conduzca. En la parte posterior de este prospecto se indica cómo resolver una “hipo” leve. -Si en alguna ocasión ha tenido una reacción alérgica a Humalog® (vea el punto D, en la parte posterior de este prospecto), dígaselo a su médico, farmacéutico o ATS especializado. - Si sus niveles de azúcar en sangre están bien controlados con su terapia actual de insulina, puede que no perciba los síntomas de alerta (vea la parte posterior de este prospecto) que le avisan de que el azúcar en sangre le está bajando demasiado. Debe controlar con atención cuándo debe comer, cuándo hacer ejercicio y hasta que punto puede hacerlo. También tiene que vigilar cuidadosamente los niveles de azúcar en sangre haciéndose con frecuencia los análisis de glucosa en sangre. - Determinados pacientes, que han sufrido “hipos” después de cambiar la insulina animal por la humana, han comentado que los primeros síntomas de la bajada (hipoglucemia) eran cada vez eran más difíciles de reconocer y menos diferenciados. Si tiene frecuentes “hipos” o dificultades para reconocerlas, no deje de comentárselo a su médico. Si contesta de forma afirmativa a alguna de las siguientes preguntas, coménteselo a su médico, farmacéutico o ATS especializado en diabetes. -¿Hace poco que se ha puesto enfermo? -¿Está tomando algún otro medicamento? Sus necesidades de insulina pueden cambiar si está tomando anticonceptivos, esteroides, terapia sustitutiva de hormona tiroidea, hipoglucemicos orales, aspirina, antibióticos sulfa, octreotrida, estimulantes beta 2 (p.e. ritodrina, salbutamol, terbutalina) o algunos antidepresivos. -¿Tiene problemas de hígado o riñón? -¿Está haciendo más ejercicio de lo habitual? -¿Está embarazada o piensa estarlo? ¿ está dando el pecho? Las necesidades de insulina normalmente disminuyen durante los tres primeros meses de embarazo y aumentan durante los siguientes. Si está dando el pecho puede necesitar ajustar la dosis de insulina y/o la dieta. -¿El paciente es un niño menor de 12 años? Sus necesidades de insulina pueden variar si bebe alcohol. Si está pensando en irse al extranjero debe decírselo a su médico, farmacéutico o ATS especializado en diabetes. La diferencia horaria entre algunos países puede obligarle a adoptar un horario para las inyecciones y comidas distinto al que está llevando ahora. 49 Utilización de Humalog® äDosis Normalmente, debe inyectarse Humalog® 15 minutos antes de cada comida. Sin embargo, su médico le habrá indicado exactamente la cantidad que tiene que utilizar, cuando ponérsela y con qué frecuencia. Estas instrucciones son específicas para Vd. Sígalas con exactitud y vaya con frecuencia a su clínica de diabetes. * Si cambia el tipo de insulina que utiliza (por ejemplo de insulina animal o humana a Humalog®), tendrá que utilizar una cantidad mayor o menor que antes. Puede que sólo sea así desde la primer inyección o puede que requiera un cambio gradual que dure varias semanas o meses. * Inyecte Humalog® debajo de la piel. Sólo se lo inyectará en un músculo si su médico así se lo indica. No deje de leer la parte posterior de este prospecto. ¿Qué debe saber sobre los cartuchos de Humalog®? - continuación äCómo preparar Humalog® * Humalog® viene ya disuelto en agua, por lo que no necesita mezclarlo. Sin embargo, sólo debe utilizarlo si su apariencia es como la del agua. Tiene que estar claro, no tener color ni contener partículas sólidas. Compruebe que ésto es así antes de ponerse cada inyección. äCómo preparar la pluma * En primer lugar lávese las manos. Desinfecte la membrana de goma del cartucho. * Utilice sólo los cartuchos de Humalog® con las plumas de inyección de Becton Dickinson o con las plumas Diapen de Lilly. Siga las instrucciones que acompañan a la pluma. Introduzca el cartucho en la pluma. * Se debe ajustar la dosis a 1 ó 2 unidades. A continuación, ponga la pluma con la aguja hacia arriba y dé un golpecito en el lateral para que cualquier burbuja suba a la parte superior. Aun con la pluma hacia arriba, presione el botón de inyección de la pluma B-D o la pinza de la Diapen. Manténgalo así hasta que salga por la aguja una gota de Humalog®. Puede que aun queden en la pluma algunas pequeñas burbujas de aire. Son inofensivas, pero si la burbuja de aire fuese demasiado grande, la dosis de la inyección podría ser menos precisa. äCómo inyectarse Humalog® Limpie bien la piel de la zona donde vaya a inyectarse. Inyéctese bajo la piel, tal como le han enseñado. No se inyecte directamente en una vena. No frote la zona donde se acabe de inyectar. Asegúrese de haberse inyectado a 1cm por lo menos de donde lo hizo por última vez y de que “rota” los lugares donde se inyecta, tal como le han explicado. 50 äDespués de la inyección Tan pronto como termine de inyectarse, retire la aguja de la pluma. De esta forma Humalog® se mantendrá estéril y no habrá pérdidas. También evitará que entre aire en la pluma y que la aguja moleste. No comparta las agujas. äInyecciones posteriores Deje el cartucho dentro de la pluma. Antes de cada inyección, marque 1 ó 2 unidades y presione el botón o la pinza, con la pluma hacia arriba, hasta que salga por la aguja una gota de Humalog®. Con la pluma Becton Dickinson, deje de utilizar el cartucho si el borde principal del émbolo ha llegado o sobrepasado la banda de color. Se puede ver la cantidad de Humalog® que queda, mirando el indicador que aparece en un lado del cartucho. La distancia entre cada señal del indicador viene a corresponder a 10 unidades. Con la Diapen, compruebe que la parte azul del pistón se ve por la ventanilla. Si es así, por el nivel que haya alcanzado en la escala se puede comprobar cuánta insulina queda en el cartucho. Si no queda suficiente para su dosis, cambie el cartucho. No mezcle ninguna otra insulina en un cartucho de Humalog®. Cuando éste se vacía ya no se puede volver a utilizar. * Emergencias y sobredosis: Si su azúcar en sangre está baja, tome tabletas de glucosa o azúcar seguida de fruta o galletas y descanse después. De esta forma suele poder superarse una “hipo” ligera o sobredosis pequeñas de insulina. Si se pone peor y su respiración es poco profunda y la piel se le pone pálida, llame inmediatamente al médico. Las hipoglucemias serias pueden tratarse con una inyección de glucagón. Después de la inyección de glucagón hay que tomar glucosa o azúcar. Si no responde al glucagón, deberá ser tratado en un hospital. Pida a su médico que informe sobre el glucagón. Si no se tratan adecuadamente, las “hipos” e hiperglucemias -en adeante “hiper”- (véase A y B) pueden ser muy graves y provocar dolor de cabeza, náuseas, vómitos, deshidratación, pérdida de conocimiento, coma e incluso causar la muerte. * Tenga siempre jeringuillas y frascos de Humalog® adicionales, o plumas y cartuchos de más, por si pierde la pluma o los cartuchos, o se estropean. * Lleve siempre consigo algún distintivo que avise de su condición de diabético. * Lleve siempre consigo algo de azúcar. 51 Cuando esté utilizando insulina Problemas corrientes de la diabetes A. Hipoglucemia Significa (“hipo”: bajo nivel de azúcar en la sangre) que no tiene suficiente azúcar en la sangre. Puede ser causada porque: * se haya puesto demasiado Humalog® o cualquier otro tipo de insulina; * se haya saltado una comida, la haya retrasado o haya cambiado su dieta; * haya trabajado mucho o hecho demasiado ejercicio inmediatamente después de una comida; * tenga una infección o esté enfermo (especialmente diarrea o vómitos); * se hayan producido cambios en sus necesidades de insulina; o * esté peor de una afección renal o hepática. El alcohol y determinados medicamentos pueden afectar a sus niveles de azúcar en sangre. Los primeros síntomas de bajada del nivel de azúcar suelen presentarse de improviso y están acompañados de: - cansancio, - palpitaciones - nerviosismo y temblores - náusea - dolor de cabeza - sudores fríos B. Hiperglucemia y cetoacidosis diabética Hiperglucemia (“hiper”: demasiada azúcar en la sangre) significa que el cuerpo no tiene suficiente insulina. La hiperglucemia puede estar causada porque: * no se haya puesto Humalog® o cualquier otro tipo de insulina; * se haya puesto menos insulina que la que le haya recetado el médico; * haya comido más de lo que su dieta le permite; o * tenga fiebre, alguna infección o tensión emocional. La hiperglucemia puede terminar en cetoacidosis diabética. Los primeros síntomas se presentan lentamente, durante muchas horas o varios días y están acompañados de: - somnolencia, - falta de apetito - enrojecimiento facial - aliento con olor a fruta - sed - sentimiento de estar enfermo. Cuando los síntomas se agravan la respiración es pesada y el pulso rápido. Hay que llamar inmediatamente a un médico. C. Enfermedades Si está enfermo, especialmente si está mareado o vomita, sus necesidades de insulina pueden variar. Aunque no esté comiendo como siempre, tiene necesidad de recibir insulina. Hágase los análisis de orina o sangre, siga las indicaciones que le hayan dado para cuando esté enfermo y llame a su médico. D. Alergia a la insulina Alergias locales: A algunas personas la zona donde se ha inyectado la insulina se les enrojece, se hincha o sienten picor. Esta situación suele pasar en unos cuantos días o unas semanas. Si le sucede, coméntelo con su médico. Alergia sistémica: Esta alergia a la insulina no es corriente. Los síntomas son: - erupción por todo el cuerpo, - bajada de tensión - dificultad para respirar - fuertes palpitaciones - respiración silbante - sudor Si cree que está sufriendo este tipo de alergia con Humalog®, hable inmediatamente con su médico. E. Lipodistrofia 52 Si observa que, en los lugares donde se pone las inyecciones, su piel se hace más gruesa o se le forma una especie de hoyo, coménteselo a su médico. Si advierte estos u otros efectos secundarios, coménteselo a su médico. Cómo guardar Humalog® Guarde Humalog® en el frigorífico, a una temperatura de entre 2° y 8°C. No lo deje cerca de ninguna fuente de calor ni al sol. Humalog® no se puede congelar. Cuando no pueda guardar Humalog® en la nevera, puede conservarlo hasta 28 días a la temperatura ambiente de una habitación (que no supere los 30°C). No guarde la pluma ni los cartuchos que esté utilizando en el frigorífico. Guarde los medicamentos donde los niños no puedan verlos ni cogerlos. No lo utilice después de la fecha de caducidad. Recuerde: Este medicamento es para usted. Nunca se lo dé a los demás. Puede ser perjudicial aunque sus síntomas sean semejantes a los que usted tiene. Fecha en que fue redactado este prospecto 53 Por favor, para cualquier información contacte con su representante local de Eli Lilly: Tiedotus Suomessa: Oy Eli Lilly Finland Ab, PL 16, 01641 Vantaa. Tel: 90-85 45 250 Information lämnas i Sverige av: Eli Lilly Sweden AB, Box 30037, 10425 Stockholm. Tel: (0)8 6199450. Indirizzo per le communicazioni in Italia: Eli Lilly Italia Spa, Via Gramsci 731/733, 50019 Sesto Fiorentino (FI). Tel: (0)55 42571 Kontaktadresse in Österreich: Eli Lilly Ges. m.b.H., Barichgasse 40-42, A-1030 Wien. Tel: 711 78/412. Kontaktadresse in Deutschland: Lilly Deutschland GmbH, Niederlassung in 61343 Bad Homburg. Tel: 6172 273 426 Dirección de contacto en España: Lilly, S.A. , Avda. de la Industria 30, Poligono Industrial de Alcobendas, Alcobendas, 28100 Madrid. Tel: (1) 6 635 000. Pessoas a contactar em Portugal: Lilly Farma, Produtos Farmaceticos, LDA, Rua Dr. Antonio Loureiro Borges, 4- Piso 3, Arquiparque- Miraflores, 1495 Alges. Tel: (1) 410 9595 Kontakt in België. Contact en Belgique. Kontact im Belgien: Eli Lilly Benelux n.v. a.g., Rue de l’Etuve 52/1, Stoofstraat, Bruxelles 1000 Brussel. Tel: (02) 548 84 84. Til brug i Danmark: Eli Lilly Danmark A/S, Thoravej 4, 2400 København NV. Tel: 381 686 00. Pour toute information contacter en France: Lilly France, 203 Bureaux de la Colline, 92213 Saint-Cloud. Tel: (1) 49 11 34 34 For information in Ireland and the UK: Eli Lilly and Co. Ltd, Dextra Court, Chapel Hill, Basingstoke, Hampshire, RG21 5SY. Tel: (0)1256 315000 Informatie in Nederland: Eli Lilly Nederland BV, Krijtwal 17-23, 3432 ZT, Nieuwegein, Nederland. Tel: 30 60 25 800 54