evaluación de la viabilidad y concentración
Anuncio

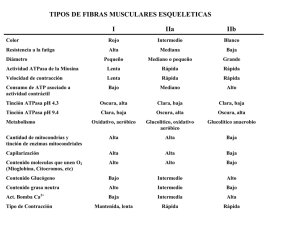
EVALUACIÓN DE LA VIABILIDAD Y CONCENTRACIÓN CELULAR Viabilidad Celular Método del Colorante de Exclusión. •Azul de tripano Ensayos: •Colorimétricos. •Fluorescentes. Método del Colorante de Exclusión Solución de azul de tripano, al 0.4% Prepared in 0.81% sodium chloride and 0.06% potassium phosphate, dibasic. Aplicaciones Para ensayos de Citotoxicidad y proliferación. Es un colorante vital que no se absorve por células viables sanas. Cuando las céluas son dañadas o están muertas, el azul de tripano puede entrar a la célula, permitiendo a la célula muerta ser contada. Ensayo Colorimétrico. Kits Cell Counting Kit-8 (CCK-8) WST-8 (2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium, monosodium salt), produce un colorante formazan soluble en agua por bioreducción en la presencia de un acarreador de electrónes, 1-Methoxy PMS. WST-8 es bioreducido por deshidrogenasa celular a un producto formazan anaranjado soluble en el medio de cultivo. El formazan producido es directamente proporcional al no. de células vivas. La solución de CCK-8 es muy estable y de poca toxicidad, se incuba de 24 a 48 h. La sensibilidad de la detección esmás alta que otras sales de tetrazolium como MTT, XTT o MTS. Ensayo Fluorescente. Propidium iodide solution solution (1.0 mg/ml in water) Membrana impermeabilizante, colorante intercalante fenantridinio exitado por láser de lámparas de mercurio o xenón. Uso: •Microscopía de fluorescencia, •Microscopía láser confocal de barrido, •Citometría de flujo, y • Fluorometría. Usado como contratinción nuclear. Tinciones: • Giemsa • Cristal violeta Tinción de Giemsa. Colorante policromático rojizo, Tiñe células cultivadas. Con la tinción de May-Grünwald se utiliza para teñir sangre, Núcleo rosa o magenta Nucleolos azul obscuro Citoplasma azul-gris pálido Las células se fijan en alcohol o formaldehído, y la preparación debe estar completamente anhidra. PROTOCOLO: Se cuenta con un cultivo celular en monocapa. Fijar el cultivo en metanol, teñir directamente con Giemsa sin diluir y después diluir el colorante 1:10. Lavar el cultivo y examinarlo ya seco. Materiales. • PBS • PBS-Metano, 1:1. • Colorante de Giemsa sin diluir. • Metanol. • Agua desionisada TINCIÓN CON CRISTAL VIOLETA. MATERIALES. No estériles. • • • • PBS. PBS-Metanol (MeOH). 50% de metanol en PBS. Metanol Cristal Violeta. Embudo de filtración y papel filtro de tamaño apropiado para tener 5 mL de colorante para cada caja Petri. • Botella para reciclar el colorante. PROTOCOLO. 1. Remover y descartar el medio. 2. Enjuagar la monocapa con PBS y descartar el líquido. 3. Agregar 5 mL de PBS-MeOH / 25 cm2. Reposar 2’, descartar el PBS-MeOH. 4. Agregar 5 mL de MeOH fresco por 10’. 5. Descartar el metanol, de la caja Petri y secar. 6. Agregar 5 mL del Cristal Violeta/ 25 cm2, reposar por 10’. 7. Pasar el colorante a la botella de reciclado. 8. Enjuagar con agua corriente y agua desionizada y dejar secar. MÉTODOS DE TINCIÓN IN VITRO. • Preparación. • Permeabilización. • Montaje. • Tinción Adecuada. Tinción directa Tinción indirecta. Afinidad de diferentes tejidos por diferentes colorantes. Tinción Negativa. COLORANTES La mayoría son compuestos orgánicos que tienen alguna afinidad específica por los materiales celulares. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y se combinan con intensidad con los constituyentes celulares cargados negativamente, tales como los ácidos nucléicos y los polisacáridos ácidos. Colorantes catiónicos: azul de metileno, el cristal violeta y la safranina. Colorantes aniónicos: eosina, la fucsina ácida y el rojo Congo. Colorantes liposolubles, negro Sudán. Colorantes histológicos más comunes, Reaccionan o se concentran en diferentes partes de las células o tejidos: Azul brillante de Coomassie(azul brillante), Azul de metileno, tiñe específ. toda proteína con un fuerte color azul. tiñe células animales, hace más visibles sus núcleos, colorante vital en reticulocitos. Azul Nilo (Azul Nilo), tiñe a los núcleos de color azul y para teñir células vivas. Bismarck brown (Bismarck brown Y o Manchester brown) imparte color amarillo a las mucinas ácidas. Bromuro de etidio (BE); se intercala en el ADN y le otorga un color rojo naranja fluorescente. Carmín, colorante de un intenso color rojo , la sal de litio tiñe glicógeno, las sales de alumbre-carmín se adhieren al núcleo. Se requiere el uso de un mordiente, que usualmente es aluminio o alumbre. Cristal violeta, API, combinado con un mordiente, tiñe las paredes celulares de color púrpura. Para Gram. colorante nuclear (tiñe núcleos) fluorescencia azul, si se excita con luz ultravioleta al estar unido al ADN. Eosina, se usa frecuentemente como contracoloración de la hematoxilina, impartiendo un color que va del rosado al rojo al material citoplasmático, membrana celular, y algunas estructuras extracelulares. Tinción Tipo Características Uso Hematoxilina Tiñe núcleos, ácidos nucleicos y Tinción Básica / estructuras basofílicas histológica Acidofílica (mitocondrias y ribosomas) en azul. general Eosina Tiñe proteínas y estructuras con Tinción Ácida / afinidad por los ácidos en diferentes histológica Basofílica tonos de rojo general Tinción hematoxilinaeosina Tinción hemalumbreeosina •Los núcleos aparecen en azul (hematoxilina) •Los ácidos nucleicos asociados a proteína (ej. ribosomas) en violeta •Fibra muscular en rojo Bicompo- •Tejido conectivo en rosado nente Anfifílica Tinción histológica general Tinción Similar a la tinción H&E con colores histológica más marcados y definidos general Tinción HOPS •Los núcleos aparecen en azul (hematoxilina) •La elastina aparece en negro (orceína) •Fibra muscular en rojo (filoxina) •Tejido conectivo (colágeno) en amarillo (safranina) Tinción HPS •Los núcleos aparecen en azul (hematoxilina) •Fibra muscular en rojo (filoxina) •Tejido conectivo (colágeno) en amarillo (safranina) Policromática Tinción de Papanicolau •Permite ver la cromatina con mucha claridad. • Núcleos entre azul y negro. •Células con alto contenido de queratina en amarillo. •Glucógeno en amarillo. •Células superficiales de naranja a rosado. •Células intermedias y parabasales entre turquesa y azul. •Células metaplásicas muestran coloraciones mezcladas (P. Ej. verde y rosa) Se utiliza para diferenciar células en muestras de secreciones biológicas (esputo, LCR, orina, etc.) y en raspados y biopsias. Permite distinguir con relativa facilidad células con transformaciones neoplásicas, levaduras y bacterias. Extendidos sanguíneos Tinción de Romanowsky Tinción de Wright Tinción de Giemsa Tinción de Jenner Tinción de Leishman Tinción de Field Tinción de MayGrünwald Tinción de MayGrünwald/Giemsa Pancromática de Romanowsky Tinción con azul de metileno Tinción con azul de prusia Supravital metacromática Tiñe de azul oscuro restos de ácidos nucleicos, y los proteoglicanos ácidos en varios tonos de violeta. Tiñe los depósitos de hemosiderina y hierro de color azul-celeste Diagnóstico de anemias regenerativas Demostración de estructuras metacromáticas Diagnóstico de hemopoyesis ineficaz, y hemocromatosis Tinción tricrómica de Masson •Los núcleos aparecen en marrón o negro •Keratina y músculo en rojo •Los citoplasmas en tonos de rosa •El colágeno y hueso en azul o verde Tinción tricrómica de Lillie Símil tricrómica de Masson Tinción tricrómica AZAN de Heidenhan Símil tricrómica de Masson, los citoplasmas aparecen en tonos de rojo más profundos y el conectivo en tonos más intensos de azul Tricrómica Tinción tricrómica de Mallory Símil tricrómica de Masson Tinción de Van Gieson •Núcleos celulares color marrón a negro. •Colágeno (tejido conectivo fibroso): Color rosa o rojo. •Músculo y Citoplasma: Color amarillo. Tinción de Movat Tinción tricrómica de Gömöri •Negro = núcleos, fibras elásticas •Amarillo = colágeno, fibras reticulares •Azul = sustancia basal, mucina •Rojo brillante = fibrina •Rojo = músculo Tricrómica Argéntica Tinción de WarthinStarry Tiñe de tonos de marrón y negro los depósitos de fosfato inorgánico en hueso. Tinción de Von Kossa Tinción de Golgi Tinción de Bielchowsky Tinción de Jones Argéntica Lado A Lado B COLORANTES FLUORESCENTES Caenorhabditis elegans DAPI (4',6-diamidino-2-fenilindol). Se une a la doble hélice metiéndose en el medio del canal menor. Fluorescence In-Situ Hybridization (FISH) USO DE ANTICUERPOS Filamentos Intermedios. Ab Microtúbulos. Colorante Fluorescente Microfilamentos. Células pulmonares en mitosis Microtúbulos en verde. Ab- anti-b tubulina conjugado con fluoresceína. Cromosomas teñidos de azul con colorante fluorescente (Hoechst 33342). Células en cultivo. Núcleos con Ioduro de propidio (rojo). Desmosomas con Ab anti-proteína desmosómica (verde). PRUEBAS DE FUNCIONALIDAD Reducción del MTT amarillo a Formazán de color azul. (3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide MTT actividad celular de enzimas oxidoreductasas dependientes de NAD (P)H Malato Deshidrogenasa CICLO DE KREBS Isocitrato Deshidrogenasa A-cetoglutarato Deshidrogenasa MTT XTT MTS WTS Mide: Viabilidad. Proliferación. Citotoxicidad. Actividad Citostática - Agentes potencialmente terapeúticos - Materiales tóxicos. Ensayos de Citotoxicidad LDH GOT-ASAT GPT-ALAT 40 74 γ-GT -GGTP 40 a 78 ALAT: GPT ASAT: GOT γ-GT : GGT : GGTP U/l U/l U/L (5 - 37) (5 - 40) ROJO NEUTRO