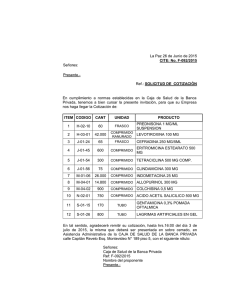
Anexo I Lista de nombres del medicmento, formas
Anuncio

Anexo I Lista de nombres del medicmento, formas farmacéuticas, dosis, vías de administración y titulares de la autorización de comercialización en los estados miembros 1 Estado miembro (en el EEE) Titular de la autorización de comercialización Nombre (inventado) Dosis Forma farmacéutica Vía de administración Austria WABOSAN Arzneimittelvertriebs GmbH, Anton Anderer Platz 6/1, A-1210 Viena Austria WABOSAN Arzneimittelvertriebs GmbH, Anton Anderer Platz 6/1, A-1210 Viena Austria TEVA Czech Industries s.r.o. Ostravská 29 747 70 Opava-Komárov República Checa PIERRE FABRE MÉDICAMENT 45, place Abel Gance 92100 Boulogne Billancourt Francia PIERRE FABRE MÉDICAMENT 45, place Abel Gance 92100 Boulogne Billancourt Francia PIERRE FABRE MEDICAMENT 45, place Abel Gance 92100 Boulogne Billancourt Francia Ergomed retard Kapseln 2,5 mg (1:1:1) Cápsula blanda de liberación prolongada Vía oral Ergomed - Tropfen 1 mg/ml (1:1:1) Gotas orales en solución Vía oral ERSILAN 1 mg/ml Gotas orales en solución Vía oral ISKEDYL FORT, comprimé 2,40 mg/19,20 mg Comprimido Vía oral ISKEDYL, comprimé 0,60 mg/4,80 mg Comprimido Vía oral ISKEDYL, solution buvable en flacon 0,10 g/0,80 g Solución oral Vía oral Austria República Checa Francia Francia Francia 2 Estado miembro (en el EEE) Titular de la autorización de comercialización Nombre (inventado) Dosis Forma farmacéutica Vía de administración Francia PIERRE FABRE MEDICAMENT 45, place Abel Gance 92100 Boulogne Billancourt Francia PHARMANEL PHARMACEUTICALS S.A. MARATHONOS 106, GERAKAS 15344 Grecia ISKEDYL, solution injectable en ampoule 0,3125 mg/ 6,25 mg Solución inyectable i.v./i.m. DIERTINA 3 mg/cápsula Cápsula blanda Vía oral Grecia PHARMANEL PHARMACEUTICALS S.A. MARATHONOS 106, GERAKAS 15344 Grecia DIERTINA 6 mg/dosis única Polvo para solución oral para dosis única Vía oral Grecia PHARMANEL PHARMACEUTICALS S.A. MARATHONOS 106, GERAKAS 15344 Grecia DIERTINA 6 mg/ comprimido Comprimido Vía oral Grecia VOCATE PHARMAKEFTIKI A.E. GOUNARI 150, GLYFADA, 16674 Grecia GENEPHARM A.E. 18TH Km MARATHONOS AVENUE, PALLINI, ATTIKIS, 15351 Grecia ERGOFIL 6 mg/ comprimido Comprimido Vía oral MEMOTIL / GENEPHARM 6 mg/ comprimido Comprimido Vía oral Grecia Grecia 3 Estado miembro (en el EEE) Titular de la autorización de comercialización Nombre (inventado) Dosis Forma farmacéutica Vía de administración Grecia ANTOR LTD P. MAVROMIHALI 1 VRILISSIA 15235 Grecia LEOVAN, M. LEWN & SIA EE ARGONAFTWN 22, ARGYROUPOLI, 16452 Grecia PHARMACEUTICAL INDUSTRY PROEL EPAM. G. KORONIS DILOU 9, PERISTERI, ATTIKIS, 12134 Grecia THRIOLAN 6 mg/ comprimido Comprimido Vía oral FENITINA 6 mg/ comprimido Comprimido Vía oral BEYTINA 6 mg/ comprimido Comprimido Vía oral Grecia FINIXFARM EPE DERVENAKION 38 & SAHINI, GERAKAS, 15344 Grecia CRISTIL 6 mg/ comprimido Comprimido Vía oral Grecia S.J.A. PHARM O.E. ARKOLEON 11, KATO PATISSIA, 10445 Grecia Pierre Fabre Médicament 45, PLACE ABEL GANCE F 92654 BOULOGNE CEDEX Francia AGIOBITA 6 mg/ comprimido Comprimido Vía oral Iskedyl Fort 2,40 mg/19,20 mg Comprimido Vía oral Daiichi Sankyo Portugal, Lda. PRT Lagoas Park, Edifício 11 2740-270 Porto Salvo Portugal Diertina 3 mg Cápsula dura Vía oral Grecia Grecia Luxemburgo Portugal 4 Estado miembro (en el EEE) Titular de la autorización de comercialización Nombre (inventado) Dosis Forma farmacéutica Vía de administración España LABORATORIOS DAVUR, S.L. Teide, 4 - planta baja Polígono Empresarial La Marina 28703 San Sebastián de los Reyes (Madrid) España TORA LABORATORIES S.L. Ferraz 80, 5º 28008 Madrid España ERGODAVUR GOTAS 1 mg (sobre monodosis) Gotas orales en solución Vía oral DIERTINE FORTE 2 mg/ml Gotas orales en solución Vía oral España 5 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización o la suspensión de las autorizaciones de comercialización, según proceda, teniendo en cuenta las indicaciones aprobadas para cada producto 6 Conclusiones científicas Resumen general de la evaluación científica de los medicamentos que contienen dihidroergocristina (véase el anexo I) El 18 de enero de 2012, Francia aplicó un procedimiento de arbitraje conforme al artículo 31 de la Directiva 2001/83/CE para los siguientes medicamentos que contienen derivados ergóticos: dihidroergocriptina/cafeína, dihidroergocristina, dihidroergotamina, dihidroergotoxina y nicergolina. Tras una revisión nacional de farmacovigilancia realizada en 2011, nuevas notificaciones espontáneas con algunos de estos productos detectaron casos graves de fibrosis y ergotismo, y Francia consideró que estos problemas de seguridad no se veían compensados por las limitadas pruebas de su eficacia. Se solicitó por tanto al CHMP que emitiera un dictamen sobre si las autorizaciones de comercialización de los medicamentos que contienen derivados ergóticos se deberían mantener, modificar, suspender o retirar, para las indicaciones siguientes: • • • • • • • • Tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias) Tratamiento coadyuvante de la claudicación intermitente en la enfermedad arterial oclusiva periférica (EAOP estadio II) Tratamiento coadyuvante del síndrome de Raynaud Tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular Retinopatías agudas de origen vascular Profilaxis de la migraña Hipotensión ortostática Tratamiento sintomático de la insuficiencia veno-linfática La dihidroergocristina es una agonista parcial de los receptores α-adrenérgicos, que disminuye la actividad de los centros nerviosos simpáticos y causa un efecto antiadrenérgico periférico con un aumento del tono de las paredes venosas. Además, tiene una acción farmacológica sobre los receptores serotoninérgicos y dopaminérgicos, responsable de sus interesantes efectos sobre el metabolismo cerebral. Está disponible combinado con raubasina, un agente antiadrenérgico y simpaticolítico que tiene un efecto inhibidor de los centros nerviosos simpáticos. Disminuye la presión arterial y aumenta el flujo sanguíneo periférico. Sus efectos se deben fundamentalmente a sus propiedades antagonistas de los receptores α1. En Europa, la dihidroergocristina también está disponible combinada con etofilina. De entre las indicaciones aprobadas para los medicamentos que contienen dihidroergocristina, las únicas que entran en el ámbito de este procedimiento de arbitraje y están aprobadas en al menos uno de los Estados miembros son las siguientes (el redactado de la indicación puede variar entre los distintos productos): • • • Tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias) Tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular Retinopatías agudas de origen vascular Los titulares de las autorizaciones de comercialización (TAC) presentaron todos los datos disponibles sobre la eficacia, procedentes de ensayos clínicos y estudios de observación, incluyendo datos que estuvieron disponibles a partir de que se concediese la autorización de comercialización inicial. Los TAC presentaron también sus propias sinopsis y resúmenes críticos de todos los informes espontáneos de reacciones fibróticas (cardíacas con o sin hipertensión arterial pulmonar, pulmonares, pleurales, peritoneales, retroperitoneales, etc.) y ergotismo con los medicamentos que contienen derivados ergóticos. Cuando fue posible, se proporcionó una revisión de los demás datos disponibles (es decir, datos de la literatura médica, datos preclínicos y otros datos clínicos, incluyendo estudios epidemiológicos) que fueran pertinentes para evaluar el riesgo de fibrosis. El CHMP ha tomado en consideración todos los datos disponibles sobre la seguridad y eficacia de la dihidroergocristina. 7 Eficacia clínica Los TAC presentaron 27 referencias bibliográficas en apoyo de la eficacia de la dihidroergocristina para la indicación «tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias)». De ellas, 18 relacionadas con ensayos controlados con placebo, 2 relacionadas con ensayos controlados con comparador activo y 7 relacionadas con estudios abiertos. De los 6 estudios aleatorizados, doble ciego y controlados con placebo, el CHMP consideró que 5 no eran relevantes porque la definición del diagnóstico no estaba normalizada, no se seleccionó un criterio principal de eficacia entre las evaluaciones multidimensionales, el número de pacientes por grupo era pequeño (de 47 a 65) y la duración del tratamiento fue corta (2 y 3 meses). Los resultados son heterogéneos e incoherentes. El CHMP consideró que no podían obtenerse conclusiones sobre la eficacia basadas en estos estudios. El estudio más reciente (Vellas, 1998 - no publicado) disponible a partir de que se concediese la autorización de comercialización inicial, utiliza una definición del diagnóstico normalizada (los pacientes deben presentar un déficit de memoria moderado, con una puntuación total en el MMSE (Mini-Mental Sate Examination) superior a 25 y una puntuación total en el autocuestionario de Mac Nair y Kahn para evaluación de las dificultades a la hora de realizar las actividades diarias superior a 38 e inferior a 70) y define el criterio principal de eficacia a priori (el autocuestionario de Mac Nair y Kahn y la prueba de Gröber y Buschke). Sin embargo, en este estudio con un estándar de calidad metodológica adecuado, no se observaron diferencias significativas entre el grupo de dihidroergocristina + raubasina y el grupo placebo. Hay 3 estudios controlados con placebo, con una población de estudio de 200 a 240 pacientes. De esos 3 estudios, los publicados por Lazzaroni et al. y Aranda et al. indicaron una superioridad sobre placebo, mientras que el de Vellas et al. demostró una eficacia similar con placebo. Existen otros 2 estudios más, de Hugonot et al., con una población de 114 a 127 pacientes, que muestran ambos una superioridad sobre placebo. En 6 de los estudios evaluables con una población inferior a 100 pacientes, los resultados fueron similares. Aunque se acepta que la terminología médica utilizada hoy en día y la utilizada en el pasado son distintas, y que los datos necesarios para la evaluación tienen en cuanta este aspecto, el síntoma clínico de demencia es el resultado de diversos procesos fisiopatológicos que hacen difícil el agrupamiento y la comparación de los datos, en especial cuando los diferentes estudios utilizan criterios de inclusión ligeramente distintos. Se revisaron y tuvieron en cuenta todos los datos presentados y, aunque pueden interpretarse como sugestivos de una ligera eficacia de la dihidroergocristina en el «tratamiento de las alteraciones cognitivas crónica en el anciano», la eficacia no puede considerarse suficientemente demostrada, principalmente debido a la falta de uniformidad de los datos generados en los ensayos clínicos más extensos. Se creó un grupo de asesoramiento científico (GAC) en diciembre de 2012 a requerimiento del CHMP, en el que los expertos debatieron, basándose en su experiencia clínica, si esta sustancia juega un papel en el tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias). El grupo subrayó que la indicación declarada ya no se utiliza en la práctica clínica y que, desde el punto de vista clínico, no hay pruebas hasta el momento de que exista una necesidad terapéutica de este principio activo en el tratamiento de las alteraciones cognitivas y neurosensoriales crónicas en el anciano. En cuanto a las indicaciones «tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular» y «retinopatías agudas de origen vascular», el CHMP consideró los pocos hallazgos preclínicos presentados que comunicaban los efectos de dosis tópicas de la dihidroergocristina insuficientes para apoyar el uso de este principio activo para bajar la presión intraocular o para otros trastornos oculares presumiblemente de origen vascular. Por otra parte, se indicó que las instilaciones tópicas de dihidroergocristina quedan fuera del ámbito de este procedimiento. El CHMP señaló también la posición de uno de los TAC de que, debido a las limitaciones de los datos disponibles, la indicación ocular no puede sostenerse. Seguridad clínica Se sabe que los derivados ergóticos son capaces de inducir fibrosis, en especial en las válvulas cardíacas. La relación entre la fibrosis y la activación de los receptores serotininérgicos, en especial 8 los receptores de 5-HT 2B por los derivados ergóticos está ampliamente descrita en la literatura médica. El agonismo por los receptores de 5-HT 2B induce una respuesta proliferativa y mitogenicidad de las células que expresan estos receptores, lo que conduce a la fibrogénesis. En general, la afinidad variable por los receptores serotininérgicos de los distintos derivados ergóticos y las dosis terapéuticas utilizadas podría explicar las diferencias observadas en las tasas de notificaciones de reacciones fibróticas. Por tanto, incluso si desde el punto de vista farmacológico es muy probable que los derivados ergóticos que actúan como agonistas de los receptores de 5-HT 2B puedan inducir una enfermedad valvular «serotoninérgica» similar a la inducida por tumores carcinoides o lesiones fibróticas de otros tejidos, se debe recordar que algunos de los derivados ergóticos no son agonistas de los receptores de 5-HT 2B . Por lo tanto, no pueden excluirse otros mecanismos inductores de fibrosis, lo que sugiere una relación causal entre la fibrosis y el agonismo de los receptores de 5-HT 2A y 5-HT 1B , así como un posible efecto sobre el transportador de serotonina. Los datos procedentes de los casos de fibrosis comunicados (n = 12) son indicativos de la capacidad de la dihidroergocristina para inducir reacciones fibróticas, la mayoría localizadas en el área pulmonar, considerando también la mejoría de algunos pacientes tras la interrupción del tratamiento. También existe la sospecha de que se comunican menos casos de los reales, ya que la sustancia se comercializa desde hace mucho tiempo y la fibrosis ya se menciona como un efecto indeseable en la información sobre el producto. Incluso en algunos casos de coadministración de un tratamiento que puede dar lugar a confusión (que se sabe induce reacciones fibróticas), la relación entre las reacciones fibróticas observadas y el tratamiento con dihidroergocristina no puede descartarse. Debe también subrayarse que se han comunicado informes sobre la reducción de la extensión de la placa fibrótica mucho tiempo después de la retirada del tratamiento con dihidroergocristina, mejorías tras suspender el tratamiento con dihidroergocristina y reexposición positiva (los síntomas vuelven a aparecer con la readministración). Esto indica una relación causal entre la fibrosis y la dihidroergocristina. Además, en la literatura médica se informaba de 1 caso de fibrosis retroperitoneal (con placa fibrótica) y un escáner realizado 1 año después de interrumpir el tratamiento con dihidroergocristina reveló una clara reducción de la placa fibrótica, que el CHMP consideró como una relación causal ente la fibrosis retroperitoneal observada y la dihidroergocristina. Basándose en estos datos y en la plausibilidad farmacológica, la dihidroergocristina se considera asociada a reacciones fibróticas. Sin embargo, debe subrayarse la intensidad de este tipo de efectos adversos, su posible resultado de muerte y el aumento del riesgo para el paciente de desarrollar un trastorno fibrótico con el uso a largo plazo de acuerdo con las indicaciones autorizadas. Además, de acuerdo con los casos comunicados, no puede excluirse una vasoconstricción provocada por dihidroergocristina. El CHMP estudió las propuestas de los TAC relativas a medidas de minimización del riesgo, entre las que se cuentan: limitar la duración del tratamiento en determinadas condiciones, no administrar el producto a pacientes con fibrosis preexistente, ni asociado a otros fármacos, emitir una DHPC haciendo hincapié en el riesgo, facilitar una lista de comprobación a los médicos y realizar un estudio farmacológico in vitro para determinar la afinidad de los receptores del subtipo 5-HT con el producto. Aunque algunas de las medidas propuestas podrían ayudar a identificar pacientes con fibrosis preexistente, medicaciones concomitantes relevantes y aumentos del riesgo, el Comité apuntó que eran insuficientes para evitar que algunos pacientes desarrollen fibrosis y ergotismo durante el tratamiento. En general, el CHMP consideró que ninguna situación justifica exponer a los pacientes al riesgo de fibrosis y ergotismo, teniendo en cuenta los limitadísimos datos sobre su eficacia. Relación riesgo/beneficio El Comité concluyó que la relación riesgo/beneficio de los medicamentos que contienen dihidroergocristina no es favorable, según el artículo 116 de la Directiva 2001/83/CE, para el tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias), para el tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular, y para las retinopatías agudas de origen vascular. 9 Motivos para la modificación de los términos de las autorizaciones de comercialización o la suspensión de las autorizaciones de comercialización Considerando que • El Comité ha seguido el procedimiento establecido en el artículo 31 de la Directiva 2001/83/CE para los medicamentos que contienen derivados ergóticos en las indicaciones contempladas. • El Comité consideró los datos generales proporcionados por los TAC y las conclusiones del grupo de asesoramiento científico. • El Comité consideró que no puede descartarse una posible relación causal entre reacciones fibróticas o ergotismo y la dihidroergocristina. Los datos disponibles son, de hecho, indicativos de dicha relación causal. Se ha recalcado la gravedad de los efectos adversos asociados y su posible resultado de muerte. • El Comité es de la opinión de que las pruebas de una eficacia clínicamente significativa de dihidroergocristina para las indicaciones actualmente evaluadas es muy limitada y, por tanto, los posibles beneficios para los pacientes en tales casos están sobrepasados por los riesgos antes señalados. • El Comité consideró que la relación riesgo/beneficio de los medicamentos que contienen dihidroergocristina: − No es favorable para el tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias). − No es favorable para el tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular. − No es favorable para las retinopatías agudas de origen vascular. Por tanto, conforme al artículo 116 de la Directiva 2001/83/CE, el CHMP recomienda: • La modificación de los términos de las autorizaciones de comercialización para los medicamentos que contienen dihidroergocristina a los que se hace referencia en el anexo I, a fin de eliminar las indicaciones siguientes de la información sobre el producto (el redactado de la indicación puede variar entre los distintos productos y los diferentes países) así como cualquier referencia relevante a estas indicaciones en la información sobre el producto, cuando haya otras indicaciones terapéuticas aprobadas como parte de su autorización de comercialización: − Tratamiento sintomático de las alteraciones cognitivas y neurosensoriales crónicas en el anciano (excluyendo la enfermedad de Alzheimer y otras demencias). − Tratamiento coadyuvante en la disminución de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular. − • Retinopatías agudas de origen vascular. La suspensión de las autorizaciones de comercialización para los medicamentos que contienen dihidroergocristina indicados en el anexo I, en el caso de que no se hayan aprobado otras indicaciones como parte de su autorización de comercialización. Para levantar la suspensión, los TAC deben identificar una población de pacientes para la cual los beneficios del producto superen con creces los riesgos conocidos. 10 Anexo III Modificaciones a las secciones correspondientes de los resúmenes de características del producto y prospectos 11 A. Resumen de las características del producto 4.1 Indicaciones terapéuticas (Se deben eliminar las indicaciones autorizadas actualmente que se presentan a continuación [el texto específico de la indicación puede variar de unos productos a otros]) • Tratamiento sintomático del deterioro cognitivo y neurosensorial patológico crónico en pacientes de edad avanzada (excepto enfermedad de Alzheimer y otras demencias) • Tratamiento complementario de la disminución de la agudeza visual y de los trastornos de campo visual de probable origen vascular • Retinopatías agudas de origen vascular Todas las referencias a las indicaciones mencionadas más arriba se deben borrar del resto de las secciones correspondientes de los resúmenes de las características del producto. B. Prospecto del envase Todas las referencias a las indicaciones mencionadas más arriba se deben borrar de las secciones correspondientes de los prospectos. 12 Anexo IV Condiciones para levantar la suspensión de las autorizaciones de comercialización 13 Condiciones para levantar la suspensión de las autorizaciones de comercialización Las autoridades nacionales competentes (ANC) de los Estados miembros, coordinadas por los Estados miembros de referencia, si procede, se asegurarán de que los TAC cumplan las condiciones siguientes: Los TAC deben identificar una población de pacientes para la cual los beneficios del producto superen con creces los riesgos. 14