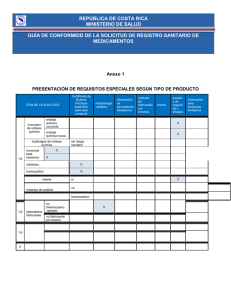
Información del Documento Original
Anuncio

Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015025656 DE 1 de Julio de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. ANTECEDENTES Que mediante Resolución No. 2014021868 de 16 de Julio de 2014 se concede la evaluación farmacológica para el producto ABRAXANE ® 100 mg. Que mediante escrito No. 2014066971 del 05/06/2014, el Señor Oscar Álvarez Flores, actuando en calidad de Representante Legal de la sociedad ABRAXIS BIOSCIENCE LLC con domicilio en 86 Morris Avenue, Summit, NJ 07901 ESTADOS UNIDOS DE AMÉRICA, solicita concesión del Registro Sanitario para el producto ABRAXANE ® 100 mg, en la modalidad de IMPORTAR Y VENDER a favor de ABRAXIS BIOSCIENCE LLC con domicilio en 86 Morris Avenue, Summit, NJ 07901 ESTADOS UNIDOS DE AMÉRICA. Que revisada la documentación allegada, este Despacho solicitó mediante auto No. 2015002073 de fecha 23/02/2015, el cumplimiento del siguiente requerimiento: Certificado de Venta Libre Indicar color del material de envase (frasco y tapón de bromobutilo). Sírvase aclarar como se realizaron los cálculos para el lote estándar. Albumina Humana: Explique el procedimiento de eliminación viral. Sírvase allegar inserto corregido con las indicaciones aprobadas para el producto bajo resolución No. 2015001438 de 19 de Enero de 2015. 6. Para el buen uso del medicamento sírvase allegar artes indicando en estas "contraindicaciones y advertencias ver inserto" 7. Sírvase allegar autorización de uso de la marca ABRAXANE. lD 1. 2. 3. 4. 5. de Que mediante escrito radicado No. 2015046638 de fecha 16/04/2015, el señor Gadil Ortiz Céspedes, actuando en calidad de representante legal de Industria Farmacéutica Unión de Vértices de Tecnofarma S.A., presentó respuesta al referido auto CONSIDERACIONES DEL DESPACHO ac ión Frente a los documentos allegados por el interesado, este Despacho se permite hacer las siguientes consideraciones: Que la marca Abraxane se encuentra registrada en la Superintendencia de Industria y Comercio a favor de la sociedad ABRAXIS BIOSCIENCE LLC con domicilio en ESTADOS UNIDOS DE AMÉRICA. Que mediante radicado No. 2015046638 de fecha 16/04/2015 el interesado da respuesta satisfactoria a todos los requerimientos del auto No. 2015002073 de fecha 23/02/2015. orm Que en el CPP expedido por la Administración de Alimentos y Medicamentos de los Estados Unidos el 06/02/2015, se indica que Abraxis BioScience LLC, con domicilio en 620 N 51 st Avenue, Phoenix Arizona 85043 fue inspeccionada y cumple con BPM para la fabricación del producto Abraxane ® 100 mg Suspensión para Solución Inyectable (partículas de paclitaxel ligadas a proteínas en suspensión inyectable). Y esta vigente hasta 06/02/2017 Inf Que el punto numero 5 del auto No. 2015002073 de fecha 23/02/2015 se solicito: Página 1 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015025656 DE 1 de Julio de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. "Sírvase allegar inserto corregido con las indicaciones aprobadas para el producto bajo resolución No. 2015001438 de 19 de Enero de 2015". En este no se solicita adicionar ningún texto mas. Pero el inserto versión Jun de 2014 allegado como respuesta no coincide en sus textos con el estudiado por la Sala Especializada de Medicamentos y Productos Biológicos de la Comisión Revisora en el radicado 2013075690 del 11/07/2013 (en el ítem de cuales son las posibles reacciones adversas de ABRAXANE?). Razón por la cual no se puede autorizar en la presente resolución. Al indicar los artes que las contraindicaciones y advertencias se encuentran en el inserto y este inserto no puede ser aprobado los artes tampoco podrán ser autorizados en la presente resolución. Se le recuerda al interesado que los artes son parte primordial del medicamento según la definición del mismo en el Decreto 677 de 1995, por tanto hasta que estos no sean autorizados no se podrá comercializar el producto. lD Que con base en el Decreto 677 de 1995, Decreto 2086 de 2010, la norma farmacológica No. 6.0.0.0.N10, acta de Comisión Revisora No. 02 de las sesiones ordinarias de los días 03, 04 y 05 de febrero de 2014, numeral 3.1.8.2. y la documentación allegada por el interesado previo estudio técnico y legal, la Dirección de Medicamentos y Productos Biológicos, RESUELVE Inf orm ac ión de ARTICULO PRIMERO.- Conceder REGISTRO SANITARIO por el término de CINCO (5) años al PRODUCTO: ABRAXANE REGISTRO SANITARIO No.: INVIMA 2015M-0015996 VIGENTE HASTA: TIPO DE REGISTRO: Importar y Vender TITULAR: ABRAXIS BIOSCIENCE LLC con domicilio en ESTADOS UNIDOS DE AMÉRICA FABRICANTE: ABRAXIS BIOSCIENCE LLC con domicilio en 620 N 51 st Avenue, Phoenix Arizona 85043 - ESTADOS UNIDOS DE AMÉRICA IMPORTADOR: INDUSTRIAL FARMACEUTICA UNION DE VERTICES DE TECNOFARMA S.A. con domicilio en BOGOTA - D.C. VENTA: Con Formula Facultativa FORMA FARMACEUTICA: Polvo Liofilizado para reconstituir a suspensión inyectable. VIA ADMINISTRACIÓN: Vía intravenosa (IV). PRINCIPIOS ACTIVOS: Cada VIAL O CADA AMPOLLA SEGÚN SEA EL CASO polvo liofilizado para suspensión inyectable contiene PACLITAXEL EN NANO PARTICULAS 100,0 mg PRESENTACIÓN COMERCIAL: Caja por un vial por 50 mL de vidrio tipo I incoloro - transparente, tapón de goma de bromobutilo y precinto de aluminio flip-off INDICACIONES: - Cáncer de mama metastásico: está indicado para tratar el cáncer de mama en caso de fracasar la quimioterapia combinada para la enfermedad metastásica o la recidiva dentro de los 6 meses de quimioterapia adyuvante. El tratamiento previo debe haber incluido una antraciclina, a menos que ésta esté clínicamente contraindicada. - Cáncer de pulmón no microcítico: está indicado como alternativo en el tratamiento de cáncer de pulmón no microcítico localmente avanzado o metastásico en combinación con carboplatino en pacientes que no son candidatos para cirugía curativa o terapia de radiación. Página 2 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015025656 DE 1 de Julio de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. - Adenocarcinoma de páncreas metastásico: está indicado para el tratamiento de adenocarcinoma de páncreas metastásico en combinación con gemcitabina. CONTRAINDICACIONES Y ADVERTENCIAS: Abraxane® no debería administrarse a pacientes con un recuento de neutrófilos inicial inferior a 1.500 células / mm3. El medicamento no debería administrarse nuevamente a pacientes que tuvieron una reacción de hipersensibilidad severa a abraxane® Precauciones: se debe realizar un monitoreo en busca de mielotoxicidad por medio de hemogramas completos de forma frecuente. No administrar abraxane® a pacientes con un recuento absoluto de neutrófilos (anc) basal inferior a 1.500 células / mm3. En caso de presentarse neutropenia severa (< 500 células / mm3 durante siete días o más) en el transcurso del tratamiento con abraxane®, reducir la dosis de abraxane® en los ciclos posteriores en pacientes con mbc o nsclc. Advertencias: la supresión de la médula ósea (principalmente neutropenia) depende de la dosis y es una toxicidad limitante de dosis de abraxane®. En estudios clínicos, la neutropenia grado 3 - 4 ocurrió en el 34% de pacientes con cáncer de mama metastásico y en el 47% de pacientes con cáncer de pulmón no microcítico. Las contraindicaciones y advertencias deben ir en las etiquetas y empaques mas la fecha de vencimiento y el numero de lote. El titular y el fabricante autorizado en el registro sanitario, adquieren la obligación de mantener las buenas practicas de manufactura y actualizar las especificaciones de materias primas y producto terminado, de acuerdo a la última versión de las farmacopeas oficiales en Colombia durante la vigencia del registro sanitario. Toda información científica, promocional o publicitaria sobre los medicamentos deberá ser realizada con arreglo a las condiciones del registro sanitario y a las normas técnicas y legales previstas en el artículo 79 del decreto 677 de 1995. Dos (2) años contados a partir de la fecha de fabricación. ac ión de OBSERVACIONES: Los reportes e informes de farmacovigilancia deben presentarse a la dirección de medicamentos y productos biológicos con la periodicidad establecida en la resolución No. 2004009455 del 28 de mayo de 2004. lD NOTA DE FARMACOVIGILANCIA: VIDA UTIL: CONDICIONES DE ALMACENAMIENTO: EXPEDIENTE No.: RADICACIÓN No.: Almacenar a una temperatura inferior a 30 ° C en su envase y empaque original. 20064116 2014066971 orm ARTICULO SEGUNDO: Debe allegar dentro de los (30) días calendario siguientes a la notificación de la presente Resolución; bocetos de etiquetas y cajas a color donde se incluya el número del registro sanitario y ajustar sus textos de acuerdo a lo dispuesto en la presente Resolución y el articulo 72 del decreto 677/95. Además de Inserto ajustándose a lo estipulado en la parte considerativa del presente proveído. Inf ARTICULO TERCERO: El tiempo de vida útil asignado para el medicamento amparado en la presente resolución, se soportó con estudios (naturales / acelerados) con la siguiente frecuencia de tiempos 0, 3, 6, 12, 18 y bajo condiciones de humedad y Temperatura de (30 °C) (65 %HR). Por tanto el interesado debe dar cumplimiento al Decreto 677 de 1995, Artículo 22, Parágrafo segundo, en el sentido de presentar los resultados completos de los estudios de envejecimiento natural. Página 3 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015025656 DE 1 de Julio de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. ARTICULO CUARTO.- Contra la presente Resolución procede únicamente el Recurso de Reposición, que deberá interponerse ante la Directora de Medicamentos y Productos Biológicos, del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, dentro de los DIEZ (10) días siguientes a su notificación, en los términos señalados en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo. ARTICULO QUINTO.- La presente Resolución rige a partir de la fecha de su ejecutoria. lD COMUNIQUESE, NOTIFIQUESE Y CUMPLASE Dada en Bogotá, D.C. a los 1 de Julio de 2015 Este espacio, hasta la firma se considera en blanco. de LUZ HELENA FRANCO CHAPARRO DIRECTORA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Inf orm ac ión Proyectó: Legal: msobrinom, Técnico: jmadridb Revisó: cordina_medicamentosProyectó Página 4 de 4