DETERMINACIÓN CUANTITATIVA DE PROTEINAS
Anuncio

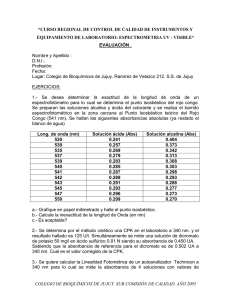
Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas DETERMINACIÓN CUANTITATIVA DE PROTEINAS Objetivos: Al finalizar este trabajo práctico los alumnos estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento químico de la Ley de Beer-Lambert. - Conocer el principio que rige la determinación cuantitativa de proteínas por los métodos de Biuret y Bradford. - Calcular la concentración de proteínas en muestras biológicas. Introducción: Conceptos básicos sobre espectrofotometría La espectrofotometría es uno de los métodos analíticos de mayor importancia y utilidad en bioquímica ya que permite medir la cantidad relativa de luz absorbida o transmitida por la materia (ej. moléculas biológicas en disolución acuosa: proteínas, aminoácidos, metabolitos, etc.) medida como absorbancia (Abs) o transmitancia (%T), respectivamente. La absorbancia es la medida de la cantidad de luz bloqueada o absorbida por una solución. Las moléculas que absorben luz se llaman cromóforos. El color de las sustancias se debe a que éstas absorben ciertas longitudes de onda de la luz blanca que incide sobre ellas y solo dejan pasar a nuestros ojos, aquellas longitudes de onda no absorbida. Todas las sustancias pueden absorber energía radiante, aun el vidrio que parece ser completamente transparente, absorbe longitudes de ondas que pertenecen al espectro visible; el agua absorbe fuertemente en la región del infrarrojo. La absorción de las radiaciones visibles, ultravioleta e infrarrojas depende de la estructura de las moléculas, y es característica para cada sustancia química. La transmitancia es el parámetro inverso de la absorbancia, constituye la medida porcentual de la cantidad de radiación o luz que pasa a través de la solución. 1 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II De este modo, una Práctica: Determinación Cuantitativa de Proteínas solución no coloreada no absorbente, mostrará 100% de transmitancia en un espectrofotómetro calibrado, y 0,00 de absorbancia (Figura 1). A= - Log (% T/100) Luz incidente Luz emergente no absorbida T = 100 (Antilog –A) Figura 1. Relación entre absorbancia y transmitancia. Para medir la absorbancia y/o transmitancia de un compuesto en solución se utiliza el espectrofotómetro, instrumento que permite determinar la radiación absorbida o transmitida por una solución, a una determinada longitud de onda. Los componentes básicos de cualquier espectrofotómetro son: 1.-Fuente de luz o radiación la cuál tiene intensidad constante en el rango de longitud de onda que abarca (usualmente es una lámpara de tungsteno para luz visible, y una de deuterio para luz ultravioleta); 2. Monocromador que selecciona la longitud de onda deseada del espectro y la dispersa al compartimiento de la muestra; 3.-Compartimiento para la muestra y 4.-Fotodetector, que mide cuantitativamente la radiación que pasa por la muestra (Figura 2). 2 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Figura 2. Componentes de un espectrofotómetro Los avances tecnológicos de los últimos años han permitido mejorar la precisión y versatilidad de los espectrofotómetros, por lo tanto hay diversos modelos disponibles en el mercado, según la utilidad que se le va a dar. Ley de Beer- Lambert. La fracción de luz incidente que es absorbida por una solución depende de la longitud de onda, de la concentración del compuesto absorbente en solución y de su naturaleza química. La relación matemática entre estas variables fue establecida por Beer- Lambert y se expresa con la siguiente ecuación: A = åcl Donde: A = Absorbancia o densidad óptica, å = Coeficiente de absortividad molar (constante), c = Concentración de la muestra y l = Longitud de onda Si se mantiene constante l, tenemos que A es directamente proporcional a la concentración de la muestra. 3 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas De este modo, la ley de Beer- Lambert establece que la concentración de un analito en solución, es directamente proporcional a la cantidad de energía radiante absorbida e inversamente proporcional al logaritmo de la energía radiante transmitida. Cuando se desconoce la concentración de un analito, ésta puede ser determinada a partir de una curva de calibración que se construye graficando los valores de absorbancia contra distintas concentraciones de un estándar o patrón. La interpolación de la absorbancia de la muestra desconocida en la curva de calibración nos permitirá conocer la concentración del analito. Cuando el método de determinación del analito cumple la ley de Beer-Lambert, la curva resulta una función lineal, por lo que se puede calcular la concentración del analito aplicando la siguiente ecuación: AA x CE CA = AE Donde: CA= Concentración del analito AA= Absorbancia del analito CE= Concentración del estándar Ventajas y aplicaciones de la espectrofotometría Este método analítico presenta varias ventajas sobre otros métodos de laboratorio, tales como: rapidez, precisión, versatilidad, fácil aplicación y eficiencia en costo. La espectrofotometría tiene diversas aplicaciones, entre las que se pueden mencionar: - Análisis cuantitativo de compuestos (orgánicos o inorgánicos) -Identificación de compuestos según su espectro de absorción 4 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Determinación cuantitativa de proteínas por espectrofotometría El contenido de proteínas de una muestra biológica es un parámetro de gran utilidad tanto para el investigador como para profesionales del área clínica. Este dato es importante para el bioquímico, ya que puede precisar la eficiencia de un método de aislamiento proteico o la cantidad de proteínas de fluidos corporales o de una determinada fracción subcelular. Para el Veterinario, Médico o el Bioanalista, la concentración sérica o urinaria de proteínas puede reflejar la presencia de algún estado patológico o simplemente verificar la condición fisiológica del animal. Para determinar la cantidad de proteínas en muestras biológicas existe una diversidad de métodos. Unos se basan en principios físicos como la refractometría, otros en determinar la composición de nitrógeno total de la muestra y luego calcular la cantidad de proteínas como el método de Kjeldhal. Sin embargo, estos métodos como herramientas de trabajo en el laboratorio de Bioquímica son poco precisos. El surgimiento del espectrofotómetro abrió camino a un gran número de pruebas, basadas en la ley de Lambert y Beer, entre ellas la determinación cuantitativa de proteínas. Alguno de los métodos para cuantificarlas son: Biuret, Lowry y Bradford. Todos los métodos colorimétricos poseen distintas sensibilidades y rangos de detección por lo que la escogencia del mismo dependerá de la naturaleza de la muestra a ser analizada. Método de Biuret Este método recibe su nombre debido a que el color que se produce en esta reacción, es similar al de la condensación de dos moléculas de urea, conocido en alemán como: Biuret. Se fundamenta en la formación de un compuesto azul violeta por la reacción del ión cúpicro con la proteína en medio alcalino. Este ión forma un enlace covalente coordinado (Figura 1). Una condición indispensable para la positividad de la reacción es que el compuesto analizado posea al menos dos enlaces peptídicos en su estructura. En el caso de los aminoácidos y dipéptidos la reacción es negativa. Si se observa la reacción se verá claramente porqué hacen falta dos enlaces: 5 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II C Práctica: Determinación Cuantitativa de Proteínas O N H O C C CH R R 2 C OH O NH H N Cu ++ O CH CH R C O Cu ++ - O C N H H N Enlaces Peptídicos N H Enlace covalente coordinado Figura 1. Reacción de Biuret El color formado responde a la ley de Lambert y Beer, por lo tanto es posible la cuantificación de las proteínas presentes en una muestra desconocida, mediante la comparación de la absorbancia de la muestra con la de los estándares de concentración conocida. Este método detecta proteinas en un rango de 0,5 a 10 mg/mL, lo que es suficiente para medir la cantidad de proteínas en algunos fluidos biológicos como el suero y el plasma, ambos con concentraciones mayores de 6 g%. Método de Bradford Éste se basa en la capacidad que presenta el azul brillante de Coomasie G-250 de unirse a las cargas positivas de la estructura proteica. El colorante presenta dos estructuras, la roja predominante en solución (Absmax= 465 nm) y la azul, cuando se encuentra asociado a las proteinas (Absmax= 595 nm). OC 2 H 5 NH CH 3 CH 3 C 2H5 - N H 5C2 N CH 2 CH 2 OS 3 S3O - 6 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Figura 2. Estructura del azul de coomasie G250 Debido a que la respuesta del método es la misma para una gran cantidad de proteínas, la cuantificación se puede llevar a cabo usando cualquier estándar disponible. La interferencia de otros compuestos distintos a las proteínas es mínima. La sensibilidad del método esta en el rango de 0,2 a 20 µg/mL. Es decir 1000 veces más sensible que el método de Biuret. MATERIALES Y REACTIVOS - Reactivo de Biuret: 1,5 g de CuSO4 : 5 H2O y 6 g de tartrato de sodio y potasio se disuelven en 500 mL de agua. Añadir 300 mL de NaOH al 10% y aforar a 1L. - Reactivo de Bradfrod: 100 mg de azul brillante de Coomasie G 250 se disuelven en 50 mL de etanol al 95%. Añadir 100 mL de H3PO4 al 85% (concentrado) y aforar a 1 L con agua destilada. Filtrar a través de papel filtro Whatman N° 1. Para probar el reactivo medir la absorbancia contra un blanco de agua destilada a 595 nm, el valor debe estar entre 0,4 y 0,6 UA. - Standard de proteína 2 g% - Espectrofotómetro - Cubetas para espectrofotometría - Azul brillante de Coomasie G-250 - NaCl 0,9% - Pipetas volumétricas de 1, 2 y 5 mL. - 12 tubos de ensayo. PARTE EXPERIMENTAL: Experimento Nº 1 Determinación de proteínas por el método de Biuret Procedimiento: - Preparar una dilución 1:10 de plasma bovino en un tubo de ensayo (muestra problema) - Prepare los estandares, blanco y muestra como se indica en el siguiente cuadro: 7 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Reactivos Blanco Estándar 0,2 g% Estándar 0,6 g% Estándar 1,0 g% Estándar Muestra 1,2 g% problema Estándar albúmina 2 g% ___ 0,1 mL 0,3 mL 0,5 mL 0,6 mL ___ NaCL 0,9% 1 mL 0,9 mL 0,7 mL 0,5 mL 0,4 mL ___ Plasma diluido ___ ___ ___ ___ ___ 1 mL 1:10 Reactivo de 5 mL 5 mL 5 mL 5 mL 5 mL 5 mL Biuret Una vez agregado el reactivo de Biuret, espere 10 minutos y proceda a leer la absorbancia a 545 nm con ayuda del espectrofotómetro. Anote los resultados en la tabla anexa para el posterior análisis. RESULTADOS TUBO ABSORBANCIA Estándar 0,2 g% Estándar 0,6 g% Estándar 1,0 g% Estándar 1,2 g% Muestra problema Experimento N° 2 Determinación de proteínas por el método de Bradford Procedimiento: - A partir del estándar de proteínas (2 g%) prepare por dilución 100 mL de una solución que contenga 100 mg%, y a partir de ésta prepare 100 mL de estándares que contengan 10, 25, 50 y 100 mg% de proteína. - Prepare 100 mL de una dilución de plasma bovino 1:100 que se utilizará como muestra problema. 8 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Prepare la siguiente serie de tubos: Reactivos blanco Estándar 10 mg% Estándar 25 mg% Estándar 50 mg% Estándar ___ 0,1 mL 0,1 mL 0,1 mL 0,1 mL ___ 0,1 mL ___ ___ ___ ___ ___ ___ ___ ___ ___ ___ 0,1 mL 5 mL 5 mL 5 mL 5 mL 5 mL 5 mL NaCl 0,9 % Plasma diluido 1:100 Reactivo de Bradford Estándar Muestra 100 mg% problema - Mezclar bien y leer la absorbancia con un espectrofotómetro a 595 nm dentro del lapso de 15 a 20 minutos después de agregar el reactivo de Bradfrod. Una vez obtenidos los resultados anótelos en la tabla que se suministra a continuación para su posterior análisis y discusión. RESULTADOS TUBO ABSORBANCIA 10 mg% 25 mg% 50 mg% 100 mg% Muestra problema Con los datos de cada tabla construya una curva patrón para cada método (graficando la concentración de proteinas en el eje “x” contra absorbancia en el eje “y”) y mediante extrapolación, estime la concentración de proteínas de la muestra. Considere la dilución realizada en el procedimiento de cada método. Discuta las diferencias encontradas entre ambos métodos, así como sus ventajas y desventajas en el análisis de muestras biológicas. 9 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Determinación Cuantitativa de Proteínas Auto evaluación 1. Establezca diferencias entre el método de Kjelhdal y los estudiados en esta práctica. 2. Que ventaja representa el hecho de que el reactivo de Bradford posea absorbancia a dos longitudes de onda distintas, una libre y otra asociado a las proteínas. 3. En base a la sensibilidad que presentaron los métodos estudiados, que aplicaciones prácticas tiene cada uno de éstos. 4. Las proteasas son enzimas que rompen los enlaces peptídicos hasta llevar las proteínas a aminoácidos libres. Si una proteína es incubada con estas enzimas que sucederá con la absorbancia en el tiempo al medir la concentración de éstas por alguno de los métodos estudiados. ¿En cuál la absorbancia se hace cero primero? Bibliografía A.V. Chechetkin, V.I. Voroniaski, G.G. Pokusay. Prácticas de Bioquímica del ganado y aves de corral. Boyer, Rrodney. Modern Experimental Biochemistry. 2da Edición. Benjamin Cummins Editores. 1993. Bradford, M. “A rapid and sensitive meted for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding”. Anal. Biochem. 72: 248-254. 1976. 10 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.