apuntes de formulación - fyq
Anuncio
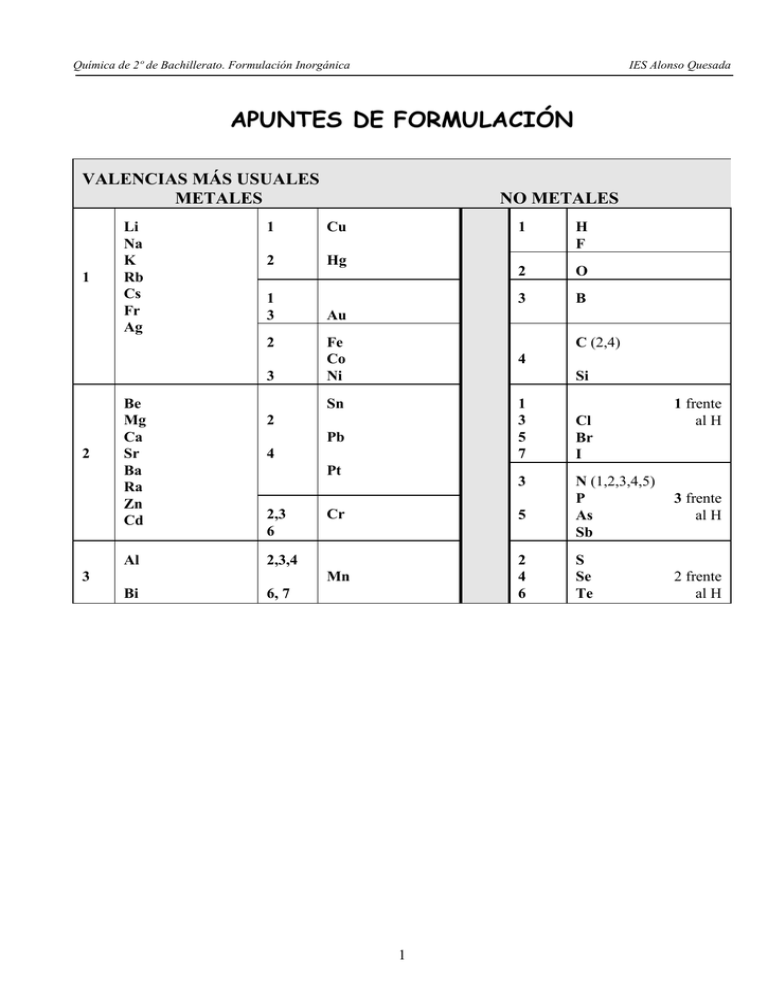
Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada APUNTES DE FORMULACIÓN VALENCIAS MÁS USUALES METALES 1 Li Na K Rb Cs Fr Ag 1 Cu 2 Hg 1 3 Au 2 3 2 Be Mg Ca Sr Ba Ra Zn Cd NO METALES Fe Co Ni Pt Bi 6, 7 3 B 1 3 5 7 4 3 O Si Pb 2,3,4 2 4 Sn Al H F C (2,4) 2 2,3 6 1 3 Cr 5 Mn 2 4 6 1 Cl Br I N (1,2,3,4,5) P As Sb S Se Te 1 frente al H 3 frente al H 2 frente al H Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada VALENCIAS MÁS USUALES METALES 1 Li Litio Na Sodio K Potasio Rb Rubidio Cs Cesio Fr Francio Ag Plata 1 Cu Cobre 2 Hg Mercurio 1 3 Au Oro 2 Fe Hierro Co Cobalto Ni Níquel 3 2 Be Berilio Mg Magnesio Ca Calcio Sr Estroncio Ba Bario Ra Radio Zn Cinc Cd Cadmio NO METALES Pt Platino Bi Bismuto 6,7 3 B Boro 1 3 5 7 4 3 O Oxígeno Si Silicio Pb Plomo 2,3,4 2 4 2 Al Aluminio H Hidrógeno F Flúor C Carbono (2,4) Sn Estaño 2,3, 6 1 3 Cr Cromo 5 Mn Manganeso 2 2 4 6 Cl Cloro Br Bromo I Yodo [4 frente al H] [1 frente al H] N Nitrógeno (1,2,3,4,5) P Fósforo [3 frente As Arsénico al H] Sb Antimonio S Azufre Se Selenio Te Teluro [2 frente al H] Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada FORMULACIÓN Y NOMENCLATURA INORGÁNICA 1.Compuestos binarios Formulas y Nombres 1.1 Óxidos: óxidos básicos (metálicos) y óxidos ácidos (no metálicos) 1.2 Peróxidos Na2O (Óxido de sodio) Nx Oy Stock [óxido de metal (nºs romanos)] PbO2 [Óxido de plomo (IV)] Sistemática: Prefijo numeral Cl2O7 (Heptaóxido de dicloro) SO3 (Trióxido de azufre) Mx O2 (peróxido de metal) K2O2 (Peróxido de potasio) BaO2 (Peróxido de bario) Peróxido = óxido + oxígeno 1.3 Hidruros metálicos. Ejemplos MHx Stock [Hidruro de metal (nºs romanos)] Cu H2 (Hidruro de cobre (II) BiH3 [Hidruro de bismuto] 1.4 Hidruros no metálicos: N Hx Sistemática: Prefijo numeral. 1.4.1. Hidruros volátiles. NH3 (Trihidruro de nitrógeno; amoniaco) CH4 (Tetrahidruro de carbono; metano) 1.4.2 Ácidos hidrácidos HxN 1.5 Combinaciones binarias metal - no metal: Sales binarias 1.6 Combinaciones binarias entre no metales: no metal - no metal. MxNy H2S (sulfuro de hidrógeno) (ácido sulfhídrico) HCl (Cloruro de hidrógeno) (ácido clorhídrico) Fe Cl3 [Cloruro de hierro (III)] Al2S3 [Sulfuro de aluminio] Nombres especiales 2. Compuestos ternarios 2.1. Hidróxidos. (---uro de hidrógeno) (ácido --- hídrico) Stock [ --uro de metal (nºs romanos)] NxN´y Sistemática: Prefijo numeral. Formulas y Nombres M(OH)x Stock: Hidróxido de metal ((nºs romanos 2.2. Oxácidos. HxNOy Tradicional (ácido ---oso) (ácido –ico) Sistemática (prefijo—oxo-ato (nº romano) de hidrógeno) 2.3. Sales neutras. Oxosales Mx(NOy)z Tradicional: –ato de metal (nº romano) Sistemática (prefijo—oxo-ato (nº romano) de hidrógeno) 2.4. Sales ácidas. Mx(HNOy)z Hidrogeno-ato de metal (nº romano) 3. Iones: 3.1 Aniones Especies cargadas Especies cargadas negativamente Monoatómicos: ion --uro Poliatómicos: ion --ato o --ito Especies cargadas positivamente 3.2 Cationes 3 CCl4 (Tetracloruro de carbono) SF6 (Hexafluoruro de azufre) Ejemplos Cu (OH)2 [Hidróxido de cobre (II)] Ca (OH)2 (Hidróxido de calcio) HClO3 (ácido clórico) (Trioxo clorato (V) de hidrógeno. H2SO3 (ácido sulfuroso) (Trioxo sulfato (IV) de hidrógeno Ba(ClO3)2 (Clorato de bario) [Trioxo clorato (V) de bario] Pb (SO4)2 [Sulfato de plomo (IV)] [Tetraoxo sulfato (VI) de plomo (IV)] K2Cr2O7 [Heptaoxodicromato (VI) de potasio] NaHCO3 [Hidrógenocarbonato de sodio] [Hidrógeno-trioxo carbonato (IV) de sodio] - 2- Cl [ion cloruro]; S [ion sulfuro] 22SO4 [Ion sulfato]; SO3 [Ion sulfito] MnO4 [Ion tetraoxomanganato (VII)] 2+ 3+ Cu [Ion cobre (II)]; Al [Ion aluminio] + NH4 [Ion amonio] Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 1. COMPUESTOS BINARIOS 1.1. ÓXIDOS : Combinaciones binarias de los elementos con el oxígeno. Su formula general es [ExOy). Para formularlos se escribe el símbolo del elemento al lado el símbolo del oxígeno. Las valencias se cruzan, pasando la del elemento al oxígeno y la del oxígeno al elemento. Se simplifica si se puede. el oxígeno siempre actúa en los óxidos con valencia 2 (número de oxidación: -2). Para nombrar los óxidos metálicos u óxidos básicos se recomienda la nomenclatura de Stock, mediante la palabra óxido, seguida del nombre del metal y a continuación su valencia con números romanos entre paréntesis, si tiene varias. Para nombrar los óxidos no metálicos u óxidos ácidos se recomienda la nomenclatura sistemática o del prefijo numeral en la que se indican las proporciones en que se encuentran los elementos mediante los prefijos griegos: mono-, di-, tri, tetra, penta-, hexa-, hepta, etc., para 1,2,3,4,5,6,7, etc átomos. El prefijo mono se puede sustituir si no es necesario. Ejemplos: ÓXIDOS Nomenclatura de Stock Nomenclatura sistemática (I.U.P.A.C.) Na2O FeO Fe2O3 Cl2O5 CO2 N2O NO N2O3 NO2 N2O4 N2O5 Óxido de sodio Óxido de hierro (II) Óxido de hierro (III) Óxido de cloro (V) Óxido de carbono (IV) Óxido de nitrógeno (I) Óxido de nitrógeno (II) Óxido de nitrógeno (III) Óxido de nitrógeno (IV) Óxido de nitrógeno (IV) Óxido de nitrógeno (V) Óxido de sodio Monóxido de hierro Trióxido de dihierro Pentaóxido de dicloro Dióxido de carbono Óxido de dinitrógeno Monóxido de nitrógeno Trióxido de dinitrógeno Dióxido de nitrógeno Tetraóxido de dinitrógeno Pentaóxido de dinitrógeno La nomenclatura tradicional: Empleaba las terminaciones -oso e -ico para indicar la valencia menor y mayor. Y los prefijos hipo- y per- cuando las valencias eran más de dos. A los óxidos no metálicos los nombraba como anhídridos. La I.U.P.A.C. desaconseja esta nomenclatura en desuso; no es recomendable sus utilización. 1.2 PERÓXIDOS Son óxidos en los cuales existe el grupo peroxo (-O-O-), o un enlace simple oxígeno-oxígeno. En los peróxidos el oxígeno tiene de número de oxidación (-1). Peróxidos = Óxidos + O. Para nombrarlos se recomienda utilizar la nomenclatura de Stock. ÓXIDOS PERÓXIDOS K2O CaO Cu2O CuO H2O K2O2 CaO2 Cu2O2 CuO2 H2O2 Óxido de potasio Óxido cálcico Óxido de cobre (I) Óxido de cobre (II) Agua 4 Peróxido de potasio Peróxido de calcio Peróxido de cobre (I) Peróxido de cobre (II) Peróxido de hidrógeno Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 1.3 HIDRUROS METÁLICOS Son combinaciones binarias de los metales con el hidrógeno. [MHx] Para formularlos se escribe el símbolo del metal seguido del símbolo del hidrogeno con la valencia del metal. El número de oxidación del hidrógeno en los hidruros es (-1). Para nombrarlos se recomienda la nomenclatura de StocK por medio de la palabra hidruro seguida con la valencia del metal, con la valencia entre paréntesis, si tiene varias. HIDRUROS KH CaH2 NiH2 NiH3 PbH4 Nomenclatura de Stock Nomenclatura sistemática (I.U.P.A.C.) Hidruro de potasio Hidruro de calcio Hidruro de níquel (II) Hidruro de níquel (III) Hidruro de plomo (IV) Hidruro de potasio Hidruro de calcio Dihidruro de níquel Trihidruro de níquel Tetrahidruro de plomo 1.4 COMBINACIONES BINARIAS NO METAL HIDRÓGENO 1.4.1. HIDRUROS ÁCIDOS: ÁCIDOS HIDRACIDOS Son combinaciones de los no metales de los grupos VI A y VII A con el hidrogeno. [HxN] Para formularlos se escribe el símbolo del hidrógeno con el subindice 1 o 2 (según la valencia del no metal) seguido del símbolo del no metal. El hidrogeno en los ácidos hidrácidos tiene de estado de oxidación (+1). Para nombrarlos se recomienda la nomenclatura sistemática, que hace terminar en -uro el nombre del no metal de los grupos VI A del oxigeno o VII A del fluor seguido de "de hidrógeno". En las disoluciones acuosas de dichas sustancias se suele utilizar la nomenclatura tradicional que empieza con la palabra ácido seguido del nombre del no metal terminado en -hidrico. ACIDOS HIDRACIDOS Nomenclatura Sistemática Nomenclatura tradicional HF HCl HBr HI Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Ácido fluorhídrico Ácido clorhídrico Ácido bromhídrico Ácido yodhídrico H2S H2Se H2Te Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno Ácido sulfhídrico Ácido selenhídrico Ácido telurhídrico 5 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 1.4.2. HIDRUROS NO METALICOS ESPECIALES: HIDRUROS VOLATILES Combinaciones de los no metales de los grupos IV a y VA con el hidrógeno. [NHx] Aunque se puede utilizar la nomenclatura sistemática, la I.U.P.A.C. admite en este caso la nomenclatura tradicional de todos estos hidruros de no metales. HIDRUROS VOLATILES Nomenclatura Sistemática Nomenclatura tradicional CH4 SiH4 Tetrahidruro de carbono Tetrahidruro de silicio Metano Silano NH3 PH3 AsH3 SbH3 Trihidruro de nitrógeno Trihidruro de fósforo Trihidruro de arsénico Trihidruro de antimonio amoniaco Fosfina Ársina Estibina BH3 Trihidruro de boro Borano El borano (BH3) es en realidad un dimero (B2H6)llamado diborano. 1.5 COMBINACIONES BINARIAS METAL - NO METAL: SALES BINARIAS Son combinaciones binarias de metal y no metal. Se forman sustituyendo el hidrógeno de los ácidos hidrácidos por metales. Su formula general es [MxNy] Para formularlos se escribe el símbolo del metal al lado el símbolo del no metal. Las valencias se cruzan. Se simplifica si se puede. Para nombrarlos se recomienda la nomenclatura de Stock para lo que se hace terminar en -uro el nombre del no metal seguido del nombre del metal seguido de la valencia entre paréntesis, si tiene varias. SALES BINARIAS Nomenclatura de Stock Nomenclatura sistemática (I.U.P.A.C.) NaCl CuCl CuCl2 CaS NH4Cl PbS2 CoBr3 Al2Se3 SnI4 Cloruro de sodio Cloruro de cobre (I) Cloruro de cobre (II) Sulfuro de calcio Cloruro amónico Sulfuro de plomo (IV) Bromuro de cobalto (III) Seleniuro de aluminio. Yoduro de estaño (IV) Monocloruro de sodio Monocloruro de cobre Dicloruro de cobre Sulfuro de calcio Cloruro amónico Disulfuro de plomo Tribromuro de cobalto Triseleniuro de dialuminio Tetrayoduro de estaño. 1.6 COMBINACIONES BINARIAS ENTRE NO METALES: NO METAL - NO METAL. 6 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada Su formula general es [TxNy] Son combinaciones binarias entre dos no metales. Se pone a la derecha el elemento más electronegativo, el de carácter más no metálico, el que figure primero en la siguiente serie: F, Cl, Br, I, S, Se, Se, Te, N, P, As, Sb, C, Si, B Para formularlos se escribe el símbolo del metal menos electronegativo, seguido del metal más electronegativo. Las valencias se cruzan. Se simplifica siempre que se pueda. Para nombrarlo se recomienda la nomenclatura sistemática o funcional que hace terminar en -uro el nombre del elemento mas no metálico seguido de la preposición de seguido del nombre del menos no metálico, para indicar las proporciones de ambos no metales se anteponen los prefijos numerales (mono-, di-, tri-, tetra-). EJEMPLOS BrCl IBr3 SF6 CCl4 SBr2 B2S3 PCl5 Si3N4 As2S5 NCl3 Nomenclatura de Stock o funcional Nomenclatura sistemática (I.U.P.A.C.) Cloruro de bromo Bromuro de yodo (III) Fluoruro de azufre (VI) Cloruro de carbono Bromuro de azufre (II) Sulfuro de boro Cloruro de fósforo (V) Nitruro de silicio Sulfuro de arsénico (V) Cloruro de nitrógeno (III) Cloruro de bromo Tribromuro de yodo Hexafluoruro de azufre Tetracloruro de carbono Dibromuro de azufre Trisulfuro de diboro Pentacloruro de fósforo Tetranitruro de trisilicio Pentasulfuro de diarsénico Tricloruro de nitrógeno 2. COMPUESTOS TERNARIOS 2.1. HIDRÓXIDOS Son compuestos ternarios formados por la combinación de un catión metálico con iones hidroxilo OH-. Se llaman bases o hidróxidos por el carácter básico que presenta el anión OH- (tiende a captar protones H+ de los ácidos con los que se combina dando sales). Su formula general es M(OH)n Se formulan escribiendo el símbolo del metal seguido del grupo OH seguido de un numero de valencia del metal. Se nombran con la palabra hidróxido seguida del nombre del metal, indicando su valencia según la nomenclatura de Stock. Ejemplos: HIDRÓXIDOS Nomenclatura de Stock Nomenclatura sistemática (I.U.P.A.C.) NaOH Ca(OH)2 Fe(OH)3 Pt(OH)4 Hidróxido de sodio Hidróxido cálcico Hidróxido de hierro (III) Hidróxido de platino (IV) Hidróxido de sodio Hidróxido calcico Trihidróxido de hierro Tetrahidróxido de platino. 7 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 2.2. OXACIDOS Son compuestos ternarios que tienen de formula general HaNbOc Se suelen considerar formalmente formados los óxidos ácidos o no metálicos con el agua. Se suelen nombrar utilizando la nomenclatura tradicional, admitida por la I.U.P.A.C., con las terminaciones -oso e -ico: -oso -oso -ico -ico HClO HClO2 HClO3 HClO4 ácido hipocloroso ácido cloroso ácido clorico ácido perclorico 1 hipo -oso 3 -oso 5 -ico HNO HNO2 HNO3 ácido hiponitroso ácido nitroso ácido nitrico 3 -oso HPO2 H4P2O5 H3PO3 ácido metafosforoso (+ H2O) ácido pirofosoforoso (+ 2H2O) ácido ortofosforoso (+ 3H2O) 5 -ico HPO3 H4P2O7 H3PO4 ácido metafosfórico (+ H2O) ácido pirofosfórico (+ 2H2O) ácido ortofosfórico (+ 3H2O) B 3 -ico HBO2 H3BO3 H2B4O7 ácico metabórico (+ H2O) ácido ortobórico (+ 3H2O) ácido tetrabórico (2B2O3 + H2O) S Se Te 4 -oso H2SO3 Ácido sulfuroso 6 -ico H2SO4 Ácido sulfúrico C 4 -ico H2CO3 Ácido carbónico 4 -ico H2SiO3 H4SiO4 (+2H2O) ácido metasilícico ácido ortosilícico Cr 6 -ico H2CrO4 ácido crómico ácido dicrómico (2CrO3 + H2O) Mn 6 7 -ico per -ico H2MnO4 HMnO4 ácido mangánico ácido permangánico Cl Br I N P As Sb 1 hipo 3 5 7 per Si 8 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 2.3. SALES NEUTRAS Resultan de sustituir totalmente los hidrógenos de un ácido por un metal. Para formularlo se escribe el símbolo del metal al que pasa el número de hidrógenos del ácido del que deriva y a continuación el resto ácido al que se le coloca como numeral la valencia del metal. Se simplifica si se puede. Ácido SALES Fe2(SO3)2 Fe(SO3) Sulfito de hierro (II) Ácido sulfuroso H2SO3 Fe2(SO3)3 Sulfito de hierro (III) En la nomenclatura tradicional: Se nombran a partir de la palabra del ácido del que se considera derivada, cambiando las terminaciones -oso e -ico del ácido por -ito o -ato respectivamente a continuación el nombre del metal con los sufijos -oso e -ico según la valencia. En la nomenclatura de Stock se nombran igual pero indicando el número de oxidación (valencia) del metal con números romanos entre paréntesis, cuando esta es variable. En la nomenclatura sistemática todas las sales terminan en -ato y si el anión entra 2, 3, 4, 5, veces, se emplean los prefijos: bis, tris, tetraquis, pentaquis, ..., respectivamente. Se nombra de la siguiente forma: [Prefijo-oxo-nombre no metal terminado en ato (valencia de no metal) - de - nombre del metal]. Las sales binarias ya estudiadas son sales neutras. EJEMPLOS Iones Nomenclatura tradicional Nomenclatura de Stock o funcional Nomenclatura sistemática (I.U.P.A.C.) NaClO Au(NO3)3 KMnO4 PbCO3 Na2SO4 FeSO4 Fe2(SO4)3 Pb(SO4)2 Ca3(BO3)2 (NH4)3PO4 Zn(AsO3)2 Ca2SiO4 Cr2(SO4)3 HgCrO4 Cu2P2O7 K2Cr2O7 Ca3(PO4)2 AgNO3 Na2B4O7 K5IO6 Al2TeO6 Na5SbO5 Ní(ClO4)3 Na+ + ClOAu3+ + 3 NO3K+ + MnO4Pb2+ + CO322 Na+ + SO42Fe2+ + SO422 Fe3+ + 3 SO42Pb4+ + 2 SO423Ca2+ + 2 BO333 NH4+ + PO43Zn2+ + 2 AsO32 Ca2+ + SiO442 Cr3+ + 3 SO42Hg2+ + CrO422 Cu2+ + P2O742 K+ + Cr2O723 Ca2+ + 2 PO43Ag+ + NO32 Na+ + B4O725 K+ + IO652 Al3+ + TeO665 Na+ + SbO55Ni3+ + 3 ClO4- Hipoclorito sódico Nitrato aúrico Permanganato potásico Carbonato plumboso Sulfato sódico Sulfato ferroso Sulfato férrico Sulfato plúmbico Ortoborato cálcico Fosfato amónico Metaarseniato de cinc Ortosilicato cálcico Sulfato crómico Cromato mercúrico Pirofosfato cúprico Dicromato potásico Fosfato cálcico Nitrato de plata Tetraborato sódico Paraperyodato potásico Ortotelurato alúminico Ortoantimoniato sódico Perclorato niquélico Hipoclorito de sodio Nitrato de oro (III) Permanganato de potasio Carbonato de plomo (II) Sulfato de sodio Sulfato de hierro (II) Sulfato de hierro (III) Sulfato de plomo (IV) Ortoborato de calcio Fosfato de amonio Metaarseniato de cinc Ortosilicato de calcio Sulfato de cromo (III) Cromato de mercurio (II) Pirofosfato de cobre (II) Dicromato de potásio Fosfato de calcio Nitrato de plata Tetraborato de sodio Paraperyodato de potasio Ortotelurato de aluminio Ortoantimoniato de sodio Perclorato de niquel (III) Monoxoclorato (I) de potasio Tristrioxonitrato (V) de oro Tetraoxomanganato (VII) de potasio Trioxocarbonato (IV) de plomo Tetraoxosulfato (VI) de sodio Tetraxosulfato (VI) de hierro Tristetraoxosulfato (VI) de hierro Bistetraoxosulfato (VI) de plomo Bistrioxoborato (III) de calcio Tetraoxofosfato (V) de amonio Bistrioxoarseniato (V) de cinc Tetraoxosilicato (IV) de calcio Tristetraoxosulfato (VI) de cromo Tetraoxocromato (VI) de mercurio Heptaoxodifosfato (V) de cobre Heptaoxodicromato (VI) de potasio Bistetraoxofosfato (V) de calcio Trioxonitrato (V) de plata Heptaoxotetraborato (III) de sodio Hexaoxoyodato (VII) de potasio Hexaoxotelurato (VI) de aluminio Pentaoxoantimoniato (V) de sodio Tristetraoxoclorato (VII) de níquel 9 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada NOMENCLATURA SISTEMÁTICA DE LOS ÁCIDOS OXÁCIDOS La I.U.P.A.C. sistematiza aún más la nomenclatura de los ácidos, pues los equipara a las sales y es de gran utilidad sobre todo en los ácidos oxácidos más excepcionales que se salen de las reglas tradicionales. Se nombarn atendiendo al esquema: [Prefijo-nombre de no metal terminado en ato (valencia) - de - hidrógeno] EJEMPLOS Iones Nomenclatura tradicional Nomenclatura de Stock o funcional Nomenclatura sistemática (I.U.P.A.C.) HBrO HBrO2 HBrO3 HBrO4 H2SO4 H2CO3 HNO3 H2SeO3 H2S2O7 H5IO6 H5SbO5 H6TeO6 H3PO2 HPO2 H4P2O5 H4P2O7 H3PO3 H3AsO4 H2SiO3 H4SiO4 HBO2 H3BO3 H2B4O7 H2CrO4 H2Cr2O7 H+ + BrOH+ + BrO2H+ + BrO3H+ + BrO42 H+ + SO422 H+ + CO32H+ + NO32 H+ + SeO322 H+ + S2O725 H+ + IO655 H+ + SbO556 H+ + TeO663 H+ + PO23H+ + PO24 H+ + P2O544 H+ + P2O743 H+ PO333 H+ + AsO432 H+ + SiO324 H+ + SiO44H+ + BO23 H+ + BO332 H+ + B4O722 H+ + CrO422 H+ + Cr2O72- Ácido hipobromoso Ácido bromoso Ácido brómico Ácido perbrómico Ácido sulfúrico Ácido carbónico Ácido nítrico Ácido selenioso Ácido pirosulfúrico Ácido paraperyódico Ácido ortoantimónico Ácido ortotelúrico Ácido hipofosforoso Ácido metafosforoso Ácido pirofosforoso Ácido pirofosfórico Ácido ortofosforoso Ácido ortoarsénico Ácido metasilícico Ácido ortosilícico Ácido metabórico Ácido ortobórico Ácido tetrabórico Ácido crómico Ácido dicrómico Ácido monoxobrómico (I) Ácido dioxobrómico (III) Ácido trioxobrómico (V) Ácido tetraoxobrómico (VII) Ácido tetraoxosulfúrico (VI) Ácido trioxobcarbónico (III) Ácido trioxonítrico (V) Ácido trioxoselénico (IV) Ácido heptaoxodisulfúrico (VI) Ácido hexaoxoyódico (VII) Ácido pentaoxoantimónico (V) Ácido hexaoxotelúrico (VI) Ácido dioxofosfórico (I) Ácido dioxofosfórico (III) Ácido pentaoxodifosfórico (III) Ácido heptaoxodifosfórico (V) Ácido trioxofosfórico (III) Ácido tetraoxoarsénico (V) Ácido trioxosilícico Ácido tetraoxosilícico Ácido dioxobórico (III) Ácido trioxobórico (III) Ácido heptaoxotetrabórico (III) Ácido tetraoxocrómico (VI) Ácido heptaoxodicrómico (VI) Oxobromato (I) de hidrógeno Dioxobromato (III) de hidrógeno Trioxobromato (V) de hidrógeno Tetraoxobromato (VII) de hidrógeno Tetraoxosulfato (VI) de hidrógeno Trioxocarbonato (IV) de hidrógeno Trioxonitrato (V) de hidrógeno Trioxoseleniato (VI) de hidrógeno Heptaoxodisulfato (VI) de hidrógeno Hexaoxoyodato (VII) de hidrógeno Pentaoxoantimoniato (V) de hidrógen Hexaoxotelurato (VI) de hidrógeno Dioxofosfato (I) de hidrógeno Dioxofosfato (III) de hidrógeno Pentaoxofosfato (III) de hidrógeno Heptaoxofosfato (V) de hidrógeno Trioxofosfato (III) de hidrógeno Tetraoxoarseniato (V) de hidrógeno Trioxosilicato (IV) de hidrógeno Tetraoxosilicato (IV) de hidrógeno Dioxoborato (III) de hidrógeno Trioxoborato (III) de hidrógeno Tetraoxoborato (III) de hidrógeno Tetraoxocromato (VI) de hidrógeno Heptaoxodicromato (VI) de hidrógen 10 Química de 2º de Bachillerato. Formulación Inorgánica IES Alonso Quesada 2.4. SALES ÁCIDAS Son sales que contienen en su molécula átomos de hidrógeno capaces de ser sustituidos por cationes. Se consideran derivados de la sustitución parcial de los átomos de hidrógeno de un ácido por un metal o grupo que actúe con carácter electropositivo. Ácido SALES Na2SO4 Sulfato de sodio [Sal neutra] Ácido sulfúrico H2SO4 NaHSO4 Hidrogenosulfato de sodio [Sal ácida] La nomenclatura al igual que las sales neutras se nombran, anteponiendo un prefijo numeral al hidrógeno seguido de del nombre de la sal. El prefijo numeral antepuesto al hidrógeno, indica el número de átomos de hidrógeno no sustituidos. Dichas sales se nombran pues anteponiendo el prefijo hidrógeno-, dihidrógeno-, etc, al nombre de la sal correspondiente. Ácido SALES Na3PO4 Fosfato de sodio [Sal neutra] Ácido fosfórico H3PO4 Na2PO4 Hidrógenofosfato sódico [Sal ácida] NaH2PO4 Dihidrógenofosfato de sodio [Sal ácida] Antiguamente, estas sales se nombraban anteponiendo el prefijo bi- al nombre de la sal neutra correspondiente, o añadiendo a este último la palabra ácido de -. Ambos metodos han caído en desuso y actualmente no están admitidos por la IUPAC, razón por la cual no debemos utilizar este tipo de nomenclatura. Ácido SALES Carbonato sódico [Sal neutra] Ácido carbónico Na2CO3 H2CO3 NaHCO3 Hidrógenocarbonato sódico [Sal ácida] Bicarbonato sódico Carbonato ácido de sodio EJEMPL OS Iones Nomenclatura tradicional Nomenclatura de Stock o funcional Nomenclatura sistemática (I.U.P.A.C.) NaHCO3 Pb(HSO4)2 Al(HSO4)3 KHS Bi(HSe)3 KH2PO4 CrHPO4 MnH2P2O7 Ca(H2PO4) Na+ + HCO3Pb2+ + 2 HSO4Al3+ + 3(HSO4)K+ + HSBi3+ + 3(HSe)K+ + H2PO4Cr2+ + HPO42Mn2+ + H2P2O72Ca2+ + 2(H2PO4)2Al3+ + 3(HPO4)2Al3+ + 3(H2PO4)Na+ + H3P2O5Mn4+ + 4(H2PO3)Fe2+ + 2 (HSO4)NH4+ + HCr2O7Ba2+ + 2 (HSeO3)Ca2+ + 2 (HSiO3)Pt4+ + 4 (HCO3)Fe3+ + 3 HSO3- Bicarbonato sódico Bisulfato plumboso Bisulfato de aluminio Bisulfuro potásico Biseleniuro de bismuto Bifosfato potásico Bifosfato cromoso Pirofosfato diácido manganoso Dibifosfato de calcio Tribifosfato de aluminio Fosfato diácido de aluminio Bipirofosfito de sodio Tetrabifosfito mangánico Bisulfato ferroso Bidicromato amónico Biselenito de bario Metabisilicato de calcio Bicarbonato platínico Bisulfito férrico Hidrogenocarbonato de sodio Hidrogenosulfato de plomo (II) Hidrogenosulfato de aluminio Hidrogenosulfuro de potasio Hidrogenoseleniuro de bismuto Dihidrogenofosfato de potasio Hidrogenofosfato de cromo (II) Dihidrogenopirofosfato de Mn (II) Dihidrogenofosfato de calcio Hidrogenofosfato de aluminio Dihidrogenofosfato de aluminio Hidrogenopirofosfito de sodio Hidrogenofosfito de Mn (IV) Hidrogenosulfato de hierro (II) Hidrogenodicromato de amonio Hidrogenoselenito de bario Hidrogenometasilicato de calcio Hidrogenocarbonato de platino (IV) Hidrogenosulfito de hierro (III) Hidrogenotrioxocarbonato (IV) de sodio Bishidrogenotetraoxosulfato (VI) de plomo Trishidrogenotetraoxosulfato (VI) de aluminio 2 Al2(HPO4)3 Al(H2PO4)3 NaH3P2O5 Mn(H2PO3 )4 Fe(HSO4)2 NH4HCr2O 7 Ba(HSeO3) 2 Ca(HSiO3) 2 Pt(HCO3)4 Fe(HSO3)3 11 Química de 2º de Bachillerato. Formulación Inorgánica A IES Alonso Quesada FORMULAR FORMULAR 1. Óxido de magnesio 48. Perbromato de cobre 2. Óxido de plomo (IV) 49. Cloruro amónico 3. Óxido de mercurio (I) 50. Sulfato amónico 4. Tetraóxido de dinitrógeno 51. Hidrógenocarbonato sódico 5. Pentaóxido de dinitrógeno 52. Dihidrógeno fosfato de potásio 6. Monóxido de carbono 53. Dihidrógenofosfato cálcico 7. Peróxido de sodio 54. Sulfito ácido de sodio 8. Peróxido de magnesio 55. Hidrógenosulfuro sódico 9. Peróxido de hidrógeno 56. Hidrógenosulfato de hierro (II) 10. Óxido de cromo (VI) 57. Ion sodio 11. Hidruro de cadmio 58. Ion hierro (II) 12. Hidruro de litio 59. Ion hierro (III) 13. Hidruro de estaño (II) 60. Ion calcio 14. Metano 61. Ion amonio 15. Amoniaco 62. Ion hidronio 16. Cloruro de hidrógeno 63. Protón 17. Ácido sulfhídrico (III) 64. Ion hidruro. 18. Bromuro de cobre (II) 65. Ion cloruro 19. Cloruro potásico 66. Ion sulfuro 20. Cloruro cálcico 67. Ion nitruro 21. Cloruro de hierro (III) 68. Ion hidróxilo 22. Tribromuro de nitrógeno 69. Ion nitrato 23. Pentacloruro de fósforo 70. Ion hipoclorito 24. Disulfuro de carbono 71. Ion sulfato 25. Tetrafluoruro de silicio 72. Ion bisulfato (Hidrógenosulfato) 26. Hidróxido de sodio 73. Ion cromato 27. Hidróxido cálcico 74. Ion dicromato 28. Hidróxido de níquel (III) 75. Ion fosfito 29. Ácido hipobromoso 76. Ion hidrógenofosfito 30. Ácido nítrico. 77. Ion dihidrógenofosfito 31. Ácido sulfúrico 78. Ion carbonato 32. Ácido mangánico 79. Ion hidrógenocarbonato 33. Ácido yódico 80. Ion nitrito 34. Ácido fosforoso 81. Ion perclorato 35. Ácido bórico 82. Ion bromito 36. Ácido carbónico 83. Ion bromuro 37. Ácido ortosilícico 84. Ion hipobromito 38. Ácido pirofosfórico 85. Ion bromato 39. Ácido metaarsenioso 86. Ion dihidrógenofosfato 40. Carbonato cálcico 87. Ion hidrógenofosfato 41. Hipoclorito sódico 88. Ion fosfato 42. Nitrato potásico 89. Ion manganato 43. Sulfato de sodio 90. Ion hidrógenomanganato 44. Dicromato potásico 91. Ion permanganato 45. Permanganato potásico 92. Ion pirofosfato 46. Sulfito de cobre (II) 93. Ion dihidrógenopirofosfato 12 Química de 2º de Bachillerato. Formulación Inorgánica I Ejercicio de Formulación A. IES Alonso Quesada Nombre: Curso: Nombrar Nombrar 1. MgO 48. CuBrO4 2. PbO2 49. NH4Cl 3. Hg2 O 50. (NH4)2SO4 4. N2O4 51. NaHCO3 5. N2O5 52. KH2PO4 6. CO 53. Ca(H2PO4)2 7. Na2O2 54. NaHSO3 8. MgO2 55. NaHS 9. H2O2 56. Fe(HSO4)2 10. CrO3 57. Na+ 11. CdH2 58. Fe2+ 12. LiH 59. Fe3+ 13. SnH2 60. Ca2+ 14. CH4 61. NH4+ 15. NH3 62. H3O+ 16. HCl 63. H+ 17. H2S 64. H- 18. CuBr2 65. Cl- 19. KCl 66. S2- 20. CaCl2 67. N3- 21. FeCl3 68. OH- 22. NBr3 69. NO3- 23. PCl5 70. ClO- 24. CS2 71. SO42- 25. SiF4 72. HSO4- 26. NaOH 73. CrO42- 27. Ca(OH)2 74. Cr2O72- 28. Ni(OH)3 75. PO33- 29. HBrO 76. HPO32- 30. HNO3 77. H2PO3- 31. H2SO4 78. CO32- 32. H2MnO4 79. HCO3- 33. HIO3 80. NO2- 34. H3PO3 81. ClO4- 35. H3BO3 82. BrO2- 36. H2CO3 83. Br- 37. H2SiO4 84. BrO- 38. H4P2O7 85. BrO3- 39. HAsO2 86. H2PO4- 40. CaCO3 87. HPO42- 41. NaClO 88. PO43- 42. KNO3 89. MnO42- 43. Na2SO4 90. HMnO4- 44. K2Cr2O7 91. MnO4- 45. KMnO4 92. P2O74- 13




