Problemas resueltos-Tema 4
Anuncio
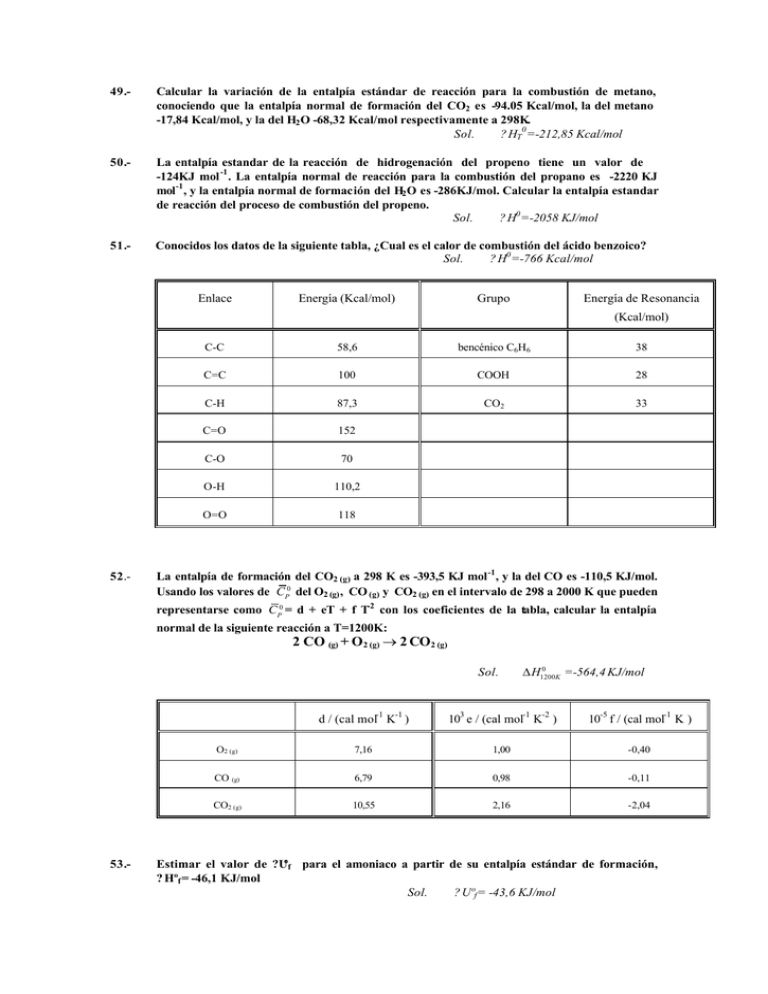
49.- Calcular la variación de la entalpía estándar de reacción para la combustión de metano, conociendo que la entalpía normal de formación del CO2 es -94.05 Kcal/mol, la del metano -17,84 Kcal/mol, y la del H2 O -68,32 Kcal/mol respectivamente a 298K. Sol. ? HT0 =-212,85 Kcal/mol 50.- La entalpía estandar de la reacción de hidrogenación del propeno tiene un valor de -124KJ mol -1 . La entalpía normal de reacción para la combustión del propano es -2220 KJ mol-1 , y la entalpía normal de formación del H2 O es -286KJ/mol. Calcular la entalpía estandar de reacción del proceso de combustión del propeno. Sol. ? H0 =-2058 KJ/mol 51.- Conocidos los datos de la siguiente tabla, ¿Cual es el calor de combustión del ácido benzoico? Sol. ? H0 =-766 Kcal/mol Enlace Energía (Kcal/mol) Grupo Energía de Resonancia (Kcal/mol) 52.- C-C 58,6 bencénico C6H6 38 C=C 100 COOH 28 C-H 87,3 CO2 33 C=O 152 C-O 70 O-H 110,2 O=O 118 La entalpía de formación del CO2 (g) a 298 K es -393,5 KJ mol -1 , y la del CO es -110,5 KJ/mol. Usando los valores de CP0 del O2 (g) , CO (g) y CO2 (g) en el intervalo de 298 a 2000 K que pueden representarse como CP0 = d + eT + f T-2 con los coeficientes de la tabla, calcular la entalpía normal de la siguiente reacción a T=1200K: 2 CO (g) + O2 (g) → 2 CO2 (g) Sol. 53.- 0 ∆ H1200K =-564,4 KJ/mol d / (cal mol-1 K-1 ) 103 e / (cal mol-1 K-2 ) 10-5 f / (cal mol-1 K ) O2 (g) 7,16 1,00 -0,40 CO (g) 6,79 0,98 -0,11 CO2 (g) 10,55 2,16 -2,04 Estimar el valor de ?Uºf para el amoniaco a partir de su entalpía estándar de formación, ? Hºf = -46,1 KJ/mol Sol. ? Uºf = -43,6 KJ/mol 54.- El poder calorífico de los alimentos puede ser determinado midiendo el calor producido al quemarse una cantidad de muestra del alimento en una bomba calorimétrica a V constante. El calor desprendido en la combustión de 1gr (3.10 -3 moles) de una muestra grasa de pollo fue 10.000 cal a 37ºC. Calcúlese el poder calorífico en cal/gr a 37ºC y P constante, sabiendo que la reacción puede representarse por la ecuación: C20 H32 O2 (s) + 27 O2 (g) → 20 CO2 (g) + 16 H 2O (l) Sol. 55.- ? Hº = 9987 cal/g Dados los calores de formación y de combustión siguientes, y sabiendo que el calor de vaporización del H2 O a 298 K es de 10,5 Kcal/mol. Calcular el ?H y ?U para la reacción a 298K: CH3 -COOH (l) + C2 H5OH (l)→ CH3COOC 2H5 (l) + H2O (g) ?Hcombustion(CH3 COOC2 H5 (l)) = -536,9 Kcal/mol ?Hf (CH3 COOH (l)) = 116,7 Kcal/mol ?Hf (C2 H5 OH (l)) = 66,3 Kcal/mol ?Hf (CO2 (g) ) = -94,0 Kcal/mol ?Hf (H2 O (g)) = -57,8 Kcal/mol Sol. ?H = -351,1 Kcal/mol ? Uº = -353,7 Kcal/mol 56.- A 298,2 K la entalpía tipo de formación del Mg(NO3 )2 es -188,77 cal/mol; y la entalpía tipo de disolución es -21,530 cal/mol; la entalpía tipo de formación del ion NO3- es -49,320 cal/ ion g. Calcúlese la entalpía tipo de formación del ion Mg 2+ a esta temperatura. Sol. ? Hº = -111.66 cal/ion g 57.- 1 mol de NaCl se disuelve en suficiente H2 O para dar una disolución que contiene un 12% de NaCl en peso. El ?H de esta reacción es de 774,6 cal a 20 ºC y de 700,8 cal a 25 ºC. La CP molar del NaCl (s) es 12 cal/K.mol, y del H2 O es 18 cal/K.mol. Calcular la capacidad calorífica de la disolución en cal/gr.K. Sol. CP disol = 0,7571 cal/g K 58.- Un nuevo compuesto fluorocarbonado, de peso molecular 102 g mol -1 , se situa en una bomba calorimétrica. A la presión de 650 Torr, el líquido hierve a 78 ºC. Por otra parte, se observa que a esa P, haciendo circular durante 650 seg por el recinto una corriente eléctrica de 0,232 A mediante una fuente de alimentación de 12 V, se evaporan 1,871 g de la muestra. Calcular el incremento de entalpía molar y de energía interna molar para el proceso de evaporación. Sol. ? HV = 98,7 KJ/mol. ? UV = 95,8 KJ/mol 59.- A 25ºC y 1at las entalpías de neutralización de los ácidos nitrico y dicloroacético por el hidróxido de sodio valen respectivamente -57,153KJ/mol y -62,05KJ/mol. Cuando a un volumen muy grande de una disolución que contiene 1 mol de HNO3 y 1mol de Cl 2 CHCOOH se le añade, a 25ºC, 1mol de NaOH se desprenden 58,41KJ en forma de calor. Calcular la proporción en que se forman las sales NaNO3 y Cl 2 CHCOONa Sol. Se forman 0,74 moles de NaNO3 y 0,26 moles de Cl2 CHCOOH 60.- La entalpía de reacción estándar para la combustión del grafito según la ecuación C(grafito) + O2(g) → CO2(g) es de -94,05 Kcal. Las capacidades caloríficas molares de los reactivos y de los productos son (en cal/mol.K): grafito(s) 2,066, O2(g) 7,200 y CO2(g) 10,56 respectivamente. Calcular la temperatura que alcanzaría un sistema que inicialmente contuviese 2 moles de grafito y 2 moles de O2 a 25ºC y en el que se produjese la combustión adiabática y completa del C a presión constante de 1 atm. ¿Cual sería la temperatura final si en lugar de 2 moles de O2 hubiera inicialmente 3 moles? Sol. Con 2 mol iniciales de O2 Tf = 9257 K Con 3 mol iniciales de O2 Tf = 6940 K 61.- Repetir el problema anterior suponiendo que el proceso transcurriese a volumen constante. Sol. Con 2 mol iniciales de O2 Tf = 11259 K Con 3 mol iniciales de O2 Tf = 8702 K 62.- Cuando 1 gramo de glucosa se quema en una bomba calorimétrica (V constante), la T varía desde 25ºC a 28,7ºC. Calcular la entalpía de combustión por mol de glucosa a 25ºC, sabiendo que la capacidad calorífica del sistema calorimétrico es 4,23 KJ/K. Datos: CP (H2O, l)= 75,29 J/K mol; CP (CO2,g) = 37,11 J/K mol; Pm(C6H12O6) =180 g/mol. Sol. ? H25ºC = -2,82 10 3 KJ/mol 63.- Calcular el incremento de entropía estandar que acompaña a la reacción: H2 (g) + 1/2 O2 (g) → H2 O (l) a 25 ºC. sabiendo que los valores de entropía convencionales a esa temperatura son: S 0 (H2 O (l))=69,9 J. mol -1 K-1 ; S 0 (H2 (g))=130,7 J mol -1 K-1 ; S 0 (O2 (g))= 205,0 J mol -1 K-1 , Sol. ? Sº = -163,3 J/K.mol 64.- Dos moles de agua sobreenfriada a -10ºC se induce a cristalizar en una vasija térmicamente aislada a presión constante, formándose una mezcla de hielo y agua a 0ºC. a) ¿Cuál es la fracción molar del hielo en la mezcla res ultante? b) Calcular el valor de ?S para el sistema en esa transformación. Datos: ? Hfusión, 273K= 6,02 KJ/mol; CP (agua sobreenfriada ) =75,24J/molK. Sol. 65.- Xhielo = 0,125 ?S = 0,10 J/K Deducir si las siguientes cantidades deben ser cero: a) ∆ H 0f ,298 ( N 2O5 , g) ; b) ∆ H 0f ,298 ( Cl, g) ; c) ∆ H 0f ,298 ( Cl2 , g ) ; 0 d) S 298 (Cl2 , g) ; 0 e) S 298 ( N 2O5 , s ) ; f) ∆ S f0,350 ( N 2 , g ) 0 Qué sustancia de cada uno de estos pares tiene mayor valor de S 298 : a) C2 H6 (g) o n-C4 H10 (g) ; c) H(g) o H2 (g) ; b) H2 O (l) o H2 O (g) ; d) C10 H8 (s) o C10 H8 (g) Predecir el signo de ∆S 0298 y ∆H0 298 en las siguientes reacciones: a) (C2 H5 )2 O(l) → (C2 H5 )2 O(g) b) Cl2(g) → 2Cl(g) c) C10 H8(g) → C10 H8(s) d) (COOH)2(s) + 1/2O2(g) → 2CO2(g) + H2 O(l) e) C2 H4(g) + H2(g) → C2 H6(g) 66.- Verdadero o falso: a) ∆H=0 para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas. b) Una sustancia en un estado termodinámico normal debe estar a 25ºC




