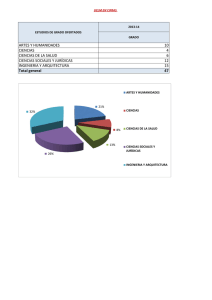
volumenes atomico y molecular en el punto de ebullicion normal
Anuncio

UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA VOLUMENES ATOMICO Y MOLECULAR EN EL PUNTO DE EBULLICION NORMAL Volumen atómico x 10 3 3 ( m / kg átomo ) Volumen molecular x 10 3 3 ( m / kg mol ) Bromo 27,0 Aire 29,9 Carbono 14,8 Br 2 53,2 Cloro 24,6 Cl 2 48,4 Hidrógeno 3,7 CO 30,7 Yodo 37,0 CO 2 34,0 Nitrógeno 15,6 CO S 51,5 Nitrógeno en aminas primarias 10,5 H2 14,3 Nitrógeno en aminas secundarias 12,0 H2O 18,9 Oxígeno 7,4 H2 S 32,9 Oxígeno en ésteres metílicos 9,1 I2 71,5 Oxígeno en ésteres superiores 11,0 N2 31,2 Oxígeno en ácidos 12,0 NH 3 25,8 Oxígeno en éteres metílicos 9,9 NO 23,6 Oxígeno en éteres superiores 11,0 N2 O 36,4 Azufre 25,6 O2 25,6 Anillo de Benceno : restar - 15,0 SO 2 44,8 Anillo de Naftaleno : restar - 30,0 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA VOLÚMENES DE DIFUSION ATOMICO Y MOLECULAR PARA LA ECUACIÓN DE FULLER Incrementos de volumen de difusión atómico y estructural, v x 10 3 ( m 3 / kg átomo ) C 16,50 ( Cl ) + + + 19,5 H 1,98 (S) 17,0 O 5,48 Anillo aromático - 20,2 (N) 5,69 Anillo heterocíclico - 20,2 H2 7,07 CO 18,9 D2 6,70 CO 2 26,9 He 2,88 N2O 35,9 N2 17,90 NH 3 14,9 O2 16,60 H2O 12,7 Aire 20,10 ( C Cl 2 F 2 ) 114,8 Ar 16,10 ( S F6 ) 69,7 Kr 22,80 ( Cl 2 ) 37,7 ( Xe ) 37,90 ( Br 2 ) 67,2 Ne 5,59 ( SO 2 ) 41,1 +++ El paréntesis indica que el valor listado se basa en muy pocos datos. TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA PARAMETROS DE ENERGIA INTERMOLECULAR, DIAMETROS DE COLISION Y CONSTANTES CRITICAS PARA LA ECUACION DE LENNARD – JONES. Molécula Peso Molecular Ar Parámetros de LENNAR JONES Constantes Críticas x 10 – 10 m /k (K) Tc ( ° K ) Pc (Atm ) Vc (cm 3 /g-mol ) 39,944 3,542 93,3 151,2 48,1 75,2 He 4,003 2,551 10,2 5,26 2,26 57,8 Kr 83,80 3,655 178,9 209,4 54,3 92,2 Ne 20,183 2,820 32,8 44,5 26,9 41,7 Xe 131,30 4,047 1,0 289,8 58,0 118,8 Aire 28,97 3,711 78,6 132,3 36,4 86,6 As H 3 77,93 4,145 259,8 ------- ------ ------ B Cl 3 117,19 5,127 337,7 ------- ------- ------- B F3 67,82 4,198 186,3 ------- ------- ------- B ( O CH 3 ) 3 103,92 5,503 396,7 ------- ------- ------- Br 2 159,83 4,296 507,9 584,2 102,1 144,0 C Cl 4 153,84 5,947 322,7 556,4 45,0 276,1 C F4 88,01 4,662 134,0 ------- ------- ------- CH Cl 3 119,39 5,389 340,2 536,6 54,2 240,0 CH 2 Cl 84,94 4,898 356,3 510,4 60,2 ------- CH 3 Br 94,95 4,118 449,2 ------- ------- ------- CH 3 Cl 50,49 4,182 350,2 416,3 65,9 143,4 CH 3 OH 32,04 3,626 481,8 513,7 78,7 ------- CH 4 16,04 3,758 148,6 190,7 45,8 99,3 CO 28,01 3,690 91,7 133,1 34,5 93,1 CO S 60,08 4,130 336,0 378,0 61,0 ------- CO 2 44,01 3,941 195,2 304,2 72,9 94,0 C S2 76,14 4,483 467,2 552,0 78,1 170,0 C2H2 26,04 4,033 231,8 309,5 61,6 131,1 C2H4 28,05 4,163 224,7 282,4 50,0 124,0 2 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA C2H6 30,07 4,443 215,7 305,4 48,2 148,3 C 2 H 5 Cl 64,52 4,898 300,0 460,3 52,1 ------- C 2 H 5 OH 46,07 4,530 362,6 516,2 63,1 ------- C 2 N2 52,04 4,361 348,6 401,1 59,0 ------- CH 3 O CH 3 46,12 4,307 395,0 ------- ------- ------- CH 2 CH CH 3 42,08 4,678 298,9 365,4 45,0 ------- CH 3 C CH 40,06 4,761 251,8 ------- ------- ------- C3H6 42,08 4,807 248,9 365,4 45,0 ------- C3H8 44,09 5,118 237,1 370,0 42,0 200,1 n – C 3 H 7 OH 60,09 4,549 576,7 536,8 49,9 ------- CH 3 CO CH 3 58,08 4,600 560,2 508,1 47,0 ------- CH 3 COO CH 3 74,08 4,936 469,8 506,8 46,3 ------- n – C 4 H10 58,12 4,687 531,4 425,2 37,5 255,0 i – C 4 H10 58,12 5,278 330,1 408,1 36,0 263,1 C 2 H5 O C 2 H 5 74,12 5,678 313,8 466,9 35,5 ------- CH 3 COO C 2 H 5 88,10 5,205 521,3 523,2 37,8 ------- n – C 5 H 12 72,15 5,784 341,1 469,8 33,3 311,1 C (CH 3) 4 72,15 6,464 193,4 470,3 33,0 ------- C6H6 78,11 5,349 412,3 562,6 48,6 260,0 C 6 H12 84,16 6,182 297,1 554,1 40,4 ------- n – C 6 H14 86,17 5,949 399,3 507,9 29,9 368,2 Cl 2 70,91 4,217 316,0 417,0 76,1 124,0 F2 38,00 3,357 112,6 ------- ------- ------- H Br 80,92 3,353 449,0 ------ ------ ------ HCN 27,03 3,630 569,1 456,6 50,1 ------- H Cl 36,47 3,339 344,7 324,5 81,6 ------- HF 20,01 3,148 330,0 ------- ------- ------- HI 127,93 4,211 288,7 424,1 82,0 ------- H2 2,016 2,827 59,7 33,3 12,8 65,0 H2O 18,02 2,641 809,1 647,1 217,7 ------- H2O2 34,02 4,196 289,3 ------- ------- ------- H2S 34,08 3,623 301,1 373,5 88,9 ------- Hg 200,61 2,969 750,2 1 832,2 211,3 ------- Hg Br 2 360,44 5,080 686,2 -------- ------- ------- TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA Hg Cl 2 271,52 4,550 750,1 -------- ------- ------- Hg I 2 454,45 5,625 695,6 -------- ------- ------- I2 253,82 5,160 474,2 800,6 ------- ------- NH 3 17,08 2,900 558,3 405,5 111,5 ------- NO 30,01 3,492 116,7 180,2 64,0 57,0 NO Cl 65,47 4,112 395,3 ------- ------- ------- N2 28,02 3,798 71,4 126,2 33,6 90,1 N2O 44,02 3,828 232,4 309,7 71,7 96,3 O2 32,00 3,467 106,7 154,4 49,7 74,4 PH 3 34,00 3,981 251,5 324,1 64,0 ------- SF 6 146,07 5,128 222,1 ------- ------- ------- SO 2 64,07 4,112 335,4 430,7 77,8 122,1 Si F 4 104,06 4,880 171,9 271,6 50,0 ------- Si H 4 32,09 4,084 207,6 269,6 48,2 ------- Sn Br 4 438,36 6,388 563,7 ------- ------- ------- UF 6 352,07 5,967 236,8 ------- ------- ------- NOTA.- La estimación de las constantes de LENNARD – JONES, para los gases que no se encuentran en esta tabla, pueden hacerse a partir de las siguientes relaciones : a).- = 0,841 ( Vc ) 1/3 = 0,841 ( Vc ) 0,3333 = 2,44 ( Tc / Pc ) 0,3333 / k = 0,77 Tc b).- = 1,18 ( V b ) 1/3 = 1,18 ( V b ) 0,3333 / k = 1,21 T b Donde: T c = Temperatura crítica, K P c = Presión crítica, Atm. V c = Volumen molar a la temperatura crítica, cm 3 / g-mol T b = Temperatura normal de ebullición, K V b = Volumen molar en el punto de ebullición normal TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA VOLUMENES ATOMICOS PARA CALCULAR EL VOLUMEN MOLAR EN EL PUNTO NORMAL DE EBULLICION Vol. atómico Elemento Vol. atómico Elemento Antimonio 34,2 Oxígeno ligado a otros dos elementos en Arsénico 30,5 Aldehídos y cetonas 7,4 Bismuto 48,0 Oxígeno en unión con S, P, N 8,3 Cloro terminal como R – Cl 21,6 Fósforo 27,0 Cloro terminal como R – CHCl – R 24,6 Silicio 32,0 Cromo 27,4 Estaño 42,3 Flúor 8,7 Titanio 35,7 Germanio 34,5 Vanadio 32,0 Plomo 46,1 – 50,1 Zinc 20,4 Mercurio 19,0 Elemento Vol. Atómico Para un anillo con tres miembros, como en el óxido de etileno - 6,0 Para un anillo con cuatro miembros, como en el ciclobutano - 8,5 Para un anillo con cinco miembros, como en el furano - 11,5 Para un anillo con seis miembros, como en el benceno, ciclohexano - 15,0 Para un anillo como el naftaleno - 30,0 Para un anillo como el antraceno - 47,5 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA VALORES DE LA INTEGRAL DE COLISION BASADOS EN EL POTENCIAL DE LENNARD - JONES PARA GASES A BAJA DENSIDAD. kT/ ó k T / AB = k Para viscosidad D AB y conductividad Para difusividad calorífica kT/ ó k T / AB = k Para viscosidad D AB y conductividad Para difusividad calorífica 0,30 2,785 2,662 2,60 1,081 0,9878 0,35 2,628 2,476 2,70 1,069 0,9770 0,40 2,492 2,318 2,80 1,058 0,9672 0,45 2,368 2,184 2,90 1,048 0,9576 0,50 2,257 2,066 3,00 1,039 0,9490 0,55 2,156 1,966 3,10 1,030 0,9406 0,60 2,065 1,877 3,20 1,022 0,9328 0,65 1,982 1,798 3,30 1,014 0,9256 0,70 1,908 1,729 3,40 1,007 0,9186 0,75 1,841 1,667 3,50 0,9999 0,9120 0,80 1,780 1,612 3,60 0,9932 0,9058 0,85 1,725 1,562 3,70 0,9870 0,8998 0,90 1,675 1,517 3,80 0,9811 0,8942 0,95 1,629 1,476 3,90 0,9755 0,8888 1,00 1,587 1,439 4,00 0,9700 0,8836 1,05 1,549 1,406 4,10 0,9649 0,8788 1,10 1,514 1,375 4,20 0,9600 0,8740 1,15 1,482 1,346 4,30 0,9553 0,8694 1,20 1,452 1,320 4,40 0,9507 0,8652 1,25 1,424 1,296 4,50 0,9464 0,8610 1,30 1,399 1,273 4,60 0,9422 0,8568 1,35 1,375 1,253 4,70 0,9382 0,8530 1,40 1,353 1,233 4,80 0,9343 0,8492 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA 1,45 1,333 1,215 4,90 0,9305 0,8456 1,50 1,314 1,198 5,00 0,9269 0,8422 1,55 1,296 1,182 6,00 0,8963 0,8124 1,60 1,279 1,167 7,00 0,8727 0,7896 1,65 1,264 1,153 8,00 0,8538 0,7712 1,70 1,248 1,140 9,00 0,8379 0,7556 1,75 1,234 1,128 10,00 0,8242 0,7424 1,80 1,221 1,116 20,00 0,7432 0,6640 1,85 1,209 1,105 30,00 0,7005 0,6232 1,90 1,197 1,094 40,00 0,6718 0,5960 1,95 1,186 1,084 50,00 0,6504 0,5756 2,00 1,175 1,075 60,00 0,6335 0,5596 2,10 1,156 1,057 70,00 0,6194 0,5464 2,20 1,138 1,041 80,00 0,6076 0,5352 2,30 1,122 1,026 90,00 0,5973 0,5256 2,40 1,107 1,012 100,00 0,5882 0,5170 2,50 1,093 0,9996 200,00 -------- 0,4644 ----- ------- -------- 400,00 -------- 0,4170 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA COEFICIENTES DE INTERDIFUSION PARA GASES BINARIOS A 1 Atm. DE PRESION . ( 101,325 kPa ) SISTEMA T (K) D AB x 10 4 ( m² / s ) Aire – Dióxido de Carbono 317,2 0,177 Aire – Etanol 313 0,145 Aire – Helio 317,2 0,765 Aire – n – Hexano 328 0,093 Aire – n – Pentano 294 0,071 Aire – Agua 313 0,288 Argón – Amoniaco 333 0,253 Argón – Dióxido de Carbono 276,2 0,133 Argón – Helio 298 0,729 Argón – Hidrógeno 242,2 0,562 448 1,760 806 4,860 1 069 8,100 Argón – Metano 298 0,202 Argón – Dióxido de Azufre 263 0,077 Dióxido de Carbono – Helio 298 0,612 Dióxido de Carbono – Nitrógeno 298 0,167 Dióxido de Carbono – Oxido Nitroso 312,8 0,128 Dióxido de Carbono – Oxígeno 293,2 0,153 Dióxido de Carbono – Dióxido de Azufre 263 0,064 Dióxido de Carbono – Agua 307,2 0,198 352,3 0,245 373 0,318 Monóxido de Carbono – Nitrógeno TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA Helio – Benceno 423 0,610 Helio – Etanol 423 0,821 Helio – Metano 298 0,675 Helio – Metanol 423 1,032 Helio – Nitrógeno 298 0,687 Helio – Oxígeno 298 0,729 Helio – i – Propanol 423 0,677 Helio – Agua 307,12 0,902 Hidrógeno – Acetona 293 0,424 Hidrógeno – Amoniaco 298 0,783 358 1,093 473 1,860 533 2,149 Hidrógeno – Benceno 311,3 0,404 Hidrógeno – Ciclohexano 288,6 0,319 Hidrógeno – Metano 288 0,694 Hidrógeno – Nitrógeno 298 0,784 573 2,147 Hidrógeno – Dióxido de Azufre 473 1,230 Hidrógeno – Tiofeno 302 0,400 Hidrógeno – Agua 328,5 1,121 Metano – Agua 352,3 0,356 Nitrógeno – Amoniaco 298 0,230 358 0,328 Nitrógeno – Benceno 311,3 0,102 Nitrógeno – Ciclohexano 288,6 0,0731 Nitrógeno – Dióxido de Azufre 263 0,104 Nitrógeno – Agua 307,5 0,256 352,1 0,359 311,3 0,101 Oxígeno – Benceno TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA Oxígeno – Tetracloruro de Carbono 296 0,0749 Oxígeno – Ciclohexano 288,6 0,0746 Oxígeno – Agua 352,3 0,352 Oxígeno – Nitrógeno 273,1 0,181 Monóxido de Carbono – Oxígeno 273 0,185 Aire – Amoniaco 273,1 1,980 Aire – n – Butanol 299 0,087 332 1,040 299 0,740 Aire – Anilina COEFICIENTES DE DIFUSION EXPERIMENTALES EN ESTADO LIQUIDO A DILUCION INFINITA. T (K) D AB x 10 9 Acetona 298 3,31 Acido benzoico Acetona 298 2,62 Dióxido de carbono Alcohol amílico 298 1,91 Agua Anilina 293 0,70 Acido acético Benceno 298 2,09 Tetracloruro de carbono Benceno 298 1,92 Acido cinámico Benceno 298 1,12 Etanol Benceno 280,6 1,77 Cloruro de etileno Benceno 288 2,25 Metanol Benceno 298 3,82 Naftaleno Benceno 280,6 1,19 Dióxido de carbono i – butanol 298 2,20 Acetona Tetracloruro de carbono 293 1,86 Benceno Clorobenceno 293 1,25 SOLUTO A SOLVENTE Acido acético TRANSFERENCIA DE CALOR Y MASA – 2012 B Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA Acetona Cloroformo 288 2,36 Benceno Cloroformo 288 2,51 Etanol Cloroformo 288 2,20 Tetracloruro de carbono Ciclohexano 298 1,49 Azobenceno Etanol 293 0,74 Alcanfor Etanol 293 0,70 Dióxido de carbono Etanol 290 3,20 Cloro Agua 289 1,26 Acido clorhídrico Agua 289 2,44 Amoniaco Agua 278 1,24 288 1,77 283 1,46 293 1,77 Dióxido de carbono Agua Metanol Agau 288 1,28 Acido acético Agua 285,6 0,82 288 0,91 291 0,96 283 0,50 286,1 0,83 289 0,90 Etanol Agua n – Butanol Agua 288 0,77 Cloroformo Etanol 293,1 1,25 Dióxido de carbono Etanol 298 3,42 Glicerol Etanol 293 0,51 Piridina Etanol 293 1,10 Urea Etanol 285 0,54 Agua Etanol 298 1,132 Agua Etilenglicol 293 0,18 Agua Glicerol 293 0,0083 Dióxido de carbono Heptano 298 6,03 TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA ESCUELA ACADEMICO PROFESIONAL DE INGENIERIA EN ENERGIA Tetracloruro de carbono n – Hexano 298 3,70 Tolueno n – Hexano 298 4,21 Dióxido de carbono Kerosene 298 2,50 Estaño Mercurio 303 1,60 Agua n – propanol 288 0,87 Agua 1,2 – propilenglicol 293 0,0075 Acido acético Tolueno 298 2,26 Acetona Tolueno 293 2,93 Acido benzoico Tolueno 293 1,74 Clorobenceno Tolueno 293 2,06 Etanol Tolueno 288 3,00 Dióxido de carbono Alcohol etílico 298 2,11 Nuevo Chimbote, mayo de 2012. TRANSFERENCIA DE CALOR Y MASA – 2012 Ingº CESAR A. FALCONI COSSIO