4 Los átomos y su complejidad
Anuncio

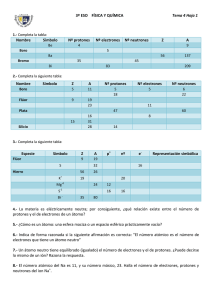
4 Los átomos y su complejidad E J E R C I C I O S P R O P U E S T O S 4.1 Pon dos ejemplos de fenómenos cotidianos que puedan interpretarse fácilmente si se considera que la materia está formada por partículas. Si se añade una pizca de sal (o de azúcar) a un vaso con agua, al poco tiempo cualquier parte del agua habrá adquirido un sabor salado (o dulce). Al destapar un frasco con perfume, el olor se extiende rápidamente por toda la habitación. 4.2 Explica por qué los átomos no pueden observarse con un microscopio óptico. ¿Qué tipo de microscopio es necesario para verlos? Los átomos no se pueden ver ni a simple vista ni con el microscopio óptico, porque son muy pequeños. Para verlos se necesita un tipo de microscopio denominado “de efecto túnel”. 4.3 Explica por qué los científicos consideraron insuficiente el modelo atómico de Dalton. Los científicos consideraron insuficiente el modelo atómico de Dalton porque no explicaba la naturaleza eléctrica de la materia. 4.4 ¿Por qué Rutherford propuso que el átomo debía tener un núcleo? Rutherford lanzó partículas alfa, que tienen carga eléctrica positiva, como proyectiles sobre una lámina muy delgada de oro. Observó que la mayoría de las partículas atravesaban la lámina sin desviarse, pero algunas se desviaban en diferentes direcciones. Para explicar estos hechos, Rutherford propuso que la mayor parte de la masa del átomo estaba concentrada en una parte muy pequeña del mismo, mientras que el resto estaba prácticamente vacío. 4.5 Identifica qué tipo de carga eléctrica tienen las distintas partículas subatómicas. Los protones tienen carga eléctrica positiva; los neutrones son eléctricamente neutros; los electrones tienen carga eléctrica negativa. 4.6 Explica por qué el átomo es eléctricamente neutro. En un átomo hay el mismo número de electrones en la corteza que de protones en el núcleo. Como la carga de electrones y protones es la misma pero de signo contrario, el átomo es eléctricamente neutro. 35 4.7 Indica el número de protones y de neutrones del elemento 17 Cl Número de protones ⫽ número atómico (Z) ⫽ 17 Número de neutrones: n ⫽ A ⫺ Z ⫽ 35 ⫺ 17 ⫽ 18 4.8 Calcula el número de protones, de electrones y de neutrones de los isótopos del hidrógeno: protio (A ⴝ 1), deuterio (A ⴝ 2) y tritio (A ⴝ 3). Para los tres isótopos: número de protones ⫽ número de electrones ⫽ 1 Número de neutrones: Protio: n ⫽ A ⫺ Z ⫽ 1 ⫺ 1 ⫽ 0 Deuterio: n ⫽ A ⫺ Z ⫽ 2 ⫺ 1 ⫽ 1 Tritio: n ⫽ A ⫺ Z ⫽ 3 ⫺ 1 ⫽ 2 4 Los átomos y su complejidad 4.9 La masa atómica del calcio es 40,1. Expresa este valor en gramos. m ⫽ 40,1 u ⫽ 40,1 (u) ⭈ 1,66 ⭈ 10⫺24 (g / u) ⫽ 6,66 ⭈ 10⫺23 g 4.10 Explica por qué un elemento químico no puede ser identificado por el número de neutrones de su núcleo atómico. Los isótopos son los átomos que tienen el mismo número atómico, pero distinto número másico; es decir, tienen el mismo número de protones, pero distinto número de neutrones. Por tanto, los átomos de un elemento químico pueden tener distinto número de neutrones. 4.11 Describe la distribución de partículas subatómicas en el átomo del isótopo 14 del nitrógeno (Z ⫽ 7). Número de protones ⫽ número de electrones ⫽ 7 Número de neutrones: n ⫽ A ⫺ Z ⫽ 14 ⫺ 7 ⫽ 7 En el núcleo del nitrógeno 14 hay 7 protones y 7 neutrones. En la corteza atómica hay 7 electrones: 2 en la capa K y 5 en la capa L. 4.12 Completa en tu cuaderno la siguiente tabla para los isótopos oxígeno 16 y azufre 32. Número Número de protones de neutrones Símbolo Z O 8 8 S 16 16 Número de electrones K L M 8 2 6 ⫺ 16 2 8 6 O, oxígeno: Z ⫽ 8; 8 protones y 8 electrones (2 en la 1.a capa y 6 en la 2.a). Neutrones: n ⫽ A ⫺ Z ⫽ 16 ⫺ 8 ⫽ 8. S, azufre: Z ⫽ 16; 16 protones y 16 electrones (2 en la 1.a capa, 8 en la 2.a y 6 en la 3.a). Neutrones: n ⫽ A ⫺ Z ⫽ 32 ⫺ 16 ⫽ 16. 4.13 ¿En qué ion se transforma un átomo de aluminio cuando pierde 3 electrones? Se transforma en el catión Al3⫹. 4.14 Completa en tu cuaderno la siguiente tabla para los iones Naⴙ (Z ⴝ 11, A ⴝ 23) y S2ⴚ (Z ⴝ 16, A ⴝ 32). Símbolo Z Número Número de protones de neutrones Número de electrones K L M Na 11 11 12 2 8 ⫺ S2ⴚ 16 16 16 2 8 8 ⴙ Número de protones 11 en Na⫹ (Z ⫽ 11) y 16 en S2⫺ (Z ⫽ 16) Número de neutrones 12 en Na⫹ (n ⫽ A ⫺ Z ⫽ 23 ⫺ 11 ⫽ 12) 16 en S2⫺ (n ⫽ A ⫺ Z ⫽ 32 ⫺ 16 ⫽ 16) Electrones: El ion Na⫹ se ha formado al perder 1 electrón el átomo de Na; por tanto, el número de electrones es 11 ⫺ 1 ⫽ 10. El ion S2⫺ se ha formado al ganar 2 electrones el átomo de S; por tanto, el número de electrones es 16 ⫹ 2 ⫽ 18. 4 Los átomos y su complejidad 4.15 ¿Cuál es la relación entre la estructura atómica de un elemento y su posición en el SP? Los elementos químicos están ordenados según valores crecientes de su número atómico, es decir, de su número de protones. Con este criterio, los elementos quedan correctamente ordenados atendiendo a sus propiedades y, sobre todo, se relaciona su posición en la tabla periódica con su estructura atómica. 4.16 Identifica qué elemento se encuentra situado en el grupo 16 y en el período 3 del SP. Es el azufre (S). 4.17 ¿Es el mercurio conductor de la corriente eléctrica? ¿Y el yodo? Justifica tus respuestas. El mercurio está situado en el sistema periódico dentro del grupo de los metales, por lo que es un buen conductor de la corriente eléctrica. El yodo, por su parte, está en el grupo de los no metales, por lo que no es un buen conductor. 4.18 Indica por qué no debe considerarse el hidrógeno incluido en ningún grupo del SP. Porque el hidrógeno no presenta propiedades características de ningún grupo del SP, sino que puede presentar unas u otras propiedades según las condiciones en que se encuentre. 4 Los átomos y su complejidad C I E N C I A A P L I C A D A 4.19 Indica cuántos electrones caben como máximo dentro de los siguientes subniveles: 2p, 3d, 4s. En el subnivel 2p: 6 electrones. En el subnivel 3d: 10 electrones. En el subnivel 4s: 2 electrones. 4.20 ¿Qué significa que la configuración electrónica del átomo de cloro es 1s2 2s2 2p6 3s2 3p5? Tiene 2 electrones en el subnivel 1s, 2 en el 2s, 6 en el 2p, 2 en el 3s y 5 en el 3p. 4 Los átomos y su complejidad E J E R C I C I O S D E A P L I C A C I Ó N 4.21 Justifica si las siguientes afirmaciones son verdaderas o falsas. a) El modelo atómico de Dalton explica la naturaleza eléctrica de la materia. b) Todas las partículas subatómicas tienen carga eléctrica. c) El núcleo ocupa una parte muy pequeña del átomo. d) El número atómico de un elemento es el número de neutrones que tiene en su núcleo. a) Es falsa. El modelo atómico de Dalton no permite explicar la naturaleza eléctrica de la materia. b) Es falsa. El neutrón es eléctricamente neutro. c) Es verdadera. Tras los experimentos de Rutherford se concluyó que el núcleo ocupa una parte muy pequeña del átomo. d) Es falsa. El número atómico de un elemento es el número de protones que tiene en su núcleo. 4.22 Dibuja el esquema de un átomo de boro (Z ⴝ 5; A ⴝ 11). 4.23 Indica cuántos protones y cuántos electrones hay en un átomo neutro de plomo (número atómico, 82). Número de protones ⫽ número de electrones ⫽ número atómico (Z) ⫽ 82. 4.24 Calcula el número de protones, de neutrones y de electrones de los átomos neutros: 9 4 Be 9 4 20 10 Ne Be: Número de protones ⫽ número de electrones ⫽ número atómico (Z) ⫽ 4 Número de neutrones: n ⫽ A ⫺ Z ⫽ 9 ⫺ 4 ⫽ 5 20 10 Ne: Número de protones ⫽ número de electrones ⫽ número atómico (Z) ⫽ 10 Número de neutrones: n ⫽ A ⫺ Z ⫽ 20 ⫺ 10 ⫽ 10 24 12 Mg:Número de protones ⫽ número de electrones ⫽ número atómico (Z) ⫽ 12 Número de neutrones: n ⫽ A ⫺ Z ⫽ 24 ⫺ 12 ⫽ 12 24 12 Mg 4 Los átomos y su complejidad 4.25 La masa atómica del aluminio es 27,0 u. Calcula su masa atómica expresada en gramos. m ⫽ 27,0 u ⫽ 27,0 (u) ⭈ 1,66 ⭈ 10⫺24 (g/u) ⫽ 4,48 ⭈ 10⫺23 g 4.26 Explica qué significa que la masa atómica del sodio sea 22,99 u. La masa atómica del sodio es igual a 22,99 unidades de masa atómica, es decir, a 22,99 doceavas partes de la masa del isótopo de carbono llamado C⫺12. 4.27 Describe la distribución de los electrones en capas en los iones O2ⴚ, Mg2ⴙ y Al3ⴙ. El ion O2⫺ se ha formado al ganar 2 electrones el átomo de O; por tanto: número de electrones ⫽ Z ⫹ 2 ⫽ 18 ⫹ 2 ⫽ 10 El ion Mg2⫹ se ha formado al perder 2 electrones el átomo de Mg; por tanto: número de electrones ⫽ Z ⫺ 2 ⫽ 12 ⫺ 2 ⫽ 10 El ion Al3⫹ se ha formado al perder 3 electrones el átomo de Al; por tanto: número de electrones ⫽ Z ⫺ 3 ⫽ 13 ⫺ 3 ⫽ 10 Todos ellos tienen 10 electrones y la misma distribución en capas: 2 en la 1.a capa y 8 en la 2.a 4.28 Razona si las siguientes afirmaciones son verdaderas o falsas. a) Los electrones situados en la capa N de un átomo se denominan electrones de valencia. b) Si un átomo neutro queda con un exceso de carga positiva se transforma en un catión. c) Las filas de elementos en el sistema periódico se denominan grupos. d) El boro, el silicio, el germanio y el arsénico son no metales. a) Es falsa. Se denominan electrones de valencia los situados en la última capa. b) Es verdadera. Un ion con carga positiva se denomina catión. c) Es falsa. Las filas de elementos en el sistema periódico se denominan períodos. d) Es falsa. Son semimetales. 4.29 De los elementos, arsénico, magnesio, carbono, cloro, cobre, neón, potasio, silicio y sodio, identifica los que son: a) Metales. Mg, Cu, K, Na b) Semimetales. c) No metales. As, Si C, Cl d) Gases nobles. e) Sólidos a 20 ⴗC. Ne As, Mg, C, Cu, K, Si, Na f) Buenos conductores. Mg, Cu, K, Na 4 Los átomos y su complejidad P R O B L E M A S D E S Í N T E S I S 4.30 Dibuja en tu cuaderno un átomo de oxígeno según el modelo de Thomson y según el modelo de Rutherford. ¿Permiten estos modelos explicar los fenómenos eléctricos? En ambos modelos se incluye el electrón como partícula constituyente del átomo, por lo que permiten explicar los fenómenos eléctricos. 4.31 Identifica los elementos del sistema periódico que no siguen el orden creciente de masas atómicas. Son el potasio (K), el níquel (Ni) y el yodo (I). 4.32 A partir de la información contenida en el sistema periódico, completa en tu cuaderno la siguiente tabla: Número de Nombre Símbolo Z A Fósforo P 15 31 15 16 15 Argón Ar 18 40 18 22 18 Bromo Br 35 80 35 45 35 protones neutrones electrones Z ⫽ 15: fósforo (P); 15 protones y 15 electrones. Neutrones: n ⫽ A ⫺ Z ⫽ 31 ⫺ 15 ⫽ 16. 18 protones ⇒ Z ⫽ 18: argón (Ar) y 18 electrones. Neutrones: n ⫽ A ⫺ Z ⫽ 40 ⫺ 18 ⫽ 22. Z ⫽ 35: bromo (Br); 35 protones y 35 electrones. Número másico: A ⫽ Z ⫹ n ⫽ 35 ⫹ 45 ⫽ 80. 4.33 Identifica en el sistema periódico el nombre, el símbolo y la masa atómica de los elementos cuyos números atómicos son Z ⴝ 14, Z ⴝ 26 y Z ⴝ 82. Z ⫽ 14: silicio (Si); m ⫽ 28,09 u. Z ⫽ 26: hierro (Fe); m ⫽ 55,85 u. Z ⫽ 82: plomo (Pb); m ⫽ 207,19 u. 4.34 Construye una tabla que indique el número de protones, el número de neutrones y el número de electrones en cada capa de los iones Hⴙ, Mg2ⴙ y Clⴚ. Número de protones: 1 en H⫹ (Z ⫽ 1), 12 en Mg2⫹ (Z ⫽ 12) y 17 en Cl⫺ (Z ⫽ 17) Número de neutrones: 0 en H⫹ (n ⫽ A ⫺ Z ⫽ 1 ⫺ 1 ⫽ 0) 12 en Mg2⫹ (n ⫽ A ⫺ Z ⫽ 24 ⫺ 12 ⫽ 12) 18 en Cl⫺ (n ⫽ A ⫺ Z ⫽ 35 ⫺ 17 ⫽ 18) 4 Los átomos y su complejidad Número de electrones: El ion H⫹ se forma al perder 1 electrón el átomo de H; por tanto: número de electrones ⫽ Z ⫺ 1 ⫽ 1 ⫺ 1 ⫽ 0. El ion Mg2⫹ se forma al perder 2 electrones el átomo de Mg: número de electrones ⫽ Z ⫺ 2 ⫽ 12 ⫺ 2 ⫽ 10. El ion Cl⫺ se forma al ganar 1 electrón el átomo de Cl: número de electrones ⫽ Z ⫹ 1 ⫽ 17 ⫹ 1 ⫽ 18. Número Número de protones de neutrones Ion Z ⴙ 1 1 12 17 H Mg2ⴙ ⴚ Cl Número de electrones K L M ⫺ ⫺ ⫺ ⫺ 12 12 2 8 ⫺ 17 18 2 8 8 4.35 Dados los iones Liⴙ, O2ⴚ, Fⴚ, Naⴙ, S2ⴚ y Kⴙ. a) Señala cuáles tienen la misma configuración electrónica de un gas noble. b) Indica en cada caso el gas noble correspondiente. a) El ion Li⫹ se forma al perder 1 electrón el átomo de Li; por tanto: número de electrones ⫽ Z ⫺ 1 ⫽ 3 ⫺ 1 ⫽ 2. El ion O2⫺ se forma al ganar 2 electrones el átomo de O; por tanto: número de electrones ⫽ Z ⫹ 2 ⫽ 8 ⫹ 2 ⫽ 10. El ion F⫺ se forma al ganar 1 electrón el átomo de F; por tanto: número de electrones ⫽ Z ⫹ 1 ⫽ 9 ⫹ 1 ⫽ 10. El ion Na⫹ se forma al perder 1 electrón el átomo de Na; por tanto: número de electrones ⫽ Z ⫺ 1 ⫽ 11 ⫺ 1 ⫽ 10. El ion S2⫺ se forma al ganar 2 electrones el átomo de S; por tanto: número de electrones ⫽ Z ⫹ 2 ⫽ 16 ⫹ 2 ⫽ 18. El ion K⫹ se forma al perder 1 electrón el átomo de K; por tanto: número de electrones ⫽ Z ⫺ 1 ⫽ 19 ⫺ 1 ⫽ 18. b) El ion Li⫹ tiene la misma configuración electrónica que el He; los iones O2⫺, F⫺ y Na⫹, la misma que el Ne; los iones S2⫺ y K⫹, la misma que el Ar. 4.36 Explica cómo pueden conseguir la configuración electrónica de un gas noble los átomos neutros siguientes: cloro, magnesio y potasio. El cloro (Z ⫽ 17) adquiere la configuración del gas noble argón si gana 1 electrón: Cl⫺. El magnesio (Z ⫽ 12) adquiere la configuración del gas noble neón si pierde 2 electrones: Mg2⫹. El potasio (Z ⫽ 19) adquiere la configuración del gas noble argón si pierde 1 electrón: K⫹. 4.37 Dadas las masas del neutrón, 1,00867 u, del protón, 1,00728 u y del electrón, 5,486 ⴢ 10ⴚ4 u. a) Exprésalas en gramos. b) Calcula cuántos protones hay en 1 g de protones y cuántos electrones hay en 1 g de electrones. a) Neutrón: m ⫽ 1,00867 u ⫽ 1,00867 (u) ⭈ 1,66 ⭈ 10⫺24 (g/u) ⫽ 1,674 ⭈ 10⫺23 g Protón: m ⫽ 1,00728 u ⫽ 1,00728 (u) ⭈ 1,66 ⭈ 10⫺24 (g/u) ⫽ 1,672 ⭈ 10⫺23 g Electrón: m ⫽ 5,486 ⭈ 10⫺4 u ⫽ 5,486 ⭈ 10⫺4 (u) ⭈ 1,66 ⭈ 10⫺24 (g/u) ⫽ 9,107 ⭈ 10⫺28 g 1 (g) b) En 1 gramo de protones: N ⫽ ᎏᎏᎏ ⫽ 6,0 ⭈ 1022 protones 1 (g) En 1 gramo de electrones: N ⫽ ᎏᎏᎏ ⫽ 1,1 ⭈ 1027 electrones 4 Los átomos y su complejidad 4.38 El núcleo atómico tiene un diámetro del orden de 10ⴚ14 m, y el átomo, del orden de 10ⴚ10 metros. Calcula qué tamaño tendría el átomo si el núcleo tuviera el tamaño de una bola de 1 cm de diámetro. La relación entre los diámetros del átomo y del núcleo atómico es: 10⫺10 / 10⫺14 ⫽ 104. Si el diámetro del núcleo fuera de 1 cm (10⫺2 m), el del átomo sería: d ⫽ 10⫺2 ⭈ 104 ⫽ 100 m. 4.39 Completa en tu cuaderno el siguiente párrafo: Los metales adquieren la configuración de gas noble cediendo electrones de su última capa y formando iones positivos o cationes. Los metales del grupo 1 se ionizan más fácilmente que los del grupo 2 porque es más fácil ceder un electrón que dos. 4.40 Completa en tu cuaderno el siguiente párrafo: Los no metales adquieren la configuración de gas noble tomando electrones y formando iones negativos o aniones. Los no metales del grupo 17, que necesitan un electrón para tener ocho en su última capa, se ionizan más fácilmente que los del grupo 16 que necesitan dos electrones. 4.41 La siguiente figura muestra el modelo atómico nuclear de dos átomos. (1) (2) a) Suponiendo que son átomos neutros, indica su número atómico e identifícalos con ayuda del sistema periódico. b) Resuelve las mismas cuestiones en caso de que (1) sea un catión con una carga positiva y (2) sea un anión con una carga negativa. a) (1): Neón (Z ⫽ 10); (2): Argón (Z ⫽ 18). b) (1): Na⫹ (Z ⫽ 11); (2): Cl⫺ (Z ⫽ 17). 4.42 Completa esta tabla para los iones Ca2ⴙ (Z ⴝ 20, A ⴝ 40) y Brⴚ (Z ⴝ 35, A ⴝ 80). Ion Número Número de protones de neutrones Número de electrones K L M N Ca2ⴙ 20 20 2 8 8 ⫺ Brⴚ 35 45 2 8 18 8 Número de protones: 20 en Ca2⫹ (Z ⫽ 20) y 35 en Br⫺ (Z ⫽ 35) Número de neutrones: 20 en Ca2⫹ (n ⫽ A ⫺ Z ⫽ 40 ⫺ 20 ⫽ 20) 45 en Br⫺ (n ⫽ A ⫺ Z ⫽ 80 ⫺ 35 ⫽ 45) Número de electrones: El ion Ca2⫹ se forma al perder 2 electrones el átomo de Ca; por tanto: número de electrones ⫽ Z ⫺ 2 ⫽ 20 ⫺ 2 ⫽ 18. El ion Br⫺ se forma al ganar 1 electrón el átomo de Br; por tanto: número de electrones ⫽ Z ⫹ 1 ⫽ 35 ⫹ 1 ⫽ 36. 4 Los átomos y su complejidad PA R A P E N S A R M Á S 4.43 Hay dos isótopos del cloro en la naturaleza: el cloro 35, con una abundancia relativa del 75%, y el cloro 37, con una del 25 %. Indica: a) Los protones y los neutrones que hay en el núcleo de cada uno de estos isótopos. b) La configuración electrónica de cada uno de ellos. c) La masa atómica del cloro (en u). a) En ambos isótopos: número de protones ⫽ número atómico (Z) ⫽ 17. Número de neutrones: 18 en el cloro 35 (n ⫽ A ⫺ Z ⫽ 35 ⫺ 17 ⫽ 18) 20 en el cloro 37 (n ⫽ A ⫺ Z ⫽ 37 ⫺ 17 ⫽ 20) b) En ambos isótopos: número de electrones ⫽ número atómico (Z) ⫽ 17. La configuración electrónica de ambos es: 2 electrones en la 1.a capa, 8 en la 2.a y 7 en la 3.a c) La masa media ponderada de las masas de los isótopos es: 75 25 m ⫽ 35 ⭈ ᎏᎏ ⫹ 37 ⭈ ᎏᎏ ⫽ 35,5 u 100 100 4.44 El carbono 14 es menos abundante en la naturaleza que el carbono 12. Consulta la siguiente página web y, a continuación, contesta las cuestiones. www.e-sm.net/fq3eso07 a) ¿Qué abundancia relativa tienen cada uno de los isótopos? b) Describe la utilidad principal del carbono 14. a) La abundancia del C⫺12 es del 98,94 %, mientras que la del C⫺14 es del 1,2 ⭈ 10⫺12 %. b) El isótopo C⫺14 se usa principalmente para estimar la edad de un resto orgánico. La proporción entre los isótopos C⫺12 y C⫺14, isótopo radiactivo, se mantiene constante mientras un organismo vive. A su muerte deja de recibir aporte de carbono, de ninguno de sus isótopos, mientras que su contenido de C⫺14 va disminuyendo al desintegrarse este isótopo. Como el ritmo de desintegración es conocido, se puede calcular el tiempo transcurrido entre la muerte del organismo y la actualidad. 4.45 Un átomo neutro de azufre tiene 16 electrones. a) Indica su distribución en las capas K, L y M de la corteza atómica. b) ¿Cómo se sitúan dentro de los subniveles energéticos? a) Capa K: 2 electrones; capa L: 8 electrones; capa M: 6 electrones. b) 1s2 2s2 2p6 3s2 3p4 4.46 El níquel (Z ⴝ 28) que se encuentra en la naturaleza está formado por los siguientes isótopos: a) Señala los protones y los neutrones que hay en el núcleo de cada uno de estos isótopos. b) Calcula la masa atómica del elemento níquel. c) ¿Cuántos átomos hay en un gramo de níquel? d) Identifica a qué clase de elementos pertenece el níquel y enumera algunas de sus propiedades. Isótopo Abundancia relativa Masa (u) Níquel 58 68,3 % 57,94 Níquel 60 26,1 % 59,93 Níquel 61 1,1 % 60,93 Níquel 62 3,6 % 61,93 Níquel 64 0,9 % 63,93 4 Los átomos y su complejidad a) En todos los isótopos, el número de protones es el número atómico (Z ⫽ 28). El número de neutrones es: 30 en el níquel 58 (n ⫽ A ⫺ Z ⫽ 58 ⫺ 28 ⫽ 30) 32 en el níquel 60 (n ⫽ A ⫺ Z ⫽ 60 ⫺ 28 ⫽ 32) 33 en el níquel 61 (n ⫽ A ⫺ Z ⫽ 61 ⫺ 28 ⫽ 33) 34 en el níquel 62 (n ⫽ A ⫺ Z ⫽ 62 ⫺ 28 ⫽ 34) 36 en el níquel 64 (n ⫽ A ⫺ Z ⫽ 64 ⫺ 28 ⫽ 36) b) La masa atómica del níquel natural es la masa media ponderada de las masas de los isótopos: 68,3 26,1 1,1 3,6 0,9 m ⫽ 57,94 ⭈ ᎏᎏ ⫹ 59,93 ⭈ ᎏᎏ ⫹ 60,93 ⭈ ᎏᎏ ⫹ 61,93 ⭈ ᎏᎏ ⫹ 63,93 ⭈ ᎏᎏ ⫽ 58,70 u 100 100 100 100 100 c) La masa promedio de un átomo de níquel natural es: m ⫽ 58,70 u ⫽ 58,70 (u) ⭈ 1,66 ⭈ 10⫺24 (g/u) ⫽ 9,74 ⭈ 10⫺23 g 1 (g) En 1 gramo de níquel, el número de átomos es: N ⫽ ᎏᎏᎏ ⫽ 1,03 ⭈ 1022 átomos d) El níquel es un metal. Por tanto, se caracteriza por su brillo metálico, es sólido a temperatura ambiente, es maleable y dúctil, es buen conductor del calor y de la electricidad y tiene tendencia a formar iones positivos. 4.47 Los elementos del grupo 16 se denominan anfígenos. a) Realiza en tu cuaderno un dibujo de los modelos nucleares correspondientes a los cuatro primeros elementos del grupo. b) Escribe sus configuraciones electrónicas. a) b) 1s2 2s2p4 1s2 2s2p6 3s2p4 1s2 2s2p6 3s2p6d10 4s2p4 1s2 2s2p6 3s2p6d10 4s2p6d10 5s2p4 4 Los átomos y su complejidad T R A B A J O E N E L L A B O R AT O R I O 1 ¿Qué color tienen los metales que has utilizado? Aluminio: gris claro; cinc: gris; cobre: amarillo rojizo; hierro: gris oscuro; plomo: gris muy oscuro. 2 ¿Son iguales de buenos conductores del calor todos los metales que has utilizado? Plantea un procedimiento de laboratorio que te permitiera ordenarlos según su facilidad para conducir el calor. Los metales tienen distinta conductividad térmica, lo mismo que eléctrica. En general, los mejores conductores eléctricos también lo son térmicos. Se puede repetir el paso 1.o del ensayo de conductividad térmica situando en el extremo libre de cada varilla un trozo de cera, de iguales características en todas las varillas, y midiendo el tiempo que tarda en derretirse en cada caso. Se pueden ordenar entonces los metales utilizados según su conductividad térmica.