Apunte Unidad 1
Anuncio

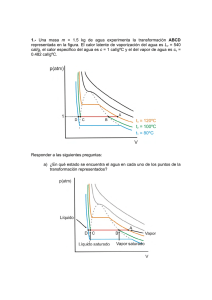
h ALUMNO: AUTORA: Prof. Ma. Laura Sanchez Fisicoquímica 3ro ES Energía térmica La energía Lectura de las páginas 12 – 13 – 14 y 15 del libro de texto. Cuestionario: 1. ¿Qué es la energía cinética? 2. Si un tren y un auto se mueven a la misma velocidad, cuál tendrá más energía cinética, por qué? 3. Si voy en mi automóvil a 40 Km/h, y duplico mi velocidad a 80 Km/h, se duplicará la energía cinética, por qué? 4. En qué unidades se mide la energía cinética? 5. ¿Qué es la energía potencial gravitatoria? 6. De qué factores depende la energía potencial gravitatoria? 7. ¿Qué es la energía potencial elástica? 8. Dar dos ejemplos de cuerpos elásticos 9. ¿Qué es la energía potencial eléctrica? 10. Un camión se queda sin frenos en lo alto de una montaña, explicar qué tipo de energías posee y de qué manera éstas irán aumentando o disminuyendo mientras el mismo cae. 11. ¿Qué tipo de energía tiene el agua acumulada en un embalse de una represa hidroeléctrica? Prof. María Laura Sanchez Página 2 Fisicoquímica 3ro ES Energía térmica Energía Térmica Temperatura A menudo solemos confundir calor con temperatura, cuando decimos “hoy hace calor” , ó “el helado está frío” nos estamos refiriendo a sensaciones térmicas que son imprecisas porque dependen de la persona que las perciba y además de otras sensaciones previas, por ejemplo si caminamos de noche en la arena, cuando nuestros pies toquen el agua la notarán tibia, en cambio si caminamos por la arena caliente del día cuando tocamos el agua con los pies la notaremos fría aunque la temperatura del agua sea la misma. Nosotros ya estudiamos a los átomos y a las moléculas y sabemos que éstas se encuentran en continuo movimiento. Definiremos a la temperatura de un cuerpo como la medida de la energía cinética (de movimiento) media de las moléculas que componen un cuerpo. De esta manera, los cuerpos cuyas moléculas vibran, rotan o se mueven con mayor velocidad poseen mayor temperatura. El instrumento que se utiliza para medir la temperatura de un cuerpo se llama termómetro, existen en la actualidad distintos tipos de termómetros, los más comunes consisten en un tubo de vidrio cerrado con una columna capilar de mercurio en su interior, éstos se basan en la propiedad de la dilatación de sólidos y líquidos, ya que al aumentar la temperatura el mercurio se dilata más que el vidrio por lo tanto puede observarse su longitud en una escala graduada del vidrio. Existen distintas escalas de temperatura, el físico Anders Celsius propuso al punto de fusión y al punto de ebullición del agua como valores de referencia y les asignó 0° y 100° respectivamente, y luego dividió este intervalo en 100 partes iguales, a cada una de ellas se las denomina grado Celsius. Gabriel Fahrenheit propuso otra escala termométrica, asignándole 32° y 212° a los puntos de fusión y ebullición del agua respectivamente, quedando este intervalo dividido en 180 partes iguales denominadas grados Fahrenheit. Lord Kelvin propuso una escala termométrica teniendo en cuenta deducciones teóricas en las que se demostraba que -273 °C era la temperatura más baja posible, entonces asignó a este valor el cero de su escala, denominado “cero absoluto”. Su escala al igual que la Celsius es Prof. María Laura Sanchez Página 3 Fisicoquímica 3ro ES Energía térmica una escala centígrada, por lo que el punto de fusión del agua corresponde a 273 °K y el punto de ebullición del agua corresponde a 373 °K. Conversión de escalas termométricas Para pasar una temperatura de escala Kelvin a Celsius o viceversa, al ser las dos escalas centígradas sólo hay que restar 273° o sumar 273° respectivamente en cada uno de los casos. Ejemplos: 30 ° C = 30 + 273 = 303 °K 280 °K = 280 – 273 = 7 °C Para pasar una temperatura de escala Fahrenheit a Celsius y viceversa hay que tener en cuenta que en el intervalo donde hay 180 °F, corresponden en la escala Celsius a 100 °C, por lo tanto 1 °C = 1,8 °F , además hay que tener en cuenta que para el 0 °C corresponde 32 °F, entonces si pasamos de °F a °C deberemos realizar la siguiente operación ° C = (°F – 32) / 1,8 Para pasar de Celsius a Fahrenheit deberemos realizar la ecuación inversa: °F = (°C x 1,8) + 32 Prof. María Laura Sanchez Página 4 Fisicoquímica 3ro ES Energía térmica Ejemplos: 50 °F = (50 – 32) / 1,8 = 18 / 1,8 = 10 °C 20 °C = (20 x 1,8) + 32 = 36 + 32 = 68 °F Actividad de investigación (trabajo grupal) Investigar qué tipos de termómetros existen, elegir tres de ellos, preparar una exposición oral con láminas, imágenes, etc. para explicar cómo funciona (Cada integrante del grupo debe explicar uno). Actividad 2 Pasar a °C las siguientes temperaturas: 41 °F 297 °K 59 °F 284 °K 104 °F 323 °K 140 °F Pasar a °F las siguientes temperaturas 30 °C 363 °K 25°C 308 °K 2 °C 317 °K 87 °C Pasar a °K las siguientes temperaturas 22 °C 95 °F 85 °C 149 °F 66 °C 86 °F 55 °C Calor Ya hemos definido a la temperatura, también hemos aprendido a medirla y además hemos dicho que no es lo mismo que el calor. Si tenemos un recipiente con agua que se encuentra a 10 °C y dentro de éste introducimos un cuerpo de hierro que se encuentra a 100 °C observaremos que el agua comienza Prof. María Laura Sanchez Página 5 Fisicoquímica 3ro ES Energía térmica a aumentar su temperatura hasta un valor determinado. En el momento en el que la temperatura del agua deja de aumentar y permanece constante decimos que ha alcanzado el “equilibrio térmico”. Debemos de tener en cuenta que si tengo el doble de cantidad de agua con la misma cantidad de hierro el equilibrio térmico será una temperatura menor. (Imaginemos un clavo de hierro caliente sumergido en un vaso de agua y el mismo clavo sumergido en el océano … la temperatura de equilibrio claramente no será la misma) Se ha producido una transferencia de energía del cuerpo más caliente, en este caso el hierro hacia el más frío, en este caso el agua. Esta energía que se transfiere como consecuencia de una diferencia de temperatura se denomina cantidad de Calor, se la indica con la letra Q y se mide en calorías. Una caloría es la cantidad de calor que debe entregarse a un gramo de agua pura para que pase de 14,5 °C a 15,5 °C, se abrevia Cal, y su relación con el Joule, otra unidad de energía estudiada es: 1 Cal = 4,186 Joules Es importante entender que dos cuerpos pueden tener la misma temperatura, sin embargo tener distinta cantidad de calor, por ejemplo: si tengo un vaso de agua a 100 °C o si tengo una pileta de natación llena de agua a 100 °C tendré en ambos casos la misma temperatura sin embargo con la pileta de natación podré por ejemplo derretir una barra de hielo y con el vaso no, ya que la cantidad de calor del vaso no alcanza. Calor específico Si entregamos una cantidad de calor a una sustancia, ésta experimenta un aumento en su temperatura. Si entregamos a la misma cantidad de sustancia el doble de cantidad de calor, entonces experimentará el doble de aumento de temperatura. Dicho en vocabulario matemático: “en masas iguales de una misma sustancia la cantidad de calor es directamente proporcional a la variación de la temperatura” Si tengo el doble de masa de una misma sustancia, necesito el doble de cantidad de calor para provocarle el mismo aumento de temperatura, o sea que “la cantidad de calor necesaria para producir una misma variación de temperatura es directamente proporcional a la masa de sustancia” Prof. María Laura Sanchez Página 6 Fisicoquímica 3ro ES Energía térmica Cuando dos magnitudes son directamente proporcionales sabemos que su cociente nos da una constante, entonces: Esta constante recibe el nombre de “calor específico” y depende de la naturaleza de la sustancia, se le asigna la letra “c” y se mide en cal/g °C. Entonces: El calor específico del agua es 1 Cal/ g °C , esto significa que un gramo de agua necesita ganar una caloría para aumentar su temperatura en un °C. El hierro tiene un calor específico de 0,115 Cal / g °C , esto significa que un gramo de hierro necesita ganar 0,115 Calorías para aumentar su temperatura en un °C. ¿Cuántas calorías necesitarán 100 g de hierro para aumentar su temperatura de 20°C a 50 °C? Actividad 3 a. Se entregan 1302 Cal a una cantidad de aluminio, y se observa que su temperatura aumenta de 50°C a 80 °C ¿Cuál es la masa del aluminio? C= 0,217 Cal/ g °C b. ¿Cuántas calorías tendrá que ceder un cuerpo de 400 gr de acero ( c = 0,11 Cal / g°C) para que su temperatura pase de 100 °C a 40 °C? Prof. María Laura Sanchez Página 7 Fisicoquímica 3ro ES Energía térmica c. Un cuerpo de 300 gr necesita 1200 Cal para aumentar su temperatura de 25°C a 70°C ¿Cuál es su calor específico? d. Un cuerpo de 100 g de hierro (C= 0,115 cal/ g°C) que se encuentra a 10°C absorbe 500 Cal, cuál es su temperatura final? e. ¿Cuántas calorías necesitará un trozo de 450 g de vidrio (C=0,2 cal/g °C) para que su temperatura sufra un aumento de 68 °F? Calor y cambios de la materia Cuando entregamos calor a un cuerpo, éste experimenta un aumento de temperatura, o sea que sus moléculas comienzan a moverse más rápidamente. Puede observarse experimentalmente si colocamos un recipiente con agua sobre un mechero que la temperatura del agua aumenta hasta que comienza su ebullición, si continuamos entregando energía la ebullición continuará pero la temperatura se mantendrá constante mientras exista agua por evaporar. Lo mismo sucede si ponemos hielo mientras se funde. Al calor que el cuerpo absorbe y produce una variación de temperatura se lo llama calor sensible y se calcula como ya sabemos mediante la ecuación Q = C . m . Δt La cantidad de calor que suministramos pero no produce una variación de temperatura sino un pasaje de estado se llama calor latente. El calor latente de fusión del agua es Lf = 80 Cal/g , lo que significa que un gramo de agua necesita absorber 80 Calorías para pasar del estado sólido al líquido. El calor latente de ebullición del agua es Lv = 540 Cal/g, lo que significa que un gramo de agua necesita absorber 540 Calorías para pasar del estado líquido al gaseoso. Observamos que en una misma cantidad de agua se necesita más energía para pasar del estado líquido al gaseoso que para pasar del sólido al líquido. La cantidad de energía que debemos entregarle a una cierta cantidad de sustancia para que cambie de estado se calculará: Ejemplo: ¿Qué cantidad de calor se necesita para que 400 gr de hielo se fundan totalmente? Prof. María Laura Sanchez Página 8 Fisicoquímica 3ro ES Energía térmica Actividad 4 a) ¿Cuántos gramos de agua a 100 °C se evaporarán con 1000 Cal? b) Si tengo 200 gr de hielo a 0°C y le entrego 20000 Cal, logrará fundirse totalmente? ¿Cuál será su temperatura final? c) ¿Qué cantidad de calor hay que entregar a 100 gr de hielo que se encuentra a 0°C para que llegue a ser vapor de agua a 120 °C? Equivalente mecánico del calor Leemos la página 20 del libro de textos. ¿Qué fue lo que demostró James Prescott Joule? Dar algún ejemplo de la vida cotidiana donde algún tipo de energía se transforme en energía térmica. ¿Cuál es la equivalencia entre el Joule y la Caloría? Problema-ejemplo Un cuerpo que pesa 400 N se encuentra a 50 m de altura, en el caso de que caiga y choque contra el suelo, cuál será el valor de la energía térmica liberada? Si esta energía es totalmente absorbida por 500 g de agua, cuál será su variación de temperatura? Solución: Epg = p . h Epg = 400 N * 50 m Epg = 20000 J -------- La energía térmica liberada es 20000 J Prof. María Laura Sanchez Página 9 Fisicoquímica 3ro ES Energía térmica 4,18 Joule --- 1 cal 20000 Joule ---- x cal El calor absorbido por el agua es 4784,69 Cal Q = c . m . Δt Δt = Q / (c . m) Δt = 4784,69 cal / ( 1 cal/g°C . 500 g) Δt = 9,56 °C Intercambio de calor Ya hemos dicho en este capítulo que el calor es una forma de energía que se transmite de los cuerpos de mayor temperatura hacia los de menor temperatura hasta que se alcanza un equilibrio térmico. La propagación del calor puede darse a través de tres formas: Propagación por conducción : si acercamos un cuerpo a una fuente calorífica, las moléculas próximas a ésta comenzarán a aumentar su energía cinética, o sea su movimiento y chocarán a las moléculas cercanas y éstas a las siguientes, de esta manera se irá propagando el calor a lo largo del cuerpo. Esta forma se produce fundamentalmente en los sólidos. Propagación por convección : si colocamos un recipiente con agua sobre el fuego, ocurre que el agua que se encuentra en contacto con el fondo del recipiente recibe el calor de la fuente, sus moléculas se mueven más rápidamente y adquieren menor densidad, por lo tanto ascienden sobre el resto del agua que se encuentra más fría. De esta manera se generan corrientes ascendentes y descendentes que hacen que el calor se propague más rápidamente. Esta forma se produce en líquidos y gases. Propagación por radiación : el calor puede pasar de un cuerpo más caliente hacia otro más frío aunque entre ellos no existan moléculas que lo propaguen, éste es el ejemplo del sol, cuya energía nos llega a través del vacío en forma de ondas electromagnéticas que viajan a la velocidad de la luz. Prof. María Laura Sanchez Página 10 Fisicoquímica 3ro ES Energía térmica Ejemplos de propagación del calor en una casa: Actividad ­ Preguntas y problemas integradores de la unidad 1 (Debe utilizarse el cuadro de calores latentes de la página 24) 1. Responder la actividad 1 de la página 19 del libro de texto. 2.Qué relación existe entre el calor específico de una sustancia y sus uniones intermoleculares (pág. 23 del libro de texto) 3. ¿Qué diferencia existe entre el calor sensible y el calor latente? 4. ¿Cuántas calorías ceden 400 gr de hierro (0,115 Cal / g °C ) que pasan de 100 °C a 20°C? ¿Esas calorías alcanzan para calentar 200 gr de agua de 20°C a 50°C?¿Cuál sería la temperatura final del agua? 5. ¿Cuántos gramos de agua captan la misma cantidad de calorías para pasar de 20°C a 50°C que 200 gr de aluminio (C= 0,217 Cal/ g °C) para la misma variación de temperatura? Prof. María Laura Sanchez Página 11 Fisicoquímica 3ro ES Energía térmica 6. 400 gr de hielo se encuentran a -20°C, sabiendo que el punto de fusión del agua es a los 0°C, que el calor latente de fusión es de 80 Cal/g, indicar cuántas calorías serán necesarias para que la temperatura final sea de 40°C. 7. 600 gr de Cobre se encuentran a 80°C y ceden 2790 Calorías, cuál es su temperatura final? 8. Una sustancia que se encuentra a 80°C debe ceder 1200 Cal para que su temperatura llegue a 20°C, si la masa de la sustancia es 100 gr, calcular su calor específico . 9. Sabiendo que el punto de ebullición del alcohol es a los 78°C, que el calor latente de vaporización es de 206 Cal/g, indicar si tengo 100 gr de alcohol a 20°C y quiero llevarlo a 120°C, cuántas calorías necesito (C alcohol = 0,6 Cal/gºC). 10. ¿Cuántos gramos de hielo se funden con 1000 Cal? 11. ¿Cuántos gramos de vidrio pasan de 20°C a 100°C con 1000 Cal? 12. 100 gr de agua y 100 gr de aceite se encuentran a 20°C, el agua llega a los 50°C, qué temperatura final tendrá el aceite si captó la misma cantidad de calorías que el agua? 13. 400gr de alcohol se encuentran a 60°C, si se le entregan 1000Cal, cuál será su temperatura final? 14.Realizar todas las actividades de la página 27 del libro de texto. Prof. María Laura Sanchez Página 12