Control de Producto No Conforme - Instituto Nacional de Pediatría
Anuncio

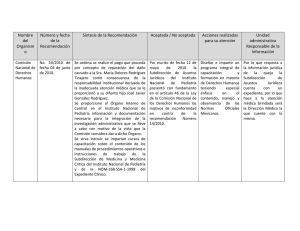
INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento PROCEDIMIENTO DE CONTROL DE PRODUCTO NO CONFORME 1. Propósito Establecer los lineamientos para la identificación y control de Productos No Conformes, para asegurar la correcta prestación del servicio de Análisis Clínicos. 2. Alcance Aplica a Toma de Productos, Recepción de Muestras y Entrega de Resultados y a todos los laboratorios del Departamento de Análisis Clínicos y Estudios Especiales (DACEE) del Instituto Nacional de Pediatría donde el resultado del proceso tenga como consecuencia un Producto No Conforme. 3. Políticas de operación Cuando el volumen de la muestra sea menor al establecido en “Criterios de aceptación” y por las condiciones del paciente no se pueda obtener el volumen indicado, se podrá aceptar sólo si es autorizado por el Laboratorio correspondiente, siempre que se asegure que no se afecta la confiabilidad de los resultados. Ningún producto no conforme podrá ser utilizado para la realización de Análisis de Clínicos, aún cuando sea solicitado por el usuario. 4. Documentos de referencia - Norma NMX-CC-9001 vigente Sistema de Gestión de Calidad: Requisitos. - Norma NMX-CC-9000 Sistemas de Gestión de la Calidad-Fundamentos y Vocabulario (Definiciones). - Manual de Gestión de la Calidad. - Procedimiento de Acciones Correctivas, Preventivas y de Mejora. Elaboró Q.F.B. Lorena Cortés Viveros Representante de la Dirección Procedimientos Normativos Revisó Q.F.B. Lorena Cortés Viveros/QFB. Norma A. Santos Peralta Representante de la Dirección 1 Autorizó Q.F.B. Lina Romero Guzmán Jefa del DACEE Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento 5. Descripción de actividades Secuencia de etapas 5.1 Detección de un Producto No Conforme Actividad 5.1.1 Identifica un Producto No Conforme cuando se presenta lo siguiente: Responsable Todo el personal del DACEE Pre-Examen a) No se verificó que el paciente cumpla con las condiciones fisiológicas o indicaciones al momento de realizar la toma de muestra. b) Se aceptó muestra que no cumple con la calidad analítica requerida de acuerdo a los requisitos establecidos en la Tabla de criterios de Recepción de Muestras (lipemia, hemólisis, ictericia, presencia de micro coágulos, así como requisitos de conservación y transporte de muestras (tempo, temperatura y volumen). c) Se acepto solicitud de estudios de laboratorio requisitada de forma incorrecta o incompleta. d) Omisión de la validación de la muestra en el sistema winlab en toma de productos (checkin). e) Confusión en la identificación de la muestra. f) Omisión en la toma de muestra primaria. g) Error en la captura de datos demográficos. h) Error u omisión en la captura de estudios al sistema winlab. Procedimientos Normativos 2 Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento Secuencia de etapas Actividad Responsable Examen a) Muestra que en el momento del proceso se detecta que no cumplen con la calidad analítica requerida (gasometrías, cultivos, cualquier otro sistema cerrado, etc.). b) Resultados de control de Calidad externo fuera de los límites establecidos por el programa respectivo. c) Falla en equipos y/o reactivos. d) Incumplimiento en llevar a cabo las instrucciones de trabajo. e) Incumplimiento en la preparación y conservación de reactivos. Post-Examen a) Omisión de la entrega de un resultado porque no se realizó. b) Omisión de la entrega de un resultado porque no se valido en el sistema. c) Entrega del reporte del resultado fuera del tiempo establecido. Nota: En los casos de muestras aceptadas bajo concesión se registran los acuerdos pactados con el médico en la solicitud de estudios firmando por ambas partes la aceptación. 5.2 Elaboración del Reporte de Producto No Conforme Procedimientos Normativos 5.2.1 Elabora Reporte de Producto No Conforme y notifica al personal involucrado en el Producto No conforme para que proceda a determinar las actividades necesarias para eliminar la no conformidad detectada, quien será responsable de 3 Todo el personal del DACEE Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento Secuencia de etapas asegurar que nuevamente. 5.3 Toma de acciones 5.4 Reporte mensual Responsable Actividad no se presente 5.3.1 Determina y ejecuta las actividades que considere necesarias para impedir el uso del producto no conforme y eliminar la no conformidad. 5.4.1 Entrega de manera mensual al Representante de la Dirección los Reportes de Productos No Conformes para su análisis. 5.5 Generación de 5.5.1 Analiza los reportes y determina si solicitudes de acción es necesario generar una acción correctiva o preventiva, de acuerdo a la magnitud y frecuencia de los Productos No conformes presentados, ver procedimiento Acciones Correctivas, Preventivas y de Mejora. Responsable del Producto No Conforme Jefes de Laboratorio Representante de la Dirección TERMINO DE PROCEDIMIENTO Procedimientos Normativos 4 Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento 6. Diagrama de bloque Proveedores Entrada Todo el personal Producto No del Laboratorio Conforme Proceso a) Detección de un Producto No Conforme b) Elaboración del Reporte de Producto No Conforme Salidas Usuario Generación de Reporte de Servicio No Conforme Generación de acciones Todo el personal del Laboratorio c) Toma de acciones d) Reporte mensual e) Generación de solicitudes de acción Procedimientos Normativos 5 Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento 7. Diagrama de flujo Procedimientos Normativos 6 Rev. 5 INSTITUTO NACIONAL DE PEDIATRÍA DIRECCIÓN MÉDICA Subdirección de Servicios Auxiliares de Diagnóstico y Tratamiento 8. Definiciones Producto No Conforme: Incumplimiento a los requisitos establecidos para el producto generado en el DACEE. No conformidad potencial del producto: Producto que esta en riesgo de convertirse en un problema que puede provocar una queja o insatisfacción del usuario. 9. Indicadores N/A 10. Anexos N/A Control de cambios Revisión Fecha 0 18-Jul-2003 3 Ene-2009 4 Abr-2009 5 Febrero 2011 Procedimientos Normativos Motivo del Cambio Creación del Sistema de Gestión de la Calidad Alineación del formato de procedimiento de acuerdo a los lineamientos de la Dirección de Planeación y ajustes en la identificación del Producto No Conforme. 5.1.1 Se complementan las causas que originan un producto no conforme. Se complementa la definición de “Producto no Conforme” para tener mayor claridad en la definición. Se corrige el número de revisión. Cambio de claves del producto no conforme 7 Rev. 5