Trabajo Práctico EQUIVALENTE EN AGUA DE UN CALORIMETRO
Anuncio

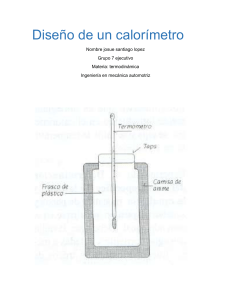
Departamento de Materias Básicas Unidad Docente Básica de Física CÁTEDRA DE FÍSICA II Ministerio de Educación Universidad Tecnológica Nacional Facultad Regional Rosario Trabajo Práctico DETERMINACIÓN DEL EQUIVALENTE EN AGUA DE UN CALORIMETRO Introducción Teórica: Se busca encontrar el equivalente en agua del calorímetro como experiencia previa a la determinación del calor específico de distintos materiales, en el trabajo práctico siguiente. El calorímetro de mezclas está compuesto por un recipiente metálico aislado térmicamente del exterior. Su superficie externa tiene un pulido muy brillante (una superficie muy reflectante es muy mala emisora) y está colocado dentro de otro recipiente impermeable al calor (paredes adiabáticas). Está provisto de un agitador y un termómetro. Nosotros emplearemos un termo de alimentos de boca ancha, el cual cumple con excelente eficiencia las funciones del calorímetro. Como termómetro emplearemos una termocupla tipo “K”. Los métodos calorimétricos se fundan en: ♣ Principio de conservación de la energía: “Cuando dos cuerpos se ponen en contacto en un sistema aislado del exterior (proceso adiabático), la cantidad de calor que pierde uno es igual a la cantidad de calor que gana el otro”. | donde | o bien ⇒ ∑ cantidad de calor intercambiada por el elemento 0 i con los otros elementos del calorímetro, en kJ. ♣ Principio de las transformaciones inversas: “La cantidad de calor que hay que suministrarle a un cuerpo para que aumente su temperatura un cierto ∆t, es igual a la cantidad de calor que debería perder para disminuir la misma temperatura”. Es válida para ambos casos la ecuación: Ing. Sandra Silvester e Ing. Rubén Sarges Guerra Página 1 Departamento de Materias Básicas Unidad Docente Básica de Física CÁTEDRA DE FÍSICA II Ministerio de Educación Universidad Tecnológica Nacional Facultad Regional Rosario . . siendo: masa del elemento i, en Kg calor específico del elemento en / . / . i (capacidad calorífica específica) temperatura final e inicial del elemento i , en o K Recordar que 1 °C = 1 K y por ello Δt [°C] = Δt [K] Si el intercambio de calor se efectuara solamente entre dos masas de agua, tendríamos: · ·∆ · ·∆ 0 (el signo lo da Δt) Pero el calorímetro, el termómetro, el agitador, etc., absorben calor. Para simplificar la operación de hallar las masas y los calores específicos (a veces de cada elemento, se calcula el Equivalente en Agua del desconocidos) Calorímetro, que no es otra cosa que una masa de agua hipotética que intercambiará la misma cantidad de calor que dichos elementos. Para ello se vierte en el calorímetro una masa luego se mide la temperatura de agua, se deja estabilizar y . Se calienta (en otro recipiente) una masa de agua y se le mide su temperatura . A continuación se vierte rápidamente esta masa de agua caliente en el calorímetro, tapando éste inmediatamente. Finalmente, se lee la temperatura de equilibrio . Luego: t m . c Σ . í t Σ t . ó 0 t . . . . Ing. Sandra Silvester e Ing. Rubén Sarges Guerra 0 Página 2 Departamento de Materias Básicas Unidad Docente Básica de Física CÁTEDRA DE FÍSICA II Ministerio de Educación Universidad Tecnológica Nacional Facultad Regional Rosario ⇒ kg (t2 >tf >t1) Materiales: • Calorímetro de 400 cm3 de capacidad termómetro • 2 termocuplas tipo “K” agitador (con su respectivo equipo de lectura) • Probeta graduada hasta 200 cm3 (1 cm3 agua ⇒ 1 g agua) pared adiabática • Cronómetro digital o analógico agua • Agitador vasija metálica • Balanza de 2 platillos • Agua fría CALORÍMETRO • Agua caliente (calentador eléctrico) Procedimiento: 1. Introducir en el calorímetro una masa de agua a una temperatura inferior a la ambiente, con m1 entre 100 y 200 cm3 (previamente medida en la probeta graduada). 2. Iniciar la lectura de la temperatura cada 10 segundos hasta que se estabilice en t1. Continuamente agitar el agua. 3. Introducir en el calorímetro entre 100 y 200 cm3 de agua temperatura t2 m2 a una superior a 60 ºC, previamente medida con otra termocupla. Esto debe hacerse rápidamente. 4. Continuar la lectura de la temperatura cada 10 segundos hasta que se estabilice en tf , siempre agitando el agua. Es conveniente que las dos masas sean similares (una masa muy grande va a predominar con su temperatura y ∆t será muy pequeño). También es importante ocupar el volumen del calorímetro lo máximo posible. Ing. Sandra Silvester e Ing. Rubén Sarges Guerra Página 3 Departamento de Materias Básicas Unidad Docente Básica de Física CÁTEDRA DE FÍSICA II Ministerio de Educación Universidad Tecnológica Nacional Facultad Regional Rosario Cuadro de valores: Medición m1 m2 t1 t2 E nº g g ºC ºC g 1 2 3 Ing. Sandra Silvester e Ing. Rubén Sarges Guerra Página 4