Cálculo de los espectros UV e IR de moléculas sencillas con el
Anuncio

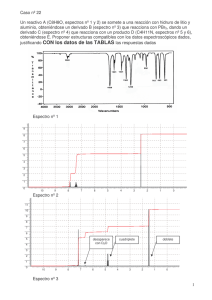
Procesos fotoquímicos de Interés Medioambiental. Prácticas en el aula de informática. Primera parte. 1 Cálculo de los espectros UV e IR de moléculas sencillas con el programa de simulación molecular Spartan Durante la segunda parte de esta práctica veremos cómo a partir de métodos puramente teóricos podemos calcular la energía total de una molécula, su estructura y obtener datos sobre sus espectros de UV/vis e IR. Ambas técnicas espectroscópicas constituyen dos herramientas fundamentales para la determinación estructural de compuestos orgánicos e inorgánicos, además de jugar un papel fundamental para comprender y seguir determinados procesos medioambientales. Para ello utilizaremos el programa Spartan con el que construiremos moléculas sencillas y resolveremos de forma aproximada su ecuación de Schrödinger (calcularemos su energía y obtendremos su función de onda). Breve fundamento teórico de la práctica Átomos y moléculas pueden absorber radiación electromagnética pero sólo de determinada energía (longitud de onda). Ciertas longitudes de onda en la región del visible (400-800 nm) y del ultravioleta (10400 nm) pueden excitar electrones desde orbitales ocupados a otros de mayor energía, o lo que es lo mismo pueden promover transiciones entre estados electrónicos. Estas transiciones electrónicas pueden ser de distintos tipos σσ*, σπ*, ππ*, πσ*, nπ*, nσ*, según el carácter σ (sigma), π (pi) o no enlazante (n) del orbital de salida y π* o σ* del orbital de llegada. Los espectros de UV/vis suelen ser espectros complejos debido a la superposición de transiciones rotacionales, vibraciones y electrónicas. La intensidad de estas transiciones puede calcularse a partir del cuadrado del momento dipolar de transición, que a su vez es función del momento dipolar de transición electrónico, el factor Franck-Condon y el solapamiento de las funciones de onda de spín. En particular Spartan no calcula las integrales Franck-Condon por lo que, al contrario de los espectros experimentales, nuestros espectros calculados teóricamente no reflejarán la estructura vibracional de las bandas electrónicas. Por su parte, los fotones de IR (800 nm-1mm), mucho menos energéticos que los anteriores, pueden excitar vibraciones moleculares. Para una determinada geometría molecular, la solución de la ecuación de Schrödinger nuclear proporciona los estados vibracionales de la molécula y sus correspondientes energías vibracionales. Como aproximación, se considera el potencial en el que se mueven los núcleos como armónico (Eel(Q)=kQ2/2), donde k es la constante de fuerza que depende del modo normal de vibración considerado y Q es la coordenada normal que hace referencia a la posición de los núcleos respecto a su posición de equilibrio. La energía de cada nivel vibracional está determinada por la ecuación Evib=(v+0.5)ħν, con v=0, 1, 2,.... y la “energía del punto cero” o la energía vibracional de una molécula en el cero absoluto de temperatura vendría determinada por la ecuación: En el caso de la espectroscopía de IR, la intensidad de las bandas de absorción es proporcional al gradiente del momento dipolar, µ, IIRα (∂µ /∂Q) 2 El número total de formas independientes de vibrar de una molécula asciende a 3N-5 para moléculas lineales y 3N-6 para moléculas angulares, siendo N el número total de átomos. Éstas pueden clasificarse en modos de tensión o de flexión, que varían € respectivamente la distancia internuclear y el ángulo de enlace descrito por tres átomos. Ambos tipos de modos normales pueden a su vez subdividirse en simétricos o asimétricos en función del movimiento relativo de unos átomos respecto a otros. A lo largo de esta práctica compararemos los espectros calculados UV/vis e IR de las moléculas propuestas con los registrados experimentalmente. Obtendremos estos espectros experimentales de la página web del National Insititute of Standards (NIST), que permite el acceso a más de 80 bases de datos que recogen información sobre un gran número de substancias y propiedades de distintas disciplinas científicas. En su página web http://www.nist.gov/ encontrarás una gran cantidad de enlaces a distintos recursos, algunos de ellos de libre acceso. En esta parte de la práctica en concreto accederemos sólo a la base de datos denominada "Chemistry WebBook" http://webbook.nist.gov/ que recoge datos experimentales termoquímicos, termofísicos y energéticos de más de 70000 especies (http://webbook.nist.gov/chemistry/download/). 1. Cálculo del espectro de UV/vis de moléculas sencillas 1.1 Cálculo del espectro teórico UV/vis de la molécula de naftaleno La construcción de la molécula de naftaleno es sencilla ya que su estructura se encuentra entre las predeterminadas en el programa. Para construirla abre Spartan, pincha en “File” y escoge la opción “New”, o alternativamente pincha en el primer icono por la izquierda en la barra de herramientas. A continuación te aparecerá un "menú lateral" con multitud de opciones. Dentro del menú que aparece por defecto (Organic), selecciona la opción “Rings” y dentro de la pestaña de la derecha pincha sobre “Naphthalene”. Construye la molécula simplemente pinchando con el botón izquierdo del ratón en la zona de trabajo de Spartan. Cada vez que pulses el botón izquierdo del ratón en esta zona te añadirá otra molécula, átomo, o grupo funcional seleccionado en el panel de la derecha… En caso de que te equivoques, puedes borrar átomo a átomo pulsando el botón "delete" y seleccionando posteriormente el átomo que quieres borrar en la zona de trabajo de Spartan. A continuación, vamos a optimizar la geometría correspondiente al mínimo del estado fundamental sobre la que vamos a calcular las energías verticales de los estados excitados para construir el espectro de UV/vis. Antes de ello, para disminuir el tiempo de cálculo selecciona en la pestaña de abajo a la izquierda SMD (Spartan Molecular Database) y en la de la derecha B3LYP/6-31G*. Esto sustituye la geometría de partida actual por otra previamente optimizada al nivel de teoría indicado. Una vez hecho esto, pincha en el menú “Setup”, “Calculations”. Siempre que vayas a calcular el espectro UV/vis o vibracional de una molécula es necesario realizar una optimización previa de la geometría de equilibrio. Para ello, selecciona en la primera pestaña del menú “Equilibrium Geometry” (1). Para realizar esta práctica utilizaremos como método de cálculo B3LYP (Teoría del funcional de la densidad) y como base 6-31G* (2). No olvides activar la casilla UV/vis para calcular el espectro de UV/vis, (3) la casilla Procesos fotoquímicos de Interés Medioambiental. Prácticas en el aula de informática. Primera parte. 3 “Symmetry”, (4) que reduce notablemente el tiempo de cálculo y la casilla “Orbitals and Energies” (5) para examinar los orbitales moleculares de la molécula posteriormente. Por defecto, Spartan calcula los 6 primeros estados excitados de la molécula. Para aumentar este número, escribe en la casilla “Options” UVSTATES=N, siendo N el número de estados excitados que quieres calcular (6). Calcularemos 10 en el caso del naftaleno. Para lanzar el cálculo debes pulsar el botón “Submit” localizado en la parte inferior derecha de la misma pantalla (7). Una vez comenzado y terminado el cálculo recibirás un mensaje de Spartan indicándolo. Para visualizar los resultados del cálculo vete a “Display” – “Spectra”, y a continuación selecciona el espectro de UV/vis. Allí verás una tabla con dos columnas que recoge las longitudes de onda (en nm) de las N primeras absorciones y sus intensidades (adimensional) calculadas al nivel de teoría especificado anteriormente, TD-B3LYP/6-31G*. Si pulsas el botón “Draw Calculated” el programa dibujará el espectro de absorción de la molécula de naftaleno. El botón “Draw Experimental” por su parte se conectará (siempre que tu ordenador tenga conexión a internet) a la base de datos Chemistry WebBook del NIST y superpondrá el espectro de absorción para esta especie registrado experimentalmente, siempre y cuando este último esté disponible en la base de datos NIST y la molécula esté recogida la base de datos de Spartan SMD. Para cambiar el rango de longitudes de onda dibujado, pulsa sobre el eje de abcisas primero con el botón izquierdo para seleccionarlo y a continuación con el derecho, que despliega un nuevo menú donde debes seleccionar “Properties”. En la nueva pantalla emergente selecciona arriba el botón “X-Axis”, donde podrás cambiar el intervalo de longitudes de onda que viene por defecto. El botón despliega a la izquierda de la zona de trabajo de Spartan un diagrama de orbitales moleculares que recoge los orbitales más próximos a los orbitales frontera HOMO (Highest Occupied Molecular Orbital) y LUMO (Lowest Unoccupied Molecular Orbital). Podrás visualizar estos orbitales pinchando sobre cada uno de ellos en el diagrama. Para visualizar los orbitales que no aparecen en el diagrama anterior, por tener energías mucho mayores o menores, accede al menú “Setup”-“Surfaces” y a continuación pincha en “More Surfaces”. Desplegando la pestaña “Surface” podrás seleccionar el orbital que quieres dibujar según su posición relativa al HOMO o al LUMO. Así, LUMO+1 dibujará el orbital que sigue en energía al LUMO, LUMO+2 dibujará el orbital que sigue en energía al LUMO+1, etc… Por su parte, HOMO-1 dibujará el orbital de energía inmediatamente inferior al HOMO, HOMO-2 el de energía inferior a HOMO-1 y así sucesivamente. Puedes pedirle al programa que calcule varios orbitales al mismo tiempo pulsando la tecla “Apply” después de cada selección. Antes de poder dibujarlos comprueba que el Status en la ventana “Surfaces” es Completed. Una vez terminados todos tus cálculos no olvides salvar tu trabajo pinchando en el menú “File”- “Save as”. Para guardar una imagen de la pantalla utiliza el menú “File”“Save as” y selecciona cualquiera de los formatos de imagen disponibles JPEG o PNG en la pestaña “Format”. Guión de prácticas (a. Molécula de Naftaleno): 1. Calcula los 10 primeros estados electrónicos para la molécula de naftaleno y construye una tabla con sus energías e intensidades. 2. Dibuja el espectro teórico para un intervalo de longitudes de onda comprendido entre 150-700 nm. 3. A continuación, superpón el espectro experimental procedente del NIST. Guarda e incluye en el guión de prácticas una imagen de los dos espectros superpuestos. 4. ¿Qué tipo de excitaciones caracteriza el espectro de absorción del naftaleno? Razona tu respuesta. 5. Incluye en tu guión un esquema con los orbitales π y π* de la molécula de naftaleno en los que aparezcan los nodos de estos orbitales y razona cuál será la energía de los mismos en función de su número de nodos. 6. A partir de la salida del programa que se adjunta más abajo determina qué orbitales están involucrados en las excitaciones de mayor intensidad en el espectro teórico. Adjunta una imagen de los mismos. 7. ¿A qué atribuyes las diferencias en la primera banda de absorción entre el espectro experimental y teórico? Procesos fotoquímicos de Interés Medioambiental. Prácticas en el aula de informática. Primera parte. 5 1.2 Cálculo del espectro teórico UV/vis para la molécula trans-propenal Guión de prácticas (b. Molécula trans-propenal): 1. Siguiendo las instrucciones descritas anteriormente construye la molécula de transpropenal (sugerencia: comienza a construirla a partir de una molécula de etileno). 2. Optimiza la estructura del estado fundamental y calcula sus 6 primeros estados electrónicos. Incluye una tabla en tu guión que recoja sus energías e intensidades. 2. Dibuja el espectro teórico para un intervalo de longitudes de onda comprendido entre 100-700 nm. 3. A continuación, superpón el espectro experimental procedente del NIST. Guarda la pantalla con los dos espectros superpuestos como imagen. 4. ¿Qué tipo/s de excitaciones prevés que pueden caracterizar el espectro de absorción del trans-propenal? 5. A partir de la salida del programa que se adjunta más abajo determina qué orbitales están involucrados en las bandas de mayor intensidad en el espectro teórico. Adjunta una imagen de los mismos. 6. A qué atribuyes la diferencia de intensidades entre las dos primeras bandas. 2. Cálculo del espectro de vibración de moléculas sencillas 2.1 Cálculo del espectro teórico IR de la molécula de CO2 Antes de comenzar la nueva actividad asegúrate de haber grabado y cerrado el trabajo realizado con la molécula de naftaleno. A continuación y de manera similar a lo hecho con el naftaleno, pincha en “File” y escoge la opción “New”, o bien pincha en el primer icono por la izquierda en la barra de herramientas. En el "menú lateral" emergente selecciona esta vez la pestaña (Inorganic), el átomo de C como átomo central y una conectividad igual a 2 y lineal para este átomo. Pincha en el panel de Spartan. A continuación y en el mismo menú, selecciona los átomos terminales de O, con una conectividad de 1 y pincha sobre las valencias disponibles del oxígeno. Para el cálculo del espectro de IR optimiza primero el estado fundamental de la molécula de CO2 y activa el cálculo de frecuencias a través de las siguientes opciones en el menú “Setup”, “Calculations”: “Equilibrium Geometry” at the “Ground State”, Nivel de cálculo: B3LYP, base: 6-31G* y Compute IR. Comprueba que las opciones de cálculo con simetría y “Vibrational Modes” están también activas en el menú. Por último, lanza el cálculo pulsando el botón “Submit” localizado en la misma pantalla. Para visualizar el espectro de IR selecciona “Display”- “Spectra”, y a continuación selecciona la pestaña de espectro de IR. Al igual que para el espectro de UV/vis, las dos columnas representadas en la tabla corresponden a las 4 absorciones de IR (en cm-1) y sus intensidades (adimensional) calculadas a nivel, B3LYP/6-31G*. Al pulsar el botón “Draw Calculated” el programa dibujará el espectro de IR calculado. Pulsando el botón “Draw Experimental” el programa debería superponer el espectro registrado experimentalmente para la molécula de CO2 sobre el espectro teórico, pero no lo hace al no estar recogida esta molécula en la base de datos del programa. Para superponer ambos espectros descargaremos el espectro experimental de la web del NIST: http://webbook.nist.gov/chemistry/ y modificaremos su extensión de .jdx a .dx. A continuación seleccionaremos la casilla: “Local File” en lugar de “Web Site” en la parte de debajo de la ventana emergente. Seguidamente pulsa el botón “Draw Experimental” y localiza el archivo .dx que has guardado previamente. Asimismo, Spartan permite animar los modos normales calculados. Para ello, activa la casilla a la izquierda de cualquiera de los 4 frecuencias calculadas. Puedes controlar la amplitud de los modos normales, así como la velocidad del movimiento modificando los valores de las casillas “Amp” y “Step”. Spartan también te permite visualizar el momento dipolar permanente. Para ello selecciona en el menú “Display” la opción “Properties” y activa la casilla “Display Dipole Vector”. Comprueba para el caso de la molécula de CO2 que no posee momento dipolar al tratarse de una molécula lineal y simétrica. Por último, salva tu trabajo/las imágenes que necesites a través del menú “File”“Save as”. Guión de prácticas (c. Molécula de CO2): 1. Construye una Tabla que recoja la energía e intensidad de las 4 absorciones de IR. Describe los modos normales de vibración calculados para la molécula de CO2. ¿Por qué hay dos de ellos que absorben a la misma frecuencia? 2. Adjunta una imagen de los espectros de vibración teóricos y experimentales superpuestos y asigna cada una de las bandas de absorción. 3. Explica, atendiendo a la variación del momento dipolar de cada uno de los modos normales, la intensidad de cada una de las bandas de IR. 4. Justifica brevemente en función de la posición de las bandas de IR del CO2 por qué esta molécula es considerada como un potente gas invernadero. Procesos fotoquímicos de Interés Medioambiental. Prácticas en el aula de informática. Primera parte. 7 2.2 Cálculo del espectro teórico IR para la molécula del CFC-11 (CCl3F) Guión de prácticas (d. Molécula de CCl3F): 1. Predice el número de modos normales que tendrá esta molécula a partir de la fórmula indicada en la introducción. 2. Construye una tabla que recoja las energía e intensidad de las absorciones de IR calculadas. Describe los modos normales de vibración calculados. ¿Por qué varias de estas frecuencias se encuentran degeneradas? 3. Captura la imagen de los espectros de vibración teóricos y experimentales superpuestos y asigna cada una de las bandas de absorción. 4. Explica, atendiendo a la variación del momento dipolar de cada uno de los modos normales, la intensidad de cada una de las bandas de IR. 5. Indica si las frecuencias de alguno de los modos activos en IR solapa con el espectro de cuerpo negro de la Tierra. Salida programa para Naftaleno: Salida programa para trans-propenal: S1.- 272.8 f=0.0001 (HOMO-1)->(LUMO) S1.- 342.7 f=0.0000 (HOMO)->(LUMO) S2.- 265.3 f=0.0744 (HOMO)->(LUMO) S2.- 179.8 f=0.4947 (HOMO-1)->(LUMO) S3.- 213.4 f=0.0000 (HOMO-2)->(LUMO) S3.- 176.3 f=0.0007 (HOMO)->(LUMO+1) S4.- 193.9 f=0.0000 (HOMO-2)->(LUMO+1) S4.- 163.9 f=0.0006 (HOMO-2)->(LUMO) S5.- 188.1 f=0.2331 (HOMO-1)->(LUMO+1) S5.- 152.8 f=0.0016 (HOMO-4)->(LUMO) S6.- 186.2 f=1.9291 (HOMO)->(LUMO+1) S6.- 145.8 f=0.0607 (HOMO-3)->(LUMO) S7.- 182.4 f=0.0000 (HOMO)->(LUMO+2) S8.- 177.7 f=0.0000 (HOMO-5)->(LUMO) S9.- 174.9 f=0.0000 (HOMO-3)->(LUMO) S10.- 165.4 f=0.0000 (HOMO)->(LUMO+3)