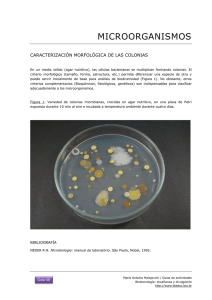
preparación de medios de cultivo y métodos de siembra
Anuncio

PREPARACIÓN DE MEDIOS DE CULTIVO Y MÉTODOS DE SIEMBRA (INFORME) 2004 INTRODUCCIÓN Se entiende por medios de cultivos a los alimentos o nutrientes en el que crecen los microorganismos, en este caso bacterias. Para conseguir un medio de cultivo óptimo es necesario tener condiciones adecuadas de temperatura, grados de humedad, presión de oxigeno, grados de acidez o alcalinidad. Debe tener como mínimo carbono, hidrógeno, oxigeno y sales inorgánicas. Los medios de cultivos se pueden clasificar de acuerdo a su consistencia en líquidos, sólidos y semisólidos, y según su composición nutricional en enriquecidos, de enriquecimiento, sintéticos, generales, entre otros. Los medios de cultivos, además deben de tener ciertos requisitos o condiciones para poder permitirle a los microorganismos su desarrollo, de ahí que la constitución de estos deben tener los suficientes nutrientes y sustratos que le brinden condiciones para realizar sus funciones metabólicas Las técnicas de cultivos bacterianos, nos permiten aislar un tipo de bacteria específico de una fuente natural, incrementar su numero de poblaciones o mantener en condiciones estables el cultivo, así como cuantificar el numero de bacterias que se encuentran en el material de estudio. OBJETIVOS OBJETIVO GENERAL Preparar medios de cultivo mediante diferentes métodos de siembra. OBJETIVOS ESPECÍFICOS Preparar los diferentes medios de cultivos indicados. Realizar siembras aplicando las diferentes técnicas de cultivo microbianos. Analizar el desarrollo y crecimiento microbiano en cada una de las siembras realizadas. 1. TEORÍA RELACIONADA Uno de los sistemas más importantes para la identificación de microorganismos es observar su crecimiento en sustancias alimenticias artificiales preparadas en el laboratorio. El material alimenticio en el que crecen los microorganismos es el Medio de Cultivo y el crecimiento de los microorganismos es el Cultivo. Para que las bacterias crezcan adecuadamente en un medio de cultivo artificial debe reunir una serie de condiciones como son: consistencia adecuada del medio, luz ambiental, esterilidad del medio, temperatura, grado de humedad y presión de oxígeno adecuadas, así como un grado correcto de acidez o alcalinidad. Un medio de cultivo debe contener los nutrientes y factores de crecimiento necesarios y debe estar exento de todo microorganismo contaminante. La clasificación de los medios es: a. Según su consistencia: Sólidos: que llevan una sustancia que se llama agar, que es un polisacárido acídico producido por ciertas algas rojas que gelifica por debajo de 45° C. Se usa a una concentración del 1,5%, da consistencia sólida y va a ser el soporte de los compuestos necesarios en la nutrición de las bacterias. Semisólidos: tienen menos agar, una proporción de 0.1% a 0.5%. Líquidos: se llaman caldos. b. Según su composición: Medios sintéticos o químicamente definidos: que son medios de cultivo de composición conocida o definida, llevan fuente de carbono, fuente de nitrógeno, sales que suplan iones (P, K, Mg, Fe, Ca...), otros elementos como son estimuladores del crecimiento (eritritol para Brucella abortus), se utilizan muy poco y suelen hacerse para cultivar una especie de bacterias determinada. Medios generales: no selectivos, para cultivo de una amplia variedad de organismos difíciles de hacer crecer. A menudo están enriquecidos con materiales como: sangre, suero, Hemoglobina, FX, FV, glutamina, u otros factores accesorios para el crecimiento de las bacterias, tienen una composición en la que crecen la mayor parte de los microorganismos. (Agar Sangre, Schaeadler, PCA, APHA, etc) Medios enriquecidos: son medios generales a los que se les añade sustancias que aumentan su poder nutritivo, además enlentecen/suprimen el crecimiento de la flora competitiva normal potenciando el cultivo y crecimiento deseado (Selenito, medio con Vitamina K). Medios selectivos: (pueden ser de moderada o de alta selectividad) se le adicionan al agar nutritivo, sustancias que inhiben el crecimiento de un grupo de microorganismos, sin aceptar el desarrollo de otras. Es de gran utilidad para el aislamiento de microorganismos a partir de una población microbiana mixta. Variando las sustancia añadidas, se varía el tipo y grado de selectividad (Mac Conkey, Kanamicina-Vancomicina) Medios de mantenimiento. Suelen ser distintos a los de crecimiento óptimo ya que el crecimiento rápido y prolífico suele ocasionar la muerte rápida de las células. Ejemplo: al añadir glucosa y utilizarla los microorganismos producen ácidos, acidificándose el medio por lo que es preferible no utilizar glucosa en los medios de mantenimiento Medios complejos o de composición indefinida. Estos medios llevan ingredientes como extracto de levadura, peptona, infusión de cerebro, extracto de carne, etc. que contienen nutrientes en abundancia pero sin saber con exactitud la composición cualitativa ni cuantitativa de estos nutrientes. Medios de enriquecimiento. Son medios complejos (normalmente) con aditivos adicionales para favorecer el crecimiento de determinados microorganismos (particularmente heterótrofos exigentes). Ejemplo: adicción de sangre, suero o extractos de tejidos de animales y plantas. c. Medios para identificación: Medios diferenciales: Formulaciones especiales en las que se estudian las peculiaridades fisiológicas (nutrición y respiración sobre todo) específicas de las bacterias. Seleccionando los medios adecuados y por medio de los reactivos que llevan nos permiten diferenciar entre todos las bacterias crecidas unas de otras. (Agar sangre diferencia hemolíticos de no hemolíticos; McConkey diferencia lactosa + de lactosa -) Medios de caracterización: se utilizan para identificar bacterias, dan lugar a una respuesta concreta al metabolismo bacteriano. Medios aislamientos especializados: formulaciones nutritivas especiales que satisfacen requerimientos de grupos específicos de bacterias, ayudando a su identificación (Lowenstein). La composición de los medios y caldos: Todos los medios llevan agua, peptonas (que son compuestos intermedios de hidrólisis de las proteínas), extracto de carne (se prepara a partir de carne de vaca troceada y macerada, suministra componentes nitrogenados, también no nitrogenados y alguna vitamina), extracto de levadura (se somete la levadura a una extracción con agua y se evapora, luego a sequedad y tiene la misma función que el extracto de carne pero es mucho más barata), gelatina (agente solidificante, se prepara hidrolizando colágeno en agua hirviendo, se emplea mucho menos ya que bastantes bacterias provocan su licuación), agar (componente para dar consistencia a los medios, se extrae de esta alga, la Gelidium corneum. Con mínimas excepciones no tiene efecto sobre el crecimiento de las bacterias y no es atacado por aquellas que crecen en él), cloruro sódico (para mantener la presión osmótica), sustancias inorgánicas (Na, K, Ca, etc.). En los diferentes medios de cultivo se encuentran numerosos materiales de enriquecimiento como hidratos de carbono, suero, sangre completa, bilis, etc. Los hidratos de Carbono se adicionan por dos motivos fundamentales: para incrementar el valor nutritivo del medio y para detectar reacciones de fermentación de los microorganismos que ayuden a identificarlos. El suero y la sangre completa se añaden para promover el crecimiento de los microorganismos menos resistentes, productos fermentables (monosacáridos, disacáridos y tienen dos funciones: producir energía y para la identificación y clasificación de los microorganismos). También se añaden colorantes que actúan como indicadores para detectar, por ejemplo, la formación de ácido o como inhibidores del crecimiento de unas bacterias y no de otras (el Rojo Fenol se usa como indicador ya que es rojo en pH básico y amarillo en pH ácido. La Violeta de Genciana se usa como inhibidor ya que impide el crecimiento de la mayoria de las bacterias Gram-positivas). Inoculación de los medios de cultivo En microbiología se entiende por "siembra" la operación que consiste en depositar un germen asépticamente en un medio de cultivo. Toda siembra debe adaptarse a los siguientes principios generales: 1 . Practicarla en medios de cultivo favorables y previamente esterilizados. 2. Emplear instrumentos asépticos. 3. No contaminar ni destruir el inóculo, 4. Depositarla asépticamente en los medios elegidos. 5. Esterilizar los instrumentos empleados antes y después de cada operación. Los medios de cultivo, como ya se ha dicho, pueden ser sólidos, semisólidos o líquidos, y estar contenidos en tubos, placas o frascos. La técnica general de las siembras variará según el estado físico del material a sembrar y del medio de cultivo. Métodos de cultivo de uso rutinario Al inocular debe trabajarse siempre dentro del radio de un mechero Bunsen (30 cm.), o, en el ambiente dentro de una campana de flujo laminar, ya que, la corriente ascendente de aire que va por la llama, o la corriente de aire del flujo laminar arrastra el polvo y otras partículas con el aire hacia arriba, o hacia afuera; impidiendo la contaminación del medio de cultivo. El asa o pipeta pasteur deben ser flameadas adecuadamente y enfriadas antes de tocar el inóculo, o el medio de cultivo. 1. Siembra en placas 2. Siembra en tubos de agar tendido 3. Siembra por picadura 4. Siembra en superficie y picadura 5. Siembra en profundidad 6. INCUBACION: Los medios de cultivo pueden ser: inoculados en estufa a 35°C en aerobiosis, anaerobiosis o en atmósfera de C02. Para aerobiosis se incuban las placas y tubos en estufa de cultivo a 35°C. Para anaerobiosis se colocan las placas y tubos dentro de una jarra Anaerobia y luego ésta se coloca en estufa de cultivo a 35°C. con un sobre productor de atmósfera anaerobia. Para incubar en atmósfera de C02 se colocan las placas y tubos dentro de la Jarra de C02 y ésta se coloca en la estufa de cultivo a 35°C con un sobre productor de atmósfera microaerófila. 2. FLUJOGRAM AS Preparación de medios de cultivo Medios de cultivo sólidos 1. verificar materiales 2. leer etiqueta 3. pesar la cantidad 4. medir agua 5. adicionar la mitad 6. agitar 7. adicionar la otra mitad 8. terminar la disolución 9. homogenizar a calor 10. agitar esterilizar enfriar verter en cajas de petri Hasta disolver solidificar prueba de esterilidad refrigerar Medios de cultivo líquidos seguir los pasos del 1-8 del 2.1.1 servir en tubos esterilizar enfriar refrigerar Medios de cultivo semisólido seguir los pasos del 1-8 del 2.1.1 verter en tubos esterilizar enfriar solidificar refrigerar 3 ml de caldo Métodos de siembra de microorganismos Inoculación de un caldo a otro 1. rotular los tubos 2. encender el mechero 3. flamear asa 4. tomar un inoculo de cepa 5. introducirla en el caldo 6. flamear la boca del tubo 7. flamear el asa 8. incubar Siembra de medio sólido a líquido, semisólido e inclinado rotular los tubos encender el mechero flamear asa enfriar tomar una colonia introducirla en el tubo girar 180º en caso de Semisólido Inclinados realizar picadura realizar por método de estrías. Seguir con pasos 6-8 del 2.2.1 Siembra de medio líquido a sólido 1. Siembra masiva o método clásico 1. rotular los tubos 2. encender el mechero 3. flamear asa 4. extraer un inoculo 5. colocarlo en extremos de la caja 6. extender la muestra 7. flamear el asa 8. incubar En zigzag 2. Siembra por agotamiento o método francés seguir los pasos del 1-5 del 2.2.3.1 extender la muestra flamear el asa y enfriarlo hacer 4 o 5 estrías incubar 3. CÁLCULOS Para la preparación del SIM el frasco pone una concentración 30g/1000ml, como nos pidieron preparar 50ml, entonces: 30g x 1000ml 50ml x = 1.5g de SIM que se utilizó para preparar el medio. Para la preparación del LIA el frasco pone una concentración 32g/1000ml, como nos pidieron preparar 40ml, entonces: 32g x 1000ml 40ml x = 1.28g de LIA que se utilizó para preparar el medio. Para la preparación del ASM el frasco pone una concentración 111g/1000ml, como nos pidieron preparar 100ml, entonces: 111g x 1000ml 100ml x = 11.1g de ASM que se utilizó para preparar el medio. Para la preparación del caldo nutritivo el frasco pone una concentración 8g/1000ml, como nos pidieron preparar 30ml, entonces: 8g x 1000ml 30ml x = 0.24g de ASM que se utilizó para preparar el medio. 4. RESULTADOS 4.1 Preparación de medios de cultivo Se observó la perfecta gelificación de las placas y tubos sin la formación de grumos, burbujas o fisuras en el gel. 4.2 Métodos de siembra de microorganismos 4.2.1 Desarrollo de un medio de cultivo líquido Utilizando el medio de cultivo SIM y por medio de la siembra del Bacillus subtillis, después de las 24h presentaron las siguientes características: Para los tubo 1y 2. se vió una coloración amarillo claro con un precipitado de color blanco en el fondo, además se notó un poco espeso. Con la misma siembra y con la bacteria Proteus sp, después de las 24h las características vistas fueron: Para los tubos 3 y 4. Presentó turbidez, con una coloración amarilla y un precipitado en el fondo de color blanco. Después de las 48h todas las muestras presentaron un precipitado en la parte inferior del tubo.(ver anexo 1) 4.2.2 Desarrollo de un medio de cultivo semisólido Utilizando el medio de cultivo SIM y por medio de la siembra del S. faecium las características que presentaron a las 24h son: Para el tubo 1. coloración amarillo claro, con turbidez y con una capa superficial blanca. Para el tubo 2 y 3. coloración amarillo claro, formación de un pequeño precipitado blanco en la parte inferior y de una capa superficial blanca, y presencia de unas gotas gelatinosas adheridas en las paredes del tubo. Para el tubo 4. coloración amarillo claro, presencia de una capa superficial de color blanco, un anillo por debajo de la mitad, de un color amarillo opaco, con una mayor turbidez en esta parte. Después de las 48h, los cambios que presentaron algunos tubos son: Para el tubo 1. hubo cambio de color de amarillo a verde con negro, en la parte superior se vió una capa superficial, hubo formación de precipitado. Para el tubo 4. la parte inferior se encontró más blanca, en esta hay una pequeña nata. Después de 5 días, los cambios que se vieron son: Para el tubo 3. color amarillo, formación de anillo en la parte inferior, con precipitado blanco.(ver anexo2) 4.2.3 Desarrollo de un medio de cultivo inclinado Utilizando el medio de cultivo LIA y por medio de la siembra del S. faecium las características que presentaron a las 24h son: Para los tubos 1 y 2. Presencia de dos fases: en la parte inferior presentó un color amarillo transparente, mientras que en la superior un morado transparente. En la parte superior presenta una capa superficial, en las paredes del tubo hay como especie de humedad. Para los tubos 3 y 4. tiene una coloración miel, formación de capa superficial y presencia de humedad. Para el 4 tenia un color más fuerte y menos humedad. Después de las 48h presentaron los siguientes cambios: Para los tubos 3 y 4. hubo cambio de color, se vieron de color naranja fuerte, hay un precipitado donde empieza la inclinación, los otros tubos no presentaron cambio. Después de 5 días se observaron otros cambios: Para los tubos 1 y 2 color púrpura totalmente. Para los tubos 3 y 4 color naranja totalmente. (ver anexo 3) 4.2.4 Desarrollo de un medio de cultivo sólido Utilizando el medio de cultivo EMB y ASM, y por medio de la siembra del Bacillus subtillis las características que presentaron a las 24h son: Para la caja 1. con EMB, Bacillus subtillis y el método de estrías, algunas colonias están de color morado y rosado. Para la caja 2. con ASM, Bacillus subtillis y método francés, no hubo ningún cambio. Para la caja 3. con EMB, Bacillus subtillis y método de estrías las colonias tornaron de color rosado. Para la caja 4. con ASM, Proteus sp y método francés las colonias se vieron amarillas. Para la caja 5. con EMB, Proteus sp y método de estrías las colonias se vieron rosadas. Para la caja 6. con EMB y Bacillus subtillis y método francés color rosado. Para la caja 7 y 8 . con ASM, Bacillus subtillis no hubo cambio alguno. Después de 5 días los cambios dados fueron los siguientes: Para la caja 1 y 3. colonia morada-azul. Para la caja 2 colonias blancas-amarillas. Para la caja 4: colonias blancas-amarillas. Para la caja 5: colonias morada-rosada-azul. Para la caja 6: colonia azul-moradas-rosadas. Para la caja 7 y 8: colonia blancas amarillas.(ver anexo 4) 5 ANÁLISIS DE RESULTADOS 5.1 Preparación de medios de cultivo Se realizó el procedimiento de acuerdo como lo indicó la guía de laboratorio, lo cual arrojó resultados positivos ya que no se presentó el crecimiento de ningún tipo de microorganismos, lo cual nos dió a entender que los medios estaban completamente estériles. 5.2 Métodos de siembra de microorganismos 5.2.1 Desarrollo de un medio de cultivo líquido Para este tipo de siembra los resultados fueron satisfactorios ya que se observó un crecimiento con base a la cantidad de desarrollo moderado; se dió la formación de turbidez, de películas membranosas y formación de floculos, anillos y sedimentos. 5.2.2 Desarrollo de un medio de cultivo semisólido Hubo movilidad a lo largo de la línea de inoculación, lo cual nos indica que hubo crecimiento bacteriano. 5.2.3 Desarrollo de un medio de cultivo inclinado Se da un crecimiento bacteriano lo cual se puedo percibir a través del cambio de color del medio. El desarrollo del medio de cultivo se dió en forma de rizoide. 5.2.4 Desarrollo de un medio de cultivo sólido Hubo formación de spreaders, es decir colonias esparcidas incontables las cuales se debieron a la mucha presencia de humedad o, a demasiada cepa bacteriana. El desarrollo de las colonias en las cajas petri se dió de forma puntiforme, según la elevación eran convexas. 6 PREGUNTAS COMPLEMENTARIAS 6.1 Fundamento de las cepas de microorganismos sembradas y de los medios de cultivo preparados El Proteus Son bacilos Gram negativos, móviles, aerobios, anaerobios facultativos, con catalasa positiva, fermentadores positivos, producen gases, hidrólisis de la urea en ocasiones, son oxidasas negativos y ureasas positivos, licuan la gelatina, son sulfhídricos positivos excepto el morgagnii. Bacillus subtilis El Bacillus subtilis , una bacteria inofensiva gram-positiva, que es capaz de producir los endosporas resistentes a las condiciones ambientales adversas tales como calor y desecación, y se utiliza extensamente para la producción de enzimas y de productos químicos de la especialidad. Medio de cultivo SIM Medio de cultivo de ensayo, para comprobar la formación del sulfuro, la producción de indol y la motilidad en el marco del diagnostico del Enterobacteriaseas. La motilidad se pone de manifiesto por la turbidez difusa del medio de cultivo alrededor del canal de la picadura. La no motilidad se caracteriza por el crecimiento producido exclusivamente a lo largo de dicho canal. La producción de H2S se reconoce por el ennegrecimiento de la zona de crecimiento. Agar Lisina Hierro Agar de ensayo para la demostración simultanea de lisina-descarbioxilasa(L-D) y de la producción de ácido sulfhídrico(H2S) para la identificación de Enterobacteriaseas, sobre todo de salmonella y arizona. Los microorganismos L-D negativos, pero fermentadores de la glucosa producen un viraje amarillo de la totalidad del medio de cultivo. La incubación prolongada puede ocasionar una alcalinización en la zona de la superficie del medio de cultivo y, en consecuencia se produce un viraje al violeta. La producción de H2S da coloración negra debida al sulfuro de hierro que se forma. La cepa del grupo Proteus providencia, con excepción de algunas cepas de Proteus morganii, desaniman a la lisina a ácido alfa cetocarbonico. Este último, con la sal de hierro y con la influencia del oxígeno forma combinaciones pardo rojizas en la región superficial del medio de cultivo. CALDO NUTRITIVO Se basa en contar el número de colonias desarrolladas en una placa de medio de cultivo sólido, donde se ha sembrado un volumen conocido de agua, transcurrido un tiempo y a una temperatura de incubación determinados. Transcurridas las 72 h (± 3 h) o las 48 h, según proceda en cada caso, contar todas las colonias desarrolladas en cada placa. Si se ha sembrado más de una dilución se seleccionará la que contenga entre 30 y 300 colonias, descartando las demás. El recuento no se efectuará en placas que contengan menos de 30 colonias, excepto en aquellas sembradas con agua sin diluir. El resultado se expresa como número de bacterias aerobias totales en 1ml en 72 h a 22°C o en 48 h a 37°C AGAR SALADO DE MANITOL Es un medio selectivo y diferencial. AMS es selectivo porque contiene 7.5% de sal. Una alta concentración de sal promueve el crecimiento de algunos organismos mientras inhibe el crecimiento de otros. AMS es un medio diferencial porque contiene el azúcar manitol y el indicador de pH rojo de fenol. Los organismos que pueden fermentar el manitol liberan subproductos ácidos, que causan un cambio de color. El rojo de fenol presenta un color rojo cereza por arriba de pH 8.5, un color amarillo rojizo desde un pH 6.9 a 8.5, y un amarillo brillante por debajo de un pH de 6.9. Aunque tanto el Staphylococcus epidermidis y Staphylococcus aureus puede tolerar el alto contenido de sal en el AMS, solamente S. aureus puede fermentar el manitol, causando que el rojo de fenol vire al amarillo. 6.2 Cuál de los métodos de siembra en caja de petri, considera el mejor y porque? Se considera como el mejor de los métodos al método francés o siembra por agotamiento, ya que esto nos permite observar el crecimiento de los microorganismos en colonia y también de forma aislada debido a la distribución que se hace de los mismos al momento de realizar la siembra en el medio sólido. CONCLUSIÓN A partir del anterior laboratorio y a través de la bibliografía citada podemos concluir los siguientes puntos: La utilización de medios de cultivos es de gran importancia en la industria de alimentos, nos permite conocer las condiciones en las cuales se desarrolla los microorganismos tales como bacterias, hongos, algas, levaduras, etc. La esterilidad es uno de los requisitos necesarios que deben cumplir los medios de cultivos para que se de el crecimiento adecuado de las bacterias. Para que las bacterias crezcan adecuadamente en un medio de cultivo artificial debe reunir una serie de condiciones como son: temperatura, grado de humedad y presión de oxígeno adecuadas, así como un grado correcto de acidez o alcalinidad. Un medio de cultivo debe contener los nutrientes y factores de crecimiento necesarios y debe estar exento de todo microorganismo contaminante En los diferentes medios de cultivo se encuentran numerosos materiales de enriquecimiento como hidratos de carbono, suero, sangre completa, bilis, etc. Los hidratos de Carbono se adicionan por dos motivos fundamentales: para incrementar el valor nutritivo del medio y para detectar reacciones de fermentación de los microorganismos que ayuden a identificarlos. El suero y la sangre completa se añaden para promover el crecimiento de los microorganismos menos resistentes. BIBLIOGRAFÍA http://html.rincondelvago.com/microbiologia_15.html http://www.geocities.com/lorigardeweg/page14.html http://www.danival.org/notasmicro/medioscult/_madre_medios.html http://edicion-micro.usal.es/web/educativo/micro2/tema06.html Manual De Microbiologia. Ed Merck