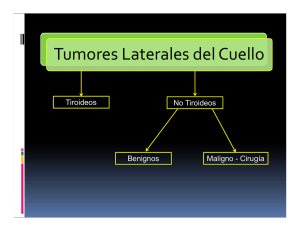
Radiología de cabeza y cuello
Anuncio

ACTUALIZACIONES SERAM Radiología de cabeza y cuello Radiología de cabeza y cuello Coordinadores: Radiología de cabeza y cuello (2012) Manuel de Juan Delago y Javier Azpeitia Armán 0-0 Portada OK 2012.indd 1 165 % 160 140 120 2 100 2 80 60 40 20 0 –11 1.938 8.000 16.000 24.000 32.000 35.892 26/4/12 18:30:33 ACTUALIZACIONES SERAM Radiología de cabeza y cuello 0-3 Capt 43.pag.indd 1 26/4/12 18:31:32 © 2012 Sociedad Española de Radiología Médica © 2012 Elsevier España, S.L. Reservados todos los derechos. El contenido de esta publicación no puede ser reproducido, ni transmitido por ningún procedimiento electrónico o mecánico, incluyendo fotocopia o grabación magnética, ni registrado por ningún medio, sin la previa autorización por escrito del titular de los derechos de explotación. Elsevier y sus asociados no asumen responsabilidad alguna por cualquier lesión y/o daño sufridos por personas o bienes en cuestiones de responsabilidad de productos, negligencia o cualquier otra, ni por uso o aplicación de métodos, productos, instrucciones o ideas contenidos en el presente material. Dados los rápidos avances que se producen en las ciencias médicas, en particular, debe realizarse una verificación independiente de los diagnósticos y las posologías de los fármacos. Depósito legal: B-39457-2011 ISBN: 978-84-7592-747-3 Impreso en España 0-3 Capt 43.pag.indd 2 26/4/12 18:31:32 ACTUALIZACIONES SERAM Radiología de cabeza y cuello Coordinadores: Manuel de Juan Delago y Javier Azpeitia Armán 0-3 Capt 43.pag.indd 3 26/4/12 18:31:33 0-3 Capt 43.pag.indd 4 26/4/12 18:31:33 Radiología de cabeza y cuello Índice de autores J. Berenguer González J. Martínez San Millán Sección Neurorradiología, Hospital Clínic, Barcelona, España Servicio de Radiodiagnóstico, Sección de Neurorradiología, Hospital Universitario Ramón y Cajal, Madrid, España Departamento de Especialidades Médicas, Universidad de Alcalá de Henares, Madrid, España M. de Juan Delago Unidad de Neurorradiología, Servicio de Radiodiagnóstico, Hospital de la Santa Creu i Sant Pau, Universidad Autónoma de Barcelona, Barcelona, España J.L. del Cura Rodríguez M. Moreno Caballero Servicio de Medicina Nuclear, Hospital Virgen de las Nieves, Granada, España Hospital de Basurto, Bilbao, España M.A. Muros de Fuentes I. Delgado Álvarez Servicio de Medicina Nuclear, Hospital Virgen de las Nieves, Granada, España Departamento de Radiología Pediátrica, Hospital Materno-Infantil Vall d’Hebron, Barcelona, España T. Pujol Farré C. Ferreiro Argüelles Servicio de Radiodiagnóstico, Hospital Universitario Severo Ochoa, Leganés, Madrid, España L. Frascheri Verzelli Unitat de Ressonáncia Magnètica (IDI), Servei de Radiologia, Hospital Universitari Vall d´Hebron, Barcelona, España E. Granell Moreno Unidad de Neurorradiología, Servicio de Radiodiagnóstico, Hospital de la Santa Creu i Sant Pau, Universidad Autónoma de Barcelona, Barcelona, España A. Hilario Barrio Servicio de Radiodiagnóstico, Sección de Neurorradiología, Hospital Universitario 12 de Octubre, Madrid, España J. Martínez Salazar Servicio de Otorrinolaringología, Hospital del Sureste, Arganda, Madrid, España 0-3 Capt 43.pag.indd 5 Sección Neurorradiología, Hospital Clínic, Barcelona, España M.J. Ramos Gómez Sección de Neurorradiología Diagnóstica y Terapéutica, Unidad de Gestión Clínica de Radiodiagnóstico, Hospital Universitario Reina Sofía, Córdoba, España A. Ramos González Servicio de Radiodiagnóstico, Sección de Neurorradiología, Hospital Universitario 12 de Octubre, Madrid, España Departamento de Radiología y Medicina Física, Universidad Complutense, Madrid, España A.J. Revert Ventura Servicio de Radiología, Hospital de Manises, Valencia, España E. Roldán Romero Sección de Neurorradiología Diagnóstica y Terapéutica, Unidad de Gestión Clínica de Radiodiagnóstico, Hospital Universitario Reina Sofía, Córdoba, España 26/4/12 18:31:33 Radiología de cabeza y cuello A. Rovira Cañellas E. Vázquez Méndez Unitat de Ressonància Magnètica (IDI), Servei de Radiologia, Hospital Universitari Vall d´Hebron, Barcelona, España Departamento de Radiología Pediátrica, Hospital Materno-Infantil Vall d’Hebron, Barcelona, España F. Salamé Gamarra R. Zabala Landa Servicio de Radiología, Hospital de Manises, Valencia, España Hospital de Basurto, Bilbao, España S. Siurana Montilva Unitat de Ressonància Magnètica (IDI), Servei de Radiologia, Hospital Universitari Vall d´Hebron, Barcelona, España 0-3 Capt 43.pag.indd 6 26/4/12 18:31:33 Radiología de cabeza y cuello Prólogo La región de la cabeza y cuello tiene una gran complejidad anatómica y funcional. Alguna de sus áreas, como la región facial, los peñascos y la base del cráneo, han sido estudiadas por los neurorradiólogos en muchos servicios de radiología; en cambio, el cuello ha sido un territorio frontera un poco abandonado. Hasta la aparición y desarrollo de los ultrasonidos, la tomografía computarizada (TC) y la resonancia magnética (RM) no se disponía de técnicas de estudio que permitiesen valorar la anatomía y la patología submucosa del cuello. El cuello, además de su compleja anatomía, es asiento de una patología muy extensa que va desde las malformaciones hasta procesos inflamatorios/infecciosos, tumores, lesiones vasculares, etc. El Comité Científico de este Congreso nos ha encargado organizar un curso precongreso y la monografía que lo acompaña, en el que se tratará en profundidad y de forma única la patología del cuello, sin incluir ninguna otra zona de la región de la cabeza y cuello. En las 12 charlas y sus correspondientes capítulos se repasa la anatomía, las malformaciones congénitas, los procesos infecciosos, la patología tumoral de las distintas estructuras, los cambios postratamiento, la patología de la glándula tiroides y las anomalías vasculares. Se presentan en profundidad las diversas técnicas actuales de las que disponemos, incluyendo TC, secuencias avanzadas de RM y PET-TC, para la valoración de los tumores malignos. En distintos capítulos y desde diversos puntos de vista se trata el tema de los tumores malignos, cuyo principal exponente es el carcinoma escamoso. Revisando los datos de 2008 de la International Agency for Research on Cancer (página web Globocan) para España se comprueba que en los varones la incidencia de los distintos tumores es: próstata (21,1%), pulmón (16,8%), colorrectal (13,9%) y cuello 0-3 Capt 43.pag.indd 7 (7,5%). En el porcentaje de tumores de cuello se incluyen los tumores de orofaringe y boca, cavum, faringe y laringe. Este hecho pone de manifiesto que hay una parte muy importante de trabajo radiológico en el diagnóstico y seguimiento de estos pacientes y que, por tanto, nuestra labor es esencial en los equipos multidisciplinares que están dedicados al diagnóstico y tratamiento de estos pacientes. Las nuevas técnicas radiológicas, como los avances en la TC y las nuevas secuencias de RM, que van apareciendo permiten que dispongamos de herramientas de trabajo cada vez más precisas para definir la extensión de los tumores y su respuesta a los distintos métodos de tratamiento. Se pretende actualizar estos temas y esperamos que al finalizar el curso se tenga una idea clara de la utilidad práctica de las distintas técnicas, cuándo utilizarlas y qué podemos esperar de ellas. Es importante que sepamos que nuestro papel es muy importante para el diagnóstico y seguimiento de los pacientes con lesiones en esta región, sobre todo en la patología tumoral, y que debemos integrarnos en los equipos multidisciplinarios de tratamiento. Para desarrollar el curso hemos contado con un amplio grupo de compañeros que, de forma desinteresada, han elaborado unos capítulos sobre temas específicos de los que tienen gran experiencia, como demuestran en su trabajo diario, publicaciones y conferencias. Queremos dar las gracias al Comité Científico del Congreso de la SERAM por la oportunidad de organizar el curso. Por supuesto, y creo que en nombre de todos los miembros de la SERAM, dar las gracias a todos los radiólogos, que con su esfuerzo han conseguido que el curso y esta, pienso que magnífica, monografía sean una realidad. M. de Juan Delago y J. Azpeitia Armán 2/5/12 16:34:15 0-3 Capt 43.pag.indd 8 26/4/12 18:31:33 Radiología de cabeza y cuello Sumario Capítulo 1. Anatomía simplificada del cuello .................... 1 Capítulo 2. Lesiones quísticas del cuello en pediatría .................... 12 Capítulo 3. Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas .................... 21 J. Berenguer González y T. Pujol Farré Capítulo 4. Tumores malignos de la naso-orofaringe y de la cavidad oral .................... 44 A. Rovira Cañellas y S. Siurana Montilva Capítulo 5. Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe .................... 59 A.J. Revert Ventura y F. Salamé Gamarra Capítulo 6. Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello .................... 75 M.A. Muros de Fuentes y M. Moreno Caballero Capítulo 7. Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética .................... 85 M.J. Ramos Gómez y E. Roldán Romero Capítulo 8. El cuello tratado. Claves para el seguimiento radiológico .................... 97 C. Ferreiro Argüelles y J. Martínez Salazar 0-3 Capt 43.pag.indd 9 E. Granell Moreno y M. de Juan Delago E. Vázquez Méndez e I. Delgado Álvarez 26/4/12 18:31:33 Radiología de cabeza y cuello Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello S. Siurana Montilva y L. Frascheri Verzelli Capítulo 10. Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo R. Zabala Landa y J.L. del Cura Rodríguez Capítulo 11. Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A. Ramos González, J. Martínez San Millán y A. Hilario Barrio Capítulo 9. Capítulo 12. Patología vascular de cabeza y M. de Juan Delago y E. Granell Moreno 0-3 Capt 43.pag.indd 10 cuello .................... 110 .................... 128 .................... 138 .................... 156 26/4/12 18:31:33 Radiología de cabeza y cuello 1 Anatomía simplificada del cuello E. Granell Moreno* y M. de Juan Delago Unidad de Neurorradiología, Servicio de Radiodiagnóstico, Hospital de la Santa Creu i Sant Pau, Universidad Autónoma de Barcelona, Barcelona, España El cuello suprahioideo El cuello suprahioideo comprende desde la base del cráneo hasta el hioides, incluyendo toda la porción extracraneal a excepción de las órbitas, la cavidad oral y los senos paranasales. La clasificación tradicional del cuello suprahioideo lo subdivide en 3: nasofaringe, orofaringe e hipofaringe1 (fig. 1). La nasofaringe se extiende desde la base del cráneo hasta el inicio del paladar blando. Por debajo, hasta el borde superior del hioides, continúa con la orofaringe, que incluye el borde libre de la epiglotis. Inferiormente desde el borde superior del hioides hasta el borde inferior del cricoides se extiende la hipofaringe. Esta clasificación es muy útil para la estadificación de los carcinomas escamosos de vía aérea y digestiva superior, pero resulta insuficiente para localizar otro tipo de tumores y lesiones inflamatorias. A partir del desarrollo de las técnicas de imagen de tomografía computarizada (TC) y resonancia magnética (RM), se establecieron nuevas clasificaciones basadas en cortes axiales en las que se definen los diferentes compartimientos delimitados por las 3 capas de la fascia cervical profunda2-6. Éstas son la capa superficial (o fascia de recubriento), la capa media (o fascia bucofaríngea) y la capa profunda (o fascia perivertebral). Estas fascias se insertan en la base del cráneo delimitando diferentes espacios funcionales que convergen hacia el hioides, por esto el hioides es el límite entre el cuello suprahioideo y el infrahioideo. El interés en la subdivisión de estos espacios radica principalmente en que permite un análisis sistemático por la imagen (TC o RM), buscando las posibles vías de extensión de diferentes procesos patológicos a través de la base del cráneo. En el caso de los tumores, la vía de extensión profunda más frecuente es la que supone menor resistencia a la infiltración, y permite la identificación del espacio en el cual se origina la masa profunda. Todo esto aporta datos diagnósticos sobre la posible naturaleza de la lesión. La subdivisión de la fascia cervical profunda en 3 capas (superficial, media y profunda) delimita los siguientes espacios profundos del cuello suprahioideo (tabla 1): Figura 1. Subdivisión clásica del cuello suprahioideo en nasofaringe, orofaringe e hipofaringe, limitadas entre sí por los planos que pasan por el paladar blando y el borde superior del hioides. – Espacio mucoso faríngeo. Se localiza medial al espacio parafaríngeo y se delimita por la capa media de la fascia cervical profunda. Contiene el tejido linfoide del anillo de Waldeyer, glándulas salivares menores, fascia faringobasilar, músculo constrictor medio de la faringe, músculo elevador del velo del paladar y torus tubárico (cartilaginoso). La fascia faringobasilar delimita el espacio mucoso faríngeo, el cual se relaciona con el agujero rasgado. Es en este nivel donde hay una pequeña área de contacto entre los espacios mucoso y preestiloideo (fig. 2). – Espacio parafaríngeo (o espacio parafaríngeo preestiloideo en la literatura anatómica). Es un área de tejido graso y localización central en la fascia cervical profunda, que incluye ramificaciones de la tercera rama del trigémino (V3), las arterias maxilar y faríngea ascendente, el plexo venoso faríngeo y glándulas salivares accesorias. En relación con el espacio parafaríngeo preestiloideo es importante remarcar que la fascia del músculo pterigoideo medial y el tensor del velo del paladar tienen una *Autor para correspondencia. Correo electrónico: [email protected] (E. Granell Moreno). 0-3 Capt 43.pag.indd 1 26/4/12 18:31:33 Radiología de cabeza y cuello 2 Tabla 1 − Lista de las estructuras más importantes en relación con los espacios profundos y sus áreas de contacto con la base del cráneo Espacio Nervios Otras estructuras Mucoso faríngeo – Tejido linfoide del anillo de Waldeyer Glándulas salivares menores Fascia faringobasilar Músculo constrictor medio de la faringe Músculo elevador del velo del paladar Torus tubárico (cartilaginoso) Parafaríngeo preestiloidelo o tonsilar Ramas del V3 Arteria maxilar y faríngea ascendente Plexo venoso faríngeo Glándulas salivares accesorias Parafaríngeo retroestiloideo o carotídeo Pares craneales IX, X, XI, plexo simpático cervical Arteria carótida interna Vena yugular interna Ganglios linfáticos Parotídeo VII Glándula parótida Ganglios intraglandulares Arterias carótida externa y maxilar interna Vena retromandibular Masticador Nervio mandibular y alveolar inferior (ramas de V3) Plexo venoso Músculos pterigoideos medial y lateral, masetero y temporal Vena y arteria alveolar inferior Retrofaríngeo – Perivertebral Elementos del plexo braquial, nervio frénico Ganglios linfáticos Arteria y vena vertebral Cuerpos vertebrales Músculos prevertebrales y escaleno Cordón medular Nótese que el espacio perivertebral y carotídeo se extienden a través del cuello supra e infrahioideo. Estrictamente hablando, la mayoría de los espacios profundos, excepto el espacio mucoso faríngeo, pueden ser considerados como espacios parafaríngeos. inserción común en el borde medial del foramen oval6. Este espacio puede ser asiento de tumores de glándulas salivares accesorias y cuando es invadido por otras lesiones, éstas tienen una vía de acceso libre hacia los espacios submandibular y sublingual, ya que éstos se comunican entre sí7,8 (fig. 3). – Espacio carotídeo (o espacio parafaríngeo retroestiloideo en la literatura anatómica). Las 3 capas de la fascia cervical profunda contribuyen a la formación de la vaina que circunscribe este espacio, que se extiende desde la base del cráneo hasta el arco aórtico. Su porción suprahioidea contiene la arteria carótida interna, la vena yugular interna, ganglios linfáticos, los pares craneales del IX, X y XI y el plexo simpático cervical. – Espacio parotídeo. Localizado lateralmente al espacio parafaríngeo y delimitado por la capa superficial de la fascia cervical profunda. En muchas ocasiones comunica libremente con el espacio parafaríngeo preestiloideo por ausencia de fascia entre ambos espacios. Contiene 0-3 Capt 43.pag.indd 2 la glándula parótida, la porción intraparotídea del nervio facial, ganglios intraglandulares, arterias carótida externa y maxilar interna, y vena retromandibular. Una lesión maligna puede tener diseminación perineural hacia el hueso temporal a través del nervio facial. – Espacio masticador. Situado anteriormente al espacio parafaríngeo, está rodeado por la fascia cervical profunda, que se divide en 2 capas a este nivel. Se encuentra en la fosa infratemporal y contiene los músculos de la masticación (masetero, temporal, pterigoideo medial y lateral), la rama vertical y cuerpo de la mandíbula, los nervios mandibular y alveolar inferior (ramas de la tercera rama del nervio trigémino) y la vena y arteria alveolar inferior. Una lesión maligna puede diseminar por vía perineural a través de la división mandibular del trigémino hacia la fosa craneal media9 (fig. 4). En la porción medial del espacio masticador encontramos la fosa pterigopalatina que contiene la segunda rama del nervio trigémino (V2), el ganglio esfenopa- 26/4/12 18:31:33 Anatomía simplificada del cuello Figura 2. Proyección del área de contacto de los espacios profundos del cuello suprahioideo sobre la base del cráneo. La línea negra representa la inserción de la fascia faringobasilar, que delimita el espacio mucoso faríngeo, el cual se relaciona con el agujero rasgado anterior (RA). A este nivel hay una pequeña área de contacto entre los espacios mucoso y parafaríngeo preestiloideo (marcado en color negro). En color blanco se representa el espacio masticador, en gris oscuro el espacio carotídeo o parafaríngeo retroestiloideo y en gris claro el espacio parotídeo. Obsérvese que en el espacio masticador se encuentran el agujero redondo (AR), donde pasa la segunda rama del trigémino (V2), y el foramen oval (FO), donde pasa la tercera rama del trigémino (V3). En el espacio carotídeo se encuentra el agujero rasgado posterior, donde salen los pares craneales IX, X y XI. Se enfatiza el paso de los pares craneales en dichos espacios, dada la importancia de la detección de una posible infiltración de un compartimiento intracraneal a través de los agujeros de la base del cráneo en la estadificación de tumores de esta región. latino y la porción distal de la arteria maxilar interna. La fosa pterigopalatina se limita anteriormente por la pared posterior del seno maxilar, medialmente por la lámina vertical del hueso palatino y posteriormente por el platillo lateral de la apófisis pterigoides (fig. 5). Además de comunicar abiertamente con el espacio masticador, tiene comunicación libre hacia la órbita (a través de la fisura orbitaria inferior), la fosa nasal (por el foramen esfeno-palatino), el endocráneo (por los agujeros redondo y vidiano) y la cavidad oral (a través del canal palatino mayor). – Espacio retrofaríngeo. Se sitúa en la línea media posterior, delimitado por delante por la capa media de la fascia cervical profunda, y por detrás y a los lados por la capa profunda de la fascia cervical profunda. Se extiende desde la base del cráneo hasta el cuerpo de D3. – Espacio perivertebral. En gran parte de la literatura radiológica de consulta, el espacio perivertebral se denomina espacio prevertebral. Se ha cambiado el nombre debido a 0-3 Capt 43.pag.indd 3 3 Figura 3. Corte coronal de tomografía computarizada a la altura del foramen oval, marcado con un círculo negro. Se han coloreado los espacios masticador en color gris rayado horizontal, el parafaríngeo preestiloideo en gris oscuro, el parotídeo en gris claro y el submandibular en gris punteado. Se ha representado con una línea blanca continua la inserción común de los músculos pterigoideo medial y el tensor del velo del paladar en el borde medial del foramen oval. La comunicación entre los espacios parafaríngeo preestiloideo y el submandibular se ha marcado con una línea discontinua en color blanco. Figura 4. Diseminación perineural de un carcinoma de nasofaringe a través de la división mandibular del trigémino hacia la fosa craneal media, con infiltración del foramen oval, cavum de Meckel y seno cavernoso derechos. 26/4/12 18:31:34 Radiología de cabeza y cuello 4 Figura 5. La fosa pterigopalatina (marcada con recuadro gris) es una vía de paso importante entre la fosa nasal, la nasofaringe y los espacios profundos (flechas blancas y negras). Imagen superior izquierda: corte en plano coronal de tomografía computarizada (TC) donde se muestra su comunicación con la órbita (fisura orbitaria inferior). Imagen superior derecha: corte en plano sagital de TC donde se muestra la comunicación con la órbita y la cavidad oral (canal palatino mayor). Imagen inferior izquierda: corte en plano axial de TC donde se muestra la comunicación con la fosa nasal (foramen esfenopalatino) y la fosa infratemporal (espacio masticador). Imagen inferior derecha: reconstrucción craneal en 3D donde se muestra la relación con el interior del cráneo a través del agujero redondo. que el espacio por detrás de la capa profunda de la fascia cervical profunda sólo es verdaderamente prevertebral en su parte anterior. Queda definido propiamente por la capa profunda de la fascia cervical profunda, que recubre la musculatura prevertebral y paravertebral posterior, y se inserta en las apófisis transversas de las vértebras. Contiene elementos del plexo braquial, el nervio frénico, la musculatura pre y paravertebral, los cuerpos vertebrales, las arterias y venas vertebrales, y el cordón medular10. Cuello infrahoideo De forma clásica, la anatomía del cuello infrahioideo se delimita según la formación de diferentes triángulos quirúrgicos y macroscópicos. Sin embargo, de la misma forma que el cuello suprahioideo, el abordaje basado en los espacios permite una mayor comprensión al aplicarlo a los estudios por imagen (tabla 2). Las principales fascias del cuello infrahioideo son la superficial y la profunda. La más importante es la profunda, que se divide en 3 capas: superficial (o de revestimiento), media (o visceral) y profunda (o perivertebral). 0-3 Capt 43.pag.indd 4 La capa superficial de la fascia cervical profunda se localiza por debajo de la piel y la fascia superficial, se extiende desde la base del cráneo hasta las clavículas y escápula, envuelve múltiples músculos y participa en la formación de la vaina del espacio carotídeo (parafaríngeo retroestiloideo). Por fuera de la capa superficial de la fascia cervical profunda queda el espacio superficial y contiene los músculos esternocleidomastoideo, platisma, omohioideo inferior, trapecio y la vena yugular externa. La capa media de la fascia cervical profunda se dispone por delante del hioides, envuelve la musculatura infrahioidea y se une con la capa superficial. Una porción se divide para formar el espacio visceral. Posteriormente se extiende desde la base del cráneo hasta el mediastino superior, formando la pared anterior del espacio retrofaríngeo y contribuyendo a formar la vaina del espacio carotídeo. Anteriormente, la capa profunda de la fascia cervical profunda se divide en 2 porciones. La más anterior forma la pared posterior y lateral del espacio retrofaríngeo y participa en la formación de la vaina del espacio carotídeo, extendiéndose desde la base del cráneo hasta el diafragma. La parte posterior se extiende desde la base del cráneo hasta el coxis. El espacio que está delimitado por la división anterior de la capa profunda es el espacio peligroso. Se localiza en la línea media, entre el espacio retrofaríngeo y el prevertebral. El espacio carotídeo está rodeado por una vaina, en la que participan las 3 capas de la fascia cervical profunda. Contiene la vena yugular, las carótidas común e interna y el nervio vago. El plexo simpático cervical y numerosos ganglios linfáticos están englobados en la pared medial de la vaina. El espacio perivertebral queda definido por la capa profunda de la fascia cervical profunda y envuelve la musculatura prevertebral y paravertebral posterior, y se inserta en las apófisis transversas. El espacio perivertebral contiene elementos del plexo braquial, el nervio frénico, los músculos prevertebrales, paravertebrales posteriores y escalenos, las arterias y venas vertebrales, los cuerpos vertebrales y el cordón medular. El espacio retrofaríngeo y el espacio peligroso se encuentran separados por fascia, pero radiológicamente la patología de la porción infrahioidea del cuello no permite diferenciarlos entre sí (fig. 6). Sí que es importante saber que el espacio peligroso tiene una relevancia clínica, dado que termina en el diafragma , por lo que representa una vía por la cual un proceso infeccioso puede continuar inferiormente hacia el mediastino posterior10. El espacio visceral se delimita por la capa media de la fascia cervical profunda. Contiene el tiroides, el paratiroides, la tráquea, el esófago, los ganglios paraesofágicos y los nervios laríngeos. El espacio cervical posterior se localiza en el triángulo posterior del cuello y se delimita entre las capas superficial y profunda de la fascia cervical profunda, posteriormente a la vaina del espacio carotídeo y anterolateralmente al espacio perivertebral. Contiene grasa, el nervio espinal accesorio, la cadena linfática cervical posterior y el plexo braquial preaxilar11. 26/4/12 18:31:34 Anatomía simplificada del cuello 5 Tabla 2 − Espacios y contenidos del cuello infrahioideo Espacio Nervios Otras estructuras Carotídeo Nervio vago (X par craneal) Plexo simpático cervical Arteria carótida común Vena yugular interna Ganglios cervicales profundos Retrofaríngeo Grasa – Perivertebral Región prevertebral: Raíces del plexo braquial Nervio frénico Región paravertebral posterior: – Región prevertebral: Músculos prevertebrales y escalenos Arteria y vena vertebral Cuerpo vertebral y pedículos Región paravertebral posterior: Músculos paravertebrales Elementos vertebrales posteriores Visceral Nervios laríngeos recurrentes Glándulas tiroides y paratiroides Laringe Hipofaringe Tráquea Esófago Ganglios paratraqueales Cervical posterior Grasa Ganglios espinales Nervio espinal accesorio (XI par craneal) Plexo braquial preaxilar De los 5 espacios, el visceral es el único específico del cuello infrahioideo. El resto atraviesa tanto el cuello supra como hioideo de forma vertical, por lo que los procesos patológicos tienden a extenderse en esta dirección. Figura 6. Tomografía computarizada del cuello poscontraste en paciente por control tras absceso retrofaríngeo en resolución, persistiendo signos de edema en el espacio retrofaríngeo (supra e infrahioideo) y carotídeo. A) Corte sagital, donde se marca el engrosamiento con aspecto edematoso de este espacio (flecha negra). B) Corte en plano coronal, donde se mantiene un pequeño plano graso entre el espacio retrofaríngeo y la vaina del espacio carotídeo. C y D) Cortes axiales, del mismo paciente, a la altura del borde libre de la epiglotis (imagen de la izquierda) y del cuerpo del hioides (imagen de la derecha). De los 5 espacios profundos (espacios visceral, carotídeo, cervical posterior, retrofaríngeo y perivertebral), el visceral es el único específico del cuello infrahioideo. El resto atraviesa tanto el cuello supra como infrahioideo de forma vertical, por lo que los procesos patológicos tienden a extenderse en esta dirección. 0-3 Capt 43.pag.indd 5 Laringe La laringe es un órgano de función protectora, respiratoria y fonatoria, situado en el espacio visceral por debajo del hueso hioides y de la base de la lengua (estructuras a las que está unida), por encima de la tráquea, por delante 26/4/12 18:31:34 6 Figura 7. Tomografía computarizada de laringe en plano sagital (A), coronal (B) y axiales en diferentes niveles (C, D y E). Se ha marcado la epiglotis en las imágenes A, B y C con cabezas de flecha, la úvula (u) en B, los repliegues glosoepiglótico medial y lateral (flechas negras) en C, el repliegue aritenoepiglótico (elipse) en D, el seno piriforme (flecha blanca) en B y D, y las cuerdas vocales (flecha cruzada). de la hipofaringe y por detrás de las aponeurosis y músculos subhioideos del cuello que se insertan en su esqueleto. Es una estructura móvil de la vía aérea superior delimitada entre los pliegues glosoepiglóticos y el margen inferior del cartílago cricoides. Externamente, la membrana fibroelástica que lo conforma está rodeada de partes duras que constituyen el aparato cartilaginoso tirohioideo. El armazón de la laringe está constituido por los cartílagos, que forman su esqueleto, y los músculos y ligamentos, que los unen entre sí y permiten su movimiento. El interior del tubo laríngeo presenta engrosamientos de parte fibroelástica, que determinan una serie de relieves característicos, siendo los más importantes: el ligamento tiroaritenoideo superior, que forma la banda ventricular, el ligamento tiroaritenoideo inferior, que forma la cuerda vocal, y el cono elástico que delimita la subglotis. Estos elementos son bilaterales, están recubiertos de una capa muscular, músculos tiroaritenoideo e interaritenoideo, y forman un anillo completo rodeando el tubo fibroelástico. Esta disposición de la musculatura intrínseca de la laringe permite la función fonatoria de la glotis. Los cartílagos laríngeos se osifican con la edad, aunque esta osificación es variable y en alguna ocasión puede llegar a ser asimétrica. A los 65 años, la osificación de la laringe está casi terminada, a veces incluso antes de esta edad, si bien la calcificación nunca es total y quedan áreas de 0-3 Capt 43.pag.indd 6 Radiología de cabeza y cuello cartílago no osificado. Cuando la osificación es completa facilita la interpretación de una posible infiltración tumoral para la estadificación del cáncer de laringe12,13. El cartílago epiglótico es el que representa la porción más superior de la laringe, tiene forma de pétalo, y está localizado por detrás de la lengua y del hioides. El borde superior de la epiglotis (porción suprahioidea) es libre. Su cara anterior está cubierta por mucosa que viene desde la lengua. En la línea media, esta mucosa se eleva para formar el pliegue glosoepiglótico medio y a cada lado de la epiglotis forma los pliegues glosoepiglóticos laterales, que pasan hacia la faringe. La depresión que se forma a cada lado del pliegue glosoepiglótico medio se denomina valécula. Desde cada lado de la epiglotis la mucosa se continúa hasta los aritenoides, formando el repliegue aritenoepiglótico (fig. 7). La porción inferior (infrahioidea) es fija y termina en el pie de la epiglotis que se inserta entre ambas láminas tiroideas, bajo la escotadura. El cartílago tiroides es el de mayor tamaño. Está formado por 2 láminas cuadradas que se unen en la línea media anterior, con una muesca en forma de V en su porción anterosuperior que constituye la escotadura tiroidea, y pequeñas elongaciones en los extremos superiores e inferiores de ambas láminas formando los cuernos superiores (donde se inserta el ligamento tirohioideo) e inferiores (que se articulan con el cricoides). El cricoides tiene forma de anillo de sello. Es el único cartílago que forma un anillo completo. Se compone de una lámina posterior y de un arco anterior. Su borde superior se une con la laringe y el inferior con la tráquea. Por encima de la lámina posterior se localizan los aritenoides. Los cartílagos aritenoides son pares, de forma triangular/piramidal, en cuyo extremo anterior se localiza la apófisis vocal, donde se inserta el extremo posterior de las cuerdas vocales. La laringe se subdivide en: – Supraglotis. Incluye la epiglotis, los espacios preepliglótico y paraglótico, el ventrículo laríngeo y las bandas ventriculares (cuerdas vocales falsas), los repliegues aritenoepiglóticos y los cartílagos aritenoides. La supraglotis se localiza a continuación de la orofaringe (base de lengua y valéculas) separada por los pliegues glosoepiglótico y faringoepiglótico. Los repliegues aritenoepiglóticos representan el margen superolateral de la supraglotis, separándola del seno piriforme que forma parte de la hipofaringe. La hipofaringe, por tanto, incluye el seno piriforme, la región poscricoidea y la pared hipofaríngea posterior14. – Glotis. Está formada por las cuerdas vocales, incluyendo las comisuras anterior y posterior. Aquí también hay espacio paraglótico. La comisura anterior corresponde al punto de unión de las cuerdas vocales en la línea media anterior. La comisura posterior es la superficie mucosa situada entre los cartílagos aritenoides. Ambas comisuras no deben superar 1 mm de espesor en respiración tranquila. – Subglotis. Empieza en un plano situado a 1 cm, de forma arbitraria, por debajo de la cuerda vocal y se extiende 26/4/12 18:31:34 Anatomía simplificada del cuello 7 hasta el borde inferior del cricoides. En esta zona existe la transición del epitelio escamoso al respiratorio. La superficie mucosa subglótica está adherida al cricoides, excepto en la porción inmediatamente inferior a las cuerdas vocales, por lo que es un área que debe ser valorada con especial atención. Los espacios paralaríngeos contienen grasa y se localizan entre la mucosa y los cartílagos laríngeos, y se extienden desde la subglotis hasta la región preepiglótica. El espacio preepiglótico se localiza entre el hioides y la epiglotis. El espacio paraglótico se encuentra adyacente a las bandas ventriculares y cuerdas vocales. Estos espacios grasos son importantes por la posibilidad de asiento de un carcinoma escamoso submucoso, o por una invasión directa de un tumor desde la superficie mucosa de la cuerda vocal o del ventrículo laríngeo. La laringe consta de 2 regiones embriológicamente definidas y separadas por un plano trazado a través de los ventrículos laríngeos por la superficie superior de la glotis. El área superior tiene una abundante red linfática que drena en la cadena ganglionar profunda superior, mientras que la inferior tiene un escaso drenaje linfático a la cadena ganglionar profunda inferior y paratraqueal. Por eso, el carcinoma escamoso supraglótico tiene una incidencia superior de metástasis ganglionares en el momento del diagnóstico, comparado con los de glotis y subglotis, en los que la extensión ganglionar es inferior al 10%15. Figura 8. Representación de las cadenas ganglionares sobre imagen 3D de una tomografía computarizada del cuello. Se remarcan los límites del borde inferior del hioides, borde inferior del cricoides, borde posterior de la mandíbula y glándula submandibular, y bordes anterior y posterior del esternocleidomastoideo. Según estos límites se obtienen los diferentes grupos ganglionares: submentonianos, submandibulares, digástricos, yugulares internos medios e inferiores, y yugulares posteriores medios e inferiores. Ganglios linfáticos Como la clasificación de los niveles ganglionares tiene una importancia crucial en la estadificación del carcinoma de células escamosas de cabeza y cuello, se ha seguido la clasificación tradicional basada en los diferentes triángulos quirúrgicos y anatómicos macroscópicos16,17. Ésta divide el cuello cervical por el músculo esternocleidomastoideo en 2 grandes triángulos desde la mandíbula hasta las clavículas: el anterior y el posterior. A su vez, éstos se subdividen dando lugar a los siguientes niveles ganglionares (figs. 8 y 9): 1. Nivel I. – IA, submentonianos: delimitado por el vientre anterior del digástrico entre ambos lados. – IB, submandibulares: en situación lateral al vientre anterior del digástrico y en relación con la glándula submandibular. 2. Nivel II. Cadena yugular interna superior o cervical profunda superior. Por detrás y encima del hioides. – IIA: rodeando la vena yugular interna y en relación con el vientre posterior del digástrico. Nota: Cuando se localizan en la porción más superior de la cadena, en relación con el ángulo de la mandíbula, se denominan yugulodigásticos. – IIB: posteriores a la vena yugular interna, con plano graso diferenciado visible entre ambos. 0-3 Capt 43.pag.indd 7 Figura 9. Cortes axiales de tomografía computarizada tras la inyección de contraste, donde se señalan adenopatías en los diferentes niveles. Para determinar el nivel hay que tener en cuenta las referencias anatómicas que nos delimitan cada región. 3. Nivel III. Cadena yugular interna media o cervical profunda media. Desde el borde inferior del hioides al borde inferior del cricoides. 4. Nivel IV. Cadena yugular interna inferior o cervical profunda inferior. Se distribuye desde el borde inferior del cricoides hasta la clavícula. 26/4/12 18:31:35 8 Radiología de cabeza y cuello 5. Nivel V. Ganglios espinales accesorios y cervicales transversales. Se localizan posteriormente al margen posterior del músculo esternocleidomastoideo. – VA: espinales altos/yugulares posteriores altos, desde la base del cráneo hasta el borde inferior del cricoides. – VB: espinales bajos/yugulares posteriores bajos, desde el borde inferior del cricoides hasta la clavícula. Nota 1: La cadena espinal accesoria también se puede subdividir en subgrupos, superior, medio e inferior, por una línea trazada a lo largo de la superficie inferior del hueso hioides y por otra trazada a lo largo del borde inferior del cartílago cricoides. Nota 2: Las adenopatías supraclaviculares son las localizadas en la porción más inferior (fosa supraclavicular) de la cadena espinal baja (también llamados ganglios de Virchow). 6. Nivel VI. Ganglios del espacio visceral: pretraqueales, paratraqueales y perilaríngeos. Se extienden anteriormente desde el hioides hasta el margen superior del manubrio del esternón. 7. Nivel VII. Mediastínicos superiores. Localizados entre ambas carótidas internas, el manubrio del esternón y la vena innominada. Otros ganglios importantes no incorporados a este esquema incluyen los retrofaríngeos (mediales o laterales) y los parotídeos. No hay que olvidar el tejido linfoide del anillo de Waldeyer (fig. 10), situado en la entrada de la vía aereodigestiva superior, compuesta de: – Amígdala faríngea o adenoides: situada en el techo o bóveda de la nasofaringe. – Amígdala tubárica: se encuentra rodeando al extremo faríngeo de la trompa de Eustaquio. – Amígdala palatina (o tonsila): situada a ambos lados de la entrada de la orofaringe, entre los pilares del velo del paladar. – Amígdala lingual: es el conjunto de tejido linfoide más voluminoso de la faringe y está situado en la base de la lengua. Glándulas salivares Disponemos de 3 pares de glándulas salivares mayores (parótidas, submandibulares y submaxilares) y de entre 500 y 1.000 glándulas salivares menores que se distribuyen a lo largo de la mucosa del tracto aereodigestivo superior18. La glándula parótida es la de mayor tamaño y se extiende desde el borde anterior del conducto auditivo externo hasta el ángulo de la mandíbula. Se localiza en el espacio parotídeo, limitando por delante con el espacio masticador y medialmente con el espacio parafaríngeo. En más del 30% de los individuos no existe fascia de separación entre el lóbulo profundo de la parótida y la grasa parafaríngea. No hay una división anatómica real en 2 lóbulos, aunque 0-3 Capt 43.pag.indd 8 Figura 10. Estructuras del anillo de Waldeyer. Cortes axiales de tomografía computarizada poscontraste en los 3 niveles representados en el plano sagital de la imagen superior izquierda. En el corte a, que pasa por la nasofaringe se marcan las adenoides con la cabeza de flecha negra. En el corte b, se marcan las amígdalas palatinas con cabezas de flecha negras, a ambos lados de la úvula. En el corte c se marca con la cabeza de flecha negra la amígdala lingual, justo por delante del borde libre de la epiglotis. el nervio facial establece una división artificial entre sus lóbulos superficial y profundo (de utilidad quirúrgica). En el 20% de la población hay una glándula parótida accesoria localizada superficialmente al masetero, en forma de lengüeta. El conducto parotídeo (de Stenon) discurre lateralmente al músculo masetero, perfora el músculo bucinador y finaliza en la mucosa oral, a la altura del segundo molar superior (fig. 11A). A diferencia del resto de las glándulas, la parótida es la única glándula que contiene ganglios linfáticos en su interior debido a que sufre una encapsulación en una fase posterior al desarrollo del sistema linfático durante la embriogénesis. Así pues, en el espacio parotídeo podemos encontrar ganglios extraglandulares, pero también intraparotídeos19,20. Las glándulas submaxilares (fig. 11B) son las siguientes en tamaño y se sitúan en el espacio submandibular, entre el hioides y el milohioideo, aunque la porción más profunda de la glándula submaxilar se ubica en el espacio sublingual que está medialmente al borde posterior del milohiodeo21. El plastisma del cuello representa su 26/4/12 18:31:35 Anatomía simplificada del cuello 9 Figura 11. A) Corte de tomografía computarizada (TC) en plano axial a la altura de las glándulas parótidas (X de color blanco). Obsérvese el conducto de Stenon, que se dirige anteriormente a buscar su agujero de drenaje a la altura del segundo molar (flechas curvas). B) Corte de TC axial a la altura del mentón, marcando las glándulas submaxilares (cabezas de flechas negras) y las sublinguales (flechas gruesas negras) de ambos lados. límite superficial y el milohioideo su límite superior, separando los espacios submandibular y sublingual, aunque existe una comunicación en la porción posterior del espacio submandibular con el sublingual y el parafaríngeo dado que el borde posterior del milohioideo no tiene inserción en ninguna estructura. El espacio submandibular de ambos lados también comunica entre sí en la línea media. El conducto de drenaje (de Wharton) recorre el suelo de la boca desembocando lateralmente al frenillo lingual, en la porción anterior del espacio sublingual. Las glándulas sublinguales (fig. 11B) son las más pequeñas de las glándulas salivares mayores y se localizan en el espacio sublingual, entre el milohioideo y los músculos geniogloso y genihioideo. Los espacios sublinguales comunican anteriormente por debajo del frenillo lingual y posteriormente comunican con el espacio submandibular y parafaríngeo21. El músculo hiogloso también se localiza en este espacio y sirve de referencia para localizar la arteria lingual que se localiza anteromedialmente a él. Tiene múltiples conductos, 10 o 12, que drenan de forma independiente en la superficie mucosa del suelo de la boca, aunque algunos de ellos lo hacen directamente al conducto de Wharton. Hay múltiples glándulas salivares menores que se distribuyen a la lo largo de la mucosa del tracto aereodigestivo superior: en labios; paladar blando y duro; cavidad oral; nariz y senos paranasales; laringe e hipofaringe. Aunque también hay localizaciones aberrantes o ectópicas en el tiroides, mandíbula, ángulo pontocerebeloso, órbitas, oído medio y silla turca (pueden ser el origen de coristomas). Estas glándulas son de pequeño tamaño e invisibles en las técnicas rutinarias de imagen. 0-3 Capt 43.pag.indd 9 Figura 12. En la imagen superior izquierda se muestra un corte coronal de tomografía computarizada de cuello a la altura del hioides (h), cartílago tiroides (t) y cricoides (c). Los lóbulos tiroideos (T) se localizan principalmente por debajo de los cartílagos tiroides y cricoides. En el corte sagital que se muestra en la imagen superior derecha se marcan nuevamente el hioides (h), el cartílago tiroides (t) y la glándula tiroides (T). La glándula tiroides en su porción lateral cubre ligeramente la mitad inferior del cartílago tiroideo. En la imagen inferior izquierda se muestra un corte axial a nivel del istmo y lóbulos tiroideos (T), a la altura del segundo-tercer anillos traqueales. En la imagen inferior derecha se muestra en una reconstrucción 3D la relación de la glándula (marcada entre flechas) con los cartílagos laríngeos y los primeros anillos traqueales. Tiroides y paratiroides La glándula tiroides se localiza en el espacio visceral del cuello infrahioideo, consta de 2 lóbulos, derecho e izquierdo, unidos por el istmo tiroideo. Tiene una longitud de 5 cm y un espesor de 2 a 3 cm. El istmo se localiza por delante de los 3 primeros anillos traqueales, generalmente por delante del segundo y tercero; los lóbulos suelen extenderse desde la mitad lateral inferior del cartílago tiroideo hasta el quinto o sexto anillo traqueal (fig. 12). En un tercio de los individuos existe el lóbulo piramidal, originado de la porción superior del istmo. También puede haber anomalías del desarrollo, con presencia de tejido tiroideo ectópico, o quistes tiroideos a lo largo del trayecto del conducto tirogloso, que es el recorrido embriológico que va desde el agujero ciego de la base de la lengua hasta la posición glandular normal, pasando por delante del hioides y de los primeros anillos traqueales. 26/4/12 18:31:35 Radiología de cabeza y cuello 10 – Variaciones en la localización y disposición de la bifurcación carotídea, especialmente de cara a una eventual intervención quirúrgica23. Habitualmente, la bifurcación tiene lugar a la altura de C3-C4, aunque puede localizarse desde C2 a T2. En el 80% de los casos, la arteria carótida interna se dispone posterolateral a la carótida externa. Sin embargo, la salida anteromedial es una variación frecuente que se debe conocer, ya que es posible encontrar una o ambas carótidas internas en situación retrofaríngea, puediendo llegar a contactar en la línea media. Esta variante en la exploración física se manifiesta como una masa pulsátil que abomba en la pared posterior de la faringe (fig. 13). Bibliografía Figura 13. Reconstrucción 3D (a la izquierda) y cortes axiales de tomografía computarizada a diferentes niveles (a la derecha): medialización de arterias carótidas internas, más prominente en la izquierda, que forma un bucle hacia la línea media y protruye hacia la pared posterior de la orofaringe. Por fuera de su cápsula encontramos una capa laxa originada de la porción visceral de capa pretraqueal de la fascia cervical profunda, que la separa de los músculos infrahiodeos y la conecta con la laringe y la tráquea, lo que explica el hecho de que la glándula se mueva durante los movimientos de deglución. Las glándulas paratiroides son de pequeño tamaño, forma ovalada y generalmente se sitúan en la cara posterior de la glándula tiroidea, entre la cápsula y la fascia pretraqueal. Las paratiroides superiores son más constantes en su posición que las inferiores, que habitualmente se localizan cerca de los polos inferiores de la glándula tiroides, pero pueden situarse en varias posiciones (paraesofágicas, timicocervicales, cervicomediastínicas, mediastínicas superiores o anteriores, etc.). Por su pequeño tamaño y localización variable, puede ser dificultoso llegar a identificarlas mediante TC, incluso cuando existen adenomas en ellas, ya que se suelen presentar en forma de pequeños nódulos inferiores a 3 cm y pueden simular adenopatías, por lo que estos casos requieren estudios de medicina nuclear (gammagrafía con 99mTc-MIBI e imágenes de SPECT o SPECT-TC)22. Consideraciones sobre las variantes anatómicas en la vascularización del cuello El estudio anatómico venoso y arterial detallado se escapa de los objetivos de este capítulo, aunque en los estudios de imagen del cuello conviene resaltar: – En el cuello hay una gran variabilidad venosa, tanto entre diferentes individuos como entre ambos lados del mismo cuello. 0-3 Capt 43.pag.indd 10 1. Becker M. Oral cavity, oropharinx, and hypopharinx. Semin Roentgenol. 2000;35:21-30. 2. Branstetter BF 4th, Weissman JL. Normal anatomy of the neck with CT and MR imaging correlation. Radiol Clin North Am. 2000;38:925-40. 3. Som. PM, Curtin HD, editors. Head and Neck Imaging. 4th ed. New York: Mosby; 2003. 4. Mukherji SJ, Castillo M. A simplified approach to the spaces of the suprahyoid neck. Radiol Clin North Am. 1998;36:761-80. 5. Yousem DM. Suprahyoid spaces of the head and neck. Semin Roentgenol. 2000;35:63-71. 6. Harnsberger HR. Handbook of head and neck imaging. 2nd ed. St. Louis: Mosby; 1995. 7. Stambuck HE, Patel SG. Imaging of the parapharingeal space. Otolaryngol Clin Nort Am. 2008;41:77-101. 8. Babbel RW, Hansberger HR. The parapharingeal space: the key to unlocking the suprahyoid neck. Semin Ultrasound CT MR. 1990;11:444-59. 9. Galli F, Flor N, Villa C, Franceschelli G, Pompili G, Felisati G, et al. The masticator space. Value of computed tomography and magnetic resonance imaging in localisation and characterisation of lesions. Acta Otorhinolaryngol Ital. 2010;30:94-9. 10. Davis WL, Smoker WR, Hansberguer HR. The normal and diseased retropharyngeal and prevertebral spaces. Semin Ultrasound CT MR. 1990;11:520-33. 11. Parker GD, Harnsberger HR. Radiologic evaluation of the normal and diseased posterior cervical space. AJR Am J Roentgenol. 1991;157:161-5. 12.Curtin HD. Larinx. En: Som PM, Curtin HD, editors. Head and Neck imaging. 4th ed. St. Louis: Mosby; 2003. p. 1595-699. 13. Abi Khalil S, Menassa-Moussa L, Smayra T, Ghossain M, Aoun N. Anatomy of the larynx with 64-channel multidetector CT. J Med Liban. 2009;57:231-6. 14. Becker M, Burkhardt K, Dulguerov P, Allal A. Imaging of the larynx and hypopharynx. Eur J Radiol. 2008;66:460-79. 15.Reidenbach MM. The paraglotic space and transglotic cancer: anatomical considerations. Clin Anat. 1996;9: 244-51. 16. Silverman PM. Lymph node imaging: multidetector CT (MDCT). Cancer Imaging. 2005;23 Spec No A:S57-67. 17. Som PM, Curtin HD, Mancuso AA. An imaging-based classification for the cervical nodes designed as an adjunct to recent clinically based nodal classification. Arch Otolaryngol Head Neck Surg. 1999;125:388-96. 26/4/12 18:31:35 Anatomía simplificada del cuello 18. Beale T, Madani G. Anatomy of the salivary glands. Semin Ultrasound CT MR. 2006;27:436-9. 19. Yousem DM, Kraut MA, Chalian AA. Major salivary gland imaging. Radiology. 2000;216:19-29. 20. Shah GV. MR imaging of salivary glands. Magn Reson Imaging Clin N Am. 2002;10:631-62. 21. Hansberger HR, Osborn AG, Mac Donald AJ, Ross JS. Oral cavity: sublingual and submandibular space. En: MacDonald AJ, editor. Diagnostic and surgical imaging ana- 0-3 Capt 43.pag.indd 11 11 tomy: brain, head and neck and spine. Manitoba, Canada: Amirsys; 2006. p. 270-3. 22. Weber A, Randolfph G, Aksoy F. The thyroid and parathyroid glands. CT and MR imaging and correlation with pathology and clinical findings. Radiol Clin North Am. 2000;38:110529. 23. Gandhi D, Gemmete JJ, Ansari SA, Gujar SK, Mukherji SK. Interventional neuroradiology of the head and neck. AJNR Am J Neuroradiol. 2008;29:1806-15. 26/4/12 18:31:35 Radiología de cabeza y cuello 2 Lesiones quísticas del cuello en pediatría E. Vázquez Méndez* e I. Delgado Álvarez Departamento de Radiología Pediátrica, Hospital Materno-Infantil Vall d’Hebron, Barcelona, España Introducción La mayoría de lesiones quísticas en niños son de origen congénito o inflamatorio, a diferencia del adulto, en el que predomina el origen inflamatorio o neoplásico. El diagnóstico por imagen juega un papel transcendental en la evaluación de estas lesiones quísticas, siendo muy importante que el radiólogo conozca las manifestaciones, tanto comunes como inusuales, de estas lesiones1,2. La mayoría están localizadas en el cuello infrahioideo y se clasifican en congénitas o adquiridas. Las lesiones congénitas incluyen quistes del conducto tirogloso (masa quística congénita más frecuente), quistes branquiales (especialmente derivados del segundo arco branquial), malformaciones linfáticas, quistes dermoides y epidermoides, y con menos frecuencia quistes tímicos y broncogénicos. Dentro de las lesiones adquiridas están las de origen infeccioso-inflamatorio (adenopatías necróticas y abscesos), las lesiones de las glándulas salivales, laringoceles y quistes tiroideos. La ecografía continúa siendo la técnica de elección en la aproximación inicial a una masa cervical, especialmente las de localización superficial, ya que nos permite definir la naturaleza sólida o quística de la lesión. En niños es especialmente valorable, ya que no utiliza radiación ionizante, no se necesita sedación, por otro lado es una técnica ampliamente disponible, barata, que proporciona excelente resolución espacial y de contraste, especialmente con los equipos modernos que disponen de transductores de alta frecuencia, tecnología 3D, imagen panorámica y aplicación de color Doppler2,3. Tras la ecografía debería utilizarse la resonancia magnética (RM), que está especialmente indicada en lesiones de localización profunda, las que infiltran múltiples espacios anatómicos, en la sospecha de lesiones vasculares, para definir mejor ciertas complicaciones infecciosas y antes de una intervención quirúrgica. Con la RM se evita la radiación ionizante de la tomografía computarizada (TC), si bien esta última modalidad se sigue utilizando para el estudio de pacientes con patología urgente, como por ejemplo en el absceso retrofaríngeo. Siempre que se utilice TC cervical en niños, debe realizarse con ajuste de dosis usando la menor irradiación posible, así como utilizar los adecuados dispositivos de radioprotección, como son los protectores de bismuto para el cristalino y la glándula tiroides3,4. Lesiones cervicales congénitas Quiste del conducto tirogloso Constituye la lesión cervical congénita más frecuente en los niños (70%) y la segunda masa cervical benigna tras la linfadenopatía. Se origina por una persistencia de parte o todo el conducto tirogloso, similar a lo que ocurre con el tejido tiroideo ectópico. El conducto tirogloso se extiende desde el foramen cecum en la base lingual hasta la glándula tiroides, e involuciona durante la octava semana de la vida intrauterina (fig. 1). Los remanentes de este conducto pueden aparecer como quistes o como tejido tiroideo ectópico5. Restos tiroideos sólidos pueden permanecer a lo largo del trayecto del conducto tirogloso. La mayoría ocurre en la línea media del dorso lingual, cerca del foramen cecum, pudiendo causar compromiso de vía aérea cuando aumentan de tamaño (tiroides lingual)6. En un niño con hipotiroidismo congénito y glándula tiroides ausente en su localización normal debe explorarse ecográficamente esta zona para descartar un tiroides lingual. La confirmación vendrá dada por la gammagrafía isotópica, aunque en ocasiones este tejido ectópico puede ser no funcional y en esa circunstancia el resultado es un falso negativo. Los quistes se presentan como masas anteriores en la línea media, en relación con el hueso hioides, más comúnmente de localización infrahioidea, siendo en la ecografía lesiones anecoicas de pared fina, homogéneas y con refuerzo acústico posterior (fig. 2), aunque a veces tienen un contenido más proteináceo por infección asociada, consecuencia de su comunicación persistente con la base de la lengua a través del foramen ciego, pudiendo entonces fis- *Autor para correspondencia. Correo electrónico: [email protected] (E. Vázquez Méndez). 0-3 Capt 43.pag.indd 12 26/4/12 18:31:35 Lesiones quísticas del cuello en pediatría 13 Figura 1. Conducto tirogloso. Imagen lateral del cuello que muestra el trayecto del conducto tirogloso desde el foramen cecum, en la base de la lengua, hasta el lecho tiroideo. Importante la posición inferior y luego posterior con respecto al hueso hioides antes de descender hacia el cuello infrahioideo (referencia 6). Figura 3. Quiste tirogloso. A) Lesión quística en base de la lengua, con señal hiperintensa en imágenes de resonancia magnética (RM) T2 con supresión grasa, en plano sagital. B) Imagen axial de RM tras contraste y supresión grasa que muestra un contenido hipointenso y homogéneo. Figura 2. Quiste tirogloso. Imagen ecográfica de la línea media de cuello infrahioideo que muestra finos ecos en su interior y refuerzo posterior compatible con quiste tirogloso. tulizar y drenar al exterior. La presencia de calcificación se considera bastante específica de carcinoma papilar asociado, lo cual ocurre en un 1% de casos, aunque esto es muy raro en la infancia1,2. En la RM, estos quistes son siempre 0-3 Capt 43.pag.indd 13 hiperintensos en imágenes potenciadas en T2, mientras que la señal puede ser más variable en T1, con hiperseñal cuando el contenido quístico es con predominio proteináceo (fig. 3). El tratamiento recomendable es la extirpación quirúrgica, con extracción del centro del hueso hioides, por cuyo 26/4/12 18:31:36 14 Radiología de cabeza y cuello interior va el conducto tirogloso, evitando así la recidiva3-5. El principal diagnóstico diferencial es con el quiste epidermoide/dermoide/teratoide. Pueden contener sólo material proteináceo (epidermoide o dermoide), tener además grasa (dermoide), o bien grasa y calcio (teratoide o teratoma)2,3,6. Se localizan en línea media o ligeramente paramediana, en el suelo de la boca, en el espacio submaxilar o sublingual, o en el hueco supraesternal, pudiendo aparecer como lesiones quísticas uniloculares, con contenido homogéneo o débilmente ecogénico por la presencia de grasa1,5. En TC o RM pueden tener una típica apariencia en “saco de mármoles” (sack-of-marbles) debido a los glóbulos de grasa presentes en su interior (fig. 4). Los teratomas son tumores habitualmente presentes en el período neonatal, descubriéndose en la actualidad mediante las técnicas de imagen prenatal (ecografía o RM). Los cervicales a menudo engloban la glándula tiroides, siendo con frecuencia de gran tamaño, pudiendo causar una hiperextensión del cuello fetal, provocando polihidramnios y distocia de parto. En la ecografía suelen presentan componentes sólidos con calcificaciones7. La mayoría son benignos, aunque la resección quirúrgica suele ser compleja por el compromiso de estructuras vitales (fig. 5). La malformación linfática es el principal diagnóstico diferencial. Una causa infrecuente de estridor y compromiso respiratorio en el recién nacido es el quiste laríngeo congénito. Algunos autores lo denominan laringomucocele. El pronóstico empeora cuando se asocia a laringomalacia o cuando se presentan prenatalmente precisando un procedimiento EXIT (ex utero intrapartum treatment) para preservar la vía aérea en el nacimiento7,8. La mayoría (58,2%) se localizan en el área glótica, pudiendo estar recubiertos por epitelio escamoso o respiratorio. Se clasifican en congénitos, de retención o de inclusión. Aparecen en ecografía como lesiones anecoicas o en RM como lesiones de señal líquido, marcadamente hiperintensos en secuencias T2 (fig. 6), indentando o en íntima relación con la vía aérea. El tratamiento es la resección por microcirugía laringoscópica. Anomalías del aparato branquial Figura 4. Quiste epidermoide. Masa sublingual derecha en niña de 11 meses ligeramente hiperintensa en imagen (A) axial T1 y marcadamente hiperintensa en la correspondiente (B) imagen T2 con saturación grasa. 0-3 Capt 43.pag.indd 14 Se originan por defectos de cierre y reabsorción de cualquiera de los 4 arcos y hendiduras branquiales primitivos, pudiendo dar lugar a quistes (75%) o a tractos sinusales (25%). Los derivados del primer arco branquial constituyen de un 5 a un 8% de los casos, siendo diagnosticados más comúnmente en mujeres de edad media, como abscesos o inflamaciones recurrentes alrededor del oído y glándula parótida, comunicando con el conducto auditivo externo y en íntimo contacto con el recorrido del nervio facial2,4. Los derivados del segundo arco branquial son los más frecuentes (95%), pudiendo aparecer en un amplio rango de edad (10-40 años) como una masa cervical lateral recurrente próxima al ángulo mandibular adyacente al borde anteromedial del esternocleidomastoideo (SCM) (fig. 7). La localización es muy característica, superficial a la arte- 26/4/12 18:31:36 Lesiones quísticas del cuello en pediatría 15 Figura 6. Quiste laríngeo congénito en recién nacido con estridor. Masa homogénea e hiperintensa en T2, en un corte coronal, que muestra el probable origen en la región glótica con marcada distorsión de la vía aérea. Figura 5. Teratoma cervical. Masa laterocervical en recién nacido con diagnóstico prenatal. La masa presenta componentes quísticos y probable calcificación en la imagen coronal T1 (A) y realce de la señal del componente sólido en la imagen axial T1 poscontraste con supresión grasa (B). ria carótida común y vena yugular interna, posterior a la glándula submaxilar y a lo largo del borde anteromedial del SCM; la extensión entre las arterias carótida interna y externa se considera un hecho patognomónico de quiste de 2.º arco branquial tipo III (“signo del pico”)9. Estos quistes fueron divididos por Bailey10 en 4 tipos: tipo I, es profundo al músculo platisma y anterior al SCM; tipo II, es el más 0-3 Capt 43.pag.indd 15 común, anterior al SCM, posterior a la glándula submaxilar y lateral a los vasos carotídeos; tipo III, protruye entre las arterias carótida interna y externa pudiendo extenderse a la pared lateral de la faringe o a la base craneal, y el tipo IV, adyacente a la pared faríngea. El diagnóstico diferencial es con adenopatía necrosada, bien sea por linfadenitis o por linfoma, sobre todo cuando el quiste branquial está infectado (fig. 8). Los originados del tercer y cuarto arcos branquiales aparecen más comúnmente en niños y adultos jóvenes como masas fluctuantes en triángulo cervical posterior izquierdo, por detrás del SCM. La fístula del seno piriforme es una anomalía rara del cuarto arco branquial que se extiende desde el ápex del seno piriforme a las proximidades de la glándula tiroidea presentándose como una infección recidivante tiroidea o peritiroidea (fig. 9). El estudio cuidadoso con bario puede demostrar el trayecto sinusal y debe ser realizado en todo niño que se presente con tiroiditis supurada o absceso peritiroideo. El tratamiento es la resección completa del tracto sinusal para evitar las recidivas11,12. Los quistes tímicos son raros remanentes de la tercera bolsa branquial, pudiendo localizarse en cualquier lugar, desde el ángulo de la mandíbula hasta el mediastino, siguiendo el trayecto del conducto timofaríngeo. El timo se desarrolla a partir del endodermo del tercer par de bolsas faríngeas13. Las anomalías derivadas se originan por un descenso incompleto hacia el tórax, pudiéndose quedar tejido tímico ectópico anterior o profundo respecto al músculo SCM (timo cervical) (fig. 10). Tanto en US como en 26/4/12 18:31:36 16 Radiología de cabeza y cuello Figura 7. Quiste de segundo arco branquial. Niño de 12 años con masa laterocervical izquierda. A) Imagen de resonancia magnética T2 con supresión grasa en plano axial, muestra inflamación circundante por probable infección añadida. B) La imagen axial T1 poscontraste con supresión grasa demuestra realce de la señal periférico sugestivo de sobreinfección de la masa, situada anterior y medial al músculo esternocleidomastoideo. RM es útil comparar la ecoestructura o la intensidad de señal con el timo mediastínico para llegar a un diagnóstico correcto. El tejido aberrante puede sufrir degeneración quística dando lugar al quiste tímico. Los quistes aparecen más frecuentemente en mujeres y en la primera década, como masas cervicales izquierdas adyacentes al SCM, bien asintomáticas o bien con clínica respiratoria (fig. 11). Tras la extirpación se descubre el tejido tímico con los típicos corpúsculos de Hassel2,13. 0-3 Capt 43.pag.indd 16 Figura 8. Linfoma no hodgkiniano en niño de 10 años. A) Adenopatía única que simula quiste de segundo arco por su localización en imagen axial T2 con saturación grasa. B y C) Imágenes de difusión (B) y mapa CDA (C) que ponen de manifiesto la notoria restricción del contenido de la lesión. 26/4/12 18:31:37 Lesiones quísticas del cuello en pediatría 17 Figura 9. Fístula de seno piriforme. Esquema del trayecto sinusal desde el seno piriforme izquierdo hasta la glándula tiroides, produciendo un absceso en el tejido tiroideo. Figura 11. Quiste tímico. A) Imagen axial de tomografía computarizada tras contraste que muestra una lesión de baja atenuación adyacente al esternocleidomastoideo izquierdo. B) Tras la resección, la anatomía patológica confirmó la presencia de tejido tímico con corpúsculos de Hassel. Figura 10. Trayecto del conducto timofaríngeo (referencia 13). Malformaciones linfáticas La clasificación de Mulliken y Glowacki 14 de las lesiones vasoformativas divide éstas en hemangioma infantil y malformaciones vasculares (capilares, venosas, linfáticas y arteriovenosas), lo cual se correlaciona con el comportamiento clínico y con la diferente terapéutica a seguir. En la región de cabeza y cuello, las más comunes son las malformaciones linfáticas y los hemangiomas. Las malformaciones linfáticas o linfangiomas son malformaciones vasculares de bajo flujo formadas por sacos linfáticos primitivos separados por tejido conecti- 0-3 Capt 43.pag.indd 17 vo. Histopatológicamente se dividen en 3 tipos: linfangioma simple, cavernoso e higroma quístico, con progresivo aumento de tamaño de los canales revestidos por endotelio2. Aunque se pueden diagnosticar prenatalmente7, se manifiestan en su mayoría posnatalmente en los 2 primeros años de vida (fig. 12). A diferencia del hemangioma infantil, no involucionan espontáneamente, pudiendo crecer súbitamente ante infección, trauma o hemorragia intralesional 15. En cabeza y cuello pueden presentarse como masa cervical o facial, compromiso respiratorio o ptosis palpebral. Un 75% se localiza en el espacio cervical posterior. 26/4/12 18:31:37 Radiología de cabeza y cuello 18 Figura 12. Correlación pre-posnatal en linfangioma. A) Malformación linfática descubierta en resonancia magnética (RM) fetal realizada a las 21 semanas. B y C) La lesión creció de manera notoria durante la gestación presentando al nacimiento un tamaño considerable, con múltiples quistes y presencia de abundante hemorragia en las imágenes de RM posnatal T1 (B) y T2 (C). En los estudios de imagen aparecen como masas quísticas uni o multiloculadas, homogéneas, mal delimitadas en espacio cervical posterior o submandibular, hipoecoicas en US, de baja atenuación en TC y con señal similar al líquido en RM, con escaso realce de la señal en T1 (septos internos o componente venoso sí pueden mostrar realce de la señal), con afectación transespacial16. La presencia de hemorragia ocasiona mayor ecogenicidad en ecografía, mayor atenuación en TC y presencia de niveles líquido-líquido. Frecuentemente, los linfangiomas forman parte de una malformación mixta, preferentemente son venolinfáticas, pudiendo entonces presentar realce de la señal en T1 al inyectar contraste, y flebolitos (fig. 13). El tratamiento de elección es la extirpación quirúrgica, pero ésta puede ser muy laboriosa en lesiones extensas y presenta una tasa de recidiva del 11,8 al 52%. Por ello se utiliza también la escleroterapia percutánea, con diversas sustancias esclerosantes, como bleomicina, doxiciclina, Ethiblok y OK-432, con una regresión considerable de los quistes17. Lesiones inflamatorias: linfadenitis y abscesos cervicales Linfadenitis supurada Figura 13. Linfagioma hemorrágico en niña de 6 años. A) Imagen ecográfica que muestra componentes ecogénicos compatibles con áreas de sangrado. B) Imagen de resonancia magnética en plano axial y potenciada en T1 que demuestra la hiperintensidad de señal de la lesión. Se realizó escleroterapia percutánea con OK-432 bajo guía ecográfica con resolución completa de los quistes en el seguimiento. 0-3 Capt 43.pag.indd 18 Es generalmente de origen bacteriano y se presenta clásicamente en niños entre 6 meses y 3 años de edad, tras una infección respiratoria alta, con fiebre, irritabilidad y malestar general. Los agentes causales suelen ser Staphylococcus aureus y Streptococcus beta-hemolítico del grupo A, así como microorganismos anaerobios. La infección alcanza los espacios profundos del cuello desde oídos, nariz o faringe por continuidad directa o por drenaje linfático. Sin tratamiento adecuado hay un crecimiento progresivo de las adenopatías desarrollándose, finalmente, necrosis y abscesificación18. 26/4/12 18:31:38 Lesiones quísticas del cuello en pediatría Figura 14. Malformación venosa en varón adolescente de 17 años. La lesión presenta una señal baja en T1 en plano axial (A), con hiperintensidad de señal en T2 (B), siendo notoria la presencia de flebolitos en su interior. 19 te, el 43% de abscesos fue retrofaríngeo o parafaríngeo, el 32% de triángulos anterior o posterior, el 25% submandibular o submental y el 1% parotídeo19. El absceso retrofaríngeo debuta con aparición brusca de dificultad para tragar, rechazo del alimento, dificultad respiratoria e hiperextensión del cuello 20. La TC permite diferenciar la celulitis, que responde a terapia antibiótica, del absceso, que requiere tratamiento quirúrgico. La presencia de un área homogénea de atenuación baja rodeada por un anillo de realce se considera típica de absceso, mientras que la celulitis se caracteriza por edema de los tejidos blandos con pérdida de los planos grasos. Las variables descritas a valorar en la TC son: hipoatenuación central, efecto de masa, anillo de captación de contraste periférico, morfología ondulada del contorno y obliteración de espacios grasos vecinos (fig. 14). No obstante, puede haber falsos positivos hasta en el 14-17% de casos, interpretando como absceso un área aún flemonosa, no susceptible de drenaje quirúrgico21. Una conducta adecuada y recomendada por los otorrinolaringólogos pediátricos es la actitud expectante tras una TC dudosa, aconsejando un tratamiento conservador con antibioterapia intravenosa durante 48 h, siempre que no haya afectación del estado general o compromiso de la vía aérea. Bibliografía 1. Wong KT, Lee YY, King AD, Ahuja AT. Imaging of cystic or cyst-like neck masses. Clin Radiol. 2008; 63:613-62. 2. Koch BR. Cystic malformations of the neck in children. Pediatr Radiol. 2005;35:463-77. 3. Vázquez E, Mayolas N, Delgado I. Cabeza y cuello en pediaFigura 15. Linfadenitis y abscesos. A) Linfadenitis necrosada en región laterocervical izquierda demostrada en tomografía computarizada (TC) axial poscontraste. B) Imagen de baja atenuación, aspecto multilocular y captación periférica en TC axial poscontraste correspondiente a un absceso retrofaríngeo que precisó drenaje quirúrgico. Abscesos cervicales Hay varios tipos de abscesos cervicales que se presentan en niños, entre los que se incluyen los siguientes: – Absceso retrofaríngeo. Es el que se forma detrás de la faringe tras una infección de las vías respiratorias superiores. Este tipo de absceso se presenta con mayor frecuencia en niños pequeños. – Absceso periamigdalino. Se presenta con mayor frecuencia en adolescentes y adultos jóvenes, y rara vez se observa en niños pequeños. – Angina de Ludwig. Es el absceso que se localiza debajo de los tejidos del suelo de la boca, suele presentarse en adolescentes mayores, especialmente después de una infección dental. En una reciente revisión realizada por Coticchia et al en 169 pacientes menores de 19 años tratados quirúrgicamen- 0-3 Capt 43.pag.indd 19 tría. En: Rovira Cañellas A, Ramos González A, De Juan Delago M, editores. Actualizaciones SERAM. Cabeza y Cuello. Cap. 11. Madrid: Panamericana; 2009. p. 117-27. 4. Vázquez E, Enríquez G, Castellote A, Lucaya J, Creixell S, Aso C, et al. US, CT and MR imaging of neck lesions in children. Radiographics. 1995;15:105-22. 5. Koeller KK, Alamo L, Adair CF, Smirniotopoulos JG. Congenital cystic masses of the neck: radiologic-pathologic correlation. Radiographics. 1999;19:121-46. 6. Som PM, Smoker WRK, Curtin HD. Congenital lesions in head and neck imaging. En: Som PM, Curtin HD, editors. Head and neck imaging. St. Louis: Mosby; 2003. p. 1828-64. 7. Vázquez E, Castellote A, Mayolas N, Carreras E, Peiro JL, Enríquez G. Congenital tumours involving the head, neck and central nervous system. Pediatr Radiol. 2009;39:115872. 8. Arens C, Glanz H, Kleinsasser O. Clinical and morphological aspects of laryngeal cysts. Eur Arch Otorhinolaryngol. 1997;254:430-6. 9. Benson MT, Dalen K, Mancuso AA, Kerr HH, Cacciarelli AA, Mafee MF. Congenital anomalies of the branchial apparatus: embryology and pathological anatomy. Radiographics. 1992;12:943-60. 10. Bailey H. The clinical aspect of branchial cysts. En: Bailey H, editor. Branchial cysts and other essays on surgical subjects in the faciocervical región. London: Lewis; 1929. p. 1-18. 11. Lucaya J, Berdon WE, Enríquez G, Regas J, Carreno JC. Congenital pyriform sinus fistula: a cause of acute left- 26/4/12 18:31:38 20 sided suppurative thyroiditis and neck abscess in children. Pediatr Radiol. 1990;21:27-9. 12. Wang HK, Tiu CM, Chou YH, Chang CY. Imaging studies of pyriform sinus fistula. Pediatr Radiol. 2003;33:328-33. 13. Z a r b o R J, M c C l a t c h ey K D, A r e e n R G, B a c k e r S B. Thymopharyngeal duct cyst: a form of cervical thymus. Ann Otol Rhinol Laryngol. 1983;92:284-9. 14. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 1982;69:412-22. 15. Castellote A, Vázquez E, Vera J, Piqueras J, Lucaya J, GarcíaPeña P, et al. Cervicothoracic lesions in infants and children. Radiographics. 1999;19:583-600. 16. Siegel MJ, Glazer HS, St. Amour TE, Rosenthal DD. Lymphangiomas in children: MR imaging. Radiology. 1989; 170:467-70. 0-3 Capt 43.pag.indd 20 Radiología de cabeza y cuello 17. Dubois J, Garel L, Abela A, Laberge L, Yazbeck S. Lymphangiomas in children: percutaneous sclerotherapy with an alcoholic solution of zein. Radiology. 1997;204:651-4. 18. Hudgins PA. Nodal and nonnodal inflammatory processes of the pediatric neck. Neuroimaging Clin N Am. 2000;10:181-92. 19.Coticchia JM, Getnick GS, Yun RD, Arnold JE. Age-, site-, and time-specific differences in pediatric deep neck abscesses. Arch Otolaryngol Head Neck Surg. 2004;130: 201-7. 20. Craig FW, Schunk JE. Retropharyngeal abscess in children: clinical presentation, utility of imaging, and current management. Pediatrics. 2003;111:1394-8. 21. Malloy KM, Christenson T, Meyer JS, Tai S, Deutsch ES, Barth PC, et al. Lack of association of CT findings and surgical drainage in pediatric neck abscesses. Int J Pediatr Otorhinolaryngol. 2008;72:235-9. 26/4/12 18:31:38 Radiología de cabeza y cuello 3 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas J. Berenguer González* y T. Pujol Farré Sección de Neurorradiología, Hospital Clínic, Barcelona, España Introducción La patología infecciosa cervical tiene una elevada morbimortalidad. En la mayoría de los casos se presenta como una urgencia que obliga al manejo clínico radiológico rápido. La mayor parte de las infecciones son polimicrobianas producidas por la flora mixta (microrganismos anaerobios y aerobios) propia de la cavidad oral1,2. Debe tenerse muy en cuenta que, debido a que los distintos espacios anatómicos del cuello están comunicados, las complicaciones de estos procesos pueden involucrar estructuras a distancia de la infección inicial. En su evolución se pueden producir complicaciones severas que ponen en riesgo la vida del paciente, incluyendo el compromiso de la vía aérea (por producir compresión sobre ésta o por ruptura en ella de un absceso), la tromboflebitis séptica yugular, la mediastinitis, la pericarditis, los abscesos pulmonares y el choque séptico1,3. Aunque no todos los pacientes precisan intubación, el potencial compromiso de la vía aérea es el principal factor que requiere la actuación rápida y coordinada del otorrinolaringólogo y del equipo de anestesia en una unidad de cuidados intensivos3. Los principales signos clínicos de alarma de posible compromiso de la vía aérea son la taquipnea con respiración superficial, la ortopnea y la disnea con estridor3. En la era preantibiótica, los abscesos cervicales profundos solían desarrollarse a partir de faringoamigdalitis4 pero, en la actualidad, el origen más común de la formación de abscesos en los planos profundos cervicales en adultos son las infecciones dentales2 (43%) y las que se derivan del uso de drogas ilegales por vía intravenosa (i.v.) (13%). En la población infantil es más frecuente el origen amigdalar1. Las infecciones profundas del cuello son más frecuentes en pacientes con diabetes mellitus, enfermedades sistémicas, inmunodeprimidos, ancianos y alcohólicos1,3. En casos con infecciones cervicales recurrentes debe considerarse la posibilidad de lesiones subyacentes no resueltas, como quiste tirogloso y branquial1. El diagnóstico precoz con soporte de la vía aérea, el tratamiento antibiótico adecuado y el drenaje de colecciones minimizan la morbimortalidad de estos pacientes3. El papel del radiólogo en estos casos puede ser determinante. Es esencial que esté entrenado en el manejo de las distintas pruebas de imagen, que esté familiarizado con la anatomía de la zona y que sea capaz de identificar los signos radiológicos, especialmente los que son críticos para estos pacientes 2 . Aunque en los pacientes con procesos infecciosos cervicales profundos la tomografía computarizada (TC) es la principal herramienta de imagen de la que disponemos, la resonancia magnética (RM) tiene un papel complementario importante 5 . La TC sin y con contraste es una técnica disponible y de rápida realización, que permite valorar correctamente la estructura ósea, la presencia de calcificaciones y de cuerpos extraños. Tiene una notable sensibilidad para evaluar partes blandas y se considera suficiente para distinguir entre absceso (colección líquida limitada por un anillo de captación de contraste con efecto de masa variable) y flemón (tejido edematoso de baja densidad sin captación periférica de contraste) 6 . Sin embargo pueden producirse falsos negativos (colecciones no captantes de contraste que contienen pus) 2 y positivos (imágenes hipodensas con captación periférica < 3,5 cm sin contenido purulento) 1 . La RM está indicada en los casos en que se requiera determinar con mayor exactitud la presencia de colecciones líquidas potencialmente drenables quirúrgicamente y en pacientes con espondilodiscitis 2. En infecciones cervicales superficiales, la ecografía puede ser una herramienta de valoración inicial muy útil 2. El tratamiento de estos pacientes incluye, en general, garantizar la permeabilidad de la vía aérea, soporte cardiorrespiratorio, antibioticoterapia y drenaje percutáneo o quirúrgico de abscesos. *Autor para correspondencia. Correo electrónico: [email protected] (J. Berenguer González). 0-3 Capt 43.pag.indd 21 26/4/12 18:31:38 Radiología de cabeza y cuello 22 Infecciones de la cavidad oral y orofaringe Los pacientes con infecciones de la cavidad oral suelen presentar hinchazón facial, odinofagia, trismus, fiebre y, en ocasiones, disfagia y disfonía. Estos procesos se originan con frecuencia en infecciones peridentales. Otras causas incluyen laceraciones del suelo de la boca, fracturas mandibulares, cuerpos extraños, neoplasias de cavidad oral, sialoadenitis y linfadenitis3. En el maxilar inferior, las raíces dentarias más anteriores se encuentran por encima del músculo milohiodeo, lo que determina que la infección afecte al espacio sublingual. Cuando el origen es en el segundo o tercer molar, el proceso puede progresar al espacio submandibular porque las raíces de estas piezas se extienden por debajo de la inserción del músculo milohiodeo1-3,5. Las vías de diseminación más frecuentes de la infección odontogénica maxilar son al espacio masticador (si surge del segundo molar), al espacio parafaríngeo (si se origina en el tercer molar) y al espacio bucal (en las infecciones originadas en las otras piezas)1. En ocasiones, en los pacientes con afectación del espacio masticador, la infección puede progresar al espacio parotídeo6. La TC con contraste i.v. es la técnica de imagen de primera elección5-7, especialmente en los pacientes que presentan abscesos en espacio masticador, debido a su escasa accesibilidad a la exploración clínica6. Permite la valoración de las piezas dentarias y de la estructura ósea mandibular poniendo en evidencia signos periodontíticos y abscesos periapicales. Demuestra eventuales signos de osteomielitis (destrucción y lisis/esclerosis ósea, reacción perióstica y secuestro óseo) y posibles soluciones de continuidad óseas, siendo más frecuentes en el margen lingual mandibular5,6 y en el margen bucal del maxilar superior 6, ambos más delgados (fig. 1). También podemos apreciar fenómenos A B celulíticos con engrosamiento de la piel y trabeculación de los planos grasos, miositis con engrosamiento y captación de contraste muscular y eventuales colecciones de partes blandas hipodensas con captación periférica de contraste. Además es una técnica excelente para detectar posibles cuerpos extraños7. La RM con contraste i.v. puede mostrar mayor número de áreas de abscesificación. En estos casos, los signos osteomielíticos implican una pauta a más largo plazo del tratamiento antibiótico5. Tras el tratamiento antibiótico en la fase aguda se realizará, bajo tratamiento antibiótico, la extracción de la pieza dentaria responsable. La angina de Ludwig fue descrita por el médico alemán Wilhelm Freidrich von Ludwig en 1936. Constituye una celulitis gangrenosa de tejidos blandos del suelo de la boca que afecta de forma rápidamente evolutiva a los espacios sublingual y submandibular. Afecta más frecuentemente a varones entre los 20 y 40 años7,8. Es de origen odontogénico en un 90% de los casos y se inicia con frecuencia en una infección del tercer molar o en una pericoronitis en los cordales incluidos2,5,8. Los factores predisponentes incluyen una pobre higiene dental, caries, fracturas mandibulares, malnutrición, adicción a drogas por vía parenteral, diabetes, sida, inmunosupresión y lupus eritematoso8. Los pacientes presentan fiebre, dolor y dificultad al tragar, habitualmente sin trismus3. Se produce edema suprahiodeo con hinchazón dolorosa del suelo de la boca y desplazamiento posterior de la lengua9. La celulitis tiende a extenderse rápidamente a ambos lados de las partes blandas de la cavidad oral a través de las comunicaciones entre los espacios submandibular y sublingual, pudiendo alcanzar la epiglotis3. La formación de absceso no es frecuente1,2,5,7. Tampoco suelen asociarse adenopatías cervicales1,3. La mandíbula y la fascia cervical profunda tienden a dirigir el edema y la inflamación hacia la base lingual y los espa- C Figura 1. Varón con dolor facial izquierdo y fiebre de 3 días de evolución. Los cortes coronal y axiales de la tomografía computarizada demuestran trabeculación de planos grasos y cambios miosíticos con engrosamiento del músculo masetero y del platisma (flechas). Se objetiva esclerosis parcial de las ramas vertical y horizontal izquierdas de la mandíbula junto a un absceso peridental con lisis ósea que afecta a los márgenes bucal y lingual, así como la formación de un mínimo absceso subperióstico (cabezas de flecha). 0-3 Capt 43.pag.indd 22 26/4/12 18:31:38 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas cios parafaríngeos con alta probabilidad de obstrucción de la vía aérea, lo que hace que el control de la permeabilidad aérea sea prioritario1,5,8,9. La infección puede propagarse al espacio retrofaríngeo y extenderse al mediastino condicionando mediastinitis, empiema o pericarditis8. La TC con contraste i.v. muestra la inflamación flemonosa afectando a los espacios sublingual y submandibular bilateralmente y permite confirmar el origen dental de la infección. Demuestra el grado de compromiso de la vía aérea, los cambios inflamatorios (miositis con captación de contraste y trabeculación de planos grasos), la eventual presencia de gas y los signos de formación de absceso con captación de contraste periférica a la colección9. Los abscesos intraamigdalinos son raros 5, pero las amigdalitis y los abscesos periamigdalinos constituyen las infecciones más comunes de los tejidos blandos de cabeza y cuello1,10. Se dan especialmente en pacientes jóvenes y adolescentes, generalmente como complicación de episodios repetidos de amigdalitis bacterianas agudas. La afectación normalmente es unilateral y los pacientes presentan dolor de garganta, fiebre, disfagia, otalgia refleja, dificultad para hablar y trismus por espasmo del músculo pterigoideo. Pueden aparecer adenopatías homolaterales. Los abscesos periamigdalinos suelen desarrollarse entre la cápsula amigdalina y el músculo constrictor superior y, en ocasiones, pueden extenderse a los espacios parafaríngeo, masticador, submandibular o retrofaríngeo desde la adenitis secundaria de las cadenas glanglionares retrofaríngeas7. La localización más común del absceso es en el polo superior de la amígdala5,10. En la patogénesis de la formación de estos abscesos en pacientes amigdalectomizados se han implicado a las glándulas salivales de Weber1. Aunque el diagnóstico de estos casos es clínico, en los casos dudosos, en los que no es posible realizar una adecuada exploración, en pacientes en los que se sospecha complicaciones y en los que no responden al tratamiento está indicada la realización de TC con contraste i.v.4,7. Aunque la TC es sensible para detectar la formación de absceso periamigdalar puede ser difícil diferenciar cambios flemonosos severos de absceso. Los hallazgos de la TC en la amigdalitis son el aumento de volumen bilateral y medialización amigdalar, y la captación de contraste de morfología estriada de las amígdalas palatinas y de los tejidos blandos parafaríngeos posteriores1,5. Característicamente, el absceso se identifica por la presencia de licuefacción con captación periférica de contraste (fig. 2). En los pacientes con infecciones no controladas que se complican con adenitis supurada retrofaríngea, la TC puede mostrar hipodensidad ganglionar sin o con captación de contraste periférica dependiendo del grado evolutivo7. En ocasiones la ecografía intraoral puede también ayudar a visualizar la presencia de absceso10. Los abscesos orofaríngeos pueden complicarse con mediastinitis aguda que rápidamente puede progresar a sepsis. A esta entidad se le denomina mediastinitis necrosante descendente. La incidencia de esta complicación es baja, pero condiciona una mortalidad de hasta el 40%5,11. La infección progresa desde la cavidad oral y la orofaringe al 0-3 Capt 43.pag.indd 23 23 mediastino a través de planos comunicantes delimitados por las fascias que conectan estas estructuras condicionando inflamación difusa y un proceso supurativo del mediastino. Además, el espacio pretraqueal conduce al pericardio, de forma que la infección que se extiende a ese nivel puede acompañarse de pericarditis y empiema supurativo11. En general, en estos pacientes los hallazgos clínicos predominantes son los relacionados con la infección cervical, de forma que la afectación mediastínica puede pasar inicialmente desapercibida. Ante la mínima sospecha de mediastinitis necrosante descendente debe realizarse una TC cervical y torácica con contraste i.v. que confirmará el diagnóstico y aportará información de la extensión del proceso5,11. Los signos que muestra la TC incluyen la presencia de celulitis con densificación de planos grasos y miositis cervical, colecciones cervicales sin o con gas (fig. 3) y densificación de la grasa con colecciones con gas en mediastino, pleura y pericardio (fig. 4). En ocasiones se puede asociar trombosis vascular y adenopatías. Adicionalmente, la TC también es útil para valorar el correcto drenaje de colecciones11. Infecciones hipofaríngeas La epiglotitis constituye una afectación infecciosa que progresa rápidamente y puede poner en riesgo la vida del paciente si no se asegura la permeabilidad de la vía aérea, especialmente en niños. La infección de la epiglotis y de las estructuras supraglóticas en el adulto se conoce como supraglotitis tendiendo a afectar más a estructuras supraglóticas que a los niños5. Implica celulitis epiglótica, de repliegues ariepiglóticos, valéculas y de las partes blandas adyacentes. Estos pacientes presentan una progresión más indolente y con menor riesgo de compromiso crítico de la vía aérea que los niños. En la actualidad la incidencia de la epiglotitis en adultos parece ir aumentando desde la implantación de la vacuna de Haemophilus influenzae en los niños1,5. En adultos debe considerarse también la etiología tuberculosa (fig. 5). Los pacientes presentan estridor, disfagia y fiebre. El diagnóstico de esta patología, especialmente en niños, es clínico, pero en ocasiones dudosas la TC con contraste i.v. permite dimensionar la extensión del proceso infeccioso demostrando los cambios inflamatorios y las posibles complicaciones, como la presencia de abscesos o de epiglotitis necrosante5. La TC en los adultos puede mostrar cambios inflamatorios del platisma y de los planos grasos adyacentes con engrosamiento epiglótico (fig. 6), de repliegues aritenoepiglóticos, bandas, cuerdas vocales y de la pared faríngea posterior7. Infecciones retrofaríngeas y del espacio peligroso Los espacios retrofaríngeo y el peligroso se localizan entre la faringe y el esófago y el margen anterior de la 26/4/12 18:31:38 Radiología de cabeza y cuello 24 A C B D Figura 2. Varón de 37 años, con antecedentes de desbridación de 2 abscesos periamigdalinos que presenta un nuevo episodio de odinofagia, disfagia, fiebre y otalgia refleja derecha de 1 semana de evolución. En la RM con contraste, en secuencia de T1 y supresión de grasa, se aprecia asimetría amigdalar y periamigdalar con engrosamiento y realce de la señal que incluye a la grasa parafaríngea del lado derecho. Se identifica un absceso periamigdalino (flechas) situado por detrás y en los márgenes laterales de la amígdala (cabeza de flecha). 0-3 Capt 43.pag.indd 24 26/4/12 18:31:39 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas A 25 B Figura 3. Mujer de 54 años de edad, con flemón dentario derecho de 9 días de evolución con empeoramiento de la clínica a pesar del tratamiento antibiótico. Acude con importante hinchazón hemifacial y submaxilar derechas y trismus. La tomografía computarizada con contraste intravenoso demuestra la presencia de un absceso submaxilar (que afecta también a la glándula) y submental, con paredes que captan de forma irregular y gas en su interior que se extiende a los espacios sublingual y submandibular (flechas). Hay asimetría facial con severos cambios inflamatorios, engrosamiento del platisma y aumento de la densidad en los planos grasos subcutáneos, del suelo de la boca y parafaríngeos. También se aprecian adenopatías regionales reactivas. columna vertebral. El espacio retrofaríngeo es el más anterior y se extiende desde la base de cráneo hasta aproximadamente el nivel C7/T41,2. La fascia visceral anterior permite que desde el espacio retrofaríngeo alrededor del espacio visceral se extiendan los procesos infecciosos hasta el mediastino superior y anterior, lo que permite la infección pleural y pericárdica3. La etiología más frecuente de formación de colecciones purulentas retrofaríngeas en niños es la adenitis supurativa de la cadena linfática cervical profunda3 secundaria a procesos infecciosos nasofaríngeos, adenoideos y de los senos paranasales posteriores10,12. Estas cadenas ganglionares se atrofian habitualmente en la pubertad10. Otras causas de abscesos retrofaríngeos (más frecuentes en adultos) incluyen faringitis, infecciones de la cavidad oral, otitis, heridas esofágicas y faríngeas posteriores, cuerpos extraños, complicación de osteomielitis, discitis o cirugía cervical, y extensión de la infección desde otros espacios cervicales comunicantes. Estos abscesos son cada vez más frecuentes en pacientes inmunodeprimidos y en enfermos con infección espinal secundaria a traumatismo5. Los abscesos retrofaríngeos pueden ser predominantemente laterales o mediales en función de su origen y pueden extenderse a los espacios prevertebral y peligroso. La extensión del proceso infeccioso al espacio peligroso (área de tejido conectivo que se localiza por detrás del retrofaríngeo y por 0-3 Capt 43.pag.indd 25 delante del prevertebral que se extiende desde la base de cráneo hasta el diafragma) permite progresar las infecciones a esas localizaciones3. Las infecciones en este espacio pueden extenderse, debido al poco tejido conectivo que lo rellena, hasta el mediastino posterior2 y el pericardio, con el riesgo de taponamiento cardíaco. En ocasiones llegan al retroperitoneo. Los pacientes con abscesos en los espacios retrofaríngeo y peligroso presentan fiebre, odinofagia, disfagia, disnea y limitación de la rotación cervical con ladeo contralateral de la cabeza. Los síntomas pueden sugerir osteomielitis cervical, tendinitis calcificada del músculo longus colli o meningitis. No es infrecuente la presencia de adenopatías cervicales10. Los pacientes pueden presentar distrés y obstrucción de la vía respiratoria por compresión y dolor pleurítico en relación con mediastinitis. Además, la ruptura de un absceso retrofaríngeo a la faringe o la eventual erosión por el absceso de las arterias o venas cervicales constituyen complicaciones prácticamente letales. En ocasiones, estos abscesos pueden extenderse a la columna y al espacio epidural5. Adicionalmente, la dificultar para tragar puede condicionar neumonía por aspiración. Con técnicas de imagen no es posible diferenciar el espacio retrofaríngeo del peligroso1. Las infecciones en estos espacios pueden condicionar cambios flemonosos y abscesos que pueden resultar difíciles de diferenciar 1. 26/4/12 18:31:39 Radiología de cabeza y cuello 26 A B D C E F Figura 4. Mujer de 24 años, con antecedentes de exodoncia de la pieza 18, que acude a urgencias por un cuadro de trismus, odinofagia, disfagia y edema facial. La tomografía computarizada con contraste intravenoso muestra la solución de continuidad ósea de la exodoncia (flecha), el engrosamiento de la musculatura mastoidea y pterigoidea, el aumento de la densidad de los planos grasos parafaríngeos y del espacio masticador con la presencia de gas (flecha) adyacente al margen externo de la rama vertical mandibular, y un absceso (cabezas de flecha) afectando al músculo pterigoideo medial y al espacio parafaríngeo progresando posterior y caudalmente hacia el espacio retrofaríngeo y por detrás de la glándula submaxilar hasta alcanzar los tejidos blandos peritiroideos. Se aprecian intensos cambios edematosos en planos grasos cervicales anteriores y laterales de predominio derecho, en el músculo platisma, en el suelo de la boca y en el mediastino superior. A B Figura 5. Varón de 60 años de edad, ex fumador desde hace 5 años que presenta infiltrados pulmonares y odinofagia, sensación de cuerpo extraño faríngeo y fiebre intermitente de predominio vespertino de 2 meses de evolución. Las biopsias pulmonar y del surco glosoamigdalino corresponden a tuberculosis pulmonar y supraglótica. La tomografía computarizada con contraste intravenoso demuestra engrosamiento asimétrico de la base de ambos pilares amigdalinos, aumento de la densidad de las paredes laterales faríngeas, epiglotis, planos grasos parafaríngeos (flechas) y adenopatías necróticas (cabeza de flecha), todo ello congruente con cambios inflamatorios secundarios al proceso infeccioso. Adicionalmente se aprecia bocio. 0-3 Capt 43.pag.indd 26 26/4/12 18:31:40 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas En pacientes con abscesos retrofaríngeos, una proyección radiográfica lateral puede mostrar engrosamiento de este espacio con eventual presencia de nivel hidroaéreo sin o con un cuerpo extraño5,10. En estos casos, la TC o la RM con contraste i.v. demuestra la extensión del proceso, el posible compromiso vascular, y ayuda a diferenciar entre los cambios inflamatorios y las colecciones purulentas 5,10,12 (figs. 7 y 8). Adicionalmente pueden mostrar cuerpos extraños relacionados con el origen de la infección12. Debido a su disponibilidad, rápida adquisición y capacidad multiplanar, la TC es la técnica de imagen más usada en estos procesos, mostrando los abscesos como colecciones hipodensas rodeadas de un anillo de captación de contraste5, aunque hay que tener en cuenta que en esta localización los abscesos no siempre presentan este aspecto clásico2. El compromiso vascular puede manifestarse por trombosis venosa yugular, seudoaneurisma y vasospasmo de la arteria carótida5, normalmente sin compromiso neurológico asociado1. En las linfoadenitis supurativas la TC puede mostrar áreas hipodensas con captación anular en los ganglios afectados5, que traduce supuración o abscesos en función del estado evolutivo. El tratamiento antibiótico puede ser suficiente si no hay complicación mediastínica. En los casos en los que se produce una mediastinitis necrosante, el desbridamiento quirúrgico y el drenaje mediastínico urgente se relacionan directamente con la mejor evolución del paciente3. 27 Las infecciones de este espacio se originan en procesos infecciosos discales y/o espinales, o como complicación de instrumentación traqueal o esofágica. Los factores de riesgo en la espondilodiscitis piógena son inmunosupresión, alcoholismo, diabetes y uso de drogas por vía i.v.3,5. Los pacientes con discitis presentan síntomas que incluyen dolor cervical, fiebre y, en ocasiones, signos de mielopatía. Contrariamente, los abscesos prevertebrales Infecciones del espacio prevertebral Este espacio se localiza entre la fascia prevertebral y los cuerpos vertebrales, y se extiende desde la base de cráneo hasta el coxis3,11. Al contrario del espacio peligroso, este espacio contiene abundante tejido fibroso que tiende a contener las infecciones2. A B Figura 6. Varón de 45 años, con disfagia y fiebre de 3 días de evolución con cambios edematosos e inflamatorios supraglóticos e intensa odinofagia que impide completar la exploración física. En la tomografía computarizada con contraste intravenoso se aprecia engrosamiento y aumento de la densidad de la epiglotis. C D Figura 7. Mujer de 91 años de edad, diabética, que presenta cuadro de 2 días de evolución de fiebre, odinofagia, trismus y aumento del volumen cervical. A la exploración se aprecia edema e hiperemia amigdalina derecha. La tomografía computarizada con contraste intravenoso muestra un absceso periamigdalar derecho con gas en su interior (flechas) e importantes cambios edematosos parafaríngeos, retrofaríngeos, en el suelo de la boca y supraglóticos (cabezas de flecha) con estenosis de la vía aérea. 0-3 Capt 43.pag.indd 27 26/4/12 18:31:41 Radiología de cabeza y cuello 28 A B D C E Figura 8. Varón de 39 años de edad, con cuadro de amigdalitis de predominio derecho con odinofagia y fiebre de 4 días de evolución, con tratamiento antibiótico mal seguido. Acude al hospital por aumento de la fiebre y la odinofagia más disfagia y malestar general. La resonancia magnética cervical con contraste en la secuencia de T1 con supresión de grasa demuestra severos cambios inflamatorios con importante realce de la señal en la zona retroamigdalar derecha, que se extienden a los espacios parafaríngeo y retrofaríngeo del mismo lado (flechas). Destaca la presencia de adenitis asociada predominante en la cadena linfática retrofaríngea. Se identifica exudado en el margen medial del músculo pterigoideo que progresa caudalmente a nivel submaxilar y cambios edematosos que alcanzan las fascias musculares y la grasa hipofaríngea del mismo lado, extendiéndose a los espacios retrofaríngeo y prevertebral (cabezas de flecha). En la exploración quirúrgica no se apreciaron colecciones de abscesificación concluyentes. pueden ser difíciles de diagnosticar debido a que sólo el 75% de pacientes presenta dolor local, el 50% fiebre y sólo el 30% síntomas neurológicos relacionados. Estos abscesos pueden complicarse con abscesos epidurales que pueden condicionar compresión medular con parálisis irreversible en un 4-22% de los casos3. En la evolución de la afectación infecciosa discal y vertebral puede aparecer inestabilidad espinal. 0-3 Capt 43.pag.indd 28 En los pacientes con espondilodiscitis, los estudios de imagen generalmente ponen de manifiesto la afectación discal y de los 2 cuerpos vertebrales adyacentes. La TC muestra cambios iniciales con pérdida de la altura discal y erosiones en las plataformas y, posteriormente, eventual colapso vertebral y masa de tejidos blandos paravertebral y/o epidural con o sin colecciones asociadas5. Además, la TC permite realizar punción guiada para tipificar el ger- 26/4/12 18:31:42 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas men etiológico antes del tratamiento antibioticoterápico. La sensibilidad en la identificación del germen con esta técnica es de un 77% mientras que la del hemocultivo es del 58%5. La RM es la técnica más sensible para detectar osteomielitis (con hiposeñal en secuencias potenciadas en T1 y alta señal en las ponderadas en T2), abscesos epidurales5 y el compromiso del cordón medular (fig. 9). Las secuencias T1 con saturación grasa y contraste i.v. suelen detectar bien el tejido flemonoso y los abscesos2. En estos pacientes, el disco intervertebral y el componente inflamatorio de partes blandas presentan captación de contraste i.v. relativamente homogéneo mientras que las colecciones purulentas persisten con señal similar al líquido con captación periférica de contraste (fig. 10). Debido a la gran extensión y comunicaciones de este espacio, en pacientes con abscesos epidurales pueden verse también abscesos de músculo psoas3. Aunque hay controversia respecto al tratamiento quirúrgico con drenaje de las colecciones, parece que muchos pacientes tratados con cirugía temprana presentan menor morbilidad y mortalidad 3. La descompresión quirúrgica está claramente indicada en los casos de compresión medular y la estabilización instrumentada espinal en los casos con inestabilidad5. Infecciones del espacio parafaríngeo El espacio parafaríngeo representa el centro anatómico de las infecciones de los tejidos profundos del cuello3. Está dividido por el proceso estiloideo en anterior (relacionado con la fosa amigdalar y el músculo pterigoideo) y posterior (que contiene el paquete carótido/nervioso). También hay comunicación con la celda parotídea y, además, en el margen posterior comunica libremente con el espacio retrofaríngeo. Las infecciones no surgen primariamente en este espacio2, se originan con mayor frecuencia por episodios de amigdalitis y en menos casos por faringitis3, otitis media, mastoiditis, parotiditis, afecciones dentales, linfadenitis y también por extensión de procesos infecciosos desde los espacios submandibular, retrofaríngeo y masticador (fig. 11). Las manifestaciones clínicas están vinculadas al espacio que está afectado; así, la infección del compartimiento anterior cursa habitualmente con fiebre, escalofríos, hinchazón por debajo del ángulo mandibular y eritema lateral del cuello, trismus, torticollis por espasmo muscular y adenopatías cervicales. También puede asociarse odinofagia, disfagia y disnea. Si el absceso se localiza en el espacio posterior, los signos clínicos se caracterizan por fiebre, septicemia con mínimo dolor o trismus10. En los pacientes con trombosis venosa se observa eritema y masa palpable cervical5. Algunos pacientes no presentan signos de localización de la infección y pueden debutar con sepsis de origen desconocido3. Las complicaciones se dan especialmente en las infecciones del espacio posterior e incluyen distrés respiratorio, edema laríngeo, obstrucción de la 0-3 Capt 43.pag.indd 29 29 vía aérea, septicemia, extensión infecciosa intracraneal y neumonía. En ocasiones, y con más frecuencia en pacientes sanos adolescentes y jóvenes13, se produce tromboflebitis supurativa yugular secundaria a trombosis séptica3 combinada con sepsis y abscesos metastásicos diseminados2 (síndrome de Lemierre) en pulmones, articulaciones, músculos, tejidos blandos, hígado, bazo, riñones y sistema nervioso central13. La eventual extensión de la infección a los espacios retrofaríngeo y carotídeo puede condicionar la aparición de mediastinitis y síndrome de Horner o de parálisis de los nervios IX y XII3. Las posibles complicaciones arteriales incluyen arteritis carotídea, que normalmente no se asocia a estrechamiento de su luz1, seudoaneurisma como complicación de la arteritis y también, eventualmente, erosión de la pared carotídea, que puede asociarse a hemorragia por el conducto auditivo externo10. La ruptura carotídea con elevada morbilidad y mortalidad puede acompañarse de la emisión de pequeños trombos precursores del episodio3. La muerte súbita de algunos pacientes se ha atribuido a compromiso del nervio vago3. La TC con contraste i.v. o la RM son útiles para diferenciar entre los 2 patrones de infección3, evaluar el alcance del proceso (fig. 12) y detectar las posibles complicaciones vasculares10. En el síndrome de Lemierre, la TC cervical muestra los cambios inflamatorios de planos grasos, el trombo y el aumento del tamaño de la vena trombosada con captación de contraste parietal1,9. La TC de tórax y abdomen puede evidenciar los émbolos sépticos en pulmones, bazo e hígado9 (fig. 13). En estos pacientes el desbridamiento quirúrgico es especialmente importante cuando las infecciones se producen en espacio anterior, donde la liquefacción de la grasa por el proceso infeccioso tiende a generar moderadas cantidades de material purulento3. El papel de la anticoagulación en el síndrome de Lemierre está en discusión13. Las complicaciones arteriales se tratan con ligadura, oclusión o la colocación de stent carotídeo. Linfadenitis cervical La linfadenitis cervical es la inflamación de uno o más ganglios del cuello. Puede originarse en microorganismos de la piel o de la mucosa orofaríngea y, con mayor frecuencia, en faringitis y amigdalitis10. Otras causas pueden ser abscesos dentales, impétigo facial, acné y otitis externa10. También puede tener su origen en una infección sistémica o como parte de una linfadenitis generalizada. El proceso inflamatorio condiciona aumento de tamaño de los ganglios por edema e infiltración celular, pudiéndose desarrollar necrosis y microabscesos que pueden evolucionar a abscesos francos y supuración. Algunos procesos inmunológicos y tumoraciones malignas también pueden producir un cuadro clínico e histológico similar10. La linfadenitis reactiva es más prevalente entre la población infantil preescolar mientras que en los adultos las adenopatías suelen ser de origen neoplásico. 26/4/12 18:31:42 Radiología de cabeza y cuello 30 A C B D Figura 9. Paciente de 36 años, natural de Pakistán, que presenta síndrome constitucional con pérdida de peso, fiebre de predominio vespertino de 2 meses de evolución y cervicalgia. En resonancia magnética de columna cervical existe hiperseñal en secuencias T2 en varios cuerpos vertebrales (flechas), con realce de la señal tras la administración de contraste (cabezas de flecha) en la secuencia de T1 con supresión de grasa, asociado a la presencia de colecciones prevertebrales con realce de la señal periférica y extensión epidural, esta última sin imagen de abscesificación (estrellas). Se confirmó etiología tuberculosa mediante punción. 0-3 Capt 43.pag.indd 30 26/4/12 18:31:42 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas A B D 31 C E Figura 10. Paciente de 38 años, que acude por dolor cervical irradiado a hombro izquierdo de 3 semanas de evolución, sin respuesta a tratamiento antiinflamatorio. En la radiografía cervical de perfil se aprecia disminución de altura del espacio discal C5-C6 con irregularidad y deformidad epifisaria. En resonancia magnética se confirma el hallazgo, existiendo hiperseñal del disco en secuencias T2 (cabeza de flecha) junto con engrosamiento de partes blandas a nivel prevertebral y epidural (flechas), con realce de la señal en las secuencias realizadas tras la administración de contraste (estrellas). El hemocultivo fue positivo para Eikenella corrodens, detectándose patología inflamatoria dental. Los pacientes con linfadenitis infecciosa muestran aumento del perímetro cervical y fiebre alta, y pueden presentar nódulos cervicales y eritema. La linfadenitis cervical también puede ser secundaria a tuberculosis. En la actualidad, la linfadenitis cervical tuberculosa o escrófula es más prevalente en pacientes con inmunodeficiencia adquirida5,7, afectando con más frecuencia a ganglios de los 2 lados del 0-3 Capt 43.pag.indd 31 cuello y usualmente sin tuberculosis pulmonar o síntomas constitucionales asociados5. También debe incluirse en el diagnóstico diferencial de linfadenitis la mononucleosis infecciosa, la fiebre por arañazo de gato, la sarcoidosis, la infección por virus de la inmunodeficiencia humana (VIH), los tumores hematológicos o los de otra etiología. En los pacientes con linfadenitis complicada puede apreciarse 26/4/12 18:31:43 Radiología de cabeza y cuello 32 A C B D Figura 11. Varón de 55 años de edad, derivado a urgencias por fiebre, trismus y tumefacción de hemicara y cervical izquierda por absceso periodontal que ha progresado desde hace 4 días a pesar del tratamiento antibiótico. La tomografía computarizada muestra un severo absceso parafaríngeo, periparotídeo y del suelo de la boca en el lado izquierdo con importante cantidad de gas en su interior (flechas) que compromete la vía aérea. Hay importantes signos flogóticos pterigoideos, maseteros, platisma, parotídeos y de los planos grasos adyacentes. 0-3 Capt 43.pag.indd 32 26/4/12 18:31:43 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas A 33 B C Figura 12. Varón de 45 años de edad, con fiebre, odinodisfagia intensa y otalgia refleja izquierda de 48 h de evolución. A la exploración se aprecia edema del pilar amigdalino posterior, hiperemia faríngea y abombamiento de la pared hipofaríngea izquierda. La tomografía computarizada con contraste intravenoso demuestra edema parafaríngeo y un absceso parafaríngeo anterior izquierdo (flechas) con compresión y disminución parcial de la vía aérea. Hay importantes cambios edematosos en el espacio retrofaríngeo (cabezas de flecha). También se visualizan adenopatías inflamatorias regionales. 0-3 Capt 43.pag.indd 33 26/4/12 18:31:44 Radiología de cabeza y cuello 34 A B C E F D Figura 13. Varón de 26 años de edad, sin hábitos tóxicos ni antecedentes patológicos de interés que presenta clínica de una semana de evolución de disfagia y fiebre alta con trismus que impide la exploración. La tomografía computarizada (TC) cervical con contraste intravenoso muestra asimetría amigdalar con engrosamiento del lado izquierdo (flecha en A), que corresponde a un flemón periamigdalar con aumento de la densidad de los planos grasos parafaríngeos y tumefacción inflamatoria de la musculatura pterigoidea del mismo lado. Signos de tromboflebitis de yugular homolateral (flechas). En la TC de tórax se identifican múltiples focos cavitados parenquimatosos periféricos correspondientes a abscesos (cabezas de flecha). celulitis, bacteriemia, sepsis, toxicidad, trombosis yugular, émbolos sépticos, mediastinitis y pericarditis10. La ecografía cervical es muy útil para determinar las características sólidas o quísticas de los nódulos ganglionares10 (fig. 14). Con frecuencia, en pacientes con escrófula la TC con contraste cervical puede mostrar un mazacote de nódulos con múltiples áreas hipodensas necróticas con captación anular de contraste7, que en una fase crónica pueden estar calcificados 5. Estas lesiones tuberculosas 0-3 Capt 43.pag.indd 34 abscesificadas pueden ser difíciles de diferenciar de un extenso tumor y/o de un mazacote adenopático necrótico, pero los síntomas asociados y la historia clínica ayudarán a diferenciar estos dos procesos5. Muchos pacientes con linfadenitis infecciosa sólo requieren el tratamiento de la infección orofaríngea desencadenante. El tratamiento precoz con antibióticos de la linfadenitis piogénica previene en muchos casos la evolución a supuración10. 26/4/12 18:31:44 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas 35 Tiroiditis supurada Aunque la tiroiditis piógena es mucho menos frecuente que las tiroiditis subaguda y crónica, el reconocimiento clínico de esta infección es esencial10, ya que se trata de un proceso que puede progresar rápidamente y comprometer la vía aérea poniendo en riesgo la vida del paciente. La resistencia a la infección de la glándula tiroides se atribuye a su alta concentración de yodo, a su rica suplencia vascular y linfática, así como a su encapsulación10,14. El origen de la tiroiditis supurada es con más frecuencia hematógeno15, pero también por diseminación directa de una fístula o quiste tirogloso o de una perforación esofágica o cutánea. La presencia de adenoma o bocio y la inmunosupresión, especialmente el sida10,14, son factores predisponentes. La infección de un quiste de un bocio puede extenderse y afectar a un lóbulo o a toda la glándula. Desde ahí el proceso infeccioso puede extenderse de forma local o sistémica con el consiguiente riesgo vital por obstrucción o perforación traqueal, rotura del absceso tiroideo, neumonía, infección metastásica, sepsis, mediastinitis o pericarditis. Los pacientes con tiroiditis supurada presentan dolor e hinchazón de la cara anterior del cuello que se moviliza con la deglución, sin o con fiebre. En esta fase puede ser difícil de diferenciar de otros procesos tiroideos no agudos10. En días o semanas posteriores aparece calor local, fiebre, eritema, disfagia, disfonía, ronquera y faringitis e hipotiroidismo transitorio. Como complicaciones severas puede ocurrir compresión traqueal, necrosis de la glándula, ruptura del absceso con extensión a estructuras vecinas y síndrome de Lemierre. La gammagrafía tiroidea puede mostrar disminución de la captación de radioyodo en el lóbulo afectado. Pruebas de imagen como la ecografía y la TC son útiles para excluir la extensión del absceso fuera de la cápsula tiroidea. En la ecografía, la glándula aparece desestructurada con posibles abscesos que pueden presentar material degradado en su interior y/o hemorragia14. La ultrasonografía tiroidea ayuda a diferenciar a la tiroiditis supurada de otros procesos y permite el drenaje percutáneo de los eventuales abscesos. La TC y la RM están indicadas cuando la ecografía no es concluyente o cuando existe la sospecha clínica de complicación10 y facilitan mayor información respecto a la extensión del proceso14. La TC multiplanar con contraste i.v. puede mostrar captación heterogénea de la glándula con cambios inflamatorios periglandulares y eventuales colecciones hipodensas con margen isodenso (con respecto a la glándula) correspondientes a abscesos14. La RM en los abscesos muestra el típico aspecto de colección, hipointenso en secuencias potenciadas en T1 e hiperintenso en secuencias ponderadas en T2 con distinta señal dependiendo de la celularidad o material que haya en su interior14. El drenaje quirúrgico se impone en los casos en los que clínica y radiológicamente se observa absceso o si existe la evidencia de formación de gas10. En los casos en que la infección persiste o hay mucha necrosis puede ser necesaria la lobectomía tiroidea. 0-3 Capt 43.pag.indd 35 Figura 14. Mujer de 61 años de edad, sin hábitos tóxicos, con antecedentes hace 30 años de enfermedad pulmonar (desconoce el diagnóstico) que presenta adenopatía palpable cervical anterior derecha y pérdida de peso de meses de evolución. La ecografía cervical muestra 3 adenopatías desestructuradas, la mayor de 28 × 19 mm, sin registro Doppler valorable (flecha) localizadas a nivel cervical anterior bajo derecho. La tomografía computarizada demuestra varias adenopatías en área III/IV del lado derecho destacando una de 30 × 20 mm (flecha), que se resecó quirúrgicamente, correspondiendo a adenitis por Mycobacterium tuberculosis complex. 26/4/12 18:31:45 Radiología de cabeza y cuello 36 Infecciones de las glándulas salivares Del 80 al 90% de los pacientes con submaxilitis presenta litiasis en el conducto de drenaje glandular. Las litiasis son más frecuentes en el conducto submaxilar7 que en el parotídeo debido a que es más grueso, tiene mayor diámetro, su recorrido es ascendente, presenta estasis salivar y, además, la saliva tiene un contenido más mucinoso y alcalino. La submaxilitis secundaria a obstrucción del conducto de drenaje por procesos neoplásicos del suelo de la boca es frecuente5. Los pacientes con submaxilitis aguda presentan cólicos salivares con dolor e inflamación que empeoran con la comida1,5 (fig. 15). Los pacientes con submaxilitis crónica no presentan dolor y en lugar de hinchazón hay atrofia glandular secundaria a la estasis crónica generada por el cálculo5. La TC muestra una glándula submaxilar unilateralmente engrosada y captante con dilatación ductal y en ocasiones la presencia de cálculo. Es frecuente que se acompañe de signos radiológicos de miosistis y celulitis de los espacios sublingual y submaxilar5. La parotiditis puede ser viral, bacteriana o inducida por cálculos. La parotiditis viral es bilateral en el 75% de los casos5, y pueden estar afectadas las glándulas submaxilares y sublinguales. Usualmente no se acompaña de producción de material purulento10. El pico de prevalencia de la parotiditis viral se da a la edad de 5-9 años. La parotiditis aguda supurada es más frecuente que en otras glándulas salivares2,7 y se puede presentar en un úni- A B co episodio o de forma recurrente. Se origina en un foco séptico de la boca (amigdalar o dental). Habitualmente es unilateral y más frecuente en niños menores de 2 años y en personas mayores debilitadas5,10. Otros factores predisponentes son la deshidratación5,7, la inmunosupresión, la malnutrición, las neoplasias de la cavidad oral, la mala higiene dental, la sialectasia, la obstrucción ductal, la traqueostomía y en pacientes que toman diuréticos, antihistamínicos o fármacos tranquilizantes que tienden a disminuir el flujo de saliva10. Los pacientes presentan dolor, hinchazón e induración del área parotídea con fiebre y apariencia tóxica. También se ha descrito la parálisis facial asociada a absceso parotídeo4. En la parotiditis supurativa podemos evidenciar la salida de material purulento a través del conducto salivar cuando se aplica presión a la glándula inflamada5,7,10. Sin embargo, raramente este material purulento drena fuera de la cápsula parotídea10. Las complicaciones de la parotiditis supurada incluyen la ruptura del absceso con la diseminación a los espacios parafaríngeos y otros espacios profundos del cuello, tromboflebitis, con menos probabilidad la paresia del VII par5, y absceso cerebral4. En algunos pacientes puede evolucionar a bacteriemia y fallo multiorgánico10. La ecografía, frecuentemente, es el primer estudio de imagen que se realiza en estos casos, pudiendo mostrar heterogenicidad de la glándula y, eventualmente, absceso2. En la parotiditis supurativa, la sialografía puede demostrar dilataciones o destrucción ductal. La sialografía TC puede ayudar al diagnóstico diferencial con tumoraciones10. La TC con contraste i.v. demuestra la localización y extensión C Figura 15. Paciente de 42 años, al que se le realiza resonancia magnética cervical en la que se detectan unas imágenes arrosariadas correspondientes a litiasis en conducto de Wharton derecho (flechas), junto con realce de la señal, tras la inyección de contraste en la glándula submaxilar (cabezas de flecha) y en la adenopatía adyacente (estrella). 0-3 Capt 43.pag.indd 36 26/4/12 18:31:45 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas 37 del proceso, evidenciando colecciones, lo que permite una adecuada valoración prequirúrgica 4. Los hallazgos en la TC incluyen el aumento de tamaño de la gandula parótida con márgenes mal definidos y captación de contraste, dilatación ductal1,5 y engrosamiento de fascias adyacentes1,7 (fig. 16). En ocasiones se aprecian áreas hipodensas en la glándula correspondientes a abscesificación5. En el 90% de los casos, los cálculos parotídeos son radiolucentes en radiología convencional, pero visibles en la TC1,4. En la RM, la glándula aparece aumentada de tamaño e hiperintensa en secuencias potenciadas en T2 por la inflamación y el edema, y con intenso realce de la señal glandular en las secuencias T1 con saturación grasa, tras inyectar contraste7. En ocasiones puede visualizarse el sialolito como una hiposeñal puntiforme en todas las secuencias1. Los pacientes con infección por el VIH pueden presentar lesiones linfoepiteliales parotídeas benignas que en la TC y/o RM aparecen como múltiples lesiones sólido/quísticas, generalmente bilaterales5. En el tratamiento de la parotiditis supurada, la ecografía puede ser útil en el drenaje de colecciones4. La buena hidratación y una buena higiene dental, junto al control de infecciones orales, pueden reducir la aparición de parotiditis supurada. Celulitis y fascitis necrosante cervical La celulitis y la fascitis necrosante cervical son infecciones que se caracterizan por ser difusas e infiltrantes. La celulitis (erisipela) corresponde a una infección aguda de la piel y del tejido celular subcutáneo que generalmente se limita a la fascia superficial. La fascitis necrosante es una infección rápidamente progresiva que se extiende a la fascia superficial y a los planos profundos con necrosis bacteriana extensa y gangrena de la piel, del tejido celular subcutáneo, la grasa, la fascia superficial y profunda, los nervios, las arterias, las venas y, en estadios avanzados, los músculos15, con formación de múltiples colecciones líquidas. Puede originarse en la piel (traumas, quemaduras, picaduras de insectos), en la mucosa, en las piezas dentarias o en las amígdalas. El origen dental se da en más del 50% de los casos15. La fascitis necrosante es más frecuente en pacientes inmunodeprimidos, alcohólicos, trasplantados y adictos a drogas por vía parenteral15. Es común que en pacientes inmunodeprimidos la fascitis necrosante empiece como una celulitis7. Los pacientes diabéticos presentan mayor facilidad para la diseminación de la celulitis1,15. Sin embargo, el 25% de los casos de fascitis necrosante cervical no presenta factores sistémicos predisponentes15. La infección se extiende por las fascias y puede llegar al mediastino. El riesgo de mediastinitis es más frecuente en infecciones de origen dental, pero también puede surgir de perforaciones esofágicas secundarias a instrumentación o por cuerpos extraños1. Los síntomas incluyen dolor, decoloración y vesiculación de la piel, fiebre, toxicidad sistémica y sepsis. Si la enfermedad progresa aparece trombosis de los vasos dér- 0-3 Capt 43.pag.indd 37 Figura 16. Paciente de 94 años, que presenta cuadro de 24 h de fiebre, con dolor, tumefacción y eritema facial. La tomografía computarizada muestra importante aumento de tamaño de la glándula parótida izquierda, con ligera hipercaptación difusa (flechas), engrosamiento de platisma (cabezas de flecha) y trabeculación de la grasa adyacente (estrellas). micos, con isquemia y necrosis de tejido celular subcutáneo y piel15. El diagnóstico clínico puede ser difícil porque la presentación no es específica y puede simular otras formas de infección menos agresivas y, aunque es clave la presencia de gas en los tejidos1, no siempre está presente2. El diagnóstico precoz de esta entidad es esencial, ya que puede evolucionar de forma muy rápida con extensa destrucción tisular, sepsis, compromiso de la vía aérea y fallo sistémico. La mortalidad del proceso descrita clásicamente es del 50 al 75%, pero artículos recientes la consideran no superior al 10%15. 26/4/12 18:31:45 38 La TC con contraste define la extensión de la enfermedad, pudiéndose apreciar presencia de gas, engrosamiento e hipercaptación de fascias y grupos musculares, formación de colecciones líquidas1,15 y signos de celulitis7. La ecografía ayuda a demostrar y localizar las colecciones líquidas superficiales susceptibles de drenaje15. La ausencia de gas en la lesión impide el diagnóstico de certeza entre celulitis y fascitis necrosante7. El drenaje quirúrgico precoz es especialmente importante en los casos complicados con mediastinitis. Absceso de Bezold Entidad descrita por Friedrich Bezold en 1881, se trata de un absceso cervical profundo secundario a mastoiditis coalescente que condiciona erosión de la punta de la mastoides con posterior progresión caudal del proceso purulento que se sitúa entre los músculos trapecio y esternocleidomastoideo. Desde ahí la infección puede extenderse a los espacios visceral, retrofaríngeo, prevertebral, espacio peligroso2 y al mediastino9. La TC con contraste i.v. muestra destrucción de las celdas con osteólisis de la punta de la mastoides y una colección inflamatoria, que capta contraste, en el espacio cervical posterior extendiéndose en profundidad al músculo esternocleidomastoideo1,9. La TC también detecta las posibles complicaciones como trombosis de seno transverso, o sigmoide o absceso cerebral. Lesiones quísticas y masas del cuello infectadas Las lesiones quísticas del cuello en general son no dolorosas y de lento crecimiento. Algunas se presentan en el nacimiento y otras aparecen a mediana edad. Estos procesos incluyen los quistes del conducto tirogloso, los quistes branquiales, el laringocele, los quistes de retención, el higroma quístico y el quiste dermoide10. Los síntomas de infección de una lesión quística cervical incluyen hinchazón con sensación de presión, eritema con calor local y aparición de ganglios cervicales reactivos. Habitualmente no se acompaña de síntomas sistémicos. La infección en un quiste cervical puede extenderse a las estructuras adyacentes pudiendo ocurrir drenaje de la supuración a fascias, a la orofaringe o a la tráquea10. En estos casos, la ecografía cervical es muy útil para caracterizar las lesiones quísticas cervicales y establecer el diagnóstico diferencial con otras entidades. La TC con contraste i.v. sugiere infección quística cuando se aprecia captación y engrosamiento de las paredes del quiste7 y, además, ayuda a la planificación quirúrgica. La resección completa después del episodio agudo tratado con antibióticos confirma el diagnóstico y excluye la posibilidad de malignización que también puede asociarse con la infección10. 0-3 Capt 43.pag.indd 38 Radiología de cabeza y cuello Los quistes del conducto tirogloso resultan de anomalías embriológicas en el descenso de la glándula tiroidea y constituyen las masas congénitas cervicales más frecuentes localizándose casi siempre en la línea media10. Si estos quistes se infectan el paciente presenta hinchazón con eritema en el margen anterior del cuello. En estos casos se debe tratar la infección con antibióticos y cuando está resuelta plantear resección quirúrgica. Los quistes de la hendidura branquial son masas cervicolaterales, a menudo indolentes, que provienen del desarrollo anormal de un arco branquial (fig. 17). Suelen aparecer en adultos jóvenes y en su gran mayoría dependen del segundo arco. En ocasiones estas lesiones pueden sangrar o infectarse pudiendo incluso fistulizar. El tratamiento quirúrgico definitivo es fundamental, ya que también existe el riesgo de malignización. El piolaringocele es una entidad poco frecuente que representa una infección en un ventrículo laríngeo dilatado. Se atribuye a la infección de un laringocele preexistente. Un laringocele es un saco de aire primitivo remanente relacionado con el ventrículo laríngeo que puede estar colapsado o lleno de aire. En ocasiones la comunicación con la vía aérea puede bloquearse, lo que favorece el acúmulo de líquido y su posterior sobreinfección. El paciente puede debutar con odinofagia, aspiración y compromiso respiratorio de forma que se trata de una emergencia cuyos signos es preciso conocer. La TC con contraste i.v. demuestra una colección líquida, con o sin aire en su interior, relacionada con el ventrículo laríngeo con extensión superolateral y a la grasa paraglótica. La hipercaptación de las paredes de la colección traduce los cambios inflamatorios1. La actinomicosis es una infección de curso crónico que tiene predilección por localizarse a nivel oral o mandibular, pero también en el cuello, apareciendo comúnmente como una masa palpable con un trayecto fistuloso7. Su aspecto en TC se ha descrito como una masa con captación gruesa de contraste periférica con centro hipodenso7. Artritis séptica espinal La artritis séptica facetaria espinal es una causa poco frecuente de infección del cuello. Lo habitual es que afecte a un solo nivel. El uso de drogas por vía i.v. y la inmunosupresión son factores predisponentes5. El paciente presenta dolor, aumento de la sensibilidad cervical y fiebre. La TC con contraste i.v. demuestra ensanchamiento articular, patrón lítico y escleroso óseo, derrame articular y edema periarticular, pudiendo observarse captación de contraste anular5. La RM con contraste es más sensible que la TC para detectar miositis, ostomielitis, inestabilidad vertebral, compromiso foraminal, abscesos paravertebrales y epidulares, lesión medular y meningitis5. La ecografía o la TC pueden ser útiles para obtener muestras de material para cultivo. 26/4/12 18:31:46 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas A 39 B C Figura 17. Paciente de 19 años, remitida por tumoración cervical, con signos clínicos de infección. La tomografía computarizada muestra una lesión quística (flechas) situada por detrás de la glándula submaxilar, medial a músculo esternocleidomastoideo, con pequeñas adenopatías (cabeza de flecha) y edema (estrella) adyacentes. La anatomía patológica confirma quiste branquial con componente inflamatorio. 0-3 Capt 43.pag.indd 39 26/4/12 18:31:46 Radiología de cabeza y cuello 40 En pacientes con compromiso epidural puede ser necesario el tratamiento quirúrgico con descompresión espinal. Patología inflamatoria cervical no infecciosa Tendinitis cálcica aguda del longus colli (tendinits retrofaríngea cálcica) Se trata de una entidad benigna y poco frecuente causada por el depósito de cristales de hidroxiapatita en la zona de la inserción del tendón del músculo longus colli asociada a inflamación de este músculo. Aunque típicamente la calcificación se sitúa a nivel C1-C2 afectando a la porción oblicua del músculo, también se ha descrito a la altura de C5-C6, lo que probablemente traduce su ubicación en relación con la inserción de la porción vertical muscular16. Su etiología no está aclarada y es posible que haya relación con traumas repetidos, presencia de tejido necrótico o isquemia17. Esta entidad afecta a adultos en un rango preferente de edad de 30 a 60 años17. Se cree que los síntomas se relacionan con la respuesta inflamatoria a cuerpo extraño generada por el depósito de cristales16,17. Los pacientes presentan dolor agudo/subagudo y rigidez cervical, disfagia, odinofagia y fiebre leve o moderada. No se observan adenopatías asociadas1,16. El diagnóstico de certeza es radiológico. Los hallazgos clásicos en las placas radiográficas simples incluyen la presencia de calcificaciones amorfas situadas por delante de los cuerpos vertebrales C1-C41 junto a engrosamiento de partes blandas prevertebrales. La TC con contraste i.v. es la técnica de elección para valorar esta entidad1,3,16. Se aprecia la calcificación mejor definida localizada en el espacio prevertebral y una hipodensidad edematosa del músculo longus colli que puede asociarse a efusión líquida desde C1 a C4-C55 (fig. 18). Este acúmulo de líquido se origina en el espacio prevertebral, pero puede extenderse al retrofaríngeo5. A diferencia de los pacientes con abscesos parafaríngeos, en estos casos no se observa la formación de colecciones con captación periférica de contraste5,16,17. Aunque la RM identifica mejor el edema de partes blandas, el líquido libre y el eventual edema de médula ósea vertebral, habitualmente no es necesaria para el diagnóstico1,17. La evolución tiende a la resolución espontánea y el tratamiento se basa en el uso de antiinflamatorios no esteroideos (fig. 19). Es muy importante reconocer este cuadro diferenciándolo de procesos infecciosos retrofaríngeos para evitar tratamientos más agresivos, especialmente la cirugía. Angioedema El angioedema puede producirse en cualquier parte del cuerpo, pero primariamente afecta a la cara, la lengua, los labios y la laringe. 0-3 Capt 43.pag.indd 40 Se trata de una inflamación transitoria que puede poner en peligro la vida del paciente por compromiso de la vía aérea. Su origen puede ser hereditario/familiar o adquirido, y puede estar relacionado con varios factores como alergias, drogas, picaduras de insectos, tintes y, en ocasiones, enfermedades subyacentes como leucemia o lupus. Los hallazgos en las pruebas de imagen varían, pero habitualmente se aprecian cambios edematosos, infiltrantes con engrosamiento mucoso circunferencial que condiciona grados variables de compromiso de la vía aérea5 (fig. 20). También se han descritos formas focales seudotumorales5. El tratamiento consiste en eliminar el factor desencadenante, añadir corticoides y antihistamínicos, y asegurar la permeabilidad de la vía aérea. Cambios inflamatorios inducidos por radiación En los pacientes irradiados por tumores de cabeza y cuello se produce mucositis, que puede asociarse a edema causado por el aumento de permeabilidad vascular. Estos cambios inflamatorios son notables especialmente entre las 2 y las 4 semanas del tratamiento radioterápico7. En estos pacientes también es común la presencia de sialoadenitis inducida por radiación. Como único síntoma suelen aquejar xerostomía7. En la TC con contraste podemos apreciar tumefacción e hipercaptación mucosa a nivel faríngeo, de repliegues, epiglótico y de bandas ventriculares, generalmente con una distribución simétrica7. En los casos con sialoadenitis, la TC con contraste i.v. en la fase aguda suele mostrar hipercaptación glandular y, con posterioridad, en una fase crónica evoluciona a atrofia. Otros cambios inflamatorios que pueden apreciarse son engrosamiento del platisma, trabeculación de planos grasos, edema retrofaríngeo7, retención salival y disminución de la luz de la vía aérea. Conclusiones La patología infecciosa cervical grave representa una urgencia médica que puede evolucionar rápida y fatalmente. Estos cuadros no deben subestimarse ya que, incluso pacientes con clínica leve o moderada, pueden presentar en forma hiperaguda complicaciones respiratorias o cardiovasculares. Estos casos deben ser atendidos en el ámbito de una unidad de cuidados intensivos por otorrinolaringólogos y personal especializado acostumbrado a tratar urgencias vitales. Junto a la valoración clínica, las pruebas radiológicas, especialmente la TC y en menor grado la RM, son esenciales. Muchos de estos pacientes son difíciles de explorar, por lo que la evaluación clínica es limitada y las pruebas de imagen fundamentales. Por su capacidad multiplanar, ambas técnicas son ideales para caracterizar y definir 26/4/12 18:31:46 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas A B D 41 C E Figura 18. Paciente varón de 38 años, que acude por cervicalgia de varios días de evolución, sin fiebre, odinofagia ni disfagia. A la exploración se evidencia limitación de la movilidad cervical por dolor. La radiografía lateral de columna cervical muestra aumento de partes blandas prevertebrales y una calcificación adyacente al margen inferior del arco anterior del atlas (flecha). En la tomografía computarizada se confirma la existencia de la calcificación grosera (flecha) junto con engrosamiento e hipodensidad de partes blandas prevertebrales (flechas en B). En una resonancia magnética, realizada 5 días después, se aprecia la calcificación tendinosa (flecha) y mínimo resto de líquido prevertebral (cabezas de flecha). colecciones y además permiten la valoración del compromiso de la vía aérea. En la práctica diaria, la TC es más utilizada debido a su mayor disponibilidad y rapidez de realización. Las indicaciones de cirugía urgente incluyen la evidencia de colecciones de tamaño > 3-3,5 cm, la extensión del absceso a más de 2 espacios distintos, las compli- 0-3 Capt 43.pag.indd 41 caciones vasculares, la implicación de los espacios prevertebral y visceral, y la extensión mediastínica2. En los casos en los que la TC no es concluyente, la RM muestra mayor sensibilidad. La ecografía es una herramienta que puede ayudar a identificar colecciones superficiales y permitir su drenaje percutáneo. Es muy importante que el radiólogo 26/4/12 18:31:47 Radiología de cabeza y cuello 42 A B Figura 19. Paciente de 56 años, que acude por cervicalgia de 4 días de evolución, sin fiebre y con discreta odinofagia. La tomografía computarizada muestra la típica calcificación por delante de C2 que en un control realizado a los 14 días se ha reabsorbido casi en su totalidad (flechas). A B Figura 20. Paciente varón de 72 años de edad con antecedentes de neoplasia laríngea tratada con laringectomía total más tratamiento quimio y radioterápico que, tras sesión de electroquimioterapia realizada a nivel de un mazacote adenopático residual laterocervical izquierdo, presenta de forma hiperaguda severo angioedema. La TC con contraste intravenoso muestra engrosamiento del platisma con intensos cambios edematosos y trabeculación de la grasa subcutánea a nivel faciocervical difuso. 0-3 Capt 43.pag.indd 42 26/4/12 18:31:47 Infecciones del cuello en adultos. ¿Una urgencia radiológica? Papel de las diferentes técnicas de imagen y consideraciones clínicas conozca bien la anatomía y las vías de diseminación de los procesos infecciosos en esta región, y que esté familiarizado con la utilización de estas técnicas diagnósticas de imagen. Bibliografía 1. Rana RS, Moonis G. Head and neck infection and inflammation. Radiol Clin North Am. 2011;49:165-82. 2. Lyle NJ, Rutherford EE, Batty VB. A pain in the neck - Imaging in neck sepsis. Clin Radiol. 2011;66:876-85. 3. Reynolds SC, Chow AW. Severe soft tissue infections of the head and neck: a primer for critical care physicians. Lung. 2009;187:271-9. 4. Kishore R, Ramachandran K, Ngoma C, Morgan NJ. Unusual complication of parotid abscess. J Laryngol Otol. 2004;118:388-90. 5. Capps EF, Kinsella JJ, Gupta M, Bhatki AM, Opatowsky MJ. Emergency imaging assessment of acute, non traumatic conditions of the head and neck. Radiographics. 2010;30:1335-52. 6. Schuknecht B, Stergiou G, Graetz K. Masticator space abscess derived from odontogenic infection: imaging manifestation and pathways of extension depicted by CT and MR in 30 patients. Eur Radiol. 2008:18:1972-9. 7. Ginsberg LE. Inflammatory and infectious lesions of the neck. Seminars in Ultrasound CT MR. 1997;118:205-19. 0-3 Capt 43.pag.indd 43 43 8. Marcus BJ, Kaplan J, Collins KA. A case of Ludwig angina. A case report and review of the literature. Am J Forensic Med Pathol. 2008;23:255-9. 9. Hoang JK, Eastwood JD, Glastonbury CM. What’s in a name? Eponyms in head and neck imaging. Clin Radiol. 2010;65:237-45. 10. Brook I. Non-odontogenic abscesses in the head and neck region. Periodontol 2000. 2009;49:106-25. 11. Scaglione M, Pezzullo MG, Pinto A, Sica G, Bocchini G, Rotondo A. Usefulness of multidetector row computed tomography in the assessment of the pathways of spreading of neck infections to the mediastinum. Semin Ultrasound CT MR. 2009;30:221-30. 12. Hoang JK, Branstetter BF, Eastwood JD, Glastonbury CM. Multiplanar CT and MRI of collections in the retropharyngeal space: is it an abscess? AJR Am J Roentgenol. 2011; 196:426-32. 13. Karkos PD, Asrani S, Karkos CD, Leong SC, Theochari EG, Alexopoulou TD, et al. Lemierre’s syndrome: a systematic review. Laryngoscope. 2009;119:1552-9. 14. Bravo E, Grayev A. Thyroid abscess as a complication of bacterial throat infection. Radiology Case. 2011;5:1-7. 15. Delaney P, Rafiq R, Dodd M. Craniocervical necrotising fasciitis—an interesting case with review of the literature. Br J Oral Maxillofac Surg. 2010;48:e1-4. 16. Park SY, Jin W, Lee SH, Park JS, Yang DM, Ryu KN. Acute retropharyngeal calcific tendinitis: a case report with unusual location of calcification. Skeletal Radiol. 2010;39:817-20. 17. Shin DE, Ahn CS, Choi JP. The acute calcific prevertebral tendinitis: report of two cases. Asian Spine J. 2010;4:123-7. 26/4/12 18:31:47 Radiología de cabeza y cuello 4 Tumores malignos de la naso-orofaringe y de la cavidad oral A. Rovira Cañellas* y S. Siurana Montilva Unidad de Resonancia Magnética (IDI), Servicio de Radiología, Hospital Universitario Vall d’Hebron, Barcelona, España Introducción A pesar de que la mayoría de las neoplasias que afectan a la faringe y la cavidad oral se diagnostican por exploración física directa, los estudios radiológicos tienen gran importancia no sólo en su estadificación inicial, ya que permiten determinar de forma precisa su origen y extensión locorregional, sino también para su seguimiento tras el tratamiento, ya que permiten evaluar objetivamente su eficacia y detectar la presencia de enfermedad residual o de recurrencias1-4. Los procesos tumorales malignos de esta región presentan características que los diferencian de los localizados en otras regiones anatómicas, como la elevada incidencia de diseminación ganglionar regional, su tendencia a presentar recurrencias locales, su baja incidencia de metástasis a distancia y la relativa alta frecuencia de presentarse de forma sincrónica o metacrónica con otras neoplasias de cavidad oral, faringe, laringe o pulmón. En este artículo se hace una revisión anatomorradiológica del segmento suprahioideo de la faringe (nasofaringe [NF] y orofaringe [OF]) y de la cavidad oral, así como de los tumores malignos que afectan estos espacios. Espacio faríngeo El espacio faríngeo (EF) se extiende desde la base del cráneo hasta el margen inferior del cartílago cricoides, alcanzando la porción más superior del cuello infrahioideo. El límite teórico del EF lo forma la fascia bucofaríngea, que rodea su margen posterior y lateral, dando una definición fascial a este espacio. Cerca de la base del cráneo, esta fascia bucofaríngea rodea la parte superior de la aponeurosis del músculo constrictor superior o fascia faringobasilar. Esta fascia se puede considerar el auténtico esqueleto de la faringe, y con frecuencia es identificable en secciones transversales de resonancia magnética (RM) como una estructura lineal de baja señal. La mayor consistencia de la fascia faringobasilar, en comparación con la bucofaríngea, hace considerar a la primera como el límite fascial real del EF a nivel de la NF. En el estudio de lesiones tumorales del EF se subclasifica este espacio mucoso en tres regiones: NF, OF e hipofaringe. Esta clasificación es especialmente útil en el estudio de las neoplasias malignas, ya que las vías de diseminación local y linfática se establecen en función de la localización del tumor en alguna de estas tres divisiones5. La tomografía computarizada (TC) y la RM son las dos técnicas diagnósticas más útiles en el estudio de la patología tumoral de esta región anatómica6-8. Si se realizan bajo condiciones técnicas óptimas, ambas son adecuadas en la mayoría de los casos, si bien la RM, gracias a su mayor contraste tisular, suele considerarse el examen de primera elección. Los objetivos esenciales que se deben considerar en el estudio inicial de las neoplasias de la faringe y cavidad oral son: localización anatómica precisa, relación con estructuras vasculares y nerviosas, e identificación de diseminación local o ganglionar. Nasofaringe La NF es la parte más superior de la faringe y, por tanto, tiene importantes relaciones con la base del cráneo. Su límite superior corresponde a la base del esfenoides, clivus y arco anterior del atlas. Las coanas la limitan anteriormente, las dos primeras vértebras cervicales posteriormente y el paladar inferiormente. El límite lateral lo establecen las fascias bucofaríngea y faringobasilar, que separan la NF de los espacios profundos cervicales. La fascia faringobasilar mantiene rígida y abierta la NF durante la relajación de los músculos faríngeos1,2,9. La estructura superficial más prominente de la NF es el torus tubárico, que se compone de cartílago, que por su naturaleza avascular es muy resistente a la invasión neoplásica. Esta estructura se debe visualizar de forma constante en los estudios de TC y RM. El orificio de salida de la trompa se sitúa por delante del torus en las secciones transversales y caudal a él en las secciones coronales. *Autor para correspondencia. Correo electrónico: [email protected] (A. Rovira Cañellas). 4-8 Capt 109.pag.indd 44 26/4/12 18:32:52 Tumores malignos de la naso-orofaringe y de la cavidad oral El receso posterolateral de la NF o receso de Rosenmüller es una reflexión mucosa situada por detrás del torus, que se produce como consecuencia de la existencia de una dehiscencia fisiológica de la fascia faringobasilar, conocida como seno de Morgagni. Este seno ofrece escasa resistencia a la extensión de los carcinomas nasofaríngeos hacia el espacio parafaríngeo y base del cráneo, lo cual se ve favorecido por la íntima relación anatómica que mantiene con la fosa de Rosenmüller, lugar de asiento de la mayoría de estos carcinomas. Los recesos de Rosenmüller suelen ser asimétricos y con un grado de distensión variable. Con la edad, la morfología de la NF y sus estructuras superficiales se hacen más evidentes, y los recesos más profundos. La presencia de abundante tejido linfoideo se puede considerar normal por debajo de los 30 años, especialmente en el techo de la NF. En los niños, esta hiperplasia adenoidea se asocia con frecuencia a adenopatías retrofaríngeas de hasta 1 cm de diámetro que no deben considerarse patológicas. La presencia de tejido adenoideo en la NF dificulta, en los estudios de TC, la identificación del torus y del receso de Rosenmüller; sin embargo, esta limitación se corrige con la RM gracias a su mayor capacidad de contraste tisular. A pesar de su localización submucosa, el tejido adenoideo nunca se extiende por fuera del límite lateral marcado por la fascia faringobasilar, siendo éste un signo importante para diferenciarlo de lesiones neoplásicas con extensión submucosa. Los músculos del velo del paladar (elevador y tensor) presentan una relación diferente con el EF, en función de su relación con la fascia faringobasilar. El músculo tensor del velo del paladar se puede considerar extrafaríngeo, ya que en su trayecto descendente se sitúa lateral a la fascia faringobasilar, hasta alcanzar su inserción distal en el paladar blando, después de reflejarse alrededor de la apófisis pterigoides. El músculo elevador del velo del paladar se considera una estructura faríngea, pues a pesar de tener su origen por fuera de la fascia faringobasilar en la superficie inferior del hueso petroso, en su trayecto descendente y medial atraviesa esta fascia junto a la trompa de Eustaquio, en el seno de Morgagni, para insertarse finalmente en la aponeurosis palatina. El contenido estricto de la NF está formado por: tejido linfático, mucosa (epitelio plano y cilíndrico), músculos constrictor superior, salpingofaríngeo y elevador del velo del paladar, torus y salida de la trompa de Eustaquio y fascia faringobasilar. La mayoría de estas estructuras pueden individualizarse entre sí y de las estructuras musculares exofaríngeas en los estudios de RM y TC. En el paladar óseo, límite inferior de la NF, la fascia faringobasilar desaparece prácticamente y los límites posterolaterales de la faringe corresponden al músculo constrictor superior y al anillo muscular de Passavant, aunque también participan los músculos elevador y tensor del velo del paladar, así como el salpingofaríngeo y el palatofaríngeo. También en este nivel existe tejido linfático que hace variable el grosor de estas paredes. 4-8 Capt 109.pag.indd 45 45 Patología maligna de la nasofaringe Carcinoma nasofaríngeo El 99% de los tumores malignos nasofaringeos son carcinomas, de los que el 80% son indiferenciados. Hay una clara relación de estos tumores, en su variante indiferenciada o pobremente diferenciada, con la infección por el virus Epstein-Bar (VEP), mientras que la variante bien diferenciada, la menos frecuente (20%), se relaciona con el consumo de alcohol y tabaco10. El VEP es un gamma herpes-virus que infecta al 95% de la población sana. En la mayoría de ocasiones la infección es asintomática, pero en ocasiones produce mononucleosis infecciosa o es causa de una infección latente en los linfocitos B. El carcinoma NF tienen una baja incidencia en Europa (< 1/100.000) pero es elevada en el sudeste asiático (20-50/100.000). En niños, las neoplasias malignas nasofaríngeas son poco frecuentes, siendo las más frecuentes en menores de 15 años el rabdomiosarcoma y el carcinoma. Este último es el único tumor epitelial que ocurre con cierta frecuencia en pediatría, presentándose generalmente como formas indiferenciadas o linfoepiteliomas11. Los carcinomas de NF son tumores agresivos con rápida tendencia a la diseminación linfática, siendo precisamente la aparición de adenopatías cervicales palpables el signo inicial más frecuente. Desde el punto de vista biológico son tumores muy radiosensibles, de elevada agresividad local y con alta predisposición a producir metástasis, tanto por vía linfática como hematógena (óseas, hígado, pulmón), si bien son excepcionales las metástasis al sistema nervioso central. Los síntomas y signos iniciales más frecuentes son la otitis serosa, cambios en la calidad de la voz y presencia de adenopatías cervicales (es el síntoma inicial en el 50% de los casos). La mayoría de estos tumores se originan en el receso posterolateral de la NF o receso de Rosenmüller y tienen una gran predisposición a la invasión submucosa, lo que favorece su diseminación hacia la parte superior del espacio parafaríngeo a través de la trompa de Eustaquio y el músculo elevador del velo del paladar. También pueden extenderse al endocráneo, ya sea directamente por destrucción de la base del cráneo, o por invasión del seno cavernoso a través del agujero rasgado anterior o del agujero oval (perineural, siguiendo la tercera rama del nervio trigémino). Posteriormente pueden afectar a los espacios retrofaríngeo y prevertebral; antero-lateralmente el espacio masticador y póstero-lateralmente el espacio parafaríngeo retroestileo. También puede diseminarse hacia la OF y fosas nasales. Las adenopatías metastásicas son muy frecuentes desde el inicio (85-90%) y suelen ser bilaterales (50%, por drenaje cruzado de los linfáticos nasofaríngeos)12-18. Linfoma El linfoma es la segunda neoplasia maligna más frecuente de la NF en pacientes adultos. En la mayoría de los casos corresponde a linfomas no-hodgkinianos, que se desarrollan de forma primaria en el anillo de Waldeyer (adenoides nasofaríngeos, amígdalas palatinas y lingua- 26/4/12 18:32:52 Radiología de cabeza y cuello 46 Figura 1. Linfoepitelioma nasofaríngeo. Las imágenes de resonancia magnética ponderadas en T1 (transversal) y T2 con supresión grasa (transversal y sagital) muestran un tejido de partes blandas homogéneo de características expansivas, que ocupa el receso posterolateral derecho de la nasofaringe respetando la fascia faringobasilar (flecha). Esta lesión se asocia a adenopatías homogéneas homolaterales de gran tamaño, que hizo sospechar el diagnóstico de un proceso linfoproliferativo maligno. les). Radiológicamente es difícil distinguirlo del carcinoma, aunque por lo general es un tumor más expansivo y menos infiltrativo, que se asocia a adenopatías de gran tamaño sin necrosis central y que no siguen las vías de drenaje linfático típicas (fig. 1). El carácter menos infiltrativo de este tumor puede, en ocasiones, dificultar el diagnóstico diferencial con la simple hiperplasia de tejido adenoideo faríngeo. El diagnóstico de linfoma nasofaríngeo debe sospecharse cuando se detecten de forma sincrónica focos tumorales en áreas extranodales (nasosinusal, órbita, espacio masticador, mandíbula, glándula salival, piel y laringe) o una afección difusa del anillo de Waldeyer19,20. En los linfomas, la morfología de la NF se suele recuperar “ad integrum” tras tratamiento. Rabdomiosarcoma Los rabdomiosarcomas son tumores malignos mesenquimales que inciden generalmente en niños menores de 12 años. El 40% de estos tumores se origina en cara y cuello, siendo la NF y la órbita los lugares predilectos. Los que afectan a la NF, oído medio y región nasosinusal se incluyen dentro del grupo de los rabdomiosarcomas parameníngeos y se clasifican entre los de peor pronóstico, ya que invaden con facilidad la base del cráneo y el endocráneo. Estos tumores tienen una rápida tendencia al crecimiento y a la invasión de estructuras vecinas. Los síntomas más frecuentes están en relación con el “efecto de masa” local, por lo que inicialmente se pueden confundir con hiperplasia de tejido adenoideo. Las adenopatías metastásicas no son frecuentes, aunque cuando aparecen indican la presencia de enfermedad sistémica. Otras localizaciones menos frecuentes son al OF, la cavidad oral, la hipofaringe, la laringe, la glándula parótida, y las partes blandas del cuero cabelludo y cara. Los rabdomiosarcomas se muestran en los estudios de imagen como masas de partes blandas heterogéneas y de límites mal definidos, que traspasan los límites fasciales destruyen- 4-8 Capt 109.pag.indd 46 do el tejido óseo. Con el contraste, la masa tumoral presenta (en los estudios de TC y RM) una captación similar a la del tejido muscular21,22. La supervivencia en estos tumores no supera el 10% en los casos con afectación meníngea (fig. 2). Orofaringe La OF es la parte de la faringe que se extiende desde el paladar hasta el límite inferior de los pliegues faringoepiglóticos, que delimitan la separación con la hipofaringe1,9. Su superficie está constituida por reflexiones de la mucosa sobre tejido linfático (amígdalas linguales y palatinas), mientras que su esqueleto (paredes laterales) es de tipo muscular. Las relaciones profundas de la OF se establecen con los espacios parafaríngeo, retrofaríngeo y masticador. Se incluyen en la OF el paladar blando, los pilares amigdalinos (anterior y posterior), las amígdalas palatinas, la base de la lengua, las paredes lateral y posterior de la faringe, y la mucosa de la valécula y de la superficie lingual de la epiglotis. El pilar amigdalino anterior es una reflexión de la mucosa sobre el músculo palatogloso (considerado un músculo extrínseco lingual), cuyo origen se sitúa en la superficie inferior del paladar blando para interdigitarse inferiormente con las fibras transversales de la lengua, confundiéndose con la porción media de las fibras del estilogloso. Las fibras del palatogloso son débiles, y por su trayecto descendente y anterior forman una leve concavidad anterior. Este músculo actúa a modo de esfínter de la OF ya que se extiende circularmente entre la lengua y el paladar blando. El pilar amigadalino posterior es la reflexión mucosa sobre el músculo palatofaríngeo, cuyas fibras se originan mayoritariamente en el paladar duro y blando, descendiendo por dentro de los músculos constrictores de la faringe pasando por el surco glosotonsilar para, finalmente, insertarse en el cartílago tiroides y 26/4/12 18:32:52 Tumores malignos de la naso-orofaringe y de la cavidad oral 47 Figura 2. Rabdomiosarcoma nasosinusal parameníngeo. La resonancia magnética en planos transversal y coronal (secuencias T2 y T1 con contraste y supresión grasa) muestra una lesión infiltrativa tumoral cuyo epicentro se sitúa en fosas nasales, con extensión a la porción izquierda de la nasofaringe, que invade lateralmente los antros maxilares y espacio masticador derecho, y alcanza el espacio epidural de la fosa craneal anterior (flechas) a través de la destrucción de la base del cráneo. en la pared posterior de la faringe donde la mayor parte de sus fibras se entrecruzan con las del lado opuesto. Las fibras musculares, más gruesas que las del pilar anterior, tienen un trayecto descendente más vertical y sin describir concavidad alguna. La amígdala palatina se sitúa entre los dos pilares amigdalinos y en posición sagital y media al músculo constrictor superior, siendo la única estructura del anillo linfático de Waldeyer encapsulada. Esta cápsula es una especialización de la fascia faringobasilar que separa la amígdala del músculo constrictor superior. La diferente disposición anatómica de los pilares amigdalinos hace que la extensión de las neoplasias varíe en función de su origen. Así, los tumores del pilar anterior se extienden en sentido descendente hacia el margen lateral de la lengua, mientras que los del pilar posterior, menos frecuentes, pueden alcanzar la base de la lengua a través de las fibras del músculo palatofaríngeo que descienden por el surco glosotonsilar. La presencia de tejido linfoide palatino facilita la discriminación, mediante RM, de los grupos musculares que conforman los pilares amigdalinos, con la pared lateral de la OF, formada por el músculo constrictor superior. La asimetría en el tamaño de los pilares amigdalinos es frecuente, aceptándose variaciones de hasta 3 mm. De los espacios en relación con la OF cabe destacar el parafaríngeo, que se sitúa profundo a la fosa amigdalina, y siempre debe ser visible en condiciones normales en los estudios de TC y RM, por lo menos en la mitad superior de la OF. La amplitud transversal del espacio parafaríngeo es inversamente proporcional a la cantidad de tejido linfoide amigdalino presente y al grosor de las paredes musculares de la OF. En los niveles más inferiores de la OF, el espacio parafaríngeo desaparece al tiempo que se hace visible el espacio submaxilar (continuación anatómica anteroinferior). El tercio posterior, o base, de la lengua forma parte de la OF y se separa anatómicamente de los dos tercios anteriores de la lengua por las papilas caliciformes o “V” 4-8 Capt 109.pag.indd 47 lingual. La mucosa que recubre la base de la lengua es la continuación de la mucosa del suelo de la boca y de la que tapiza la parte inferior de la fosa amigdalar. En la unión de ambas se forman dos repliegues laterales que se conocen como surcos glosotonsilares o glosopalatinos. En el espacio submucoso de la base de la lengua hay nódulos linfáticos que forman la amígdala lingual. Éstos pueden presentar una amplia variabilidad en tamaño y aspecto, e incluso pueden aparecer asimétricos en un mismo individuo, condicionando grados variables de ocupación de las valéculas y luz orofaríngea. La base de la lengua es atravesada por la arteria lingual con un trayecto medial al del músculo hiogloso, 1 o 2 cm por encima del hueso hioides. Al mismo nivel anatómico, pero externamente al músculo hiogloso, se sitúan el nervio hipogloso y la vena lingual. La patología que podemos encontrar en la OF es similar a la que se ha descrito en la NF, aunque hay características anatómicas propias referentes a los lugares de origen más frecuentes de los tumores malignos y vías de diseminación23. Patología maligna de la orofaringe Las neoplasias malignas de la OF se subdividen en función de su origen inicial: pared anterior (base de la lengua, valécula), pared lateral (pilares amigadalinos, fosa amigdalina, surco glosotonsilar) y pared superior (úvula y superficie inferior del paladar blando). Son los tumores malignos más frecuentes después de los que se originan en la cavidad oral y tienen, al igual que éstos, una clara relación con el hábito enólico y fumador. El 90% corresponde a carcinomas escamosos y en la mayoría de los casos los estudios de TC o RM son necesarios para determinar su extensión. Se ha descrito un gradiente de malignidad en función de la localización de los tumores en la cavidad oral y OF, de tal forma que los tumores más posteriores tienen una mayor agresividad e indiferenciación tisular9,23-26. 26/4/12 18:32:52 48 Carcinomas de la base de la lengua El 90% de los tumores malignos de la base de la lengua corresponde a carcinomas escamosos poco diferenciados y el 10% restante a linfomas o carcinomas de glándulas salivales menores. Los carcinomas se diagnostican, por lo general, tardíamente y, con frecuencia, el signo inicial es la aparición de adenopatías, que se presentan en el 75% de los casos, siendo bilaterales en el 30%. Los ganglios de drenaje primario son los yugulodigástricos, afectándose los submaxilares cuando hay invasión del suelo de la boca. Es notoria la tendencia de estos carcinomas a la infiltración hacia la profundidad, en ocasiones sin signos de afección mucosa, por lo que la inspección clínica ocular es, en ocasiones, insuficiente y se requiere la palpación, lo cual es realmente difícil en enfermos no colaboradores. Estas neoplasias crecen en el seno de la musculatura extrínseca lingual y con frecuencia rodean el surco glosotonsilar. El origen suele ser lateral y no cruzan la línea media hasta fases avanzadas; sin embargo, cuando lo hacen está contraindicado el tratamiento quirúrgico (debería realizarse glosectomía total) y el tratamiento de elección es la quimio y/o radioterapia. Su extensión y crecimiento son diversos: inferiormente pueden infiltrar el espacio preepiglótico, mientras que superficialmente se extienden sobre el repliegue faringoepiglótico y valécula y/o hacia el seno piriforme; anteriormente pueden infiltrar el margen posterior del músculo milohioideo y, a través del espacio sublingual, afectar la parte anterior del suelo de la boca; lateralmente pueden invadir la parte inferior del surco glosotonsilar y, a partir de aquí, extenderse a las partes blandas del cuello y al espacio parafaríngeo; finalmente, a través de la musculatura intrínseca y extrínseca lingual pueden extenderse a la parte anterior de la lengua. La detección de una extensión hacia la supraglotis indica la práctica de una laringectomía supraglótica. La destrucción mandibular es rara, salvo en casos muy avanzados o en recurrencias. Esta destrucción se produce generalmente por diseminación a través de los músculos pterigoideos o milohiodeo, o bien por el paquete neurovascular que penetra en la cara medial de la mandíbula. El estudio radiológico es obligado en todos los pacientes, siendo especialmente indicada la RM. Las secuencias sagitales son útiles para identificar la extensión anterior hacia la musculatura lingual (geniogloso, genihioideo). Esta misma proyección permite detectar la extensión preepiglótica, aunque es rara ya que el ligamento hioepiglótico, que separa la valécula del espacio preepiglótico es relativamente resistente a la extensión tumoral. Los estudios de TC o RM deben abarcar desde el paladar óseo hasta la región supraglótica media, así como las cadenas ganglionares de mayor interés (fig. 3). Carcinomas de pared lateral orofaríngea Los carcinomas de la región amigdalina son extremadamente difíciles de diagnosticar en su fase inicial mediante técnicas de imagen, ya que la simple asimetría de la pared lateral orofaríngea puede considerarse una variante anatómica. Únicamente, cuando hay extensiones por fuera 4-8 Capt 109.pag.indd 48 Radiología de cabeza y cuello de las estructuras propias de esta zona se pueden obtener imágenes diagnósticas. Junto con los carcinomas de la base de la lengua son tumores con especial tendencia a presentar un crecimiento submucoso, lo que hace que sea uno de los lugares frecuentes de neoplasias clínicamente ocultas en pacientes que presentan adenopatías metastásicas (fig. 4). Los tumores primarios del pilar anterior, los más frecuentes de la OF, con frecuencia se diseminan hacia el paladar blando y margen libre posterolateral de la lengua siguiendo las fibras del músculo palatogloso. Pueden también alcanzar la mucosa del trígono retromolar si hay invasión de la inserción, en el ligamento pterigomandibular del músculo constrictor superior de la faringe. Los carcinomas de fosa amigdalina se originan a partir de remanentes de tejido adenoideo o del receso mucoso formado entre los dos pilares. La invasión profunda se produce hacia el espacio parafaríngeo a través de la infiltración del músculo constrictor faríngeo, que permitirá la diseminación posterior hacia la NF y base del cráneo. Los tumores del pilar posterior son menos frecuentes y presentan una forma de diseminación similar a los de la fosa amigdalina, aunque predomina la extensión a partir de las fibras del palatofaríngeo hacia el surco glosotonsilar y base de la lengua, e incluso hacia valéculas y senos piriformes (fig. 5). Los carcinomas de pilar anterior presentan una incidencia de adenopatías metastásicas iniciales del 45%, afectándose primariamente las cadenas submandibular y yugulodigástrica. Esta incidencia aumenta al 75% en los tumores de pilar posterior y de fosa amigdalina, que además pueden drenar en la cadena del triángulo posterior. Carcinomas de pared superior de orofaringe Las neoplasias con origen en el paladar blando presentan un comportamiento similar a las que se originan en la parte anterior de la región amigdalina. La mayoría de lesiones se desarrolla en la superficie oral y se extienden con facilidad hacia la NF, el espacio parafaríngeo e incluso a la base del cráneo a través de los músculos del velo del paladar. La diseminación inferior se desarrolla a partir de los músculos palatogloso y palatofaríngeo que permiten la extensión hacia la lengua oral y base de la lengua, respectivamente (fig. 6). Cabe destacar que la extensión anterior con destrucción del paladar óseo es posible pero poco frecuente. Es importante en estos tumores la obtención, en los estudios de RM, de planos coronales tras la administración de contraste, ya que tienen una tendencia a diseminarse cranealmente siguiendo el músculo elevador del velo del paladar hacia la base del cráneo. La diseminación perineural es frecuente siguiendo los nervios palatinos (ramas del nervio maxilar superior), lo que permite la extensión tumoral hacia la base del cráneo a través de la fosa pterigopalatina y agujero redondo mayor (fig. 7). La diseminación ganglionar aparece de forma inicial en un 35-50% de los casos, afectando primariamente la cadena yugulodigástrica, aunque también son cadenas de riesgo las del triángulo posterior, la submandibular y la retrofaríngea. 26/4/12 18:32:53 Tumores malignos de la naso-orofaringe y de la cavidad oral 49 Figura 3. Carcinoma de base de lengua. A) Resonancia magnética (RM) de cavidad oral (secuencias en plano sagital y axial en secuencias ponderadas en T1 y T2 con saturación grasa). Se observa una pequeña lesión infiltrativa de la mitad izquierda de la base de la lengua que atraviesa la línea media (flechas). Estadificación radiológica: T2. B) RM de cavidad oral (secuencias en plano sagital y axial en secuencias ponderadas en T1 y T2 con saturación grasa). Se evidencia una extensa lesión infiltrativa cuyo epicentro se localiza en la base de lengua derecha que invade la musculatura extrínseca de la lengua y en sentido posterior oblitera la luz de la orofaringe. Estadificación radiológica: T4a. Figura 4. Carcinoma de pilar amigdalino anterior. Las imágenes de tomografía computarizada (TC) con contraste y resonancia magnética ponderadas en T1 y T2 en planos axiales y coronales con supresión grasa, muestran una asimetría del pilar amigdalino izquierdo condicionada por una lesión infiltrativa hipercaptante en la TC e hiperintensa en secuencias ponderadas en T2 (flechas). La biopsia de esta lesión estableció el diagnóstico de carcinoma escamoso. Estadificación radiológica: T2. 4-8 Capt 109.pag.indd 49 26/4/12 18:32:53 50 Radiología de cabeza y cuello Figura 5. Carcinoma de la fosa amigdalina. Resonancia magnética de la cavidad oral (secuencia ponderada en T2 con supresión grasa en los planos sagital, transversal y coronal) que muestra una lesión que se origina en la fosa amigdalina derecha (flecha doble) y que, a través de las fibras del músculo palatofaríngeo, descienden por el surco glosotonsilar e invaden la hemilengua oral (arterisco). Hay una adenopatía metástasica yugulodigástrica homolateral (flecha). Estadificación radiológica: T2N1. Figura 6. Carcinoma del paladar blando. Resonancia magnética de la cavidad oral (secuencias ponderada en T1 y T2 en el plano transversal y T2 en el plano coronal). Se identifica un engrosamiento de la mitad derecha del paladar blando por una lesión infiltrativa (flecha) que se extiende en sentido inferior a través del músculo palatogloso (flecha doble). Estadificación radiológica: T2. Cavidad oral y suelo de la boca La cavidad oral y el suelo de la boca no forman estrictamente parte de la faringe, aunque sus íntimas relaciones anatómicas y fisiopatológicas con la OF obligan a estudiarlas conjuntamente con ella. La cavidad oral incluye la mucosa oral, los dos tercios anteriores de la lengua o lengua oral y el paladar óseo, mientras que el paladar blando se considera parte de la OF. El límite posterior de la cavidad oral es la propia OF, de la que se separa por un anillo de estructuras diversas: velo del paladar, pilares amigdalinos 4-8 Capt 109.pag.indd 50 anteriores y papilas caliciformes. La lengua oral está formada por los dos tercios anteriores de la lengua, marcando su límite posterior la “V” lingual. El tercio posterior de la lengua o base forma parte de la OF. La lengua oral presenta en su eje longitudinal y medio un septo graso que se fija al hueso hioides. A los lados de este septo, se describen los músculos intrínsecos linguales (longitudinales superior e inferior, transverso y vertical). Éstos se interdigitan entre sí de forma que entre los haces musculares transversales y longitudinales aparecen formaciones de tejido adiposo perfectamente identificables en las secciones sagitales 26/4/12 18:32:53 Tumores malignos de la naso-orofaringe y de la cavidad oral 51 Figura 7. Carcinoma del paladar. Resonancia magnética de la cavidad oral (secuencias ponderadas en T1 y T2 en el plano transversal y T2 en el plano coronal). Se observa una extensa lesión tumoral infiltrativa que invade la mitad izquierda del paladar duro y blando, cresta alveolar, antro maxilar, suelo de la órbita, fosa nasal y fosa pterigomandibular. Estadificación radiológica T4b. de RM. El músculo geniogloso se considera un músculo extrínseco lingual, aunque se interdigita en la musculatura intrínseca lingual. La irrigación lingual depende de las arterias linguales, ramas de la arteria carótida externa, que se sitúan entre los músculos geniogloso e hiogloso en el suelo de la boca, desde donde se ramifican de forma terminal hacia toda la lengua. El suelo de la boca es una estructura en forma de herradura cubierta por epitelio escamoso. Está constituido por el músculo milohioideo y el vientre anterior del músculo digástrico, en combinación con la musculatura extrínseca lingual (geniogloso, estilogloso e hiogloso). El límite anterior es el borde gingival mandibular y el posterior la base o inserción basal del pilar amigdalino anterior. Sin embargo, de forma estricta, el suelo de la boca debe considerarse como una estructura únicamente constituida por el músculo milohioideo, que se inserta superiormente en la línea oblicua interna del maxilar inferior, para dirigirse hacia adentro y hacia abajo al hueso hioides y al rafe medio maxilohioideo. La inervación de los músculos intrínsecos y extrínsecos linguales se realiza a través de los nervios hipoglosos, que desde su trayecto en el espacio parafaríngeo se introducen, medialmente al músculo milohioideo, en el espacio sublingual. Los músculos milohioideo y el vientre anterior del músculo digástrico se inervan a través del nervio milohiodeo, rama terminal del nervio dentario inferior. El músculo milohioideo subdivide el suelo de la boca en dos espacios, el sublingual y el submandibular, los cuales se comunican libremente por detrás de su margen posterior. El espacio sublingual es un área en forma de herradura, con abertura posterior, que se sitúa entre el cuerpo de la mandíbula y la raíz de la lengua. El margen inferolateral lo forma el músculo milohioideo y el superomedial el complejo muscular geniohioideo/geniogloso en el segmento 4-8 Capt 109.pag.indd 51 más anterior y la parte anterior del músculo hiogloso en el más posterior. Su límite superior está cubierto por la mucosa del suelo de la cavidad oral. Este espacio contiene importantes estructuras neurovasculares, como las ramas del nervio glosofaríngeo, las ramas del nervio hipogloso, el nervio lingual y la arteria y venas linguales, así como el extremo anterior del músculo hiogloso y el conducto de drenaje de la glándula submandibular. El espacio sublingual se encuentra ocupado mayoritariamente por tejido conjuntivo y adiposo, y por la glándula sublingual, que se sitúa pegada a la cara interna de la mandíbula, en la fosa sublingual, cubriendo la parte anterior del músculo milohioideo. El tejido conjuntivo rodea las estructuras del espacio sublingual y se continúa por detrás del borde posterior del milohioideo con el tejido conjuntivo del espacio submandibular. Esta continuidad facilita la extensión de lesiones, incluso poco agresivas, desde el espacio sublingual al submaxilar y viceversa. La inserción del músculo milohioideo a lo largo de la línea milohioidea forma un canal que facilita la diseminación tumoral en sentido anterior de carcinomas del surco glosotonsilar-base de la lengua o bien de carcinomas del suelo de la boca, lengua y trígono retromolar. El espacio submandibular también tiene forma de herradura, pero de abertura anterior. Se sitúa entre el músculo milohioideo como límite superior y el hueso hioides como límite inferior. Equivale a la continuación inferior, sin limitación fascial del espacio parafaríngeo preestíleo y, a su vez, se continúa anterosuperiormente con el espacio sublingual. Este espacio, rico en tejido graso, contiene la porción superficial de la glándula submaxilar, los ganglios de la cadena submentoniana y submandibular, las arterias y las venas faciales, el asa descendente del nervio hipogloso (antes de introducirse en el espacio sublingual) y el vientre anterior del músculo digástrico. 26/4/12 18:32:53 52 Radiología de cabeza y cuello Figura 8. Carcinoma de trígono retromolar. Resonancia magnética de la cavidad oral (secuencias ponderadas en T1 y T2 en el plano transversal y T2 en el plano coronal). Se observa una lesión infiltrativa que afecta el trígono retromolar izquierdo (arterisco), que se extiende en profundidad siguiendo el rafe pterigomandibular, a través del cual alcanza el pilar amigdalino anterior (flecha doble). Lateralmente, la lesión invade y destruye parcialmente el ángulo mandibular e invade los músculos del espacio masticador (pterigoideo lateral y masetero). En la imagen coronal se identifica una adenopatía metastásica submaxilar homolateral (flecha). Estadificación radiológica: T4bN1. Patología maligna de la cavidad oral La mayoría de tumores malignos de la cavidad oral corresponden a carcinomas escamosos que pueden originarse en cualquier punto de la mucosa oral, aunque las zonas declives y con repliegues favorecen su desarrollo, siendo los más frecuentes los originados en el trígono retromolar, el suelo de la boca, la lengua oral y las mucosas gingivobucal y bucofaríngea5,23. Estas neoplasias tienen clara relación con la exposición prolongada al alcohol y tabaco9,23-27. Desde el punto de vista más pragmático, el estudio de estos carcinomas debe enfocarse según el lugar de origen, ya que su pronóstico y diseminación varían en función de éste. Carcinoma del trígono retromolar El trígono retromolar es un pequeño triángulo mucoso que se sitúa posteriormente al tercer molar y recubre la rama ascendente de la mandíbula. Mediante sus relaciones profundas conecta con diferentes estructuras de la cavidad oral, OF, NF y suelo de la boca, lo que convierte a esta zona en un verdadero cruce de regiones anatómicas. Por debajo de la mucosa del trígono retromolar se encuentra el rafe pterigomandibular, zona de inserción conjunta de los músculos buccinador y constrictor superior de la faringe, que se extiende entre el gancho de la apófisis pterigoides lateral y el surco milohioideo de la mandíbula. El espacio pterigomandibular, en el que se sitúa el nervio lingual, es un pequeño triángulo graso que se ubica posterior y medial al rafe pterigomandibular, entre el músculo pterigoideo medial y la mandíbula. Este espacio se puede describir como la continuación anterior del espacio parafaríngeo preestíleo. 4-8 Capt 109.pag.indd 52 Los carcinomas de esta zona suelen presentarse inicialmente con dolor y trismus, lo cual indica estadios avanzados con afección ósea e invasión de la fosa infratemporal. El patrón de diseminación que muestran estos tumores es intermedio entre los carcinomas del pilar amigdalino anterior y los del surco gingivobucal. El pequeño tamaño de esta región favorece la diseminación precoz hacia las estructuras adyacentes, con preferencia hacia el pilar amigdalino anterior y la mucosa bucal. La infiltración profunda posterior puede afectar al espacio pterigomandibular y al músculo pterigoideo medial, y la lateral al espacio y músculo buccinadores, así como al rafe pterigomandibular. Cranealmente puede extenderse hacia el maxilar y destruir la parte inferior de las apófisis pterigoides y la tuberosidad posterior del maxilar, para alcanzar incluso el límite inferior de la fosa infratemporal. La afectación de la mandíbula es precoz, pero su destrucción franca es un hallazgo tardío. Para detectar esta invasión precoz de la mandíbula es útil realizar secciones coronales con RM o TC (fig. 8). No es infrecuente la diseminación perineural siguiendo el nervio alveolar inferior (rama del nervio mandibular). Los ganglios inicialmente afectados son los yugulodigástricos y los submandibulares, mientras que los ganglios retrofaríngeos se afectan en casos de extensión tumoral hacia el paladar o cavidad nasal. Un 30-40% de enfermos presenta metástasis ganglionares en el momento del diagnóstico. Carcinoma del suelo de la boca (surco alveololingual/ espacio sublingual) Es una zona anatómica difícil de explorar clínicamente. El carcinoma escamoso es la neoplasia más frecuente del suelo de la boca y afecta preferentemente su tercio ante- 26/4/12 18:32:54 Tumores malignos de la naso-orofaringe y de la cavidad oral 53 Figura 9. Carcinoma del suelo de la boca. A) Resonancia magnética (RM) de cavidad oral (secuencias ponderadas en T1 en el plano transversal, en T2 con supresión grasa en el plano transversal y en T1 en el plano sagital). Se observa una lesión infiltrativa que compromete al espacio sublingual izquierdo (arterisco) sin signos de infiltración de la cortical bucal de la rama mandibular. Estadificación radiológica: T2. B) RM de cavidad oral (secuencias ponderadas en T1 en el plano transversal, en T2 con supresión grasa en el plano transversal y en T1 en el plano sagital). Se identifica una extensa lesión infiltrativa que ocupa la porción anterior y medial del espacio sublingual (flecha), que invade por contigüidad el conducto de drenaje de ambas glándulas submaxilares así como a la región sinfisaria y rama horizontal de la mandíbula, con destrucción de la cortical e infiltración de la médula ósea (arterisco). Estadificación radiológica: T4a. rior. Se ha descrito que un 5% de estos carcinomas se origina en la glándula sublingual y corresponde a carcinomas mucoepidermoides o adenoideoquísticos. La extensión o diseminación de estos carcinomas puede tipificarse según la frecuencia: la infiltración de la musculatura extrínseca de la lengua, sobre todo del músculo geniogloso es frecuente, al igual que la extensión a través del tejido fibroadiposo del espacio sublingual. En estos casos se puede producir una obstrucción e infiltración tumoral del conducto de drenaje de la glándula submaxilar con sialoadenitis obstructiva de la misma. La infiltración del periostio a lo largo de la superficie interna de la mandíbula suele ser temprana, pero la destrucción de la mandíbula es infrecuente, ya que el periostio actúa como barrera frente a la diseminación neoplásica. La destrucción mandibular se desarrolla más fácilmente a través de estructuras sin recubrimiento perióstico que permitan la diseminación tumoral, como los agujeros mentonianos u orificios alveolares inferiores (fig. 9). La tendencia de estos tumores a extenderse hacia 4-8 Capt 109.pag.indd 53 el espacio sublingual favorece la temprana invasión perineural/perivascular, lo cual se puede sospechar radiológicamente por el borramiento de la grasa que rodea los nervios y arterias linguales. El englobamiento de la arteria lingual es frecuente pero raramente causa hemorragias masivas. La invasión de los nervios hipogloso y lingual es un hallazgo tardío, y produce alteraciones sensitivas y motoras, como la denervación atrófica de la musculatura intrínseca y extrínseca de la lengua homolateral. Se encuentran adenopatías palpables en la región submandibular y yugulodigástrica en el 30% de los casos de carcinomas menores de 2 cm de diámetro (estadio T1). En el 50% de los carcinomas no tratados se desarrollan adenopatías metastásicas bilaterales. Carcinoma lingual Los tumores malignos del tercio anterior de la lengua suelen ser superficiales en su presentación inicial, mientras que los del tercio medio son más infiltrativos, con tendencia a invadir el suelo de la boca. Los carcinomas del 26/4/12 18:32:54 54 Radiología de cabeza y cuello Figura 10. Carcinoma de lengua oral. Tres pacientes diagnosticados de carcinoma escamoso de la lengua, estadificados con resonancia magnética en secuencias ponderadas en T2 con saturación grasa. A) Pequeña lesión infiltrativa confinada al margen libre de la hemilengua derecha < 2 cm de diámetro (flecha). Estadificación radiológica: T1. B) Lesión infiltrativa que afecta la hemilengua oral izquierda, que alcanza la línea media con un diámetro < 4 cm. Estadificación radiológica: T2. C) Extensa lesión infiltrativa de la mitad derecha de la lengua, que invade la lengua contralateral y los músculos extrínsecos linguales. Estadificación radiológica: T4a. tercio posterior son especialmente invasivos y se comportan de forma similar a los carcinomas de la base de la lengua. En general, no hay barreras efectivas que limiten la infiltración profunda de estos tumores, que se diseminan libremente siguiendo las fibras de la musculatura intrínseca y extrínseca lingual. La extensión posterosuperior hacia el paladar blando, a través del músculo palatogloso, al igual que la extensión posteroinferior a través del palatofaríngeo hacia el surco glosotonsilar, son relativamente frecuentes. La extensión tumoral inferior hacia la parte posterior del suelo de la boca se realiza principalmente a 4-8 Capt 109.pag.indd 54 través del músculo hiogloso. En estos casos también pueden afectarse los músculos geniohioideo y milohioideo, lo que conlleva un comportamiento similar al de los carcinomas primarios del suelo de la boca. El crecimiento posterior a través de la musculatura intrínseca lingual permite, a su vez, la invasión de la base de la lengua. Es esencial determinar la extensión a través de la línea media, ya que cuando existe contraindica la resección simple del tumor y se debería hacer una glosectomía total, que en la actualidad se sustituye por tratamiento médico con quimio y/o radioterapia (fig. 10). 26/4/12 18:32:54 Tumores malignos de la naso-orofaringe y de la cavidad oral 55 Figura 11. Carcinoma de la mucosa bucofaríngea y gingivobucal. A) resonancia magnética (RM) de cavidad oral con secuencias ponderadas en T1 en los planos sagital y transversal y T2 con saturación grasa en los planos sagital y transversal. Se identifica una lesión infiltrativa originada en la mucosa yugal izquierda que invade el músculo bucinador. Estadificación radiológica: T2. B) Estudio de RM de cavidad oral con secuencias ponderadas en T1 en los planos sagital y transversal y T2 con saturación grasa en los planos sagital y transversal. Se identifica lesión infiltrativa del surco gingivobucal inferior derecho (arterisco) con invasión ósea. Estadificación radiológica: T4. La diseminación linfática es especialmente frecuente, con una incidencia inicial de ganglios clínicamente positivos del 30-40% en los estadios T1 o T2, y del 72% en los estadios más avanzados. La incidencia de metástasis ganglionares clínicamente ocultas es especialmente elevada en los carcinomas linguales incluso en estadios T1 y T2, donde alcanzan el 20-42%. Las cadenas ganglionares de ambos lados tienen un elevado riesgo de afectación debido a la alta frecuencia con que las lesiones se extienden a través de la línea media y también por la existencia de drenaje linfático cruzado. Dadas estas premisas, los estudios de TC o RM están indicados en el estudio de las neoplasias en estadios T2 o superior y/o siempre que se sospeche la existencia de invasión de los espacios profundos, lo cual es altamente frecuente en lesiones del tercio posterior. La RM permite, gracias a la posibilidad de efectuar secciones coronales y sagitales, definir con más precisión la afectación del suelo de la boca y de la base de la lengua. La estadificación ganglionar debe efectuarse como mínimo hasta la región cervical media, siendo infrecuente la afección retrofaríngea, a menos que la lesión infiltre el paladar, la NF o la pared faríngea posterior. Carcinoma de mucosa bucofaríngea y gingivobucal Son tumores que se originan en la mucosa que tapizan el músculo bucinador y surco gingivobucal. Con frecuencia se extienden en profundidad hacia la mandíbula (lo que 4-8 Capt 109.pag.indd 55 requiere realizar manbibulectomía segmentaria) o siguiendo el músculo bucinador hacia el rafe pterigomandibular para, a partir de éste, infiltrar el músculo constrictor superior de la OF y la fosa infratemporal. Las lesiones neoplásicas de la mucosa gingivobucal presentan patrones de diseminación hacia el paladar óseo, el paladar blando, el suelo de la boca y estructuras óseas subyacentes, que varían en función de su lugar de origen. Las lesiones superiores (surco gingivobucal superior) se diseminan hacia el paladar óseo y, eventualmente, hacia la cavidad y septo nasal. Cabe destacar que en las lesiones del surco gingivobucal superior también puede haber invasión de la base del seno maxilar aunque, frecuentemente, éste es un hallazgo tardío. Posterolateralmente, las lesiones pueden invadir el músculo buccinador e incluso los músculos pterigoideos y masetero, con la consiguiente invasión de la rama vertical mandibular. Las lesiones inferiores (surco gingivobucal inferior) invaden precozmente el periostio mandibular, el suelo de la boca y la mucosa bucal adyacente. También pueden extenderse en sentido posterolateral afectando al espacio buccinador, a partir del cual pueden alcanzar los músculos pterigoideos, masetero y el rafe pterigomandibular, siguiendo entonces las vías de diseminación propias de los carcinomas del trígono retromolar. La invasión linfática sigue esencialmente los mismos patrones que los carcinomas del trígono retromolar (fig. 11). 26/4/12 18:32:55 56 Radiología de cabeza y cuello Figura 12. Diseminación tumoral musculofacial. Resonancia magnética de cavidad oral con secuencias ponderadas en T1 en los planos transversal y coronal (fila superior) y T2 con supresión grasa en los planos transversal y coronal (fila inferior). Paciente diagnosticado de un rabdomiosarcoma del ángulo mandibular izquierdo, que mostró una rápida progresión de la lesión por infiltración de los músculos pterigoideos (arterisco) y temporal (flecha). Vías de extensión en los tumores malignos faríngeos y de cavidad oral La diseminación local de los tumores de cabeza y cuello suele ser siguiendo planos mucosos, submucosos o en profundidad siguiendo planos musculofasciales. La diseminación en profundidad suele realizarse a partir de los planos fibroadiposos perimusculares o siguiendo las propias estructuras musculares, pero también puede producirse siguiendo las superficies periósticas o la medular ósea, o siguiendo el espacio perineural o los tractos nerviosos o vasculares4,28,29. Los datos clinicopatológicos y radiológicos permiten diferenciar diferentes tipos de diseminación tumoral: – Diseminación musculofacial. El tejido fibroadiposo que rodea las estructuras musculares submucosas permite la fácil extensión de los carcinomas lejos de su origen inicial. Este tipo de extensión requiere estudios tomográficos de imagen (TC o RM), ya que muchas veces se desarrolla bajo una mucosa intacta y, por tanto, no accesible a la inspección visual (fig. 12). – Diseminación perióstica. No es infrecuente la diseminación de los tumores faríngeos y de la cavidad oral hacia el periostio de la mandíbula y base del cráneo y, a partir de la invasión de los canales nutrientes, invadir el tejido óseo subyacente. – Diseminación perineural. Los tumores pueden extenderse siguiendo los nervios craneales que inervan las super- 4-8 Capt 109.pag.indd 56 ficies mucosas o los que cruzan los espacios profundos del cuello. Este tipo de extensión permite la diseminación tumoral hacia la base del cráneo y endocráneo. Los nervios más afectados son el hipogloso y el trigémino, y los tumores que con más predilección siguen este tipo de diseminación son los carcinomas escamosos recurrentes y los carcinomas adenoides quísticos. Los estudios de RM efectuados con contraste intravenoso son los más útiles en su detección precoz, que en ocasiones antecede a las manifestaciones clínicas (hasta el 40% de estas diseminaciones son asintomáticas) (fig. 13). – Diseminación linfática. La evaluación individual de la extensión ganglionar en los carcinomas faríngeos y de la cavidad oral es necesaria para determinar el pronóstico y establecer con más precisión la actitud terapéutica. La incidencia de diseminación ganglionar al inicio es relativamente frecuente y los patrones varían en función de su lugar de origen. – Metástasis a distancia. Las metástasis a distancia son infrecuentes en los carcinomas de cabeza y cuello, con una incidencia clínica global del 11%, que aumenta hasta el 50% en las necropsias. La incidencia aumenta con tumores de gran tamaño y con metástasis ganglionares. El sitio de origen del tumor no parece influir demasiado, si bien parece que los de la NF y tiroides son los que con más frecuencia se asocian a metástasis a distancia. Las metástasis asientan sobre todo en 26/4/12 18:32:55 Tumores malignos de la naso-orofaringe y de la cavidad oral 57 Figura 13. Invasión metastásica perineural. Estudio de resonancia magnética con secuencias ponderadas en T1 sin saturación grasa antes (fila superior) y tras la administración de contraste en plano transversal y coronal en paciente con un carcinoma adenoide quístico de la mitad derecha y porción anterior del paladar duro (arterisco), que muestra una obliteración de la grasa de la fosa pterigopalatina y un engrosamiento del seno cavernoso derechos (flechas en fila superior). En las imágenes obtenidas tras la administración de contraste (fila inferior) se observa un engrosamiento y realce de la señal de la segunda (flecha) y tercera (flecha doble) ramas trigeminales secundarias a infiltración tumoral perineural, que permite la extensión tumoral hacia el seno cavernoso (cabeza de flecha). el pulmón, seguido del hueso e hígado. La supervivencia de estos pacientes no suele superar el año. Conclusión Los estudios radiológicos son esenciales para valorar el origen exacto, localización y extensión de las neoplasias malignas que afectan la faringe y la cavidad oral. El conocimiento anatómico detallado de estas regiones anatómicas, incluyendo sus contenidos y relaciones de vecindad, es necesario para un correcto diagnóstico radiológico de estas lesiones y para determinar sus vías de extensión locorregional, lo cual es esencial para determinar su pronóstico y tratamiento más adecuado. Bibliografía 1. Mukherji SK. Pharynx. En: Som PM, Curtin HD, editors. Head and Neck Imaging. 4th ed. New York: Mosby; 2003. 2. Harnsberger HR. Handbook of head and neck imaging. 2nd ed. St. Louis: Mosby; 1990. 3. Ljumanovic R, Langendijk JA, Hoekstra OS, Leemans CR, Castelijns JA. Distant metastases in head and neck carci- 4-8 Capt 109.pag.indd 57 noma: identification of prognostic groups with MR imaging. Eur J Radiol. 2006;60:58-66. 4. Mukherji SK, Pillsbury HR, Castillo M. Imaging squamous cell carcinomas of the upper aerodigestive tract: what clinicians need to know. Radiology. 1997;205:629-46. 5. Sobin LH, Wittekind CH, editors. UICC TNM Classification of Malignant Tumors. 6th ed. New York: Wiley-Liss; 2002. 6. Lenz M. Imaging of head and neck tumors. Eur J Radiol. 2000;33:151-2. 7. Lenz M, Greess H, Baum U, Dobritz M, Kersting-Sommerhoff B. Oropharynx, oral cavity, floor of the mouth: CT and MRI. Eur J Radiol. 2000;33:203-15. 8. Ahmad A, Branstetter BF 4th. CT versus MR: still a tough decision. Otolaryngol Clin North Am. 2008;41:1-22. 9. Mukherji SK, Castelijns J, Castillo M. Squamous cell carcinoma of the oropharynx and oral cavity: how imaging makes a difference. Semin Ultrasound CT MR. 1998;19:463-75. 10. Lo KW, To KF, Huang DP. Focus on nasopharyngeal carcinoma. Cancer Cell. 2004;5:423-8. 11. Lloyd C, McHugh K. The role of radiology in head and neck tumours in children. Cancer Imaging. 2010;10:49-61. 12. Mancuso AA, Hanafee WN. Head and Neck Imaging. Vol. II. Philadelphia: Lippincot Williams and Wilkins; 2011. 13. Glastonbury CM. Nasopharyngeal carcinoma: the role of magnetic resonance imaging in diagnosis, staging, treatment, and follow-up. Top Magn Reson Imaging. 2007;18:225-35. 14. Chin SC, Fatterpekar G, Chen CY, Som PM. MR imaging of diverse manifestations of nasopharyngeal carcinomas. AJR Am J Roentgenol. 2003;180:1715-22. 26/4/12 18:32:55 58 15. Jeyakumar A, Brickman TM, Jeyakumar A, Doerr T. Review of nasopharyngeal carcinoma. Ear Nose Throat J. 2006;85:168-70. 16. King AD, Bhatia KS. Magnetic resonance imaging staging of nasopharyngeal carcinoma in the head and neck. World J Radiol. 2010;2:159-65. 17. Goh J, Lim K. Imaging of nasopharyngeal carcinoma. Ann Acad Med Singapore. 2009;38:809-16. 18. Chong VF, Ong CK. Nasopharyngeal carcinoma. Eur J Radiol. 2008;66:437-47. 19. King AD, Lei KI, Richards PS, Ahuja AT. Non-Hodgkin’s lymphoma of the nasopharynx: CT and MR imaging. Clin Radiol. 2003;58:621-5. 20. King AD, Lei KI, Ahuja AT. MRI of neck nodes in nonHodgkin’s lymphoma of the head and neck. Br J Radiol. 2004;77:111-5. 21. Latack JT, Hutchinson RJ, Heyn RM. Imaging of rhabdomyosarcomas of the head and neck. AJNR Am J Neuroradiol. 1987;8:353-9. 22. Yousem DM, Lexa FJ, Bilaniuk LT, Zimmerman RI. Rhabdomyosarcomas in the head and neck: MR imaging evaluation. Radiology. 1990;177:683-6. 4-8 Capt 109.pag.indd 58 Radiología de cabeza y cuello 23. Trotta BM, Pease CS, Rasamny JJ, Raghavan P, Mukherjee S. Oral cavity and oropharyngeal squamous cell cancer: key imaging findings for staging and treatment planning. Radiographics. 2011;31:339-54. 24. Stambuk HE, Karimi S, Lee N, Patel SG. Oral cavity and oropharynx tumors. Radiol Clin North Am. 2007;45:1-20. 25. Becker M. Oral cavity, oropharynx, and hypopharynx. Semin Roentgenol. 2000;35:21-30. 26. Weber AL, Romo L, Hashmi S. Malignant tumors of the oral cavity and oropharynx: clinical, pathologic, and radiologic evaluation. Neuroimaging Clin N Am. 2003;13:443-64. 27. Laporte SJ, Juttla JK, Lingam RK. Imaging the floor of the mouth and the sublingual space. Radiographics. 2011;31:1215-30. 28. Parker GD, Harnsberger HR. Clinical-radiologic issues in perineural tumor spread of malignant diseases of the extracranial head and neck. Radiographics. 1991;11: 383-99. 29. Gandhi D, Gujar S, Mukherji SK. Magnetic resonance imaging of perineural spread of head and neck malignancies. Top Magn Reson Imaging. 2004;15:79-85. 26/4/12 18:32:55 Radiología de cabeza y cuello 5 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe A.J. Revert Ventura* y F. Salamé Gamarra Servicio de Radiología, Hospital de Manises, Valencia, España Introducción Anatomía Los tumores de laringe e hipofaringe se originan de la mucosa de la vía respiratoria y digestiva alta; por tanto, la mayoría son carcinomas epidermoides y son accesibles a la exploración endoscópica y a la biopsia. La endoscopia permite una adecuada valoración de la extensión mucosa, suficiente para el diagnóstico, pero no puede evaluar la infiltración submucosa que asocian estas neoplasias por su capacidad infiltrante. Además, áreas como la comisura anterior o la región subglótica pueden quedar ocultas por las tumoraciones exofíticas. Precisamente por estas limitaciones, la exploración clínica tiende a subestimar las estadificaciones locales. En cambio, las técnicas de imagen sí permiten evaluar la extensión en profundidad del tumor, lo que las hace indispensables para una estadificación precisa. En general, los resultados de imagen hacen que el descriptor T tienda a ser superior al definido por la exploración clínica. De hecho, la eficacia de la estadificación tumoral cuando se compara con los hallazgos patológicos es del 58% para la exploración clínica-endoscópica y del 80 y 85% para la tomografía computarizada (TC) y la resonancia magnética (RM), respectivamente. La combinación de la información de los hallazgos clínicos con los de imagen consigue una mejor estadificación clínica del TNM, que permite una selección adecuada de las opciones terapéuticas1-3. El tratamiento de los pacientes con neoplasias de laringe e hipofaringe incluye la cirugía, la radioterapia y la quimioterapia, o una combinación de éstas. Las decisiones terapéuticas se basan tanto en la extensión de la enfermedad como en el estado general del paciente, con el fin de lograr un equilibrio entre el incremento de la supervivencia y la calidad de vida del paciente. En este capítulo nos ocuparemos del descriptor T en las distintas localizaciones de los tumores. También se revisarán otros indicadores pronósticos que se obtienen con las técnicas de imagen, y los tumores de las localizaciones o extensiones específicas que afectan a determinados tratamientos, como las técnicas quirúrgicas de preservación de la voz. La laringe y la hipofaringe forman una unidad anatómica funcional, ya que actúan de forma coordinada para realizar la función esfinteriana que permite la separación de las vías respiratoria y digestiva. La laringe, además, realiza la fonación y forma parte de la vía respiratoria. La laringe está formada por un armazón óseo-cartilaginoso, que sirve de soporte para la mucosa respiratoria que lo tapiza, para el fibrocartílago de la epiglotis y para la musculatura intrínseca y extrínseca. Las 3 regiones en que se divide la laringe son: supraglotis, glotis y subglotis. El ventrículo laríngeo es la estructura anatómica que sirve para referenciarlas (fig. 1). La supraglotis se extiende desde la epiglotis hasta la cara inferior del ventrículo laríngeo y está constituida por la epiglotis, la cara anterior de los repliegues aritenoepiglóticos, las bandas o cuerdas falsas, el propio ventrículo laríngeo y la mucosa que recubre la porción superior de los cartílagos aritenoideos. La glotis incluye 1 cm por debajo del límite de los ventrículos y está formada por las cuerdas vocales y las comisuras, anterior y posterior. El margen inferior del aritenoides con la apófisis vocal señala el plano de la cuerda vocal. La región subglótica se extiende por debajo de las cuerdas hasta el borde inferior del cartílago cricoides (fig. 2). Hay 2 espacios muy importantes en la laringe, el preepiglótico y el paraglótico, que están en continuidad y constituidos principalmente por grasa. La invasión tumoral suele ocurrir a través de estos espacios y se identifica muy bien en las técnicas de imagen como una ocupación del plano graso. No se debe confundir el ligamento hioepiglótico que cruza el espacio preepiglótico con tejido tumoral. En la glotis, el espacio paraglótico prácticamente no contiene grasa y sólo se identifica el músculo tiroaritenoideo. Esto hace que la valoración de la extensión tumoral al espacio paraglótico sea mucho más difícil en esta localización. Aunque estos espacios se valoran bien en todos los planos, el espacio preepiglótico se observa mejor en la reconstrucción sagital y el paraglótico en la coronal (fig. 1B y C). La mucosa que recubre las comisuras, anterior y posterior, y el espacio subglótico es muy *Autor para correspondencia. Correo electrónico: [email protected] (A.J. Revert Ventura). 4-8 Capt 109.pag.indd 59 26/4/12 18:32:55 Radiología de cabeza y cuello 60 A B C Figura 1. Anatomía de la laringe. A) Reconstrucción en el plano coronal de tomografía computarizada. El ventrículo laríngeo (flecha) sirve de referencia para identificar los pisos de la laringe, supraglótico (SPG), glótico (G) y subglótico (SG). B) Reconstrucción sagital. El espacio preepiglótico (asterisco). Epiglotis (flecha gruesa). C) Reconstrucción coronal. El espacio paraglótico corresponde al espacio graso paralaríngeo (flechas cortas). Se ven los bordes laterales de la epiglotis (flecha doble), las bandas ventriculares (flecha discontinua) y las cuerdas vocales (flecha larga). fina (< 2 mm) y está pegada al pericondrio de los cartílagos y delimitada por el aire endolaríngeo. La presencia de un engrosamiento mucoso o de otro tejido debe considerarse como patológica. Hay 2 estructuras que no se identifican por imagen pero que contribuyen a dirigir la propagación de los tumores laríngeos. Son el cono elástico y las membranas tirohioidea y cricotiroidea. El cono elástico dificulta la extensión subglótica de los tumores por el espacio paraglótico y los dirige hacia el cartílago tiroideo. Las membranas tirohioidea y cricotiroidea son puntos débiles por los que se extienden las neoplasias a los espacios cervicales extralaríngeos sin afectar a los cartílagos. La hipofaringe es la continuación de la faringe hasta el esófago cervical, se extiende desde el plano del hueso hioides hasta la porción inferior del cartílago cricoides y está situada por detrás de la laringe. No hay hitos anatómicos que permitan delimitarla. Los repliegues aritenoepiglóticos y la cara posterior del cricoides marcan el límite anterior. También se divide en 3 regiones: los senos piriformes, la pared posterior de la hipofaringe y el área retrocricoidea. La transición entre hipofaringe y esófago se intuye con el cambio de morfología, pasa de ser una estructura aplanada a tener una forma redondeada. La forma de desplegar 4-8 Capt 109.pag.indd 60 adecuadamente estas regiones es realizando la adquisición con la maniobra de Valsalva (fig. 3). Técnicas de imagen para la estadificación del descriptor T de los tumores de la laringe e hipofaringe El estudio por imagen de la extensión de los tumores es clave para una adecuada estadificación, ya que la exploración física tiene limitaciones en la valoración de los espacios anatómicos profundos. El estudio de la extensión local de los tumores debería realizarse antes de la biopsia o separarlo de ésta para que los fenómenos inflamatorios relacionados con la toma de la muestra no dificulten la interpretación de los hallazgos de imagen (fig. 4). Tanto la TC como la RM se utilizan para la evaluación de los pacientes con tumores de laringe e hipofaringe, y los protocolos de adquisición son los mismos debido a la estrecha relación anatómica que guardan estas 2 estructuras. No hay un protocolo de imagen “ideal” para el estudio de estas neoplasias. En la mayoría de los hospitales se prefiere la TC, debido a que tiene una disponibilidad y una 26/4/12 18:32:56 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe A B C D 61 E Figura 2. Anatomía de la laringe. Estudio de tomografía computarizada con respiración suave. A) Plano del pie de la epiglotis (asterisco), el espacio preepiglótico (flechas) y los repliegues aritenoepiglóticos (flechas discontinuas). B) Plano basal de la epiglotis. C) Plano de las bandas ventriculares. Se identifica el espacio paraglótico (flechas naranjas) y, anteriormente, la porción inferior del preepiglótico (flecha blanca). D) Plano de cuerdas vocales con el músculo tiroaritenoideo (líneas), comisura anterior (flecha fina) y comisura posterior (flecha gruesa), entre el cartílago tiroideo y el músculo se observa una banda grasa del espacio paraglótico (flecha naranja). La apófisis vocal de los aritenoides y el borde superior del cricoides marcan el plano de las cuerdas vocales. E) Plano subglótico, la mucosa está pegada al pericondrio. rapidez mayores, reservando la RM para resolver problemas concretos. Los equipos de TC multidetectores (TCMD) permiten la adquisición con tiempos muy cortos, con los que se consiguen estudios con una calidad diagnóstica suficiente, aun en pacientes poco colaboradores. El estudio se realiza tras la administración de contraste, con un volu- 4-8 Capt 109.pag.indd 61 men ajustado al peso del paciente (70-120 ml) y un flujo variable, pero en líneas generales bajo, 2 ml/s. También se pueden utilizar protocolos de inyección bifásicos, 50 ml a 1 ml/s, una demora de 30 s y una segunda inyección de 30 ml a 2 ml/s. En nuestra experiencia, este protocolo consigue una buena opacificación de la lesión y de los vasos, 26/4/12 18:32:57 Radiología de cabeza y cuello 62 A Figura 4. Biopsia de carcinoma de seno piriforme derecho (asterisco) con hematoma secundario a ésta (flecha pequeña). Adenopatía necrosada en la cadena yugular media derecha (flecha grande). B C Figura 3. Anatomía de la hipofaringe. A) Estudio basal con respiración suave. No hay distensión del seno piriforme izquierdo (flecha). B) Adquisición tras la maniobra de Valsalva, se distienden los senos piriformes (flechas), no hay límite anatómico que señale la pared faríngea posterior (flecha negra) y, anteriormente a los senos, se ven los repliegues aritenoepiglóticos (flecha con cabeza doble). C) Área retrocricoidea (flechas pequeñas). 4-8 Capt 109.pag.indd 62 especialmente de la carótida, en los casos en los que hay sospecha de infiltración por el tumor o sus adenopatías. En ambos protocolos, el contraste se empuja con un bolo de 40 ml de suero fisiológico a un flujo de 2 ml/s; tras finalizar esta administración se lanza la adquisición. Se adquiere desde el paladar duro hasta el mango del esternón. El paciente se coloca en decúbito supino, con los brazos a lo largo del tórax y se le indica que no degluta y que procure respirar suavemente durante el estudio. Es aconsejable que la adquisición dure menos de 10 s para evitar artefactos de movimiento. El grosor de corte debe ser de al menos 1 mm para obtener unas reconstrucciones multiplanares de calidad, y el campo de visión de entre 18 y 22 cm. La adquisición debe ser paralela a C3-C4 para tener un plano adecuado de los ventrículos y cuerdas vocales. Si no se ha realizado así, se deben obtener reconstrucciones en este plano para identificar las cuerdas vocales y las comisuras. La reconstrucción sagital facilita la valoración de la comisura anterior, del espacio preepiglótico y la extensión a la valécula y base de la lengua. Las reconstrucciones coronales son adecuadas para visualizar la infiltración del espacio paraglótico y la extensión transglótica. Además, es recomendable realizar reconstrucciones con algoritmo de hueso para evaluar los cartílagos. La adquisición de imágenes con maniobras funcionales optimiza los estudios de TC en la valoración de determinadas áreas críticas y, habitualmente, se realizan tras el examen inicial. Las maniobras funcionales son dos: la fonación en “i” y la maniobra de Valsalva modificada (fig. 5). Ambas utilizan el aire como contraste para delimitar las estructuras y las lesiones. La maniobra de fonación es la más útil para la valoración de los tumores laríngeos, dis- 26/4/12 18:32:58 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe 63 A B C D Figura 5. Maniobras funcionales. A) Neoplasia del tercio medio de la cuerda vocal derecha. B) En la fonación, la movilidad de la cuerda es normal. C) Carcinoma del seno piriforme izquierdo, la neoplasia (asterisco) no se puede delimitar con el estudio con respiración suave. Se acompaña de adenopatías en la cadena yugular media (flecha negra). D) Adquisición con maniobra de Valsalva, se distiende el seno y se aprecia el repliegue aritenoepiglótico (flecha blanca) engrosado, pero sólo está afectada la cara de la hipofaringe. La grasa del espacio paraglótico está conservada (flecha naranja). En la exploración clínica, la cara laríngea del repliegue era normal. Sólo hay una sublocalización afectada con adenopatías, estadio T1 N2. tiende los ventrículos y permite valorar el borde medial de las cuerdas. La maniobra de Valsalva es más útil para la valoración de los tumores de hipofaringe. Durante la adquisición, el paciente espira manteniendo los labios cerrados. Así, se distienden los senos piriformes separando la región retrocricoidea de la pared faríngea posterior, lo que permite identificar lesiones pequeñas y valorar la extensión de los tumores a otras regiones. Con esta maniobra se consiguen reducir tanto resultados falsos positivos como falsos negativos. Recordar que con las maniobras funcionales, especialmente con la de Valsalva, se produce un descenso de la laringe y la hipofaringe. Hay que tenerlo en cuenta al planificar el límite caudal de la adquisición, para evitar que quede fuera de ella la porción inferior de los senos piriformes y el espacio subglótico. 4-8 Capt 109.pag.indd 63 El estudio con RM precisa de una mayor colaboración por parte del paciente para que no se produzcan artefactos por el movimiento. Se realiza con la bobina de cuello y hay que adquirir desde el paladar duro hasta el estrecho cervicotorácico. Es muy importante para planificar el estudio mediante RM conocer previamente la localización del tumor para elegir la combinación de planos de adquisición. El grosor de corte oscila entre 3 y 5 mm, con un intervalo entre cortes de 0-1 mm, un campo de visión de al menos 18 cm y una matriz de 256 × 512 o 512 × 512. Las secuencias básicas incluyen planos transversales paralelos a las cuerdas vocales en turbo espín eco T2 y espín eco T1 y, posteriormente, las adquisiciones con contraste. La obtención de otros planos debe ir focalizada a evaluar regiones anatómicas concretas. 26/4/12 18:32:58 64 Radiología de cabeza y cuello ción condiciona el manejo terapéutico de los pacientes y su pronóstico4. Estadificación de las neoplasias de laringe, descriptor T Figura 6. A) Tomografía computarizada (TC) de cuello con contraste. Neoplasia en el seno piriforme izquierdo (asterisco) con extensión laríngea al repliegue aritenoepiglótico y al espacio paraglótico (flechas pequeñas), y extralaríngea, a través de la membrana tirohioidea, al espacio carotídeo con pérdida del plano graso de separación con la carótida pero sin criterios radiológicos de infiltración vascular (flecha larga). La extensión extralaríngea hace que sea T4a. B) TC de tórax en el mismo paciente al momento de la estadificación. Nódulo espiculado en lóbulo inferior izquierdo. La punción confirmó una neoplasia broncopulmonar. Muchos protocolos de trabajo incluyen, en el estudio inicial y en el seguimiento, la exploración del tórax por TC. La asociación elevada con el carcinoma de pulmón en el momento del diagnóstico (fig. 6A y B) así como la existencia de metástasis en los tumores con estadios avanzados justifican esta inclusión. La frecuencia de estas segundas neoplasias oscila entre el 15 y el 19%. Además, su detec- 4-8 Capt 109.pag.indd 64 El sistema TNM es el método de estadificación de las neoplasias que más se utiliza para la clasificación de los tumores de la laringe e hipofaringe. El descriptor T de los tumores laríngeos en las distintas localizaciones se encuentra en la tabla 15. La estadificación de los carcinomas de laringe se basa en la localización regional, en la movilidad de las cuerdas y en la infiltración submucosa. Para determinar la extensión submucosa se precisa de las técnicas de imagen. Únicamente los tumores glóticos pequeños o superficiales (T1) se estadifican con una eficacia alta sólo con la exploración clínica y sin necesidad de la TC. En cambio, si la comisura anterior está afectada es obligatorio realizar una prueba de imagen para descartar una infiltración submucosa o cartilaginosa oculta a la endoscopia6,7. En cada uno de los puntos implicados en la estadificación veremos cuáles son los signos que permiten identificarlos, la eficacia de la técnica y las consecuencias que conllevan en el tratamiento. Los puntos en los que hay que prestar especial atención en los estudios de imagen se pueden resumir en: ¿Cuál es la localización del tumor? Determinar si es supraglótico, glótico o subglótico. ¿Cómo están los espacios submucosos, el prepiglótico y el paraglótico?, ya que condiciona cambios en el estadio y en las técnicas quirúrgicas. ¿Están afectadas las comisuras anterior o posterior?, puesto que oculta la diseminación tumoral, a su través se facilita la invasión en profundidad y tiene implicaciones en la planificación de la cirugía. ¿Hay infiltración cartilaginosa?, porque cambia el estadio y según qué cartílago el tipo de cirugía. ¿Cuál es el volumen de la tumoración?, ya que tiene repercusión pronóstica dependiendo de la localización. Localización del tumor y vías de diseminación En las lesiones circunscritas es sencillo identificar su origen, mientras que en los tumores voluminosos puede ser imposible. En estos casos, la identificación del “epicentro” de la tumoración y el conocimiento de las vías de diseminación pueden orientar sobre el origen de la lesión. Los tumores supraglóticos son los más frecuentes en la laringe y tienen varios puntos de origen: epiglotis, bandas ventriculares, ventrículo, repliegues aritenoepiglóticos. Los que se originan en la porción suprahioidea de la epiglotis producen ulceraciones que terminan destruyéndola, mientras que los tumores de la epiglotis infrahioidea tienen una capacidad de diseminación mayor. Ambos se pueden extender al espacio preepiglótico, caudalmente desde el pie de la epiglotis a la comisura anterior y al espacio subglótico, cranealmente por el pliegue glosoepiglótico a las valéculas 26/4/12 18:32:58 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe 65 Tabla 1 − Estadificación del carcinoma de laringe Supraglotis • T1. Tumor limitado a una localización de la supraglotis con cuerda vocal móvil • T2. Tumor que invade la mucosa de más de una localización de la supraglotis o se extiende a la glotis o fuera de la supraglotis (mucosa de la base de la lengua, valécula o pared medial del seno piriforme) pero sin fijación de la hemilaringe • T3. Tumor limitado a la laringe con parálisis de la cuerda vocal y/o que invade cualquiera de las siguientes localizaciones: el área retrocricoidea, la pared medial del seno piriforme, el espacio preepiglótico, el espacio paraglótico, la cara interna del cartílago tiroideo • T4a. Enfermedad local moderadamente avanzada. Tumor que invade a través de los cartílagos tiroideos o invade los tejidos extralaríngeos • T4b. Enfermedad local muy avanzada. Tumor que invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras mediastínicas Glotis • T1. Tumor limitado a la(s) cuerda(s) vocal(es) que puede afectar a la comisura, anterior o posterior, pero con movilidad normal – T1a. Tumor limitado a una cuerda vocal – T1b. Tumor que afecta a ambas cuerdas vocales • T2. Tumor que se extiende a la supraglotis y/o a la subglotis o hay deterioro de la movilidad de la cuerda vocal • T3. Tumor limitado a la laringe con parálisis de la cuerda vocal o invade el espacio paraglótico o hay erosión de la cortical interna del cartílago tiroideo • T4a. Enfermedad local moderadamente avanzada. Tumor que invade la cara externa del cartílago tiroideo y/o invade los tejidos extralaríngeos (musculatura extrínseca de la lengua, musculatura infrahioidea, glándula tiroidea, tráquea o esófago) • T4b. Enfermedad local muy avanzada. Tumor que invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras del mediastino Subglotis • T1. Tumor limitado a la subglotis • T2. Tumor que se extiende a la(s) cuerda(s) vocal(es) con movilidad normal o deteriorada • T3. Tumor limitado a la laringe con la cuerda vocal paralizada • T4a. Enfermedad local moderadamente avanzada. Tumor que invade cartílago tiroideo o cricoideo y/o invade los tejidos extralaríngeos (musculatura extrínseca de la lengua, musculatura infrahioidea, glándula tiroidea, tráquea o esófago) • T4b. Enfermedad local muy avanzada. Tumor que invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras del mediastino y a la base de la lengua (figs. 7 y 8). Los tumores que tienen su origen en las bandas ventriculares o ventrículo, infiltran en profundidad hacia el espacio paraglótico y en dirección caudal a las cuerdas vocales y subglotis (fig. 9). Las neoplasias de los repliegues aritenoepiglóticos crecen en profundidad al espacio paraglótico e infiltran las cuerdas vocales falsas (bandas ventriculares) y verdaderas. El crecimiento en dirección posterior afecta al seno piriforme. En muchas ocasiones, no es posible diferenciar si el foco original se encuentra en el seno piriforme (neoplasia de hipofaringe) o en el repliegue aritenoepiglótico (neoplasia laríngea). En dirección posteroinferior pueden infiltrar la articulación cricoaritenoidea, condicionando el tipo de cirugía. Los puntos clave que hay que tener muy en cuenta en el estudio de los tumores supraglóticos son los espacios preepiglótico y paraglótico que indican un estadio T3, y la exten- 4-8 Capt 109.pag.indd 65 sión a la base de la lengua; si la infiltración es sólo mucosa corresponde a un T2, mientras que si es profunda cambia a T4. Estas extensiones, además de cambios de estadio, determinan los tipos de cirugía que se pueden emplear. Los carcinomas glóticos suelen iniciarse en el borde libre del tercio anterior de las cuerdas vocales. Desde aquí, por afectación de la comisura anterior, pueden cruzar la línea media T1b (fig. 10). También pueden extenderse desde la comisura anterior, cranealmente, al compartimiento supraglótico y alcanzar el espacio preepiglótico T3 y, caudalmente, a la subglotis T2. El origen en la porción posterior es menos frecuente y tiende a afectar a la comisura posterior y a la articulación cricoaritenoidea. La extensión lateral de los tumores glóticos produce afectación del espacio paraglótico T3 y a continuación del cartílago tiroideo T4. El espacio paraglótico sirve de vía de disemi- 26/4/12 18:32:59 66 Radiología de cabeza y cuello Figura 7. Neoplasia supraglótica T3. A) Tumoración con extensa afectación de la epiglotis (asterisco) que en profundidad afecta al espacio preepiglótico (flecha naranja). Hay adenopatías yugulares bilaterales (flechas negras). B) En el plano de las bandas se ve la afectación del espacio paraglótico (flechas blancas largas). C) Plano de cuerdas vocales. Hay extensión extralaríngea a través de la membrana tirocricoidea, ésta pasaría desapercibida en la exploración clínica. D) Reconstrucción en plano sagital. Extensa afectación de la epiglotis (flechas pequeñas) que en profundidad afecta al espacio preepiglótico (flecha naranja). La tumoración hasta el ventrículo (flecha larga). Por el crecimiento a espacios extralaríngeos se estadificó como neoplasia supraglótica T4a N2c. nación de los tumores del piso glótico al supraglótico y viceversa. El carcinoma subglótico es un tumor poco frecuente, la mayoría representa la extensión inferior de los tumores glóticos o supraglóticos. Algunos autores, desde el punto de vista de imagen, los agrupan con las neoplasias glóticas. En la mayoría de los casos hay afectación de las cuerdas vocales, por lo que no es posible determinar cuál es el 4-8 Capt 109.pag.indd 66 origen anatómico inicial, la cuerda o el espacio subglótico. Muchas veces son lesiones circunferenciales que pueden infiltrar precozmente el cartílago cricoides. También se pueden extender en dirección caudal a la tráquea y al esófago cervical T4. Resaltar que la invasión en los tumores de la laringe del esófago corresponde a una enfermedad localmente avanzada T4a, pero en los tumores de hipofaringe esta misma invasión condiciona un T3. 26/4/12 18:32:59 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe 67 Neoplasias supraglóticas y glóticas localmente circunscritas frente a avanzadas (T1-T2 frente a T3-T4) En los tumores que se originan en la supraglotis y en la glotis, en ausencia de adenopatías, el tratamiento de los estadios bajos, T1-T2 N0, tiene unos resultados similares cuando se tratan con cirugías conservadoras o con radioterapia, mientras que los estadios localmente avanzados, T3-T4, ya condicionan cirugía más amplia o tratamientos de conservación de órgano con quimio y radioterapia combinadas. Por tanto, es crítico separar estos 2 grupos de pacientes. Gran parte de esta información se obtiene de los estudios de imagen. Los datos que determinan el paso a T3 son: la extensión al espacio preepiglótico, al espacio paraglótico, la fijación de la hemilaringe o la lisis de la cortical interna del cartílago tiroideo. La destrucción del cartílago tiroideo y la extensión extralaríngea marcan los estadios T4. El espacio preepiglótico y paraglótico Figura 8. Neoplasia supraglótica. A) Plano transversal. La tumoración infiltra el espacio preepiglótico (flecha negra) y se extiende a los repliegues aritenoepiglóticos. Adenopatía necrosada en la cadena yugular media izquierda (flecha pequeña), en los planos inferiores no presentados eran bilaterales. B) Reconstrucción sagital con infiltración submucosa que alcanza a la musculatura extrínseca de la lengua (flechas blancas largas). La extensión al suelo y musculatura extrínseca condiciona T4a N2c 4-8 Capt 109.pag.indd 67 Identificar la extensión a estos espacios submucosos es imposible sólo con la exploración clínica y endoscópica. Por imagen, la infiltración tumoral de estos espacios se aprecia al comprobar la sustitución de la grasa normal por otro tipo de tejido. Aunque esta infiltración se identifica en los planos axiales, se puede demostrar con más claridad en las reconstrucciones sagitales del espacio preepiglótico y en las coronales del espacio paraglótico (figs. 7 y 9). La eficacia global, tanto de la TC como de la RM, para la valoración de estos espacios es alta y oscila entre el 86 y el 95%, y no hay diferencias significativas entre las 2 técnicas3,8. El edema y los cambios reactivos secundarios a la existencia de un tumor son las causas de los falsos positivos en la valoración de estos espacios. En el plano de las cuerdas vocales, la eficacia de la TC en la valoración del espacio paraglótico desciende porque gran parte del espacio está ocupado por el músculo tiroaritenoideo y el plano graso es mínimo. La alteración de grosor del músculo o de sus características de densidad y señal pueden hacer sospechar su infiltración. La extensión al espacio preepiglótico se da con más frecuencia en los tumores supraglóticos; en cambio, la extensión paraglótica se presenta tanto en los tumores supraglóticos como en los glóticos. De hecho, la vía por la que los tumores se extienden del piso supraglótico al glótico y viceversa es junto a la comisura anterior. Además de en el estadio, la afectación de estos espacios tiene implicaciones terapéuticas y pronósticas. La invasión preepiglótica aumenta el riesgo de diseminación ganglionar y reduce las probabilidades de control de la enfermedad cuando se considere la radioterapia como único tratamiento. Por otro lado, el grado de afectación de estos espacios determina la planificación quirúrgica. La infiltración amplia del espacio preepiglótico con extensión al hioides contraindica las cirugías supraglóticas conservadoras como la laringuectomía supracricoidea, en la que se requiere realizar una pexia 26/4/12 18:33:00 Radiología de cabeza y cuello 68 A C B D Figura 9. Neoplasia transglótica. A) Plano de bandas. Tumoración en el espacio paraglótico izquierdo. El cartílago aritenoides izquierdo está escleroso (flecha fina) y por detrás. B) Plano glótico, la lesión afecta a la cuerda (asterisco) e infiltra el espacio paraglótico. Comparar con el lado izquierdo, en el que se aprecia el plano graso de separación con el cartílago tiroideo (flecha negra). No obstante, esta diferenciación es difícil en el plano de músculo tiroaritenoideo. C) Plano subglótico, se ve la extensión anterior de la tumoración (flecha blanca) y la esclerosis del cartílago cricoides (flecha negra). D) En la reconstrucción coronal se observa la afectación del espacio paraglótico (flecha naranja) y la extensión subglótica. La extensión al espacio paraglótico hace que la lesión sea T3. En la exploración clínica la cuerda vocal estaba paralizada. entre el cricoides y el hioides. En los tumores supraglóticos, la infiltración del espacio paraglótico que se extiende por debajo del ventrículo contraindica la laringuectomía supraglótica. En los tumores glóticos, la infiltración tumoral del espacio paraglótico que contacta con el pericondrio del cartílago tiroideo excluye la realización de las cirugías con resección mediante láser. 4-8 Capt 109.pag.indd 68 Los cartílagos La invasión franca de los cartílagos laríngeos reduce la probabilidad de curación de los pacientes tratados con radioterapia e incrementa el riesgo de radionecrosis. Las mínimas infiltraciones cartilaginosas se pueden tratar con éxito con radioterapia. Del mismo modo, la afecta- 26/4/12 18:33:00 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe Figura 10. Neoplasia glótica. Neoplasia que afecta al tercio anterior de ambas cuerdas y a la comisura anterior. No hay afectación del cartílago tiroideo ni extensión a partes blandas anteriores. En la exploración clínica las cuerdas conservaban la movilidad. Se clasificó como tumor de glotis T1b ción o no de los cartílagos determina los tipos de cirugía que se pueden emplear. Por otra parte, los cartílagos, al ser submucosos, quedan fuera de la exploración clínica, por lo que son responsabilidad exclusiva de la radiología. Por todo ello es importante demostrar por imagen la invasión cartilaginosa, ya que influye tanto en la estadificación como en la planificación del tratamiento y en el pronóstico de los pacientes. Debido a las características que tienen los cartílagos, con áreas de matriz condral junto a otras osificadas, es difícil demostrar su infiltración y esto resulta más evidente en el cartílago tiroides. De todas maneras hay que recordar que en la estadificación TNM sólo se recoge el estado del cartílago tiroideo. La lisis de la cortical interna del cartílago señala un estadio T3, mientras que la extensión a la cortical externa implica un estadio T4. La infiltración de los otros cartílagos supone un T4 si la destrucción de éste condiciona una extensión extralaríngea. La afectación de los aritenoides y del cricoides tiene implicaciones en la planificación quirúrgica pero no de estadio. En TC se emplean varios signos para identificar la infiltración de los cartílagos: el crecimiento extralaríngeo, la destrucción de los dos lados del cartílago afectado, la mínima destrucción de la cortical interna y la esclerosis (fig. 9). Cada uno de estos signos tiene una sensibilidad o especificidad diferente pero, en líneas generales, la sensibilidad es baja y la especificidad alta, con una eficacia que oscila entre el 75 y el 80%9. La destrucción del cartílago tiene la mayor especificidad pero con una baja sensibilidad, ya que se suele ver en los tumores avanzados (fig. 11). Por el contrario, la esclerosis es un hallazgo 4-8 Capt 109.pag.indd 69 69 Figura 11. Neoplasia supraglótica (asterico) que provoca una destrucción de ambas láminas tiroideas (flechas cortas) con tejido tumoral entre los cartílagos y la musculatura infrahioidea (flechas largas) T4a. frecuente y, aisladamente, no es un buen indicador de infiltración. Puede deberse a una reacción inflamatoria por el contacto del tumor con el cartílago e, incluso, en los aritenoides puede tratarse de una variante anatómica. Así, la especificidad de este signo varía de un cartílago a otro. En el cartílago tiroideo es baja, del 40%; en los aritenoides y cricoides es mayor, siendo del 76 y 79%, respectivamente. Sí que se considera significativa la esclerosis asimétrica del cartílago cricoides acompañada de esclerosis del aritenoides homolateral, con un valor predictivo positivo alto, 75%. Con la combinación de la extensión tumoral extralaríngea y erosión o lisis en los cartílagos y esclerosis en los cartílagos aritenoides y cricoides (no en el tiroides) se consigue unos resultados razonables para determinar la infiltración de los cartílagos, con una sensibilidad del 82%, una especificidad del 79% y un valor predictivo negativo del 91%10. Los criterios de afección cartilaginosa en RM son: una baja intensidad de la señal en T1 del cartílago, una intensidad de señal alta en T2, una captación del cartílago subyacente al tumor y el crecimiento del tumor a ambos lados del cartílago. La sensibilidad de la RM es del 89%, el valor predictivo del 94% y la especificidad del 84%. Recientemente se han introducido unas modificaciones en los criterios de RM que mejoran la capacidad para diferenciar entre infiltración tumoral e inflamación peritumoral11. Estos autores proponen como indicadores de infiltración las alteraciones de señal dentro del cartílago, pero tomando como referencia la señal del tumor. Si en las secuencias potenciadas en T2 y en T1 tras el contraste, la alteración de señal del cartílago es igual a la del tumor debe considerarse como infiltrado. Por el contrario, la mayor señal en T2 o mayor captación en T1 se considera reacción inflamatoria 26/4/12 18:33:01 70 Radiología de cabeza y cuello deo. La comisura posterior es el área comprendida entre los 2 cartílagos aritenoideos y, también, sólo está cubierta por mucosa (fig. 2). Habitualmente, las comisuras se valoran muy bien con la exploración endoscópica. En cambio, pueden no ser visibles en casos de tumores supraglóticos exofíticos, siendo únicamente valorables mediante TC. Las comisuras deben verse de manera nítida, con el aire de la luz laríngea en contacto con el cartílago. Cualquier tejido con densidad de partes blandas interpuesto se debe considerar como patológico. Además, la comisura anterior es un punto débil del cartílago que a este nivel carece de pericondrio que pueda frenar el crecimiento tumoral. Así, si el tumor utiliza la comisura anterior para pasar de una cuerda a otra, el cambio de estadio es apenas relevante, de T1a a T1b (fig. 10), mientras que si hay una extensión profunda con infiltración del cartílago y de la musculatura pretiroidea, sí que hay un cambio muy significativo en el descriptor T, que pasaría de T1 a T4. Además, esta extensión anterior condiciona la selección del tipo de cirugía y puede contraindicar las cirugías conservadoras de la voz. Por otra parte, la comisura anterior sirve de vía de diseminación tumoral supra y subglótica. Por tanto, siempre que se identifique en la endoscopia una lesión de la comisura anterior, es imprescindible realizar TC para descartar una infiltración precoz del cartílago tiroideo no sospechada clínicamente12. Por otro lado, la extensión a la comisura posterior constituye una contraindicación de la laringuectomía supracricoidea. Extensión subglótica Figura 12. A) Neoplasia del seno piriforme. La tumoración (asterisco) se extiende al espacio paraglótico izquierdo (flecha naranja), al espacio cervical anterior (flechas blancas) y provoca una atrapamiento de la carótida común izquierda (flecha negra); este hallazgo convierte a la estadificación en T4b. B) Plano de esófago. Se observa la extensión al esófago cervical (flecha negra gruesa) y a la glándula tiroidea (flecha discontinua). Adenopatías necrosadas en la cadena yugular baja (flecha corta). Estadio T4b. peritumoral. En líneas generales, la sensibilidad de la RM es ligeramente mayor que la del TC pero su especificidad es menor. La eficacia de las dos técnicas es similar y oscila entre el 80 y el 85%. Las comisuras anterior y posterior La comisura anterior es la banda mucosa que une la porción anterior de las cuerdas vocales sobre el cartílago tiroi- 4-8 Capt 109.pag.indd 70 Como sucede con las comisuras, no se debe ver tejido con densidad de partes blandas que contacte con el pericondrio del cartílago cricoideo. Es crucial determinarla en la estadificación pero a su vez también lo es para sentar la indicación del tipo de cirugía. Habitualmente, con los planos transversales se pueden identificar estas extensiones al identificar tejido sobre el cartílago, aunque las reconstrucciones coronales también permiten detectarla (fig. 9). La destrucción del cartílago cricoideo también se considera un signo de extensión subglótica. Extensión extralaríngea La pérdida de los planos grasos y el desplazamiento o el engrosamiento de las estructuras adyacentes son los signos que permiten identificarla. Esta extensión depende en gran medida de la localización inicial del tumor. En los tumores supraglóticos es frecuente la progresión craneal hacia las estructuras de la base de la lengua (fig. 8). La extensión tumoral por la mucosa mantiene el estadio en T2; en cambio, la infiltración en profundidad con invasión de la musculatura extrínseca de la lengua lo transforma en T4. Los tumores desde la comisura anterior pueden infiltrar el cartílago tiroideo y extenderse a la musculatura pretiroidea, T4a (fig. 11). El crecimiento posterior de los carcinomas supra o glóticos hace que invadan la hipofaringe. En la mayoría de las ocasiones la diseminación extralarín- 26/4/12 18:33:01 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe gea no se acompaña de afectación cartilaginosa, sino que se produce a través de las membranas (fig. 7). La inflamación peritumoral puede, tanto en TC como en RM, conducir a una sobrestimación de la extensión tumoral siendo ésta la causa de falsos positivos en la estadificación. La fijación de la laringe La fijación de la cuerda o hemilaringe es uno de los indicadores para la estadificación T; demostrarla indica un estadio T3. Se identifica fácilmente con la endoscopia, mientras que en imagen se correlaciona con la infiltración de la articulación cricoaritenoidea y la extensión al espacio paraglótico. Además, las maniobras funcionales pueden ponerla de manifiesto. Identificar tumores T4b. Criterios de irresecabilidad La separación dentro del estadio T4 tiene como finalidad separar el grupo de pacientes en que, pese a tener una enfermedad extensa, la resección quirúrgica es posible con una morbilidad aceptable. El grupo de pacientes con tumores 4a precisa de una cirugía amplia, pero son lesiones resecables. El grupo 4b tiene una proporción alta de pacientes con mal pronóstico y son tumores irresecables. Los criterios para la inclusión en el estadio T4b son: afectación vascular, infiltración del espacio prevertebral y extensión mediastínica. Se considera irresecable por infiltración vascular si la carótida se encuentra rodeada, por el tumor (fig. 12) o sus adenopatías, en un sector de 270º o más de su circunferencia13. La presencia de tumor intraluminal sería otro criterio específico aunque poco sensible. Los tumores que pueden infiltrar el espacio prevertebral son los de hipofaringe y, ocasionalmente, los de laringe muy avanzados. Clínicamente se define como la infiltración de la musculatura prevertebral. En radiología, la presencia de un plano graso de separación es un indicador excelente de que no existe infiltración14. Los signos que sugieren infiltración son las alteraciones de atenuación o de señal y morfología de la musculatura prevertebral, la existencia de captación y la irregularidad en la interfase entre el tumor y la musculatura. La eficacia de estos signos no es muy elevada (60%), con una sensibilidad alta pero con especificidad baja. De este modo, si no hay otras condiciones que contraindiquen la cirugía, el diagnóstico de infiltración, y por lo tanto la irresecabilidad, debe confirmarse quirúrgicamente15. Así, el diagnóstico por imagen de ausencia de infiltración es muy fiable; por el contrario, la infiltración de éste no lo es, salvo que haya una extensión grosera. La extensión caudal al mediastino es poco frecuente en los tumores de cabeza y cuello pero, aunque rara, sí se puede ver en los tumores de laringe subglóticos e hipofaringe. No están bien establecidos los criterios de infiltración, pero empíricamente la infiltración de la grasa mediastínica o de los troncos supraaorticos o del cayado, de la tráquea o del 4-8 Capt 109.pag.indd 71 71 Tabla 2 − Estadificación del carcinoma de hipofaringe • T1. Tumor limitado a una localización de la hipofaringe y/o tiene < 2 cm de diámetro mayor • T2. Tumor que invade más de una localización de la hipofaringe o una localización adyacente, o mide > 2 cm pero no más de 4 cm y sin fijación de la laringe • T3. Tumor > 4 cm o con parálisis de la laringe o extensión al esófago • T4a. Enfermedad local moderadamente avanzada. Tumor que invade los cartílagos tiroideo o cricoides, el hueso hioides, la glándula tiroidea o invade la musculatura infrahioidea o el tejido celular subcutáneo anterior • T4b. Enfermedad local muy avanzada. Tumor que invade el espacio prevertebral, envuelve la arteria carótida o invade las estructuras mediastínicas esófago torácico, deben considerarse como indicativos de extensión a este espacio. Los criterios de infiltración traqueal incluyen: alteración de señal del cartílago traqueal, presencia de lesiones intraluminales y atrapamiento circunferencial > 180º. La combinación de cualquiera de los signos da una sensibilidad del 100% y una especificidad del 84%16. Los criterios para afectación del cayado aórtico son: obliteración del plano graso de separación y un ángulo de contacto > 45º con la aorta. Estadificación los tumores de la hipofaringe T En el estudio de extensión de estos tumores es muy recomendable completar el estudio convencional con la maniobra de Valsalva, ya que distiende la hipofaringe y consigue precisar la localización del tumor y su extensión y, por lo tanto, mejorar la determinación del T. La estadificación del carcinoma de hipofaringe se encuentra en la tabla 25. El descriptor T de los carcinomas de hipofaringe depende de la localización, del tamaño de la tumoración y de la extensión a las estructuras vecinas. La medición del tamaño tumoral debe realizarse en el diámetro mayor. La extensión a más de una localización regional, la invasión de la laringe pero sin fijación de ésta o el tamaño > 2 cm marcan el paso a T2. La fijación de la hemilaringe o un tamaño > 4 cm determinan el estadio T3. La invasión del esqueleto laríngeo (hioides, tiroides y cricoides), la glándula tiroides y los tejidos blandos prelaríngeos determinan el paso a estadio T4a. Una mayor extensión local con infiltración prevertebral de la carótida o la extensión mediastínica indican la irresecabilidad de la tumoración, T4b. En imagen se aplican los mismos signos de afectación de las estructuras para los tumores de la hipofaringe que para los carcinomas de laringe con iguales resultados y lo mismo sucede con los criterios de irresecabilidad (fig. 12). Por su localización, estos tumores tienden a extenderse cranealmente a la orofaringe, hacia delante a la laringe 26/4/12 18:33:01 Radiología de cabeza y cuello 72 Tabla 3 − Cirugía de laringe: indicaciones y contraindicaciones Técnica Resección Indicación Contraindicación Cordectomía Resección cordal Tumores glóticos T1 y T2 Extensión extracordal Hemilaringuectomía Resección de la cuerda Tumores glóticos T1 y vertical hacia arriba y de un tercio T2 unilaterales de la cuerda contralateral Extensión de más de un tercio de la cuerda contralateral o de la articulación cricoaritenoidea Laringuectomía supraglótica Extensión transglótica, paraglótica, invasión extensa de cartílagos Supraglótica por encima Tumores supraglóticos T3 de las cuerdas conservando por extensión los aritenoides preepiglótica Laringuectomía Supraglotis con la porción Tumores transglóticos supracricoidea con membranosa de cricohioidopexia o las cuerdas y el cartílago epiglotopexia tiroideo preservando un aritenoides Afectación del espacio preepiglótico, del hioides, de la base de la lengua, de la comisura posterior, afectación de ambos aritenoides, del cricoides o extensión subglótica > 1 cm Laringuectomía total Resección laríngea Tumores avanzados sin posibilidad de cirugía conservadora Criterios de irresecabilidad Laringuectomía total ampliada Tumores con extensión a la base de la lengua, hipofaringe o partes blandas prelaríngeas Criterios de irresecabilidad Resección laríngea con glosectomía parcial o faringuectomía o prelaríngea y caudalmente al esófago. Los tumores de los senos piriformes son los más frecuentes de la hipofaringe. Pueden extenderse a la pared posterior de la hipofaringe y al área retrocricoidea, T2. En dirección anterior infiltran la laringe por el repliegue aritenoepiglótico T2 y espacio paraglótico, si queda fija la cuerda ya corresponde a T3 y si los cartílagos laríngeos está afectados a T4a. Habitualmente se trata de una diseminación submucosa que pasa desapercibida en la exploración clínica. La extensión a las partes blandas del espacio cervical anterior mantiene el estadio T4a. Si la propagación es lateral infiltran los espacios carotídeo y cervical posterior; si la carótida queda englobada cumpliría criterios de irresecabilidad T4b. En sentido descendente infiltran el esófago cervical T3. Determinar esta extensión es crucial para planificar el tipo de cirugía, ya que en caso de existir, a la laringofaringuectomía debe asociarse una esofaguectomía parcial. Se considera como indicativo de infiltración del esófago cervical la presencia de tumor caudal al margen inferior del anillo cricoideo o que la distancia entre la cara posterior del cricoides y el cuerpo vertebral sea mayor de 1 cm. Los tumores que se originan en la pared posterior de la hipofaringe tienen una tendencia a diseminar en dirección craneocaudal, hacia la orofaringe y el esófago cervical. La extensión posterior, aunque por proximidad sería frecuente, en la práctica es rara. En cualquier caso, aun cuando no haya plano graso de separación 4-8 Capt 109.pag.indd 72 con la musculatura prevertebral, se necesita la confirmación quirúrgica de irresecabilidad T4b. Las neoplasias localizadas en el área retrocricoidea tienden a invadir la laringe provocando parálisis de la cuerda o extenderse al esófago cervical; ambas condicionan un T3. Tratamiento de las neoplasias de laringe e hipofaringe La exploración clínica consigue una valoración adecuada de la extensión superficial de los tumores de laringe e hipofaringe; por el contrario, la eficacia disminuye en la extensión en profundidad. A las técnicas de imagen les sucede lo contrario. Por estos motivos es fundamental que en los comités de oncología de los tumores de cabeza y cuello haya una colaboración estrecha entre clínicos y radiólogos para estadificar estos tumores y, por lo tanto, seleccionar la opción terapéutica óptima para cada paciente. Radioterapia Los pacientes con tumores en estadio T1-T2, N0 y aquellos con estadios avanzados en los que se considere un protocolo de conservación de órgano son candidatos a tratamiento con radioterapia. En los casos subsidiarios 26/4/12 18:33:01 Estadificación de los tumores de cabeza y cuello (T): laringe e hipofaringe 73 de tratamiento con radioterapia, la información adicional que deben aportar las técnicas de imagen son: el volumen tumoral, la existencia de afección de los cartílagos, la localización de infiltraciones, el estado de los espacios pre y paraglótico y la existencia de adenopatías, ya que son indicadores del pronóstico. Técnicas quirúrgicas Son varias las técnicas quirúrgicas que se emplean en el tratamiento de los carcinomas de laringe. La elección de éstas depende de la localización y extensión del tumor. En la evaluación por imagen se debe prestar especial atención a las estructuras críticas que determinan el tipo de cirugía que se va a emplear. Son referencias anatómicas clave la extensión a través de la línea media en las laringuectomías verticales, la extensión transglótica o paraglótica en las laringuectomías supraglóticas, la existencia y el grado de afección del espacio preepiglótico en las laringuectomías supraglótica y supracricoidea, la afectación bilateral de los aritenoides o de la comisura posterior en la laringuectomía supracricoidea, la afectación subglótica y la del cartílago cricoides en todas las laringuectomías conservadoras. En la tabla 3 se puede ver un resumen del tipo de resección, la indicación y qué hallazgos contraindican las diferentes técnicas quirúrgicas. Factores pronóstico identificables por imagen en las neoplasias de laringe e hipofaringe Diferentes trabajos han demostrado que, además de la estadificación de los tumores, las pruebas de imagen ofrecen información adicional de valor pronóstico. El análisis cuantitativo del volumen tumoral, la extensión a los espacios pre y paraglótico, y la infiltración cartilaginosa son factores que afectan al resultado de los tratamientos. El volumen tumoral es un ejemplo significativo. Se ha comprobado que de forma aislada es un indicador de la supervivencia en los pacientes tratados sólo con radioterapia. El volumen varía en función de la localización de la neoplasia. La TC es la técnica de imagen que más se ha usado para realizar la cuantificación del volumen tumoral, siendo un método efectivo y reproducible17,18. En los tumores supraglóticos, el volumen tumoral se correlaciona mejor incluso que el descriptor T para predecir el control local de la enfermedad. Independientemente del T, las lesiones con un volumen < 6 cm3 tienen una probabilidad mayor de control local de la enfermedad19. En la localización glótica, con estadio T3 y un volumen < 3,5 cm3, sin o con esclerosis de un cartílago, se consiguen mejores resultados que con volúmenes tumorales mayores20. En tumores de los senos piriformes T1 y T2, el volumen tumoral y la extensión del tumor en el plano del ápex del seno son 2 indicadores con valor pronóstico. Los tumores con un volumen < 6,5 cm3 y un diámetro de la lesión en el ápex del seno < 10 mm tienen un control de la enfermedad local alto, 94%21. 4-8 Capt 109.pag.indd 73 Figura 13. A) Carcinoma supraglótico (asterisco) con infiltración del espacio preepiglótico (flecha negra) y paraglótico (flecha naranja), estadio T3. B) Control tras el tercer ciclo de quimioterapia. Reducción de la tumoración quedando un tenue incremento de atenuación en el espacio preepiglótico (flecha). En los pacientes con tumores supraglóticos y glóticos, la infiltración en profundidad a los espacios preepiglótico y paraglótico incrementa la probabilidad de fracaso del tratamiento con radioterapia para tumores con un mismo volumen. Las alteraciones de señal en RM en los cartílagos laríngeos se correlacionan con un pronóstico más desfavorable en los tratamientos con radioterapia, sólo si el volumen tumoral es > 5 cm3 22. 26/4/12 18:33:02 74 En los tratamientos quirúrgicos, al igual que sucede con la radioterapia, el volumen tumoral obtenido por TC es un buen indicador del control local de la enfermedad23. Actualmente, en los estadios tumorales avanzados se puede optar por tratamientos que combinan quimio y radioterapia. La reducción del volumen tumoral > 50% tras la quimioterapia de inducción permite separar 2 grupos de pacientes, los respondedores de los no respondedores (fig. 13). En el primer grupo se opta por un tratamiento definitivo con radio y quimioterapia y en el segundo por cirugía radical. Conclusiones Las técnicas de imagen junto a la exploración clínica son imprescindibles para la estadificación de los tumores de laringe e hipofaringe. La valoración de la extensión mucosa se consigue con la exploración clínica, la submucosa sólo por imagen. La mayor aportación de la imagen en la estadificación de estos tumores consiste en identificar la invasión de los espacios anatómicos submucosos y extralaríngeos. En estos tumores es crítico separar a los pacientes con descriptores T1-T2 del grupo de pacientes T3-T4 por las implicaciones que tiene en el manejo terapéutico y pronóstico. En ambas localizaciones, laringe e hipofaringe, es importante diferenciar a los pacientes con tumores con criterios de irresecabilidad T4b. Con las técnicas de imagen se aporta información adicional con un valor pronóstico, como el volumen tumoral y la extensión local fuera de la laringe e hipofaringe. Todo en conjunto hace que los radiólogos juguemos un papel notable en los comités de oncología de cabeza y cuello para la elección de las opciones de tratamiento. Bibliografía 1. Keberle M, Kenn W, Hahn D. Current concepts in imaging of laryngeal and hypopharyngeal cancer. Eur Radiol. 2002;12:1672-83. 2. Becker M. Larynx and hypopharyx. Radiol Clin North Am. 1998;36:891-20. 3. Zbären P, Becker M, Läng H. Pretherapeutic staging of laryngeal carcinoma. Clinical findings, computed tomography, and magnetic resonance imaging compared with histopathology. Cancer. 1996;77:1263-73. 4. Reiner B, Siegel E, Sawyer R, Brocato RM, Maroney M, Hooper F. The impact of routine CT of the chest on the diagnosis and management of newly diagnosed squamous cell carcinoma of the head and neck. AJR Am J Roentgenol. 1997;169:667-71. 5. American Joint Committee on Cancer: Larynx. En: Greene FL, editor. American Joint Committee on Cancer: AJCC Cancer Staging Manual. 7th ed. New York: Springer; 2010. p. 57-68. 6. Dullerud R, Johansen JG, Dahl T, Faye-Lund H. Influence of CT on tumor classification of laryngeal carcinomas. Acta Radiol. 1992;33:314-8. 7. Thabet HM, Sessions DG, Gado MH, Gnepp DA, Harvey JE, Talaat M. Comparison of clinical evaluation and computed tomographic diagnostic accuracy for tumors of the larynx and hypopharynx. Laryngoscope. 1996;106:589-94. 4-8 Capt 109.pag.indd 74 Radiología de cabeza y cuello 8. Loevner LA, Yousem DM, Montone KT, Weber R, Chalian AA, Weinstein GS. Can radiologists accurately predict preepiglottic space invasion with MR imaging? AJR Am J Roentgenol. 1997;169:1681-7. 9. Becker M, Zbaren P, Delavelle J, Kurt AM, Egger C, Rüfenach DA, et al. Neoplastic invasion of the laryngeal cartilage: reassessment of criteria for diagnosis at CT. Radiology. 1997;203:521-32. 10. Becker M. Neoplastic invasion of laryngeal cartilage: radiologic diagnosis and therapeutic implications. Eur J Radiol. 2000;33:216-29. 11. Becker M, Zbären P, Casselman JW, Kohler R, Dulguerov P, Becker CD. Neoplastic invasion of laryngeal cartilage: reassessment of criteria for diagnosis at MR imaging. Radiology. 2008;249:551-9. 12. Barbosa MM, Araújo VJ Jr, Boasquevisque E, Carvalho R, Romano S, Lima RA, et al. Anterior vocal commissure invasion in laryngeal carcinoma diagnosis. Laryngoscope. 2005;115:724-30. 13. Yousem DM, Hatabu H, Hurst RW, Seigerman HM, Montone KT, Weinstein GS, et al. Carotid artery invasion by head and neck masses: prediction with MR imaging. Radiology. 1995;195:715-20. 14. Hsu WC, Loevner LA, Karpati R, Ahmed T, Mong A, Battinemi ML, et al. Accuracy of magnetic resonance imaging in predicting absence of fixation of head and neck cancer to the prevertebral space. Head Neck. 2005;27:95-100. 15. Righi PD, Kelley DJ, Ernst R, Deutsch MD, Gaskill-Shipley M, Wilson KM, et al. Evaluation of prevertebral muscle invasion by squamous cell carcinoma. Can computed tomography replace open neck exploration? Arch Otolaryngol Head Neck Surg. 1996;122:660-3. 16. Wang JC, Takashima S, Takayama F, Kawakami S, Sato A, Masushita T, et al. Tracheal invasion by thyroid carcinoma: prediction using MR imaging. AJR Am J Roentgenol. 2001;177:929-36. 17. Nawaratne S, Fabiny R, Brien JE, Zalcberg J, Cosolo W, Whan A, et al. Accuracy of volume measure- ment using helical CT. J Comput Assist Tomogr. 1997;21:481-6. 18.Preda L, Lovati E, Chiesa F, Ansarin M, Cattaneo L, Fasani R, el tal. Measurement by multidetector CT scan of the volume of hypopharyngeal and laryngeal tumours: accuracy and reproducibility. Eur Radiol. 2007;17:2096102. 19. Mancuso AA, Mukherji SK, Schmalfuss I, Mendenhall W, Parsons J, Pameijer F, et al. Preradiotherapy computed tomography as a predictor of local control in supraglottic carcinoma. J Clin Oncol. 1999;17:631-7. 20. Pameijer FA, Mancuso AA, Mendenhall WM, Parsons JT, Kubilis MS. Can pretreatment computed tomography predict local control in T3 squamous cell carcinoma of the glottic larynx treated with definitive radiotherapy? Int J Radiat Oncol Biol Phys. 1997;37:1011-21. 21. Pameijer FA, Mancuso AA, Mendenhall WM, Parsons JT, Mukherji SK, Hermans R, et al. Evaluation of pretreatment computed tomography as a predictor of local control in T1/ T2 pyriform sinus carcinoma treated with definitive radiotherapy. Head Neck. 1998;20:159-68. 22. Castelijns JA, Van den Brekel MW, Tobi H, Smit EM, Golding RP, Van Schaik C, et al. Laryngeal carcinoma after radiation therapy: correlation of abnormal MR imaging signal patterns in laryngeal cartilage with the risk of recurrence. Radiology. 1996;198:151-5. 23. Mukherji SK, O’Brien SM, Gerstle RJ, Weissler M, Shockley W, Castillo M. Tumor volume: an independent predictor of outcome for laryngeal cancer. J Comput Assist Tomogr. 1999;23:50-4. 26/4/12 18:33:02 Radiología de cabeza y cuello 6 Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello M.A. Muros de Fuentes* y M. Moreno Caballero Servicio de Medicina Nuclear, Hospital Virgen de las Nieves, Granada, España Cáncer de cabeza y cuello Introducción El cáncer de cabeza y cuello constituye un grupo heterogéneo de tumores que pueden situarse sobre diversas estructuras anatómicas englobando, craneocaudalmente, desde senos paranasales hasta laringe, incluyendo nasofaringe, cavidad oral, glándulas salivares, orofaringe e hipofaringe. Otros tumores que también pueden incluirse dentro de esta categoría son los que se localizan en el tercio proximal esofágico, glándula tiroides y glándulas paratiroides. Ocupan el sexto puesto en la lista de cánceres más frecuentes, con una relación varón:mujer de 3:1, representando una incidencia anual de 650.000 nuevos casos con un promedio de 350.000 muertes en el ámbito mundial1. Tradicionalmente se consideraba una enfermedad propia de personas de edad avanzada; sin embargo, algunos estudios han mostrado una mayor incidencia entre pacientes jóvenes menores de 40 años de edad2, aunque otros estudios no observan diferencias entre pacientes mayores y menores de 40 años3,4. La evolución de la enfermedad dependerá tanto de su localización como de su origen histopatológico. Son tumores malignos que derivan en su mayoría de células epiteliales que recubren las mucosas de gran parte de las estructuras anatómicas que se encuentran en cabeza y cuello, siendo el tipo más frecuente el carcinoma de células escamosas. Entre los factores de riesgo más frecuentemente relacionados destaca en primer lugar el tabaquismo, seguido por el exceso en el consumo de alcohol, que puede considerarse como un factor potenciador. Otras causas menos frecuentes descritas serían: predisposición genética, enfermedades de carácter infeccioso (sífilis, infecciones por virus del papiloma humano, virus de Epstein-Barr, liquen plano bucal, virus de la inmunodeficiencia humana), factores inmunológicos e irritantes mecánicos. Hay una clara necesidad de nuevos indicadores pronósticos, que podrían utilizarse en el diagnóstico y, en consecuencia, en la selección del método de tratamiento más eficaz. Para poder realizar un diagnóstico precoz se debe comenzar con una historia médica completa además de un minucioso examen de cabeza y cuello. El abordaje terapéutico, tanto si se intenta enfrentar desde una perspectiva de curación como si se pretende realizar un tratamiento con intención paliativa, pasa por la necesidad de una intervención quirúrgica o por la combinación de cirugía con radioterapia. La localización de la enfermedad y su estadio condicionarán su pronóstico, mejorándolo considerablemente si se encuentra en fases precoces. No obstante, a pesar del carácter radical del tratamiento, las recurrencias suelen ser habituales. Otra característica propia de esta patología es que la afectación tumoral de determinadas zonas anatómicas y su posterior tratamiento pueden alterar considerablemente funciones básicas como el habla, la deglución, el gusto y el olfato, llegando a producir en ocasiones importantes secuelas que merman la calidad de vida del paciente. El conocimiento de la presencia de enfermedad a distancia puede evitar, en ocasiones, cirugías agresivas y muy mutilantes. Tomografía por emisión de positrones La tomografía por emisión de positrones (PET) es una nueva técnica de medicina nuclear, que utiliza moléculas marcadas con isótopos emisores de positrones para realizar diagnóstico por imagen. La información que aporta es fundamentalmente metabólica o bioquímica, frente a la mayoría de técnicas de imagen que proporcionan información estructural o anatómica. La molécula más utili- *Autor para correspondencia. Correo electrónico: [email protected] (M.A. Muros de Fuentes). 4-8 Capt 109.pag.indd 75 26/4/12 18:33:02 76 zada es la fluorodesoxiglucosa marcada con 18F, conocida por las siglas 18F-FDG. La 18F-FDG, tras ser introducida en el organismo por vía intravenosa, pasa al interior de las células por difusión pasiva, incrementándose por efecto de la insulina y la hipoxia5. La hipoxia, que es frecuente en los tejidos tumorales, estimula el transporte de 18F-FDG a través de la membrana celular. En el interior de la célula, la 18F-FDG no sigue las vías de metabolización de la glucosa normal, quedando atrapada en cantidad inversamente proporcional a la concentración de glucosa-6-fosfatasa6,7. Valoración de los estudios de tomografía por emisión de positrones En el momento de realizar el estudio PET, aproximadamente a los 60 min de la inyección, la concentración de 18F-FDG en los tejidos alcanza una meseta y la mayor parte de la radiación detectada proviene de tejidos con baja concentración de glucosa-6-fosfatasa, como el tejido cerebral, el miocárdico y el tumoral. La interpretación visual de las imágenes considera positivos para malignidad los focos de captación asimétricos de 18F-FDG considerándolos sospechosos de ser tumorales. Se puede hacer una evaluación semicuantitativa de los datos mediante el cálculo del índice semicuantitativo SUV (standard uptake value), que se calcula en regiones de interés que incluyen la lesión sospechosa8. Éste se interpreta como la cantidad de radiotrazador presente en una lesión (en uCi/ml) normalizado al peso del paciente (en kg) y a la dosis administrada de 18F-FDG (en mCi). Un índice SUV > 2,5-3 orienta con mayor probabilidad a que el foco de captación tenga un origen neoplásico. Este índice sólo sirve de orientación y no debe, en ningún caso, sustituir a la valoración visual de las imágenes. El estudio normal de cabeza y cuello presenta una serie de captaciones fisiológicas que pueden determinar una mala interpretación de las imágenes: – Cavidad oral y nasal. Acúmulo de trazador de moderada intensidad y homogénea. Las amígdalas palatinas y faríngeas muestran captación moderada o intensa. – Laringe. Captación en forma de “V” correspondiente a la musculatura vocal (debido a que el paciente hable tras la inyección). – Músculos cervicales. Diferentes grados de captación (moderado a intenso) en pacientes tensos. – Mediastino. Captación moderada y bastante homogénea. Precauciones. Debe hacerse una correcta selección de los pacientes y del momento de realización del estudio evitando procesos inflamatorios activos en el momento de la exploración, lo que aumenta la especificidad del estudio. –R ecoger información clínica detallada (cirugía, radioterapia) y los resultados de las pruebas de imagen convencionales (tomografía computarizada [TC], resonancia magnética [RM]). Limitaciones. – Necrosis. Las áreas necróticas pueden presentar una captación leve del trazador. 4-8 Capt 109.pag.indd 76 Radiología de cabeza y cuello – Inflamación e infección. Los patrones de captación pueden ser intensos y resultar indistinguibles de las células malignas. – Resolución espacial de la cámara. 4-6 mm. Para lesiones < 10 mm la capacidad de detección puede ser menor si presentan bajo índice de captación. Indicaciones de los estudios de tomografía por emisión de positrones Las técnicas de imagen morfológicas juegan un papel fundamental en la estadificación, reestadificación y adecuada planificación del tratamiento en tumores de cabeza y cuello (TCC). La TC y RM permanecen como las primeras técnicas de referencia para el diagnóstico de los TCC. Progresivamente, las técnicas funcionales como la 18F-FDG-PET se han incorporado al protocolo diagnóstico y constituyen una ayuda fundamental si se utilizan adecuadamente. La 18F-FDG-PET y 18F-FDG-PET-TC pueden ser de gran utilidad en pacientes de TCC en las siguientes indicaciones: – Estadificación linfática cervical. – Detección de metástasis a distancia. – Identificación de tumor primario desconocido. – Detección de tumores primarios sincrónicos. – Monitorización de la respuesta al tratamiento. – Seguimiento a largo plazo de recurrencias y metástasis. Detección del tumor primario Existen numerosos estudios en la bibliografía que muestran que la PET es, al menos, igual de sensible que la TC y RM para la detección del tumor primario. Sin embargo, la PET y PET-TC sin contraste no proporcionan la definición anatómica de la RM y de la TC multicorte. Estas últimas siguen siendo las técnicas de referencia para la correcta definición anatómica del tumor primario antes de la intervención quirúrgica. La utilización de la FDG-PET para la identificación y caracterización del tumor primario en pacientes con sospecha de TCC no ha demostrado, en general, importantes ventajas sobre las del protocolo de estudio convencional, debido a que la PET aislada no puede aportar la información anatómica necesaria para la planificación de la cirugía. El uso de la PET-TC combinada aporta los detalles anatómicos, pero permanece sin dilucidar si los hallazgos de la PET proporcionan información adicional cuando el tratamiento de elección es quirúrgico, como sucede en los estadios tumorales I y II. Schöder et al9 comparan los resultados obtenidos en el estudio PET y en el estudio PETTC en 68 pacientes con TCC, analizando la utilidad para la detección de las lesiones primarias y las metástasis linfáticas. La PET-TC mejora la localización anatómica del 63% de lesiones (98/155) en comparación con la PET, y esta proporción aumenta si las lesiones se localizan en áreas de cabeza y cuello previamente tratadas. Además, el número de lesiones consideradas equívocas para malignidad disminuye desde 39 hasta 13 cuando se utiliza la PET-TC, 26/4/12 18:33:02 Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello 77 Tabla 1 − Validez de la tomografía computarizada (TC) y de la tomografía por emisión de positrones-TC (PET-TC) en la estadificación inicial de pacientes con tumores de cabeza y cuello con estadificaciones N1, N2 y N3 Schwartz et al, 200513 Koshy et al, 200512 Ha et al, 200616 Goerres et al, 200417 PET-TC TC S = 96% 36% de cambio TNM 31% de cambio TNM (16% cambio en N) 15% de cambio TNM (21% de N) S = 78% ya que 26 lesiones equívocas son recalificadas como benignas o malignas. Estadificación inicial Recientes estudios de investigación (tabla 1) demuestran que en la evaluación de metástasis linfáticas cervicales, la PET-TC es comparable o superior a las técnicas de imagen convencionales. Además, la PET-TC puede desempeñar un importante papel en la detección de ganglios linfáticos en localizaciones inesperadas, como mediastino superior y axila. También aporta la posibilidad de detectar metástasis a distancia. La PET-TC tiene 2 ventajas sobre las técnicas de imagen convencional, la capacidad de rastrear todo el cuerpo y de detectar lesiones que pueden perderse con las técnicas de imagen convencional (fig. 1). La FDG-PET presenta una sensibilidad similar o ligeramente superior a las técnicas de imagen convencional en la estadificación inicial de los TCC. Schöder et al10 encuentran una sensibilidad del 87-90% y una especificidad del 80-93% para la FDG-PET en la detección de metástasis linfáticas en comparación con el 61-97% y el 21-100% para la TC y RM, respectivamente. Sin embargo, el impacto de esta técnica en la estadificación inicial de las metástasis linfáticas no está bien establecido. La PET presenta las mismas limitaciones que la TC y la RM en la estadificación de los TCC. La principal de estas limitaciones se encuentra relacionada con el tamaño de la lesión, que debe ser como mínimo de 1 cm para que sea detectada correctamente. La sensibilidad de la PET puede verse reducida en la evaluación de lesiones de tamaño < 1 cm y, como resultado, la valoración del SUV resulta indicativa de benignidad cuando se trata en realidad de lesiones malignas. La FDG-PET-TC puede proporcionar mayor seguridad en el diagnóstico de extensión de los TCC al aportar una información anatómica y funcional más exacta, que permite planificar una cirugía más conservadora que la que pudiera realizarse basándose en los hallazgos de la TC aisladamente. La información anatómica de la PET mejora marcadamente con el uso combinado de imágenes de PET y TC. Syed et al11 revisan 24 pacientes diagnosticados de TCC antes de iniciar su tratamiento en un estudio piloto realizado para valorar la utilidad de la PET-TC en la estadificación de éstos. La PET-TC disminuye el estadio y cambia el tratamiento en el 17% de los pacientes, comparada con la PET aisladamente, al asignar algunas captaciones posi- 4-8 Capt 109.pag.indd 77 Figura 1. Paciente varón de 50 años de edad, con mioepitelioma de cavum. A) Imágenes axiales de fusión de tomografía por emisión de positrones-tomografía computarizada (PET-TC) que muestran área hipermetabólica en cavum compatible con tumor primario. B) Imágenes coronales de fusión de PET-TC que muestran múltiples focos de captación de localización hiliar bilateral y subcarinales sugerentes de afectación metastásica en adenopatías mediastínicas.. 26/4/12 18:33:03 78 tivas encontradas en la PET a captación fisiológica muscular o grasa. Además mejora la exactitud en la localización anatómica y la reproducibilidad interobservador al localizar correctamente algunas lesiones poco claras en determinadas áreas anatómicas. Koshy et al12 analizan el valor de la PET-TC en la estadificación inicial y planificación de la radioterapia en pacientes diagnosticados de carcinoma epidermoide de cabeza y cuello (tabla 1). La PET-TC determina un cambio de estadio en la clasificación TNM en el 36% de los pacientes y en la estadificación tumoral de la AJCC en el 14% de pacientes de TCC. Schwartz et al13 estudian pacientes con TCC de estadio intermedio y avanzado. Encuentran que la PET-TC tiene una gran utilidad en la correcta localización de la afectación linfática ganglionar en estos pacientes, presentando valores del 96% de sensibilidad y del 98,5% de especificidad. La principal ventaja de las técnicas funcionales (FDG-PET y PET-TC) sobre las técnicas de imagen convencional en la estadificación de los cánceres de cabeza y cuello es su habilidad para detectar enfermedad contralateral y a distancia (metástasis o segundo tumor primario) en tórax o abdomen. Por lo tanto, un estudio PET, combinado o no con TC, es de mayor utilidad en pacientes con enfermedad localmente avanzada (estadio III o IV) en los que hay un riesgo del 10% o incluso mayor de tener metástasis a distancia. En nuestro servicio hemos analizado la utilidad de la PET-TC en la estadificación inicial de 35 pacientes diagnosticados de TCC de diferentes localizaciones (cavidad oral, cavum, laringe y glándulas salivales). La PET-TC presentó hallazgos coincidentes con los resultados de las técnicas de imagen convencional (ECO, TC o RM) en 25 de 35 (71%) pacientes. Además detectó metástasis no conocidas en 4 pacientes (11%), cambiando el abordaje terapéutico de éstos. Actualmente se están produciendo continuos cambios y mejoras técnicas en la PET-TC, RM y TC multicorte. Aunque todavía es necesario un mayor número de estudios de investigación para determinar cuál de estas modalidades diagnósticas es la más exacta, parece que el uso combinado de una técnica metabólica (PET) con la TC de alta resolución es, en el momento presente, la modalidad de imagen más útil en el diagnóstico de extensión de los TCC. Esquemas de utilización de los estudios de tomografía por emisión de positrones en la estadificación inicial. Quon et al14 proponen un esquema sobre la utilización de la PET-TC en la estadificación de los TCC (fig. 2). – La RM es la técnica inicial de elección debido a su mayor resolución para delinear la extensión del tumor, evaluar la afectación de otros órganos o la extensión intracraneal, y además presenta una sensibilidad comparable en la detección de los ganglios cervicales. – La TC con contraste se usa como técnica de elección en caso de tumores laríngeos. – La PET-TC se debe recomendar cuando hay sospecha de metástasis a distancia basándose en la extensión local o regional del tumor. La PET-TC no se realiza en la esta- 4-8 Capt 109.pag.indd 78 Radiología de cabeza y cuello dificación linfática regional, pero sí en el asesoramiento de la presencia de metástasis a distancia, pudiendo evitar cirugías agresivas innecesarias. – La PET-TC se puede recomendar incluso en pacientes con estadio clínico N0 de inicio. Puede ser de utilidad tener un examen basal para facilitar el seguimiento tras la terapia debido a la gran cantidad de variantes de la normalidad existentes, que incluyen captación en los músculos faríngeos, glándulas salivares, tejido linfoide, etc. que dificultan la interpretación posterior. En un reciente estudio realizado en 31 pacientes con estadio inicial N0 se demuestra que la PET-TC falla en la detección de ganglios linfáticos mínimamente afectados (< 3 mm) en 3 pacientes (debido a la limitada resolución espacial y pobre capacidad de detección de lesiones < 5 mm) y tiene resultados falsamente positivos en 4 pacientes Agarwal et al15 proponen el siguiente esquema de utilización de la PET-TC en la estadificación de los TCC basándose en el TMN tumoral: 1. T. – T1. PET-TC no indicada. Escasa frecuencia de metástasis a distancia. – T3-T4. PET-TC de elección por la frecuencia de metástasis a distancia. – T2. Permanece controvertido. 2. N. – N0. Hay estudios en la bibliografía que valoran la utilidad diagnóstica de la PET en la detección de metástasis linfáticas ocultas. Los datos disponibles no demuestran una exactitud adecuada de la PET que permita evitar disecciones cervicales innecesarias. No hay suficientes estudios que evalúen la utilidad de la PET-TC en el paciente con cuello N0, pero debemos presuponer que es similar a la de la PET. Estos datos no permiten utilizar la PET-TC para determinar la necesidad o no de disecciones cervicales en el cuello N0. – N1, N2 y N3. La PET-TC es la técnica de elección para evaluar la presencia de diseminación linfática en pacientes con TCC (tabla 1). La mayoría de los pacientes diagnosticados de TCC presenta enfermedad local y regionalmente avanzada acompañada de diseminación metastásica a los ganglios linfáticos cervicales en el momento del diagnóstico. La estadificación correcta de los ganglios linfáticos cervicales es crítica para determinar la extensión de la cirugía y planificación precisa de los campos de radioterapia. 3. M. La PET-TC es la técnica de elección para evaluar la presencia de metástasis a distancia en pacientes con TCC. Permite una mejor caracterización de las imágenes equívocas y una mejor localización anatómica mediante TC de las lesiones vistas en PET. Ha et al16 encuentran un 31% de cambio en el estadio TNM (16% de cambio en N) de los pacientes con TCC estudiados mediante PET-TC. Goerres et 26/4/12 18:33:03 Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello 79 Figura 2. Paciente mujer de 65 años de edad, con carcinoma epidermoide de amígdala izquierda. A) Imágenes coronales de fusión de tomografía por emisión de positrones-tomografía computarizada (PET-TC) que muestran área de captación en cavidad oral compatible con tumor primario. B) Imágenes sagitales de fusión de PET-TC que muestran un gran foco de captación a nivel del tercio distal del esófago compatible con segundo tumor sincrónico de esófago. 4-8 Capt 109.pag.indd 79 26/4/12 18:33:04 Radiología de cabeza y cuello 80 al17 encuentran que la PET-TC cambia la estadificación de los TCC al detectar en un 24% de pacientes la presencia de metástasis desconocidas o segundos tumores. Varios estudios han demostrado que la PET puede detectar lesiones metastásicas ocultas en, por lo menos, un 10% de pacientes con enfermedad local avanzada. Además, los pacientes con cáncer de cabeza y cuello tienen un elevado riesgo de tener tumores sincrónicos, especialmente en el aparato digestivo superior (figs. 2 y 3). La presencia de metástasis a distancia puede determinar la necesidad de otras medidas terapéuticas adicionales y puede evitar tratamientos quirúrgicos agresivos innecesarios. En la mayoría de los pacientes, las metástasis pueden ser silentes clínicamente. Agarwal et al15 consideran que hay una serie de situaciones clínicas en las que debe realizarse un cribado de metástasis a distancia (tabla 2): ≥ 4 ganglios linfáticos metastáticos; metástasis linfáticas bilaterales; metástasis linfáticas de gran tamaño (≥ 6 cm); metástasis linfáticas en nivel IV cervical; presencia de recurrencia tumoral, y presencia o sospecha de segundo primario. Recientemente, Uyl-de-Groot et al18 han publicado un estudio multicéntrico que recoge los datos de 145 pacientes, y en el que se analiza la relación coste-efectividad de la TC torácica y de la 18F-FDG-PET en el cribado de metástasis a distancia en pacientes con TCC. El cribado pretratamiento detectó metástasis a distancia en un 21% de los pacientes. La 18F-FDG-PET tenía mayor sensibilidad (el 53 frente al 37%) y valor predictivo positivo (el 80 frente al 75%) que la TC torácica, y esta sensibilidad era todavía superior si se utilizaba 18F-FDGPET-TC. La 18F-FDG-PET-TC es la más coste-efectiva de las 3 opciones como procedimiento de cribado. Detección del tumor de origen desconocido El 2-9% de los carcinomas escamosos de cabeza y cuello se presentan como un ganglio linfático cervical sin clara evidencia de la localización del tumor primario. La identificación del tumor primario es fundamental porque permite la realización de la resección quirúrgica y limita la extensión de la radioterapia. La evaluación inicial de metástasis cervicales de primario desconocido debe incluir exploración física, endoscopia e imágenes anatómicas (RM y TC). Múltiples estudios han analizado la utilidad de la PET en la detección del tumor primario de localización desconocida. En una revisión de Schoeder10 de un total de 300 pacientes recogidos en 11 estudios, la sensibilidad de la PET oscila entre el 10 y el 60%, dependiendo de los criterios de inclusión de pacientes y de la confirmación de los hallazgos. En un reciente metaanálisis19 que recoge selectivamente los estudios con pacientes en los que la exploración física inicial y la RM eran negativas, la PET y PET-TC eran capaces de detectar el tumor primario en 40/150 pacientes (27%). Quon et al14 recomiendan que una vez que la exploración física y la RM resultan negativas se debe realizar una PET-TC para la localización del tumor primario de origen 4-8 Capt 109.pag.indd 80 Tabla 2 − Situaciones clínicas en pacientes con tumores de cabeza y cuello en las que debe realizarse cribado de metástasis a distancia – ≥ 4 ganglios linfáticos metastásicos – Metástasis linfáticas bilaterales – Metástasis linfáticas ≥ 6 cm – Metástasis linfáticas en nivel IV – Recurrencia tumoral – Presencia o sospecha de segundo primario desconocido. Si aparece un foco sospechoso, se realiza una panendoscopia, obteniéndose biopsia y cortes congelados de la zona sospechosa. Si la biopsia resulta negativa, se obtienen biopsias de las zonas más frecuentes de localización tumoral: base de lengua, fosa amigdalina ipsilateral y, en algunos casos, fosa amigdalina y seno piriforme contralateral y nasofaringe. Agarwal et al15 recomiendan el uso de la PET-TC en la localización del tumor de origen desconocido como complementaria, no como sustituta, al resto de las técnicas (endoscopia y biopsia) que no pueden ser evitadas. La PET-TC detecta entre el 20-30% de tumores de origen desconocido más que las técnicas convencionales. Carcinoma diferenciado de tiroides Introducción El cáncer de tiroides constituye la neoplasia endocrina más frecuente y supone el 1% de todos los cánceres. Dentro del cáncer de tiroides, el de estirpe folicular o carcinoma diferenciado de tiroides (CDT), que incluye el carcinoma papilar y folicular, constituye la inmensa mayoría (85-90%). Su incidencia anual oscila entre 0,310/100.000 habitantes/año, estimándose que cada año se producen en torno a 28.000 casos nuevos. Se ha observado un incremento de la incidencia anual en los últimos años, de tal forma que la incidencia de cáncer de tiroides se ha incrementado en más de un 300% en la mitad del siglo xx, sin cambios en la mortalidad. Esto es posiblemente debido a la mejora de los métodos diagnósticos, ya que el incremento de la incidencia es debido a un incremento del número de cáncer, predominantemente cáncer papilar, en estadio I o II. El CDT es de 2 a 3 veces más frecuente en las mujeres, que suponen el 74% de los casos20,21. El cáncer de tiroides es una neoplasia de buen pronóstico, con una tasa de mortalidad anual de entre 0,2 y 1,2 por 100.000 habitantes y con una supervivencia a los 10 años superior al 90%, por lo que se incrementa de forma paulatina la prevalencia. En la mayoría de los cánceres de tiroides se consigue la curación tras el tratamiento inicial con cirugía y radioyodo, si bien en un porcenta- 26/4/12 18:33:04 Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello 81 Figura 3. Paciente varón de 52 años de edad, con carcinoma epidermoide de suelo de boca intervenido quirúrgicamente. A) Imágenes coronales de fusión de tomografía por emisión de positrones-tomografía computarizada (PET-TC) que muestran varias áreas de captación cervicales derechas compatibles con adenopatías metastásicas en niveles I, II, III y IV derechos. B) Imágenes axiales de fusión de PET-TC que muestran varios focos hipermetabólicos en lóbulo superior derecho y lóbulo inferior izquierdo de ambos pulmones compatibles con metástasis pulmonares. 4-8 Capt 109.pag.indd 81 26/4/12 18:33:05 82 je no desdeñable de casos (20%) la enfermedad persiste o recurre, lo que obliga a un seguimiento y tratamiento continuado, a fin de conseguir la curación a largo plazo20,21. La edad es el factor pronóstico más importante de mortalidad por cáncer de tiroides20,21. El carcinoma de tiroides es más letal cuando la edad al diagnóstico es superior a los 40 años; y el índice de mortalidad se dispara cuando el diagnóstico se realiza en pacientes mayores de 60 años. El riesgo de recidiva local es mayor en menores de 20 años y en mayores de 60 años (40%). Este tipo de neoplasias son más agresivas en los varones que en las mujeres, aunque las diferencias en el pronóstico según el sexo son pequeñas. El carcinoma papilar de tiroides familiar es más agresivo que el esporádico. Algunas variantes histológicas del carcinoma papilar de tiroides se asocian a un peor pronóstico (células altas, células columnares, esclerosante difusa y variantes sólidas). Un 10% de los carcinomas papilares presenta una cápsula que rodea el tumor, lo que determina una evolución favorable. En general, el cáncer papilar y el folicular muestran un comportamiento muy parecido a igualdad de edad y estadio clínico al diagnóstico, de tal forma que tienen un buen pronóstico si el tumor está confinado al tiroides, es de pequeño tamaño y mínimamente invasivo22. Los carcinomas foliculares ampliamente invasivos, que son los menos frecuentes, tienen mal pronóstico, de manera que hasta el 80% de los casos presenta metástasis en el momento del diagnóstico. La variante oncocítica del carcinoma folicular se asocia con índices de recidiva y de mortalidad superiores a los del resto de carcinomas foliculares22. Hay una relación directa entre el tamaño tumoral y los índices de recidiva local y la mortalidad producida por el cáncer, tanto en las neoplasias foliculares como papilares. Los cánceres de tiroides < 1,5 cm que limitan su extensión al interior del tiroides no producen casi nunca metástasis a distancia, por lo que la mortalidad que ocasionan es mínima22,23. Hay estudios que encuentran relación entre la existencia de adenopatías y un aumento de la recurrencia o de la mortalidad. Se han publicado series en las que la presencia de adenopatías se asocia a un incremento de las metástasis a distancia, sobre todo si son bilaterales, se encuentran en la zona alta del mediastino o tienen la cápsula ganglionar infiltrada23. Casi el 10% de los cánceres papilares y hasta el 25% de los foliculares cursan con metástasis, y la mitad de éstas están presentes en el momento del diagnóstico. Las metástasis a distancia son más frecuentes en las variantes oncocíticas y en los mayores de 40 años. Las regiones a las que con más frecuencia metastatizan los cánceres de tiroides son los pulmones (50%), el hueso (25%), los pulmones y hueso (15%) y el sistema nervioso central (10%). Las variables relacionadas con el pronóstico de los pacientes que presentan metástasis a distancia son la edad, el tamaño y la capacidad de captar radioyodo por las células tumorales22,23. 4-8 Capt 109.pag.indd 82 Radiología de cabeza y cuello Estadificación inicial La captación de 18F-FDG en los pacientes con CDT está relacionada con la diferenciación tumoral. Feine et al (1996)24 describen un patrón alternante de captación de 131I y FDG en los cánceres tiroideos. Hay tumores con buena captación de 131I y con baja captación de FDG (alto grado de diferenciación), o tumores con ausencia de captación de 131I combinada con elevada captación de FDG (tumores moderada o pobremente diferenciados). Incluso en lesiones de mayor tamaño de un mismo paciente, coexisten áreas con captación de 131I y otras de captación de FDG. La aplicación clínica principal de la 18F-FDG-PET en el CDT ha sido, durante muchos años, la localización de recidiva o metástasis de enfermedad en pacientes con valores detectables de tiroglobulina y rastreo corporal con 131I (RCT) negativo25. Posteriormente, otras publicaciones proporcionan datos que apoyan un uso de la 18F-FDG-PET en indicaciones diferentes a la anteriormente descrita. La guía actualizada de la ATA 200923 contempla que los usos clínicos actuales de la 18F-FDG-PET pueden incluir (grado de recomendación tipo C): – Estadificación inicial y seguimiento de los pacientes de alto riesgo con cánceres de tiroides poco diferenciados y con pocas probabilidades de concentrar 131I, con objeto de identificar localizaciones de enfermedad no detectadas en el RCT. – Estadificación inicial y seguimiento del carcinoma de células de Hürthle invasivo o metastásico. – Como herramienta pronóstica para identificar qué pacientes con metástasis a distancia conocidas tienen un alto riesgo de mortalidad relacionada con la enfermedad. – Como herramienta selectiva para identificar a los pacientes con poca probabilidad para responder al tratamiento con 131I. – Como medida de la respuesta postratamiento a la radiación externa, resección quirúrgica, embolización o tratamiento sistémico. Como puede comprobarse en la anterior lista de indicaciones, los pacientes de bajo riesgo muy probablemente no requerirán 18F-FDG-PET como parte de estadiaje inicial y seguimiento. Sin embargo puede tener un papel en variantes de mal pronóstico. Se ha señalado que la FDG-PET debe emplearse precozmente en la evaluación y seguimiento clínico del carcinoma de células de Hürthle, ya que mejora la capacidad de detección respecto al rastreo con 131I y las técnicas de imagen morfológicas26. Además, la FDG-PET es un método diagnóstico útil para la detección de recurrencias y metástasis en pacientes con carcinoma de células de Hürthle, resultando de mayor utilidad en pacientes con rastreo con 131I negativo y elevación de tiroglobulina27. Diagnóstico del tumor primario Los estudios sobre el papel del 18F-FDG-PET en el diagnóstico preoperatorio del CDT son escasos y con un limitado número de pacientes. Todos los subtipos his- 26/4/12 18:33:05 Papel de la tomografía por emisión de positrones en la estadificación de los tumores y metástasis de cabeza y cuello tológicos (carcinoma papilar, folicular, Hürthle, medular y anaplásico) muestran un aumento de captación de 18F-FDG y la intensidad de captación depende del grado de diferenciación del tumor, siendo mayor en tumores poco diferenciados. Un nódulo tiroideo positivo en la 18F-FDG-PET tiene una probabilidad postest de ser maligno superior al 30%, según se deduce de los hallazgos incidentales de captaciones tiroideas en estudios PET realizados a pacientes de otras patologías. Por lo tanto, una captación focal de 18F-FDG en tiroides, aunque sea incidental, debe ser investigada aunque sus valores de SUV no alcancen el umbral óptimo descrito en la bibliografía. La 18F-FDG-PET se puede utilizar con relativo éxito (sensibilidad del 50%) en la detección de tumores tiroideos ocultos28. Sin embargo son necesarios estudios prospectivos bien diseñados, que establezcan la sensibilidad y especificidad de la técnica en el tumor primario tiroideo antes de que esta indicación sea aprobada y recomendada de forma general (fig. 4). En nuestro servicio de medicina nuclear hemos analizado de forma prospectiva 34 pacientes con diagnóstico de proliferación folicular en la punción aspiración con aguja fina del nódulo tiroideo. Para ello hemos realizado una PET-TC antes de la intervención quirúrgica, con el fin de valorar la utilidad de ésta para la discriminación entre benignidad o malignidad del nódulo tiroideo. Los resultados del estudio 18F-FDG-PET-TC fueron confirmados con los hallazgos del informe de anatomía patológica obtenido tras la cirugía. La PET-TC muestra una sensibilidad del 90% y una especificidad del 47% para la detección de malignidad en el nódulo tiroideo. Cuando se clasifican los pacientes en función de los valores del SUV, un nivel de SUV máximo de 4,5 clasifica adecuadamente las lesiones en benignas o malignas (sensibilidad 81%, especificidad 69%, valor predictivo positivo 56%, valor predictivo negativo 88%). Recientemente, Yun et al29 han publicado un estudio que recoge 87 pacientes diagnosticados de microcarcinoma papilar de tiroides unifocal a los que se les había realizado un estudio 18F-FDG-PET-TC preoperatoriamente. El autor encuentra que los pacientes con PET+ presentaban un 70% de extensión extratiroidea y un 40% de diseminación linfática al compartimiento central, frente a los pacientes con PET–, que presentaban un 29% de extensión extratiroidea y un 19% de diseminación linfática. Según los autores, la captación + de FDG en microcarcinomas papilares de tiroides es un factor de riesgo potencial que se asocia a una mayor diseminación linfática y extensión extratiroidea. Se requiere analizar en estudios prospectivos con mayor número de pacientes si la 18F-FDG-PET-TC preoperatoria tendría beneficios a largo plazo y sería coste-efectiva en el seguimiento del paciente. Bibliografía 1. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. Cancer J Clin. 2005;55:74-108. 4-8 Capt 109.pag.indd 83 83 Figura 4. Paciente mujer de 22 años de edad, con nódulo tiroideo en LTI y punción aspiración con aguja fina (PAAF) de proliferación folicular sugerente de malignidad. A) Imágenes coronales de fusión de tomografía por emisión de positrones-tomografía computarizada (PET-TC) que muestran área de captación en tiroides sugerente de tumor primario tiroideo. B) Imágenes axiales del tórax que muestran nódulos pulmonares visibles en TC y con baja captación de fluorodesoxiglucosa compatibles con metástasis pulmonares bilaterales. 2. Shiboski CH, Schmidt BL, Jordan RC. Tongue and tonsil carcinoma: increasing trends in the US population ages 20-44 years. Cancer. 2005;103:1843-9. 3. L l ew e l l y n C D, L i n k l a t e r K , B e l l J, J o h n s o n N W, Warnakulasuriya KA. Squamous cell carcinoma of the oral cavity in patients aged 45 years and under: a descriptive analysis of 116 cases diagnosed in the South East of England from 1990 to 1997. Oral Oncol. 2003;39:106-14. 4. Manuel S, Raghavan SK, Pandey M, Sebastian P. Survival in patients under 45 years with squamous cell carcinoma of the oral tongue. Int J Oral Maxillofac Surg. 2003;32:167-73. 26/4/12 18:33:05 84 5. Weber G, Cantero A. Glucose-6-phosphatase activity in normal, precancerous and neoplasic tissues. Cancer Res. 1955;15:105-8. 6. Zierler K. Whole body glucose metabolism. Am J Physiol. 1999;276:409-26. 7. Haberkon U, Ziegler SI, Oberdorfer F, Trojan H, Haag D, Peschke P, et al. FDG uptake, tumor proliferation and expression of glycolisis associated genes in animal models. Nucl Med Biol. 1994;21:827-34. 8. Martí-Climent, JM, García Velloso MJ, Serra P, Boán FJ, Richter JA. Tomografía por emission de positrones con un equipo PET/TAC. Rev Esp Med Nucl. 2005;24:60-79. 9. Schöder H, Yeung HWD, Gonen M, Kraus D, Larson SM. Head and neck cancer: clinical usefulness and accuracy of PET/CT image fusion. Radiology. 2004;60:65-72. 10. Schöder H, Yeung HWD. Positron emision imaging of head and neck cancer, including thyroid carcinoma. Semin Nucl Med. 2004;34:180-97. 11. Syed R, Bomanji JB, Nagabhushan N, Hughes S, Kayani I, Groves A, et al. Impact of combined 18F-FDG PET/CT in head and neck tumours. Br J Cancer. 2005;92:1046-50. 12. Koshy M, Paulino AC, Howell R, Schuster D, Halkar R, Davis LW. PET-CT fusion in radiotherapy treatment planning for head and neck cancer. Head Neck. 2005;27:494-502. 13. Schwartz DL, Ford E, Rajendran J, Yueh B, Coltrera MD, Virgin J, et al. FDG-PET/CT imaging for pre-radiotherapy staging of head and neck squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2005;61:129-36. 14. Quon A, Fischbein NJ, McDougall R, Quynh-Thu L, Loo BW, Pinto H, et al. Clinical role of fluorine-18 fluorodeoxyglucose positron emission tomography in the management of squamous cell carcinoma of the head and neck and thyroid carcinoma. J Nucl Med. 2007;48:58-67. 15. Agarwal V, Branstetter BF, Johnson JT. Indications for PET/ CT in the head and neck. Otolaryngol Clin N Am. 2008;41: 23-49. 16. Ha PK, Hdeib A, Goldenberg D, Jacene H, Patel P, Koch W, et al. The role of positron emission tomography and commputed tomography fusion in the management of early-stage and advanced-stage primary head and neck squamous cell carcinoma. Arch Otolaryngol Head Neck Surg. 2006;132:12-6. 17. Goerres GW, Schmidt DT, Bandhauer F, Huguenin PU, Von Schulthess GK, et al. Positron emission tomography in the early follow-up of advanced head and neck cancer. Arch Otolaryngol Head Neck Surg. 2004.130:105-9. 18. Uyl-de Groot CA, Senft A, De Bree R, Lemans CR, Hoekstra OS. Chest CT and Whole-body 18F-FDG PET are cost-effec- 4-8 Capt 109.pag.indd 84 Radiología de cabeza y cuello tive in screening for distant metastasese in head and neck cancer patients. J Nucl Med. 2010;51:178-82. 19.Menda Y, Graham MM. Update on 18F-fluorodeoxyglucose/ positron emission tomography and positron emission tomography/computed tomography imaging of squamous head and neck cancers. Semin Nucl Med. 2005;35: 214-9. 20. Instituto de Salud Carlos III. Boletín epidemiológico semanal. Vol. 12. Centro Nacional de Epidemiología. Madrid: Ministerio de Sanidad y Consumo; 2004. p. 161-72. 21. Gómez JM. Cáncer de tiroides. En: Diéguez C, Yturriaga R, editores. Actualizaciones en endocrinología. Tiroides. Madrid: McGraw-Hill-Interamericana de España; 2007. p. 253-65. 22. Pacini F, Schlumberger M, Dralle H, Elisei R, Smit J, Wiersinga W, et al. The European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid cancer of the follicular ephitelium. Eur J Endocrinol. 2006;154:787-803. 23. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2009;19:1167215. 24. Feine U, Lietzenmayer R, Hanke J, Held J, Wöhrle H, et al. Fluorine-18-FDG and iodine-13 1-iodide uptake in thyroid cancer. J NucI Med. 1996;37:1468-72. 25. Muros MA, Llamas-Elvira JM, Ramírez-Navarro A, Gómez MJ, Rodríguez-Fernández A, Muros T, et al. Utility of fluorine-18-fluorodeoxyglucose positron emission tomography in differentiated thyroid carcinoma with negative radioiodine scans and elevated serum thyroglobulin levels. Am J Surg. 2000;179:457-61. 26. Lowe VJ, Mullan BP, Hay ID, McIver B, Kasperbauer JL. 18F-FDG PET of patients with Hürthle cell carcinoma. J Nucl Med. 2003;44:1402-6. 27. Plotkin M, Hautzel H, Krause BJ, Schmidt D, Larisch R, Mottaghy FM, et al. Implication of 2-18fluor-2-deoxyglucose positron emission tomography in the follow-up of Hürthle cell thyroid cancer. Thyroid. 2002;12:155-61. 28. Tomografía por emisión de positrones (PET) con 18FDG en oncología clínica (revisión sistemática). Informe de Evaluación de Tecnologías Sanitarias n.º 30. Madrid, noviembre de 2001. 29. Yun M, Noh TW, Cho A, Choi YJ, Hong SW, Park CS, et al. Visually discernible [18F]fluorodeoxyglucose uptake in papillary thyroid microcarcinoma: a potential new risk factor. J Clin Endocrinol Metab. 2010;95:3182-8. 26/4/12 18:33:05 Radiología de cabeza y cuello 7 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/resonancia magnética M.J. Ramos Gómez* y E. Roldán Romero Sección de Neurorradiología Diagnóstica y Terapéutica, Unidad de Gestión Clínica de Radiodiagnóstico, Hospital Universitario Reina Sofía, Córdoba, España Introducción Los ganglios linfáticos (fig. 1), que son la barrera defensiva natural que tiene el organismo frente a agresiones externas, pueden también ser un escalón de paso en la diseminación de neoplasias. La existencia de ganglios aumentados de tamaño y palpables es muy frecuente, sobre todo en niños y adolescentes; suele ser una respuesta inespecífica del organismo, que en muchos casos no requiere estudios de imagen. Diferenciar estos ganglios linfáticos denominados reactivos o inespecíficos de los ganglios infiltrados por procesos neoplásicos es un reto para el radiólogo, pues la presencia de metástasis ganglionares empeora el pronóstico y la supervivencia de los pacientes con neoplasia. En los tumores de cabeza y cuello (que son fundamentalmente carcinomas epidermoides) esta disminución de las expectativas de supervivencia alcanza el 50%1. Por este motivo, el asesoramiento de la alteración ganglionar por imágenes es de extremada importancia, máxime cuando la evaluación clínica muestra menor sensibilidad y fiabilidad que los estudios radiológicos2. La tecnología actual permite la utilización de métodos variados para el diagnóstico por imagen de los ganglios linfáticos patológicos: ecografía, tomografía computarizada (TC), resonancia magnética (RM), linfogammagrafía para detección de ganglio centinela o tomografía por emisión de positrones (PET). En los últimos años se han incorporado los estudios de fusión de técnicas (fundamentalmente PET-TC), que combinan lo mejor de la imagen funcional y anatómica. De las diferentes técnicas radiológicas, las preferidas en la bibliografía para la estadificación son la TC y la RM, por la posibilidad de valorar el tumor primario y porque las imágenes obtenidas pueden ser revaluadas por distintos observadores. Esta posibilidad de reinterpretación de las imágenes por profesionales de centros especializados y radiólogos dedicados a la cabeza y el cuello puede condu- Figura 1. Microfotografía de ganglio linfático normal, tinción de hematoxilina-eosina 20×. Cápsula (flechas), folículos linfoides (estrellas). cir a cambios en la valoración de los hallazgos, alterando el manejo terapéutico y el pronóstico. No obstante, la ecografía es una técnica muy útil, fundamentalmente cuando se complementa con técnicas de punción como la punción aspiración con aguja fina (PAAF) o la biopsia con aguja gruesa (BAG). Aunque todos estos métodos poseen alta sensibilidad y especificidad, sigue existiendo la dificultad de diagnosticar infiltración tumoral cuando los ganglios son de pequeño tamaño, porque hay un porcentaje nada desdeñable (1520%) de ganglios infiltrados que son indetectables por los medios actuales. Por este motivo, las guías clínicas3 siguen aconsejando realizar vaciamientos cervicales selectivos, profilácticos, pese a que el cuello sea clínica y radiológicamente N0 (tabla 1). *Autor para correspondencia. Correo electrónico: [email protected] (M.J. Ramos Gómez). 4-8 Capt 109.pag.indd 85 26/4/12 18:33:06 86 Radiología de cabeza y cuello Tabla 1 − Sistema de estadificación TNM NX No se pueden valorar los ganglios linfáticos N0 No hay metástasis ganglionares N1 Metástasis en un único ganglio ipsilateral, de 3 cm o menor en su máxima dimensión N2Metástasis en un único ganglio ipsilateral, mayor de 3 cm, pero inferior a 6 cm en su máxima dimensión; o en múltiples ganglios ipsilaterales, ninguno mayor de 6 cm; o en ganglios bilaterales o contralaterales, ninguno mayor de 6 cm N2aMetástasis en un único ganglio ipsilateral, mayor de 3 cm, pero inferior a 6 cm en su máxima dimensión N2b Metástasis en múltiples ganglios ipsilaterales, ninguno mayor de 6 cm N2c Metástasis en ganglios bilaterales o contralaterales, ninguno mayor de 6 cm N3 Metástasis en un ganglio linfático, mayor de 6 cm en su máxima dimensión N: ganglios linfáticos regionales. Fuente: clasificación del AJCC Cancer Staging Manual, 7th ed. Springer Science and Business Media LLC (SBM); 2010. Niveles ganglionares Los ganglios del cuello se distribuyen en 10 grupos ganglionares4 que, a efectos clínicos, se dividen en 7 niveles que tienen su correlación anatomorradiológica5,6 (figs. 2-5). Hay otros ganglios que no están incluidos en esta clasificación por niveles y que tienen denominación específica; entre ellos se encuentran los retrofaríngeos, los supraclaviculares o los parotídeos (fig. 6). De forma esquemática se puede resumir recordando que los ganglios del nivel I corresponden a los ganglios cervicales anteriores, los de los niveles II, III y IV son los de la cadena yugular inter- Figura 3. Reconstrucción volumétrica de niveles ganglionares altos. CI: arteria carótida interna; DG: músculo digástrico; ECM: músculo esternocleidomastoideo; M: mandíbula; SM: glándula submandibular; VYI: vena yugular interna. Figura 2. Clasificación por niveles de los ganglios linfáticos. Fuente: Som PM, Curtin HD, Mancuso AA. An imaging-based classification for the cervical nodes designed as an adjunct to recent clinically based nodal classification. Arch Otolaryngol Head Neck Surg. 1999;125:388-96 (con autorización). 4-8 Capt 109.pag.indd 86 na, los del nivel V, nivel que es el equivalente a la antigua cadena del nervio accesorio del espinal, se localizan por detrás del músculo esternocleidomastoideo, los del nivel VI son los de la región visceral anterior y los del nivel VII son los ganglios del mediastino superior. Los límites entre niveles están definidos por estructuras musculares, el cartílago cricoides y el hueso hioides (tabla 2). Dentro de los ganglios de la cadena yugular interna hay 2 ganglios que por su situación adquieren gran importancia: 26/4/12 18:33:06 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética Figura 4. Reconstrucción volumétrica de niveles ganglionares medios. CI: arteria carótida interna; T: cartílago tiroides; VYI: vena yugular interna. 87 Figura 5. Corte tomográfico de tomografía computarizada de niveles bajos, inferiores al cartílago cricoides. Fuente: Rovira A, Ramos A, De Juan Delago M. Radiología de cabeza y cuello. Actualizaciones SERAM. Editorial Médica Panamericana; 2010. – El ganglio yugulodigástrico, que es el nódulo centinela más alto, situado en el ápex de la cadena yugular interna en el ángulo de la mandíbula. – El ganglio de Virchow, que se encuentra en el límite inferior de la cadena yugular interna en la fosa supraclavicular izquierda (fig. 7). Este ganglio se localiza en la desembocadura del conducto torácico, a la altura de la unión de la vena yugular interna y de la vena subclavia. Cuando hay infiltración de este ganglio, sin que aparezcan alteraciones en el resto de grupos ganglionares del cuello, se debe buscar el tumor primario en el tórax o en el abdomen. Técnicas de imagen Es conveniente que, aunque se disponga de múltiples técnicas, se seleccione un esquema diagnóstico común a la patología tumoral de cabeza y cuello, que tiene que estar consensuado con los especialistas con los que se trabaja en cada institución. El manejo de este tipo de pacientes es muy complejo y requiere la formación de equipos multidisciplinares de profesionales (cirujanos, oncólogos, patólogos, radiólogos, enfermería, etc.) que puedan dar respuesta adecuada a las necesidades de los pacientes. Figura 6. Adenopatía retrofaríngea derecha (flecha gruesa) en paciente con neoplasia de cavum. Es medial a la arteria carótida interna (flecha fina). Ecografía La exploración se realiza con el paciente en decúbito supino y el cuello hiperextendido. Se utilizan sondas lineales de alta frecuencia (≥ 7,5 MHz) y, si es posible, se complementa el estudio convencional en modo B con la evaluación de la vascularización del ganglio con Doppler-color o Doppler-espectral. Aunque la ecografía tiene sus limitaciones, especialmente en pacientes obesos y en la valoración de los ganglios profundos (retrofaríngeos), es una técnica muy útil 4-8 Capt 109.pag.indd 87 por la posibilidad que ofrece de valorar la estructura interna del ganglio, sobre todo en ganglios de pequeño tamaño, y asesorar la presencia de calcificaciones. Es especialmente útil cuando se combina con la PAAF, siendo para algún autor7 la técnica que tiene mayor sensibilidad en la detección de ganglios linfáticos malignos. Es, sin embargo, la técnica que tiene mayor dependencia del explorador y los estudios no pueden ser reinterpretados por otro observador. 26/4/12 18:33:06 88 Radiología de cabeza y cuello Tabla 2 − Correlación de niveles ganglionares clínicos con la imagen tomográfica obtenida por tomografía computarizada (TC) o resonancia magnética (RM) El nivel I corresponde a las adenopatías cervicales anteriores 1. Submentonianas (IA), localizadas entre los márgenes mediales del vientre anterior de los músculos digástricos 2. Submandibulares (IB), laterales a ellos Su límite inferior es el hueso hioides y el posterior la glándula submandibular Los niveles II, III y IV corresponden a los ganglios de la cadena yugular interna El nivel II se extiende desde la base del cráneo hasta el extremo del cuerpo del hueso hioides. Los ganglios de este nivel son posteriores a la glándula submandibular y anteriores al borde posterior del músculo ECM 1. IIA (anteriores, laterales o posteriores a la vena yugular interna si no hay plano graso de separación con ella) 2. IIB: corresponde a los ganglios posteriores a la vena si existe plano graso de separación El nivel III se localiza entre el borde inferior del cuerpo del hueso hioides y el extremo del cartílago cricoides. Los ganglios en este nivel son también anteriores al borde posterior del ECM El nivel IV se extiende desde el borde inferior del cartílago cricoides a la clavícula. Sus ganglios son laterales a las arterias carótidas y anteriores a una línea que conecta el borde posterior del ECM y el margen posterolateral del músculo escaleno anterior El nivel V corresponde a los ganglios del triángulo posterior. Se sitúan por detrás del ECM desde la base del cráneo hasta el borde inferior del cartílago cricoides y por detrás de una línea imaginaria que cruce el borde posterior del ECM y el posterolateral del músculo escaleno anterior. Son anteriores al músculo trapecio; también se subdividen en: 1. VA: desde la base del cráneo hasta el extremo inferior del cartílago cricoides 2. VB: desde el borde inferior del cartílago cricoides hasta la clavícula Nivel VI. Son los ganglios del compartimiento visceral. Se extienden desde el borde inferior del hueso hioides hasta la región supraesternal. El borde lateral de este nivel lo forma la región medial de la vaina carotídea Nivel VII. Ganglios del mediastino superior ECM: esternocleidomastoideo. Fuente: Som PM, Curtin HD, Mancuso AA. An imaging-based classification for the cervical nodes designed as an adjunct to recent clinically based nodal classification. Arch Otolaryngol Head Neck Surg. 1999;125:388-96. Tomografía computarizada Figura 7. Ganglio de Virchow. Masa adenopática laterocervical izquierda (flecha corta gruesa) en niveles IV y V. Metástasis de carcinoma de colon. 4-8 Capt 109.pag.indd 88 La TC debe realizarse tras la administración de contraste intravenoso. Generalmente se introducen 80-100 ml de contraste yodado a un rango de 1,5-2 ml/s. La adquisición de la imagen se retarda al menos hasta el final de la inyección de contraste e incluso algunos segundos más, para que además de realzarse las estructuras vasculares se produzca captación del contraste en las superficies mucosas. Los estudios se realizan en equipos multidetectores que permiten realizar una exploración muy rápida para disminuir los artefactos por movimientos respiratorios o por deglución en los pacientes que no pueden aguantar una inspiración mantenida. El algoritmo de reconstrucción debe ser el adecuado en cada equipo para mantener la calidad de la imagen (habitualmente entre 2 y 3 mm), obteniendo reconstrucciones en los planos axial y coronal. Como se ha mencionado, es una técnica rápida, accesible en todos los centros hospitalarios, con una gran sensibilidad y especificidad en la detección de ganglios malig- 26/4/12 18:33:06 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética nos, especialmente en los casos de necrosis, en los que es superior a la ecografía8. Tiene limitaciones, derivadas del método, que impiden o dificultan la visualización de estructuras; el ejemplo típico es el artefacto provocado por los materiales protésicos dentales en la cavidad oral o los materiales quirúrgicos empleados en cirugías previas. Además hay otros inconvenientes: la posibilidad de efectos adversos por la utilización de contrastes yodados y el uso de radiaciones ionizantes. Resonancia magnética Habitualmente, este tipo de estudios se realiza en equipos de 1,5 T y, aunque el tiempo de exploración es mayor que en la TC y tiene menor resolución espacial, presenta mayor resolución tisular, lo que permite valorar detalles anatómicos muy importantes en la planificación del tratamiento de las neoplasias (p. ej., infiltración del espacio prevertebral)9. Dado que los ganglios linfáticos se encuentran habitualmente en un entorno graso, es necesario utilizar secuencias que permitan diferenciarlos de la grasa en que están inmersos. Hay 2 tipos de técnicas que permiten suprimir esta señal grasa, bien selectivamente, utilizando el desplazamiento químico, o bien utilizando un pulso de inversión (STIR). Tanto el T2 con supresión grasa (fig. 8) como el STIR (fig. 9) se utilizan para localizar y diferenciar los ganglios linfáticos, aunque con frecuencia no permiten su caracterización10; para conseguirla se utilizan secuencias T1 con supresión grasa tras la administración de contraste. Estas secuencias son esenciales porque facilitan la detección de necrosis (fig. 10) y la existencia de diseminación extracapsular, aunque alargan el tiempo de exploración. Habitualmente se utiliza un grosor de corte de 4 o 5 mm, con separación entre los cortes que oscila entre 0,5 y 1 mm. Al igual que la TC, también tiene inconvenientes pues es una técnica exploratoria lenta, que plantea muchos problemas a los pacientes con claustrofobia y tiene contraindicaciones absolutas (pacientes portadores de marcapasos, neuroestimuladores, válvulas cardíacas metálicas, desfibrilador automático implantable). Los contrastes utilizados (derivados del gadolinio) tienen menos reacciones y efectos secundarios que los contrastes yodados utilizados en la TC; es excepcional la existencia de reacciones anafilácticas, aunque no son inocuos. Su uso está contraindicado en pacientes con insuficiencia renal grave o en los que van a someterse o son receptores de un trasplante hepático, por la posibilidad de desarrollar fibrosis sistémica nefrogénica, salvo en algún preparado concreto y después de analizar cuidadosamente el binomio riesgo/beneficio11. Hay otros tipos de contraste que se han investigado en RM, concretamente el uso de partículas microscópicas de óxido de hierro que son atrapadas por los ganglios linfáticos normales, lo que produciría una disminución de la 4-8 Capt 109.pag.indd 89 89 ★ Figura 8. Resonancia magnética de cuello. T2 con supresión grasa. Identificación de ganglios linfáticos (flechas) en un paciente con carcinoma de amígdala y base de lengua (estrella). Se visualizan mejor los planos musculares y los límites de las estructuras. Figura 9. Resonancia magnética de cuello. Secuencia STIR. Ganglios linfáticos (flechas) en niveles I y II. La definición anatómica es peor; se suprime de forma más homogénea la señal de la grasa. 26/4/12 18:33:07 Radiología de cabeza y cuello 90 Figura 11. Ecografía. Ganglios “normales”, hipoecoicos, de contornos netos, con hilio graso ecogénico. Figura 10. Resonancia magnética. T1 con supresión grasa tras la administración de contraste, corte transversal. Adenopatías heterogéneas, con zonas de aspecto necrótico en nivel II derecho (flechas) en un paciente con carcinoma epidermoide de trígono retromolar y suelo de boca (estrella). intensidad de señal en estos ganglios, en las secuencias potenciadas en T2 y T2*12, mientras que no sucedería en los ganglios patológicos por tener alterados los mecanismos de fagocitosis. Este tipo de contraste no está actualmente autorizado para su uso clínico para este propósito, aunque se sigue trabajando en modelos experimentales. La difusión es la técnica avanzada de RM que más se ha desarrollado en este campo en los últimos años y que se está empezando a utilizar de forma rutinaria en los protocolos de estudio de los carcinomas de cabeza y cuello, tanto en los estudios de estadificación inicial13 como en la monitorización de la respuesta al tratamiento14. Este tema será analizado en otro capítulo de esta monografía. Valoración por imagen de los ganglios linfáticos El radiólogo, en los tumores de cabeza y cuello, tiene que identificar si hay ganglios patológicos y si éstos son ipsilaterales, contralaterales o bilaterales al tumor primario. La alteración ganglionar se deduce bien por el tamaño de los ganglios o bien por la alteración de su aspecto. Los ganglios considerados normales son de morfología ovoidea y tienen un tamaño pequeño; en ecografía se ven como nódulos de contorno homogéneo e hipoecoicos, salvo por el hilio graso excéntrico que presentan (fig. 11), y además muestran vas- 4-8 Capt 109.pag.indd 90 Figura 12. Ecografía Doppler de ganglio reactivo, con la vascularización hiliar típica. cularización hiliar o central (fig. 12). En TC estos ganglios son isodensos con respecto al músculo mientras que en RM son hiperintensos en secuencias potenciadas en T2 o STIR. En ambas técnicas son homogéneos, excepto cuando se aprecia la zona de metaplasia grasa del hilio, aunque ésta no es una consideración que se aplique habitualmente a la TC y la RM. (fig. 13). Tamaño Los pilares básicos en los que se basa la detección de un ganglio patológico son la morfología, el tamaño y el 26/4/12 18:33:07 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética 91 Figura 14. Ganglios redondeados y aumentados de tamaño (flechas finas) en paciente con carcinoma epidermoide de seno piriforme (flecha gruesa). Figura 13. Tomografía computarizada de cuello con contraste. Ganglios de morfología ovoidea y contornos bien definidos (flechas) en nivel IB. No se aprecia la zona de metaplasia grasa del hilio. ★ aspecto del ganglio. A medida que la adenopatía deja de ser ovoidea y tiende a ser redondeada, la posibilidad de infiltración neoplásica es mayor. En este contexto interviene el tamaño y la relación entre los diámetros longitudinal y transversal; cuando esa relación longitudinal/transversal es mayor de 2 (ganglio ovoideo) se supone que el ganglio es inespecífico, cuando la relación es inferior a 2 (tendencia a ser redondeado) el ganglio puede ser patológico (figs. 14 y 15). Esta simplificación puede llevar a error, pues los ganglios de los niveles I y II pueden ser redondeados sin que estén infiltrados. El tamaño más utilizado hoy para la valoración de los ganglios linfáticos es de 10-15 mm de diámetro transversal máximo en los niveles I y II, y de 10 mm para el resto de niveles. Los ganglios retrofaríngeos se consideran patológicos en el contexto de enfermedad neoplásica si superan los 6-8 mm. Sin embargo, exclusivamente con estos criterios, la tasa de falsos negativos es del 20% y la de falsos positivos del 15%1. Cuando se intenta disminuir el tamaño ganglionar para diferenciar entre un ganglio no infiltrado y uno infiltrado aumenta la sensibilidad, pero disminuye mucho la especificidad15. No hay que olvidar que los ganglios también pueden estar aumentados de tamaño en procesos reactivos inespecíficos y en la patología inflamatoria. Por otro lado, un ganglio de pequeño tamaño puede estar infiltrado. 4-8 Capt 109.pag.indd 91 ★ Figura 15. Resonancia magnética de columna cervical. T2 en plano transversal. Hallazgo incidental de una adenopatía (flecha) aumentada de tamaño y con morfología anómala. En los estudios posteriores se confirmó la existencia de un carcinoma epidermoide de amígdala con metástasis ganglionares. En ecografía, el principal patrón de detección de un ganglio infiltrado es la pérdida del hilio graso, que suele ser visible con esta técnica hasta en el 90% de los ganglios > 5 mm16 así como la vascularización anárquica en Doppler (fig. 16A y 16B). 26/4/12 18:33:08 Radiología de cabeza y cuello 92 Figura 16. Ecografía de ganglio metastásico. A) Adenopatía laterocervical homogéneamente hipoecoica con pérdida del hilio graso. B) Vascularización anárquica con pérdida del flujo hiliar habitual. En los seguimientos de los tumores de cabeza y cuello, el aumento de tamaño de un ganglio preexistente es sospechoso y obliga a descartar infiltración (figs. 17A y 17B). Ni la ecografía, ni la TC, ni la RM son capaces de detectar las micrometástasis, por lo que en función de la localización y la T de la estadificación del tumor primario, en muchos centros se realizan vaciamientos cervicales preventivos unilaterales o bilaterales. Esta decisión provoca que en muchos casos se produzca un tratamiento excesivo del tumor y un aumento de la morbilidad. Homogeneidad y contorno Como se ha mencionado, los considerados ganglios “normales” o “inespecíficos” son homogéneos y de un contorno regular; cuando esa homogeneidad desaparece o cuando existen abombamientos focales (fig. 18A y 18 B) ese ganglio es sospechoso, pues la infiltración tumoral se inicia en la periferia (fig. 19). 4-8 Capt 109.pag.indd 92 Figura 17. Seguimiento de carcinoma epidermoide de cavidad oral. A) Tomografía computarizada (TC) de control en 2009, pequeña adenopatía (flecha) inespecífica. B) TC de control en 2011, aumento de tamaño y heterogeneidad de la adenopatía (flecha). Por punción aspiración con aguja fina se diagnosticó metástasis de carcinoma epidermoide. Necrosis A medida que la infiltración progresa, el ganglio se vuelve heterogéneo hasta que finalmente se produce la necrosis. Esta aparición es lo único que permite afirmar que un 26/4/12 18:33:08 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética 93 Figura 19. Microfotografía ampliada (40×) de infiltración periférica de un ganglio linfático. La cápsula no está afectada (flecha fina). En el interior de la lesión se aprecia acúmulo de queratina (flecha gruesa). Folículos linfoides en la zona intacta del ganglio (estrellas). Figura 20. Tomografía computarizada de cuello con contraste; estadificación de carcinoma epidermoide de cabeza y cuello. Adenopatía necrosada en nivel IV derecho. En este contexto, la adenopatía es metastásica mientras no se demuestre lo contrario. Figura 18. Tomografía computarizada (TC) de estadificación de carcinoma epidermoide de borde lateral izquierdo de lengua. A) Ganglio de pequeño tamaño, con abombamiento focal (flecha). Al paciente se le realizó resección de la lesión primaria más vaciamiento cervical funcional izquierdo. B) TC de seguimiento 4 meses después del estudio inicial: necrosis (flecha) de la zona lobulada; metástasis de carcinoma epidermoide. ganglio es patológico mientras no se demuestre lo contrario (fig. 20). La frecuencia de necrosis aumenta con el tamaño ganglionar, llegando al 63% en los ganglios > 1,5 cm17. 4-8 Capt 109.pag.indd 93 Cuando aparece un ganglio con necrosis en un estudio de cabeza y cuello, la primera posibilidad que se debe considerar es la de una metástasis de carcinoma epidermoide de cabeza y cuello, aunque pueden haber otras causas, tanto neoplásicas (carcinoma papilar de tiroides, menos frecuentemente linfoma no hodgkiniano, etc.) como inflamatorias o infecciosas (tuberculosis, enfermedad por arañazo de gato, etc.) (fig. 21). Si en la TC o la RM la necrosis es relativamente fácil de identificar, en la ecografía la necrosis puede tener 2 comportamientos diferentes: aparecer como áreas hiperecogénicas dentro de un ganglio patológico (necrosis coagulativa) o como zonas anecoicas (necrosis quística). 26/4/12 18:33:09 Radiología de cabeza y cuello 94 ★ Figura 21. Tomografía computarizada de cuello con contraste. Ganglio necrosado intraparotídeo derecho. La punción aspiración con aguja fina sólo mostró signos de inflamación aguda, sin alteraciones sugestivas de malignidad. Si la necrosis progresa mucho, puede aparecer en la exploración un ganglio cuyo material está completamente reemplazado por contenido líquido o necrótico, y sólo se aprecia una captación periférica; a este tipo de ganglios se les denomina quísticos y no deben confundirse con otras lesiones en el cuello de tipo benigno como el quiste branquial. Cuando en un adulto aparece una imagen de aparente quiste branquial en localización poco habitual hay que descartar la existencia de una adenopatía metastásica (fig. 22). Calcificaciones La existencia de calcificaciones es poco frecuente en los ganglios linfáticos, pues ocurre en un 1% de los casos18. Su presencia no implica enfermedad maligna, pues pueden verse en procesos inflamatorios y granulomatosos. Sin embargo, la aparición de calcificaciones ganglionares limita el diagnóstico diferencial entre las enfermedades no neoplásicas, fundamentalmente a la tuberculosis (fig. 23) y a la sarcoidosis, y entre las neoplásicas a las metástasis de carcinoma papilar de tiroides, linfoma tratado, y carcinomas de faringe y cavidad oral. El informe del radiólogo El radiólogo, en su informe, debe especificar los ganglios sospechosos o claramente patológicos, los niveles en que 4-8 Capt 109.pag.indd 94 Figura 22. Tomografía computarizada con contraste: lesión quística expansiva (estrella) localizada entre el músculo esternocleidomastoideo y los grandes vasos. Linfoma no hodgkiniano. Fuente: Rovira A, Ramos A, De Juan Delago M. Radiología de cabeza y cuello. Actualizaciones SERAM. Editorial Médica Panamericana; 2010. se encuentran, si son unilaterales, contralaterales o bilaterales al tumor primario y el tamaño de dichos ganglios, que son los datos que permiten encuadrar el tumor en un N determinado. Pero hay otros parámetros de valoración distintos a los mencionados que son esenciales para el pronóstico, tratamiento y supervivencia de los pacientes y que deben estar incluidos en la valoración radiológica: – Diseminación extracapsular. Los ganglios patológicos tienen normalmente contornos bien definidos; cuando esos contornos se desdibujan y se pierden los planos de separación con las estructuras de vecindad (fig. 24) se supone que el tumor ha sobrepasado el ganglio y está extendiéndose por contigüidad. Este fenómeno se conoce con el nombre de diseminación extracapsular y su existencia implica empeoramiento del pronóstico y aumento de la tasa de recurrencias. – Invasión carotídea. La invasión de la arteria carótida, que se produce teóricamente cuando el tumor engloba en 270º a la arteria19 implica un estadio avanzado, por lo que, teóricamente, el tumor es inoperable, salvo que se provoque oclusión del vaso. – Invasión vertebral y de base de cráneo. Es un criterio de exclusión de cirugía y, por tanto, de curación. 26/4/12 18:33:09 Estadificación de los ganglios del cuello (N). Criterios de imagen tomografía computarizada/ resonancia magnética 95 ★ Figura 23. Tomografía computarizada de cuello sin contraste. Ganglio necrosado (estrella) y con calcificaciones periféricas. Tuberculosis tratada. Papel de la ecografía cervical La ecografía puede ser un complemento muy importante en la estadificación, control y seguimiento de los pacientes con carcinoma epidermoide de cabeza y cuello. Aunque no es la técnica preferida en nuestro medio para la valoración de las cadenas linfáticas cervicales en las neoplasias, su uso está indicado para: – Obtener una muestra histológica del ganglio supuestamente patológico mediante técnicas de punción guiadas por ecografía, bien por PAAF20 o por BAG21. – Valorar los ganglios dudosos por otras técnicas. – Control y seguimiento de pacientes cuando la TC y la RM no están disponibles o no se pueden realizar (pacientes claustrofóbicos y con alergias a contrastes). – Valoración inicial de una tumoración cervical, por su rapidez, inocuidad y relativo bajo coste. Metástasis de origen desconocido No es excepcional que aparezcan metástasis cervicales sin que haya un tumor primario conocido22, aunque los porcentajes varían según los autores. En esta situación, el conocimiento de las vías de diseminación linfática de los tumores de cabeza y cuello, que es bastante predecible1, es muy útil para tratar de identificar la lesión primaria, pues en la mayor parte de los casos el tumor primario se localiza en esta zona. Cuando no se encuentran lesiones en cabeza y cuello, la búsqueda se debe extender a otras zonas del organismo (estudios digestivos, TC de tórax y abdomen). Con estas técnicas usualmente se detecta un 25% de tumores primarios. Desde hace algunos años se incluyen en muchos centros estudios de PET y, más recientemente, de fusión para identificar el tumor primario. Aunque es un tema controvertido23, la tendencia actual es incluir esta técnica, pues 4-8 Capt 109.pag.indd 95 Figura 24. Tomografía computarizada de cuello; adenopatía de gran tamaño con zonas de necrosis situada en el nivel III izquierdo. Sus límites están mal definidos y se pierden los planos de separación con el músculo (flechas). Son signos de diseminación extracapsular confirmados en cirugía. en algunos estudios puede aumentar la capacidad de detección de tumor primario hasta el 55%24. Agradecimientos Queremos expresar nuestro agradecimiento al Dr. Antonio Acosta, facultativo de la Unidad de Gestión Clínica (UGC) de Anatomía Patológica por las imágenes histológicas; al Dr. Pedro Seguí de la Sección de Neurorradiología diagnóstica y terapéutica de la UGC de radiodiagnóstico, por su contribución en las imágenes y en la valoración ecográfica que aparecen en este capítulo, y finalmente a nuestro compañero, el Dr. Francisco Bravo, por sus aportaciones en la revisión de este documento. Bibliografía 1. Gor DM, Langer JE, Loevner LA. Imaging of cervical lymph nodes in head and neck cancer: the basics. Radiol Clin North Am. 2006;44:101-10. 2. Haberal I, Celik H, Göçmen H, Akmansu H, Yörük M, Ozeri C. Which is important in the evaluation of metastatic lymph nodes in head and neck cancer: palpation, ultrasonography, or computed tomography? Otolaryngol Head Neck Surg. 2004;130:197-201. 3. Head and Neck Cancer. Practice Guidelines in Oncology – v.2.2011. National Comprehensive Cancer Network (NCCN). Disponible en: http://www.nccn.org/ 4. Som PM. Lymph nodes. En: Som PM, Curtin HD, editors. Head and Neck imaging. 4th ed. St. Louis: Mosby; 2003. p. 1865-934. 5. American Joint Committee on Cancer Staging. American Joint Committee on Cancer Staging manual. 5th ed. Philadelphia: Lippincott Raven; 1997. 26/4/12 18:33:09 96 6. Som PM, Curtin HD, Mancuso AA. An imaging-based classification for the cervical nodes designed as an adjunct to recent clinically based nodal classification. Arch Otolaryngol Head Neck Surg. 1999;125:388-96. 7. Ahuja AT, Ying M, Ho SY, Antonio G, Lee YP, King AD, et al. Ultrasound of malignant cervical lymph nodes. Cancer Imaging. 2008;8:48-56. 8. King AD, Tse GM, Ahuja AT, Yuen EH, Vlantis AC, To EW, et al. Necrosis in metastatic neck nodes: diagnostic accuracy of CT, MR imaging and US. Radiology. 2004;230:720-6. 9. Loevner LA, Ott IL, Yousem DM, Montone KT, Thaler ER, Chalian AA, et al. Neoplastic fixation to the prevertebral compartment by squamous cell carcinoma of the head and neck. AJR Am J Roentgenol. 1998;170:1389-94. 10. Ishikawa M, Anzai Y. MR imaging of lymph nodes in the head and neck. Neuroimag Clin N Am. 2004;14:679-94. 11. Nota informativa de la AEMPS sobre fibrosis sistémica nefrogénica y contrastes de gadolinio: finalización de la revisión en Europa. Ref. 2009/12. 20 noviembre de 2009. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2009/ NI_2009-12_FSN-gadolinio.htm 12. M a ck M G, B a l z e r J O, S t ra u b R , E i ch l e r K , Vog l T J. Superparamagnetic iron oxide-enhanced MR Imaging of head and neck lymph nodes. Radiology. 2002;222:239-44. 13. Vandecaveye V, De Keyzer F, Vander Poorten V, Dirix P, Verbeken E, Nuyts S, et al. Head and neck squamous cell carcinoma: value of diffusion-weighted MR imaging for nodal staging. Radiology. 2009;251:134-46. 14. Chawla S, Kim S, Wang S, Poptani H. Diffusion-weighted imag ing in head and neck cancers. Future Oncol. 2009;5:959-75. 15. Curtin HD, Ishwaran H, Mancuso AA, Dalley RW, Caudry DJ, McNeil BJ. Comparison of CT and MR imaging in staging of Neck metastases. Radiology. 1998;207:123-30. 4-8 Capt 109.pag.indd 96 Radiología de cabeza y cuello 16. Ying M, Ahuja A. Sonography of neck lymph nodes. Part I. Normal lymph nodes. Clin Radiol. 2003;58:351-8. 17. Friedman M, Roberts N, Kirshenbaum GL, Colombo J. Nodal size of metastatic squamous cell carcinoma of the neck. Laryngoscope. 1993;1030:854-6. 18. Eisenkraft BL, Som PM. The spectrum of benign and malignant etiologies of cervical node calcification. AJR Am J Roentgenol. 1999;172:1433-7. 19. Yousem DM, Hatabu H, Hurst RW, Seigerman HM, Montone KT, Weinstein GS, et al. Carotid artery invasion by head and neck masses: prediction with MR imaging. Radiology. 1995;195:715-20. 20. Knappe M, Louw M, Gregor RT. Ultrasonography-guided fine-needle aspiration for the assessment of cervical metastases. Arch Otolaryngol Head Neck Surg. 2000;126:1091-6. 21. Kim BM, Kim EK, Kim MJ, Yang WI, Park CS, Park SI. Sonographically guided core needle biopsy of cervical lymphadenopathy in patients without known malignancy. J Ultrasound Med. 2007;26:585-91. 22. Waltonen JD, Ozer E, Hall NC, Schuller DE, Agrawal A. Metastatic carcinoma of the neck of unknown primary origin: evolution and efficacy of the modern workup. Arch Otolaryngol Head Neck Surg. 2009;135:1024-9. 23. Deron PB, Bonte KM, Vermeersch HF, Van de Wiele C. Lymph node metastasis of squamous cell carcinoma from an unknown primary in the upper and middle neck: impact of (18)f-fluorodeoxyglucose positron emission tomography/computed tomography. Cancer Biother Radiopharm. 2011;26:331-4. 24. Rudmik L, Lau HY, Matthews TW, Bosch JD, Kloiber R, Molnar CP, et al. Clinical utility of PET/CT in the evaluation of head and neck squamous cell carcinoma with an unknown primary: A prospective clinical trial. Head Neck. 2011;33:935-40. 26/4/12 18:33:10 Radiología de cabeza y cuello 8 El cuello tratado. Claves para el seguimiento radiológico C. Ferreiro Argüellesa,* y J. Martínez Salazarb aServicio de Radiodiagnóstico, Hospital Universitario Severo Ochoa, Leganés, Madrid, España bServicio de Otorrinolaringología, Hospital Universitario del Sureste, Arganda, Madrid, España Introducción Los carcinomas escamosos de cabeza y cuello son el quinto cáncer más frecuente del mundo, representando aproximadamente el 3-4% de todas las neoplasias y son responsables de un 1% de las muertes por cáncer1. En los últimos años se han realizado importantes avances en el diagnóstico y tratamiento de los tumores de cuello. Para lograr el control local de la enfermedad, las modalidades más empleadas son (de forma aislada o en combinación) la cirugía, la radioterapia y la quimioterapia. El desarrollo de estas medidas terapéuticas se centra en lograr un control tumoral con el menor daño de los tejidos adyacentes e intentando preservar al máximo el funcionamiento del órgano en cuestión. El tipo de tratamiento está, evidentemente, en estrecha relación con el tipo de tumor primario, el estadio, la resecabilidad, y los resultados funcionales y oncológicos esperados. La infección por el virus del papiloma humano 16 (VPH 16) es el marcador que se ha relacionado de modo más consistente con la respuesta al tratamiento en pacientes con tumores de cabeza y cuello. Los carcinomas positivos para VPH se asocian con mayores tasas de respuesta, de supervivencia libre de recidiva y de supervivencia global2. Sin embargo, la supervivencia no ha experimentado los cambios sustanciales que cabría esperar para el esfuerzo realizado, ya que se sigue diagnosticando a muchos pacientes (casi a dos tercios de ellos) en estadios avanzados3. La mortalidad sigue siendo alta, por un lado a causa de las recidivas tumorales, y por el otro al desarrollo de metástasis a distancia y a la alta incidencia de segundos tumores primarios4,5. Actualmente, la recidiva local es la principal causa de muerte en los pacientes con carcinoma de cabeza y cuello avanzado en los primeros 3 años. Después de los primeros 3 años, la principal causa de muerte son las metástasis a distancia (pulmón, hueso e hígado) y el desarrollo de segundos tumores: pulmón en el caso de tumores laríngeos y de vía aerodigestiva en el caso de los tumores faríngeos6. Papel del seguimiento de los pacientes diagnosticados de carcinomas de cabeza y cuello El seguimiento rutinario de los pacientes tratados de carcinoma de cabeza y cuello después de la realización de tratamiento es objeto de controversia. Las razones principales que apoyan el seguimiento son: la detección precoz de recurrencia locorregional y el diagnóstico de segundos tumores primarios y metástasis a distancia. Además, el seguimiento mejora la detección y manejo de complicaciones terapéuticas, y proporciona un soporte emocional y psicológico a los pacientes y a sus familiares7,8. Lógicamente se asume que una identificación precoz de las recurrencias, es decir, en pacientes todavía asintomáticos, conllevaría tratamientos más precoces y eficaces y, por tanto, mejoraría la supervivencia. Sin embargo, no hay estudios controlados, con datos prospectivos, que demuestren un beneficio en la supervivencia para ninguna estrategia de seguimiento9,10. Una explicación que justifica por qué el cribado rutinario no mejora la supervivencia es la alta proporción de recurrencias que se presentan como sintomáticas, hasta un 86%, según un estudio de Schwartz11. Se cree que el seguimiento sistemático puede ser más eficaz en pacientes en los que inicialmente se les ha detectado enfermedad limitada y en los que todavía hay opciones terapéuticas curativas, como los paciente con tumores T1 o T2 que presentan recidiva tras haber recibido tratamiento con una sola modalidad de cirugía o radioterapia12,13. Además, hasta la fecha no hay consenso en relación con la frecuencia, la duración del seguimiento, ni en el tipo de pruebas complementarias indicadas, lo que significa una enorme variabilidad en los protocolos utilizados mundialmente. En general, la intensidad del seguimiento es mayor en los primeros 2 a 4 años, ya que aproximadamente el 80-95% de las recidivas ocurren en este margen de tiempo. Aunque existe poca evidencia del beneficio del seguimiento después de los 3 primeros años, se suelen continuar las revisiones periódicas después de 5 años por el riesgo de desarrollar segundos tumores primarios. *Autor para correspondencia. Correo electrónico: [email protected] (C. Ferreiro Argüelles). 4-8 Capt 109.pag.indd 97 26/4/12 18:33:10 98 Papel del otorrinolaringólogo El seguimiento postratamiento del paciente con carcinoma de cabeza y cuello debe ser realizado por el otorrinolaringólogo a 3 niveles14. Historia clínica Se revisan todos los síntomas locales que pueden manifestarse: disfonía, disnea, disfagia, odinofagia, otalgia refleja, etc. Se debe prestar especial atención a la aparición de nuevos síntomas o al empeoramiento de los previos. Igualmente hay que vigilar síntomas de regiones próximas (neumonía, hemoptisis, hematemesis, etc.) o síntomas sistémicos (pérdida de peso, astenia, dolores óseos o musculares). También hay que ser especialmente cuidadoso con los pacientes que continúan consumiendo tabaco o alcohol. Exploración física No es fácil la valoración de estos pacientes, ya que hay que diferenciar los cambios postratamiento (cicatrices, edema, inflamación, colgajos cutáneos interpuestos, etc.) de los cambios patológicos. La atención se orienta hacia: 1. Examen visual de las mucosas de todas las localizaciones de cabeza y cuello (incluyendo fibrolaringoscopio) en busca de asimetrías, irregularidades, masas, úlceras, etc. 2. Estado del cuello mediante palpación para descartar masas, adenopatías, etc. Pruebas complementarias no radiológicas Nos deben facilitar descartar 2 problemas: – Complicaciones de los tratamientos recibidos y estado general del paciente: analítica para descartar problemas hepáticos, renales, tiroideos, etc. – S egundos tumores primarios, principalmente del tracto aereodigestivo: esofagoscopia, broncoscopia, etc. No es necesario de forma rutinaria, sí si existieran síntomas sugestivos. Papel de las pruebas de imagen radiológicas Las neoplasias primarias laríngeas suelen surgir de la superficie mucosa, por lo que son accesibles a endoscopia y biopsia. Sin embargo, las recidivas tumorales suelen ser más profundas, submucosas y más difíciles de detectar. Se realizan pruebas de imagen postratamiento cuando se sospecha clinicamente recidiva tumoral, para confirmar la existencia de dicha lesión y para determinar su extensión. La extensión de la recidiva es un dato clave que condicionará la posibilidad de tratamiento curativo posterior. Las principales técnicas de imagen utilizadas son la ecografía, la tomografía computarizada (TC), la resonancia magnética (RM), incluyendo estudios de difusión por RM, y 4-8 Capt 109.pag.indd 98 Radiología de cabeza y cuello la tomografía con emisión de positrones (FDG-PET) sola o combinada con TC (PET-TC). La ecografía es útil en cuellos tratados difíciles de palpar, con piel indurada posradioterapia. El papel principal de esta técnica es la detección de adenopatías con signos ecográficos sospechosos de malignidad: ganglios de morfología redondeada, hipoecogénicos, con pérdida del hilio graso central y con patrón de vascularización periférico o mixto (periférico y central). También resulta fundamental para la realización de biopsias guiadas por ultrasonidos (fig. 1). En la mayoría de los pacientes, la TC es la modalidad de imagen más útil, tanto para el diagnóstico como para el seguimiento. La RM será la primera opción en pacientes con tumores nasofaríngeos, sinonasales, lengua y de la base del cráneo. La RM también es útil en casos en los que la TC no es capaz de demostrar afectación del ventrículo laríngeo, es más fiable para determinar si un tumor cruza la línea media o en sospecha de afectación cartilaginosa. Sin embargo, tanto en TC como en RM, muchas veces es difícil identificar el resto o recidiva tumoral en estos pacientes en los que los planos anatómicos y fasciales han sido distorsionados por la cirugía, la quimioterapia o la radioterapia. Por este motivo es imprescindible un buen conocimiento de los cambios postratamiento esperados15,16. Además, para facilitar el diagnóstico de las recidivas es recomendable obtener, 3-6 meses después del fin del tratamiento, un estudio basal para comparación17. Algunos autores recomiendan FDG-PET como estudio basal. Cuando se realiza 3-4 meses después del tratamiento, el valor predictivo negativo de la PET es muy elevado. Sin embargo pueden ocurrir falsos negativos debido a la baja resolución espacial. Por ello, en caso de PET negativa se recomienda seguimiento. El valor predictivo positivo de la PET es claramente más bajo debido a los cambios inflamatorios provocados por el tratamiento. Así, ante un estudio de PET positivo postratamiento se recomienda correlacionar con datos clínicos y con el resultado de otras pruebas de imagen, requiriéndose confirmación histológica. Hay pocos estudios que comparen la TC y la RM con la PET en estudios de seguimiento. Aunque pudiera parecer lógico que la PET realiza el diagnóstico de la recurrencia de forma más precoz que el resto de los métodos de imagen, hasta ahora esa afirmación no ha sido probada en estudios prospectivos. Recientemente se está extendiendo el uso de las técnicas de difusión por RM para el estudio de recidivas tumorales cervicales. Los tejidos hipercelulares, como los tumores y adenopatías malignas, muestran bajos valores del coeficiente de difusión aparente (ADC) (fig. 2). Por el contrario, los cambios no tumorales, como edema, inflamación, fibrosis y necrosis, presentan baja celularidad, lo que provoca altos valores de ADC. El uso de la imagen de difusión por RM parece prometedor para situaciones difíciles de resolver por imagen convencional, como la caracterización de ganglios de pequeño tamaño, en la diferenciación de los cambios postratamiento (especialmente después de quimio y radioterapia) y en la enfermedad persistente o recurrente. También puede utilizarse para monitorizar la 26/4/12 18:33:10 El cuello tratado. Claves para el seguimiento radiológico 99 Figura 1. Adenopatías malignas. Ecografía cervical y biopsia guiada por ultrasonidos. A) Múltiples adenopatías agrupadas (más de tres en un territorio ganglionar) redondeadas hipoecogénicas, con ausencia de hilio central ecogénico normal. Doppler (B) y angio (C) que muestran vascularización mixta (central y periférica). D) La biopsia guiada por ecografía (flecha) demostró metástasis de carcinoma epidermoide. respuesta tumoral tras radioterapia. Un valor añadido de la imagen por difusión es que puede usarse para el estudio del cuerpo completo, lo que ayudaría en el diagnóstico de metástasis y segundos tumores primarios18. Diagnóstico por imagen de las recurrencias Recidiva local Las recidivas locales influyen decisivamente en la supervivencia de este tipo de pacientes y se diagnostican mayoritariamente en los primeros 3 años de seguimiento. Una localización ampliamente citada en la bibliografía de recidiva es la cavidad oral, siendo los tumores de faringe en general los más recidivantes. La supervivencia general tras recidiva se sitúa entre el 22 y el 44%. Los tumores de laringe y cavum son los que tienen mayor supervivencia, mientras que en los de faringe y cavidad oral la supervivencia es muy baja19. Se ha tratado de establecer pautas en el seguimiento con endoscopia y técnicas de imagen (TC y RM) que, aunque son útiles para determinar la extensión del tumor, planificar el tratamiento y monitorizar su respuesta, no parecen permitir el diagnóstico precoz de las recidivas. Un hecho llamativo es que el número de revisiones y su periodicidad 4-8 Capt 109.pag.indd 99 no mejoran la detección precoz de las recidivas, pese a su importante coste económico. Para determinar la presencia o no de recidivas locales es aconsejable disponer de un estudio basal (TC, RM) a los 3-6 meses tras el fin del tratamiento en todo paciente con un perfil de alto riesgo. Este estudio basal conlleva, además, importante información predictiva respecto a la evolución del paciente, ya que diferencia entre los pacientes que responden y los que no responden al tratamiento. Así, según los hallazgos encontrados en el estudio control de fin de tratamiento, se pueden establecer 3 categorías: a) curación, la resolución radiológica es completa y no son necesarios estudios de seguimiento; b) fallo terapéutico, reducción tumoral < 50% e implica la reconsideración de las opciones terapéuticas, y c) indeterminado, pacientes con reducciones tumorales entre el 50 y el 75%. En este subgrupo es necesario un seguimiento estrecho (figs. 3 y 4). Las recidivas locales se suelen ver en TC y RM como masas sólidas, circunscritas, de bordes mal definidos, infiltrativos (fig. 5) y que captan contraste. En RM presentan alta intensidad de señal en las imágenes potenciadas en T2 y realce tras administrar gadolinio20. La localización de la recidiva está en relación con el tipo de tratamiento realizado21. Así, después de radioterapia, las recurrencias aparecen tipicamente como masas de tejidos blandos en el 26/4/12 18:33:10 100 Radiología de cabeza y cuello Figura 2. Resonancia magnética axial T2 con saturación grasa que muestra un tumor amigdalino derecho (flecha) que se extiende a suelo de boca (A) con metástasis ganglionares ipsilaterales (*) en el nivel IIB (B). La imagen de difusión (C) y el mapa del coeficiente de difusión aparente (ADC) (D) muestran marcada restricción en la difusión y valores bajos de ADC, tanto del tumor primario (flecha) como de las adenopatías metastásicas (*). Caso cortesía de los Dres. Carrascoso Arranz y Martínez de Vega (Hospital Universitario Quirón, Madrid). mismo sitio del tumor primario. Después de tratamientos quirúrgicos, las recidivas aparecen como masas de tejidos blandos en el lecho quirúrgico, en los márgenes de resección quirúrgica (fig. 6) o en la zona del traqueostoma (fig. 7). Un aspecto siempre difícil de determinar es el estado de los cartílagos. En recurrencias de gran tamaño se observa una masa de tejidos blandos que se extiende a ambos 4-8 Capt 109.pag.indd 100 lados del cartílago, afectando a la musculatura pretiroidea. En TC se puede ver esclerosis cartilaginosa (fig. 8), que es un dato poco preciso debido a la variabilidad en la osificación de los cartílagos laríngeos. La RM es superior a la TC para determinar la afectación cartilaginosa, mostrando disminución de la hiperseñal normal del cartílago en secuencias potenciadas en T222. 26/4/12 18:33:11 El cuello tratado. Claves para el seguimiento radiológico A 101 A B B C C Figura 3. Tomografía computarizada cervical con contraste intravenoso. Estudio de extensión (pretratamiento). Carcinoma epidermoide afectando a orofaringe derecha (A), seno piriforme (B) y extendiéndose a la grasa paraglótica laríngea y al área glótica (C). Adenopatías patológicas en los niveles IIA, IIB, III y IV con necrosis central y extensión extracapsular. 4-8 Capt 109.pag.indd 101 Figura 4. Estudio de control (tomografía computarizada con contraste intravenoso) basal 6 meses tras finalizar el tratamiento (quimio y radioterapia). Importantes cambios inflamatorios postratamiento con edema extenso de faringe que hace difícil la valoración del tumor residual. Nótese la resolución completa de la enfermedad ganglionar. Este estudio servirá como base para nuevos controles radiológicos. 26/4/12 18:33:11 Radiología de cabeza y cuello 102 – Tamaño: eje largo > 1,5 cm en ganglios yugulodigástricos y submandibulares (niveles IIA y IB), > 8 mm en ganglios retrofaríngeos y > 1 cm en el resto de los niveles ganglionares. – Morfología ganglionar: pérdida de aspecto normal ovalado, adoptando los ganglios al infiltrarse por tumor un aspecto redondeado y ausencia de visualización del hilio graso central. – Agrupamiento: 3 o más ganglios en un mismo territorio ganglionar, cada uno con diámetro de entre 8 y 15 mm. – Necrosis central: es el mejor indicador radiológico de afectación tumoral ganglionar. Se define como un área central de baja atenuación rodeada de un borde periférico irregular que capta contraste. Además se ha postulado la hipótesis de que la necrosis central ganglionar es un predictor de diseminación extracapsular. – Diseminación extracapsular: irregularidad del contorno capsular, captación nodular capsular e infiltración de grasa o planos musculares adyacentes. Figura 5. Tomografía computarizada cervical con contraste intravenoso realizada 1 año después de una laringectomía supracricoidea por carcinoma laríngeo. Se observa recurrencia local en forma de masa de tejidos blandos (*) de bordes imprecisos, mal definidos. Recidiva ganglionar El estado de los ganglios linfáticos es uno de los factores pronósticos más importantes en los pacientes con carcinoma escamoso de cabeza y cuello, estando la recidiva ganglionar claramente asociada con una menor supervivencia23. La recidiva ganglionar es más frecuente durante los 2 primeros años y es esperable tanto ipsilateral como contralateral al tumor primario (fig. 9). Los carcinomas de la cavidad oral tienden a extenderse a los ganglios de los niveles IA, IB, II y III. Los carcinomas de orofaringe, hipofaringe y laringe supraglótica se extienden a los ganglios de niveles II, III y IV. Los tumores glóticos tienen menor tendencia a la recidiva ganglionar. Los ganglios retrofaríngeos, clínicamente silentes pero visibles en imagen, suelen ser de primarios en nasofaringe, hipofaringe, pared lateral y posterior de orofaringe, amígdala palatina, paladar blando y tiroides. Los ganglios viscerales (niveles VI y VII) provienen de carcinomas de laringe subglótica, esófago cervical, tráquea y glándula tiroides. Los pacientes con enfermedad avanzada a los que se ha tratado con quimio y/o radioterapia pueden presentar al final del tratamiento enfermedad ganglionar persistente. En estos pacientes se suele plantear posteriormente la realización de vaciamiento ganglionar cervical. Por ello es importante determinar de forma fiable la presencia o no de enfermedad ganglionar residual para así poder evitar, en caso de no existir ganglios afectados, una cirugía. Para el diagnóstico de recidiva ganglionar por TC y RM hay varios criterios24: 4-8 Capt 109.pag.indd 102 En los pacientes con cuello tratado, la evaluación de las adenopatías cervicales es más difícil que en los estudios pretratamiento. Una fuente de error en el diagnóstico de recidiva ganglionar es la alteración que se produce en los ganglios linfáticos después de tratamiento con radioterapia. No debe confundirse la adenitis posradiación, en la que los ganglios presentan intensa captación de contraste, con recidiva ganglionar (fig. 10). Tras quimioterapia se puede observar necrosis del tumor primario y necrosis ganglionar como indicador de buena respuesta al tratamiento. Esta necrosis es indistinguible por métodos de imagen convencionales de la necrosis tumoral, estando indicada en estos casos difíciles la PET-TC y siendo prometedora la técnica de difusión por RM25. Metástasis La localización más frecuente de metástasis en los carcinomas de cabeza y cuello son los pulmones (fig. 11). Menos habitualmente pueden observarse metástasis óseas (fig. 12), hepáticas, cutáneas (fig. 13) y cerebrales. Las metástasis cutáneas de tumores de cabeza y cuello son raras (1% de los casos), suelen aparecer en los primeros 6 meses y tienen un pronóstico ominoso, con una supervivencia media de 3 meses tras su diagnóstico. La indicación de las pruebas de imagen torácicas para el cribado de metástasis pulmonares (y segundos tumores) es también objeto de controversia. Se puede individualizar la decisión basándose en cada paciente. Para pacientes no fumadores, con cánceres de cabeza y cuello que parecen relacionados con el VPH y no en relación con la exposición a tabaco, el estudio rutinario de tórax parece no estar indicado. Para el resto de pacientes se sugiere una radiografía de tórax anual o una TC de tórax con baja dosis de radiación cada 2 años. Para los pacientes que presenten muy alto riesgo de metástasis pulmonares o segundos tumores pulmonares, incluyendo pacientes que continúan fuman- 26/4/12 18:33:11 El cuello tratado. Claves para el seguimiento radiológico 103 B C D Figura 6. Carcinoma de hipofaringe. Recidiva local. A) Tomografía computarizada cervical con contraste intravenoso que muestra una masa de tejidos blandos en la zona de los bordes de resección quirúrgica (*). Nótese en el lado izquierdo de la imagen el hueso hiodes y el cartílago tiroides (flechas) en el mismo plano, hallazgo en relación con la reconstrucción (tiro-hioido-pexia) realizada. B) Resonancia magnética (RM) axial Gd T1-SPIR mostrando extensión de la recurrencia al suelo de la boca. C) RM T1 WI que demuestra extensión a la lengua, suelo de boca. D) RM coronal T2 al espacio submaxilar. 4-8 Capt 109.pag.indd 103 26/4/12 18:33:12 104 Radiología de cabeza y cuello Figura 7. Recidiva en traqueostoma. Tomografía computarizada cervical con contraste intravenoso. Reconstrucción multiplanar coronal (A) y corte axial (B) mostrando masa de partes blandas alrededor del agujero de traqueostomía (fecha) y en mediastino superior (asterisco). Figura 8. Afectación cartilaginosa. A y B) Tomografía computarizada cervical con contraste intravenoso 2 meses después de laringectomía frontolateral por un carcinoma glótico. Recurrencia local en cuerda vocal derecha y comisura anterior. El aritenoides (flecha), el cricoides (*) y el ala tiroidea posterior derecha están escleróticos. Se realizó laringectomía total con el resultado de carcinoma epidermoide en cuerda vocal, comisura anterior, cartílagos aritenoides, tiroides y cricoides. El pequeño ganglio III izquierdo (flecha) también fue positivo para malignidad. do o bebiendo, se recomienda estudio de radiografía de tórax o TC cada 6 o 12 meses26. Segundos tumores Los pacientes con carcinomas escamosos de cabeza y cuello tienen más riesgo de desarrollar segundos tumores primarios que cualquier otro tipo de pacientes oncológi- 4-8 Capt 109.pag.indd 104 cos. La incidencia global es mayor en pacientes fumadores y bebedores27. Es por esto que la posibilidad de un segundo tumor primario debe ser tenida en mente durante el diagnóstico, en la fase de tratamiento y en el seguimiento de los tumores de cabeza y cuello. Los criterios para clasificar un tumor como segundo primario maligno son28: confirmación histológica de malignidad, debe existir al menos 2 cm de superficie mucosa separando a los 2 tumores (fig. 14) y debe excluirse metástasis; 26/4/12 18:33:12 El cuello tratado. Claves para el seguimiento radiológico Figura 9. A) Tomografía computarizada (TC) cervical con contraste intravenoso (CIV). Recidiva ganglionar de pequeño tamaño en el nivel IIB (flecha). La zona central ganglionar de baja atenuación (necrosis) es altamente sospechosa de recurrencia de carcinoma epidermoide. B) TC cervical con CIV. Recidiva ganglionar en nivel IIB derecho donde se observa adenopatía con necrosis central y signos de infiltración extracapsular. No hay plano de separación con el músculo esternocleidomastoideo (*) ni con la arteria carótida derecha (c). C) Reconstrucción multiplanar coronal de TC cervical con CIV en otro paciente que muestra gran recidiva ganglionar cervical izquierda extendiéndose a mediastino superior. 4-8 Capt 109.pag.indd 105 105 Figura 10. Adenitis postirradiación. A y B) Tomografía computarizada cervical con contraste intravenoso que demuestra ganglios de pequeño tamaño que captan contraste de forma intensa y homogénea en los niveles IIA y IIB. Aunque el estudio de FDG-PET resultó positivo en múltiples niveles ganglionares siendo sospechoso de malignidad, la biopsia demostró adenitis postirradiación. 26/4/12 18:33:13 106 Figura 11. Metástasis pulmonares de carcinoma transglótico. Tomografía computarizada torácica (ventana pulmonar) mostrando nódulos pulmonares izquierdos (flechas) en relación con metástasis pulmonares 1 año después del diagnóstico. Figura 12. Metástasis óseas y pulmonares. Tomografía computarizada torácica con contraste intravenoso (ventana mediastino) mostrando metástasis costal derecha (*) y en parénquima pulmonar izquierdo (flecha). así, una lesión en el pulmón debe ser solitaria e histológicamente diferente del tumor primario de cabeza y cuello. Los segundos tumores se suelen desarrollar en el tracto aerodigestivo de la región cervical (fig. 15) y en el pulmón (fig. 16)29. Claves para el diagnóstico de las recidivas El estudio de un paciente con un cuello tratado de un tumor primario es un reto para el radiólogo. Hay una serie 4-8 Capt 109.pag.indd 106 Radiología de cabeza y cuello Figura 13. Metástasis cutánea (flecha). Tomografía computarizada cervical con contraste intravenoso en paciente al que se le había realizado laringectomía total 2 años antes. Se observa recurrencia local circunferencial en el sitio de la neofaringe y metástasis cutáneas (*). de claves que, usadas de forma sistemática, pueden facilitar la realización del informe radiológico. – Es imprescindible conocer el sitio de origen del tumor primario y su estadio al diagnóstico. – Asimismo, es fundamental conocer el tipo de tratamiento usado y estar familiarizado con los cambios postratamiento habituales después de cada tipo de cirugía, quimio o radioterapia. – Se aconseja tener un estudio de base realizado 3-6 meses después del fin de tratamiento que nos servirá de control (TC, RM o PET-TC). – Para descartar recidivas locales hay que tener en cuenta el tipo de tratamiento realizado. Tras radioterapia, las recidivas suelen ocurrir en el lugar donde se originó el tumor primario. Tras cirugía, las recidivas suelen localizarse en las zonas de anastomosis quirúrgica y en la zona del traqueostoma. – En el cribado de recidiva ganglionar hay que prestar atención fundamentalmente a los niveles ganglionares II, III y IV en los tumores epidermoides de cabeza y cuello. En todos los casos habrá que incluir el mediastino superior para excluir afectación ganglionar en esa localización. No olvidar otros datos fundamentales, como la presencia de necrosis, la extensión extracapsular y la relación con estructuras vasculares. – Descartar la presencia de metástasis. Buscar en pulmón, hueso e hígado. – No olvidar los segundos tumores primarios: pulmón en el caso de tumores laríngeos y de vía aerodigestiva en caso de los tumores faríngeos. 2/5/12 15:48:09 El cuello tratado. Claves para el seguimiento radiológico 107 Figura 14. Tumores síncronos. Tomografía computarizada cervical con contraste intravenoso, cortes al nivel de orofaringe (A) y senos piriformes (B). Tumores de amígdala izquierda e hipofaringe derecha: masa ulcerada en amígdala izquierda (flecha en A) y tumoración en seno piriforme derecho (flecha en B) que se extiende al repliegue ariepiglótico derecho y a la grasa paraglótica. Adenopatías metastásicas en nivel III derecho (*). Conclusiones Las recidivas de tumores de cuello tratado causan elevada mortalidad. La recurrencia locorregional es la más frecuente, y se produce fundamentalmente en tumores faríngeos y laríngeos. Respecto al seguimiento, aunque parece lógico, hasta ahora no se ha demostrado en estudios prospectivos una mejora en la supervivencia derivada del seguimiento rutinario de pacientes asintomáticos. Las indicaciones más ampliamente aceptadas de las pruebas de imagen postratamiento son, por un lado, la confirmación y determinación de la extensión de recidivas sospechadas clínicamente y, por otro, la monitorización de la respuesta al tratamiento. La obtención de un estudio basal a los 3-6 meses tras finalizar el tratamiento sirve de base para controles sucesivos y facilita el diagnóstivo de las recidivas. 4-8 Capt 109.pag.indd 107 Figura 15. Segundo tumor primario en la lengua 19 meses después de tratamiento de carcinoma de laringe transglótico. A) Tomografía computarizada (TC) cervical con contraste intravenoso que muestra una masa (flecha) que capta contraste en el lado derecho de la lengua. B) Resonancia magnética axial y coronal. C) Gd T1WI + SPIR confirma los datos del estudio de TC. 26/4/12 18:33:13 108 Radiología de cabeza y cuello Figura 16. A) Radiografía posteroanterior y lateral de tórax. Desplazamiento inferior del hilio izquierdo. La cisura mayor izquierda está desplazada posteriormente, hallazgo en relación con pérdida de volumen del lóbulo inferior izquierdo. La radiografía posteroanterior muestra una pequeña opacidad proyectada sobre la aorta descendente (flechas). Nótese el tubo de traqueotomía. El informe radiológico no sugirió carcinoma de pulmón. Tomografía computarizada torácica con contraste intravenoso 1 mes después de la realización de la radiografía de tórax. Ventana de mediastino (B) y pulmón (C). Masa en lóbulo inferior izquierdo (*) con colapso. La cisura mayor izquierda está marcadamente desplazada (flecha), con un borde convexo (signo de la “S” de Golden). Bibliografía 1. Joshi A, Calman F, O’Conell M, Jeannon JP, Pracy P, Simo R. Current trends in the follow-up of head and neck cancer patients in the UK. Clin Oncol. 2010;22:114-8. 2. Marur S, D’Souza G, Westra WH, Forastiere AA. HPVassociated head and neck cancer: a virus related cancer epidemic. Lancet Oncol. 2010;11:781-9. 4-8 Capt 109.pag.indd 108 3. Quer M, León X, Orús C, RecherK, Gras JR. Análisis de 2.500 carcinomas escamosos de cabeza y cuello. Acta Otorrinolaringol Esp. 2001;52:201-5. 4. Larson JT, Adams GL. Fattah HA. Survival statistics for multiple primaries in head and neck cancer. Otolaryngol Head Neck Surg. 1990;102:14-24. 5. Yamamoto E, Shibuya H, Yoshimura R, Miura M. Site specific dependency of second primary cancer in early stage head and neck squamous cell carcinoma. Cancer. 2002;94:2007-14. 26/4/12 18:33:14 El cuello tratado. Claves para el seguimiento radiológico 6. Spector JG, Sessions DG, Haughey BH, Chao KS, Simpson J, El Mofty S, et al. Delayed regional metastases, distant metastases, and second primary malignancies in squamos cell carcinomas of the larynx and hypopharynx. Larynoscope. 2001;111:1079-87. 7. Manikantan K, Khode S, Dwivedi RC, Palav R, Nutting CM, Rhys-Evans P, et al. Making sense of post-treatment surveillance in head and neck cancer: when and what of followup. Cancer Treat Rev. 2009;35:744-53. 8. Flynn CJ, Khaouam N, Gardner S, Higgins K, Enepekides D, Balogh J, et al. The value of periodic follow-up in the detection of recurrences after radical treatment in locally advanced head and neck cancer. Clin Oncol. 2010;22:868-73. 9. De Visscher AV, Manni JJ. Routine long-term follow-up in patients treated with curative intent for squamous cell carcinoma of the larynx, pharynx, and oral cavity. Does it make sense? Arch Otolaryngol Head Neck Surg. 1994;120:934-9. 10. Ritoe SC, De Vegt F, Scheike IM, Krabbe PF, Kaanders JH, Van den Hoogen FJ, et al. Effect of routine follow-up after treatment for laryngeal cancer on life expectancy and mortality: results of a Markov model analysis. Cancer. 2007;109:239-47. 11. Schwartz DL, Barker J Jr, Chansky K, Yueh B,Raminfar L, Drago P, et al.Postradiotherapy surveillance practice for head and neck squamous cell carcinoma too much for too little? Head Neck. 2003;25:990-9. 12. Agrawal A, Hammond TH, Young GS, Avon AL, Ozer E, Shuller DE. Factors affecting long-term survival in patients with recurrent head and neck cancer may help define the role of post-treatment surveillance. Laryngoscope. 2009;119:2135-40. 13. Francis DO, Yueh B, Weymuller EA Jr, Merati AL. Impact of surveillance on survival after laryngeal cancer in the medicare population. Laryngoscope. 2009;119:2337-44. 14. Kaanders JH, Hordijk GJ. Carcinoma of the larynx: the Dutch national guideline for diagnostics, treatment, supportive care and rehabilitation. Radiother Oncol. 2002;63:299-307. 15. Ferreiro-Argüelles C, Jiménez Juan L, Martínez Salazar J, Cervera Rodilla JL, Martínez Pérez M, Cubero Carralero J, et al. CT Findings after laryngectomy. Radiographics. 2008;28:869-82. 16. Offiah C, Hall E. Post-treatment imaging appearances in head and neck cancer patients. Clin Radiol. 2011;66:13-24. 4-8 Capt 109.pag.indd 109 109 17. Hermans R. Posttreatment imaging in head and neck cancer. Eur J Radiol. 2008;66:501-5. 18. Hermans R. Diffusion-weighted MRI in head and neck cancer. Curr Opin Otolaryngol Head Neck Surg. 2010;18:72-8. 19. Álvarez Marcos CA, Llorente Pendás JL, Franco Gutiérrez C, Fernández Espina H, Alonso Guervós M, Suárez Nieto C, et al. Recidivas en el cáncer escamoso de cabeza y cuello. Acta Otorrinolaringol Esp. 2007;58:156-63. 20. Lell M, Baum U, Greess H, Nömayr A, Nkenke E , Koester M, et al. Head and neck tumors: imaging recurrent tumor and post-therapeutic changes with CT and MRI Eur J Radiol. 2000;33:239-47. 21. Hermans R. Post-treatment imaging in head and neck cancer. Cancer Imaging. 2004;4:S6-15. 22. Ljumanovic R, Langendijk JA, Van Wattingen M, Schenk B, Knol DL, Leemans CR, et al. MR imaging predictors of local control of glottic squamous cell carcinoma treated with radiation alone. Radiology. 2007;244:205-12. 23. Layland MK, Sessions DG, Lenox J. The influence of lymph node metastasis in the treatment of squamous cell carcinoma of the oral cavity, oropharynx, larynx, and hypopharynx: N0 versus N+. Laryngoscope. 2005;115: 629-39. 24. Som PM. Detection of metastasis in cervical lymph nodes: CT and MR criteria and differential diagnosis. AJR Am J Roentgenol. 1992;158:961-9. 25. Perrone A, Guerrisi P, Izzo L, D’Angeli I, Sassi S, Mele LL, et al. Diffusion-weighted MRI in cervical lymph nodes: Differentiation between benign and malignant lesions. Eur J Radiol. 2011;77:281-6. 26. Hsu YB, Chu PY, Liu JC, Lan MC, Chang SY Tsai TL, et al. Role of chest computed tomography in head and neck cancer. Arch Otolaryngol Head Neck Surg. 2008;134:1050-4. 27. León X, Quer M, Díez S, Orús C, López-Pousa A, Burgués J. Second neoplasm in patients with head and neck cancer. Head Neck. 1999;21:204-10. 28. Warren S, Gates O. Multiple primary malignant tumors: a survey of the literature and a statistical stud. Am J Cancer. 1932;16:1358-414. 29. Haughey BJ, Gates GA, Arfken CL, Harvey J. Meta-analysis of second malignant tumors in head and neck cancer: the case for an endoscopic screening protocol. Ann Otol Rhinol Laryngol. 1992;101:105-12. 26/4/12 18:33:14 Radiología de cabeza y cuello 9 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello S. Siurana Montilva* y L. Frascheri Verzelli Unitat de Ressonància Magnètica (IDI), Servei de Radiologia, Hospital Universitari Vall d´Hebron, Barcelona, España Introducción El carcinoma de cabeza y cuello es una causa importante de morbimortalidad en todo el mundo, con cerca de 400.000 casos nuevos al año1. En el momento de su diagnóstico, la mayoría de los pacientes presentan una enfermedad locorregional en estado avanzado requiriendo tratamientos agresivos con cirugía y/o quimio/radioterapia (Q/RT), que pueden dejar secuelas importantes como desfiguración, dificultades al habla, boca seca, y disfunción al masticar y al tragar1. Los métodos de imagen usados en la evaluación de pacientes con carcinoma escamoso de cabeza y cuello son la tomografía computarizada (TC) y la resonancia magnética (RM), proporcionando ambas información detallada de la extensión anatómica del tumor primario y de las metástasis ganglionares locorregionales. Para la evaluación del tumor primario y de la afección ganglionar, estas técnicas de imagen se basan en criterios morfológicos y en el tamaño de la lesión. La combinación de la exploración clínica/endoscópica con los estudios radiológicos con TC o RM alcanzan una certeza de un 80-87% en la estadificación tumoral, en comparación con un 57% cuando sólo se practica la evaluación clínico/endoscópica2. Aunque la TC y la RM convencional son herramientas diagnósticas precisas en la discriminación y estadificación del cáncer de cabeza y cuello, resultan insuficientes en el estudio de lesiones primarias de pequeño tamaño, en la detección de micrometástasis ganglionares y en la evaluación de partes blandas perilesionales en pacientes tratados con radioterapia3. En algunos casos, también puede ser difícil discriminar entre patología benigna y maligna, teniendo en cuenta que lo que evalúan estas técnicas convencionales es la morfología macroscópica de los tejidos, pero sin establecer diferencias de la microestructura tisular. La tomografía por emisión de positrones (PET/TC) no siempre resuelve estos problemas dadas sus propias limitaciones, como la baja resolución espacial, la captación fisiológica del trazador 18F-fludesoxiglucosa por determi- nadas estructuras anatómicas del cuello y la captación de la patología inflamatoria que, en algunos casos, se superpone a la tumoral4. A continuación se detallan las ventajas de aplicar técnicas funcionales de imagen en la detección y estadificación del cáncer de cabeza y cuello. Perfusión por tomografía computarizada El estudio de la perfusión por TC (TC-P) se puede utilizar para superar las limitaciones que han surgido a otras alternativas diagnósticas, hecho que ha sido impulsado por la disponibilidad cada vez mayor de equipos multidetector5. Esta técnica se basa en la obtención de imágenes dinámicas tras la inyección de contraste intravenoso yodado, que registra el cambio temporal de la atenuación de los tejidos permitiendo cuantificar la microcirculación tisular. Las lesiones malignas se caracterizan por inducir neovascularización, por lo que el estudio de la perfusión sanguínea permite, en teoría, diferenciar lesiones benignas de lesiones malignas, con lo que podría contribuir a la detección precoz de malignidad, predicción del comportamiento tumoral y evaluación de las respuestas a la terapia5-7. Esta técnica se desarrolló hace 30 años para la cuantificación de la perfusión sanguínea cerebral en pacientes con ataque cerebrovascular agudo y, recientemente, se utiliza como una herramienta no invasiva en la evolución de los cambios en la microcirculación asociada a varias neoplasias, como el carcinoma hepatocelular, de páncreas, de pulmón, de recto y también de la cabeza y el cuello7,8. El interés en las aplicaciones oncológicas de la TC-P ha sido impulsado aún más por la progresiva disponibilidad de equipos de TC multidetectores que proporcionan una mayor cobertura anatómica y una mayor resolución temporal9,10. En la adquisición dinámica se distinguen 2 fases: en la primera, que dura entre 40 y 60 s, el realce traduce la distri- *Autor para correspondencia. Correo electrónico: [email protected] (S. Siurana Montilva). 9-12 Capt 174 pag.indd 110 26/4/12 18:34:27 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello bución del medio de contraste yodado en el lecho vascular regional, durante el cual tiene una distribución intravascular, y la segunda, con una duración de entre 2 y 5 min, el realce depende de la distribución del agente de contraste entre los espacios intra y extravasculares. La clave para el análisis clásico de la TC-P se basa en el hecho de que el espacio vascular del tejido estudiado pueda ser comparado desde el punto de vista hemodinámico, con una entrada y una salida de sangre correspondiente al aporte arterial y drenaje venoso, respectivamente. Este modelo es adecuado si se considera que la dispersión al medio intersticial del contraste yodado es insignificante en el primer paso. Sin embargo, en la patología tumoral debe considerarse la extravasación intersticial del medio de contraste a través de la neovascularización. Por esta razón, la adquisición de datos debe prolongarse más allá de la duración del primer paso del contraste, para abarcar al menos la parte inicial de su paso al espacio intersticial11. El estudio se adquiere mediante modo cine con el paciente respirando tranquilamente, sin tragar, usando una colimación del haz lo más amplia posible para maximizar la cobertura anatómica de la región. Independientemente del equipo usado, la alta resolución temporal es esencial para realizar de forma precisa las mediciones de los valores de atenuación de contraste, que se obtienen de las distintas fases del primer paso del contraste. Para maximizar la resolución de contraste y reducir tanto la radiación como la dosis del contraste puede realizarse un ajuste en la tensión del tubo12. En general, una tensión de 80 kV es suficiente para las imágenes de TC-P de los tumores de cabeza y cuello, ya que incrementa la resolución y reduce la exposición a la radiación en 2,8 veces, en comparación con la obtenida con tensiones de 120 kV. El amperaje del tubo debe ser fijado a un nivel bajo para minimizar la exposición a la radiación. El espesor de corte es de 2,5 mm. El bolo de contraste es de 40 ml de contraste yodado no iónico que se administra a 5 ml/s, seguido de la administración de 40 ml de solución salina (0,9% NaCl). En teoría, concentraciones altas de yodo permiten un mejor realce de contraste y mejoran las imágenes de perfusión, pero no se han demostrado diferencias significativas entre los resultados obtenidos con contrastes yodados de alta concentración media (400 mg I/ml) con los de menor concentración12,13. La adquisición debe incluir todo el período del primer paso del contraste a través de la microcirculación tisular. El protocolo TC-P se inicia con un retraso de 10 s después de la administración intravenosa de 40 ml de contraste yodado a 6,5 ml/s, con una duración de 50 s, seguido de la administración de 20 ml de solución salina a la misma velocidad. Esto asegura la obtención de datos sobre el primer paso del contraste además de la fase inicial de su recirculación, lo que permite la medición de la permeabilidad vascular. En cuanto a la selección de la región de interés (ROI), la arteria carótida externa homolateral al tumor o cerca de ésta se considera el lugar más representativo para calcular la entrada de sangre al tumor6. 9-12 Capt 174 pag.indd 111 111 Independientemente del tipo de algoritmo utilizado, se obtienen parámetros cuantitativos que describen el estado de la microcirculación en un determinado tejido definido por el ROI. Estos parámetros son: – Flujo sanguíneo (FS): es la cantidad de sangre que pasa por un punto, en un tiempo determinado. Normalmente se expresa en mililitros por minuto. – Volumen sanguíneo (VS): volumen de sangre por unidad de tiempo por unidad de tejido. – Tiempo de tránsito medio (TTM): es el tiempo medio entre la entrada y la salida del contraste a través de la microcirculación que puede ser calculado como la proporción de la VS/ FS (teorema central del volumen). – Tiempo al pico (TTP): tiempo desde el inicio de la perfusión del contraste hasta el pico máximo de realce en una ROI. Finalmente, es posible calcular otro parámetro: la permeabilidad vascular del tejido tumoral, que refleja la tasa de contraste yodado que circula a través de la pared de la neomicrovascularización12. El cálculo de la permeabilidad es relevante para la evaluación de la neoangiogénesis tumoral, ya que los vasos tumorales, al tener una pared sólo formada por neoendotelio, presentan mayor permeabilidad de lo normal, lo que permite que el medio de contraste yodado inyectado refluya del espacio intersticial al espacio intravascular. Por esta razón, el cálculo de la permeabilidad requiere la prolongación de la adquisición de la TC-P más allá del final de la primera pasada de contraste, para incluir la fase intersticial del contraste. Aunque hay pocos trabajos referidos al comportamiento de la TC-P en la patología tumoral de cabeza y cuello, los resultados parecen ser alentadores en cuanto a su utilidad en la evaluación del cuello tratado y en establecer el pronóstico. Distintos autores han demostrado una correlación entre el TTM y la naturaleza maligna de los tumores de cabeza y cuello6. Los tumores malignos presentan un TTM menor de 3,5 s en relación con los benignos (5,5 s) junto con un aumento significativo del VS, del FS y de la permeabilidad en la superficie tumoral. Este comportamiento se ha atribuido al desarrollo de la neoangiogénesis tumoral, con aumento de la presión de perfusión y de la permeabilidad capilar. Sin embargo, la reducción de TTM no sólo está presente en los tumores malignos de esta región, sino también en otros tumores hipervasculares benignos, como el angiofibroma y el paraganglioma8. En el caso de las lesiones de parótida, los hallazgos son muy heterogéneos debido a las diferencias histopatológicas de los tumores en esta glándula. Se ha descrito un aumento del FS y del VS, si bien los valores medios en los tejidos neoplásicos es más bajo que en el tejido sano, probablemente por la presencia de necrosis tumoral. Por otro lado, ciertos tumores benignos de parótida muestran un aumento del FS como consecuencia de una hipercelularidad estromal13. De todas maneras, el TTM del tumor es menor que en el tejido normal debido al rápido paso del medio de contraste yodado a través de la neovasculariza- 26/4/12 18:34:27 112 ción y de la distorsión epitelial de las paredes de los vasos6. Por otra parte, la permeabilidad vascular puede ser mayor en los tumores de parótida con un alto grado de celularidad (tumor de Warthin) que la observada en los tumores malignos, ya que los primeros tienen una mayor microvascularización y celularidad, en comparación con los malignos, que tienen mucha microvascularización pero menor celularidad estromal14. En cuanto a las aplicaciones y utilidad de la técnica, actualmente en los tumores de cabeza y cuello no hay evidencia de la necesidad de su uso rutinario y se considera una técnica complementaria en caso de dudas diagnósticas o cuando no se disponga de otras alternativas como la PET/TC. Distintos estudios demuestran los beneficios potenciales de la técnica en el diagnóstico y seguimiento de las lesiones tumorales, especialmente para la evaluación de la recurrencia tumoral después de la radioterapia, y para la caracterización de los ganglios linfáticos5. En resumen, los datos preliminares de diferentes estudios muestran que el VS, el FS y la permeabilidad vascular son significativamente más altos en los tumores malignos, y que el TTM es significativamente menor (tanto en tumores primarios como en los ganglios linfáticos metastáticos) en comparación con el tejido normal. Resonancia magnética Difusión por resonancia magnética La difusión por RM (dRM) es una técnica de imagen funcional que permite caracterizar los tejidos basándose en el desplazamiento al azar de las moléculas de agua (movimiento browniano). Este movimiento está limitado por barreras microestructurales específicas para cada tejido y se cuantifica usando el coeficiente de difusión aparente (CDA), que expresa el desplazamiento neto por unidad de tiempo (mm2/s)15. Los valores de CDA reflejan la cantidad de señal perdida en las imágenes de dRM con los diferentes valores de b y muestran una relación inversa con la celularidad tisular. La principal ventaja de la dRM es la sensibilidad que tiene para detectar alteraciones patológicas muy pequeñas antes de que se hagan visibles en la RM convencional16. La dRM ha sido utilizada en el diagnóstico de diferentes procesos que afectan el sistema nervioso central, como la isquemia aguda, las lesiones traumáticas cerebrales, la epilepsia, las demencias y diferentes trastornos neurotóxicos. Extrapolar los hallazgos intracraneales a la patología extracraneal ha tenido que superar algunos desafíos, como los artefactos por movimiento, por las interfases entre los tejidos y el aire, así como por el hecho de que la molécula de agua tiene una menor densidad en las partes blandas que en el parénquima cerebral. En la última década se han desarrollado mejoras tecnológicas, entre la que destaca el desarrollo de las imágenes ecoplanares (EPI), mayores campos magnéticos, gradientes más potentes, antenas 9-12 Capt 174 pag.indd 112 Radiología de cabeza y cuello multirreceptoras y técnicas que permiten la obtención de imágenes de difusión en paralelo, lo que ha facilitado la aplicación de la dRM en el estudio de diferentes procesos extracraneales17. En los tejidos biológicos, las moléculas de agua se desplazan dentro y entre diferentes compartimientos: el espacio intracelular (EIC), el espacio extracelular (EEC), el espacio extravascular (EEV) y el espacio intravascular (EIV). Los protones de agua extracelular son transportados al EIC a través de la membrana celular y su movimiento estará controlado por fibras, organelas y macromoléculas intracelulares, por lo que cualquier cambio en la estructura tisular (intra o extracelular) alterará el CDA del agua en los tejidos18. En lesiones sólidas malignas, el EEC es relativamente menor que el EIC debido al incremento en el número y volumen de las células (núcleo mayor), al pleomorfismo celular (hipercromatismo y angulación del contorno celular) y a la neoangiogénesis, con formación de una red vascular desorganizada. Este incremento en la densidad microestructural reduce la matriz extracelular y dará lugar a una restricción del movimiento de la molécula de agua con una reducción del valor de CDA17,18. En tejidos con baja densidad celular, el EEC será relativamente mayor que el EIC debido a la presencia de edema intersticial (procesos inflamatorios) o de necrosis, en donde no existen estructuras con tejido organizado. Así, a menor interacción con las membranas celulares el movimiento aleatorio de la molécula del agua estará favorecido19. En las lesiones quísticas benignas, los protones del agua se mueven con mayor libertad que en los tejidos y estará sólo restringida en proporción a la concentración de proteínas que tenga la lesión; así, a mayor viscosidad menor movilidad de los protones del agua17. La dRM no está basada en las características de magnetización inherentes del T1 o T2, sino en una modificación de la fuerza del campo magnético mediante la aplicación de gradientes externos. Por lo tanto, la adquisición práctica de dRM requiere una secuencia subyacente (usualmente una secuencia EPI ponderada en T2) que se modifica con la aplicación de gradientes en las direcciones de los ejes X, Y y Z, lo que permite evaluar las interrupciones del movimiento del agua libre en esas direcciones. La necesidad de adaptar la difusión a una secuencia spin-echo genera una imagen con el contraste del T2. La variedad de los métodos usados en esta creación produce directa e indirectamente la proliferación de imágenes de difusión20. Comúnmente, las imágenes de dRM se obtienen mediante secuencias EPI, que son susceptibles a las diferencias en la movilidad del agua mediante el emparejamiento de 2 pulsos de gradientes de igual magnitud, pero opuestos en 180°. El pulso del primer gradiente induce la dispersión de las moléculas de agua que será proporcional a su ubicación inicial, mientras que el segundo pulso las reorganiza. Si las moléculas de agua son estáticas, los gradientes se cancelan mutuamente y la medición de la señal de intensidad será igual a cualquier medición obtenida sin gradientes de difusión. Sin embargo, debido al movimiento variable 26/4/12 18:34:28 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello Microperfusión Difusión real 113 Microperfusión Difusión real CDA CDA b0 b 300 b 1.000 b0 b 300 b 1.000 Figur 1. Cálculo del coeficiente de difusión aparente (CDA) en lesiones benignas (izquierda) y malignas (derecha). A) Lesión benigna que presenta una pérdida de la señal en las imágenes de difusión a medida que aumentan los valores de b, lo que se correlaciona con un valor elevado del CDA. B) Lesión maligna en donde se mantiene la señal de intensidad elevada en las imágenes de difusión a medida que aumentan los valores de b, correlacionándose con un descenso del valor del CDA. y aleatorio del agua en los tejidos biológicos, el refase será siempre incompleto y dará lugar a una pérdida de señal que dependerá de la cantidad y velocidad del movimiento así como de la síntesis de difusión de los gradientes21. La sensibilidad de la difusión para detectar el movimiento de la molécula de agua se puede modificar mediante la modulación de la amplitud y duración de los gradientes, o cambiando la duración entre ambos gradientes. Sin embargo, en la práctica, la sensibilidad de la difusión es modulada por el valor “b”. En secuencias estándar de dRM se obtienen imágenes consecutivas aumentando el valor de b, que van desde 0 hasta 1.000 s/mm2, ya que pueden demostrar un resumen del movimiento del agua en los tejidos. Repitiendo las secuencias con un incremento progresivo de los valores de b, se registrará un descenso progresivo de la señal de distintos tejidos empezando con la sangre circulante y siguiendo con las áreas glandulares, las necróticas y por último las tumorales. Esta pérdida de señal se puede cuantificar mediante el CDA, que de manera simplificada muestra una correlación inversa con la celularidad del tejido22. El tejido hipercelular se caracteriza por un EEC limitado con restricción de la difusión, mostrando una leve disminución de la señal al aumentar los valores de b (refase más completo debido a la limitada movilidad del agua), manteniendo una intensidad de señal elevada en las imágenes de difusión obtenidas con valores altos de b (1.000/mm2) y obteniendo valores bajos de CDA. La combinación de una señal de intensidad elevada en valores elevados de b con un bajo CDA permite diferenciar a los tejidos malignos de 9-12 Capt 174 pag.indd 113 los benignos, y en los casos de seguimiento de pacientes tratados permite diferenciar el tumor residual de la necrosis o inflamación (fig. 1). La obtención de la dRM no sólo depende de la difusión del agua, sino también del tiempo de relajación transversal (T2) del tejido a estudio. Un área con un T2 muy largo, como pasa en el líquido y posiblemente con la necrosis, puede mostrar una hiperseñal persistente en las imágenes con valores altos de b dificultando la diferenciación con la hiperseñal ocasionada por restricción de la difusión. A esto se le llama efecto de brillo del T2 y puede dificultar la interpretación cualitativa de las imágenes de dRM23. Este efecto puede reducirse disminuyendo el tiempo de eco o aumentando el valor de b, pero lo más frecuente es que no pueda eliminarse por completo. Por otro lado, el cálculo de CDA está mínimamente afectado por el efecto T2, ya que emplea la pérdida relativa de la señal sobre los valores de b. Ante la duda de que la alta intensidad de señal en valores altos de b sea ocasionada por restricción al movimiento de los protones del agua o por el efecto T2, debe medirse el valor de CDA. En las aplicaciones extracraneales, incluyendo la cabeza y el cuello, la técnica de difusión mas utilizada es la basada en secuencias EPI en eco de espín (SE-EPI). La razón y ventaja principal es su rapidez, lo que permite estudiar grandes volúmenes con múltiples valores de b en un tiempo corto. Sin embargo son altamente sensibles a los artefactos de susceptibilidad, lo que puede dar lugar a imágenes de baja calidad diagnóstica. La secuencia single-shot turbo spin-echo (SS-TSE) ha demostrado tener más precisión diagnóstica, 26/4/12 18:34:28 114 ya que disminuye los artefactos de susceptibilidad24, por lo que podría considerarse como una alternativa a la secuencia SE-EPI. No obstante, debido a la necesidad inherente de utilizar pulsos en eco de espín de 180º, la secuencia SS-TSE tiene una mayor tasa de absorción específica, lo que no permite estudiar todo el cuello usando diferentes valores de b. Adicionalmente, el tiempo de eco más elevado que requieren las secuencias SS-TSE en comparación con las SE-EPI conlleva una relación señal/ruido (S/R) desfavorable, lo que dificulta la detección de los tumores. Como tal, la SE-EPI es la secuencia preferida para le evaluación del cuello mientras que la SS-TSE puede agregarse en casos de recurrencia tumoral posquirúrgica o en casos de implantes dentales que distorsionan de manera significativa las imágenes obtenidas con secuencias SE-EPI18. La dRM en cabeza y cuello puede realizarse tanto en equipos de 1,5 como de 3,0 T24,25. Puede utilizarse la bobina estándar de cabeza y cuello en conjunto con la activación de la antena de superficie o bien una antena integrada de 16 canales específica para esta región anatómica. Para estudiar el cuello, lo más importante es utilizar un tiempo de eco muy corto, con una adecuada relación S/R y en donde los artefactos de susceptibilidad y de desplazamiento de la grasa sean minimizados. También es importante usar una matriz de 128 × 128, aunque en zonas de baja susceptibilidad puede incrementarse hasta 192 × 192. Un tema importante en la obtención de estudios de dRM de alta calidad es realizar una homogeneización o “shiming” manual de campo magnético en vez de hacerla de forma automática, lo que disminuye significativamente los artefactos de distorsión y mejora la calidad de la imagen. La optimización en la selección del “shiming” debe realizarse en forma individual para cada equipo. En los de 3,0 T se recomienda adaptar el “shiming” a todo el cuello evitando las áreas de aire que lo rodean. En los equipos de 1,5 T, la caja del “shiming” debe ser más pequeña, y cubrir solamente los músculos del cuello y la columna vertebral evitando, en lo que cabe, estructuras móviles o que contengan aire. Para que la difusión sea reproducible es importante escoger por lo menos 3 valores de b que superen los 500 s/mm2, lo que permite eliminar el efecto producido por la microperfusión21. Antes de interpretar las imágenes de dRM del cuello se debe tener claro que en valores elevados de b el tejido glandular, las amígdalas palatinas y los ganglios linfáticos normales, por su naturaleza, son hiperintensos y no deben confundirse con lesiones tumorales. El análisis cualitativo de las imágenes obtenidas con un único valor de b (valor más alto) tiene una alta sensibilidad pero baja especificidad en la detección de la enfermedad tumoral26, lo que es relevante en la diferenciación de los ganglios linfáticos, en donde tanto los benignos como los malignos brillan o en caso de necrosis por el efecto T2. El CDA cuantifica la pérdida de señal con el incremento de los valores de b, no se modifica con la señal de intensidad subyacente y es menos susceptible a las variaciones intra e interobservadores. La medición válida es el promedio de CDA que se expresa en milímetros por segundo 9-12 Capt 174 pag.indd 114 Radiología de cabeza y cuello (promedio de difusión del protón en un área determinada en una unidad de tiempo). Se cuantifica dibujando las ROI sobre el tejido a estudiar (tumor y/o ganglio linfático). Las lesiones tumorales sólidas se miden dibujando una ROI que contenga toda la lesión, obviando las mediciones que colocan pequeñas ROI al azar. Cuando la lesión contiene zonas necróticas, visibles en las imágenes obtenidas con un valor b 1.000 o en el mapa de CDA, la ROI debe colocarse rodeando la porción sólida y excluyendo la necrótica27 (fig. 2). Por tanto, se recomienda utilizar las imágenes con valores b de 1.000 s/mm2 para delinear la ROI en las lesiones heterogéneas, ya que permite delimitar mejor los bordes de la porción sólida. El CDA puede entonces calcularse directamente a partir de la señal de intensidad (SI) obtenida en las imágenes primitivas de difusión, o se puede copiar la ROI dibujado en la imagen con b de 1.000 s/mm2 y trasladarla sobre el mapa de CDA, aunque hay ocasiones en que las distorsiones producidas por los artefactos de susceptibilidad dificultan este reposicionamiento. Los valores promedio del CDA se usan como una manera rápida de aproximarse a los cambios que experimentan las lesiones con el tratamiento, inclusive si las lesiones han modificado significativamente su forma y tamaño. Pero para ser más precisos y evitar los errores causados por los diferentes grados de heterogeneidad que van sufriendo estas lesiones con el tratamiento, se han desarrollado otros métodos alternativos de medición como los mapas paramétricos de CDA y los histogramas20. En la actualidad no hay un consenso de cuánto debe ser el valor límite en la caracterización de las lesiones, por lo que cada centro debe establecer su propio valor límite para cada equipo de RM. Hasta el momento no hay datos suficientes que concluyan que los valores obtenidos en equipos de 1,5 T son equiparables a los obtenidos en equipos de 3,0 T, aunque algunos estudios recientes no muestran diferencias significativas entre los valores obtenidos entre ambos28. En múltiples estudios realizados en equipos de 3,0 T, las lesiones con un promedio de CDA mayor a 1,3 × 10-3 mm2/s han tenido mayor probabilidad de corresponder a lesiones benignas que las que presentaron un valor menor de CDA, por lo que se concluye que las lesiones malignas del cuello demuestran valores mas bajos de CDA que las lesiones benignas o que el tejido normal28 (fig. 3). Finalmente es importante recalcar que el valor límite del CDA para diferenciar el tejido maligno del benigno es generalmente mayor en el cuello tratado con Q/RT que el obtenido en los estudios diagnósticos, lo que se explicaría por la influencia del edema de los tejidos tratados. Perfusión por resonancia magnética En RM se dispone de 2 métodos que permiten visualizar la angiogénesis tumoral, uno es el realce dinámico con contraste (CD-RM) y el otro la perfusión dinámica por susceptibilidad (SD-RM). El CD-RM es una técnica mínimamente invasiva que muestra las condiciones del tumor y de su entorno, reflejando la fisiología de la microcirculación (perfusión, per- 26/4/12 18:34:28 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello 115 A B Figura 2. Método de colocación de la región de interés para calcular el valor del coeficiente de difusión aparente. Paciente con carcinoma escamoso de la mitad derecha de la lengua. A) Imagen de la lesión en secuencias T2, imagen de difusión con valor b de 1.000 s/ mm2 y mapa de coeficiente de difusión aparente, que valoran tanto la porción sólida como la necrótica del tumor obteniendo un valor promedio de coeficiente de difusión aparente de 1,7 × 10-3 mm2/s. B) Imagen de la lesión en secuencias T1 con contraste, imagen de difusión con valor b de 1.000 s/mm2 y mapa de coeficiente de difusión aparente. Corrección de la medición de la zona tumoral tomando en cuenta sólo la porción sólida, obteniéndose un valor promedio de 1,0 × 10-3 mm2/s. 9-12 Capt 174 pag.indd 115 3 2 1,5 Valor de CDA meabilidad de la estructura vascular y volumen del espacio extracelular). Los cambios en la estructura vascular intratumoral condicionados por la angiogénesis determinan una función vascular alterada que genera un flujo sanguíneo transtumoral insuficiente y heterogéneo, con incremento de la permeabilidad capilar y de la presión intersticial. La CD-RM se adquiere con secuencias eco de gradiente ponderadas en T1 (GRE-T1) que se obtienen de forma repetida sobre la lesión o región de interés, antes y después de la inyección de agentes de contraste basados en el gadolinio, con una resolución temporal elevada. Habitualmente se obtienen 16 mediciones, de las cuales las 3 primeras se adquieren previas a la administración del contraste. Cada medición tiene 30 cortes de 4 mm de grosor y el tiempo total del estudio es de 5 min. En las arterias y red capilar, la concentración del medio de contraste aumenta después de la inyección (primer paso) y de un modo rápido difunde al EEC acortando el tiempo de relajación T1 de los tejidos (segunda fase). Posteriormente, el contraste pasa al EEV y desciende a un valor basal antes de ser eliminado por los riñones. En los tejidos normales y en los tumorales, los CDA: 1,3 × 10–3 mm2/s 1 26 0,5 0 Linfoma Carcinoma escamoso Lesiones benignas Figura 3. Estudio de difusión por resonancia magnética realizado en equipo de 3 T en 45 pacientes con patología de cabeza y cuello. El valor umbral del coeficiente de difusión aparente entre lesiones benignas y malignas se estableció en 1,3 × 10 –3 mm2/s. Entre las lesiones malignas se identificaron 2 grandes grupos: el primero para el carcinoma escamoso con un valor promedio de 0,86 × 10–3 mm2/s y el segundo para los linfomas con un valor promedio de 0,56 × 10–3 mm2/s. 26/4/12 18:34:29 Radiología de cabeza y cuello 116 A B C D Figura 4. Estudio de perfusión por resonancia magnética con técnica de realce dinámico con contraste. Diferentes curvas del realce dinámico: arterial (zona amarilla), tumor (zona roja) y tejido sano contralateral (zona verde) en diferentes tiempos durante la secuencia de contraste dinámico. A) Antes de la inyección de contraste. B) Fase arterial temprana. C) Fase temprana de lavado. D) Última fase de lavado. agentes de contraste pasan al espacio intersticial en un porcentaje variable y sólo se eliminará cuando baja la concentración de contraste intravascular. La tasa de paso del agente de contraste al espacio intersticial dependerá de la perfusión tisular, de la permeabilidad de la pared del vaso y de la superficie total del vaso (fig. 4). Las señales de intensidad que se van adquiriendo en la repetición consecutiva de la secuencia permiten obtener curvas de intensidad/tiempo que contienen la información de la perfusión del tejido, el realce del contraste y del volumen sanguíneo. En forma típica, estas curvas van a mostrar 3 fases diferentes: la pendiente de ascenso o realce arterial rápido, el punto de realce máximo y el punto del lavado retardado. En general, el porcentaje de ascenso de la pendiente se verá influenciado, sobre todo, por la perfusión tisular que dependerá a su vez del volumen arterial elevado y la elevada extracción en el primer paso. El realce máximo estará influenciado principalmente por la absorción total del medio de contraste en el espacio intersticial y su eliminación estará determinada en gran medida por la permeabilidad del vaso y por el área de superficie vascular que permite la extracción del contraste fuera del espacio intersticial (fig. 5). El realce dinámico obtenido en secuencias T1-GRE puede evaluarse mediante el estudio semicuantitativo de la 9-12 Capt 174 pag.indd 116 curva de intensidad/tiempo o mediante la cuantificación de la variación de la concentración del contraste basada en modelos farmacocinéticos. Los parámetros semicuantitativos intentan medir un punto determinado de la curva de intensidad/tiempo, haciendo caso omiso de la información en el resto de la curva. Estos parámetros incluyen el máximo realce del contraste (pico de realce), el tiempo que tarda en alcanzar el máximo realce (TTP) y la velocidad del realce arterial (pendiente inicial). Son parámetros muy certeros y fáciles de implementar, lo que facilita su uso rutinario. Sin embargo, los parámetros semicuantitativos no reflejan con exactitud la concentración del agente de contraste en los tejidos y puede variar dependiendo de la configuración del equipo y de la fisiología cardiovascular de cada paciente. Con el fin de disminuir la variabilidad intra y entre pacientes durante el seguimiento, la normalización del realce del contraste se realiza midiendo la intensidad de señal en una arteria donante (AIF), a partir de la cual se normalizan las mediciones en los tejidos que irriga29. En lesiones tumorales, las curvas obtenidas de intensidad/tiempo se pueden dividir en 2 grupos: el primero muestra un patrón de realce rápido con un pico temprano y un descenso continuo, y en el segundo hay un incremento lento pero continuo y posteriormente un descenso gradual. No se han encontrado explicaciones clínicas o 26/4/12 18:34:29 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello Figura 5. Perfusión por resonancia magnética con técnica de realce dinámico con contraste. Paciente con carcinoma escamoso del trígono y pilar amigdalino izquierdo con valoración de parámetros semicuantitativos de la curva de permeabilidad, que miden diferentes puntos, en las fases intra y extravascular: el pico de realce máximo, el tiempo que tarda en alcanzar el máximo realce y la velocidad de la pendiente de ascenso. histopatológicas de estas diferencias. Algunas hipótesis sugieren que los defectos del endotelio vascular ocasionan diferencias en la permeabilidad capilar30. El análisis cuantitativo de estas curvas permite extraer parámetros relacionados con la microcirculación tumoral. Para ello es necesario ajustar las curvas a un modelo de curva basado en supuestos biológicos, como el VS, el FS o la permeabilidad. En la mayoría de los casos se usa un modelo de 2 compartimientos que correlacionan la concentración del trazador en el tejido con las diferencias entre las concentraciones en el plasma y en el espacio intersticial. El análisis farmacocinético también ha ido evolucionando y en la actualidad pueden calcularse las tasas de relajación de las curvas para cada “vóxel” y obtener mapas de estos parámetros. Los parámetros cuantitativos cada vez más utilizados son la constante de transferencia del volumen del agente de contraste del vaso al intersticio a través del endotelio vascular (Ktrans), la vuelta al espacio vascular (Kep) y la fracción del espacio extravascular del tumor (Ve). Estos parámetros proporcionan información que puede vincularse con los procesos biológicos del lecho vascular subyacente (superficie de permeabilidad y flujo) y son más apropiados en la evaluación de la eficacia del tratamiento antiangiogénico que los parámetros semicuantitativos29. Una de las principales limitaciones de la técnica de CD-RM es que sólo puede actuar como un marcador indirecto de la viabilidad del tejido tumoral y que puede tener dificultades en demostrar pequeños depósitos residuales de tumor viable en fases tempranas tras la finalización del tratamiento. Aún no queda clara la contribución del flujo intravascular a la intensidad de señal, pudiendo variar su precisión dependiendo de cada tipo tumoral. 9-12 Capt 174 pag.indd 117 117 Además, los modelos cuantitativos son más difíciles de obtener, ya que son más sensibles a la relación S/R y a los artefactos de movimiento voluntarios o fisiológicos del paciente. La perfusión dinámica por susceptibilidad T2* (SD-RM) consiste en la obtención de una serie de imágenes repetidas del tumor durante el paso de sangre previamente marcada con material de contraste o bien con un marcador magnético endógeno a través de un lecho capilar. Esta técnica se fundamenta en la disminución de señal de RM inducida por el paso de contraste cuando se utilizan secuencias ponderadas en T2*, lo que permite evaluar la angiogénesis tumoral en diferentes regiones del cuerpo. La pérdida de señal dependerá del volumen del espacio intravascular intratumoral y de la concentración del medio de contraste en la sangre. Se emplean secuencias EPI de rápida adquisición que permiten una cobertura amplia, empleando altas dosis de contraste (≥ 2 mmol/kg) para mejorar la relación S/R. Se debe obtener una serie de, por lo menos, 5 imágenes antes de administrar contraste, lo que permitirá mejorar la estimación de la intensidad de señal basal durante el análisis. Se colocará una ROI que contenga sólo el componente que realce de la lesión, y si la lesión es muy heterogénea se pueden usar ROI múltiples. En los estudios de perfusión extracraneal, el agente de contraste pasa rápidamente al espacio extracelular (del 12 al 45%), por lo que se están estudiando agentes de contraste con macromoléculas que mejoren la capacidad diagnóstica de esta técnica31. Comparando las diferentes secuencias de perfusión que se pueden usar en RM se puede concluir que el tipo de secuencia empleada influye en la fiabilidad y la calidad de la imagen obtenida. Parece más adecuado obtener los estudios de perfusión por RM de los tumores de cabeza y cuello mediante CD-RM, ya que ofrecen una mayor calidad de imagen anatómica con menos artefactos de susceptibilidad en comparación con la técnica SD-RM, la cual tiene como ventaja permitir una cuantificación absoluta de la perfusión. Otra ventaja de la técnica CD-RM es que disminuye la dosis de contraste necesaria (0,1 mmol/kg) y permite estudiar grandes volúmenes con una resolución y tiempo aceptables. Además, el realce de contraste positivo obtenido con CD-RM es mejor que con SD-RM. Aplicaciones clínicas en pacientes con patología de cabeza y cuello El valor añadido de la CD-RM y la dRM a las modalidades de imagen convencionales se pondrán de relieve en el contexto pretratamiento para la detección de tumores primarios de origen desconocido y en la estadificación ganglionar, haciendo hincapié en la necesidad de interpretarlas en conjunto con las imágenes convencionales. Las imágenes de dRM tienen la ventaja de mostrar la lesión y la capacidad de caracterizarla, independientemente de la morfología subyacente, mientras que la CD-RM debe ser considerada como una técnica de imagen de apoyo a la imagen microestructural. 26/4/12 18:34:30 Radiología de cabeza y cuello 118 A B C Figura 6. Caracterización tumoral con secuencias de difusión por resonancia magnética. En 3 tipos tumorales diferentes: secuencias ponderadas en T2, imagen de difusión con valor b de 1.000 s/mm2 y mapa de coeficiente de difusión aparente. A) Adenoma pleomorfo del lóbulo profundo de la parótida derecha. Señal heterogénea en T2 y difusión, con valor promedio del coeficiente aparente de difusión de 1,6 × 10–3 mm2/s. B) Carcinoma escamoso del trígono retromolar derecho con invasión ósea. Señal heterogénea en T2 y difusión, con valor promedio del coeficiente de difusión aparente de 0,67 × 10–3 mm2/s. C) Linfoma no hodgkiniano con adenopatías submandibulares izquierdas. Señal homogénea en T2 y difusión con valor promedio del coeficiente de difusión aparente de 0,21 × 10–3 mm2/s. Caracterización tumoral La pregunta más común y a la vez más crítica en el estudio de la patología del cuello es si la lesión que vamos a estudiar es una lesión maligna, una lesión benigna o un tejido normal (fig. 6). En la detección de tumores primarios de origen desconocido, la alta resolución de contraste de la dRM hace que sea una técnica adecuada. La CD-RM puede añadir un valor complementario a la difusión funcionando como una plantilla adicional que muestra las lesiones que realzan con el contraste. La dRM también puede ser útil en la diferenciación entre los distintos tipos tumorales específicos del cuello, a partir 9-12 Capt 174 pag.indd 118 de las diferencias en los valores de CDA entre diferentes tipos de carcinomas, que se relacionan con la celularidad tisular y tamaño o constitución del espacio extracelular, más que con la necrosis tumoral. Esta técnica ha demostrado tener una precisión aceptable en la diferenciación entre el carcinoma escamoso con otros tumores, como el linfoma y el linfoepitelioma nasofaríngeo, pero la habilidad de diferenciar entre el linfoma y el linfoepitelioma nasofaríngeo es bastante deficiente, debido a la similaridad histológica entre ambos. Además, sólo permite diferenciar el carcinoma escamoso del linfoma no hodgkiniano, ya que en el linfoma de Hodgkin se han obtenido valores de CDA similares32,33. 26/4/12 18:34:30 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello A 119 B C D Figura 7. Caracterización ganglionar por resonancia magnética. Paciente con carcinoma escamoso de hemilengua izquierda y pequeño ganglio metastásico en el nivel II homolateral (flechas). A) Secuencia ponderada en T2: ganglio heterogéneo y redondeado con diámetro transverso mínimo < 10 mm; B) Imagen de difusión con valor b de 1.000 s/mm2 que muestra 2 pequeños focos hiperintensos intraglandulares que sugieren depósitos de tumor. C) Mapa de coeficiente de difusión aparente con valor 0,80 × 10–3 mm2/s. D) Detalle histológico del ganglio que demuestra la infiltración metastásica. Estadificación ganglionar Después de delimitar el tumor primario, la estadificación ganglionar es uno de los aspectos diagnósticos más importantes para determinar el tratamiento a seguir y establecer el pronóstico de los pacientes. Por lo general, los ganglios son significativamente anormales o clásicamente benignos, aunque algunos tienen características indeterminadas y tamaños limítrofes. Aunque la PET-TC se ha convertido en la técnica de imagen de elección para determinar las anomalías de los ganglios linfáticos del cuello, algunas veces sus resultados no son concluyentes debido a su baja resolución espacial así como a la variabilidad del metabolismo de la glucosa de algunas estructuras anatómicas o en lesiones inflamatorias18. Se ha descrito que los ganglios linfáticos metastásicos tienen valores significativamente menores de CDA que los ganglios linfáticos benignos, lo que puede explicarse por las alteraciones histológicas que producen los depósitos de 9-12 Capt 174 pag.indd 119 células cancerígenas en la microarquitectura ganglionar, así como a un aumento de la mitosis. Estas características microestructurales contrastan claramente con el tejido linfoide constituido por pequeñas células linfoides organizadas en centros germinales y en los sinusoides de los vasos34. En el contexto de la estadificación ganglionar, la estandarización en la interpretación de imágenes, en la adquisición de la imagen y el conocimiento de los peligros potenciales, son aspectos clave para mejorar la aplicación. La necrosis y, por lo tanto, la ausencia de importantes barreras microestructurales pueden aumentar el CDA y dar lugar a falsos negativos. Esto puede corregirse evaluando la heterogeneidad del ganglio en las imágenes con valor alto de b en donde las áreas hiperintensas indican depósitos viables del tumor, y la señal de la necrosis se suprime, o mediante la correlación de las imágenes de dRM con las secuencias convencionales de RM, que muestra una alta precisión para la detección de la necrosis intranodal35 (fig. 7). 26/4/12 18:34:31 Radiología de cabeza y cuello 120 A C B D Figura 8. Adenopatías por Micobacterium tuberculosis. Paciente de 37 años con conglomerado adenopático submandibular derecho positivo para tuberculosis valorado en diferentes secuencias. A) Secuencia ponderada en T1. B) Secuencia ponderada en T2. C) Imagen de difusión con valor b de 1.000 s/mm2. D) Valores promedio del coeficiente de difusión aparente superponibles con los valores tumorales (0,7 × 10–3 mm2/s). La reactividad ganglionar es causa de falsos positivos. Se caracteriza por una infiltración linfoide homogénea organizada en una multitud de centros germinales y estroma fibrosa, que pueden disminuir los valores de CDA hasta los valores obtenidos en los ganglios metastásicos17,34,36. La correlación cuidadosa con el aspecto morfológico de los ganglios linfáticos puede ayudar a evitar errores diagnósticos. Otras condiciones en las que se ha demostrado valores bajos de CDA en los ganglios, que se superponen a los valores tumorales, incluyen la tuberculosis y la linfaadenitis por Bartonella, por lo que es útil tener en cuenta la presentación clínica de las adenopatías36 (fig. 8). Los resultados preliminares sugieren un posible papel de la dRM en la planificación de la cirugía y la radioterapia. En el contexto prequirúrgico, la alta sensibilidad y alto valor predictivo negativo en la detección de adenopa- 9-12 Capt 174 pag.indd 120 tías subcentimétricas pueden ayudar a detectar o excluir de manera fiable la afección ganglionar contralateral, en tumores situados próximos a la línea media, o también pueden ayudar en la detección de metástasis “en salto” en ganglios del nivel IV34. En la actualidad, la dRM no es capaz, sin embargo, de detectar depósitos de micrometástasis < 4 mm, por lo que su utilidad en pacientes N0 aún no está bien establecida. En la planificación de la radioterapia se ha demostrado mayor conformidad en la estadificación ganglionar con la dRM que con las imágenes convencionales, lo que podría potencialmente reducir la toxicidad inducida por el tratamiento o intensificar el tratamiento en zonas con pequeños depósitos tumorales no detectados en el estudio convencional18. Tanto los nódulos malignos como los benignos realzan con la administración de los agentes de contraste en 26/4/12 18:34:31 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello 121 A B Figura 9. Monitorización del tratamiento mediante difusión por resonancia magnética. Carcinoma escamoso de lengua y pilar amigdalino izquierdo valorado en secuencias ponderadas en T2, imagen de difusión con valor b de 1.000 s/mm2 y mapa de coeficiente de difusión aparente. A) Imágenes diagnósticas del tumor. B) Imágenes obtenidas a los 2 meses postratamiento con zonas hiperintensas en T2, que se suprimen en la imagen de difusión, compatibles con el diagnóstico de respuesta completa. las imágenes convencionales de RM. La microcirculación tumoral genera diferencias con respecto al tejido normal en 3 aspectos: en las características del flujo, la permeabilidad y en el incremento de la fracción del volumen en el EEE. Las imágenes de CD-RM han sido estudiadas en la caracterización de ganglios linfáticos en pacientes con carcinoma escamoso del cuello, evaluando su capacidad de diferenciar entre los ganglios normales y los metastásicos. Estos estudios han demostrado un alargamiento significativo del TTP, con un pico de realce menos elevado y una pendiente más lenta de lavado que los ganglios normales, lo que refleja una disminución en la transferencia del contraste y una reducción del volumen del EEE en los ganglios metastásicos comparado con los ganglios normales o reactivos Monitorización del tratamiento no quirúrgico En la imagen convencional, la medición de respuesta al tratamiento se basa en la variación del tamaño tumoral, lo que vendría a ser el resultado final de que una proporción importante de células tumorales mueran y se compacten. Los cambios producidos en la zona tratada por la 9-12 Capt 174 pag.indd 121 proliferación reactiva pueden ocasionar una estabilidad o incremento en el tamaño de la masa tumoral, a pesar del descenso de células malignas, confundiendo la valoración de la respuesta al tratamiento. La dRM permite medir los cambios de comportamiento del agua libre resultante de la necrosis tumoral durante el curso del tratamiento con Q/RT20 (fig. 9). El valor predictivo de la dRM durante el tratamiento con radioterapia cada vez gana más interés. La capacidad de predecir una respuesta tumoral tardía puede ayudar al comienzo o adaptación del tratamiento no quirúrgico y a la planificación de un tratamiento sistémico y/o con radioterapia (tratamiento coadyuvante o definitivo Q/RT) de manera individualizada, con el objetivo de mejorar la eficacia y de disminuir la toxicidad. Algunos estudios han determinado el valor del CDA basal antes del inicio del tratamiento con Q/RT28. Tumores con valores absolutos de CDA bajos y elevada señal en las imágenes de dRM con valores altos de b pretratamiento, mostraron una mayor reducción de su volumen a las 2 semanas de finalizado el tratamiento comparado con las que mostraron valores mayores de CDA o menor señal de 26/4/12 18:34:31 122 intensidad (SI). Otros autores han señalado que los tumores con valores bajos de CDA basal se correlacionaron de manera significativa con una respuesta clínica completa o con remisión tumoral después de los 6 meses de la culminación del tratamiento28. Esto se puede explicar basándose en que los tumores con valores mayores de CDA por lo general presentan más necrosis, lo que se asocia a hipoxia, acidosis tisular, hipoperfusión y sensibilidad reducida a la Q/RT. Como imagen predictiva durante Q/RT, algunos estudios mostraron que los cambios en el CDA basal con los obtenidos en la primera, segunda y cuarta semanas de tratamiento tuvieron un valor predictivo del resultado de éste (remisión frente a recurrencia tumoral)18,28. Para el desarrollo de la dRM como herramienta de diagnóstico predictivo es fundamental la incorporación de métodos más avanzados en la evaluación de la imagen, que incluyan la distribución espacial de la respuesta tumoral y que permitan guiar con seguridad dosis programadas de radiación a los componentes tumorales residuales. Entre las evaluaciones automatizadas están las basadas en histogramas o las que registran los datos de los “vóxel” en series de imágenes obtenidas durante el intervalo de tratamiento. La capacidad de representar de manera espacial la heterogeneidad de la respuesta tumoral a través de un mapa paramétrico de respuesta y luego visualizar de manera separada los componentes del tumor que responden de los que no responden, puede ser útil en la orientación efectiva del tratamiento18. La alta resolución obtenida en la CD-RM la postula como una herramienta importante en la evaluación de la hemodinámica tumoral con sensibilidad y especificidad elevadas. Los parámetros farmacocinéticos derivados de las imágenes con contraste dinámico, en especial el Ktrans, refleja el FS tumoral y la permeabilidad microvascular. Se ha demostrado su eficacia en la predicción de la respuesta al tratamiento con Q/RT en pacientes con carcinoma escamoso, lo que sugiere su potencial como biomarcador no invasivo. Los pacientes que respondieron en forma favorable presentaron valores de Ktrans significativamente más elevados que los que mostraron una respuesta parcial o que no presentaron respuesta37. Esto se pude explicar por el hecho de que los tumores con mayor Ktrans presentan un FS elevado, vasos permeables con altas concentraciones de oxígeno que aumentan la radiosensibilidad y que mejoran el acceso de los fármacos, particularmente a las que dependen del ciclo celular, y la formación de radicales libres. Por otro lado, los valores disminuidos de Ktrans indican un aporte sanguíneo heterogéneo con hipoxia, fibrosis y acidosis, lo que impide la distribución de los fármacos de terapias del cáncer y menor supervivencia37. Cambios postratamiento frente a recurrencia tumoral La evaluación clínica del cuello tratado con Q/RT es difícil, debido a la presencia de diferentes grados de inflamación, necrosis y distorsión de los planos tisulares. Por otra parte, la recurrencia del tumor después de la Q/RT y las complicaciones ocasionadas por el tratamiento como la 9-12 Capt 174 pag.indd 122 Radiología de cabeza y cuello necrosis pueden tener una presentación clínica similar. La evaluación histológica de las biopsias puede ser complicada debido a los errores producidos en la toma o interpretación de las muestras, causados por las alteraciones celulares en los tejidos normales después de la Q/RT, lo que confiere al estudio por imagen un rol preferente en la detección temprana de la recidiva tumoral18. En las imágenes de RM convencionales hacer la diferenciación entre enfermedad persistente/recurrente del tejido normal del cuello tratado resulta, algunas veces, todo un desafío y, en otras, una tarea imposible de realizar. Aunque el tratamiento adicional innecesario tiende a aumentar la morbilidad, el retraso de las terapias de rescate disminuye los resultados positivos20. Cada cuello tratado es una entidad única y cada decisión, bien sea de espera o de intervención, se toma después de evaluar cada pieza de información disponible. Bajo estas circunstancias, la dRM debería formar parte de estas opciones, ya que permite evaluar a los pacientes en diferentes fases del tratamiento. Los estudios realizados hasta el momento demuestran valores significativamente bajos de CDA en casos de recurrencias tumorales independientemente de las alteraciones morfológicas o metabólicas subyacentes. Pueden alcanzarse rangos de sensibilidad que van desde el 84 al 94%, y de especificidad, que van desde el 90 al 95% usando un umbral de CDA < 0,0013 mm2/s18. La principal ventaja de la dRM en los cuellos tratados con Q/RT es su falta de sensibilidad a los cambios inflamatorios, lo que la convierte en una herramienta de imagen adecuada en la primera fase de seguimiento en la evaluación de la respuesta al tratamiento (fase temprana < 4 meses), con una mayor especificidad y valor predictivo positivo que el aportado por las imágenes anatómicas convencionales. Por esta misma razón también es útil en la diferenciación entre radionecrosis y recidiva tumoral. En la diferenciación temprana de las linfadenopatías persistentes del cuello tratado, la dRM tiene un alto valor predictivo negativo, lo que puede en un futuro ayudar a seleccionar a los pacientes en los que puede ser evitado el vaciamiento ganglionar (fig. 10). Gracias a la alta sensibilidad y a las mejoras en la supresión de la grasa de la dRM puede ser útil en la detección precoz de pequeños depósitos de tumor recurrente o persistente, tanto en el lugar de origen como ganglionares, lo cual puede tener impacto en mejorar la supervivencia de los pacientes. En este entorno, la CD-RM está claramente obstaculizada debido a los cambios tisulares resultantes al tratamiento con Q/RT, en donde la inflamación conducirá a un mayor realce de contraste arterial. Sin embargo, en combinación con la dRM, la CD-RM resulta útil como técnica de apoyo y aumenta la confianza en la diferenciación basada en la dRM de pequeñas ulceraciones o adenopatías ganglionares cuando los valores de CDA no pueden ser calculados en forma precisa. La presencia simultánea de hiperseñal en las imágenes de dRM con valores b de 1.000 s/mm2 con una pendiente arterial aumentada en CD-RM debe ser considerada altamente sospechosa de recidiva tumoral. La adición 26/4/12 18:34:31 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello 123 A B C Figura 10. Diferenciación temprana de linfadenopatías persistentes. Paciente de 67 años, con carcinoma escamoso del tercer cuadrante y conglomerado adenopático submandibular. A) Imágenes diagnósticas: secuencia ponderada en T2, imagen de difusión con valor b de 1.000 s/mm2 y mapa de coeficiente de difusión aparente. B) Imágenes postratamiento: secuencia ponderada en T2 que muestra nódulos residuales heterogéneos. La imagen de difusión con valor b de 1.000 s/mm2 y el mapa de coeficiente de difusión aparente sugieren enfermedad residual en el nivel I. C) Curva promedio obtenida a partir de un estudio de perfusión por resonancia magnética con técnica de realce dinámico con contraste en diferentes puntos de interés: zona roja en adenopatía sospechosa, zona amarilla en adenopatía necrótica y zona turquesa en ganglio del nivel I contralateral, demostrando un alargamiento significativo de la pendiente de ascenso, con un pico de realce menos elevado y una pendiente de lavado que continúa en ascenso en el ganglio IB izquierdo, en comparación con el ganglio IB contralateral. El resultado de la punción biopsia fue positivo para enfermedad residual. de CD-RM a la dRM podría disminuir la dependencia del cálculo de CDA y, por lo tanto, hacer la evaluación funcional de RM de cabeza y cuello después de la Q/RT de manera más cualitativa que cuantitativa (fig. 11) Tractografía por tensor de difusión La tractografía por tensor de difusión (TTD) permite la visualización tridimensional de la arquitectura de las 9-12 Capt 174 pag.indd 123 fibras de un nervio. Esta técnica se ha usado ampliamente en el sistema nervioso central para demostrar y evaluar los diferentes tractos nerviosos de la sustancia blanca cerebral y de la médula espinal, y también de los nervios craneales38. Su papel en el estudio de la patología del cuello es más especifico, pero no menos importante que en el sistema nervioso central. Una de las preguntas críticas en relación con el cáncer de cuello es si hay o no invasión perineural. En la RM 26/4/12 18:34:32 124 Radiología de cabeza y cuello Figura 11. Detección de segunda neoplasia primaria. Estudio de resonancia magnética (RM) de control en paciente tratado de un carcinoma de lengua y pilar amigdalino derechos (flechas), con lesión sospechosa de segundo primario en pilar amigdalino contralateral. A) Secuencia ponderada en T2: hiperseñal difusa del pilar amigdalino izquierdo. B) Imagen de difusión con valor de b de 1.000 s/mm2: hiperseñal focal sobre el pilar amigdalino. C) Mapa de coeficiente de difusión aparente con valor de 0,8 × 10 –3 mm2/s. D) Secuencia dinámica ponderada en T1 con supresión grasa tras administración de contraste que delimita una zona de realce temprano en el pilar amigdalino. E) Morfología de la curva sugestiva de lesión tumoral. F) PET-TC que muestra una zona hipermetabólica que confirma los hallazgos de la RM. convencional los tractos nerviosos son de difícil visualización, incluso en equipos de alta resolución, y los estudios de TC sólo permiten visualizar las paredes óseas del canal mandibular o de los diferentes agujeros de la base craneal, aportando información insuficiente para determinar la existencia de una diseminación tumoral perineural. En el tratamiento quirúrgico de la patología del cuello, el conocimiento de las relaciones entre el tumor y el curso de las fibras nerviosas puede ayudar a prevenir las complicaciones neurológicas posquirúrgicas38. La TTD obtenida en equipos de 3,0 T permite evaluar el recorrido de las fibras nerviosas, mediante el análisis de imágenes obtenidas por difusión anisotrópica que caracteriza el movimiento del agua en 3 dimensiones, lo que lo convierte en un medio ideal para determinar la localización de los nervios periféricos20. En la patología tumoral mandibular, la evaluación se centra en el estudio de la tercera rama del trigémino (V3), buscando determinar si hay o no infiltración o desplazamiento de ésta. El nervio alveolar inferior, por lo general, se encuentra desplazado por tumores como el ameloblastoma o el queratoquiste odontogénico y está infiltrado en casos de carcinoma escamoso y adenoideo quístico39. El nervio facial a nivel parotídeo dibuja un recorrido anterolateral y 9-12 Capt 174 pag.indd 124 se divide en las ramas temporal, zigomática, bucal, mandibular y cervical. Estas ramas están compuestas de haces muy delgados cuyo diámetro es menor que el tamaño de un vóxel, generando mayores artefactos en el momento de su visualización38. La TTD se emplea en la visualización bilateral del nervio alveolar desde la porción proximal inferior a su entrada en el canal mandibular hasta su entrada en el agujero oval. Los resultados dependerán del algoritmo de rastreo, del umbral de anisotropía, de la longitud del intervalo, de los ángulos entre 2 intervalos contiguos y del método en la aplicación de la ROI38. La colocación de la ROI se realiza en las imágenes axiales con valores b 0 de la dRM y se confirma su ubicación superponiendo las imágenes anatómicas en T1. La propagación de cada tracto nervioso finaliza cuando la fracción de anisotropía del vóxel es < 0,15. Después de la reconstrucción se determinará el número y la densidad de las fibras. Estudios realizados sugieren que para disminuir el ruido y mejorar la densidad de las fibras, se deben aplicar 2 ROI con un ángulo máximo de 40º y una longitud mínima de 10 mm entre ellos, similares a los parámetros usados en la tractografía del sistema nervioso central38 (fig. 12). 26/4/12 18:34:33 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello 125 Figura 12. Tractografía por difusión por resonancia magnética de la tercera rama trigeminal (V3) en voluntario sano, reconstruyendo su trayecto desde su salida desde el foramen oval hasta su entrada en el foramen mentoniano. La TTD es una técnica en investigación que necesita ser ampliada antes de poder determinar su utilidad en la evaluación pre y posquirúrgica de la patología mandibular y en la detección temprana de diseminación metastásica perineural. Espectroscopia por resonancia magnética La espectroscopia por RM (ERM) ha demostrado ser un método no invasivo que permite detectar la presencia de las alteraciones bioquímicas tumorales. Su utilidad se basa en la detección de metabolitos presentes o aumentados en lesiones tumorales, o bien la disminución o desaparición de metabolitos normales en tejidos sanos. Los patrones típicos del espectro asociados con el cáncer incluyen el incremento de la señal de intensidad total de la colina (Cho, 3,2 ppm) en relación con el de la creatina (Cr, 3,0 ppm) junto con la presencia de otros metabolitos como el lactato (Lac, 1,3 ppm). Las aplicaciones diagnósticas y oncológicas se basan en la discriminación entre zonas de tejido normal, necrosis, crecimiento o recurrencia tumoral previa toma de muestras para biopsia, y en la monitorización de la respuesta al tratamiento40. La ERM, en la monitorización de la terapia del cáncer de cabeza y cuello, tanto in vivo como in vitro, es un método poco aplicado en la práctica diaria. En el carcinoma escamoso y en los ganglios metastásicos se ha descrito una relación elevada de la relación Cho/Cr que resulta de la disminución de la señal de la Cr más que de la elevación de la Cho. Esta relación será mayor en tipos tumorales más agresivos que presentan índices elevados de proliferación y biosíntesis de las membranas con incremento del metabolismo y del consumo de energía. La elevación del espectro en la posición 1,3/0,9 ppm corresponde tanto a la presencia de lípidos como a la de lactato. La intensidad de los lípidos aumentada en los tumores se debe al incremento de la movilidad de los protones de la membrana plasmática41. El lactato se explica 9-12 Capt 174 pag.indd 125 por el compromiso de la microcirculación tumoral y se asocia con el desarrollo de lesiones metastásicas40. Los artefactos de movimiento ocasionados principalmente por la respiración, la presencia de alto contenido de grasa y las interfases entre tejido-hueso-aire, pueden alterar las mediciones de los metabolitos, convirtiendo la aplicación clínica de la ERM en todo un reto. Los avances tecnológicos han mejorado la aplicación de la ERM en vivo proporcionando indicadores objetivos en la selección de técnicas de tratamiento sin necesidad de añadir procedimientos invasivos para el paciente. Ya que la RM es de uso frecuente en el estudio del carcinoma de cabeza y cuello, la ERM puede ser incorporada fácilmente a los protocolos ya existentes como una herramienta que detecta los cambios bioquímicos de los tejidos con el potencial de predecir en forma precisa y temprana el comportamiento tumoral y la respuesta al tratamiento. Conclusión En un pasado reciente, la evaluación clínica del cáncer de cuello dependía solamente del examen físico. Las técnicas de imagen han revolucionado el manejo de estos pacientes aportando información valiosa en el diagnóstico y planificación del tratamiento. El próximo paso es ampliar los conocimientos anatómicos que ofrecen las técnicas de imagen convencional con el estudio de la fisiología y biología celulares, lo que dependerá de múltiples modalidades, como son la dRM, las técnicas de perfusión por TC y por RM, la TTD y la ERM. El desarrollo y estandarización de las secuencias, técnica e interpretación de estas técnicas, permitirá su uso clínico adecuado, pero aún son necesarios estudios que demuestren el valor real de estas técnicas avanzadas en la caracterización y estadificación de las lesiones, y en la predicción y valoración de su respuesta al tratamiento. 26/4/12 18:34:33 126 Bibliografía 1. Gibson MK, Forastiere AA. Multidisciplinary approaches in the management of advanced head and neck tumours: state of the art. Curr Opin Oncol. 2004;16:220-4. 2. Ang KK, Harris J, Garden AS, Straube W, Glisson B, Xia P, et al. Concomitant boost radiation plus concurrent cisplatinum for advanced head and neck carcinomas: radiation Therapy Oncology Group phase II trial 99- 14. J Clin Oncol. 2005;23:3008-15. 3. Z b ä re n P, C ave r s a c c i o M , T h o e ny H C , N u ye n s M , Curschmann J, Stauffer E. Radionecrosis or tumor recurrence after radiation of laryngeal and hypopharyngeal carcinomas . Otolaryngol Head Neck Surg. 2006;135: 838-43. 4. Ng SH, Yen TC, Chang JT, Chan SC, Ko SF, Wang HM, et al. Prospective study of [F]fluorodeoxyglucose positron emission tomography and computed tomography and magnetic resonance imaging in oral cavity squamous cell carcinoma with palpably negative neck. J Clin Oncol. 2006;24:4371-6. 5. Rumboldt Z, Al-Okaili R, Deveikis J. Perfusion CT for head and neck tumors: pilot study. AJNR Am J Neuroradiol. 2005;26:1178-85. 6. Faggioni L, Neri E, Bartolozzi C. CT perfusion of head and neck tumors: how to do it. AJR Am J Roentgenol. 2010;194:62-9. 7. Axel L. Cerebral blood flow determination by rapid-sequence computed tomography: theoretical analysis. Radiology. 1980;137:679-86. 8. Bisdas S, Baghi M, Wagenblast J, Knecht R, Thng CH, Koh TS, et al. Differentiation of benign and malignant parotid tumors using deconvolution-based perfusion CT imaging: feasibility of the method and initial results. Eur J Radiol. 2007;64:258-65. 9. Miles KA, Griffiths MR. Perfusion CT: a worthwhile enhancement? Br J Radiol. 2003;76:220-31. 10. Kambadakone AR, Sahani DV. Body perfusion CT: technique, clinical applications, and advances. Radiol Clin North Am. 2009;47:161-78. 11. Lee TY. Functional CT: physiological models. Trends Biotechnol. 2002;20:S3-10. Dsiponible en: http://www.ajronline.org/cgi/external_ref?access_num=12570152&link_ type=MED 12. Ash L, Teknos TN, Gandhi D, Patel S, Mukherji SK. Head and neck squamous cell carcinoma: CT perfusion can help no invasively predict intratumoral microvessel density. Radiology. 2009;251:422-8. 13. Bisdas S, Medov L, Baghi M, Konstantinou GN, Wagenblast J, Thng CH, et al. A comparison of tumour perfusion assessed by deconvolution-based analysis of dynamic contrastenhanced CT and MR imaging in patients with squamous cell carcinoma of the upper aerodigestive tract. Eur Radiol. 2008;18:843-50. 14. Gandhi D, Hoeffner EG, Carlos RC, Case I, Mukherji SK. Computed tomography perfusion of squamous cell carcinoma of the upper aerodigestive tract—initial results. J Comput Assist Tomogr. 2003;27:687-93. 15. Ross BD, Moffat A, Lawrence TS, Mukherji SK, Gebarski SS, Quint DJ, et al. Evaluation of cancer therapy using diffusion magnetic resonance imaging. Mol Cancer Ther. 2003;2: 581-7. 16. Eastwood JD, Lev MH, Wintermark M, Fitzek C, Barboriak DP, Delong DM, et al. Correlation of early dynamic CT perfusion imaging with whole-brain MR diffusion and perfusion imaging in acute hemispheric stroke. AJNR Am J Neuroradiol. 2003;24:1869-75. 9-12 Capt 174 pag.indd 126 Radiología de cabeza y cuello 17. Wang J, Takashima S, Takayama F, Kawakami S, Saito A, Matsushita T, et al. Head and neck lesions: characterization with diffusion-weighted echo-planar MR imaging. Radiology. 2001;220:621-30. 18. Vandecaveye V, De Keyzer F, Dirix P, Lambrecht M, Nuyts S, Hermans R. Applications of diffusion-weighted magnetic resonance imaging in head and neck squamous cell carcinoma. Neuroradiology. 2010;52:773-84. 19. Le Bihan D, Breton E, Lallemand D, Aubin ML, Vignaud J, Laval-Jeantet M. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology. 1988;168:497-505. 20. Schafer J, Srinivasan A, Mukherji S. Diffusion magnetic resonance imaging in the head and neck. Mag Reson Imaging Clin N Am. 2011;19:55-67. 21. Melhem ER, Itoh R, Jones L, Barker PB. Diffusion tensor imaging of the brain: effect of diffusion weighting on trace and anisotropy measurements. AJNR Am J Neuroradiol. 2000;21:1813-20. 22. Thoeny HC, De Keyzer F, Vandecaveye V, Chen F, Sun X, Bosmans H, et al. Effect of vascular targeting agent in rat tumor model: dynamic contrast- enhanced versus diffusion-weighted MR imaging. Radiology. 2005;237:492-9. 23. Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188:1622-35. 24. De Foer B, Vercruysse JP, Bernaerts A, Deckers F, Pouillon M, Somers T, et al. Detection of postoperative residual cholesteatoma with non-echo-planar diffusion-weighted magnetic resonance imaging. Otol Neurotol. 2008;29:513-7. 25. Vandecaveye V, De Keyzer F, Hermans R. Diffusionweighted magnetic resonance imaging in neck lymph adenopathy. Cancer Imaging. 2008;30:173-80. 26. Takahara T, Imai Y, Yamashita T, Yasuda S, Nasu S, Van Cauteren M. Diffusion weighted whole body imaging with background body signal suppression (DWIBS): technical improvement using free breathing, STIR and high resolution 3D display. Radiat Med. 2004;22:275-82. 27. Padhani AR, Liu G, Koh DM, Chenevert TL, Thoeny HC, Takahara T, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia. 2009;11:102-25. 28. Kim S, Loevner L, Quon H, Sherman E, Weinstein G, Kilger A, et al. Diffusion-weighted magnetic resonance imaging for predicting and detecting early response to chemoradiation therapy of squamous cell carcinomas of the head and neck. Clin Cancer Res. 2009;15:986-94. 29. Kim S, Loevner L, Quon H, Kilger A, Sherman E, Weinstein G, et al. Prediction of response to chemoradiation therapy in squamous cell carcinomas of the head and neck using dynamic contrast-enhanced MR imaging. AJNR Am J Neuroradiol. 2010;31:262-8. 30. Guckel C, Schnabel K, Deimling M, Steinbrich W. Dynamic snapshort gradient-echo imaging of head and neck malignancies: time dependency and quality of contrast-to-noise ratio. MAGMA. 1996;4:61-9. 31. Abdel Razek A, Galal Elsorogy L, Soliman NY, Nada N. Dynamic susceptibility contrast perfusion MR Imaging in distinguishing malignant from benign head and neck tumors: A pilot study. Eur J Radiol. 2011;77:73-9. 32. Lindberg R. Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and digestive tracts. Cancer. 1972;29:1446-9. 33. Maeda M, Kato H, Sakuma H, Maier SE, Takeda K. Usefulness of the apparent diffusion coefficient in line scan diffusion-weighted imaging for distinguishing bet- 26/4/12 18:34:33 Técnicas avanzadas en tomografía computarizada y resonancia magnética en la estadificación de los tumores de cabeza y cuello ween squamous cell carcinomas and malignant lymphomas of the head and neck. AJNR Am J Neuroradiol. 2005; 26:1186-92. 34. Vandecaveye V, De Keyzer F, Vander Poorten V, Dirix P, Verbeken E, Nuyts S, et al. Head and neck squamous cell carcinoma: value of diffusion-weighted MR imaging for nodal staging. Radiology. 2009;251:134-46. 35. Abdel Razek AA, Soliman NY, Elkhamary S, Alsharaway MK, Tawfik A. Role of diffusion-weighted MR imaging in cervical adenopathy. Eur Radiol. 2006;16:1468-77. 36.Muenzel D, Duetsch S, Fauser C, Slotta-Huspenina J, Gaa J, Rummeny EJ, et al. Diffusion-weighted magnetic resonance imaging in cervical lymphadenopathy: report of three cases of patients with Bartonella henselae infection mimicking malignant disease. Acta Radiol. 2009; 50:914-6. 37. Chawla S, Kim S, Loevner LA, Hwang WT, Weinstein G, Chalian A, et al. Prediction of disease-free survival in patients with squamous cell carcinomas of the head and 9-12 Capt 174 pag.indd 127 127 neck using dinamic contrast –enhanced MR. AJNR Am J Neuroradiol. 2011;32:778-84. 38. Akter M, Hirai T, Minoda R, Murakami R, Saiki S, Okuaki T, et al. Diffusion tensor tractography in the head and neck region using a clinical 3-T MR scanner. Acad. Radiol. 2009;16:858-65. 39. Mori S, Kaneda T, Fujita Y, Kato M, Sakayanagi M, Minami M. Diffusion tensor tractoghraphy for the inferior alveolar nerve (V3). Initial experiment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;106:270-4. 40. Star-Lack JM, Adalsteinsson E, Adam M, Terris DJ, Pinto HA, Brown JM, et al. In vivo 1H MR Spectroscopy of human head and neck lymph node metastasis and comparison with oxygen tension measurements AJNR Am J Neuroradiol. 2000;21:183-93. 41. Bezabeh T, Odlum O, Nason R, Kerr P, Sutherland D, Patel R, et al. Prediction of treatment in head and neck cancer by magnetic resonance spectroscopy. AJNR Am J Neuroradiol. 2005;26:2108-13. 26/4/12 18:34:33 Radiología de cabeza y cuello 10 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo R. Zabala Landa* y J.L. del Cura Rodríguez Hospital de Basurto, Bilbao, España Introducción Desde el punto de vista de cualquier radiólogo que lleve trabajando unos años, no es difícil tener la impresión de que estamos ante una epidemia de patología tiroidea. Y, en cierto modo, lo estamos. Sólo que en este caso, buena parte de la culpa de esa epidemia la tenemos precisamente los radiólogos. Y es que mientras que la prevalencia del nódulo tiroideo palpable es del 4-8%, la detección incidental de esta patología mediante técnicas de imagen hace que la prevalencia ascienda hasta al 67%1,2, lo que hace que, ante el incremento de las exploraciones radiológicas realizadas en el cuello por causas diversas, la detección de patología tiroidea se haya incrementado enormemente3. El manejo del nódulo tiroideo es, por tanto, un reto habitual en la práctica diaria, tanto desde el punto de vista clínico como radiológico, dada su alta prevalencia y dado que la incidencia de cáncer en ellos es de sólo el 9-13% por paciente1. Además, la gran mayoría de los cánceres detectados son carcinomas papilares cuyo pronóstico es muy bueno, con una supervivencia a los 30 años del 95%4. Todo esto ha llevado a algunos autores a proponer “apagar los equipos de ultrasonidos” cuando se trata de explorar el tiroides3. Sin embargo, y a pesar de lo atractivo de esta postura nihilista, especialmente en momentos de crisis económica, hay una serie de consideraciones que no se puede dejar de lado. El potencial maligno de los nódulos no palpables es igual que el de los palpables; incluso algunos de los nódulos descubiertos de forma incidental son más agresivos que los descubiertos por palpación5,6. Por otra parte, la mortalidad del cáncer de tiroides, aunque baja, existe, siendo mayor en las mujeres y aumentando su agresividad conforme disminuye la edad. Y no hay que olvidar que, aunque el tratamiento del cáncer de tiroides es muy eficaz, el diagnóstico tardío está asociado a una mayor frecuencia de recidivas, con la morbilidad asociada a la necesidad de retratamiento1,6,7. La detección de un nódulo tiroideo, bien sea por sospecha clínica o bien por detección incidental en una exploración radiológica, abre un camino de actuaciones médicas encaminadas a determinar su naturaleza. Éstas incluyen exploración clínica y anamnesis, análisis, técnicas de imagen y biopsia. Los radiólogos tenemos una participación central en las 2 últimas, pero ocurre que con frecuencia ignoramos lo que ocurre antes de que el paciente acuda a nuestros servicios. Histología del nódulo tiroideo Las lesiones nodulares del tiroides pueden corresponder histológicamente a: Lesiones benignas – Hiperplasias nodulares (80-90%). La mayoría de los nódulos hiperplásicos tienen su origen en bocios adenomatosos que sufren ciclos de hiperplasia y degeneración coloide. – Adenomas tiroideos (5-10%). Son neoplasias benignas, claramente separadas del tejido tiroideo por una cápsula fibrosa. Suelen ser solitarios y no funcionantes. Generalmente tienen un crecimiento lento y no suelen superar los 4 cm, a menos que exista un sangrado intralesional. Neoplasias malignas – Carcinoma papilar. Es el tumor tiroideo maligno más frecuente (80-90% de los cánceres tiroideos). Es un tumor de bajo grado y con buen pronóstico, con una supervivencia a los 20 años del 90%. Los factores pronósticos más importantes son: edad (mejor pronóstico en menores de 50 años), tamaño, extensión extratiroidea y subtipo histológico. Puede ser multifocal. Es muy característica la presencia de cuerpos de psamoma en el estudio histológico, que ecográficamente se representan como zonas de microcalcificaciones. Suelen ser sólidos, pero también pueden presentarse como una lesión quística con polo sólido vascularizado. Es el tumor maligno tiroideo que tiene mayor tendencia a la diseminación linfática cervical. Como característica funcional, son lesiones con tendencia a concentrar el yodo, por lo que *Autor para correspondencia. Correo electrónico: [email protected] (R. Zabala Landa). 9-12 Capt 174 pag.indd 128 26/4/12 18:34:33 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo el I-131 es útil para determinar la existencia de tiroides residual tras una tiroidectomía, recidivas y metástasis a distancia. – Carcinoma folicular. Es el 5% de las neoplasias malignas del tiroides. Más agresivos que los papilares, se siguen considerando lesiones bien diferenciadas y de bajo grado. Para diagnosticar un carcinoma folicular, histológicamente debe existir una invasión de la cápsula del nódulo, por lo que el diagnóstico definitivo se obtiene con la valoración completa de la cápsula en la pieza quirúrgica. Tienen menor tendencia a la diseminación linfática, pero la extensión hematógena es más frecuente. Al igual que el carcinoma papilar, tienen tendencia a captar yodo. – Carcinoma de células de Hürtler. Las células de Hürtler derivan del epitelio folicular. Como en los carcinomas foliculares, debe haber una invasión capsular en el estudio de la pieza para diagnosticar un carcinoma de células de Hürtler. Pueden tener una diseminación linfática o hematógena. – Carcinoma medular. Tiene su origen en las células C parafoliculares. Tiene un pronóstico peor que el carcinoma papilar y los foliculares bien diferenciados. Representa menos del 5% de los tumores tiroideos. Aunque la mayoría de los casos son esporádicos, puede formar parte de los síndromes de neoplasia endocrina múltiple (MEN) IIA y IIB. Suele manifestarse como nódulo único, heterogéneo y de bordes imprecisos y con tendencia a la infiltración local, con extensión a tejidos adyacentes. Puede tener una diseminación linfática y hematógena. Produce un aumento en las concentraciones de calcitonina en sangre. No capta yodo, pero sí talio y galio. – Carcinoma anaplásico. Menos del 5% de los carcinomas tiroideos. Muy agresivo y de muy mal pronóstico, suele provocar la muerte con rapidez. Es de rápido crecimiento, comprimiendo la vía aérea y digestiva, infiltrando vasos y provocando metástasis linfáticas con rapidez. – Linfoma primario. Representa el 1-3% de las neoplasias malignas tiroideas. Es una localización infrecuente del linfoma primario. Los pacientes con tiroiditis de Hashimoto presentan una mayor incidencia de linfoma tiroideo. Suele presentarse como nódulo único y no existe ningún dato radiológico que permita diferenciarlo del resto de neoplasias malignas. – Metástasis. Muy infrecuentes. Los tumores que con más frecuencia metastatizan en el tiroides son el carcinoma renal, el de pulmón y el de mama1,8,9. Historia y exploración clínica El clínico realizará siempre una exploración inicial de la glándula valorando los signos asociados que existan. Asimismo realizará una historia clínica que incluirá los antecedentes familiares del paciente. Con todo ello valorará la presencia de signos de sospecha asociados, ya que la presencia de estos signos puede eventualmente modificar 9-12 Capt 174 pag.indd 129 129 el manejo diagnóstico del nódulo. Estos signos de sospecha son2,6,10: A. Signos de alta sospecha. – Historia familiar de carcinoma tiroideo o de síndromes endocrinos múltiples, MEN II (enfermedad de Cowden, poliposis familiar, enfermedad de Wegener) en primera línea de parentesco. – Rápido crecimiento del nódulo (aunque sólo un 5% de los nódulos con rápido crecimiento son malignos). – Nódulo duro y firme, adherido a estructuras vecinas. – Presencia de adenopatías regionales. – Disfonía, disfagia, disnea o parálisis de cuerdas vocales. B. Signos de sospecha moderada. – Edad menor de 20 o mayor de 70 años. – Sexo masculino. – Tamaño > 4 cm. Los nódulos no palpables tienen el mismo riesgo de malignidad que los papables, siempre comparando nódulos del mismo tamaño. – Historia de irradiación en cabeza-cuello en la infancia o adolescencia. Análisis – Tirotropina (TSH). La posibilidad de lesiones malignas es mayor en pacientes con altos valores de TSH. Asimismo, la posibilidad de nódulos malignos es mayor en pacientes con tiroiditis de Hashimoto que en glándulas normales. Los nódulos con valores de TSH bajos raramente son malignos. – Tiroglobulina. Aunque no se recomienda la medición de tiroglobulina sérica en la evaluación inicial del nódulo tiroideo, ésta es un marcador tumoral excelente para el seguimiento de los pacientes con carcinoma papilar tiroideo. El aumento indica la existencia de recurrencia. – Calcitonina. La calcitonina sérica es útil para detectar cáncer medular del tiroides en estadios iniciales. Sin embargo se trata de un tumor poco frecuente, por lo que no existe la recomendación de hacer este estudio de manera sistemática, sino únicamente en pacientes con historia familiar o antecedentes de carcinoma medular6. Diagnóstico por imagen La gammagrafía y la ecografía suelen ser los métodos diagnósticos habitualmente empleados, dejándose la tomografía computarizada y la resonancia magnética para valorar eventualmente la extensión de la patología tiroidea. Medicina nuclear La gammagrafía ofrece información funcional de la glándula. Los radioisótopos utilizados en el tiroides son el 26/4/12 18:34:34 Radiología de cabeza y cuello 130 Tabla 1 − Valores diagnósticos de los signos ecográficos más significativos en el nódulo tiroideo11-13 Signos ecográficos Sensibilidad (%) Especificidad (%) VPP (%) Nódulo sólido Hipoecogenicidad marcada Bordes espiculados Diámetro anteroposterior mayor que el transverso Microcalcificaciones Calcificaciones groseras en nódulos solitarios 93-98 23-41 33-48 40-51 49-44 10-24 58-87 92-99 92-99 91-96 91-96 87-96 43-75 78-80 81-86 71-77 69-78 27-65 VPP: valor predictivo positivo. minar si un nódulo es caliente (baja incidencia de malignidad, inferior al 5%) o frío (mayor incidencia de malignidad, de aproximadamente el 20%). Los nódulos calientes no requieren punción6. Ecografía Figura 1. Hiperplasia tiroidea. Nódulo de apariencia espongiforme formado por múltiples áreas líquidas adosadas que le confieren un aspecto espumoso. La ecografía es la técnica de imagen de elección en la valoración del tiroides y debe ser realizada en todos los pacientes en los que se sospeche la existencia de nódulos tiroideos6. El estudio ecográfico permite valorar si realmente existe el nódulo, si se trata de un quiste o de un nódulo sólido, su tamaño y localización, y sus características ecográficas. Aunque algunos signos son altamente específicos, no existe un dato ecográfico único que permita determinar la malignidad de un nódulo tiroideo, es necesario valorar en conjunto las características de cada nódulo para identificar los nódulos sospechosos. Los datos ecográficos a valorar ante un nódulo tiroideo se exponen a continuación. Consistencia Figura 2. Carcinoma papilar de tiroides. Nódulo sólido, marcadamente hipoecoico, bien delimitado, en el polo inferior del lóbulo tiroideo izquierdo. Los nódulos, dependiendo de su consistencia, pueden clasificarse en: sólido, mixto (sólido-quístico) y quístico. Los tumores malignos son casi siempre totalmente sólidos. La diferencia en la proporción entre lesiones sólidas con respecto a las mixtas entre las lesiones malignas (98% de sólidas) y las benignas (87% de sólidas) es significativa, siendo este signo altamente sensible pero sólo moderadamente específico para malignidad (tabla 1). Por otra parte, las lesiones quísticas muy raramente son malignas. Igualmente, la apariencia espongiforme de un nódulo, que se define como la agregación de múltiples microquistes en más del 50% del volumen del nódulo (fig. 1), descarta malignidad con una especificidad del 99,7%11-13. Ecogenidad pertecnetato de tecnecio (Tc-99m), yodo 123 (I-123) y yodo 131 (I-131), este último para la detección de recidivas tras tratamiento. Se debe realizar una gammagrafía ante cualquier nódulo tiroideo en que la TSH sea inferior a lo normal para deter- 9-12 Capt 174 pag.indd 130 Los nódulos sólidos marcadamente hipoecogénicos con respecto a la glándula tiroidea o a la musculatura infrahioidea se asocian con malignidad (fig. 2). La presencia de una hipoecogenicidad marcada es casi patognomónica de malignidad (tabla 1). Sin embargo, la sensibilidad es baja dada la escasa frecuencia de este signo 11-13. La simple 26/4/12 18:34:34 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo 131 hipoecogenicidad no es útil como signo diferenciador, con un valor predictivo positivo de tan sólo el 25%. Márgenes La presencia de un halo hipoecogénico rodeando el nódulo suele estar relacionada con lesiones benignas, e indica la formación de una seudocápsula, infiltrado inflamatorio y parte del parénquima tiroideo comprimido (fig. 3). La presencia de un borde bien delimitado y liso en una lesión tiene un valor predictivo negativo del 95%. Por el contrario, la presencia de bordes espiculados indica malignidad con una alta especificidad, aunque la sensibilidad vuelve a ser baja (tabla 1). Por otra parte, la presencia de bordes mal definidos o microlobulados se asocia de forma similar con tumores malignos y benignos11-13. Forma Las lesiones con un diámetro anteroposterior mayor que el transversal (fig. 4) son con más frecuencia malignas, también con una especificidad alta y con una sensibilidad limitada11-13 (tabla 1). Figura 3. Nódulo hiperplásico. En la ecografía aparece como un nódulo sólido, isoecogénico y bien delimitado por un halo hipoecogénico. Calcificaciones Las calcificaciones groseras suelen ser frecuentes en los bocios multinodulares, sobre todo las llamadas calcificaciones en cáscara de huevo14. Cuando se ven en un nódulo único también deben considerarse sospechosas (tabla 1). Las microcalcificaciones son más sospechosas, sobre todo las calcificaciones en “tormenta de nieve”. Estas microcalcificaciones representarían múltiples cuerpos de psamoma calcificados, que son típicos del carcinoma papilar (fig. 5). Hay que ser cuidadoso en el diagnóstico ecográfico de estas microcalcificaciones dado su pequeño tamaño, comprobando que no presentan sombra acústica posterior, para diferenciarlas de pequeños focos ecogénicos con un artefacto en cola de cometa posterior, que se ven generalmente en nódulos quísticos benignos. Este signo ecográfico también tiene una especificidad alta y una sensibilidad baja11-13 (tabla 1). Figura 4. Carcinoma papilar de tiroides que se presenta como un nódulo sólido, heterogéneo y con diámetro anteroposterior mayor que el transverso. Patrón de vascularización La vascularización centrípeta (mayor vascularización central que periférica) sugiere más una lesión maligna. Se puede ver hasta en el 74% de las lesiones malignas, pero no es específica. Por otro lado, un nódulo con baja o nula vascularización es raro que sea maligno15. Sin embargo, este signo es poco usado en las guías clínicas dada la alta variabilidad en su interpretación1,6,12,16. También se ha descrito que el estudio Doppler color puede servir de guía para planificar una punción15, ya sea para determinar el nódulo a biopsiar o para elegir la zona del nódulo que es mejor biopsiar (fig. 6). Afectación ganglionar La existencia de adenopatías sospechosas asociadas a un nódulo tiroideo aumenta la sospecha de lesión maligna. Hay afectación ganglionar hasta en un 20% de los carcinomas tiroideos, siendo estas adenopatías generalmente 9-12 Capt 174 pag.indd 131 Figura 5. Carcinoma papilar. Pequeño grupo de calcificaciones cercano al istmo asociado a un nódulo de 4 mm de diámetro. 26/4/12 18:34:34 132 Radiología de cabeza y cuello de malignidad1,6-12. Sin embargo se han descrito cambios en los valores diagnósticos de los signos ecográficos con el tamaño de los nódulos12, probablemente por diferencias en la interpretación de estos signos. Manejo del nódulo tiroideo Figura 6. Carcinoma papilar con vascularización central abigarrada. Figura 7. Adenopatía con infiltración por carcinoma papilar de tiroides. Adenopatía en cadena yugular (flechas finas) ligeramente aumentada de tamaño. En su interior se aprecia un nódulo más ecogénico que corresponde a la infiltración tumoral. de tamaño normal, pero con características ecográficas características como zonas de microcalcificaciones, áreas quísticas y alteración en la ecoestructura normal del ganglio6-9 (fig. 7). La ecografía es también la técnica indicada para el seguimiento posquirúrgico en los pacientes con carcinoma de tiroides para descartar recidiva ganglionar1. Infiltración de estructuras extratiroideas Este hallazgo ecográfico tiene una alta especificidad para malignidad, relacionándose con tumores agresivos o ya muy avanzados6-9. Tamaño y número La frecuencia de carcinoma en pacientes con nódulo único o múltiple es similar. La ecografía sirve, en los pacientes con múltiples nódulos tiroideos, para seleccionar los sugestivos de malignidad, siguiendo para ellos los mismos criterios que se siguen para valorar el nódulo solitario. Actualmente, tampoco hay evidencia científica que relacione el tamaño de los nódulos y una mayor incidencia 9-12 Capt 174 pag.indd 132 El manejo de la sospecha de nódulo tiroideo parte siempre de una evaluación de los datos clínicos (fig. 8). La indicación inicial de una gammagrafía o una ecografía viene determinada fundamentalmente por las concentraciones sanguíneas de TSH. Si se realiza una ecografía y se detecta un nódulo, la siguiente decisión es si se debe realizar punción-biopsia (PAAF) del nódulo o no6. Y ésta es probablemente la decisión más controvertida actualmente en el manejo del nódulo tiroideo. La incidencia de los nódulos tiroideos es tan alta que la punción de la totalidad de los que se detectan es inviable, por lo que se han propuesto múltiples estrategias para seleccionar pacientes en los que la punción no es necesaria. Como se ha visto antes, hay varios signos ecográficos de alta especificidad cuya presencia por sí mismos hace indicada la punción del nódulo. Sin embargo, la sensibilidad de estos signos y del resto de los descritos es baja, lo que los hace inservibles para descartar lesiones como benignas, que es lo que se necesita. Tan sólo la presencia de un nódulo quístico o espongiforme garantiza suficientemente la benignidad para descartar la punción. En consecuencia se han propuesto diversas estrategias para seleccionar nódulos para su punción, entre las cuales las más conocidas son: – Guía de la Society of Radiologists in Ultrasound. Es probablemente la que más éxito ha tenido entre los radiólogos. Se basa en el tamaño y en las características ecográficas de los nódulos. Recomienda realizar PAAF en los nódulos > 1,5 cm de diámetro si son sólidos o presentan calcificaciones groseras. También recomienda biopsiar los nódulos > 2 cm cuando son mixtos (quístico-sólidos), o son quísticos pero con un componente mural sólido o si han crecido significativamente. También recomienda realizar punción de cualquier nódulo si se detecta una adenopatía sospechosa asociada1. S u punto débil es claramente usar el tamaño como criterio, ya que éste no está relacionado con un mayor riesgo de malignidad. Fundamenta el uso del tamaño en que el carcinoma de tiroides tiene un pronóstico bueno y el diagnóstico de tumores < 1 cm no influye en el pronóstico de éstos1. A pesar de su popularidad, una revisión reciente ha demostrado su escaso valor, ya que presenta una sensibilidad del 35%, una especificidad del 54%, con una proporción de carcinomas no detectados del 64,5%. Estos datos son del todo inaceptables16. – G u í a d e l a A m e r i c a n A s s o c i a t i o n o f C l i n i c a l Endocrinologists. Propugna la biopsia de todo nódulo hipoecoico > 1 cm, incluso < 1 cm si es hipoecoico y asocia algún signo ecográfico de malignidad (márgenes 26/4/12 18:34:34 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo TSH bajo 133 TSH normal o alto Historia, exploración y TSH Gammagrafía No hiperfunción Estudio ecográfico Hiperfunción Existe nódulo tiroideo No existe nódulo Hipertirodismo Punción TSH alto TSH normal Descartar hipotirodismo Punción no indicada Figura 8. Algoritmo de actuación ante sospecha de nódulo tiroideo. Modificado de Cooper et al6. irregulares, vascularización intranodular, mayor diámetro anteroposterior que transverso, presencia de microcalcificaciones, o de adenopatías patológicas) o hay factores de riesgo en los antecedentes clínicos17. Sus resultados en una revisión externa han sido mucho mejores que en la anterior, con una sensibilidad del 79%, una especificidad del 91%, con un 21% de carcinomas no detectados16. – Criterios de Kim. Propuestos por un grupo coreano, recomiendan la biopsia de todo nódulo, independientemente de su tamaño, que presente un solo signo ecográfico sospechoso de entre los siguientes: hipoecogenicidad marcada, márgenes irregulares o lobulados, microcalcificaciones y mayor diámetro anteroposterior que transverso18. Como es de esperar, es más sensible que las anteriores (93%) y presenta también una especificidad alta (81%), con sólo un 7% de carcinomas no detectados16. – Guía clínica de la American Thyroid Association. Publicada en 2009, también considera para la indicación de punción criterios clínicos y de imagen. Recomienda PAAF de todo nódulo sólido > 1 cm con datos ecográficos de sospecha. Define como hallazgos sospechosos: la existencia de microcalcificaciones, hipoecogenicidad del nódulo, márgenes mal definidos, aumento de la vascularización y diámetro profundo mayor que el transverso. La PAAF rutinaria para nódulos subcentimétricos no está recomendada. 9-12 Capt 174 pag.indd 133 En el caso de historia familiar de alto riesgo también recomienda puncionar los nódulos < 1 cm con datos ecográficos sospechosos. En los pacientes con bocio multinodular, cada nódulo tiene el mismo riesgo de malignidad que si fuese único. Si ninguno de los nódulos tiene datos ecográficos sospechosos, se recomienda biopsia del dominante y realizar seguimiento ecográfico del tiroides por si hubiese cambios en la imagen ecográfica de alguno de los nódulos. En los nódulos mixtos sólido-quísticos, si es necesario biopsiarlos, recomienda punción del componente sólido. En las lesiones totalmente quísticas, sólo está indicada la punción para aliviar la sintomatología, aunque recidivan en el 80%. También recomienda que se use la ecografía como método de seguimiento rutinario en pacientes con nódulos benignos o bocios multinodulares, y repetir la punción si se detecta un crecimiento de más del 50% del volumen. También recomienda, tras un diagnóstico de cáncer de tiroides, realizar una ecografía cervical preoperatoria y la punción guiada por ecografía de cualquier adenopatía sospechosa. No recomienda incluir la ecografía cervical en el protocolo de seguimiento de los pacientes con cáncer de tiroides después del tratamiento6. – TIRADS. Diversos grupos han propuesto sistemas de clasificación de los nódulos tiroideos que intentan imitar al exitoso BIRADS usado para la clasificación 26/4/12 18:34:35 Radiología de cabeza y cuello 134 más elevado, como en pacientes con antecedentes familiares de carcinoma tiroideo o de síndromes endocrinos múltiples, historia de irradiación en cabeza-cuello, crecimiento rápido del nódulo o exploración o clínica sospechosa. En caso de existencia de múltiples nódulos, puncionamos todos los que cumplan estos criterios. No puncionamos lesiones puramente quísticas o esponjosas6. Diagnóstico patológico Técnica Figura 9. Punción de nódulo tiroideo con control ecográfico. Se introduce la aguja siguiendo el plano de corte del ecógrafo hasta alcanzar la lesión. Una vez la punta de la aguja está en el lugar deseado, se aspira o se realizan movimientos de la aguja para facilitar el paso de las células por capilaridad. de las lesiones mamarias. Estos sistemas se basan en adjudicar a los nódulos un nivel de sospecha, de 1 a 5, dependiendo del número de hallazgos ecográficos sospechosos12,19,20. En definitiva, consiste en recomendar no realizar biopsia a los nódulos que no tienen signos ecográficos de sospecha. La propuesta es muy reciente y no ha sido contrastada, aunque tiene algunos puntos débiles. Por ejemplo, no considera el riesgo clínico. Usa signos ecográficos que tienen una altísima especificidad por sí solos y una sensibilidad muy baja. Esto hace que el previsible efecto acumulativo de estos signos sobre el riesgo de carcinoma sea escaso y, por otra parte, que la categoría 3 (no biopsia necesaria) tenga un porcentaje de lesiones malignas no desdeñable. – Nuestra práctica. El hecho de que se estén proponiendo continuamente nuevas guías clínicas para el manejo del nódulo tiroideo es un signo evidente de que ninguna de ellas está generalmente aceptada. Nuestra práctica clínica habitual tiene en cuenta diversos criterios de estas guías, así como criterios clínicos, y se adapta a nuestro entorno sanitario. Nosotros realizamos punción de todos los nódulos que presenten signos ecográficos con especificidad alta para malignidad, en concreto: hipoecogenicidad marcada, bordes espiculados, diámetro anteroposterior mayor que el transverso, microcalcificaciones, calcificaciones groseras en nódulos solitarios o signos de infiltración de estructuras vecinas. También realizamos punción de las adenopatías sospechosas. Además realizamos punción a solicitud del endocrinólogo en los nódulos en que la clínica sugiere un riesgo 9-12 Capt 174 pag.indd 134 La PAAF es la técnica más eficaz y con la mejor relación coste-efectividad para el estudio del nódulo tiroideo, con una sensibilidad y especificidad para el diagnóstico de malignidad mayor del 90%. Ofrece un diagnóstico citológico de la lesión e influye sustancialmente en las decisiones a tomar6,17,21. Consiste en realizar una punción del nódulo tiroideo mediante aguja fina entre 20-23G. Una vez la aguja entra en el nódulo, se puede realizar aspiración o, simplemente, obtener la muestra por capilaridad. Ambas opciones han demostrado tener unos resultados similares (fig. 9). Una muestra de punción se considera adecuada cuando al menos en 2 de las laminillas hay 6 o más grupos con más de 10 folículos epiteliales bien conservados6,17,21,22. La PAAF bajo control ecográfico ha demostrado ser más eficaz que la guiada por palpación manual para llegar al diagnóstico anatomopatológico correcto. Se consigue disminuir significativamente los resultados no diagnósticos y los falsos negativos, y aumenta la sensibilidad y la especificidad, ya que disminuye la posibilidad de error de muestreo. En el caso de bocio multinodular permite seleccionar el o los nódulos más adecuados para biopsiar. La guía ecográfica es imprescindible en los nódulos no palpables, en los de localización posterior y en los que tienen componente quístico, porque permite seleccionar las zonas sólidas6,17,23. Interpretación del resultado El resultado citológico de la PAAF de los nódulos tiroideos clasifica los hallazgos en 4 grupos, uno de los cuales a su vez se divide en 2 subgrupos. La actitud a tomar ante el nódulo va a depender en gran parte de esta clasificación (fig. 10). A. Benignas. Incluyen, nódulos coloideos, hiperplasia nodular, tiroiditis linfocítica, enfermedad de Graves, tiroiditis inflamatorias. Ante un resultado benigno no se requieren nuevos procedimientos o tratamientos. Sin embargo se recomienda realizar una ecografía en 6-18 meses para valorar crecimiento y, en caso de que sea estable (menos de un 50% de aumento de volumen), no realizar una nueva ecografía en 3-5 años. Por el contrario, si se detecta crecimiento, debe repetirse la PAAF1,6,17,24. 26/4/12 18:34:35 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo No diagnóstica Benigno Indeterminado Tumor de Hürtle Neoplasia folicular Repetir PAAF 135 Maligno Lesión folicular Seguimiento Valoración de factores de riesgo Crecimiento Cirugía Ecografía preoperatoria Figura 10. Algoritmo de actuación según el resultado de la punción aspiración con aguja fina (PAAF). B. Malignas. Ante este diagnóstico está indicada la cirugía1,6,17. C. Insuficientes. Cuando no se consigue obtener material suficiente para el diagnóstico. Incluso en centros con gran experiencia no bajan del 15-20%. En estos casos se recomienda repetir la PAAF. En caso de no llegar a un diagnóstico tras la segunda punción se recomienda un seguimiento estrecho y en caso de tratarse de un nódulo sólido con características de malignidad, valorar la necesidad de cirugía. Más adelante se discutirán otras alternativas en este tipo de resultados1,6,17. D. Indeterminadas. Incluyen 2 tipos de lesiones: – Neoplasias foliculares o neoplasias de células de Hürtler. Suponen un riesgo de malignidad del 20-30%. En estos casos se recomienda lobectomía del tiroides. En el caso de las neoplasias foliculares puede ser útil realizar antes una gammagrafía, sobre todo en pacientes con concentraciones normales o bajas de TSH. Si no se detecta un nódulo caliente se recomienda cirugía. – Lesiones foliculares o atipias. Tienen un riesgo de malignidad de entre el 5-10%. En principio su manejo es similar al de las neoplasias foliculares, pero dado el menor riesgo de malignidad es razonable una evaluación clínica del riesgo antes de tomar una decisión6,17. Punción de las adenopatías cervicales En los pacientes con diagnóstico de carcinoma papilar de tiroides, la detección de adenopatías cervicales, tanto si es antes de la cirugía como en las ecografías de seguimiento, plantea un problema diagnóstico importante, ya que el manejo terapéutico del paciente es muy diferente en caso 9-12 Capt 174 pag.indd 135 de que estas adenopatías sean reactivas o si corresponden a diseminación tumoral metastásica25. El problema surge porque estas adenopatías suelen ser muy pequeñas, lo que hace que el manejo tradicional mediante PAAF o mediante biopsia con aguja gruesa (BAG) sea problemático y tenga un riesgo elevado de falsos negativos. Una alternativa más sensible que las técnicas patológicas consiste en la realización de una PAAF para posteriormente lavar el aspirado en una pequeña cantidad de suero fisiológico y enviarlo al laboratorio para una determinación de tiroglobulina en el líquido de lavado (fig. 11). La detección de más de 1,7 ng/ml de tiroglobulina en pacientes tiroidectomizados o de más de 39 ng/ml, o una concentración mayor que la sérica antes de la cirugía, es diagnóstica de infiltración por carcinoma papilar26,27. Problemas de la punción aspiración con aguja fina Aunque la PAAF es una herramienta muy fiable, también tiene limitaciones que incluyen los falsos positivos, los falsos negativos (más del 5%) y, sobre todo, los resultados indeterminados. Aunque la mayoría de las PAAF son adecuadas para un diagnóstico citológico, entre el 15 y el 20% serán insuficientes o no diagnósticas, bien por escasez de células en el material obtenido en la punción o por no ser éstas suficientemente representativas. La incidencia de malignidad entre los nódulos con punciones no diagnósticas es similar a la del resto de los nódulos tiroideos, es decir, del 5-10%. Por ello, las guías clínicas recomiendan el seguimiento de los nódulos benignos y la repetición de las PAAF no concluyentes, especialmente cuando hay datos ecográficos de sospecha1,6,17. 26/4/12 18:34:35 Radiología de cabeza y cuello 136 Figura 11. Punción de una adenopatía cervical en paciente tiroidectomizado por carcinoma papilar para analizar la tiroglobulina en el lavado del líquido obtenido. El análisis no evidenció concentraciones apreciables de tiroglobulina. te, realizar una valoración clínica adecuada y completar el estudio con estudios analíticos para conocer la función tiroidea. Asimismo debe confirmarse su existencia mediante una técnica de imagen, siendo la ecografía la prueba de elección. Las características ecográficas del nódulo son útiles para decidir si es necesario completar el estudio con una punción para obtener un diagnóstico patológico. Cada nódulo debe ser valorado de manera independiente y determinar si existe algún dato de sospecha y si es necesario realizar punción. Hay guías clínicas que pueden facilitar la toma de decisiones. En cuanto a la técnica de la punción, la guía ecográfica es imprescindible para evitar los falsos negativos y aumentar la sensibilidad y la especificidad. La BAG es una alternativa a considerar para resolver el problema de las punciones no valorables. Bibliografía Figura 12. Biopsia con aguja gruesa 18G de un nódulo hiperplásico. Puede apreciarse el extraordinario grado de precisión que puede conseguirse con esta técnica. Una alternativa consiste en la BAG. La BAG está considerada en las guías clínicas como una alternativa en los casos en que la PAAF es repetidamente no diagnóstica17. Sin embargo, en nuestra experiencia (no publicada), el uso de esta técnica como primera indicación permite disminuir drásticamente, hasta casi hacerlas desaparecer, las punciones no valorables, con una correlación casi perfecta con la cirugía y sin que eso suponga un incremento apreciable de las complicaciones (fig. 12). Puede realizarse con agujas de corte frontal 18G y consigue obtener especímenes que se procesan como biopsias, permitiendo el estudio histológico28. Conclusiones Ante la sospecha de un nódulo tiroideo siempre se deben investigar los antecedentes y la clínica del pacien- 9-12 Capt 174 pag.indd 136 1. Frates M, Benson C, Charboneau J, Cibas E, Clark O, Coleman B. Management of thyroid nodules detected at US: Society of Radiologist in Ultrasound Consensus Conference Statement. Radiology. 2005;237:796-800. 2. Mazzaferri EL. Management of a solitary thyroid nodule. N Engl J Med. 1993;328:553-9. 3. Cronan JJ. Thyroid nodules: is it time to turn off the US machines? Radiology. 2008;247:602-4. 4. Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, et al. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. 5. Hagag P, Strauss S, Weiss M. Role of ultrasound guided fine-needle aspiration biopsy in evaluation of nonpalpable thyroid nodules. Thyroid. 1998;8:989-95. 6. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. Revised American Thyroid Association management guidellines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009;19:1167214. 7. Cortázar R, Quirós R, Acebal MM. Papel del radiólogo en el manejo del nódulo tiroideo. Radiología. 2008;50:471-81. 8. Revert AJ, Pallardó Y, Selma VR. Radiología del tiroides y el paratiroides. En: Rovira A, Ramos A, De Juan M, editores. Radiología de cabeza y cuello. Madrid: Editorial Médica Panamericana; 2009. p. 23-34. 9. Revert JA, Pallardó Y. Radiología del cuello infrahioideo, laringe, tiroides y paratiroides. En: Del Cura JL, Pedraza S, Gayete A, editores. Radiología esencial. Madrid: Editorial Médica Panamericana; 2009. p. 1384-8. 10. Coltrera M. Evaluation and imaging of a thyroid nodule. Surg Oncol Clin N Am. 2008;17:37-56. 11. Moon WJ, Jung SL, Lee JH, Na DG, Baek JH, Lee YH, et al. Bening and malignant thyroid nodules: US diferentiation-multicenter retrospective study. Radiology. 2008;247: 762-70. 12. Kwak JY, Han KH, Yoon JH, Moon HJ, Son EJ, Park SH, et al. Thyroid Imaging Reporting And Data System for us features of nodules: a step in establishing better stratification of cancer risk. Radiology. 2011;260:892-9. 13. Hoang J, Lee W, Johnson D, Farrel S. US features of thyroid malignancy: pearls and pitfalls. Radiographics. 2007;27:847-65. 14. Yoon DY, Lee JW, Chang SK, Choi CS, Yun EJ, Seo YL, et al. Peripheral calcification in thyroid nodules. J Ultrasound Med. 2007;26:1349-55. 26/4/12 18:34:36 Ecografía de tiroides. Nódulos tiroideos. Manejo del nódulo tiroideo 15. Moon HJ, Kwak JY, Kim MJ, Son EJ, Kim EK. Can vascularity at Power Doppler US help predict thyroid malignancy? Radiology. 2010;255:260-9. 16. Ahn S, Kim E-K, Kang D, Lim S-K, Kawk J, Kim M. Biopsy of thyroid nodules: compararison of three sets of guidelines. AJR Am J Roentgenol. 2010;194:31-7. 17. Gharib H, Papini E, Valcavi R, Baskin HJ, Crescenzi A, Dottorini ME, et al. American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocrinol Pract. 2006;12:63-102. 18. Kim EK, Park CS, Chung WY, Oh KK, Kim DI, Lee JT, et al. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid. AJR Am J Roentgenol. 2002;178:687-91. 19. Park JY, Lee HJ, Jang HW, Kim HK, Yi JH, Lee W, et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma. Thyroid. 2009;19:1257-64. 20. Horvath E, Majlis S, Rossi R, Franco C, Niedmann JP, Castro A, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab. 2009;94:1748-51. 21. Carmeci C, Jeffrey RB, McDougall IR, Nowels KW, Weigel RJ. Ultrasound-guided fine-needle aspiration biopsy of thyroid masses. Thyroid. 1998;8:283-9. 22. Tublin ME, Martin JA, Rollin LJ, Pealer K, Kurs-Lasky M, Ohori P. Ultrasound-guided fine-needle aspiration versus 9-12 Capt 174 pag.indd 137 137 fine-needle capillary sampling biopsy of thyroid nodules. J Ultrasound Med. 2007;26:1697-701. 23. Danese D, Sciacchitano S, Farsetti A, Andreoli M, Pontecorvi A. Diagnostic accuracy of conventional versus sonographyguided fine-needle aspiration biopsy of thyroid nodules. Thyroid. 1998;8:15-21. 24. Kwak JY, Koo H, Youk JH, Kim MJ, Moon HJ, Son EJ, et al. Value of US correlation of a thyroid nodule with initially bening cytologic results. Radiology. 2010;254:292-300. 25. Ko MS, Lee JH, Shong YK, Gong GY, Baek JH. Normal and abnormal sonoggraphic findings at the thyroidectomy sites in postoperative patients with thyroid malignancy. AJR Am J Roentgenol. 2010;194:1596-609. 26. Uruno T, Miyauchi A, Shimizu K, Tomoda C, Takamura Y, Ito Y, et al. Usefulness of thyroglobulin measurement in fineneedle aspiration biopsy specimens for diagnosing cervical lymph node metastasis in patients with papillary thyroid cancer. World J Surg. 2005;29:483-5. 27. Boi F, Baghino G, Atzeni F, Lai ML, Faa G, Mariotti S. The diagnostic value for differentiated thyroid carcinoma metastases of thyroglobulin (Tg) measurement in washout fluid from fine-needle aspiration biopsy of neck lymph nodes is maintained in the presence of circulating anti-Tg antibodies. J Clin Endocrinol Metab. 2006;91: 1364-9. 28. López JI, Fernández de Larrinoa A, Zabala R, Del Cura JL. El diagnóstico histológico de la patología tiroidea en biopsias guiadas con control ecográfico. Rev Esp Patol. 2009:42:97106. 26/4/12 18:34:36 Radiología de cabeza y cuello 11 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A. Ramos Gonzáleza,b,*, J. Martínez San Millánc,d y A. Hilario Barrioa aServicio de Radiodiagnóstico, Sección de Neurorradiología, Hospital Universitario 12 de Octubre, Madrid, España bDepartamento de Radiología y Medicina Física, Universidad Complutense, Madrid, España cServicio de Radiodiagnóstico, Sección de Neurorradiología, Hospital Universitario Ramón y Cajal, Madrid, España dDepartamento de Especialidades Médicas, Universidad de Alcalá de Henares, Madrid, España Introducción Las glándulas salivales se dividen en mayores y menores. Las mayores incluyen 3 pares de glándulas: parótidas, submaxilares y sublinguales. Las glándulas salivales menores, que producen el 5% de la saliva, son pequeños islotes de tejido salival que se encuentran distribuidos predominantemente en la cavidad oral y, ocasionalmente, en los espacios parafaríngeos, la nasofaringe, la tráquea, el tracto aerodigestivo superior, la cavidad nasal y los senos paranasales. El algoritmo de estudio radiológico de las glándulas salivares depende de la clínica con la que se presenta el paciente. Cuando se sospecha patología inflamatoria/ infecciosa, la tomografía computarizada (TC) debe considerarse la técnica de elección y debe obtenerse inicialmente sin contraste, con el objeto de detectar litiasis como mecanismo causal. Si la sospecha es patología tumoral, la mejor técnica es la resonancia magnética (RM), porque proporciona mayor contraste tisular, que permite delimitar mejor la extensión lesional extraglandular, especialmente la invasión ósea, meníngea y la diseminación perineural. Los tumores de glándulas salivares (TGS) representan menos del 3% de todas las neoplasias. La mayoría son tumores benignos que se localizan en la glándula parótida (aproximadamente, el 80% de los tumores salivares son parotídeos, el 10% submandibulares, el 1% sublinguales y el 4-5% en glándulas salivares menores). Como regla general se puede afirmar que cuanto menor sea la glándula salivar donde asienta la tumoración más posibilidades hay de que se trate de una lesión maligna. El porcentaje de tumores malignos es del 20-30% en la glándula parótida, el 45-60% en la submandibular y el 70-85% en las sublinguales y salivares accesorias1. La diversidad de tumores benignos y malignos salivares es probablemente mayor que en cualquier otro órgano. Los tumores benignos epiteliales más frecuentes son el adenoma pleomorfo, el tumor de Warthin y el oncocitoma. Entre los tumores malignos epiteliales, los más frecuentes son el carcinoma mucoepidermoide, el carcinoma adenoide quístico, el carcinoma de células acinares y el carcinoma de células escamosas. También hay tumores no epiteliales benignos fáciles de reconocer, como el hemangioma o el lipoma, y tumores malignos no epiteliales, como el linfoma o el grupo de los sarcomas. El objetivo de los estudios radiológicos en lesiones de glándulas salivares es determinar la localización intra o extraglandular, y la relación con estructuras vasculares y nerviosas, determinar la presencia de signos de malignidad, valorar la extensión hacia estructuras adyacentes, evaluar la presencia de metástasis ganglionares y descartar extensión perineural e intracraneal Técnicas de imagen Ecografía La ecografía es de gran utilidad en el diagnóstico diferencial de la patología de las glándulas salivares. Aunque es una técnica infrautilizada en Estados Unidos2, en Europa se considera la exploración inicial en la evaluación de los ganglios linfáticos y partes blandas de la región craneocervical, donde se incluyen las glándulas salivares, especialmente en niños y mujeres embarazadas 3,4. Su principal indicación son las tumoraciones localizadas en el lóbulo superficial de la glándula parótida, aunque también se emplea para determinar la naturaleza sólida o quística de una lesión, en la estadificación ganglionar y como guía en el intervencionismo de la región cervical. En los casos en los que la tumoración asienta en el lóbulo profundo de la parótida o detrás de la sombra acústica de la mandíbula, la ecografía resulta insuficiente y es nece- *Autor para correspondencia. Correo electrónico: [email protected] (A. Ramos González). 9-12 Capt 174 pag.indd 138 26/4/12 18:34:36 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen sario realizar TC o RM. Cuando exista sospecha clínica de neoplasia maligna debe realizarse también TC o RM para valorar adecuadamente estructuras profundas (base de cráneo, espacio parafaríngeo) que de otro modo no podrían ser evaluadas5,6. La exploración debe realizarse con transductores de alta frecuencia (5-12 MHz). Durante el estudio debe evaluarse la totalidad de la glándula en al menos 2 planos perpendiculares entre sí, siendo también de gran importancia la exploración sistemática del cuello en la búsqueda de ganglios linfáticos y patología asociada6. El estudio ecográfico debe valorar si la tumoración tiene una localización intra o extraglandular, su naturaleza sólida o quística, la vascularización intralesional, los márgenes tumorales, si hay o no adenopatías asociadas, y si se trata de una lesión solitaria o multicéntrica. Todas estas características son importantes en el diagnóstico diferencial y sirven como guía en la planificación terapéutica4. La ecogenicidad normal de las glándulas salivares es mayor que la de los músculos adyacentes. Depende de la cantidad de tejido graso intraglandular y varía desde muy hiperecogénica a sólo ligeramente ecogénica en comparación con los planos musculares4,6,7. Es frecuente encontrar ganglios linfáticos intraparotídeos, que se sitúan preferentemente en los polos superior e inferior de la glándula. Los ganglios intraparotídeos normales tienen una morfología oval y un eje corto que no debe exceder los 5-6 mm. La presencia de un hilio graso hiperecogénico es uno de los criterios de normalidad más importantes de los ganglios linfáticos intraparotídeos. Los ductos intraglandulares normales no son visibles a la exploración ecográfica. La vena retromandibular se sitúa adyacente al nervio facial, y delimita el límite entre el lóbulo superficial y profundo en el estudio ecográfico6. Las neoplasias malignas de las glándulas salivares son generalmente tumoraciones de márgenes irregulares y mal definidos, hipoecogénicas y heterogéneas. A diferencia de las lesiones benignas, carecen de refuerzo acústico posterior (fig. 1)8. En ecografía Doppler, la vascularización de las neoplasias malignas no presenta hallazgos característicos. Sin embargo, Schick et al9 sugieren que un aumento de la vascularización y de la velocidad pico sistólica apoya el diagnóstico de neoplasia maligna. Por otro lado, Bradley et al10 demostraron una relación directa entre la elevación de los índices de resistencia y el riesgo de malignidad tumoral. La presencia de adenopatías de aspecto metastásico asociadas a una TGS apoya el diagnóstico de neoplasia maligna11. Tomografía computarizada La elección de la técnica de imagen debe realizarse en función de la información que se espera obtener: si se trata de localizar y delimitar un tumor benigno en una glándula salivar, la ecografía podría ser suficiente; sin embargo, en la mayoría de los casos, con lesiones de naturaleza desconocida la TC y RM son más apropiadas. Hasta 9-12 Capt 174 pag.indd 139 139 Figura 1. Adenoma pleomorfo. Características ecográficas de tumor benigno. Tumoración hipoecogénica de márgenes lobulados y bien definidos (A) localizada en la glándula submandibular, con refuerzo acústico posterior (B) y discreta vascularización periférica en el estudio Doppler (C). la aparición de las unidades de tomografía por emisión de positrones (PET-TC), el papel de las pruebas de medicina nuclear (MN) era limitado, pero aportaba una notable especificidad para el diagnóstico de oncocitomas y cistoadenolinfomas, dada la avidez única de estos tumores por el pertecnetato de Tc99m, no aparente en otros tumores. La irrupción en el mercado de los equipos PETTC resulta básica en los estudios de extensión regional y a distancia de tumores malignos, dada su habilidad para localizar lesiones hipermetabólicas mediante trazadores y para ubicarlas mediante TC. La técnica para el estudio de los tumores de las glándulas salivares mediante TC es muy variable en función de factores como las características técnicas de los equipos, inherentes a los distintos fabricantes, y la protocolización 26/4/12 18:34:36 140 A Radiología de cabeza y cuello lesión glandular original y las cadenas ganglionares regionales. Ocasionalmente, una vez valorada la serie anterior, y si no resulta concluyente, completamos el estudio mediante una nueva serie, una vez pasados 5-6 min desde el comienzo de la administración de contraste1. Por lo general, la TC parece un método inferior a la RM para valorar la patología tumoral de las glándulas salivares; sin embargo, en determinados centros sigue siendo la prueba de elección, ya que permite valorar el tumor local y las cadenas ganglionares regionales en estudios de duración y confortabilidad aceptables, algo que no ocurre aún con los estudios realizados mediante RM, que requieren tiempos de exploración mucho más largos. Además es la prueba de elección en pacientes con contraindicación para la realización de RM, y presenta una sensibilidad y una especificidad muy superiores a aquellas para la demostración de calcificaciones. Resonancia magnética B Figura 2. Anatomía del espacio parotídeo (A), submandibular y sublingual (B). Cortes axiales y coronales T1 en resonancia magnética de 3 Teslas. Nótese la mayor hiperintensidad de señal de la glándula parótida respecto a la submandibular. ACE: arteria carótida externa; AL: arteria lingual; CW: conducto de Wharton de la glándula submandibular; EPF: espacio parafaríngeo; GG: músculo geniogloso; GH: músculo genihioideo; GSL: glándula sublingual; GSM: glándula submandibular; HG: músculo hiogloso; LAP: lóbulo accesorio de la parótida; MH: músculo milohioideo; MM: músculo masetero; NF: nervio facial; VRM: vena retromandibular. propia de cada centro, inherente a su vez a los gustos y experiencia de los radiólogos que trabajen en este tipo de patología. Es recomendable obtener cortes axiales de 1-1,5 mm de espesor, con solapamientos del 40-50%, que facilitan la realización de reconstrucciones multiplanares de alta calidad, preferiblemente de 2-3 mm de grosor, en los planos axial, sagital y coronal, que permiten una adecuada valoración del tumor glandular original y de las cadenas ganglionares de la región cervicofacial. Todos los estudios deben realizarse con contraste intravenoso (i.v.), pero el protocolo de uso también es variable en función de la experiencia de cada grupo de trabajo. El protocolo debe incluir un estudio con contraste i.v. desde el conducto auditivo externo a la entrada torácica a los 36-40 s del comienzo de una embolada de 70 ml de contraste a una tasa de inyección de 2,5-3 ml/s, que permite valorar la 9-12 Capt 174 pag.indd 140 Si hay una sospecha clara de tumor, algunos autores preconizan realizar directamente RM y obviar la TC. La glándula parótida tiene abundante tejido graso, con una relación de tejido adiposo a glandular de 1:1; esta composición la hace aparecer hiperintensa en secuencias potenciadas en T1 y T2. A diferencia de la parótida, el tejido adiposo no es un componente fundamental en la glándula submandibular y, por tanto, el parénquima de esta glándula aparece menos hiperintenso, tanto en secuencias potenciadas en T1 como en T2 (fig. 2). Las glándulas sublinguales aparecen en T1 con menor intensidad que la grasa, pero hiperintensas respecto al músculo; en secuencias potenciadas en T2 son hiperintensas. Las glándulas sublinguales disminuyen progresivamente de tamaño con la edad, de forma que en la séptima década se ha perdido el 25% del grosor que estaba presente en la segunda década. Aunque con la edad, y debido al reemplazamiento graso del tejido glandular, la glándula parótida aumenta la hiperintensidad de señal en secuencias potenciadas en T1, esto no ocurre en las glándulas submandibular ni sublingual1. La señal de la glándula parótida es heterogénea, con múltiples áreas lineales hipointensas que representan tejido intersticial, conductos salivares y ramas del nervio facial. Los vasos principales intraparotídeos, la vena retromandibular y la arteria carótida externa son fácilmente identificables por el vacío de señal, especialmente en secuencias potenciadas en T2. La vena retromandibular es el vaso de mayor calibre y se sitúa inmediatamente por detrás del ángulo de la mandíbula; la arteria carótida externa se encuentra medial a la vena retromandibular, y las ramas del nervio facial tienen un trayecto lateral a la vena12. Las secuencias potenciadas en T1 proporcionan una excelente delimitación de los márgenes del tumor hipointenso frente al tejido glandular graso hiperintenso; en cambio, en secuencias potenciadas en T2 donde los tumores, especialmente benignos o de bajo grado, pueden aparecer hiperintensos la visibilidad del tumor puede estar muy limitada. Las secuencias potenciadas en T2 con supre- 26/4/12 18:34:36 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen sión grasa o las secuencias de supresión grasa con técnica de inversión-recuperación STIR son, por tanto, imprescindibles para delimitar con potenciación T2 los tumores al suprimir el componente graso de la glándula. Las secuencias en T2 y la secuencia en T1 con contraste y supresión grasa son especialmente útiles en la valoración de la extensión tumoral extraglandular, ya que tanto la médula ósea como la cortical de la mandíbula, el maxilar y la base del cráneo deben aparecer hipointensos en las secuencias con saturación grasa. La identificación de zonas hiperintensas en T2 o el realce con el contraste en la secuencia en T1 extendiéndose a estas estructuras es un signo de infiltración ósea tumoral. También con secuencias T1 con contraste y saturación grasa es posible identificar la extensión tumoral meníngea, así como la diseminación perineural. Los tumores malignos se extienden por invasión directa, metástasis hematógenas y diseminación perineural; esta última es característica de carcinomas adenoides quísticos, pero también se puede observar en adenocarcinomas y en carcinomas de células escamosas. Los signos de diseminación perineural incluyen: a) engrosamiento de los nervios; b) ampliación de los agujeros neurales; c) obliteración del manguito graso que normalmente se identifica en los agujeros de la base de cráneo; d) captación del nervio, bien nodular o difusa; e) lesiones a distancia que se explican por invasión y diseminación de nervios. En los tumores parotídeos, la diseminación perineural se produce siguiendo el nervio facial hacia el foramen estilomastoideo, o el nervio auriculotemporal que anastomosa el trayecto intraparotídeo del nervio facial con el nervio mandibular; la infiltración perineural de este nervio se extiende, por tanto, hacia el agujero oval13. El nervio facial y los conductos salivares intraparotídeos pueden identificarse en RM si se utilizan secuencias específicas de alta resolución. En los últimos años se han descrito técnicas de 3D steady state eco de gradiente con supresión grasa y difusión que obtienen excelentes resultados al suprimir la señal de los vasos, de la grasa y del parénquima glandular, permitiendo al mismo tiempo la visualización del nervio facial y del conducto parotídeo como estructuras hiperintensas14. Además, la localización superficial de la glándula la hace muy adecuada para la utilización de antenas con alto número de canales. En la cirugía, la localización y preservación del nervio facial es extremadamente importante dado los profundos déficits funcionales y estéticos que produce su lesión. Las glándulas submandibular y sublingual se resecan totalmente con relativa impunidad dado que los déficits del nervio lingual, hipogloso o ramas marginales del nervio facial que pueden producirse se toleran y compensan con facilidad por los pacientes. La diferenciación entre masas benignas y malignas no puede hacerse exclusivamente basada en el aspecto morfológico con métodos de imagen, aunque es cierto que la combinación de la clínica y la radiología orienta la aproximación diagnóstica en la mayoría de las lesiones. Si bien las lesiones benignas (quistes, ganglios, tumores) tienen una cápsula y, por tanto, un contorno liso, y están 9-12 Capt 174 pag.indd 141 141 bien delimitadas del tejido salivar adyacente, sin embargo, también es cierto que algunos de los más frecuentes tumores malignos de bajo grado (carcinoma mucoepidermoide, carcinoma de células acinares y algunos carcinomas adenoides quísticos) desarrollan seudocápsulas que los hacen aparecer en estudios de imagen como tumores de apariencia benigna (fig. 3). Los tumores malignos de alto grado (carcinomas mucoepidermoides, carcinomas epidermoides, adenocarcinomas y carcinomas indiferenciados) tienen unos márgenes imprecisos, irregulares e infiltrantes respecto al tejido salivar. Sin embargo, también en este apartado puede haber confusión dado que, aunque de forma poco frecuente, una tumoración benigna puede acompañarse de inflamación o hemorragia (a veces producida por palpación vigorosa) y adquirir una apariencia agresiva en la imagen. Aunque es un dato controvertido, se acepta mayoritariamente que los TGS malignos de alto grado son tumores muy celulares, con una alta relación núcleo/citoplasma, que prácticamente no producen secreciones y presentan una intensidad intermedia o baja en todas las secuencias, mientras que los tumores benignos o malignos de bajo grado se presentan como masas hipointensas en secuencias potenciadas en T1 e hiperintensas en secuencias potenciadas en T21. Esta hiperintensidad de señal en T2 refleja histológicamente que los tumores bien diferenciados o benignos tienen una alta relación citoplasma/núcleo y, además, son capaces de producir secreciones serosas o mucosas, y tienen, por tanto, un alto contenido en agua que se refleja en la hiperintensidad de señal en secuencias potenciadas en T22. Sin embargo, estos criterios de imagen no están exentos de error debido a que el segundo tumor benigno en frecuencia en la glándula parótida, el tumor de Warthin, presenta señal baja, intermedia o mixta en T2. Por otra parte, los carcinomas mucoepidermoides de bajo grado, algunos carcinomas adenoides quísticos y, más raramente, los adenocarcinomas pueden aparecer hiperintensos en esta secuencia. En conjunto, una tumoración con comportamiento hipointenso en secuencias potenciadas en T2 debe alertarnos de la posibilidad de una tumoración maligna de alto grado (fig. 3). En los últimos años, nuevas tecnologías con RM están mostrando resultados muy prometedores en la diferenciación de tumores de glándulas salivares. King et al15 utilizan estudios de H-RM espectroscopia con TE largo y obtienen unos resultados sorprendentes. La colina está presente en todos los tumores benignos y malignos y no en las glándulas normales; sin embargo, la creatina es más difícil de identificar y estos autores la encuentran únicamente en la mitad de los pacientes con TGS. Describen unos ratios de colina/creatina con un rango de 2,4-8,2 para los tumores benignos y de 1,19-2,28 para los malignos, lo que significa que puede ser muy buena herramienta diagnóstica al no existir solapamiento en este marcador. La diferenciación entre adenoma pleomorfo y tumor de Warthin no es tan clara basándonos en la relación de estos metabolitos, 5,49 ± 1,86 en los tumores de Warthin frente a 3,46 ± 0,84 en los adenomas pleomorfos. En resumen, estos autores encuen- 26/4/12 18:34:36 Radiología de cabeza y cuello 142 A B Figura 3. Secuencias T1 (A) y T2 (B) axiales en paciente con adenocarcinoma de bajo grado de parótida que simula tumor benigno. La masa localizada en el lóbulo profundo tiene bordes lisos y está perfectamente delimitada. Sin embargo, la tumoración es hipointensa en T2, lo que sugiere alta celularidad y posible tumor maligno. tran que una relación colina/creatina > 2,4 tiene un valor predictivo positivo del 100% para tumor benigno; si el ratio es > 4,5 el valor predictivo positivo para tumor de Warthin es de 71%. El problema de la espectroscopia con RM es que el tumor debe ser grande, ya que el vóxel debe ser mayor de 1 ml y aun en estas circunstancias en la mitad de los casos no se puede establecer relaciones porque no se encuentra la creatina. Otros autores intentan evitar este problema estableciendo la relación de la colina frente al ruido de fondo, y encuentran fundamentalmente diferencias entre 9-12 Capt 174 pag.indd 142 lesiones tumorales con mayor proporción de colina frente a lesiones seudotumorales o infecciones crónicas donde la colina está ausente o es menor que en los tumores16. También se han publicado numerosos trabajos sobre la utilidad de las secuencias de difusión y los valores del coeficiente de difusión aparente (CDA) en la diferenciación de los TGS. Las secuencias de difusión en los estudios de macizo facial tienen muchos artefactos de susceptibilidad magnética, por lo que es recomendable utilizar secuencias de eco planar con fast spin echo (FSE) y utilizar valores b bajos < 1.000. Si se utilizan valores de b muy bajos, < 300 a 500, los valores de CDA serán más altos porque estarán influenciados por la vascularización y el volumen sanguíneo de la glándula17. Un dato importante es que las 3 glándulas salivares tienen distintos valores del CDA, los valores más bajos los tiene la glándula parótida seguida de la glándula submandibular y sublingual. Los valores del CDA están influenciados por varios factores complejos, entre los que se incluyen la celularidad y la composición de la matriz tumoral. Las matrices tumorales más frecuentes en los TGS son fibras colágenas, tejido mixoide y linfoide. En general, los tumores malignos son hipercelulares, con alta relación núcleo/citoplasma y presentan una restricción de la difusión, con valores bajos del CDA. Hay excepciones y así, los adenocarcinomas y el carcinoma adenoide quístico suelen mostrar áreas moteadas de CDA elevado debido a la presencia de pequeños focos quísticos o necrosis sobre una base de tejido con restricción de la difusión. El linfoma, en cambio, es característicamente homogéneo y altamente celular en su crecimiento, por lo que los valores del CDA son extremadamente bajos. En cambio, el adenoma pleomorfo tiene grandes zonas quísticas y de tejido mixomatoso hipocelulares y, por tanto, valores altos del CDA (fig. 4). En el tumor de Warthin, los valores pueden ser muy heterogéneos con zonas de muy bajo CDA que se corresponden con tejido linfoide, áreas con valores intermedios en relación con necrosis e incluso otras zonas con valores altos que se correlacionan con la presencia de pequeños quistes en el interior del tejido linfoide. Los tumores benignos, en general, contienen componentes quísticos que contribuyen a los elevados valores del CDA que presentan. En cambio, en los tumores malignos es muy raro encontrar focos del CDA elevado18. Así pues, la presencia de zonas extensas con valores altos del CDA en un TGS puede ser un criterio importante para diferenciar tumores benignos de malignos. Por otro lado, la utilización de bajos valores del CDA como criterio de malignidad no es útil, ya que tanto el tumor de Warthin como los adenomas pleomorfos muy celulares y con escaso estroma mixoide pueden presentar zonas variables que incluyen zonas con CDA muy bajo19. En estudios de doble fase de TC con contraste y, especialmente, en estudios dinámicos con RM se describen distintos patrones de las curvas de intensidad de señal frente al tiempo (CIT) según la histología. En las curvas dinámicas, los parámetros que se analizan son similares a los estudiados en otras localizaciones como la mama: tiempo al pico (Tpic), intensidad de señal en el pico, intensidad de señal prebolo, intensidad de señal máxima, ratio de incremento 26/4/12 18:34:37 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen 143 A B C Figura 4. Adenoma pleomorfo en glándula parótida derecha. A) Secuencia T1. B) Secuencia T2 con supresión grasa. C) Mapa de coeficiente de difusión aparente (CDA). Imagen característica de tumor benigno hipointenso en T1, muy hiperintenso en T2 y con altos valores de CDA que traducen escasa celularidad. 9-12 Capt 174 pag.indd 143 Figura 5. Curvas de intensidad de señal frente al tiempo (CIT) según la histología. Las curvas se dividen en 4 grandes patrones: tipo I, con un incremento de la ratio de señal < 20%; tipo II ≥ 20% incremento de la ratio y Tpic > 120 s; tipo III ≥ 20% incremento de la ratio, Tpic ≤ 120 s y < 30% de porcentaje de lavado; tipo IV ≥ 20% incremento de la ratio, Tpic ≤ 120 s y > 30% de porcentaje de lavado. Las curvas tipos I y II se obtienen con tumores benignos, las curvas tipo III son más características de tumores malignos y las curvas tipo IV se encuentran en tumores de Warthin y linfomas. de señal y porcentaje de lavado20. Las curvas se dividen en 4 grandes patrones: tipo I, con un incremento del ratio de señal < 20%; tipo II, ≥ 20% incremento del ratio y Tpic > 120 s; tipo III, ≥ 20% incremento del ratio, Tpic ≤ 120 s y < 30% de porcentaje de lavado; tipo IV, ≥ 20% incremento del ratio, Tpic ≤ 120 s y > 30% de porcentaje de lavado. Las curvas tipos I y II se obtienen con tumores benignos, Tpic > 120 s son característicos de tumores benignos, aunque Tpic < 120 s pueden corresponder tanto a tumores benignos como malignos. Los adenomas pleomorfos presentan, generalmente, un aumento lento de la señal seguido de una fase plana con Tpic generalmente > 120 s debido a la escasa microvascularización y a un estroma escasamente celular con abundante matriz mixoide. El tumor de Warthin, que se caracteriza por tener una abundante microvascularización y alta celularidad, muestra curvas tipo IV caracterizadas por una captación y un lavado rápido (fig. 5). Los tumores malignos, aunque variables, presentan, en la mayoría de los casos, curvas tipo III con captación rápida (que los diferencia de los adenomas pleomorfos) y lavado lento (a diferencia del tumor de Warthin). Sin embargo hay cierto grado de solapamiento entre los distintos patrones de las CIT y los CDA entre tumores benignos y malignos19,21,22. Recientemente, Aida et al23 desarrollaron un método multiparamétrico utilizando CIT y valores de CDA en estudios píxel a píxel para caracterizar mejor los TGS y evitar este solapamiento. Los valores del CDA los clasifican también en 4 grupos: muy bajos, bajos, intermedios y altos (< 0,6, 26/4/12 18:34:37 Radiología de cabeza y cuello 144 Tabla 1 − Hallazgos en resonancia magnética de los tumores parotídeos más frecuentes Tumores parotídeos Borde definido Necrosis/quistes Señal en T2 Captación Adenoma pleomorfo Tumor de Warthin Carcinoma mucoepidermoide Carcinoma adenoide quístico Carcinoma de células acinares + + +/– – –/+ –/+ ++ – + + ↑↑↑ ↓ ↓ (↑) ↑ ↑ (↓) ↑↑ ↑ ↑ ↑↑ ↑ < 1,2, < 1,8 y > 1,8 × 10–3 mm2/s, respectivamente). Los tumores con > 30% de la totalidad del tumor con curvas tipo I son benignos, los tumores malignos pueden tener zonas aisladas del CIT tipo I, que corresponden con zonas no captantes, pero no superan el 30% de la extensión del tumor. Las curvas tipo II, aunque características de adenomas pleomorfos, también pueden encontrarse en tumores malignos; sin embargo, estos últimos muestran unos valores del CDA bajos o muy bajos que no se encuentran en los tumores benignos con curvas tipo II. Estos autores encuentran que todos los tumores con curvas tipo III son malignos. Las curvas tipo IV corresponden a tumores de Warthin o linfomas, y estos 2 tipos de tumores pueden fácilmente diferenciarse según el CDA. Así, los linfomas tienen CDA menores que los tumores de Warthin, es más, el tumor de Warthin presenta focos de alto CDA debido a la presencia de áreas quísticas no presentes en los linfomas que característicamente muestran CDA bajos o muy bajos en la totalidad del tumor. En estudios con PET y 18-fluorodeoxiglucosa, la captación es significativamente mayor en tumores malignos que en tumores benignos y procesos inflamatorios, exceptuando el tumor de Warthin24. La punción aspiración siempre se recomienda previa a la cirugía; sin embargo es una técnica dependiente del operador y no sólo depende de la experiencia del radiólogo que realiza la biopsia, sino también del patólogo que analiza la muestra. Si los resultados de la muestra no son concluyentes o son negativos no siempre garantizan un diagnóstico benigno. En un reciente trabajo con 245 muestras de masas en glándulas salivares mayores se obtuvo un 4,2% de falsos negativos en tumores malignos, aunque no hubo falsos positivos25. La sensibilidad y especificidad de esta técnica oscila entre el 88-93% y el 75-99%, respectivamente. La finalidad de este trabajo no es la revisión exhaustiva de todos los tumores benignos y malignos que pueden afectar a las glándulas salivares, por lo que sólo se van a exponer los tumores más frecuentes. Patología tumoral benigna primaria El adenoma pleomorfo, también denominado tumor mixto benigno, representa más de dos tercios de las neoplasias parotídeas benignas. Los adenomas monomorfos y los mioepiteliomas son los otros tumores benignos fre- 9-12 Capt 174 pag.indd 144 cuentes y pueden originarse tanto en la glándula parótida como en la submandibular, mientras que el oncocitoma es casi exclusivo de la glándula parótida. Los tumores de Warthin son exclusivos de la glándula parótida, ya que corresponden a tejido de conducto salival atrapado en ganglios linfáticos durante el desarrollo. Cuando en una glándula parótida se encuentran masas múltiples, generalmente se trata de adenopatías o de tumores de Warthin. Aunque no siempre es posible, hay algunos datos que ayudan a diferenciar tumores benignos o neoplasias de bajo grado de los tumores malignos. Como regla general, las neoplasias benignas tienen bordes lisos, bien definidos y captación homogénea de contraste, son de crecimiento lento e indoloras. Al contrario, las masas malignas son dolorosas, crecen rápidamente, presentan bordes infiltrantes, son heterogéneas por la presencia de áreas quísticas o necrosis, captan contraste de forma irregular y pueden presentar infiltración de tejidos vecinos. La presencia de infiltración cutánea, adenopatías locales o parálisis facial, son signos muy sugestivos de malignidad (tabla 1). El adenoma pleomorfo es el más frecuente de los tumores benignos originados en todas las glándulas salivales, tanto mayores como menores. Son tumores encapsulados, de bordes lisos y morfología redondeada u oval. Aparecen más frecuentemente en mujeres de entre 40 y 50 años como una masa indolora en la región parotídea. El término tumor mixto benigno, con el que también se conoce al adenoma pleomorfo, hace referencia a las características histológicas de estos tumores, que están compuestos de elementos mixtos epiteliales y mesenquimales (estroma). El estroma, a su vez, puede estar formado por elementos mucoides, fibroides, condroides y vasculares en proporciones variables26. Para recordar los datos epidemiológicos del adenoma pleomorfo es útil tener presente la regla del 80%: representa el 80% de los tumores del espacio parotídeo; el 80% se localiza en la glándula parótida y el 80% asienta en su lóbulo superficial. De todas maneras, este tumor también representa el 50% de los tumores submandibulares. Si bien el adenoma pleomorfo es un tumor solitario, no son infrecuentes las siembras multifocales por ruptura capsular inducidas por resecciones previas incompletas o biopsia. Las recurrencias son generalmente múltiples y agrupadas alrededor de la localización inicial de la tumoración. En ecografía se ve un tumor unilateral hipoecogénico con refuerzo acústico posterior (fig. 1). Pueden contener calcificaciones, y la mayoría tiene morfología lobulada y 26/4/12 18:34:37 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A C 145 B D 165 % 160 140 120 2 100 2 80 60 40 20 0 –11 1.938 8.000 16.000 24.000 32.000 35.892 Figura 6. Adenoma pleomorfo de glándula submandibular. Las imágenes con contraste T1 axiales (A) y coronales (B) muestran un realce heterogéneo de la señal en la tumoración. C) El mapa de CDA demuestra áreas de altos valores de CDA en la parte sólida captante de la tumoración (zonas rojas). D) La curva CIT es de tipo II con incremento ≥ 20% en la intensidad de señal y Tpic > 120 s es una curva de ascenso lento en la captación que se mantiene en el tiempo. apariencia homogénea6. Se ha descrito también como hallazgo característico unos márgenes bien definidos y delimitados por una banda lineal altamente ecogénica4. En ecografía Doppler, los adenomas pleomorfos se caracterizan por vascularización ausente o escasa y de localización periférica (fig. 1)4,6. En la TC y la RM, los tumores de pequeño tamaño son, generalmente, homogéneos, de alta densidad respecto a la grasa de la parótida en la TC, hipointensos en secuencias T1 y característicamente muy hiperintensos 9-12 Capt 174 pag.indd 145 en secuencias T2 en la RM, debido al alto contenido mucoide del estroma. Un tumor salivar sólido muy hiperintenso en secuencias potenciadas en T2 es altamente sugestivo de adenoma pleomorfo (fig. 4). La captación de contraste tiende a ser tardía, por lo que es útil realizar series tardías tanto en la TC como en la RM o bien realizar estudios de perfusión dinámicos para valorar la curva de captación, que generalmente es de tipo II (fig. 6) y excepcionalmente de tipo III20. Cuando los tumores son de gran tamaño 26/4/12 18:34:38 Radiología de cabeza y cuello 146 A B C D Figura 7. Gran masa en el espacio parafaríngeo que corresponde a un adenoma pleomorfo. A) Corte axial de tomografía computarizada con contraste. Resonancia magnética sagital T1 (B), axial (C) y coronal (D) T1 con contraste y supresión de grasa. La tumoración es heterogénea y presenta zonas de hemorragia (flecha sólida) y quistes en su interior (flechas huecas), hallazgo frecuente cuando los tumores mixtos adquieren gran tamaño como en este caso. Los márgenes muy bien definidos y la ausencia de infiltración de estructuras adyacentes sugieren el diagnóstico de tumor benigno. pueden ser lobulados y heterogéneos por la presencia de quistes, hemorragia, grasa y calcificaciones; en estos casos puede ser difícil la diferenciación con tumores malignos (fig. 7). Son los tumores de las glándulas salivares que más frecuentemente calcifican, por lo que la presencia de calcio en un tumor en el interior de una glándula salivar favorece el diagnóstico de tumor mixto benigno25. Como regla general se debe considerar que si un tumor es multicéntrico, no ha sido operado previamente, tiene bordes infiltrativos o es hipointenso en T2, no corresponde a un tumor mixto benigno (fig. 3). 9-12 Capt 174 pag.indd 146 La transformación maligna aumenta con la duración del tumor, de forma que si no se trata un 25% de estos tumores desarrollarán una transformación maligna. Hay 3 tumores malignos asociados al tumor mixto benigno que incluyen el carcinoma ex adenoma pleomorfo, el tumor mixto maligno o carcinosarcoma, y el tumor mixto benigno metastatizante27. El carcinoma ex adenoma pleomorfo aparece sobre lesiones de muy larga evolución (10-15 años) y/o intervenidas en varias ocasiones, en las cuales pueden apreciarse áreas benignas y malignas, que corresponden fundamentalmente a adenocarcinoma, y se pueden mani- 26/4/12 18:34:39 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A 147 B Figura 8. Carcinoma ex adenoma pleomorfo. A y B) Cortes axiales poscontraste, en distintos niveles, correspondientes a un paciente operado en múltiples ocasiones de un tumor mixto recidivante de la glándula submandibular izquierda, que presenta una voluminosa lesión con captación heterogénea del contraste (flechas) y áreas de necrosis (estrellas), cuyo estudio patológico reveló un tumor mixto maligno. festar en los estudios de imagen como un tumor mixto, con características de muy baja agresividad mezcladas con áreas focales de aspecto mucho más agresivo o bien como lesiones agresivas con centro necrótico, paredes gruesas e irregulares y márgenes infiltrantes (fig. 8). Estos carcinomas son altamente metastatizantes y tienen alto índice de recidiva28. El carcinosarcoma es muy raro y con muy mal pronóstico. La variante metastatizante del tumor mixto benigno es la variante más rara, las metástasis se desarrollan a lo largo de décadas, son múltiples y afectan a cualquier órgano o tejido blando (fig. 9). En la evaluación radiológica de este tumor es importante determinar si afecta al lóbulo profundo de la parótida, ya que modifica el abordaje quirúrgico; en estos casos existirá una ampliación del espacio estilomandibular y un desplazamiento en sentido anteromedial de la grasa parafaríngea. Otro dato importante es determinar su relación con el trayecto intraparotídeo del nervio facial, ya que la cirugía debe evitar lesionarlo. El tumor de Warthin, también llamado cistoadenoma papilar linfomatoso, es el segundo tumor salival más frecuente (2-10% de los tumores parotídeos). Es una neoplasia frecuentemente quística, de crecimiento lento, que ocurre de forma prácticamente exclusiva en la parótida, y dentro de ella en la región inferior por detrás del ángulo de la mandíbula. La parótida es la última glándula en adquirir una cápsula; cuando lo hace, ya se ha desarrollado el sistema linfático y, por tanto, hay nódulos linfáticos en el interior de la glándula, algo que no ocurre con las otras 9-12 Capt 174 pag.indd 147 Figura 9. Variante metastatizante de tumor mixto benigno. Paciente intervenido de parotidectomía izquierda completa hacía 8 años por un tumor mixto benigno, que presenta una voluminosa adenopatía (flechas) bajo el lecho quirúrgico, correspondiente en el estudio histológico a una metástasis ganglionar de un tumor mixto benigno. 26/4/12 18:34:39 Radiología de cabeza y cuello 148 A B C Figura 10. Tumor de Warthin múltiple y bilateral. Imágenes axiales T1 (A), T2 (B) y T1 con contraste y supresión de grasa (C). Múltiples lesiones en la glándula parótida izquierda y una en el lóbulo superficial de la parótida derecha (flechas). Nótese que las lesiones, a diferencia del adenoma pleomorfo, son hipointensas en secuencias potenciadas en T2. 9-12 Capt 174 pag.indd 148 glándulas salivares mayores, que se encapsulan de forma más temprana en la embriogénesis, antes del desarrollo del sistema linfático, por lo que no tienen ganglios linfáticos intraglandulares. El tumor de Warthin se origina de tejido glandular salivar heterotópico presente en el interior de los ganglios linfáticos intra o periparotídeos. Este origen explica su localización, prácticamente exclusiva en la parótida y, dentro de ella, su preferencia por la región de la cola, donde son más abundantes los ganglios linfáticos26. Otro dato a destacar es que, aunque estos tumores tienen una localización intraglandular, pueden afectar también a ganglios periparotídeos y simular una metástasis ganglionar. Es el TGS que más frecuentemente se presenta como lesiones múltiples o bilaterales hasta en un 15% de los casos (fig. 10). Aunque clásicamente se consideraba un tumor típico de varones, en los últimos años se ha descrito una incidencia similar en ambos sexos. Además, se ha establecido su relación con el consumo de tabaco y con exposición a radiaciones ionizantes; es muy frecuente en la población asiática, especialmente en chinos13. Radiológicamente son lesiones de morfología ovalada, de márgenes bien definidos que ecográficamente se muestran como masas hipoecogénicas con múltiples áreas anecoicas en su interior como hallazgo característico6. En ecografía Doppler presentan, a diferencia del adenoma pleomorfo, múltiples estructuras vasculares intratumorales4,6. En TC son hipodensas y con intensidad intermedia tanto en secuencias en T1 como en T2 de la RM (fig. 11). Estos tumores son de pequeño tamaño (< 4 cm) y heterogéneos pero, a diferencia del adenoma pleomorfo, no calcifican. En algunas ocasiones aparece como dato característico la presencia de focos parcheados hiperintensos en T2 en el interior o en la periferia del tumor, debido a la existencia de pequeños quistes que lo rodean y que se encuentran en un 30% de los casos. La captación de contraste es intensa y asocia un lavado rápido (30-60 s) que se corresponde en los estudios dinámicos con una curva tipo IV y explica que en secuencias convencionales de RM obtenidas 3-5 min tras la administración de contraste, estos tumores presenten escaso realce20,29 (fig. 11). Muestran afinidad por el pertecnetato de 99mTC en las pruebas de MN. Si el diagnóstico histológico es definitivo, se puede mantener una actitud expectante, dado que el riesgo de degeneración maligna (carcinoma y linfoma) es un evento excepcional que ocurre en menos del 1%. Ante lesiones múltiples parotídeas uni o bilaterales, si el enfermo no ha sido intervenido previamente, el diagnóstico de tumor de Warthin es la primera posibilidad diagnóstica. También pueden ser causa de masas parotídeas múltiples los quistes linfoepiteliales en pacientes con sida, las adenopatías, la afectación parotídea del síndrome de Sjögren en estadios finales, el linfoma y enfermedades granulomatosas como la sarcoidosis. El oncocitoma y otros tumores epiteliales benignos como mioepiteliomas, adenomas monomórficos y adenomas de células basales ocurren también con mayor frecuencia en la parótida y en adultos mayores de 60 años. No tienen características de imagen específicas y el diagnóstico se realiza por biopsia o en la cirugía. El oncocitoma es el otro tipo 26/4/12 18:34:40 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A C 149 B D 124 % 120 110 2 100 90 2 80 2 70 60 50 40 30 20 10 0 –4 0 20.000 40.000 60.000 80.000 94.300 Figura 11. Tumor de Warthin. A y B) Masa hipointensa en secuencia de T2 situada en la cola de la glándula parótida izquierda (flecha) con pequeñas imágenes quísticas hiperintensas en la periferia de la lesión (flechas huecas). C) En secuencia de T1 con contraste el realce de la señal es poco intenso. D) En el estudio de perfusión con resonancia magnética la CIT muestra el aspecto típico de los tumores de Warthin con captación rápida e incremento de la señal > 20%, Tpic ≤ 120 s y lavado rápido > 30% (curva tipo IV). tumoral de las glándulas salivares que presenta afinidad por el pertecnetato de 99mTc en las pruebas de MN. Patología tumoral maligna primaria Los tumores malignos de las glándulas salivares representan un 1% de todos los tumores malignos de la cabeza y el cuello. La presentación clínica de un paciente con una 9-12 Capt 174 pag.indd 149 masa dura, generalmente dolorosa, en región parotídea o submandibular es muy sugestiva de tumor maligno. Si hay asociada una parálisis facial la sospecha debe ser muy alta. El tumor maligno más frecuente en la glándula parótida es el carcinoma mucoepidermoide, mientras que en las glándulas submandibular, sublingual y menores, es más frecuente el carcinoma adenoide quístico. Los carcinomas mucoepidermoides comprenden el 30% de los tumores malignos de glándulas salivares. Aunque 26/4/12 18:34:40 Radiología de cabeza y cuello 150 A B C Figura 12. Carcinoma adenoide quístico del paladar duro con invasión perineural. Tomografía computarizada con ventana ósea. A) Crecimiento en la región pterigopalatina (estrella) y extensión perineural a lo largo del nervio vidiano. Obsérvese la erosión de los márgenes óseos y el ensanchamiento del canal del nervio vidiano izquierdo (flecha horizontal) en comparación con el derecho (flecha oblicua). B) En la imagen se identifica la extensión perineural a través del nervio maxilar con ensanchamiento y erosión del agujero redondo mayor izquierdo (flecha curva), a comparar con el derecho (flecha recta). C) En la imagen se aprecia la fosa pterigopalatina izquierda ensanchada y ocupada (flecha curva negra) por un tejido de densidad muy superior a la grasa normal que ocupa la derecha (flecha recta negra). 9-12 Capt 174 pag.indd 150 suelen ocurrir en adultos de entre 35 y 65 años, también pueden presentarse en niños. Se originan más frecuentemente en la parótida o en glándulas salivares menores del paladar y mucosa. Admite un sistema de gradación entre tumores de bajo y alto grado en función de los hallazgos histológicos y este hecho explica que los hallazgos radiológicos dependan en gran medida del tipo histológico. Los tumores de bajo grado están bien definidos y tienen una apariencia radiológica similar a las neoplasias benignas (fig. 3), mientras que las lesiones de alto grado infiltran estructuras adyacentes y tienen márgenes imprecisos. En la RM presentan una intensidad de señal baja o intermedia, y no se debe olvidar evaluar la base de cráneo en busca de diseminación perineural a través del nervio facial o trigémino. Los de alto grado recurren hasta en un 70% de los casos, metastatizan a ganglios regionales en un 60%, dan metástasis a distancia en un 6% y tienen una mortalidad global del 60%26,27. Los carcinomas adenoides quísticos son los segundos tumores malignos en frecuencia en las glándulas salivares. Se originan fundamentalmente en la parótida, en la glándula submandibular y en el paladar. En la parótida tienden a manifestarse como lesiones benignas bien delimitadas, en cambio en las glándulas salivares menores el aspecto es más infiltrativo y tienen peor pronóstico. Tienen tendencia a crecer lentamente y a producir metástasis en ganglios linfáticos, infiltración ósea y metástasis a distancia, pero el dato más característico de este tumor es su tendencia a experimentar crecimiento perineural (50-60%), muchas veces salteado, sin continuidad, que puede llevar al tumor lejos de su origen, incluso dentro de la cavidad craneal a lo largo del trayecto de los pares craneales V y VII30. El crecimiento perineural debe buscarse por el radiólogo, ya que es habitual que no se sospeche en la exploración clínica por la dificultad para diferenciar signos clínicos que puede ocasionar el propio tumor sin este tipo de crecimiento. Por ello, es nuestra responsabilidad evaluar en todos los pacientes el trayecto de las posibles vías de extensión perineural: valorar adecuadamente el estado de los planos grasos que rodean estas raíces (fosa pterigopalatina, espacio entre los músculos pterigoideos medial y lateral, agujeros redondo mayor y oval, seno cavernoso y trayecto cisternal hasta el tronco en el caso del nervio trigémino, y grasa por fuera del agujero estilomastoideo y el trayecto intrapetroso del nervio facial para evaluar este último) (fig. 12). Hay que ser cuidadoso al evaluar los músculos, ya que un aumento de volumen y realce de su señal en T1 tras la inyección de contraste pueden presentarse en las fases precoces de la denervación y no deben confundirse con infiltración de éstos. Estos hallazgos, mucho más evidentes en la RM que en la TC, deben obligarnos a insistir en localizar áreas de crecimiento perineural. Tampoco debemos confundir el crecimiento perineural con la infiltración y destrucción ósea directa desde el tumor primitivo (fig. 13). El carcinoma de células acinares se presenta, generalmente, como masa indolora de lento crecimiento. Mas del 90% se localiza en la parótida; las glándulas salivares menores son la segunda localización y sólo de forma 26/4/12 18:34:40 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen A 151 A B B Figura 13. Carcinoma adenoide quístico de glándula parótida derecha con extensión directa a base de cráneo. A) Corte axial de tomografía computarizada con contraste intravenoso. El tumor sobrepasa la glándula y crece en la región preauricular (estrella) y en el espacio epidural de la fosa craneal media (flecha), después de invadir y destruir la escama temporal. B) Proyección axial con algoritmo para reconstrucción de hueso que demuestra una extensa destrucción de la escama (flecha pequeña) y de la porción mastoidea (flecha grande) del hueso temporal. excepcional aparece en las glándulas submandibular o sublingual. Es el tumor maligno que con mayor frecuencia es bilateral (fig. 14). Son lesiones que pueden ser quísticas y bien definidas, en cuyo caso el diagnóstico diferencial con los tumores benignos puede ser muy difícil. Hay múltiples variedades histológicas de tumores malignos, entre las que se incluyen el carcinoma ductal, poco frecuente pero muy agresivo, el adenocarcinoma, que tiene distinta apariencia y pronóstico según el grado histológico, 9-12 Capt 174 pag.indd 151 Figura 14. Carcinoma de células acinares múltiple. Resonancia magnética con secuencias en plano coronal T2 (A) y T1 con contraste y supresión de grasa (B). Se identifican 2 nódulos tumorales acentuadamente hipointensos en T2, de bordes imprecisos y que realzan su señal con el contraste. Además hay adenopatías periparotídeas (flecha hueca), lo que junto con la hipointensidad en T2 confirma la sospecha de tumor maligno. y el carcinoma epidermoide, típico de varones mayores de 60 años y que se manifiesta como tumoraciones de muy rápido crecimiento adheridas a los tejidos blandos vecinos y a la piel27. Tumores benignos no epiteliales Las lesiones quísticas de las glándulas salivares mayores pueden clasificarse en quistes congénitos (quistes branquiales, linfoepiteliales o dermoides) y quistes ductales 26/4/12 18:34:41 Radiología de cabeza y cuello 152 A B Figura 15. Hemangioma intraparotídeo. Tomografía computarizada sin (A) y con contraste (B). Lesión nodular (flecha) bien delimitada, de contornos muy bien definidos y densidad mayor que la glándula en el estudio basal sin contraste, que capta el contraste intensamente de forma muy precoz y homogénea. (sialoquistes y ránulas). Los quistes de las glándulas salivares menores son mucoceles. En niños, una lesión quística intraparotídea puede ser un dermoide, un epidermoide, un quiste de inclusión, una malformación linfática, un quiste branquial o la infrecuente enfermedad poliquística. En adultos, la mayor parte de lesiones quísticas son tumores de Warthin o lesiones linfoepiteliales benignas asociadas al sida; ocasionalmente, algunos tumores malignos de bajo grado, como el carcinoma mucoepidermoide o el carcinoma papilar productor de moco, pueden presentarse como lesiones predominantemente quísticas1. 9-12 Capt 174 pag.indd 152 El hemangioma es un tumor benigno epitelial vascular y no una malformación vascular. Los hemangiomas son los tumores más frecuentes en la edad pediátrica, están presentes desde el nacimiento en un 40% de los casos, mientras que el 60% restante aparece en los primeros meses de vida. Son 5 veces más frecuentes en niñas. Los anteriores términos descriptivos, como capilar, juvenil o celular, están actualmente en desuso. La mayoría de los autores coincide en considerar los hemangiomas cavernosos como malformaciones venosas; de igual forma, los hemangiomas en mancha de vino de oporto se incluyen dentro de las malformaciones capilares. Los verdaderos hemangiomas tienen una fase proliferativa durante los primeros 12-18 meses de vida, durante la cual experimentan crecimiento, para regresar gradualmente durante los siguientes 6-10 años. Aproximadamente la mitad desaparece totalmente26. Pueden ser localizados o difusos, y se caracterizan por presentar una intensa captación de contraste. En la RM aparecen muy hiperintensos en secuencias T2 y, durante la fase proliferativa, presentan vacíos de señal por la presencia de alto flujo (fig. 15). Los flebolitos son excepcionales en los hemangiomas y en cambio son característicos de las malformaciones venosas. La ausencia de vacíos de flujo indica que el tumor está involucionando y que tiene escaso flujo. En el Doppler se caracterizan por ser masas heterogéneas, fundamentalmente hipoecoicas con espacios sinusoidales y con alta vascularización intratumoral6. Los hemangiomas pueden diferenciarse de una malformación arteriovenosa porque los hemangiomas tienen masa de tejidos blandos, mientras que no hay componente parenquimatoso asociado en las malformaciones arteriovenosas. Es difícil, sin embargo, diferenciar hemangiomas en involución de una malformación venosa de bajo flujo. Los lipomas son tumores de contenido graso, bien delimitados, que se localizan con frecuencia en los espacios periparotídeo y submandibular, incluso en contacto con la celda parotídea, pero menos frecuentemente dentro de las propias glándulas salivares. En la TC se presentan como lesiones muy bien delimitadas, a pesar de carecer de cápsula, debido a la característica densidad que presentan (–80/–120 UH) (fig. 16), aunque hay lesiones infiltrantes que, por lo tanto, presentan márgenes mal definidos e irregulares. Algunos lipomas benignos presentan bandas fibrosas y/o focos hemorrágicos, que pueden hacer difícil el diagnóstico y obligan a plantear el diagnóstico diferencial con los sumamente infrecuentes liposarcomas. Linfoma El linfoma en la glándula parótida puede ser primario o, lo que es más frecuente, secundario en los ganglios linfáticos intraparotídeos. El linfoma primario es de tipo MALT, afecta a las parótidas en un 80% de los casos y en un 20% a las glándulas submandibulares. Se caracteriza por una masa infiltrante que reemplaza el parénquima glandular, con señal intermedia tanto en T1 como en T2 en estudios 26/4/12 18:34:41 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen 153 A Figura 16. Lipoma intraparotídeo. Pequeña lesión redondeada, de contornos netos y muy baja densidad (flecha) en el espesor de la glándula parótida derecha. B de RM, y característicamente tiene valores muy bajos de CDA. El linfoma secundario también es raro, está descrito en un 1-8% de los linfomas sistémicos, suele ser del tipo no hodgkiniano y aparece como múltiples masas intraparotídeas, generalmente homogéneas y a veces con captación periférica en anillo (fig. 17). Hay una asociación entre el síndrome de Sjögren y la macroglobulinemia de Waldenström con el linfoma parotídeo secundario1,13,26. Invasión por tumores de vecindad Cualquier tumor maligno puede invadir directamente una glándula salivar vecina. Aunque no es frecuente, los carcinomas de células escamosas cutáneos pueden presentar invasión directa de la glándula parótida y los carcinomas de células escamosos del suelo de la boca invasión de la glándula submandibular. Aunque las imágenes de la TC pueden ser diagnósticas, en estos casos, es recomendable utilizar la RM, por su mayor capacidad de discriminación tisular, para completar las observaciones de la TC, ya que los impactos quirúrgico y pronóstico pueden ser suficientemente importantes como para justificarlo. Metástasis en ganglios intraparotídeos Figura 17. Linfomas de glándula parótida, estudios de tomografía computarizada con contraste. A) Paciente con extensa lesión que afecta a la práctica totalidad de la parótida, con captación homogénea de contraste que correspondió a un linfoma MALT primario de la glándula. B) Paciente con múltiples nódulos de tamaño variable en ambas parótidas, correspondientes a adenopatías intraparotídeas, que también asociaba voluminosas adenopatías cervicales y mediastínicas, diagnóstico histológico de linfoma no-hodgkiniano. A diferencia del resto de glándulas salivares, la glándula parótida se encapsula después del desarrollo del sistema linfático, por lo que es la única que presenta ganglios linfáticos (aproximadamente 20) en su interior, los cuales drenan la región superior y media de la piel de la cara y la amígdala palatina. Estos ganglios parotídeos drenan a la cadena yugular interna (nivel IIA) y a la región superior de la cadena espinal accesoria (nivel IIB). Los tumores malig- nos de la piel (melanoma y carcinoma de células escamosas) son los tumores que con más frecuencia metastatizan a estos ganglios (fig. 18). Otras neoplasias, especialmente carcinoma renal, pulmonar, de mama o tubo digestivo, también pueden metastatizar a los ganglios parotídeos o periparotídeos13,27. 9-12 Capt 174 pag.indd 153 26/4/12 18:34:42 Radiología de cabeza y cuello 154 A B Figura 18. Metástasis en ganglios intraparotídeos. Secuencia T2 con supresión grasa. A) Adenopatías intraparotídeas bilaterales de angiosarcoma de cuero cabelludo. B) Metástasis intraparotídea derecha (flecha) de melanoma del cuero cabelludo, con extensa necrosis central. Extensión tumoral Los tumores malignos de las glándulas salivares pueden extenderse siguiendo patrones comunes a los demás tumores malignos del organismo. Así, es poco frecuente encontrar diseminación a distancia en el momento del diagnóstico, salvo que éste sea muy tardío. Inicialmente, estos tumores tienden a invadir los tejidos vecinos, es decir, a crecer de forma local, primero dentro de la propia glándula y luego fuera de ella (fig. 15). Es frecuente que ocasionen metástasis regionales en los distintos grupos ganglionares linfáticos del cuello, comenzando por los más próximos. La diseminación hematógena suele ser más tardía y afecta, fundamentalmente, a pulmones y esqueleto óseo, aunque puede implicar a cualquier órgano1. El tipo más especial de extensión de los tumores de las glándulas salivares es a lo largo del trayecto de los nervios que pasan cerca de o por su interior. Este tipo de extensión puede ser continua o salteada, y debe ser investigada por el radiólogo, ya que difícilmente puede ser sospechada por el cirujano. Ya se ha comentado con anterioridad en el apartado del carcinoma adenoide quístico que éste es el tumor que más frecuentemente se complica con esta forma de crecimiento tumoral, aunque puede verse también en otros tipos histológicos. La RM es superior a la TC para localizar este tipo de complicaciones, pero una adecuada valoración de los espacios que recorren los nervios correspondientes, los orificios particulares de la base del cráneo, el seno cavernoso, las cisternas de la base y el tronco, resulta capital para una adecuada valoración de la presencia o ausencia de crecimiento tumoral perineural (fig. 12). Para terminar, otro tipo de extensión tumoral consiste en la invasión de las estructuras óseas vecinas (mandíbula, base del cráneo) 9-12 Capt 174 pag.indd 154 de forma directa desde los tumores originales (fig. 13). Este tipo de invasión tan sólo se produce en casos de tumores muy voluminosos y agresivos. El tumor con el que más frecuentemente se asocia es el carcinoma adenoide quístico, pero resulta posible también en otros tumores malignos. Bibliografía 1. Som PM, Brandwein MS. Salivary gland: Anatomy and Pathology. En: Som PM, Curtin HD, editors. Head and Neck imaging. 4th ed. San Louis, Missuri: Mosby; 2003. p. 2005133. 2. Yousem DM, Kraut MA, Chalian AA. Major salivary gland imaging. Radiology. 2000;216:19-29. 3. Alyas F, Lewis K, Williams M, Moody AB, Wong KT, Ahuja AT, et al. Diseases of the submandibular gland as demonstrated using high resolution ultrasound. Br J Radiol. 2005;78: 362-9. 4. Fodor D, Pop S, Maniu A, Cosgaria M. Gray scale and Doppler ultrasonography of the benign tumors of parotid gland (pleomorphic adenoma and Warthin’s tumor). Pictorial essay. Med Ultrason. 2010;12:238-44. 5. Gritzmann N, Rettenbacher T, Hollerweger A, Macheiner P, Hubner E. Sonography of the salivary glands. Eur Radiol. 2003;13:964-75. 6. Bialek EJ, Jakubowski W, Zajkowski P, Szopinski KT, Osmolski A. US of the major salivary glands: anatomy and spatial relationships, pathologic conditions, and pitfalls. Radiographics. 2006;26:745-63. 7. Howlett DC. High resolution ultrasound assessment of the parotid gland. Br J Radiol. 2003;76:271-7. 8. Dumitriu D, Dudea SM, Botar-Jid C, Baciut G. Ultrasonographic and sonoelastographic features of pleomorphic adenomas of the salivary glands. Med Ultrason. 2010;12:75-83. 9. Schick S, Steiner E, Gahleitner A, Bohm P, Helbich T, Ba-Ssalamah A, et al. Differentiation of benign and malig- 26/4/12 18:34:42 Tumores de glándulas salivares. Papel de las diferentes técnicas de imagen nant tumors of the parotid gland: value of pulsed Doppler and color Doppler sonography. Eur Radiol. 1998;8:1462-7. 10. Bradley MJ, Durham LH, Lancer JM. The role of colour flow Doppler in the investigation of the salivary gland tumour. Clin Radiol. 2000;55:759-62. 11. Lee YY, Wong KT, King AD, Ahuja AT. Imaging of salivary gland tumours. Eur J Radiol. 2008;66:419-36. 12. Beale T, Madani G. Anatomy of the salivary glands. Semin Ultrasound CT MR. 2006;27:436-9. 13. Madani G, Beale T. Tumors of the salivary glands. Semin Ultrasound CT MR. 2006;27:452-64. 14. Naganawa S, Ishihara S, Satake H, Kawai H, Sone M, Nakashima T. Simultaneous three-dimensional visualization of the intra-parotid facial nerve and parotid duct using a three-dimensional reversed FISP sequence with diffusion weighting. Magn Reson Med Sci. 2010;9:153-8. 15. King AD, Yeung DK, Ahuja AT, Tse GM, Yuen HY, Wong KT, et al. Salivary gland tumors at in vivo proton MR spectroscopy. Radiology. 2005;237:563-9. 16. Yu Q, Yang J, Wang P. Malignant tumors and chronic infections in the masticator space: preliminary assessment with in vivo single-voxel 1H-MR spectroscopy. AJNR Am J Neuroradiol. 2008;29:716-9. 17. Thoeny HC, De Keyzer F, Boesch C, Hermans R. Diffusionweighted imaging of the parotid gland: Influence of the choice of b-values on the apparent diffusion coefficient value. J Magn Reson Imaging. 2004;20:786-90. 18. Eida S, Sumi M, Sakihama N, Takahashi H, Nakamura T. Apparent diffusion coefficient mapping of salivary gland tumors: prediction of the benignancy and malignancy. AJNR Am J Neuroradiol. 2007;28:116-21. 19. Habermann CR, Arndt C, Graessner J, Diestel L, Petersen KU, Reitmeier F, et al. Diffusion-weighted echo-planar MR imaging of primary parotid gland tumors: is a prediction of different histologic subtypes possible? AJNR Am J Neuroradiol. 2009;30:591-6. 20. Yabuuchi H, Fukuya T, Tajima T, Hachitanda Y, Tomita K, Koga M. Salivary gland tumors: diagnostic value of gado- 9-12 Capt 174 pag.indd 155 155 linium-enhanced dynamic MR imaging with histopathologic correlation. Radiology. 2003;226:345-54. 21. Hisatomi M, Asaumi J, Yanagi Y, Unetsubo T, Maki Y, Murakami J, et al. Diagnostic value of dynamic contrastenhanced MRI in the salivary gland tumors. Oral Oncol. 2007;43:940-7. 22. Yabuuchi H, Matsuo Y, Kamitani T, Setoguchi T, Okafuji T, Soeda H, et al. Parotid gland tumors: can addition of diffusion-weighted MR imaging to dynamic contrast-enhanced MR imaging improve diagnostic accuracy in characterization? Radiology. 2008;249:909-16. 23. Eida S, Sumi M, Nakamura T. Multiparametric magnetic resonance imaging for the differentiation between benign and malignant salivary gland tumors. J Magn Reson Imaging. 2010;31:673-9. 24. Cermik TF, Mavi A, Acikgoz G, Houseni M, Dadparvar S, Alavi A. FDG PET in detecting primary and recurrent malignant salivary gland tumors. Clin Nucl Med. 2007;32:286-91. 25. Cho HW, Kim J, Choi J, Choi HS, Kim ES, Kim SH, et al. Sonographically guided fine-needle aspiration biopsy of major salivary gland masses: a review of 245 cases. AJR Am J Roentgenol. 2011;196:1160-3. 26. Mukherji SK, Chong V. Sublingual and submandibular space. En: Mukherji S K, Chong V, editors. Atlas of Head and Neck imaging. Nueva York: Thieme; 2004. p. 515-85. 27. Thoeny HC. Imaging of salivary gland tumours. Cancer Imaging. 2007;7:52-62. 28. Kato H, Kanematsu M, Mizuta K, Ito Y, Hirose Y. Carcinoma ex pleomorphic adenoma of the parotid gland: radiologic-pathologic correlation with MR imaging including diffusion-weighted imaging. AJNR Am J Neuroradiol. 2008;29:865-7. 29. Ikeda M, Motoori K, Hanazawa T, Nagai Y, Yamamoto S, Ueda T, et al. Warthin tumor of the parotid gland: diagnostic value of MR imaging with histopathologic correlation. AJNR Am J Neuroradiol. 2004;25:1256-62. 30. Maroldi R, Farina D, Borghesi A, Marconi A, Gatti E. Perineural tumor spread. Neuroimaging Clin N Am. 2008;18:413-29. 26/4/12 18:34:42 Radiología de cabeza y cuello 12 Patología vascular de cabeza y cuello M. de Juan Delago* y E. Granell Moreno Unidad de Neurorradiología, Servicio de Radiodiagnóstico, Hospital de la Santa Creu i Sant Pau, Universidad Autónoma de Barcelona, Barcelona, España Introducción Los términos utilizados para denominar este grupo de lesiones han sido siempre descriptivos, basados en el aspecto clínico, con poca correlación clinicopatológica. En el diagnóstico y tratamiento participan diferentes especialidades médicas y quirúrgicas; actualmente la radiología diagnóstica e intervencionista juega un papel trascendental. Los diversos especialistas utilizan términos que pueden ser muy diferentes para una misma lesión, de manera que hay dificultad para un correcto intercambio de información1. En muchas ocasiones los distintos especialistas desconocen las técnicas diagnósticas y terapéuticas disponibles. En 1982, Mulliken y Glowacki2, ante la confusión en la terminología utilizada para describir este tipo de lesiones, propusieron una clasificación basada en las características histológicas, reológicas y de comportamiento de éstas; establecieron 2 grandes categorias: hemangiomas y malformaciones vasculares. La ISSVA (International Society for Study of Vascular Anomalies, fundada en 1992 para el estudio multidisciplinar de estas lesiones), durante su reunión de 1996 adoptó dicha clasificación, que se ha ido ampliando al añadir hallazgos posteriores en diversos campos. Los tumores vasculares y las malformaciones vasculares se diferencian por su comportamiento biológico, su apariencia clínica y los hallazgos radiológicos y patológicos3. Los tumores vasculares crecen por proliferación celular, principalmente endotelial. Las malformaciones vasculares tienen el endotelio inactivo, sin capacidad de proliferacón, y se considera que son defectos localizados de la morfogénesis vascular, posiblemente por disfunción de las vías de regulación de la vasculogénesis. De esta forma, las malformaciones vasculares nunca pueden involucionar, persisten durante toda la vida, mientras que los tumores vasculares pueden persistir o regresar dependiendo del tipo. Tambien hay una gran diferencia entre la morbilidad de las diversas lesiones y su tratamiento. Las malformaciones vasculares se subdividen, según su hemodinámica y al tipo de vaso que predomina en ellas3-5 en: malformaciones de alto flujo y malformaciones de bajo flujo. Las malformaciones de bajo flujo se subclasifican en malformaciones capilares (MC), venosas (MV), linfáti- cas (ML) y mixtas, y las de alto flujo en malformaciones arteriovenosas (MAV) y mixtas. Las malformaciones mixtas están formadas por una combinación más o menos compleja de los subtipos anteriores, con vasos de 2 o más tipos en su composición (tabla 1). Esta subclasificación es útil, ya que el manejo de las malformaciones, tanto para su diagnóstico como para su tratamiento, es diferente dependiendo del subtipo. Muchas de las malformaciones de bajo flujo forman parte de síndromes clínicos que todavía se conocen por sus epónimos (Klippel-Trenaunay, Rendu-Osler-Weber, etc.). A partir de 1982 numerosas investigaciones biológicas han confirmado la diferencia entre los 2 grupos de lesiones vasculares. Los marcadores de proliferación celular, como la colagenasa tipo IV, el factor de crecimiento endotelial vascular, el factor de crecimiento fibroblástico básico y otros están elevados en los hemangiomas en proliferación y no en las malformaciones vasculares. Otros marcadores celulares, como el GLUT1 o la merosina, se encuentran sólo en los hemangiomas y no en las malformaciones vasculares6. El término hemangioma se ha sustituido por el de tumor vascular, que incluye otras lesiones con capacidad de proliferación. Queremos resaltar que hemangioma se ha utilizado como un término genérico para describir lesiones vasculares muy diferentes. El término hemangioma cavernoso continúa siendo usado incorrectamente para denominar anomalías venosas que no involucionan nunca y van creciendo gradualmente (tabla 1). Hay diversas teorías sobre la patogénesis de los hemangiomas, desarrolladas al valorar tanto factores extrínsecos como intrínsecos, celulares y genéticos de éstos. Actualmente se hipotetiza que el hemangioma infantil es fundamentalmente consecuencia de un exceso de angiogénesis (hemangiogénesis) y las malformaciones vasculares se producirían por errores en la remodelación vascular. Hay hallazgos que indican que algunas malformaciones vasculares podrían ser también dependientes de la angiogénesis. La existencia de formas hereditarias de malformaciones vasculares, que son raras, ha permitido una nueva visión del complejo proceso de la vasculogénesis y las vías moleculares que están involucradas en la formación de estas *Autor para correspondencia. Correo electrónico: [email protected] (M. de Juan Delago). 9-12 Capt 174 pag.indd 156 26/4/12 18:34:42 Patología vascular de cabeza y cuello 157 Tabla 1 − Clasificación actual de las lesiones vasculares Nomenclatura actual Terminología antigua Tumores vasculares Hemangioma de la infancia Superficial Mixto Profundo Hemangioma congénito RICH NICH Angioma en penacho Hemangioendotelioma kaposiforme Hemangioendotelioma de células fusiformes Otros hemangioendoteliomas raros Malformaciones vasculares Bajo flujo Malformación capilar Malformación capilar propiamente Telangiectasias Malformación venosa Malformación linfática Microquística Macroquística Malformación combinada o mixta (CV, CL, CVL, VL) Alto flujo Malformación arteriovenosa Fístula arteriovenosa Malformación arteriovenosa Malformación combinada o mixta (AVL, AVC, AVCL) Angioma fresa, angioma capilar Angioma tuberoso Angioma cavernoso Nevus flammeus, mancha vino de Oporto, mancha salmón, nevus telangiectásico Angioma cavernoso, linfangiohemangioma Linfangioma Higroma quístico Tabla 2 − Características de los hemangiomas y las malformaciones vasculares Hemangiomas Malformaciones vasculares En general no existe al nacer Femenino > masculino Más común en caucásicos Crecimiento rápido y regresión lenta Firme y gomoso Raramente lesionan el hueso GLUT1 positivo Siempre presente al nacer Igual ambos sexos Igual en todas las razas Crece progresivamente con la persona Compresible Puede producir hipertrofia y distorsión del esqueleto craneofacial GLUT1 negativo lesiones7. Se han identificado defectos genéticos en varios tipos de malformaciones vasculares (MV, malformaciones glomovenosas, etc.) que puede que permitan conocer cómo la alteración genética lleva a producir canales vasculares anómalos. La biología molecular podría cambiar completamente nuestros criterios de clasificación de varias malformacio- 9-12 Capt 174 pag.indd 157 nes vasculares. No sabemos si los mecanismos biológicos de las malformaciones vasculares esporádicas, que son las más frecuentes, son similares a las formas hereditarias. La historia y el examen físico de los pacientes con lesiones vasculares permiten llegar al diagnóstico exacto en la mayoría de los casos (tabla 2). En algunos pacientes se 26/4/12 18:34:42 Radiología de cabeza y cuello 158 Tabla 3 − Utilidad de los distintos métodos radiológicos y su valor para el diagnóstico de las lesiones vasculares Hemangioma infantil Malformación capilar Malformación linfática Malformación venosa Malformación arteriovenosa US TC RM, ARM Angiografía convencional +++ ++ – – ++ – – – ++ ++ +++ – ++ ++ ++++ – +++ ++ +++ ++++ ARM: angiorresonancia magnética; RM: resonancia magnética; TC: tomografía computarizada; US: ultrasonidos. Tabla 4 − Hallazgos en resonancia magnética de las principales lesiones vasculares T1 Hemangioma Masa tejidos blandos Iso o hipointensa “Flow voids” T2 Gd Masa tejidos blandos lobulada Hipointensa “Flow voids” Teñido intenso y uniforme Malformación venosa Isointenso al músculo Masa tejidos blandos septada Hiperintenso focal Hiperintenso si trombos “Signal voids” (si hay flebolitos) Teñido difuso, inhomogéneo y no muy intenso Malformación linfática Masa tejidos blandos Masa tejidos blandos septada Hiperintenso focal Niveles líquidos Teñido en anillo periférico y en los septos, o ausente Malformaciones arteriovenosas Teñido difuso variable Engrosamiento tejidos Hiperintenso variable blandos “Flow voids” “Flow voids” necesita un estudio radiológico para valorar la extensión de la lesión o para ayudar en el diagnóstico (tablas 3 y 4). Los ultrasonidos permiten determinar la extensión de la lesión, si es superficial y si en ella hay vasos arteriales y/o venosos y qué tipo de flujo tienen. Así, se pueden diferenciar las malformaciones vasculares de bajo flujo (anomalías venosas o linfáticas) de los hemangiomas infantiles. La mayoría de los tumores vasculares de la cabeza y el cuello son pequeños e invariablemente regresan espontáneamente. Los corticoides ayudan a una regresión más rápida, o estabilizan su crecimiento, sobre todo en los niños más pequeños y en los pacientes con lesiones grandes o que pueden producir secuelas por su localización. Por ejemplo, los que se extienden por los párpados y la órbita pueden producir ambliopía, astigmatismo, estrabismo, miopía, etc. En ocasiones, si no responden a los corticoides se utiliza vincristina asociada o alternando los 2 medica- 9-12 Capt 174 pag.indd 158 mentos para conseguir la regresión. En ocasiones también se utiliza interferón. Las ML o las MV se tratan con exéresis quirúrgica completa para que no recidiven o con escleroterapia solo, inyectando en su interior diversas sustancias (etanol puro, deoxiciclina, OK-432, etc.), o con escleroterapia para reducir la lesión antes de resecarla con cirugía. Es muy importante establecer un diagnóstico exacto de las distintas lesiones antes de iniciar el tratamiento, ya que si efectuamos un tratamiento inapropiado se consiguen malos resultados o incluso posibles complicaciones8. Tumores vasculares El hemangioma infantil o de la infancia es un tumor benigno, aparece pocas semanas o meses después del 26/4/12 18:34:42 Patología vascular de cabeza y cuello 159 Figura 1. Hemangioma infantil mixto, tiene componente superficial y profundo, “en barba”. Niño de 5 meses, debido a la infiltración orbitaria se inició tratamiento inmediato para evitar complicaciones oculares. A los 10 meses gran mejoría, puede abrir el ojo, ve y lo mueve bien. En resonancia magnética se demuestra el gran hemangioma bilateral. En la imagen coronal en T1 se demuestra realce muy importante y uniforme, se continúan viendo vasos en su interior. En la imagen axial en T2 con supresión de grasa, se ve la infiltración superoexterna de la órbita izquierda. No tiene malformaciones intracraneales. nacimiento, crece alcanzando su máximo tamaño hacia el año de vida (fase proliferativa) y luego regresa espontáneamente, lenta y constantemente, durante unos años (fase involutiva) hasta que la piel vuelve a ser casi normal. En ocasiones deja secuelas, con deformaciones y alteración en el color de la piel dependiendo, sobre todo, del tamaño que hubiera alcanzado el tumor (fase involucionada). Estas fases tienen una duración variable en cada paciente. Es el tumor más frecuente en la infancia, su incidencia es de un 10% al año de edad, predomina claramente en niñas con piel clara, aproximadamente 3-5/19,10. Su incidencia es mayor en los niños prematuros de muy bajo peso, por debajo de 1.500 g. El 50% ha regresado o involucionado a los 5 años y el 90% a los 9 años, y puede continuar mejorando hasta los 10 o 12 años. Estos datos permiten afirmar que un tumor que aparece en un adolescente o en un adulto no es posible que sea un hemangioma o un hemangioma capilar. Pueden aparecer en cualquier localización y ser únicos o múltiples (tabla 1). Su apariencia depende de su localización y se han subdividido en 3 subtipos: – Hemangiomas superficiales. Aparecen como lesiones aplanadas de color rojo intenso. – Hemangiomas profundos. Son como nódulos del color de la piel o azulados y son elásticos. – Hemangiomas mixtos. Son los más frecuentes, aparecen como tumoraciones de rojo intenso con componente superficial y profundo (fig. 1). 9-12 Capt 174 pag.indd 159 Se originan predominantemente en la piel, en cuaquier localización, pero también pueden originarse en la mucosa oral y genital, la órbita, la vía aérea y la parótida. La afectación visceral es infrecuente, pero cuando existe se comporta igual que en la piel con la evolución en 3 fases. Los huesos no se afectan, los llamados hemangiomas óseos corresponden principalmente a MV óseas. Hay un marcador inmunohistoquímico muy selectivo y altamente específico para el hemangoma, el GLUT1, que tiene una expresión muy alta en todos los estados del hemangioma infantil. Por tanto es de gran utilidad cuando el diagnóstico es dudoso; si la lesión no es GLUT1 positivo se puede afirmar que no es un hemangioma6, nunca se encuentra en otros tumores o malformacones vasculares. El 80% de los hemangiomas es único. La región de la cabeza y el cuello es la más comúnmente implicada. La mayoría son pequeños y no representan nigún peligro, por tanto se puede dejar que involucionen espontáneamente sin ningún tratamiento. Los hemangiomas pueden ser localizados, segmentarios, indeterminados y multifocales. Los segmentarios tienen una alta frecuencia de complicaciones y también de asociarse con otras anomalías8,9. Los hemangiomas cervicofaciales, sobre todo los que presentan una distribución “en barba”, cuando se extienden al centro y a los 2 lados de la cara tienen un riesgo de hasta el 63% de tener hemangiomas de vías respiratorias altas que produzcan sintomatología. 26/4/12 18:34:43 160 Radiología de cabeza y cuello Figura 2. Hemangioma infantil superficial. Niño de 6 meses, con infiltración de la órbita izquierda. En la tomografía computarizada se ve el hemangioma en el ángulo superoexterno del ojo izquierdo que produce desviación del globo ocular; por este motivo se realizó tratamiento con corticoides que mejoró rápidamente el tumor. En resonancia magnética se ve una malformación del hemisferio cerebeloso izquierdo. En la secuencia T1 coronal se ve una arteria trigeminal izquierda (flechas) (síndrome PHACES). Casos individuales de anomalías estructurales (cerebro, corazón, vaos y esternón) asociadas con hemangiomas se han publicado en la bibliografía11. En 1996 Frieden et al12 publican 2 casos y proponen el nombre de síndrome PHACE, epónimo que enfatiza los hallazgos de este síndrome neurocutáneo, en el que se asocian: malformaciones en la fosa posterior (P), hemangioma (H), anomalías arteriales (A), defectos cardíacos y coartación de aorta (C), y anomalías oculares (E). Posteriormente se ha añadido la S final (PHACES) porque hay pacientes que asocian defectos esternales y del rafe supraumbilical (S); en general, el síndrome se presenta incompleto (fig. 2). Cuando los hemangiomas cervicofaciales son grandes son más frecuentes en niñas (9:1) y, a menudo, se asocian a otras anomalías en el organismo9,13,14. El término hemangioma congénito se introdujo en 1996 para los tumores vasculares que están completamente desarrollados al nacer y no aumentan. Recientemente se ha reconocido la existencia de un tipo de hemangioma que está presente al nacer, se ha 9-12 Capt 174 pag.indd 160 llamado hemangioma congénito, que se comporta de forma diferente al hemangioma clásico o hemangioma infantil. Estos hemangiomas congénitos, según su comportamiento, se diferencian en hemangiomas rápidamente involutivos (RICH: rapidly involuting congenital hemangioma), que regresan completamente antes de los 14 meses (fig. 3), y hemangiomas no involutivos (NICH: non involuting congenital hemangioma), que tienen un crecimiento proporcional con el niño y no regresan. Los hemangiomas congénitos tienen similitudes histológicas con el hemangioma de la infancia, en cambio no se encuentra el GLUT1 en ellos. Como características radiológicas más llamativas están que en los hemangiomas congénitos se encuentran calcificaciones, que nunca se ven en los clásicos, y que se ven vasos de forma llamativa, especialmente venas, hecho que es poco frecuente en el hemangioma infantil15-17. Hay una forma rara de hemangioma, con presencia de lesiones múltiples de tipo miliar, que se conoce también como hemangiomatosis neonatal diseminada (DNH, de las 26/4/12 18:34:43 Patología vascular de cabeza y cuello 161 Figura 3. Estudio con ultrasonidos efectuado a finales del segundo trimestre del embarazo. Se encontró una lesión con múltiples vasos en su interior que sugiere un hemangioma en el cuero cabelludo. Imagen una semana después del nacimiento. En la imagen de la derecha, a los 2 meses y medio, prácticamente ya ha desaparecido la lesión espontáneamente. siglas en inglés), en la que los hemangiomas se desarrollan pronto despues del nacimiento y crecen rapidamente. Algunos combinan lesiones pequeñas y grandes en la piel, y tienen un riesgo mucho mayor de asociarse a hemangiomas viscerales, principalmente en el hígado. Todos estos hemangiomas suelen tener una evolución benigna sin tratamiento, con involución de los hemangiomas de todas las localizaciones. La involución suele empezar a finales del primer año13. Cuando los hemangiomas presentan signos de alarma por su tamaño, volumen o localización amenazando una función, los de párpado y órbita pueden producir ambliopía, astigmatismo, estrabismo, miopía, etc., y los de vías respiratorias pueden producir insuficiencia respiratoria grave. Los hay que pueden amenazar la vida por ser un tumor masivo, presentar ulceración con infección subsecuente, en alguna localización visceral con hemorragias recurrentes, fallo cardíaco congestivo por existir tumores grandes en niños pequeños, etc., requieren un manejo terapéutico activo y rápido. Estudio radiológico La resonancia magnética (RM) demuestra con exactitud la extensión e infiltración de los distintos planos tisulares. Los hemangiomas muestran una lesión lobulada con señal intermedia en T1 e hiperintensa moderada en T2. Las 9-12 Capt 174 pag.indd 161 imágenes de vacío de flujo en la masa tumoral o alrededor representan las arterias nutricias y las venas de drenaje que pueden estar dilatadas en la fase proliferativa (fig. 1). En los hemangiomas faciales grandes o segmentarios, la RM permite determinar con exactitud las posibles alteraciones vasculares o parenquimatosas cerebrales que los acompañan (síndrome PHACES) (fig. 2). Es muy importante determinar la extensión intraorbitaria del tumor ya que cuando existe puede interferir en la movilidad ocular y llegar a producir secuelas (figs. 1 y 2)5,18. La tomografía computarizada (TC) con multidetectores, con contraste en fase intermedia, permitirá demostrar los vasos aferentes y eferentes además de ver bien la extensión del hemangioma. El hemangioendotelioma es un tumor vascular invasivo infantil, característicamente la piel afectada está tensa, brillante y de color morado oscuro. En las lesiones grandes puede existir un área central blanda, sugestiva de hemorragia o necrosis tumoral. En la RM, en la secuencia T1 se ve una masa de tejidos blandos isointensa o hiperintensa comparada con los músculos adyacentes. En la secuencia T2 se ve hiperseñal con infiltración subcutánea. Se pueden ver focos de ausencia de señal (“signal voids”) en la secuencia eco de gradiente, que representan hemosiderina u otros productos de degradación de la sangre. En las imágenes T1 después de inyectar contraste se ve un realce difuso y heterogéneo en toda la masa tumoral. 26/4/12 18:34:44 162 Radiología de cabeza y cuello Figura 4. Síndrome de Sturge-Weber. Mujer de 16 años, con malformación capilar facial típica. En la tomografía computarizada se ven calcificaciones corticales occipitoparietales y frontales parasagitales derechas, el hemicráneo derecho también es menor. En resonancia magnética se ve atrofia cortical y craneal derechas. En la secuencia T1 tras la inyección de contraste, imágenes axial y sagital, se ve realce pial y asimétrico del plexo coroideo. Malformaciones vasculares Son lesiones con vasos displásicos, sin capacidad proliferativa, que se producen por una morfogénesis anómala de los vasos durante el desarrollo embrionario. Están presentes al nacer, no involucionan espontáneamente y crecen progresivamente por distensión de los vasos que las forman. Su prevalencia es muy inferior a la de los hemangiomas. Se pueden clasificar como lesiones de bajo o de alto flujo (tabla 1). Pueden ser únicas o múltiples. Si son múltiples suelen tener un carácter familiar y forman parte de síndromes malformativos complejos. Malformaciones capilares Las MC son malformaciones inactivas hemodinámicamente, de flujo lento, que afectan la red capilar de la piel y mucosas, y en ocasiones invaden las estructuras adyacentes más profundas, específicamente en la región facial. Hay 2 formas clínicas: una, la llamada MC propiamente, que son máculas no palpables, rosadas y de tamaño variable. Han recibido diversos nombres (mancha en vino de Oporto, etc.) y afectan al 0,3% de los recién nacidos, son de tamaño variable y están bien delimitadas. Las de localización segmentaria son frecuentes en la cara, suelen estar presentes al nacer y persisten a lo largo de la vida crecien- 9-12 Capt 174 pag.indd 162 do proporcionalmente con la persona. En la cara se pueden presentar en localización medial, que van perdiendo color y desaparecen, y lateral, que persisten en el tiempo. Según su localización pueden tener un carácter sindrómico y asociarse otras alteraciones: 1. S índrome de Sturge-Weber. Está causado por una mutación somática en el primordio neural anterior. Se asocia a una MC facial que siempre se localiza en el área V1, frente y párpado superior (territorio de inervación de la primera rama del nervio trigémino), aunque en ocasiones tiene una extensión mayor, y una angiomatosis leptomeníngea (malformación capilar o venosa en la pía) y/o anomalías oculares (glaucoma) ipsilaterales a la malformación. También es frecuente el angioma coroideo; los pacientes con este angioma prácticamente siempre tienen angiomatosis leptomeníngea. La angiomatosis cerebral es más frecuente en el lóbulo occipital, pero puede extenderse a otros lóbulos y en ocasiones es bilateral. Estos pacientes tienen crisis parciales focales de diverso tipo con un efecto devastador, ya que generalmente se inician muy pronto, antes del primer año de vida. Pueden tener déficit cognitivo y retraso mental, que suele estar relacionado con la existencia de crisis tempranas y su duración, y déficits focales. La angiomatosis con un drenaje venoso anómalo conduce a una disminución de la perfu- 26/4/12 18:34:44 Patología vascular de cabeza y cuello 163 Figura 5. Síndrome de Sturge-Weber. Niño de 4 meses, con malformación capilar en el territorio de distribución de la 1.ª rama del trigémino. En resonancia magnética, imágenes axial en T1 y coronal en T2 en las que se ve atrofia cortical difusa e importante en el hemisferio derecho. Imágenes axial y coronal en T1 con contraste, importante realce de la malformación pial y un discreto realce del plexo coroideo derecho. sión cerebral, que sería el mecanismo que produce el daño cerebral. Cuanto menor es la perfusión, mayor es el grado de atrofia, se asocian crisis más frecuentes y mayor duración de la epilepsia. Aproximadamente un 10% de los niños con MC en el área V1 tienen anomalía vascular leptomeníngea, hay mayor riesgo de que aparezcan estas lesiones cuando la malformación capilar tiene afectación bilateral, incluyendo las 2 áreas V1. El estudio con RM cerebral de los pacientes con este tipo de MC es importante, ya que si se demuestra la existencia de las lesiones leptomeníngeas se puede establecer un tratamiento profiláctico antiepiléptico para prevenir la aparición de crisis y, con ello, evitar los déficits cognitivos y motores secundarios19,20. En la TC se pueden ver las calcificaciones corticomedulares y piales asociadas a atrofia cortical focal de predominio occipital, con dilatación de surcos corticales y, 9-12 Capt 174 pag.indd 163 en ocasiones, asimetría craneal con menor tamaño del lado afectado; cuando más extensa es la calcificación mayor es la clínica neurológica (fig. 4). La RM permite demostrar con gran precisión la atrofia focal y su extensión, si se utiliza contraste se ve el realce de la angiomatosis leptomeníngea, hipertrofia del plexo coroideo homolateral con mayor realce de la señal, el plexo también puede estar más calcificado 20 (fig. 5). También se pueden ver venas periventriculares y transmedulares. Si se utiliza la secuencia de susceptibilidad (SWI) se pueden identificar perfectamente venas transmedulares aumentadas, venas periventriculares anómalas y anomalías giriformes en el córtex y en la unión entre la sustancia blanca-sustancia gris21 (fig. 6). Se ha visto que el grado de alteración de la sustancia blanca es directamente proporcional al déficit cognitvo. En otros pacientes se ven zonas de microgiria cuyo origen podría ser vascular. En algunos niños de menos de 26/4/12 18:34:45 164 Radiología de cabeza y cuello Figura 6. Síndrome de Sturge-Weber. Paciente de 14 años, que se estudia con resonancia magnética, incluyendo una secuencia de susceptibilidad. En secuencia T1 con contraste se objetiva realce de la angiomatosis cortical y de venas medulares, que atraviesan la sustancia blanca entre la pared ventricular y la zona corticomedular, y venas periventriculares. En la secuencia de susceptibilidad se ven mejor las imágenes de las venas, incluso la alteración cortical y pial. 6 meses se ha encontrado una mielinización acelerada del hemisferio afectado. 2. Forma familiar hereditaria con MC y malformación arteriovenosa. Es una nueva forma clínica y genética asociada a genes del cromosoma 5q. Las MC múltiples en varios miembros de una familia se pueden asociar a MAV dérmicas, en el sistema nervioso central (SNC) o en otros órganos22 (fig. 7). 3. Síndrome de Proteus. Hay otros síndromes complejos en los que no hay alteraciones craneocervicales asociadas: síndrome de KlippelTrenaunay; MC con hipertrofia; MC hipotrofia; facomatosis pigmentovasculares; MC lumbosacras, y disrafismo. La otra forma de MC son las telangiectasias: consisten en vasos capilares dilatados que aparecen como un punto rojo, o vasos capilares que irradian de un punto central o bien en forma de finas líneas rojas. Pueden ser congénitas o adquiridas. Hay algunas formas clínicas con entidad propia: – Cutis marmorata telangiectásica congénita (CMTC). – Síndrome de Adams-Oliver. – CMTC, macrocefalia y malformación del filtrum. – Síndrome de Rendu-Osler-Weber o telangiectasia hemorrágica hereditaria. Este síndrome es una enfermedad 9-12 Capt 174 pag.indd 164 hereditaria autosómica dominante, con penetrancia y expresividad variables, que tiene una amplia variedad de fenotipos. Se caracteriza por telangiectasias en la piel y mucosas, particularmente las nasales son responsales de epistaxis prolongadas y recurrentes23. En algunos pacientes se producen epistaxis incoercibles que no responden a ningún tratamiento medicoquirúrgico, produciendo grandes pérdidas de sangre y anemia importantes. En estos pacientes se utiliza la embolización de las telangiectasias por vía endovascular como tratamiento, que suele ser efectivo de forma inmediata pero en muchas casiones se repiten las epistaxis y es necesario proceder a embolizaciones repetidas. Por tanto, en este caso, la radiología tiene un papel no diagnóstico, sino terapéutico (fig. 8). En algunos pacientes con este síndrome se han encontrado malformaciones y fístulas arteriovenosas, de flujo rápido, en pulmones, cerebrales, medulares y en higado. En general, en las MC el estudio radiológico no es necesario para su diagnóstico, que se hace por la clínica y la exploración. En cambio es muy importante para ver si existen lesiones asociadas en el SNC, sobre todo en los síndromes en que éstas se asocian a las malformaciones capilares. 26/4/12 18:34:45 Patología vascular de cabeza y cuello 165 Figura 7. Forma familiar hereditaria de malformación capilar con malformación arteriovenosa en sistema nervioso central. Niña de 14 meses, con múltiples hemangiomas capilares. Una hermana de la niña, el padre y su hermano, entre otros familiares, tienen también malformaciones capilares múltiples. En la resonancia magnética (RM), realizada por la posibilidad de que existan malformaciones vasculares cerebrales en esta entidad, se ve una vena cortical muy dilatada, en secuencia T2, y una imagen sugestiva de fístula pial en una secuencia de angio-RM de flujo. Se confirmó la existencia de la fístula arteriovenosa con angiografía que se ocluyó o trató por vía endovascular. Malformaciones venosas Estas malformaciones son de flujo lento, por tanto inactivas hemodinámicamente, que se desarrollan en la parte venosa de la red vascular. Son las malformaciones vasculares más comunes. Histológicamente son vasos dilatados, de diverso diámetro, con una cantidad variable de músculo liso en la pared. En su luz, en ocasiones, se producen trombosis que con el tiempo se calcifican y forman los flebolitos. En casos raros, las cadenas vasculares están más agrupadas y pegadas unas a otras formando un “paquete” sin componentes del tejido normal del órgano en que asientan, entre ellas, en forma de nódulos bastante bien delimitados. Este tipo de malformación vascular venosa se llama a menudo “cavernoma” cuando se localiza en el SNC, y raramente se diagnostica como malformación vascular preoperatoriamente. La expresión clínica de la MV es la de una tumoración compresible de color azul oscuro que ya existe al nacer. Estas malformaciones se localizan en la piel y las mucosas aunque pueden extenderse a los tejidos blandos, fundamentalmente músculos, articulaciones y huesos y órganos 9-12 Capt 174 pag.indd 165 internos. Aumentan con maniobras de Valsalva y similares. La mayoría son únicas, con frecuencia de distribución segmentaria. Hay formas familiares múltiples, raras, aproximadamente un 1% del total. Las malformaciones extensas constituyen un problema funcional y estético por su aumento o dilatación progresiva a lo largo de los años, el aumento de estas lesiones es variable y aparentemente impredecible. La gran variabilidad de estas malformaciones afecta a su forma, extensión y número de lesiones4,8,24. Un cierto número de síndromes se han asociado o han sido confundidos con MV comunes, algunos son de presentación familiar y otros esporádicos. – Forma familiar de MV, malformaciones cutáneas y mucosas. Estos pacientes tienen MV múltiples y generalizadas en la piel, mucosas y en músculos, distribuidas aparentemente al azar. Como causa de esta rara malformación vascular familiar autosómica dominante se ha encontrado un gen mutado, localizado en 9p21. Su frecuencia es aproximadamente el 1% de todas las MV25 (fig. 9). 26/4/12 18:34:45 166 Radiología de cabeza y cuello Figura 8. Paciente de 57 años, con síndrome de Rendu-Osler-Weber de muy larga evolución, con epistaxis repetidas que se han tratado con medidas convencionales, con buen resultado. En las imágenes superiores se ven las telangiectasias múltiples linguales y nasales. Se le efectuó una angiografía de todas las ramas de la carótida externa bilateral y se embolizaron distalmente las ramas en las que existían anomalías. Abajo a la izquierda, fase arterial tardía, en el centro fase capilar de la serie angiográfica del lado derecho. A la derecha, fase tardía de la angiografía de control final de la embolización, en la que han desaparecido las alteraciones capilares. – Síndrome del nevus azul en tetina de goma (“Blue rubber bleb nevus syndrome” o síndrome de Bean). Es de presentación esporádica en la mayoría de pacientes, aunque en ocasiones es familiar. Hay múltiples MV de pequeño tamaño casi desde el nacimiento (fig. 10). Rápidamente aumenta su número, con los años aparecen por toda la piel y por el tracto gastrointestinal. Existen lesiones de 3 tipos: lesiones azul oscuro, a menudo lunares queratósicos, ampollas de color normal de la piel y grandes masas venosas, o venosas y linfáticas que parecen MV comunes. Un aspecto importante de estos pacientes es que sus lesiones del tracto digestivo pueden sangrar. Se han publicado lesiones viscerales en otras localizaciones: vejiga, cerebro, hígado, bazo, pulmón, corazón, etc. Todas las lesiones son MV y como tales se ven en los estudios con RM26. Estudio radiológico Figura 9. Forma familiar de malformaciones venosas múltiples cutáneas y mucosas. Mujer de 30 años. Antes de los 10 años empezaron a aparecerle múltiples lesiones vasculares por todo el cuerpo, subdérmicas y submucosas, con apariencia de malformaciones venosas, varias de ellas en cabeza y cuello. Imágenes axial y coronal de resonancia magnética en secuencia T2 con supresión de grasa. Se ven múltiples lesiones hiperintensas, algunas tabicadas (lengua, subglotis/tráquea, subdérmicas, musculares). 9-12 Capt 174 pag.indd 166 Las MV se ven en la TC como masas isodensas con la musculatura adyacente, que captan contraste de forma heterogénea y moderada. Si se efectúan cortes en fase tardía la captación es más homogénea, aunque no todas captan igual. Se localizan con más frecuencia en la zona de los músculos maseteros y pterigoideos. La presencia de flebolitos, en forma de pequeñas calcificaciones redondeadas en su interior, es un hallazgo muy específico (fig. 11). En RM, las MV se ven como masas bien delimitadas, algunas septadas, o difusas, dependiendo de su tamaño, 26/4/12 18:34:47 Patología vascular de cabeza y cuello 167 Figura 10. Síndrome de Bean. Niño de 4 meses, que al nacer tenía una gran malformación venosa frontal que le resecaron. A los 4 meses le ha vuelto a crecer. En ese momento tiene 118 malformaciones venosas en todo el cuerpo, la mayoría de pocos milímetros. Se esclerosó la malformación venosa, con inyección directa de etanol (segunda imagen de la izquierda) en 2 sesiones. Las imágenes de la derecha muestran el resultado. Como un compartimiento (imagen de la izquierda) drenaba al seno longitudinal superior, se resecó quirúrgicamente después de la esclerosis. hipointensas o de señal intermedia en T1 e hiperintensas en secuencias T218,27. Si hay flebolitos, sobre todo los de mayor tamaño, se ven como focos de hiposeñal en T1 y T2 (fig. 12). En ocasiones se ven zonas de hiperseñal en T1 y T2 que corresponden a focos de hemorragia o trombosis de relativamente poco tiempo de evolución, suelen coincidir con episodios de aumento brusco del tamaño de la lesión asociados a dolor (fig. 13). Con contraste se produce un realce en la lesión en la secuencia T1; este hallazgo diferencia las MV de las ML y de otras lesiones quísticas de cabeza y cuello (quiste tirogloso o branquial, etc.). Si se asocia el estudio con contraste a una secuencia de angio-RM vemos que el realce es tardío y coincide con la visualización de las venas (fig. 14). La angiografía convencional por vía arterial no se utiliza, ya que no se rellenan o lo hacen muy poco y en fase muy tardía. Es útil la flebografía por punción directa, a veces son necesarias varias punciones porque existen diversos compartimientos (fig. 15). Siempre es necesaria esta técnica cuando se van a realizar tratamientos esclerosantes. El tratamiento de estas malformaciones es quirúrgico o bien con esclerosis, por inyección de distintos materiales en su interior, o una combinación de esclerosis con resección posterior. Cuando son muy extensas o afectan a diversas estructuras el tratamiento no puede ser definitivo, pero se realiza de forma paliativa para eliminar el dolor o disminuir el tamaño si crecen mucho. 9-12 Capt 174 pag.indd 167 Figura 11. Malformación venosa. Mujer de 26 años, con una masa de lento crecimiento y compresible. Estudio de tomografía computarizada con contraste en 2 fases. A) Fase precoz, arterial tardía, ausencia de teñido, se ve una masa hipodensa comparada con el resto de estructuras del cuello, y 2 flebolitos en su interior. B) En una fase muy tardía, a los 12’ aproximadamente se ve una captación discreta, casi uniforme y algo menor que la de los músculos de alrededor. – Malformaciones glomovenosas. En esta malformación hay cadenas venosas anómalas que tienen varias capas de celúlas en sus paredes. En un 64% de los pacientes es hereditaria, autosómica dominante, con una gran penetrancia en las familias afectadas. La imagen en la RM es 26/4/12 18:34:47 168 Radiología de cabeza y cuello Figura 12. Malformación venosa, es la misma paciente que en la figura anterior. Resonancia magnética, imágenes sagitales en T1 y T2 con supresión de grasa, y corte axial en T2 con supresión de grasa. Se ve la lesión claramente delimitada en T2 con flebolitos y unos finos tabiques. Figura 13. Malformación venosa. Varón de 27 años, con una lesión ya conocida en la región masetera izquierda de crecimiento rápido. Resonancia magnética en secuencias T1 con isoseñal global con focos de hipo e hiperseñal, T2 con supresión de grasa (SG) hiperseñal difusa con tabiques y focos de hiposeñal, los focos de hiperseñal son difíciles de diferenciar en la hiperseñal difusa; y eco de gradiente (EG) hiperseñal difusa heterogénea con focos de hiposeñal también. La imagen es la de una malformación venosa con flebolitos y pequeños trombos. 9-12 Capt 174 pag.indd 168 26/4/12 18:34:48 Patología vascular de cabeza y cuello 169 Figura 14. Malformación venosa. Mujer de 32 años, con una masa multinodular blanda, visible, azulada y compresible en la fosa supraclavicular derecha que ha ido aumentando. En la tomografía computarizada con contraste se ve una masa que capta levemente, en fase tardía, con flebolitos. En resonancia magnética (RM) se ve muy bien la masa multilobular en secuencia T2 con supresión de grasa, arriba a la derecha; en el centro secuencia T1 se ve una zona isointensa con los músculos, con contraste se ve un discreto realce en la lesión. En la secuencia de angio-RM con contraste se nota su aparición en fase tardía, cuando ya se ven todas las venas. Figura 15. Malformación venosa en labio superior. Niña de 5 años, con malformación que le ha crecido progresivamente. Arriba, imagen de la lesión y de la flebografía por punción directa en distintos compartimientos. Se embolizó prequirúrgicamente y se consiguió una exéresis completa. 9-12 Capt 174 pag.indd 169 26/4/12 18:34:49 170 similar a la de las MV convencionales, afecta sobre todo a la piel y no suele penetrar en los músculos. – Síndrome de Mafucci. Malformaciones linfáticas Son malformaciones con vasos linfáticos hiperplásicos y aberrantes, vesículas pequeñas y bolsas grandes llenas de líquido linfático, rico en proteínas y eosinófilos. Estas malformaciones crecen proporcionadamente con la persona, pero pueden producirse crecimientos extraordinarios o rápidos por infecciones o hemorragias intralesionales. Pueden inducir sobrecrecimiento de los huesos subyacentes, y en la región cefálica producir asimetrías faciales con deformidades maxilares y mandibulares. Hay 2 formas clínicas: – ML macroquísticas (clásicamente higromas quísticos). Están constituidas por vasos linfáticos de gran tamaño. Se localizan preferentemente en el cuello, tórax y axila. La mayoría ya se nota al nacer pero pueden manifestarse durante la infancia. No hay diferencia entre sexos. A menudo se localizan por debajo del músculo milohioideo y aparecen generalmente en los triángulos cervicales anterior y posterior. – ML microquísticas (clásicamente linfangioma circunscriptum). Son agregados de vasos linfáticos. Clínicamente tienen forma de placas con vesículas claras, de contenido claro o hemorrágico, en la superficie. Los límites microscópicos de esta lesión no están bien definidos, pueden infiltrar distintos planos de los tejidos y compartimientos adyacentes, por lo que es difícil su extirpación completa. Son muy frecuentes en la mucosa bucal, de la lengua y los labios, generalmente por encima del músculo milohioideo, aunque también se originan en otras localizaciones de esta región. Una asociación de las 2 formas se encuentra en las que afectan al área orbitaria, donde pueden producir complicaciones visuales. Las afectaciones viscerales también suelen combinar las 2 formas, aunque suele predominar la microquística. En una serie de 145 pacientes, la localización más frecuente, 36,5%, es de la cabeza y cuello. Aproximadamente, un 75% es evidente antes de los 5 años28. Otras localizaciones frecuentes son las extremidades, la axila y el tronco. Las lesiones viscerales torácicas o abdominales fueron el 8%. En ocasiones se ven lesiones macroquísticas en ecografías fetales. Estudio radiológico En la ecografía, las macroquísticas se ven como quistes anecoicos multiloculados; las microquísticas son lesiones hipoecoicas heterogéneamente; en ninguna de las 2 se ve flujo. En la TC se presentan como masas hipodensas multiloculadas, sólo se aprecia captación discreta de los septos 9-12 Capt 174 pag.indd 170 Radiología de cabeza y cuello que separan las zonas quísticas en la forma microquística. Las macroquísticas son lesiones con hipodensidad en relación con los músculos y no captan contraste (fig. 16). En RM, las ML macroquísticas se ven como masas de diversa morfología, generalmente bien delimitadas con hiposeñal en T1 e hiperseñal en T2, situadas en las localizaciones apropiadas y no se produce realce de éstas al inyectar contraste. En las microquísticas y en las mixtas (micro y macroquísticas) se ven masas de bordes mal definidos que borran los planos musculares y grasos. En su interior se aprecian zonas hipointensas o isointensas en T1 e hiperintensas en T2 que corresponden a los quistes. Se realzan con contraste en la periferia y en los septos (fig. 17). El tratamiento de la ML es quirúrgico y se deben resecar completamente, ya que recidivan con facilidad. Las macroquísticas con una sola o pocas cavidades se pueden tratar con punción directa e inyección de sustancias esclerosantes, como el picibanil u otras, a la vez que se extrae parte del líquido linfático de su interior. Hay algunos síndromes que asocian ML: – Linfedemas. – Síndrome de Aagenaes o síndrome de colestasis-linfedema. – Síndrome de Hennekam. – Síndrome de Gorham-Stout. También conocido como enfermedad de los huesos evanescentes, producida por un proceso espontáneo que destruye los huesos. En la zona del hueso destruido hay numerosos canales vasculares dilatados, con sangre o linfa, que lo desmineralizan. Malformaciones arteriovenosas Son las menos frecuentes de las malformaciones vasculares. Existe una comunicación de calibre variable entre arterias y venas. Si la comunicación es única, o casi, se habla de fístula arteriovenosa y cuando hay numerosas fístulas en un nido capilar se habla de malformaciones arteriovenosas (MAV). Aunque están presentes al nacer, la fístula arteriovenosa tarda un tiempo en desarrollarse y no se hace aparente hasta la primera o segunda década de la vida. Es una malformación hemodinámicamente activa, de alto flujo. Nunca regresa ni involuciona. Cuando está completamente desarrollada pulsa, suele auscultarse un soplo, a veces fuerte y, generalmente, se ve un leve rubor o una mancha con tonalidades rojas variadas. Un 70% de estas malformaciones se localiza en la región de la cabeza y el cuello. Las que se localizan en la piel o los huesos de la cara pueden producir asimetría facial, hipertrofia gingival, sangrado peridentario e incluso úlceras mucosas. Su curso evolutivo es impredecible; la pubertad, un embarazo o un traumatismo pueden desencadenar su crecimiento o empeoramiento29-31. También puede acelerar su crecimiento un tratamiento inadecuado, por ejemplo con láser. Una 26/4/12 18:34:49 Patología vascular de cabeza y cuello 171 Figura 16. Malformación linfática macroquística. Joven de 15 años, que notó la aparición de una masa blanda en el triángulo posterior derecho del cuello. Dos años después nota que le ha aumentado y la tomografía computarizada confirma el hecho. Se resecó quirúrgicamente y la anatomía patológica confirmó la histología. exéresis incompleta o embolizaciones proximales pueden estimular un crecimiento importante de la lesión o producir complicaciones graves con el tiempo. Algunas MAV se encuentran formando parte de síndromes complejos: – Síndrome de Cobb. – Síndrome de Parkes Weber (en las extremidades). – Síndrome de MAV craneofaciales metamérico o CAMS. – Malformaciones combinadas. Estudio radiológico En los casos con sospecha de una MAV, el estudio de TC en general no aporta información útil, aunque permite hacer el diagnóstico diferencial con los hemangiomas y las MV. Si el examen se efectúa con una TC multidetector se puede hacer una angio-TC y se consigue una evaluación detallada de la malformación. La RM puede demostrar la existencia de hiposeñales lineales de los vasos con flujo rápido (imágenes alargadas con forma vascular, de ausencia de flujo, se ven negras), arterias y venas arterializadas. Estas imágenes se ven igual en las secuencias potenciadas en T1 y T2, con contraste puede haber un discreto realce de la señal en el tejido de alrededor de la lesión, los vasos no varían y mantienen la misma imagen (figs. 18 y 19). Los vasos 9-12 Capt 174 pag.indd 171 Figura 17. Malformación linfática mixta. Joven de 12 años, con masa en cuello ya operada parcialmente de pequeña en 2 ocasiones. Recidiva de la lesión. Tomografía computarizada y resonancia magnética con las características de una malformación linfática. 26/4/12 18:34:50 172 Radiología de cabeza y cuello Figura 18. Malformación arteriovenosa. Joven de 19 años, con una lesión en labio inferior que le ha ido creciendo poco a poco, en ocasiones nota pulsación y le ha sangrado varias veces por traumatismo, clínicamente parece una malformación arteriovenosa (MAV). Imágenes axiales de resonancia magnética (RM) en secuencias T2 con supresión de grasa, arriba derecha; T1 sin y tras la inyección de contraste. En todas las imágenes se ve la existencia de vasos de alto flujo dentro de una zona de aumento de tejidos blandos, que realza con contraste persistiendo en su interior la imagen de vasos de alto flujo. En la secuencia de angio-RM con contraste se ve también la imagen sugestiva de MAV, que se confirmó en la cirugía. se ven también en las secuencias eco de gradiente y en las secuencias de angio-RM de flujo. La angio-RM con secuencias de flujo o con contraste así como la angio-TC se pueden utilizar como única técnica de estudio y seguimiento en los pacientes que, bien por sus circunstancias clínicas (p. ej., paciente con multipatología) o porque sean muy extensas, y en personas mayores en que no se va a tratar la MAV, no es necesario ver la evolución exacta de la malformación. La angiografía convencional por vía arterial es la exploración de elección para evaluar de forma exacta los componentes de la MAV, el tipo de comunicación arteriovenosa, las venas de drenaje, la posible existencia de aneurismas de flujo asosiados, etc. antes de su tratamiento (fig. 19). En ocasiones se puede embolizar completamente una malformación y conseguir la curación definitiva o embolizar parcialmente para facilitar la exéresis quirúrgica posterior. Conclusión Es importante que aprendamos a reconocer los distintos tipos de lesiones vasculares que existen y que adapte- 9-12 Capt 174 pag.indd 172 mos nuestros informes y lenguaje al de la clasificación que hemos presentado, que hoy en día está universalmante aceptada. Se deben utilizar los términos tumor vascular y malformaciones vasculares y las correspondientes subdivisiones exclusivamente. Hay que abandonar los términos clásicos que no están aceptados en la actualidad, puesto que además de incorrectos inducen a equívocos en el diagnóstico y, por tanto, en el tratamiento. Esta clasificación y las denominaciones que utiliza permiten un diagnóstico exacto y con él se puede indicar el tratamiento correcto. Hay algunos pacientes con lesiones complejas, muchas veces mixtas, en los que puede resultar difícil llegar a un diagnóstico exacto. Los tumores vasculares, fundamentalmente los hemangiomas infantiles, en una gran proporción no necesitan tratamiento, ya que regresan espontáneamente. Los tratamientos de las anomalías vasculares se han ido haciendo más específicos en los últimos 30 años. Hoy existen indicaciones claras de embolización por vía arterial o escleroterapia por punción directa en casos seleccionados. Las técnicas quirúrgicas se han ido adaptando y personalizando a cada lesión. El desarrollo de la técnica láser ha supuesto un gran avance para el tratamiento de las MC. 26/4/12 18:34:51 Patología vascular de cabeza y cuello 173 Figura 19. Malformación arteriovenosa. Joven de 18 años. Antes de la adolescencia le apareció una lesión de características vasculares frontal izquierda, que le ha ido aumentando progresivamente. Nota un importante defecto estético aunque no le produce ninguna molestia física. Imágenes axiales de resonancia magnética en secuencias T1, T2 y eco de gradiente. Se hizo angiografía prequirúrgica, y en el mismo acto se embolizó por punción percutánea. Se realizó posteriormente la exéresis completa con mínimo sangrado. La revisión y puesta a punto de este tema ha sido posible por la existencia de un Comité de Hemangiomas y Lesiones Vasculares en nuestro hospital (creado a principios de 2003), con la participación multidisciplinar de dermatología, pediatría, radiología (diagnóstica e intervencionista), cirugía plástica, otorrinolaringología, cirugía vascular y, puntualmente, otros especialistas cuando lo requiere algún paciente en concreto. Este Comité está liderado por la Dra. Eulalia Baselga Torres, Cap Clínic de la Unitat de Dermatologia Pediàtrica, a la que agradecemos su colaboración y exigencia de precisión en nuestros diagnósticos, que ha hecho que cada día nos sintamos más implicados en este tema. Por supuesto le agradecemos expresamente que nos ceda las imágenes clínicas de estos pacientes, que nos permiten la comparación clínico-radiológica. Bibliografía 1. Hand JL, Frieden IJ. Vascular birthmarks of infancy: resolving nosologic confusion. Am J Med Genet. 2002;108:257-64. 2. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification base on endotelial characteristics. Plast Reconst Surg. 1982;69: 412-20. 3. Wassef M, Enjolras O. Les malformations vasculaires superficielles: classification et histopathologie. Ann Pathol. 1999;19:253-64. 9-12 Capt 174 pag.indd 173 4. Enjolras O, Mulliken JB. Vascular tumors and vascular malformations (new issues). Adv Dermatol. 1997;13:375-423. 5. Dubois J, Garel L. Imaging and therapeutic approach of hemangomas and vascular malformations in the pediatric age group. Pedatr Radiol. 1999;29:879-93. 6. North PE, Waner M, Mirezacki A, Mihm MC Jr. GLUT1: a newly discovered inmunohistochemical marker for juvenile hemangioma. Hum Pathol. 2000;32:11-22. 7. Cohen MM. Valculogenesis, angiogenesis, hemangiomas and vascular malformations. Am J Med Genet. 2002;108:265-74. 8. Ernemann U, Kramer U, Miller S, Bisdas S, Rebmann H, Breuninger H, et al. Current concepts in the classification, diagnosis and treatment of vascular anomalies. Eur J Radiol. 2010;75:2-11. 9. Chiller KG, Passaro D, Frieden IJ. Hemangiomas of infancy. Clinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex. Arch Dermatol. 2002;138:1567-76. 10. Baer AH, Parmar HA, DiPietro MA, Kasten SJ, Mukherji SK. Hemangiomas and vascular malformations of the head and neck: a simplified approach. Neuroimag Clin N Am. 2011;21:641-58. 11. Pascual-Castroviejo I. Vascular and non-vascular intracranial malformations with external capillary hemangiomas. Neuroradiology. 1978;16:82-4. 12. Frieden IJ, Reese V, Cohen D. PHACE síndrome. The association of posterior fossa brain malformations, hemangiomas, arterial anomalies, coarctation of the aorta and cardiac defects, and eye abnormalities. Arch Dermatol. 1996;132:307-11. 26/4/12 18:34:51 174 13. Frieden IJ, Haggstrom AJ, Drolet BA, Mancini AJ, Friendlander SF, Boon L, et al. Infantike hemangiomas: current knowledge, future directions. Proceedings of a Research Workshop on Infantile Hemangiomas. Bethesda, Maryland. April 7-9, 2005. Pediatr Dermatol. 2005;22:383-406. 14. Metry DW, Dowd CF, Barkovch AJ, Frieden JJ. The many faces of PHACES syndrome. J Pediatr. 2001;139:117-23. 15. Gorincour G, Kokta V, Rypens F, Garel L, Powell J, Dubois J. Imaging characteristics of two subtypes of congenital hemangomas: rapidly involuting congenital hemangiomas and non-involuting congenital hemangiomas. Pediatr Radiol. 2005;35:1178-85. 16. Enjolras O. Hemangiomes congénitaux. Ann Dermatol Venerol. 2003;130:367-71. 17. Mulliken JB, Enjolras O. Congenital hemangiomas and infantile hemangioma: missing links. J Am Acad Dermatol. 2004;50:875-82. 18. Dubois J, Garel L, Grignon A, David M, Laberge L, Filiatrault D, et al. Imaging of hemangiomas and vascular malformations in children. Acad Radiol. 1998;5:390-400. 19. Ville D, Enjolras O, Chiron C, Dlac O. Prophylactic antiepileptic treatment in Sturge-Weber disease. Seizure. 2002;11:145-50. 20. Boukobza M, Enjolras O, Cambra MR, Merland J. Síndrome de Sturge-Weber. Dones actuelles de l’imaginerie neuroradiologique. J Radiol. 2000;81:765-71. 21. Juhász C, Haacke EM, Hu J, Xuan Y, Makki M, Behen ME, et al. Multimodality imaging of cortical and white matter abnormalities in Sturge-Weber syndrome. AJNR Am J Neuroradiol. 2007;28:900-6. 9-12 Capt 174 pag.indd 174 Radiología de cabeza y cuello 22. Boon LM, Mulliken JB, Vikkula M. RASA1: variable phenotyp with capillary and arteriovenous malformations. Curr Opin Genet Develop. 2005;15:262-9. 23. Folz BJ, Wollstein AC, Lippert BM, Werner JA. Morphology and distribution of nasal telangiectasia in HHT-patients with epistaxis. Am J Rhinol. 2005;19:65-70. 24. Puig S, Casati B, Staudenherz A, Paya K. Vascular low-flow malformations in children: current concepts for classification, diagnosis and therapy. Eur J Radiol. 2005;53:35-45. 25. Boon LM, Mulliken JB, Enjolras O, Vikkula M. Glomuvenous malformation (glomangioma) and venous malformation: distinct clinicopathologic and genetic entities. Arch Dermatol. 2004;140:971-6. 26. Flis CM, Connor SE. Imaging of head and neck venous malformations. Eur Radiol. 2005;15:2185-93. 27. Kassarjian A, Fishman SJ, Fox VL, Burrows PE. Imaging characteristics of blue rubber bleb nevus syndrome. AJR Am J Roentgenol. 2003;181:1041-8. 28. Gimeno Aránguez M, Colomar Palmer P, González Mediero I, Ollero Capran JM. The clinical and morphological apects of childhood lymphangiomas: a review of 145 cases. An Esp Pediatr. 1996;45:25-8. 29. Enjolras O, Wassef M, Chapot R, editors. Color atlas of vascular tumors and vascular malformations. New York: Cambridge University Press; 2007. 30. Garzón MC, Huang JT, Enjolras O, Frieden IJ. Vascular malformations. Part I. J Am Acad Dermatol. 2007;56:353-70. 31. Enjolras O, Logeart I, Gelbert F, Lemarchaud-Venencie F, Reizine D, Guichard JP, et al. Malformations artériovenouses: étude de 200 cases. Ann Dermatol Venerol. 2000;127:17-22. 26/4/12 18:34:51 ACTUALIZACIONES SERAM Radiología de cabeza y cuello Radiología de cabeza y cuello Coordinadores: Radiología de cabeza y cuello (2012) Manuel de Juan Delago y Javier Azpeitia Armán 0-0 Portada OK 2012.indd 1 165 % 160 140 120 2 100 2 80 60 40 20 0 –11 1.938 8.000 16.000 24.000 32.000 35.892 26/4/12 18:30:33