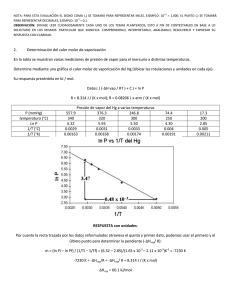
estados de la materia y cambios de fase
Anuncio
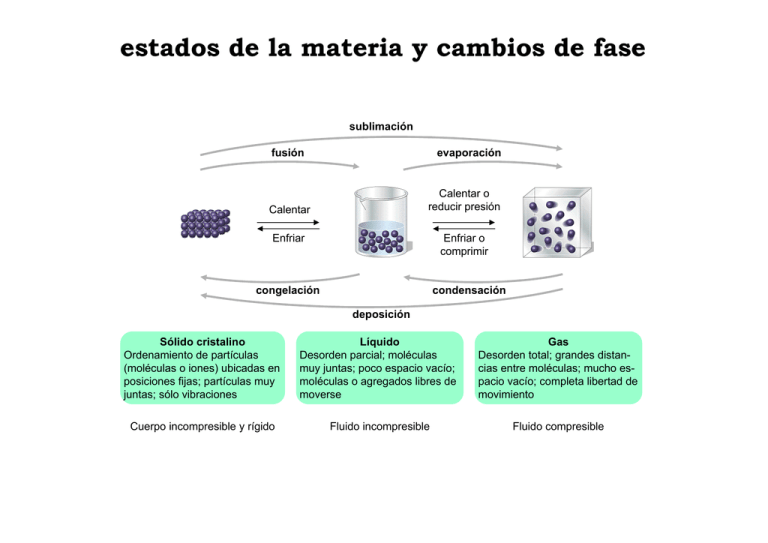
estados de la materia y cambios de fase sublimación fusión evaporación Calentar o reducir presión Calentar Enfriar o comprimir Enfriar congelación condensación deposición Sólido cristalino Ordenamiento de partículas (moléculas o iones) ubicadas en posiciones fijas; partículas muy juntas; sólo vibraciones Líquido Desorden parcial; moléculas muy juntas; poco espacio vacío; moléculas o agregados libres de moverse Gas Desorden total; grandes distancias entre moléculas; mucho espacio vacío; completa libertad de movimiento Cuerpo incompresible y rígido Fluido incompresible Fluido compresible Temperatura de ebullición normal (ºC) estados de la materia y cambios de fase H2O(s) H2O(l) diamante grafito Masa molar (g/mol) CO2(s) equilibrio líquido-vapor NaCl líquidos y sólidos CsCl sólidos cristalinos y fuerzas intermoleculares Sólidos moleculares Fuerzas de van der Waals, puente hidrógeno Punto de fusión menor que 300ºC: H2O, 0ºC; CO2, -78ºC Sólidos iónicos Unión iónica (algunas sales poseen fuerte carácter covalente) Punto de fusión alto (en especial iones pequeños y de alta carga) Sólidos covalentes Unión covalente Puntos de fusión muy altos + + + + + + + + + + + + + + + + + Sólidos metálicos Metales y aleaciones; alta conductividad eléctrica y térmica Puntos de fusión mayores para elementos de transición centrales equilibrio líquido-vapor 1 bar 60ºC 0,2 bar 60ºC 1 bar 100ºC 1 bar 100ºC 1.0 ln (P / bar) P / bar 0.0 P = A exp(- B / T) 0.8 0.6 0.4 0.2 -2.0 -4.0 ln P = ln A - B / T 0.0 0 50 60 T / oC 100 -6.0 0.0025 0.0030 (T / K)-1 0.0035 ecuación de Clausius-Clapeyron T 0 = ∆Gvap = ∆Hvap - T∆Svap (P y T constantes) ∆Svap(P1) = ∆Hvap / T1 Te P y T constantes Q P T ∆Svap(P2) = ∆Hvap / T2 ∆Svap(P2) − ∆Svap(P1) ≈ Svap(P2) − Svap(P1) = − R ln (P2/P1) R ln (P2/P1) = − ∆Hvap (1/T2 − 1/T1) Q ln P = ln A - B / T → B = ∆Hvap / R diagrama Presión-Temperatura P/bar 218 L 1 L punto crítico evaporación condensación L G S 0.006 G R ln (P2/P1) = − ∆Hvap (1/T2 − 1/T1) punto triple 0 0.0098 100 374 T/°C (273,15 K) (273,16 K) sublimación deposición S G Ecuaciones de ClapeyronClausius P / bar 1.0 R ln (P2/P1) = − ∆Hsub (1/T2 − 1/T1) 0.5 0.0 0 50 T / oC 100 fusión congelación dP / dT = ∆Svap / ∆Vvap = ∆Hvap / T∆Vvap ≈ ∆Hvap / TVG dP / dT ≈ ∆Hvap P / RT → ecuación de Clausius-Clapeyron L S dP / dT = ∆Sfus / ∆Vfus → ∞ Ecuación de Clapeyron diagrama Presión-Temperatura CO2 S 1288 73 5,11 1 P / bar líquido sólido vapor − 78,2 − 56,6 T / °C rómbico 25,0 31,1 líquido monoclínico 3,6 × 10−5 5,7 × 10−6 vapor 95,4 119 151 T / °C H2O P / MPa P / bar 67 L Ih líquido T / ºC G regla de las fases 1 fase (V = 2) P es 2 fas V=1 1 fase (V = 2) S s se a f 1) 2 = (V L s se ) a f 1 2 = V ( punto triple 3 fases (V = 0) G punto crítico (V = 0) 1 fase (V = 2) V=C–F+2–R V = no. de variables indep. C = no. de componentes (1) F = no. de fases (1 a 3) R = no. de restricciones (1 en el punto crítico) 1 fase (V = 2) T diagrama Presión-Volumen (diagrama de Andrews) P punto crítico L P1 L G T1 P1 T1 G T P P1 T1 V Punto crítico del benceno http://jchemed.chem.wisc.edu/jcesoft/cca/ CCA2/MAIN/BENZENE/CD2R1.HTM 300,7°C 307,4°C 309,2°C