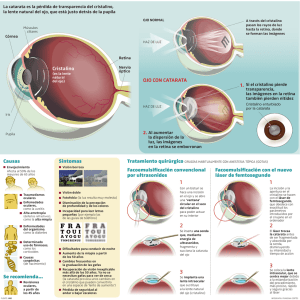
•008-fisiologia del cristalino.qxd
Anuncio

8 Fisiología del cristalino Sixto García-Castiñeiras INTRODUCCIÓN El conocimiento de la fisiología del cristalino constituye el pilar fundamental para entender posteriormente muchos de los procesos que puede sufrir con la edad. Las fases del desarrollo embrionario y los cambios observados en la organización de las estructuras cristalinianas a lo largo de la vida, los mecanismos que aseguran su transparencia y los que condicionan la pérdida de la misma son aspectos fundamentales que es necesario conocer. FUNCIONES DEL CRISTALINO La fisiologia del cristalino (Tabla I) está orientada hacia1-3: 1) El mantenimiento de su transparencia a la luz visible por largo tiempo, de modo ideal durante toda la vida del individuo; 2) Proveer un medio refractivo adecuado de alto índice de refracción, por encontrarse entre líquidos con índice de refracción mayor que el aire, y que disminuya las aberraciones ópticas de un lente grueso; 3) La conservacion de su poder de enfoque variable mediante el proceso de acomodación; 4) Permitir la supervivencia metabólica de su región central de fibras diferenciadas o maduras desposeidas de organelos subcelulares; y 5) Filtrar la luz ultravioleta que penetra al ojo, para evitar daño a la retina, sobre todo. La fisiopatología del cristalino está dominada por los procesos que llevan a la deficiencia o pérdida de la acomodación y la pérdida de su transparencia (cataratas). El desarrollo del cristalino está dirigido por una serie de factores de transcripción que se van expresando consecutiva y ordenadamente en sus células por influencia de los tejidos adyacentes1. Las células que formarán el cristalino proceden del ectodermo que cubre las dos vesículas ópticas que se están formando al mismo tiempo (Fig. 1), una a cada lado de la región frontal del embrión1,4. El ectodermo, en esta etapa, forma un engrosamiento, la placoda lenticular ectodérmica, que se invagina dentro de la vesícula óptica, y acaba independizándose del ectodermo para formar la vesícula lenticular. Es ésta una vesícula invertida donde, por tanto, todas las células tienen sus polos apicales mirando hacia el lumen de la estructura. Los polos basales de las células, por el contrario, constituyen la superficie externa de la vesícula y segregan una membrana basal. Las células epiteliales de la mitad posterior de la vesícula comienzan entonces a elongarse en dirección anteroposterior hasta que queda obliterada la luz de la vesícula. El proceso termina hacia el final del segundo mes de gestación5. DESARROLLO Y CRECIMIENTO DEL CRISTALINO Recordar cómo se forma y cómo crece el cristalino es fundamental para establecer las bases de su fisiología. Tras la aparente simplicidad de esta estructura tisular, exquisitamente transparente, hay una complejidad celular extraordinaria. Tabla I. Funciones fisiológicas del cristalino 1. 2. 3. 4. 5. Mantenimiento de transparencia Mantenimiento de un medio de alto índice de refracción Conservación de la acomodación Permitir la supervivencia metabólica de sus fibras Filtrar la luz ultravioleta Fig. 1. Etapas en el desarrollo del cristalino. A: placoda lenticular sobre la vesícula óptica. B: placoda lenticular invaginada, comienza a formarse la copa óptica. C: vesícula lenticular invertida ya formada e independizada. D: células posteriores comienza a elongarse para convertirse en la fibras primarias. E: las fibras primarias llenan la vesícula lenticular. F: las fibras secundarias desplazan hacia el centro el núcleo embrionario de fibras primarias, éstas ya han perdido sus núcleos; comienzan a formarse suturas con las fibras secundarias, éstas ya comienzan a aparecer diferenciadas a fibras maduras sin organelos celulares. Adaptada de: Jaffe9. 97 II. FUNDAMENTOS En esa etapa, el cristalino queda formado por una cubierta anterior sencilla de células epiteliales cuboidales y una masa posterior de células elongadas diferenciadas que se denominan las fibras lenticulares primarias, que constituyen el núcleo embrionario del cristalino adulto. Estas células perderán eventualmente todos sus organelos intracelulares4,5. A partir de este momento, el cristalino va a crecer continuamente en tamaño y número de células mediante la aposición de capas concéntricas de fibras lenticulares secundarias, derivadas de la capa germinativa del epitelio anterior, hasta formar la estructura adulta. Hay autores que describen al cristalino como formado por columnas de fibras aplastadas y colocadas una sobre otra radialmente (Fig. 2), y adosadas por sus lados estrechos unas a otras lateralmente4. Un corte transverso muestra que las fibras son más estrechas en el centro de la estructura que en la periferia, para acomodarse a la forma esferoidal del cristalino4. Esto parece estar relacionado con un tipo de compactación de las fibras más centrales, tal como se comentará más adelante. Otro mecanismo que tiende hacia el mismo objetivo es la fusión lateral de fibras en la región central y la presencia ocasional de células de sección pentagonal que reducen, a una, dos de las columnas radiales4. Las células de la parte anterior de la vesícula lenticular van a permanecer siempre como una monocapa de células más o menos cuboidales o aplastadas. Solamente una zona Fig. 2. Estructura del cristalino. Se presenta información de interés para la comprensión del texto, adapatado de otros autores. A: corte de la región ecuatorial del cristalino mostrando las relaciones de la cápsula, el epitelio anterior y el paquete de fibras secundarias, junto con las dimensiones de un corte transversal de estas fibras (adaptado de: Jaffe9). B: contraste entre la estructura desordenada a nivel de una sutura y el empacamiento hexagonal quasi cristalino de las fibras (adaptado de: Wanko T, Gavin MA. Cell surfaces in the crystalline lens. In: Smelser GK. The Structure of the Eye. New York: Academic Press; 1961: 221-233). C: Representación computerizada de la aposición de columnas radiales de fibras secundarias, mostrando una de las maneras en que las fibras se adaptan a la forma esferoide del cristalino, siendo más anchas en la periferia que en el centro (adaptado de: Kuszak JR, Zoltoski RK, Sivertson C. Fibre cell organization in crystalline lenses. Exp Eye Res 2004; 78: 673-687). 98 específica de esta monocapa, cerca del ecuador, retiene la capacidad de multiplicación celular y se llama la zona germinativa del epitelio. Las células de la región central del epitelio no se dividen normalmente pero pueden hacerlo ante determinados estímulos. En la zona germinativa las células entran en mitosis y se van desplazando hacia la periferia y transformándose en las llamadas células transicionales; esto crea una presión tisular que tiende a la expansión del ecuador del cristalino. Las células transicionales, en el ecuador, dan un giro de 180º reorientando su polo basal hacia atrás, al mismo tiempo que se inicia un proceso de diferenciación terminal/elongacion bidireccional durante el cual se cargan de las proteínas típicas del cristalino, las cristalinas. Al elongarse, el polo anterior de estas fibras secundarias se desliza entre las celulas del epitelio anterior y el núcleo embrionario. Por detrás, el polo posterior de la fibra se insinúa entre los polos posteriores del núcleo embrionario y la cápsula. El núcleo embrionario, por tanto, va acomodándose centralmente en el cristalino. Este proceso crea capa sobre capa concéntrica de fibras secundarias. Las fibras que se producen nunca se pierden, ya que quedan bajo las nuevas capas celulares que van apareciendo, así que las capas del centro son tan antiguas como el individuo y las más jóvenes son las capas concéntricas más superficiales. Las fibras se elongan hasta que sus polos se encuentran con el polo correspondiente de otra fibra, a nivel de una sutura. Poco después degradan sus organelos: el núcleo, las mitocondrias, el aparato de Golgi, y el retículo endoplásmico liso y rugoso. Solamente quedan los polisomas y las membranas plasmáticas1,5. Esta es una manera de contribuir a que la transparencia del cristalino perdure, al desaparecer centros potenciales de dispersión (scattering) y moléculas que absorberían luz visible. Por otro lado, las fibras se han cargado de las proteínas cristalinas, que van a establecer las bases estructurales de la transparencia del cristalino a largo plazo. Las fibras conservan su polaridad, no siendo equivalentes los extremos anteriores y los posteriores. El cristalino se ha tomado como modelo de envejecimiento y diferenciacion celular, ya que está constituido por un solo tipo de células en diferentes etapas de envejecimiento y diferenciación. En este sentido tiene una constitución única respecto a la pluralidad celular que existe en cualquier otro tejido. En el centro están las células más viejas y diferenciadas; por el contrario, en la corteza las más jovenes y en vías de diferenciación. Y en la periferia de la superficie anterior se encuentran las que comienzan el proceso de diferenciacion a diferentes edades. Por eso, la simple interpretación de que lo más viejo está en la región central del cristalino puede no ser estrictamente correcta en todas las circunstancias. Dentro de un mismo cristalino, cualquier capa o lamela de fibras puede verse desde dos puntos de vista: 1) El material depositado cuando el cristalino era más jóven (y una lamela más externa correspondería entonces a material depositado con el envejecimiento); o 2) El material más viejo, depositado allí hace más tiempo (y una lamela más externa correspondería a ma- 8. FISIOLOGÍA DEL CRISTALINO terial mas jóven, depositado hace menos tiempo). La primera alternativa tiene que que ver con desarrollo/diferenciación y la segunda con envejecimiento. Decidir entre ambas alternativas puede requerir una cuidadosa consideracion y un conocimiento profundo de la situación6. En el mecanismo de elongación, aunque disparado por factores de crecimiento procedentes del vítreo, parece que el estímulo inmediato es la retencion intracelular de K y Cl, que condiciona un aumento osmótico en el volumen celular y posiblemente modificaciones en el citoesqueleto1. METABOLISMO DEL CRISTALINO El metabolismo de las fibras del cristalino, a consecuencia de la desaparición de organelos, queda en situación muy precaria, ya que se hace completamente dependiente de los enzimas solubles del citoplasma, y dejan de sintetizarse proteínas nuevas que renueven las que se van modificando con el tiempo. Los enzimas del citoplasma solamente pueden utilizar glucosa a través de la vía denominada glicolisis anaeróbica, cuyo producto final es ácido láctico7. El rendimiento energético de esta vía (síntesis de ATP) es relativamente pequeño y puede conducir a la producción de un exceso de ácido láctico en un intento compensatorio. Por otro lado, las fibras centrales quedan dependientes para muchas funciones de las células de las capas más superficiales que aún conservan toda la maquinaria metabólica normal. Estas fibras en proceso de diferenciacion, y las células del epitelio anterior, producen CO2 y H2O y muestran un mayor rendimiento de ATP gracias a la presencia del ciclo de Krebs y la cadena transportadora de electrones en las mitocondrias. Como están limitadas a una estrecha franja cortical y, en gran parte, fuera del eje visual, estas células no suelen representar un problema de transparencia, a pesar de contener organelos y grupos cromofóricos mitocondriales. Transporte transepitelial en el cristalino El epitelio del cristalino se dispone como una barrera de una capa de células de espesor en su superficie anterior; controla muchos intercambios entre el humor acuoso y la masa de fibras del cristalino y, en última instancia, entre el humor acuoso y el vítreo. Por otro lado, genera y organiza las etapas de diferenciación/elongación que convierten a las células del epitelio en fibras maduras. Por similitud con otros epitelios y endotelios que separan compartimentos, el epitelio lenticular puede considerarse como una barrera capaz de transportar solutos y agua unidireccionalmente8. En barreras con estas características es la distribución asimétrica de la ATPasa Na/K-dependiente de las células la que permite el establecimiento de flujos unidireccionales y flujos netos a través de la barrera, bien sean de absorción o de secreción. En algunos casos tambien sirven para regular el contenido de agua de una matriz extracelular o tejido (por ejemplo, hidratación del estroma corneal). El propio cristalino podría utilizar este mecanismo para regular su volumen, ajustar la tensión de la cápsula o desencadenar otras respuestas. Las células que constituyen la barrera tienen un polo apical y otro basal, son polarizadas, como hemos mencionado. Según la ATPasa Na/K-dependiente se localice en el polo basal, predominantemente, o en el polo apical, predominantemente, el movimiento neto de transporte ocurrirá en una u otra dirección8. En células no polarizadas esto no ocurre porque la ATPasa se localiza con la misma densidad en toda la membrana plasmática de las células y su función básica es simplemente mantener Na bajo y K alto dentro de las células. 1. Localizacion de la ATPasa Na/K-dependiente del cristalino Este enzima se ha asociado definitivamente con el epitelio anterior del cristalino y las fibras ecuatoriales. En el cristalino, originado a partir de una vesícula invertida, hemos visto que las células de la media esfera posterior crecen hacia el frente, hasta que el vacío central de la vesícula desaparece y quedan con sus polos apicales enfrentados con los polos apicales de las células epiteliales, y con sus polos basales expuestos al exterior (humor acuoso por delante, cuerpo vítreo por detrás). La barrera, por tanto, es compleja, compuesta por la aposición de las células epiteliales anteriores y los polos anteriores de las fibras superficiales. La barrera, denominada EFI (epithelial-fiber cell interface) por algunos autores4,9, tiene la capacidad, en principio, de funcionar en ambas direcciones, dependiendo de cual sea la concentracióon relativa de ATPasa en los polos apicales del epitelio y de las fibras que interaccionan con el epitelio. Es razonable asumir que estas últimas tienen una menor densidad de enzimas ya que han expandido ampliamente su membrana durante el proceso de elongacion/diferenciacion. En esta barrera compleja la localizacion de la ATPasa Na/K-dependiente ha sido objeto de varias investigaciones, alguna de las cuales arrojan resultados contradictorios10. Uno de los trabajos que parece más convincente es, sin embargo, el de Unakar y Tsui11 de 1980, en el que se localiza histoquímicamente el enzima a base de precipitar con estroncio los productos de reacción (fosfato) usando NPP (nitrofenolfosfato) como sustrato para el enzima; es decir, se localiza propiamente la actividad enzimática, no la proteina. Según estos autores11, la Na/K ATPasa se localiza preferencialmente en las células del epitelio anterior, en sus membranes laterales y apicales, y en las células ecuatoriales. 2. Modelo de transporte transepitelial de Na y K Para efecto de los movimientos de Na y K creados por la ATPasa Na/K-dependiente usaremos la distribución apical 99 II. FUNDAMENTOS como modelo básico, junto con la conservación de la misma polaridad en las fibras. Esto quiere decir que la Na/K ATPasa no está limitada a las células del epitelio anterior exclusivamente sino que debe aparecer en los polos apicales y en las membranas laterales de las fibras subyacentes, es decir en las suturas anteriores y mitad anterior de estas fibras del cristalino, aunque en menor concentración. Es precisamente esta ATPasa la que podría aparecer como perteneciente «aparentemente» a la corteza o incluso al núcleo del cristalino cuando se estudia la distribucion regional del enzima12. La localizacion descrita de la ATPasa es compatible con un movimiento de Na neto hacia la parte posterior del cristalino y deplección de Na en la región anterior de la lente. El mecanismo inverso ocurriría para el K. Estos hallazgos han sido descritos en estudios de NMR del cristalino aislado de vaca13. Aceptando la localización apical predominante de las células del epitelio del cristalino se puede predecir un modelo de transporte en el cual el Na se mueve en dirección neta anteroposterior (Fig. 3). El trabajo de Fishbarg14 le ha dado apoyo experimental a este esquema de transporte transepitelial en el cristalino. La membrana basal de las células, es decir el polo opuesto a donde se localiza la ATPasa Na/K-dependiente, debe poseer transportadores Na-dependientes capaces de introducir sustratos contra gradiente de concentración en las células epiteliales en tanto se mantenga un gradiente de Na favorable (Na alto en humor acuoso, Na intracellular bajo). Este polo basal de las células, por tanto, permite la entrada por transporte activo secundario de los sustratos necesarios para el metabolismo del propio epitelio y de la masa de fibras del cristalino. En esta categoría podemos colocar aminoácidos9 y cualquier otro sustrato cuya transferencia sea Na-dependiente como, por ejemplo, el glutation15. También se pueden situar aquí transportadores independientes de Na para sustratos que no se mueven por transporte activo sino pasivo, como glucosa9 y dehidroascorbato16,17. Los sustratos que entraron a las células deben salir por difusión o difusión facilitada por el polo apical, hacia su destino en EFI. Y el Na que entró a las células es expulsado en el polo apical por medio de la ATPasa Na/K-dependiente, que así regenera una concentración intracellular baja de sodio necesaria para mantener los transportes activos. El bombeo de sodio inicia un movimiento osmótico de agua (y otros solutos, arrastrados en el flujo de agua, o flujo convectivo) hacia la parte central del cristalino que distribuye sus componentes por todo el espacio extracelular que rodea la masa de fibras del cristalino. Este esquema es conveniente para acelerar los procesos de transporte en el cristalino. Por ser éste un tejido avascular, por lo reducido y tortuoso de su espacio extracelular y por el espesor del propio cristalino2, cualquier proceso de difusión simple puede ser demasiado lento8. La existencia de flujos convectivos crea una corriente de líquido en la que moléculas importantes como glucosa, aminoácidos, GSH y dehidroascorbato, por ejemplo, pueden moverse con mucha mayor rapidez y llegar a las regiones centrales del cristalino con mayor facilidad. 100 Fig. 3. Representacion esquemática de la interfase entre el epitelio anterior del lente y las fibras diferenciadas de la corteza (EFI). Los puntos negros son ATPasa Na/K-dependiente. Los círculos con solo una flecha representan transporte facilitador de G (glucosa) y DHA (dehidroascorbato). Los circulos con dos flechas en la misma dirección representan transporte activo secundario, Na-dependiente de aminoácidos (AA) y glutation (GSH). Los cuadrados sólidos son ATPasa Ca-dependiente de la membrana celular. Dada la asimetría en la distribución de ATPasa Na/K-dependiente el movimiento neto de Na y agua es hacia la derecha de la figura. En el texto se ofrece información adicional. En la parte inferior se ve la actividad endocítica de la interfase. Comunicación entre células del epitelio anterior2,4,9 Estas células están comunicadas entre sí a través de uniones comunicantes (gap junctions) en las membranas laterales9, y parece que pueden regular su grado de apertura o acoplamiento. Los polos apicales de células adyacentes no tienen uniones estrechas (tight junctions, zonula occludens), por lo que debe existir una elevada permeabilidad paracelular (o sea, a través del espacio que queda entre las células). Así que ante las fuerzas osmóticas creadas por la ATPasa Na/Kdependiente apical debe alcanzarse el equilibrio rápidamente a través de la vía paracelular, creándose una corriente de agua en dirección anteroposterior. Las membranas laterales presentan muchos pliegues y también presentan desmoso- 8. FISIOLOGÍA DEL CRISTALINO mas (macula adherens). En otras palabras, pueden representar una zona de resistencia que dificulta que el flujo osmótico de agua ocurra hacia el humor acuoso, en dirección contraria al descrito. Comunicación intercelular en el cristalino2,4,10 Las fuerzas osmóticas que actúan sobre cualquier célula pueden tener consecuencias desastrosas para la transparencia del cristalino ya que tienden a romper su delicada estructura y crear zonas de índice de refracción diferente, si se dilatan los espacios extracelulares. Tradicionalmente, el cristalino responde a los cambios osmóticos del medio y posee los componentes de una disminucion regulatoria de volumen (RVD, regulatory volume decrease) y un aumento regulatorio de volumen (RVI, regulatory volume increase) que contribuyen a contrarrestar cambios en la osmolaridad del medio en que se encuentre el cristalino (ver más adelante). Pero el cristalino también puede disipar rápidamente diferencias de presión osmótica que pudieran crearse en su interior, mediante procesos de comunicación intercelular, que facilitan el movimiento de agua y sales, para evitar tensiones estructurales indebidas sobre sus fibras. Por otro lado, y sobretodo en la región central del cristalino, son necesarios mecanismos para hacer llegar de manera rápida sustratos metabólicos desde la periferia o eliminar desechos metabólicos hacia la periferia, dada la precariedad metabólica de esa región tan alejada de vasos sanguíneos. Por ambas razones, el cristalino es uno de los tejidos más ricos en uniones comunicantes (gap junctions) entre células y en poros acuosos que conectan el citoplasma de las fibras con el medio extracelular. Las uniones comunicantes están formadas por las proteínas denominadas conexinas. Las uniones comunicantes crean vías de comunicacion intercelular para muchas moléculas pequeñas sin casi gasto de energía. Los poros acuosos son canales en la membrana plasmática cuyo sustrato proteico son las aquaporinas18 (Fig. 4). Por mucho tiempo, se confundieron éstas con uniones gap especiales, pero su naturaleza es fundamentalmente diferente. Estos poros permiten que exista comunicación del citoplasma de las fibras con el medio extracelular, tanto para moléculas de agua como otras de bajo peso molecular1. Por tanto, permiten fenómenos de equilibración osmótica rápida y abren caminos para la difusión de colorantes inyectados dentro de una de las células del cristalino, que así se distribuyen directamente por el espacio extracelular10. Como consecuencia de esas amplias comunicaciones existe un grado elevado de acoplamiento entre células del cristalino10, tanto de tipo eléctrico/iónico como de transferencia de colorantes inyectados (amarillo Lucifer, por ejemplo). Estos colorantes pasan de una célula a otra, por las uniones comunicantes, o de una célula al medio extracellular, por los poros acuosos. El comportamiento de las uniones varía con su localizacion celular. Fig. 4. Canales en la membrana plasmática. Diferencias entre uniones gap y aquoporinas. 4.1. Modelo de union comunicante (gap junction). Estos canales se forman por la aposición de dos hemicanales, uno en cada membrana adosada; en la zona de la unión el espacio entre membrana y membrana se reduce a 3,5 nm; cada hemicanal se crea a base de 6 conexinas, cuya configuracion puede abrir o cerrar el canal (Tomado de: Borgnia18). 4.2. Disposicion en la membrana de una de las subunidades aquaporina para formar un canal central permeable a agua y otras moléculas pequeñas no cargadas. El esquema representa un único polipeptídico con seis tramos transmembranales. El canal, que recuerda a un reloj de arena, se forma con las regiones polipeptídicas que unen los tramos transmembranales 2-3 y 5-6 de la subunidad. En la membrana aparecen asociadas estas subunidades de cuatro en cuatro. 101 II. FUNDAMENTOS Las uniones de tipo comunicante son típicamente sensibles al potencial eléctrico en la vecindad, al pH y a la concentración de Ca++. La acidificacion y el aumento de Ca++ son agentes desacoplantes (cierran las uniones), por lo general, así como los cambios en el potencial eléctrico de ±40 mV; por el contrario, cAMP, ATP y la fosforilización son agentes acoplantes (abren las uniones). Todos ellos pudieran actuar en el cristalino, aunque se desconocen los detalles funcionales específicos. Las uniones comunicantes predominan en la región central de las fibras, siendo escasas en los extremos. En las membranas laterales de las fibras hay abundantes poros acuosos muy densos en las capas superficiales, no en las profundas. En los extremos de las fibras se ven estructuras que revelan actividad endocítica4,10. Comunicación entre células epiteliales y fibras superficiales (EFI) A nivel de esta interfase, identificada previamente, no hay evidencia de comunicación intercelular del estilo que acabamos de describir en las fibras del cristalino, basada en abundantes uniones comunicantes y poros acuosos. Son raras aquí estas estructuras. Por el contrario, los intercambios parecen tener lugar estrictamente a través de transportadores específicos en ambas superficies de la interfase y con participación del espacio extracelular. Sí parece existir mucha actividad pinocítica y endocítica, lo cual sugiere fenómenos especializados de transporte por transcitosis cuyo significado aun se nos escapa4,10. donde el acoplamiento en las fibras maduras depende solo de Cx46. Los canales que forma ésta son insensibles a pH, permanenciendo abiertos en medio ácido. Esta Cx46, pues, sería una conexina estable de larga vida, destinada a quedarse muchos años en la región nuclear del cristalino. Aquaporinas Las aquoporinas (Fig. 4.2) constituyen canales específicos para agua y pequeñas moléculas en todos los tejidos18. Se pudo demostrar, en el cristalino, que una de las proteínas de la membrana de las fibras más abundante, MIP 26, por tiempo considerada como una union comunicante especial, no pertenecía a las gap junctions clásicas sino a las recién descritas aquaporinas formadoras de canales de agua entre el medio extracelular y el citoplasma. Especificamente se denomina AQP0 a la proteína de las fibras del cristalino. En el epitelio anterior se expresa AQP1, mucho más permeable. En el proceso de diferenciación de las fibras, la AQP1 se pierde y se sustituye por la AQP0. En el centro del cristalino hay variantes de AQP1 modificadas postsintéticamente1. Se conoce la estructura de AQP1, proteína intrínseca que cruza seis veces la membrana y tiene dos regiones conservadas que no llegan a cruzar la membrana cada una de ellas pero se yuxtaponen en el grosor de la membrana para formar un poro acuoso. La configuracion de la estructura se parece a la de un reloj de arena (hour glass), en la que el estrangulamiento central es precisamente el poro acuoso18. Regulación del volumen del cristalino20,21 Conexinas Las conexinas (Fig. 4.1) son las proteínas que constituyen las clásicas uniones comunicantes (gap junctions)19. En zonas de aposición de la membrana plasmática de dos células hay estructuras proteicas enfrentadas que pueden constituir un canal que comunica el citoplasma de una célula con el citoplasma de la otra. Cada estructura proteica es aproximadamente cilíndrica y está compuesta de 6 subunidades que cruza de lado a lado cada una de las membranas. Ante el estímulo configuracional adecuado, el canal central puede abrirse o cerrarse. Cuando se abre, ambas células quedan comunicadas (acopladas). Si el canal central se cierra las células quedan desacopladas. A través de estos canales hay comunicación de moléculas pequeñas, iones y agua, siendo impermeable para macromoléculas. En el epitelio cristaliniano se expresan las conexinas Cx43 y Cx501. Las células en diferenciación dejan de expresar Cx43, que se sustituye por Cx46, pero aún es detectable Cx50. Cx50 parece tener funciones adicionales como regular el crecimiento de las fibras y el grado de acoplamiento entre ellas. Finalmente estas dos Cx’s sufren modificaciones postsintéticas y Cx50 queda en una forma no funcional en la región nuclear, 102 Un aumento regulatorio de volumen (RVI, regulatory volume increase) ocurre tras exponer células a una solución hipertónica que las encoje de manera aguda. La respuesta celular incluye la incorporacion de Na y K al interior celular a través de varios mecanismos de transporte: 1) Intercambiador de Na/K; 2) Canales de Na; 3) Cotransportador de Na/K/2Cl; y 4) Captacion Na-dependiente de móleculas pequeñas (osmolitos orgánicos) como taurina, glutamato, GLICINA, alanina (aminoácidos no esenciales), myo-inositol, sorbitol, creatina, y otros. La disminución regulatoria de volumen (RVD, regulatory volume decrease) ocurre tras exponer células a una solución hipotónica que las hincha agudamente. Incluye pérdida de K y de Cl a través de varios mecanismos y canales (cotransporte electroneutro de K y Cl, intercambio acoplado de K/H y Cl/HCO3, canales de conductancia específica para K y/o Cl); y extrusión de osmolitos orgánicos. RVD conduce a la subida de concentración intracelular de Ca. Fenómenos de adaptación más rapidos pueden ocurrir gracias al acoplamiento de las células del cristlino y a la existencia de uniones comunicantes y poros acuosos, con el objetivo de que no se creen gradientes marcados de molaridad en el espesor del cristalino. 8. FISIOLOGÍA DEL CRISTALINO Regulación del pH intracelular Muchas de las funciones celulares dependen de mantener un pH citoplásmico adecuado, por los efectos dramáticos que el pH puede tener sobre conformación de proteínas, actividad de enzimas y sobre muchas funciones celulares. El pH intracellular del cristalino es aproximadamente 7,1. El mismo se acidifica hacia la región interna, hasta 6,9 a nivel de las fibras de la corteza profunda2,3,22. Es posible que en el epitelio anterior y fibras corticales del cristalino el control del pH ocurra como en muchas otras células que producen CO2 y agua como productos finales del metabolismo. CO2 difunde fácilmente hacia la periferia, por ser un gas. El CO2 que se hidrata en presencia de anhidrasa carbónica, sin embargo, tiende a acidificar el medio y es necesaria la expulsion de H+ para equilibrar de nuevo el pH. Esto se logra por tres mecanismos principales23: 1) Intercambio de H por Na, que aprovecha el gradiente de Na para expulsar H de las células; el HCO3 que queda detrás alcaliniza el medio intracelular; 2) Otro mecanismo Na-dependiente también logra lo mismo, y es el intercambio de Cl por HCO3 Na-dependiente, que lleva a la entrada de bicarbonato al citoplasma; y 3) Existe otro tercer mecanismo que también aprovecha el gradiente de Na para alcalinización intracelular, el cotransporte de Na y HCO3. En el centro del cristalino el control del pH implica el manejo de ácido láctico, porque la masa de fibras diferenciadas sobrevive metabólicamente a base de glicolisis anaeróbica de glucosa. El producto final de este metabolismo es ácido láctico, que tiende a acidificar el citoplasma de las fibras y el medio extracelular. El cristalino, por tanto, mantiene un pH intracelular más ácido hacia las regiones centrales y más alcalino hacia la periferia. La única manera de deshacerse de ácido láctico es mediante difusion o difusion facilitada de las moléculas hacia la periferia, movimiento que, en efecto, tiende a diluirlo. En este sentido parece muy conveniente que en la región central del lente se mantengan las uniones comunicantes siempre abiertas, como indicamos previamente. Los protones producidos por láctico deben manejarse probablemente mediante los tres mecanismos ya mencionados. Existe una relación cercana entre control del pH y control del volumen celular. La acidificación indebida del citoplasma tiende a producir edema celular, quizás debido a un compromiso de la función de la bomba de Na/K, y por un mecanismo osmótico provocado por acumulacion de ácido láctico. Esto resulta en un aumento en el volumen celular y en un compromiso para su transparencia. Un intercambio Cl/HCO3 Na-independiente podria mediar la normalizacion del pH intracellular en caso de alcalinizacion. Permeabilidad de la cápsula del cristalino7,9 La cápsula del cristalino es la membrana basal de su epitelio, por lo que por delante deriva de la región basal de las células del epitelio anterior y por detrás deriva de los polos basales de las fibras del cristalino. Como las primeras se dividen continuamente, la cápsula anterior es más gruesa que la posterior, siendo la región capsular más joven la más próxima a la membrana basal de estas células. De hecho, la cápsula es la membrana basal más gruesa del cuerpo. Constituída por una malla no extensible de fibras de colageno parece dejar pasar no solamente agua, iones y sustancias de bajo peso molecular, sino proteínas de hasta 50.000 daltons. Esto excluiría albumina (60.000) y proteínas plasmaticas de PM mayor que albúmina, como transferrina. Debido a la importancia funcional de estas proteinas en los líquidos y tejidos oculares, los estudios de permeabilidad de la cápsula deberían ser replanteados, con técnicas más modernas y sensibles. Con el tiempo, en la cápsula del cristalino se forman entrecruzamientos moleculares típicos de colágeno24, que incluyen bitirosina, y que deben contribuir a mantener su inextensibilidad. ELECTROFISIOLOGÍA2,10,25,26 El comportamiento eléctrico del cristalino dio una apariencia engañosamente simple de este órgano con las técnicas clásicas habituales de registro. Los primeros electrofisiólogos que lo estudiaron encontraron que un electrodo insertado en cualquier parte del cristalino registra invariablemente el mismo potencial de reposo de unos -70 mV. Esto sugirió, desde el principio, que el cristalino era un tejido de naturaleza sincitial, con células que no se comportan individualmente sino con un grado elevado de acoplamiento eléctrico entre las mismas, cuyo comportamiento integrado daba el mismo potencial de reposo en todas ellas. Esto convertía al cristalino en una especie de gran céula, sin divisiones internas, y una polaridad anteroposterior en la que el epitelio permitiría controlar el paso de sustancias desde el humor acuoso hacia el vítreo. Este epitelio contenía la bomba (pump) capaz de expulsar Na hacia adelante y K hacia atrás, explicando que K fuera alto dentro del cristalino y Na bajo. Los gradientes de concentración así creados tenderían a disiparse a través de canales pasivos de conductancia (leak). Esta visión describe lo que es un modelo clásico de bombeo y fuga («pump and leak»)25. Técnicas electrofisiológicas más finas permitieron detectar la posición del electrodo en el espacio extracelular del cristalino, que debería acercarse a 0 mV, como caídas ocasionales rápidas del potencial de membrana a -30 mV. Esta dificultad en detectar espacio extracelular deriva del hecho de que el mismo, en el cristalino, es muy reducido, ya que representa menos del 1% del volumen del mismo, factor que facilita la transparencia al evitar espacios amplios con diferentes índices de refracción25. La inyección de colorantes también indicaba que las células están acopladas y se comunican unas con otras y el color podía difundir bien a lo largo de una fibra (movimiento preferencial), o bien de fibra a fibra adyacente (a través de uniones comunicantes). El colorante que era inyectado en el 103 II. FUNDAMENTOS espacio extracelular formaba otro patron (esférico), por difusión en el espacio extracelular. A pesar de la aparente simplicidad del cristalino, su electrofisiología se ha ido reconociendo cada vez como más compleja10. Su indudable naturaleza sincitial deriva, más que de la ausencia de membranas como se creyó en un principio, de la existencia de un sinnúmero de canales iónicos, bombas y transportadores insertados asimétricamente sobre una estructura citológica muy peculiar dotada de amplia comunicación intercelular y poros acuosos. Se han detectado corrientes eléctricas que se dirigen desde los polos anterior y posterior hacia el centro, desde el centro hacia el ecuador del cristalino y, finalmente, desde el ecuador a los polos del cristalino10. Los mecanismos iónicos responsables de las mismas no se han aclarado en su totalidad. Se cree que hay una conductancia elevada en la zona ecuatorial que dirige hacia afuera la corriente que cruza el cristalino, a través de uniones comunicantes concentradas ahí, junto con el hecho de ausencia de ATPasa Na/K-dependiente en el centro del cristalino, y concentración alta de este enzima en la región ecuatorial26,28. La proposición de los autores es que esas corrientes y circuitos pudieran tener como base movimientos de Na, con lo que se favorecería el movimiento de líquido dentro de la tortuosa estructura del espacio extracelular del cristalino con una finalidad única: crear un sistema microcirculatorio interno que compense el hecho de que el cristalino es avascular. En su última formulación, el modelo trabajaría así25: Na entra en el espacio extracelular desde la superficie total del cristalino, penetra las fibras a través de canales no identificados y luego camina de fibra a fibra a través de uniones comunicantes hacia la superficie, movido porque la conductancia (permeabilidad) de las uniones comunicantes aumenta hacia la superficie en el ecuador. El agua sigue el movimiento de los iones para mantener la presion osmótica. La ATPasa Na/K-dependiente superficial concentrada en el ecuador se encarga de mantener el flujo de Na hacia afuera, que queda disponible para un nuevo ciclo circulatorio. Es crítico para el modelo profundizar en la correlación entre las corrientes detectadas y los movimientos iónicos, y definir la orientación de la ATPasa Na/K-dependiente tanto en cuanto a localización como en cuanto a polaridad del bombeo. Entre este modelo y el modelo de transporte transepitelial descrito al principio, no basado en electrofisiología, hay sin duda, similitudes interesantes, particularmente en lo que se refiere al movimiento activo de Na desde la superficie anterior del cristalino hacia el centro. Es necesario continuar estos estudios desde varios puntos de vista y sobre diferentes modelos para decidir las mejores alternativas funcionales. lar la actividad de numerosas proteínas, canales, enzimas, kinasas, etc. La concentración de Ca libre (Ca2+) en el citoplasma de una célula oscila entre 10 y 100 nM, mientras que en el medio extracelular es de 1-2mM27. Existe, por tanto, un enorme gradiente de concentración favorable para que pase Ca a través de la membrana plasmática hacia el interior de las células. Son varios los componentes que intervienen en la creación y el mantenimiento de estos desequilibrios tan marcados respecto a Ca. Existen dos mecanismos activos de expulsión de Ca de las células. El primero esta mediado por la ATPasa dependiente de Ca de la membrana plasmática (PMCA, Ca-ATPasa plasmática), que maneja Ca con gran afinidad y puede crear gradientes grandes de concentración. Este es un sistema de transporte activo primario, directamente energizado por ATP. El segundo esta mediado por el intercambiador de Ca por Na (Ca/Na), que permite la salida de 1 Ca en contra de gradiente en intercambio por una entrada de 3 Na a favor de gradiente, siendo el sistema de gran capacidad, es decir, que puede mover cantidades grandes de Ca rápidamente. Este es un sistema de transporte acttvo secundario, energizado por el gradiente de Na/K. La entrada de Ca al interior celular se realiza a favor de gradiente de concentración, a través de varios canales presentes en la membrana plasmática, que se abren en virtud de interacciones específicas27. Normalmente el REP constituye un reservorio importante intracellular de Ca, donde Ca se encuentra a concentraciones parecidas a las que existen en el líquido extracelular. La ATPasa Ca-dependiente del REP (SERCA, sarcoendoplasmic reticulum Ca-ATPase, Ca-ATPasa reticuloendoplásmica) bombea Ca citoplásmico hacia dentro del REP, donde existen proteinas fijadoras de Ca que lo mantienen ligado. La salida de Ca del REP hacia el citoplasma es controlado por receptores específicos, uno de los cuales es el receptor de IP3 que, en presencia de su ligando IP3, abre un canal para el escape de Ca27. También intervienen las mitocondrias en la regulación del Ca citoplásmico27. La concentración intramitocondrial de Ca se mantiene normalmente alrededor de 100 nM. Cuando sube el Ca citoplásmico las mitocondrias incorporan Ca por medio de un transportador uniport de elevada afinidad que depende del potencial eléctrico de las mitocondrias (interior negativo). En adición, las mitocondrias contienen un intercambiador de Ca/Na, que hace salir Na hacia el citoplasma al tiempo que entra Ca. La mitocondria, por tanto, trabaja con el REP para mantener niveles citoplásmicos bajos de Ca. Se ha propuesto que también el compartimento nuclear puede efectuar cierto control independiente de la concentración de Ca. La variedad y eficacia de los mecanismos descritos que manejan el Ca intracelular permiten cambios muy rápidos de la concentración de Ca intracitoplásmico. Homeostasis del calcio27 Efectos patológicos del calcio Muchas de las células que responden a señales extracelulares utilizan a Ca como un segundo mensajero que puede provocar una variedad grande de respuestas intracelulares, al regu104 El Ca interviene en la regulación de numerosos procesos de señalizacion intracelular de gran importancia para las célu- 8. FISIOLOGÍA DEL CRISTALINO las, pero sus efectos patológicos se asocian más bien al efecto lesivo directo de la subida patológica de Ca en el citoplasma y activación de procesos destructivos que pueden conducir hasta muerte celular por necrosis y apoptosis27: formación de agregados moleculares, cambios en la permeabilidad de membranas, activacion de fosfolipasas y proteasas, como calpaínas, que degradan elementos del citoesqueleto y algunas cristalinas, e inducen membrane blebbing (ballooning) y agregación proteica. Las calpaínas también pueden activar proteasas que inducen apoptosis (caspasas), y endonucleasas envueltas en ese mismo proceso. Ca tambien puede actuar por defecto, en cuyo caso el bloqueo de sus funciones normales puede ser causa de serios problemas celulares. Homeostasis del calcio en el cristalino2,28-30 El potencial de reposo de las células del lente es de unos 70 mV, y el potencial de equilibrio de Nernst para Ca es de 125 a 200 mV. La discrepancia entre ambas potenciales nos indica la necesidad de mecanismos verdaderamente efectivos de transporte activo para la expulsion de Ca de la célula. La concentración intracellular de Ca libre (0,1-1,0% del Ca total) es del orden nM. El nivel de Ca en el humor acuoso es alrededor de 2 mM2. El cristalino no es una excepción a los fenómenos asociados con la homeostasis de Ca, pero lo es necesariamente de manera atípica, ya que solamente el epitelio anterior y las fibras corticales más superficiales poseen los organelos relacionados con la regulación de la concentracion intracelular de Ca, sobretodo el REP y las mitocondrias. Es en la región del epitelio anterior y fibras corticales donde los mecanismos de señalización en que interviene Ca deben jugar un papel importante. Las fibras ya diferenciadas de la región central del cristalino no poseen estos compartimentos, por lo que la concentración intracelular de Ca debe ser mucho más homogénea, pero más elevada28. Los efectos lesivos directos de Ca jugarían en estas circunstancias un papel dominante. Particularmente en lo que se refiere a destrucción/agregación de proteínas, destrucción de membranas y aparición de puntos de dispersión/opacificación. Estas fibras diferenciadas no poseen mecanismos de expulsion de Ca (ATPasa Ca-dependiente, intercambiador de Ca/Na) por lo que la región central del cristalino estaría en condiciones precarias para deshacerse del Ca y mantener una concentración citoplásmica de Ca muy baja29,30. Se ha propuesto que estas células dependen, para deshacerse del Ca, de fibras más externas corticales que poseen tanto ATPasa Ca-dependiente como el intercambiador Ca/Na, con las que están en contacto funcional, acopladas, a través de uniones comunicantes. La permeabilidad de estas uniones podría estar, como en otros tejidos, bajo el control de los niveles de Ca, aunque se desconocen los detalles en el cristalino. El transporte de Ca en el cristalino es un tema fisiológico de gran interés, ya que se ha documentado ampliamente que los niveles de Ca aumentan con la edad y en muchos tipos de cataratas, incluidas las seniles31,32. Oxígeno y el cristalino La presión parcial de O2 (pO2) en la cámara anterior del ojo, de promedio, es alrededor de 45-50 mmHg en varias especies animales incluyendo humanos33. El modo clásico de medir pO2 es con el método polarográfico utilizando un electrodo o microelectrodo de platino. Aunque con el uso de microelectrodos se pueden hacer algunas mediciones regionales dentro del ojo, el método polarográfico tiene el gran inconveniente de consumir oxígeno durante la medición y los microelectrodos son muy frágiles para penetrar tejidos duros como las cubiertas del ojo34. Helbig33 midió tal pO2, en humanos y durante cirugía de cataratas no complicadas en el momento en que se abre el globo ocular, y observó un promedio de pO2 en cámara anterior que va descendiendo desde el ángulo iridocorneal (44,9 mm Hg) hasta el centro de la pupila (13,5 mm Hg), pasando por 35 mm Hg en el borde del iris. Los vasoconstrictores reducen esos valores a aproximadamente la mitad en todas las posiciones. La distribución y respuesta a drogas adrenérgicas es compatible con la procedencia iridial del O2 del humor acuoso. Antes de extraer el cristalino, estos autores puncionaron su cápsula para obtener un valor promedio en la corteza superficial anterior de 2,5 mm Hg (entre 0,8 y 4 mmHg). Pocos estudios se han hecho con el método polarográfico con la pretensión de conseguir perfiles completos de [O2] dentro del ojo, pero algunos hallazgos se consideraban ya como bien establecidos antes de incorporar nuevos métodos al repertorio experimental: 1) La concentración promedio, ya mencionada, en humor acuoso de alrededor de unos 50 mm Hg; 2) Una concentración mucho más baja al acercarse a la superficie anterior del cristalino; 3) La procedencia del O2 de la cámara anterior es el humor acuoso, que recoje la aportación de los capilares del iris anterior y del cuerpo ciliar; no queda claro, sin embargo, si llega O2 atmosférico a través de la córnea. De hecho, se interpreta que los valores más altos de O2 bajo la córnea no son debidos a O2 precorneal sino al hecho de que el cristalino consume O2 y crea un gradiente en cámara anterior, quedando las pO2 más altas cerca de la córnea. La nueva generación de métodos de estudio se basa en el hecho de que la fluorescencia de ciertas sustancias (un complejo de ruthenium) es inhibida por O2 34. Una sonda o electrodo (optode, sensor de oxígeno de fibra óptica) conteniendo esas moléculas transmite, por medio de fibras ópticas, la fluorescencia a un detector donde se mide su intensidad y se convierte a [O2]. En ausencia de O2 la fluorescencia es máxima, en presencia de O2 la fluorescencia se reduce proporcionalmente a la concentracion de O2 en la muestra analizada. Estos métodos de medir oxígeno en el ojo son mas versátiles y permiten hacer exploraciones más detalladas y fiables de la distribución de O2 en los diferentes regiones oculares bajo diferentes condiciones fisiológicas y patológicas. Barbazetto34 es el primer autor que da valores de O2 dentro del cristalino in vivo en el conejo y encuentra que en el núcleo del mismo existen los valores más bajos del globo ocu105 II. FUNDAMENTOS lar, entre 9 y 10 mm Hg. En este estudio, los conejos están anestesiados y respirando aire a ritmo espontaneo. A lo largo del eje anteroposterior la pO2 pasa de un promedio de unos 29 mm Hg en mitad del acuoso a 22 mm Hg subcapsularmente y cae a 12 mmHg en el 1/3 anterior del cristalino y se estabiliza en 11 mm Hg en la región posterior del mismo. De cápsula posterior a vítreo casi no hay gradiente. Dentro del vítreo, la pO2 comienza a subir muy despacio al principio y luego mucho más rápido a medida que entramos en vítreo posterior hasta unos 26 mm Hg prerretinales y 40-60 mm Hg tocando la retina. El epitelio anterior del cristalino, por tanto, condiciona una caída marcada en el nivel de O2 dentro del cristalino, que no es simétrica ya que no se observa el fenómeno equivalente en la cara posterior del mismo. Los mencionados autores34 también verifican que la vitrectomía produce un duradero aumento (varias semanas) de concentración de O2 dentro del cristalino y en el vítreo, que puede ser más de dos o tres veces los niveles normales en ambas localizaciones. Esto se considera una buena razó para explicar la conocida asociació entre vitrectomí y catarata nuclear postoperatoria. En otro estudio35 detallado, practicado en conejos in vivo, se estudiaron los perfiles de pO2 intraoculares, pero sin penetrar en el cristalino. Recogemos algunos de los hallazgos. Los niveles de oxígeno fueron máximos en estructuras periféricas del globo ocular cercanas a las zonas vasculares del mismo (retina e iris), exhibiendo la córnea los niveles máximos. Todos los valores descienden hacia el cristalino. La superficie anterior del cristalino está expuesta a niveles mayores de O2 que su región ecuatorial y la región posterior. En la parte posterior del cristalino los niveles son de unos 6 mm Hg respirando O2 al 20% y unos 3 mm Hg respirando O2 al 1315%, al mismo ritmo respiratorio. No obtuvieron datos de concentración dentro del cristalino pero, presumiblemente, deben ser menores de 6 mm Hg. Los niveles altos de córnea no bajan al respirar O2 al 13-15% (hipoxia), sugiriendo su origen atmosférico precorneal. Los perfiles hallados se explican bien considerando que O2 entra primariamente al globo ocular desde los vasos retinianos e iridianos, asi como por difusión a través de la córnea central. Los autores35 parecen sugerir que la córnea central y la periférica no se comportan de la misma forma respecto a permeabilidad al O2. La distribución no uniforme de vasos en la retina da valores variables de concentracion de O2 en su superficie vítrea. Interesantemente, demuestran lo fácil que es modificar el perfil de pO2 dentro del ojo al variar la pO2 del aire que el conejo respira, y su frecuencia respiratoria. Para que las comparaciones sean válidas se debe exigir que estos parámetros respiratorios se tengan en cuenta. Shui35 también observa que tras vitrectomia los niveles de O2 suben en el vítreo a niveles de 72,4 y 78,6 mm Hg en la superficie posterior del cristalino, apoyando las conclusiones del estudio mencionado previamente. Usando un sistema in vitro (cristalino de vaca de 2 g incubado en una solución salina parecida al humor acuoso con 106 una concentración al 5% de O2, similar a la que rodea al cristalino in vivo), McNulty36 observa valores de 1-2 mm Hg en el núcleo del cristalino y, por tanto, gradientes corticales muy marcados respecto al baño. Estos son los niveles más bajos publicados en relación con el núcleo de todos los citados, pero las condiciones analíticas no son comparables. La conclusión general sobre pO2 en el cristalino es que, aunque los valores absolutos de pO2 dentro y en la superficie del cristalino varían según autores, son los más bajos del interior del globo ocular. Solubilidad de O2 durante cirugía ocular y otra implicaciones Dada la elevada concentración de O2 en el aire (21%, 155 mmHg) y la dependencia de temperatura de la solubilidad de los gases (la solubilidad aumenta al bajar la temperatura), se pueden dar situaciones especiales durante la cirugía oftálmica que conviene tener en cuenta para evitar la exposicion del cristalino y otros tejidos oculares a condiciones de estrés oxidativo evitable. Barbazetto34 describe que la solución salina BSS, usada para reemplazar vítreo, justo al abrir la botella muestra una pO2 de 70 mmHg a temperatura ambiente, lo cual refleja que fue autoclaveado. Expuesto el contenido al aire a temperatura ambiente, la concentracion de O2 sube hasta llegar eventualmente a 160 mm Hg en poco menos de 1 hora. Cuando se calienta a 39° C (temperatura corporal del conejo) la solubilidad disminuye y el exceso de O2 se libera hacia los tejidos incluído el cristalino, que es expuesto momentáneamente a concentraciones elevadas de O2. Se presume entonces que el ojo pueda estar expuesto a estos niveles de O2 durante la vitrectomía, con el consiguiente riesgo oxidativo. McNulty36 describe básicamente el mismo problema: si una solución salina (AAH) es enfriada temporalmente antes de ser usada en cirugía, se carga de O2, que luego, al calentarse en contacto con los tejidos, los inunda con O2 creando un riesgo evitable. Otra propiedad de O2 de interés fisiológico es que su solubilidad en solventes orgánicos es mayor que en soluciones acuosas. Las membranes celulares, por tanto, no son barrera para la difusión de O28; por el contrario, pudieran representar un medio preferencial de difusión. Esto explicaría la facilidad con que O2 difunde en el cristalino36, tan rico en membranes celulares, y que O2 hiperbárico conduzca a la formación de cataratas nucleares37. Peróxido de hidrógeno Desde finales de la década de los años 70 se ponían los niveles promedio de peróxido de hidrógeno en el humor acuoso de varias especies animales en el rango de 25 a 60 µM. Cuando se describió el hallazgo de niveles significativamente más altos en el humor acuoso de personas con cataratas se- 8. FISIOLOGÍA DEL CRISTALINO niles38, se comenzó a considerar seriamente la posibilidad de que H2O2 del humor acuoso (también detectable en el cristalino a concentraciones parecidas) fuese un agente oxidante cataratogénico importante en el ojo. De hecho, H2O2 se convirtió en uno de los compuestos más frecuentemente utilizados como fuente de estrés oxidativo experimental al que se somete el cristalino, al ser el más digamos «fisiológico». Por extensión lógica de estas ideas se hicieron intentos de diseñar peroxidasas apropiadas que pudiesen servir para prevenir las cataratas seniles39. Salvo raras excepciones, los niveles de H2O2 en el humor acuoso se establecieron siempre con el método del diclorofenolindofenol (DCPIP). Lo atractivo de este sencillo e ingenioso método es que permitía determinar, al mismo tiempo, los niveles de ascorbato en el humor acuoso. La Fig. 5 recoge el procedimiento cuando se hace con un espectrofotómetro que permite el registro continuo de la reacción40. Cuando DCPIP está oxidado tiene un color azul que se revela por su absorbancia a 605 nm. En la Fig. 5 esto corresponde al trazo que comienza a tiempo 0 a un nivel de absorbancia poco mayor de 0,60 unidades. Al añadir ascorbato, o humor acuoso que contiene ascorbato, DCPIP se reduce, y Fig. 5. Cuantificación de peróxido de hidrógeno (H2O2) con diclorofenol indofenol (DCPIP). Al principio del registro se observa la absorbancia de DCPIPox (azul) a 605 nm, justo por encima de 0,6 unidades. Al añadir ascorbato (o humor acuoso) donde indica la punta de flecha, poco antes de los 2 min de registro, la línea cae indicando que DCPIPox se ha reducido a DCPIPred (leuco). La adición de peroxidasa (doble punta de flecha) provoca un pequeño aumento en la absorbencia que es debido al H2O2 acumulado por la autoxidación de DCPIPred en los casi 3 min transcurridos desde la adición del ascorbato a la mezcla de reacción. Si estuviéramos analizando una muestra de humor acuoso, este H2O2 se añadiría a cualquier cantidad de H2O2 que estuviese realmente presente en la muestra. La adición posterior de 10 nmoles de H2O2 provoca una reoxidación cuantitativa de DCPIPred, manifestada como una subida en absorbencia de la mezcla. El trazo superior en la zona de 3 a 7 min representa a mayor amplificación la respuesta a la adición de 2 nmoles de H2O2. Obsérvese la tendencia de la línea base a subir poco a poco, reflejo de la mencionada autoxidación de DCPIPred. Gráfica adapatada de: García-Castiñeiras40. pierde su color azul. El trazo, en la figura, cae verticalmente. La concentración de ascorbato añadido, o del presente en el humor acuoso, puede calcularse sobre el nivel de absorbancia residual a 605 nm, mediante estándares de concentración conocida de ascorbato. Si luego añadimos a la mezcla de reacción una alicuota de peroxidasa (POX), el trazo de absorbancia sube si hay H2O2 en el medio, ya que DCPIPred se reoxida segun la reacción: POX = DCPIPox + 2H2O DCPIPred + H2O2 La subida es proporcional a la concentracion de H2O2 en la muestra. Al utilizar el mencionado método, los autores40 observaron algo preocupante: el trazo de absorbancia residual de DCPIPred siempre mostraba una tendencia a subir espontáneamente sin ninguna adición de peroxidasa, indicando que DCPIPred está reoxidándose espontáneamente en presencia de oxígeno. Y se puede demostrar fácilmente que en esa reoxidación se esta produciendo H2O2: DCPIPred + O2 = DCPIPox + H2O2 El peróxido producido se añade al peróxido que pudiera haber existido en la muestra, y ambos reaccionan igual en presencia de la peroxidasa. Esto conduce a una hiperestimacióon de H2O2 en la muestra, o a hacer que parezca que hay H2O2 donde no lo hay. Corregir este problema no es fácil por las razones discutidas ampliamente en el trabajo original. Pero sí podemos hacer la reacción tras desplazar lo más posible el oxígeno del medio de reacción con argón. En estas condiciones se reduce al mínimo la autooxidación de DCPIPred, y lo que era antes una concentración aparente de 25 µM H2O2 en el humor acuoso se convierte ahora en alrededor de 1 µM H2O2. Y si se hubiera podido suprimir del todo la autoxidacion de DCPIPred, hubiera desaparecido el H2O2 del humor acuoso. Todavía pudiera existir, sin embargo, pero a niveles inferiores al límite de detección del método (que es de aproximadamente 0,25 µM). Usando el método del DCPIP sin precauciones especiales, siempre existe una correlacion directa entre la concentración de ascorbato y la de H2O2: cuanto más alto sea el nivel de ascorbato en la muestra analizada más rápida será la autooxidación del DCPIPred y más elevada será la aparente concentración de H2O2 encontrada. Esto llevó a la cuestionable interpretación, de que el origen del aparente H2O2 en el humor acuoso es la autooxidacion de ascorbato41. Pero bajo ningún concepto está garantizada esta conclusión, la cual solamente depende de un artefacto metodológico. Curiosamente, sin embargo, la idea de que ascorbato es el origen de peróxido en el humor acuoso persiste en la literatura34. Entre las consecuencias beneficiosas derivadas de esta historia, sin embargo, está el hecho de que prácticamente ya no se hacen experimentos en presencia de 100 ó 200 µM H2O2 para estudiar los efectos patológicos de H2O2 sobre el cristalino. Estos niveles pudieran ser fácilmente hasta 1.000 107 II. FUNDAMENTOS veces mayores de las concentraciones reales en el humor acuoso; en adición, se ha popularizado como fuente de estrés oxidativo el uso de niveles hiperbáricos de O2, que es de mucha más transcendencia clinica37. Tabla III. Estrés mecánico durante la acomodación: consecuencias Desplazamiento de unas fibras sobre otras Tracción sobre fibras ecuatoriales: posibilidad de rotura Fragilidad progresiva de fibras centrales ACOMODACIÓN El reflejo de acomodación La acomodación es el proceso que permite enfocar sobre la retina la imagen de los objetos a diferentes distancias42-45. Estando el ojo emétrope enfocado normalmente a infinito, la acomodación permite llevar a foco los objetos cercanos. El cristalino está directamente envuelto en este proceso, ya que es capaz de cambiar de forma, para que ocurra la acomodación (Tabla II). Los otros elementos refractivos del ojo no son capaces de modificar su forma para ajustar el foco sobre la retina. El ojo no acomodado tiene un poder refractivo total de 60 dioptrías (D), de los que corresponden unas 40 D fijas a la córnea y unas 20 D fijas al cristalino. Cuando el cristalino se acomoda contribuye hasta 10 D adicionales de poder refractivo, que tienen la relevancia particular de que son variables y representan el ajuste focal fino para los objetos cercanos. En resumen, el cristalino puede contribuir un poder refractivo de 30 D totales, de las que 1/3 aproximadamente representan un poder refractivo variable. Acomodación como fuente de estrés mecánico46,47 El fenómeno de la acomodación representa una fuente de estrés mecánico continuo al que está sometido todo el cristalino, estrés que puede llevar a la producción de lesiones en sus fibras. La miopia impone un estrés mecánico adicional sobre el cristalino al estar la zónula en tensión durante más tiempo de lo normal, lo que, consecuentemente, convierte a la miopía en un factor de riesgo para desarrollar catarata asociada a la edad46. Este estrés mecánico (Tabla III) puede derivar en: 1) Desplazamiento obligado de unas fibras sobre otras, particularmente en zonas donde las fibras corticales se desplazan sobre la fibras de la región nuclear del cristalino que ya se están endureciendo; 2) Tracción de la zónula sobre las fibras de la región cortical/ecuatorial del cristalino, que tira de la parte media de las fibras, haciendo posible la rotura de alguna de ellas; y 3) Fragilidad progresiva de las fibras centrales que se están esclerosando. Tabla II. Cambios morfológicos durante la acomodación Ojo no acomodado • • • • • Músculo ciliar relajado Foco en infinito Cristalino aplanado Zónula tensa Cápsula tensa 108 El estímulo adecuado para la acomodación es la borrosidad de la imagen retiniana42,43. Pero se desconoce el mecanismo exacto de como la retina se informa de cuál es el movimiento correctivo adecuado, acomodación o desacomodación. Se trata de un reflejo rápido y complejo que puede procesar muy variada información, como aberraciones esféricas y cromáticas, cambios en el tamaño de la imagen y juicio sobre distancia aparente de la imagen. También puede provocarse intencionalmente lo que sugiere que en el reflejo de acomodación pueden estar envueltos los más elevados niveles cognoscitivos y de procesamiento visual48. La rama aferente del reflejo es el nervio óptico y la eferente son las neuronas del núcleo de Edinger-Westphal que envían señales al músculo ciliar vía sinapsis en el ganglio ciliar. La contracción del músculo ciliar hacia adelante y adentro, que actúa en este caso como un esfinter, ejecuta el proceso de acomodación del cristalino, que lleva de nuevo la imagen sobre la retina. Asociados con la acomodación se dan varios fenómenos45: 1. Aumento de las curvaturas anterior y posterior del cristalino, particularmente de la anterior. 2. Desplazamiento anterior del centro del cristalino y de su polo anterior. La cámara anterior se hace más plana. Se cree que el polo posterior no se mueve, por efecto de la presencia del vítreo. 3. El núcleo del cristalino aumenta de grosor y se abomba hacia delante, el córtex que recubre el núcleo no cambia de espesor. 4. El diámetro ecuatorial del cristalino se reduce. 5. El ángulo de la cámara anterior se ensancha periféricamente. La acomodación se acompaña normalmente de miosis (que aumenta la profundidad de foco) y de convergencia (para mantener la fijacion bifoveal). Estos tres fenómenos, acomodacion, miosis y convergencia, constituyen la triada de visión cercana42,44. Plasticidad y elasticidad de cápsula y cristalino42-44 Ojo acomodado • • • • • Músculo ciliar contraido Foco cercano Cristalino engrosado Zónula relajada Cápsula relajada El cristalino jóven es fácilmente deformable bajo presión pero su elevada elasticidad permite que recupere la forma original una vez liberada la presión. Bajo la tensión de la zónula, la cápsula distribuye las fuerzas que recibe sobre todo el cristalino, ya que es una capa de colágeno inextensible que se ha enriquecido en entrecruzamientos moleculares con la edad. 8. FISIOLOGÍA DEL CRISTALINO En consecuencia, el cristalino se aplasta. Cuando la zónula pierde la tensión, las fuerzas elásticas del propio cristalino y las de la cápsula, hacen que recupere su forma de reposo original para aumentar su poder refractivo. Es posible que ciertos elementos del citoesqueleto (actina, vimentina, microtúbulos, spectrina, actinina, etc.) estén envueltos en el proceso. También es posible, aunque especulativo, que el cristalino pueda regular su volumen en función de la acomodacion, para tensar la cápsula y facilitar el efecto de la zónula. Para mantener la integridad anatómica de la estructura celular del cristalino durante estos desplazamientos, las fibras se enriquecen en uniones intercelulares que tienden a mantener su cohesividad, evitando que se separen a consecuencia de las fuerzas disociativas de acomodación. Las uniones entre las fibras van aumentando en densidad y complejidad hacia el nucleo4. Los nombres de estas uniones reflejan su capacidad de ensamblaje al formar estructuras complementarias, que las asemejan a un «velcro» biológico44: balls and sockets, outpocketings and infoldings, flaps and imprints, tongue and groove, microvilli, furrowed membrane, etc. Estas uniones, sin embargo, pudieran quebrarse si la fuerza que reciben es suficiente, originando una lesión de la membrana de la fibra o una dehiscencia de fibras. Se cree que, en muchos casos, estas lesiones microscópicas podrían aislarse y curarse. Además de estas estructuras existen también las suturas que contribuyen de modo importante a la interdigitación de las fibras y otras formaciones en las membranas de las fibras que se cree tienen que ver más bien con moléculas de adhesion intercelular. Se ha afirmado que las fibras no pueden desplazarse unas sobre otras, por las uniones intercelulares, sino que los cambios de forma del cristalino deben ser debidas a desplazamientos del citoplasma de las fibras. Es muy posible, sin embargo, que, con el tiempo, el propio citoplasma de las fibras maduras tenga las mismas dificultades para desplazarse que las membranas de las fibras. Presbiopía La acomodación puede aumentar el poder dióptrico del cristalino hasta en 10 ó 12 D. La amplitud máxima de acomodación se da entre los 10 y 20 años de edad. Luego decrece constantemente sin que nos demos cuenta. Cuando llega a 3,75 D, la situación es definida como presbicia o presbiopía y es entonces cuando tenemos la sensación de haber perdido la capacidad de ver de cerca. Esto puede aparecer como algo relativamente repentino, pero en realidad ha requerido una evolución de 45 años de edad de promedio. Hacia los 50 años desaparece la capacidad de acomodación. La presbiopía comienza antes y es de progresión más rápida cerca del ecuador que en latitudes más frías49,50. Lo mismo ocurre a baja altitud respecto al nivel del mar. Este factor geográfico se ha atribuido a la temperatura49,50. La temperatura, desde luego, puede ser un factor que acelera cualquier Fig. 6. Las fuerzas que afectan a la forma del cristalino. En el estado no-acomodado la zónula tira de la capsula, provocando fuerzas que tienden a aplastar el cristalino. En el estado de acomodación, la zónula se relaja debido a la contracción del músculo ciliar y la elasticiad inherente de la cápsula y del cristalino crean fuerzas dirigidas hacia afuera que permiten que éste se expanda antero-posteriormente; en la región ecuatorial, por el contrario, las fuerzas se dirigen hacia adentro y hacen que el diámetro ecuatorial del lente disminuya. Adaptado de: Oyster44. proceso de envejecimiento, por ser precisamente un factor general de aceleración de las reacciones químicas. Por su posición dentro del ojo, y por ser avascular, el cristalino no tiene la temperatura central del organismo, sino que es influenciable por la temperatura ambiental51. El proceso molecular que hace perder elasticidad al cristalino es, pues, probablemente dependiente de la temperatura ambiental, retrasable al bajar ésta, y acelerable al subirla. Aunque hay factores extralenticulares de menor influencia que pueden contribuir a la presbiopía (geometría de la inserción zonular, envejecimiento del músculo ciliar, entre otros), se cree que este fenómeno óptico se origina en la propia sustancia del cristalino (teoría de Finchman)43,44, que se hace mas rígida con la edad, en un proceso lento que coincide temporalmente con la reducción progresiva de la amplitud de acomodación. Con el músculo ciliar relajado, el cristalino cada vez responde menos al efecto de la tensión de la zónula sobre la cápsula, que tiende a aplanar el mismo. Y, tras la contracción del músculo ciliar, el cristalino recupera con mayor dificultad su forma acomodada y la cápsula pierde la elasticidad que trabajaba en la misma dirección. Todo sugiere que el aumento de rigidez o dureza de la sustancia del cristalino no implica pérdida de transparencia del mismo, pero sí puede implicar cambios moleculares similares que no tienen relación directa en una etapa precoz con la pérdida de transparencia. Sería necesario un nivel adicional de nuevas modificaciones para provocar la disminución de la transparencia del cristalino. 109 II. FUNDAMENTOS Una relación entre estos procesos fue ya propuesto por algunos autores en el pasado52, pero se enfrenta con el desconocimiento que aún tenemos de la química envuelta en el envejecimiento normal y anormal del cristalino y con la sensación clínica subjetiva de que estas condiciones no tienen nada que ver entre sí: la presbicia nos afecta la visión cercana a los 45 años y las cataratas nos bloquean la vista a los 70. TRANSPARENCIA DEL CRISTALINO El conservar la transparencia del cristalino es clave para conservar su función a lo largo de la vida. El envejecimiento y otros factores bien conocidos la comprometen y son la causa del empeoramiento de la calidad visual, hecho que puede condicionar la necesidad de cirugía. La luz que penetra en el ojo53,54 El ojo posee tejidos transparentes a la luz visible (longitudes de onda entre 400 nm y 750 nm) para que ésta pueda llegar, sin impedimento, hasta la retina y se pueda iniciar ahí el fenómeno de la visión. Poca radiación nos llega de la atmósfera por debajo de 295 nm. Pero la que llega es absorbida por la córnea, que deja pasar solamente longitudes de onda por encima de 295 nm. La radiacion UV entre 295 y 400 nm penetra hasta el cristalino que, parcialmente, la absorbe en función de la edad del individuo. A ese rango es al que pertenecen la radiación biológicamente activa UV-B (295-315 nm) y UV-A (315-400 nm). A la retina comienza a llegar radiación sobre 380 nm y todo el espectro visible. En la región infrarroja del espectro, el patrón de transmitancia de los medios oculares se parece mucho al mostrado por el agua. La absorción de estas energías supone riesgo de daño térmico. Ascorbato en humor acuoso El ascorbato muestra un pico de absorción máximo hacia 265 nm, pero exhibe absorción terminal hasta unos 310 nm55. Dada la concentración elevada de ascorbato (mayor de 1 mM) en el humor acuoso humano y de animales con hábitos de vida diurnos, éste compuesto puede contribuir a absorber radiacion UV-B menor de unos 310 nm56, que de otro modo llegaría al cristalino. Al mismo tiempo puede suprimir fluorescencia del humor acuoso en la región UV-A. A través de estos mecanismos, y junto a su efecto antioxidante, el ascorbato de humor acuoso representa un mecanismo adicional de protección ocular que puede beneficiar más que nada al cristalino. El cristalino se tiñe de amarillo con el tiempo El cristalino debe ser transparente durante toda la vida del individuo a la radiación visible, para que le sea verdaderamente útil. Esto puede implicar muchos años en el caso de ciertas especies animales de larga vida. A medida que el cristalino envejece se vuelve cada vez más amarillo y llega a adquirir hasta una tonalidad marrón en el centro (ver, en el apartado correspondiente, «Modificaciones postsintéticas de las cristalinas»). Este hecho es debido a la acumulación de pigmentos en sus proteínas que van absorbiendo una proporción cada vez mayor de la radiación UVA y azul que pasa por el cristalino, de manera terminal. Se trata de un proceso normal de envejecimiento que no interfiere en realidad con la visión a no ser que progrese hasta un grado en que la absorción terminal invada regiones amplias del espectro visible y reduzca hasta un punto crítico la cantidad de luz que pasa hacia la retina. Que el cristalino se torne amarillo tiene ciertas consecuencias favorables: 1) Disminuir la aberración cromática del cristalino; 2) Proteger a la retina de los efectos nocivos de la luz UV que haya rebasado la córnea; y 3) Ser reflejo de un proceso controlado de estabilización estructural del cristalino que aumenta su capacidad de permanecer transparente con el tiempo. Absorción y dispersión La luz visible que penetra en el ojo puede no llegar a su destino, la retina, por dos razones fundamentales: 1) Por ser absorbida; o 2) Por ser dispersada53. Tanto absorción como dispersión hacen que la luz que sale del medio absorbente o dispersante sea de menor intensidad que la luz incidente. 1. Absorción Fig. 7. Transmitancias espectrales cumulativas en las superficies posteriores de los componentes oculares indicados. Los datos son the transmitancia directa y corresponden a un adulto jóven o niño, según Boettner y Wolter (Invest Ophthal 1962; 1: 776-783). Adaptado de: Atchinson53. 110 La luz absorbida se utiliza para hacer pasar las moléculas que la absorbieron a un estado excitado que se disipa de varias maneras. Si la luz se reemite (fluorescencia) lo hace 8. FISIOLOGÍA DEL CRISTALINO con energía menor (mayor longitud de onda). Ninguno de los aminoácidos normales que forman parte de una proteína absorben luz visible, por lo que incluso grandes concentraciones de proteína no causan pérdida de transparencia por absorción en la región visible del espectro. Por otro lado, como los tejidos transparentes del ojo son avasculares, carecen de los grupos cromofóricos de la proteína hemoglobina que puedan interferir con la visión. Desde el punto de vista metabólico estos tejidos sobreviven a base, sobretodo, del metabolismo anaeróbico de glucosa, que no necesita del concurso de los citocromos y otros pigmentos respiratorios mitocondriales que también poseen grupos cromofóricos. En el cristalino, las mitocondrias están limitadas al epitelio anterior y capas superficiales de fibras en vías de diferenciación36. Ello representa un espesor pequeño de la estructura, que no interfiere con la transmisión de luz visible. Solamente los pigmentos de envejecimiento del propio cristalino van aumentando con la edad y pueden influir sobre la percepción de color, pero son en realidad compatibles con un elevado grado de transparencia por muchos años. Así que quedan los fenómenos de dispersión como mecanismo fundamental de pérdida de transparencia en el cristalino. Considerando a la luz como fotones (partículas) en movimiento, también podemos describir el fenómeno de dispersión como producido por la existencia de heterogeneidades en el medio, debidas a cambios o fluctuaciones en su índice de refracción (densidad). Se admite también que simples cambios en la orientación de materiales birrefringentes (ópticamente activos), como los relacionados con el citoesqueleto, presentes en el medio también pueden ocasionar dispersión60. Transparencia de los medios oculares Los medios oculares pueden ser transparentes por razones varias. Es fácil explicar porqué el humor acuoso, e incluso el vítreo, por ejemplo, son transparentes; al tratarse de líquidos homogéneos acuosos con una concentración muy baja de proteínas apenas se producen fenómenos de dispersión. Al aumentar la concentracion proteica, sin embargo, el humor acuoso se torna inmediatamente turbio u opalescente. Esto ocurre, por ejemplo, cuando se produce el llamado humor acuoso secundario por ruptura de la barrera hematoacuosa, que lleva a la inundación del humor acuoso con proteínas plasmáticas. Transparencia en el cristalino 2. Dispersión (scattering) El tratamiento de los fenómenos de dispersión es complejo y depende de numerosos factores53,57-60: 1) Tamaño de las partículas en relación a la longitud de onda que los atraviesa; 2) Forma de las partículas; 3) Fluctuaciones en el índice de refracción del medio; 4) Grado de independencia de los centros de dispersión; y 5) Grado de regularidad estructural del medio. Los fenómenos de dispersión resultan en turbidez u opalescencia del medio, no así los de absorción. La luz, por ser radiación electromagnética, es capaz de inducir dipolos oscilantes en las moléculas o átomos con los que tropieza, con lo cual cada centro de dispersión se convierte en un centro de reemision de luz. En el caso sencillo de scattering de Rayleigh o elástico cada centro de dispersión se comporta como independiente de los demás, la luz dispersada es de la misma longitud de onda que la incidente y su intensidad es proporcional al inverso de la cuarta potencia de la longitud de onda que se dispersa. En otras palabras, la intensidad de la luz dispersada cae rápidamente al aumentar la longitud de onda de la luz. Es por esto que la luz azul se dispersa más intensamente que la luz roja53,59,60. En el caso de que las partículas sean mayores que la longitud de onda de la luz, cada partícula contiene varios dipolos que pueden interaccionar entre ellos, por lo que el tratamiento se hace mucho más complejo que en el caso anterior. Sin embargo, se cumple que cuanto mayor sea el área seccional de la partícula mayor será el grado de dispersión53,59. Más complejo es el fenómeno de la transparencia de la córnea o del cristalino, por contener estructuras celulares y representar soluciones muy concentradas de proteínas. En principio, la dispersión mostrada por el cristalino es mayor que la de la córnea, ya que se trata de un tejido celular de bastante mayor grosor que la córnea (4 mm vs 0,53 mm, en el centro). Aun así, es muy poca la luz dispersada por el cristalino (5%). La transparencia de un objeto se asocia en principio con poseer una estructura molecular típica de los cristales, en la que los átomos ocupan posiciones invariantes dentro de una matriz geométrica ordenada y rígida (cristalina). En estas circunstancias se produce el fenómeno de interferencia destructiva que hace desaparecer el fenómeno de dispersión, al anularse entre sí las emisiones que están fuera de fase, procedentes de los distintos centros de dispersión. Al tener la luz una longitud de onda mucho mayor que el tamaño de los átomos individuales de la matriz cristalina también disminuye la probabilidad de que ocurra la interacción, sobreviviendo gran parte de la luz que camina hacia el frente. Al cristalino se le consideró en algún momento como una estructura paracristalina57, por mostrar un elevado grado de orden, estructuralmente hablando y a varios niveles. Sin embargo, pudo definirse posteriormente que la condición de transparencia solamente exige que exista un elevado grado de orden localmente y no una estructura cristalina tridimensional extendida. Se compara la situación con la que se da en el vidrio, que es transparente, pero no consiste en una estructura estrictamente cristalina58,59. 111 II. FUNDAMENTOS En la medida que disminuye el orden (cristal > líquido) disminuye el grado de interferencia destructiva que se produce, y por tanto, aumenta la dispersión. El citoplasma de las células del cristalino carece de organelos y tiene una textura granular fina (tamaño menor 20 µm) compatible con gran calidad óptica, compuesta de las cristalinas y del citoesqueleto, de elevado índice de refracción (la concentración proteica es del 35%). Las membranas de las fibras son las que contribuyen más a la dispersión mencionada del 5%, porque tienen un índice de refracción mayor que el del citoplasma. De hecho las membranes dan débiles patrones de difracción, que son suficientemente débiles como para no degradar apreciablemenne la imagen, aunque pueden producir halos alrededor de objetos brillantes53,59,61. La elevada concentración de proteína en el cristalino, además de aumentar su índice de refracción, facilita su transparencia61. Este hecho podría parecer contradictorio en principio, pero tiene su explicacion en la teoría física de la dispersión. Explicado de la manera más sencilla posible, una concentración alta de proteína facilita el orden estructural, respecto a la situación en que la concentración es baja y cada centro de dispersión se mueve con libertad respecto a los otros. Cuando los centros de dispersión son independientes y se mueven al azar, la dispersión es máxima. Cuando los centros de dispersión dejan de moverse al azar, porque interaccionan unos con otros, hay más orden y se facilita la transparencia. Por eso, la mera dilución del material del cristalino por agua osmótica imbibida da directamente un aumento de turbidez, aunque la concentracion local de proteína haya bajado. Sin tener en cuenta la regularidad estructural y para centros independientes de dispersión, la intensidad de la luz dispersada aumenta con la concentración y el peso molecular de la partícula. Gradientes proteicos en el cristalino Una funcion importante del cristalino es enfocar las imágenes sobre la retina. El poder refractivo del cristalino depende de su índice de refracción respecto a los líquidos que lo rodean y de la curvatura de sus superficies anterior y posterior. El índice de refracción promedio del cristalino es 1,420 y el de los líquidos que lo rodean, el humor vítreo y el humor acuoso, es de 1,33661. El índice de refracción de la cápsula no es diferente del de estos últimos. El índice de refracción es máximo en la región central del cristalino y mínimo en la región periférica del mismo. Este elevado índice de refracción se debe a las proteínas de las fibras del cristalino, cuya concentración tiende a ser máxima, por lo general, en la región nuclear del mismo y disminuye en dirección ecuatorial y axial hacia la corteza. La microrradiografía cuantitativa permite establecer la distribución de concentración de proteína (peso seco/ml) de polo anterior a polo posterior a lo largo del eje visual en zo112 nas pequeñas del cristalino. En la rata, por ejemplo, Philipson62 encontró un gradiente continuo de concentración de proteína en todas las edades, a partir de unos días de vida. La concentración de proteína aumenta continuamente hacia el centro del cristalino, tanto a lo largo del eje visual como del eje ecuatorial. En el cristalino humano el gradiente es solamente semicontinuo63: hay una región central de índice de refracción máximo pero constante y una zona periférica en que va subiendo el índice de refracción progresivamente hacia la región central, en una distancia de unos 0,5 mm. La concentración máxima de proteína aumenta algo con la edad. La región de concentración constante representa un promedio del diámetro a lo largo del eje visual de 75%, con tendencia a los valores más altos (80%) en cristalinos de mayor edad (70-80 años). El cambio más significativo de concentración proteica ocurre en las regiones subcapsulares anterior y posterior. Un gradiente de índice de refracción tiene la ventaja óptica de que disminuye la aberración esférica del cristalino, fenómeno que tiende al desenfoque de la imagen; en ausencia de un índice de refracción cambiante los rayos de luz son refractados por la parte periférica del cristalino más intensamente que los que pasan cercanos al centro convirtiendo al foco en una línea focal y no un punto focal53,61. Estos gradientes continuos o semicontinuos de concentración proteica pueden generarse mediante dos mecanismos de compactacion de las fibras del cristalino. Compactación del cristalino Este fenómeno puede implicar dos tipos de proceso diferentes: 1. En el primer caso, compactación tipo 1, las fibras pierden parte de su material interno, que no se sustituye, así que la concentración de lo que se pierde es de la misma concentración de lo que queda. Las fibras deben encojerse para compensar por la pérdida, y por lo tanto se compactan, pero lo que tienen dentro en realidad no aumenta en concentración, es decir, no hay cambio en el índice de refracción. Existe evidencia inmunológica clara de que el cristalino está continuamente soltando a circulación fragmentos de sus proteínas cristalinas, lo cual apoya la plausibilidad de este mecanismo de compactación en el cristalino humano (ver «Modificaciones post-sintéticas del cristalino»). 2. En la compactacion tipo 2, las fibras pierden agua por deshidratación, lo cual hace que la concentración de proteína que queda en las fibras aumente, con aumento del índice de refracción. Este es típicamente un fenómeno sinerético (ver más adelante), que puede pasar desapercibido desde el punto de vista inmunológico si no se transfieren a la circulación péptidos derivados. 8. FISIOLOGÍA DEL CRISTALINO SUTURAS Las fibras secundarias maduras pueden tener hasta 8-10 mm de longitud, lo cual representa una considerable elongación, pero no les permite cubrir toda la circunferencia del cristalino. Se dice, por tanto, que las fibras no representan meridianos verdaderos en ninguna de las capas concéntricas, ni su polo anterior se encuentra nunca con su polo posterior. El proceso ha sido particularmente bien estudiado por Kuszak4,64. La fibra que se origina en un polo no llega a alcanzar al otro polo, sino que se queda corta. El espacio que falta, sin embargo, lo van a ocupar los extremos correspondientes de otras fibras adyacentes que se han originado más ecuatorialmente, desplazadas unas sobre otras. Cuando las fibras alcanzan su sutura dejan de elongarse. La línea en que se funden los extremos de las fibras se denominan suturas. Cuando consideramos no solamente una capa sino todo el espesor del cristalino, las suturas forman planos de sutura (Fig. 8). Las suturas son regiones de gran desorden de las membranas que las forman, por la abundancia de interdigitaciones que comprometen la calidad óptica. Sin embargo, cuanto más complejo es el patrón de suturas (como en primates) menos es el efecto disruptor, porque los planos son de menor superficie y muchos están alejados del eje visual64. El mismo autor ha adelantado otra posibilidad sobre la función de las suturas en el cristalino, que es considerarlas lugares de intercambios intensos de tipo endocítico, fundamentales para la supervivencia metabólica del cristalino a largo plazo, siendo su efecto óptico negativo simplemente un mal menor65. El patrón de suturas es variado, dependiendo de la especie animal: suturas de una línea, una posterior y otra anterior, suturas en forma de Y (tres líneas), etc. También, dentro de una misma especie, hay variaciones morfológicas según la fase de desarrollo (Fig. 8; Tabla IV). En el núcleo embrionario del cristalino humano no hay suturas; en el núcleo fetal las suturas son tipo Y (tres líneas), una anterior y otra posterior invertida; en el núcleo infantil son tipo estrella sencilla, de 6 líneas; en el núcleo adulto son de 9-10 líneas (estrella) que convergen en cada polo, y con zonas de convergencia de líneas alejadas de los polos; finalmente, en la corteza de un cristalino adulto (20 años o más) se pueden distinguir 10-14 líneas (estrella compleja). Garland66 describe un método para disecar cristalinos humanos (obtenidos del National Disease Research Interchange en Philadelphia, PA) que utiliza el patrón de suturas como guía. Tiene gran interés porque es precisamente el patrón de suturas lo que establece las líneas de discontinuidad en la imagen de un cristalino en la lámpara de hendidura67. En este método existe un plano de fácil disección en todos los cristalinos adultos que aparece cuando el cristalino se reduce en diámetro a 7 mm. Esta zona de discontinuidad establece el límite entre corteza y núcleo. Dependiendo del diámetro total del cristalino, el núcleo representa entre el 64 y el 87% del diámetro total. El núcleo así definido contiene el núcleo embrionario (a los tres meses de gestación, contiene fibras primarias), el fe- Fig. 8. Tipos de núcleos reconocidos en el cristalino y organización de suturas y cápsula. Los diferentes núcleos que se reconocen en el cristalino (A), las suturas en Y del núcleo fetal (en morado la anterior, en rojo la posterior) (B), y el complejo patrón sutural estrellado de la cápsula de un lente adulto humano (C). Adaptados de: A) Procede de Kuszak4; B) Procede de Brown5; C) Procede de: Kuszak (Kuszak JR, Bertram BA, Macsai MS, Rae JL. Sutures of the crystalline lens: a review. Scanning Electron Microsc 1984; III: 1369-1378). tal, el infantil y el adulto. Alcanzada la superficie del núcleo adulto, su patrón de suturas es más difícil de ver. Continuando la disección del núcleo se perciben por lo menos dos planos adicionales de fácil disección, uno que define la interfase entre el núcleo adulto y el infantil (5,5 mm de diámetro) y el otro la superficie del núcleo fetal (4 mm de diámetro). El núcleo definido según Garland66 es mayor que el que otros autores definen. Por ejemplo, unos consideran núcleo el núcleo embrionario más el fetal, es decir, el cristalino que existe al nacer67. El resto que se deposita tras el nacimiento lo consideran corteza. Kusak4 define un núcleo parecido al de Garland66, que contiene fibras depositadas hasta la madurez sexual (unos 15 años de edad). La imagen del cristalino vista con la lámpara de hendidura presenta un patrón relativamente fijo de líneas o zonas oscuras (transparentes) y blancas (opacas), que se sabía relacionado con la edad del cristalino. Hoy día se sabe que este patrón en el humano se debe de manera importante al patrón de suturas que el tiempo establece en el cristalino y no a cambios en la velocidad de crecimiento de las fibras, que era una de las alternativas previamente consideradas. Tabla IV. Morfología de suturas en función de la edad Estructura Morfología Líneas de sutura Núcleo embrionario Núcleo fetal Núcleo infantil Núcleo adulto Córtex adulto Tipo Y Estrella Estrella Estrella compleja No hay suturas Una anterior y otra posterior Seis líneas Nueve o diez líneas Diez a catorce líneas 113 II. FUNDAMENTOS PÉRDIDA DE TRANSPARENCIA EN CATARATAS En el cristalino cataratoso los fenómenos de dispersión de la luz son mucho más marcados que en el cristalino normal senil de la misma edad. Esto, por un lado, produce primero deslumbramiento (glare) y luego lleva a la desaparición parcial o completa de la imagen. El glare lo produce, sobretodo, la catarata subcapsular posterior, ya que en la posición de este tipo de catarata se dispersa la luz ya enfocada previamente por córnea y cristalino. Bettelheim60 resume los varios mecanismos de pérdida de transparencia en el cristalino (Tabla V): 1) Agregación; 2) Sinéresis; 3) Separaciones de fase; 4) Degeneración de membranas; y 5) Cambios de orientación de componentes del citoesqueleto. Agregación Las partículas cuyo diámetro es λ/20 o mayor inducen dispersión. Se suele considerar un peso molecular de 1x106 dalton o mayor como el de un agregado que se convierte en centro de dispersión. Los fenómenos de agregación se manifiestan ya durante el proceso de envejecimiento. Estos procesos, covalentes o no-covalentes, se describen en la sección de «Modificaciones postsinteticas de las cristalinas». El proceso hacia la insolubilización proteica parece ser distinto en cataratas corticales y nucleares, debido sobretodo a diferencias en la etapa biológica de las fibras que reciben el daño, como se detalla en la sección de «Etiopatogenia de la catarata relacionada con la edad». Sinéresis Se define así el proceso que aumenta la diferencia de índice de refracción entre la unidad o centro de dispersión y el medio. Su mecanismo primario es el colapso de la proteína al perder agua de hidratación (bound, nonfreezable water) que pasa a agua libre (bulk, freezable water). Esto automáticamente produce turbidez por aumento de la amplitud de fluctuación del índice de refracción, y no por el aumento en el tamaño de los centros de dispersión. Estos centros, en realidad, hasta pudieran disminuir de tamaño al colapsarse la proteína. En un proceso cataratoso, tanto como 1/3 del agua total intracelular se convierte a libre. Otros experimentos sugieren una redistribución del agua en el cristalino: aunque el agua de hidratación del cristalino pudiera ser la misma en cristalinos normales y cataratosos, la fracción de agua libre es mayor en los cristalinos con cataratas. A este fenómeno, Bettelheim60 lo ha denominado «exudación sinerética» creyendo que es parte del proceso de envejecimiento normal del cristalino y que se produce aún antes de que se den fenómenos de agregación. Este autor argumenta que el proceso que más contribuye a la opacificacion en las cataratas nucleares es la sinéresis (42%), contribuyendo mucho menos la agregacion (14%). 114 Tabla V. Pérdida de transparencia en cataratas: mecanismos 1. 2. 3. 4. 5. Agregación Sinéresis Separaciones de fase Degeneración de membranas Cambios de orientación de componentes del citoesqueleto Separaciones de fase En la denominada catarata por frío se produce la opacificación del núcleo del cristalino al bajar la temperatura. El fenómeno es fácilmente reversible al recalentar el sistema. Se supone se debe a que al enfriar un cristalino se producen microfases de solubilidad (densidad) diferente entre las cristalinas, que se convierten en opacidad al hacerse su tamaño del orden de la longitud de onda de la luz visible. El fenómeno ocurre a una temperatura de transición específica en cada caso y suele afectar al núcleo. Algunas se comportan como crioproteínas que precipitan con el frío, creando la separación de fases y la opacificación. Por lo general, este mecanismo no requiere la separación macroscópica de fases. Degeneración de las membranas Las membranas de las fibras del cristalino, prácticamente la única estructura subcelular que queda en las fibras, se disponen en una malla o trama hexagonal muy regular que permite interferencia destructiva y promueve, por tanto, transparencia de manera dominante. La desintegración de las membranas de las fibras del cristalino, por tanto, promueve opacificación al favorecer el desorden. Por otro lado, una lesión bioquímica de la membrana puede actuar como principio de un fenómeno de agregación e insolubilización a través de varios mecanismos, que pueden implicar alteraciones iónicas, interferencia con sistemas de transporte, entrecruzamientos moleculares permanentes con cristalinas y citoesqueleto, así como fenómenos osmóticos que terminen en alteraciones estructurales y cambios en el índice de refracción de los componentes del cristalino: vacuolización, edema, agrandamiento de espacio intercelular, acúmulos de residuos celulares, ruptura de membrana adicional, etc. Este mecanismo sería particularmente prevalente en cataratas osmóticas corticales y en cataratas secundarias a daño oxidativo de las membranas en cualquier región. El caso de las suturas en relación con la transparencia del cristalino se ha comentado previamente. Cambios de orientación de components del citoesqueleto Con frecuencia se ignora que cambios en la anisotropía óptica de las macromoléculas que forman el citoesqueleto y de algunas cristalinas (detectables con luz polarizada) son ra- 8. FISIOLOGÍA DEL CRISTALINO zón suficiente para la pérdida de transparencia del cristalino, en cuanto que implican randomización del orden estructural preexistente. CONCLUSIONES El cristalino constituye un órgano único en cuanto a su anatomía y fisiología. Su fisiología debe mantener su transparencia a lo largo de la vida, conservar la acomodación y filtrar la luz ultravioleta. Conocer los mecanismos que explican estas importantes funciones serán la base para desarrollar estrategias que eviten la pérdida tanto de la transparencia como de la acomodación o para intentar recuperalas, en el futuro. BIBLIOGRAFÍA 1. Beebe DC. The lens. In: Kaufman PL, Alm A. Adler’s Physiology of the Eye. Clinical Application. 10th edition. St Louis: Mosby; 2003; Ch 5: 117-158. 2. Rae J. Physiology of the Lens. In: Albert DM, Jakobiec FA. Principles and Practice of Ophthalmology. Philadelphia: WB Saunders Co; 1994: Ch 8: 123-146. 3. Brown NP, Bron AJ. Biology of the Lens. In: Lens disorders. A clinical Manual of Cataract Diagnosis. Glasgow: Butterworth-Heinemann; 1996; Ch 6: 53-77. 4. Kuszak JR, Brown HG. Embriology and Anatomy of the Lens. In: Albert DM, Jakobiec FA Principles and Practice of Ophthalmology. Philadelphia: WB Saunders Co; 1994: Ch 5: 82-96. 5. Brown NP, Bron AJ. Development of the lens. In: Lens disorders. A Clinical Manual of Cataract Diagnosis. Glasgow: Butterworth-Heinemann; 1996; Ch 2: 4-16. 6. Harding J. The ageing lens. In: Cataract. Biochemistry, Epidemiology and Pharmacology. London: Chapman & Hall; 1991; Ch 2: 71-82. 7. Harding JJ, Crabbe MJC. The lens: development, proteins, metabolism and cataract. In: Davson H. The Eye, vol Ib (Vegetative Physiology and Biochemistry). 3rd ed. London: Academic Press; 1984; Ch 3: 207-492. 8. Vander A, Sherman J, Luciano D. Movement of molecules across cell membranes. In: Vander A, Sherman J, Luciano D, eds. Human Physiology. 5th ed. McGraw-Hill Pub Co; 1990; Ch 6: 107-137. 9. Jaffe NS, Horwitz J. Lens Physiology. In: Podos SM, Yanoff M Texbook of Ophthalmology, vol 3 (Lens and cataract). New York: Gower Medical Pub; 1992; Ch 3: 3.1-3.5. 10. Mathias RT, Rae JL, Baldo GJ. Physiological properties of the normal lens. Physiol Rev; 1997; 77: 21-50. 11. Unakar NJ, Tsui JY. Sodium-potassium-dependent ATPase. I. Cytochemical localization in normal and cataractous rat lenses. Invest Ophthalmol Vis Sci 1980; 19: 630-641. 12. Garner MH, Kuszak JR. Cations, oxidants, light as causative agents in senile cataracts. PRHSJ 1993; 12: 115-122. 13. Garner WH, Hilal SK, Lee SW, Spector A. Sodium-23 magnetic resonance imaging of the eye and lens. Proc Natl Acad Sci USA 1986; 83: 1901-1905. 14. Fishbarg J, Diecke FPJ, Kuang K, Yu B, Kang F, Iserovich P, Li Y, Rosskothen H, Koniarek JP. Transport of fluid by lens epithelium. Am J Physiol 1999; 276; 45: 548-557. 15. Mackic JB, Jinagouda S, McComb JG, Weiss MH, Kannan R, Kaplowitz N, Zlokovic BV. Transport of circulating reduced glutathione at the basolateral side of the anterior lens epithelium. Exp Eye Res 1996; 62: 29-37. 16. Kern HL, SL Zolot SL. Transport of vitamin C in the lens. Curr Eye Res 1987; 6: 885-896. 17. Garland DL. Ascorbic acid and the eye. Am J Clin Nutr 1991; 54: 1198-1202. 18. Borgnia M, Nielsen S, Engel A, Agre P. Cellular and molecular biology of the aquaporin water channels. Annu Rev Biochem 1999; 68: 4258. 19. Kandel ER, Siegelbaum SA. Overview of synaptic transmission. In: Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science. 4th ed. NewYork: McGraw-Hill; 2000; Ch 10: 175-186. 20. Katz U. Cellular water content and volume regulation in animal cells. Cell Biochem Function 1995; 13: 189-193. 21. Kuang K, Yiming M, Zhu Z, Iserovich P, Diecke FP, Fischbarg J. Lack of Threshold for Anisotonic Cell Volume Regulation. J Membrane Biol 2006; 211: 27-33. 22. Williams MR, Duncan C, Croghan PC, Riach R, Webb SF. pH regulation in tissue-cuotured bovine lens epithelial cells. J Membr Biol 1992; 129: 179-187. 23. Bassnett S. Intracellular pH regulation in the embryonic chicken lens epithelium. J Physiol 1990; 431: 445-464. 24. Schultz RM, Liebman MN. Proteins I. Composition and Structure. In: Devlin TM. Textbook of Biochemistry with Clinical Correlations. 6th ed. New York: Wiley & Sons, Inc; 2006; Ch 3: 75-132. 25. Mathias RT, Rae JL. The Lens: local transport and global transparency. Exp Eye Res 2004; 78: 689-698. 26. Candia O. Electrolyte and fluid transport across corneal, conjunctival and lens epithelia. Exp Eye Res 2004; 78: 527-535. 27. Dong Z, Saikumar P, Weinberg JM, Venkatachalam MA. Calcium in cell injury and death. Annu Rev Pathol Mech Dis 2006; 1: 405-434. 28. Paterson CA, Delamere NA. ATPases and lens ion balance. Exp Eye Res 2004; 78: 699-703. 29. Marian MJ, Li H, Borchman D, Paterson CA. Plasma membrane Ca2+ATPase expression in the human lens. Exp Eye Res 2005; 81: 57-64. 30. Gao J, Sun X, Martínez-Wittinghan FJ, Gong X, White TW, Mathias R. Connections between connexins, calcium and cataracts in the lens. J Gen Physiol 2004; 124: 289-300. 31. Duncan G, Jacob TJC. The Lens as a Physicochemical System. In: Davson H. The Eye, vol Ib (Vegetative Physiology and Biochemistry). 3rd ed. London: Academic Press; 1984; Ch 2: 159-206. 32. Harding JJ. Experimental opacification of the lens in vivo and in vitro. In: Harding JJ, ed. Cataract. Biochemistry, Epidemiology and Pharmacology. London: Chapman & Hall; 1991; Ch 4: 125-194. 33. Helbig H, Hinz J-P, Kellner U, Foerster M. Oxygen in the anterior chamber of the human eye. German J Ophthalmol 1993; 2: 161-164. 34. Barbazetto IA, Liang J, Chang S, Zheng L, Spector A, Dillon JP. Oxygen tension in the rabbit lens and vitreous before and after vitrectomy. Exp Eye Res 2004; 78: 917-924. 35. Shui Y-B, Fu J-J, García C, Dattilo LK, Rajagopal R, McMillan S, Mak G, Holekamp NM, Lewis A, Beebe DC. Oxygen distribution in the rabbit eye and oxygen consumption by the lens. Invest Ophthalmol Vis Sci 2006; 47: 1571-1580. 36. McNulty R, Wang H, Mathias RT, Ortwerth BJ, Truscott RJW, Bassnett S. Regulation of tissue oxygen levels in the mammalian lens. J Physiol 2004; 559: 883-898. 37. Palmquist BM, Philipson B, Barr PO. Nuclear cataract and myopia during hyperbaric oxygen therapy. Br J Ophthalmol 1984; 68: 113-117. 38. Spector A, Garner WH. Hydrogen peroxide and human cataract. Exp Eye Res 1981; 33: 673-681. 39. Wilson SR, Zucker PA, Huang RRC, Spector A. Development of synthetic compounds with glutathione peroxidase activity. J Am Chem Soc 1989; 111: 5936-5939. 40. Garcia-Castiñeiras S, Velázquez S, Martínez P, Torres N. Aqueous humor hydrogen peroxide analysis with dichlorophenol-indophenol. Exp Eye Res 1992; 55: 9-19. 41. Giblin FJ, McCready JP, Kodama T, Reddy VN. A direct correlation between the levels of ascorbic acid and H2O2 in the aqueous humor. Exp Eye Res 1984; 38: 87-93. 42. Koretz JF. Accommodation and presbyopia. In: Albert DM, Jakobiec FA Principles and Practice of Ophthalmology. Philladelphia: WB Saunders Co; 1994: Ch 16: 270-282. 43. Atchison DA, Smith G. The aging eye. In: Atchison DA, Smith G, eds. Optics of the human eye. Somerset: Butterworth-Heinemann; 2000; Ch 20: 221-233. 115 II. FUNDAMENTOS 44. Oyster CW. The ciliary body and the choroid. In: Oyster CW, ed. The Human Eye. Structure and Function. Sunderland: Sinauer Assoc Inc; 1999; Ch 11: 447-490. 45. Brown NP, Bron AJ. Accommodation and presbyopia. In: Brown NP, Bron AJ, ed. Lens disorders. A clinical manual of cataract diagnosis. Glasgow: Butterworth-Heinemann; 1996; Ch 5: 48-52. 46. Weale R. A note on a possible relation between refraction and a disposition for senile nuclear cataract. Br J Ophthalmol 1980; 64: 311314. 47. Harding J. The epidemiology of cataract. In: Harding J, ed. Cataract: Biochemistry, Epidemiology and Pharmacology. London: Chapman and Hall; 1991; Ch 3: 83-124. 48. Westheimer G. The neurology of accommodation. In: Albert DM, Jakobiec FA, eds. Principles and Practice of Ophthalmology. Philadelphia: WB Saunders Co; 1994: Ch 17: 282-284. 49. Miranda MN. The geographic factor in the onset of presbyopia. Trans Amer Ophthal Soc 1979; 77: 603-621. 50. Weale RA. Human ocular aging and ambient temperature. Br J Ophthalmol 1981; 65: 869-870. 51. Schwartz B. Environmental temperature and the ocular temperature gradient. Arch Ophthalmol 1965; 74: 237-243. 52. Miranda MN. Environmental temperature and senile cataract. Trans Amer Ophthal Soc 1980; 78: 255-262. 53. Atchison DA, Smith G. Passage of light into the eye. In: Atchison DA, Smith G. Optics of the human eye. Somerset: Butterworth-Heinemann; 2000; Ch 12: 105-116. 54. Pitts DG, Cameron LL, Jose JG, Lerman S, Moss E, Varma SD, Zigler S, Zigman S, Zuclich. Optical radiation and cataracts. In: Waxler M, Hitchins VM, eds. Optical Radiation and Visual Health. Boca Raton: CRC Press; 1986; Ch 2: 5-41. 55. Lewin S. Vitamin C: Its Molecular Biology and Medical Potential. London: Academic Press; 1976; Ch 1: 5-39. 116 56. Ringvold A. Aqueous humor and ultraviolet radiation. Acta Ophthalmol Scand 1980; 58: 69-82. 57. Trokel S. The physical basis for transparency of the crystalline lens. Invest Ophthalmol 1962; 1: 493-501. 58. Benedek GB. Theory of transparency of the eye. Appl Opt 1971; 10: 459-473. 59. Tardieu A, Delaye M. Eye lens proteins and transparency: from light transmission theory to solution x-ray structural analysis. Ann Rev Biophys Biophys Chem 1988; 17: 47-70. 60. Bettelheim FA. Physical basis of lens transparency. In: Maisel H. The Ocular Lens. Structure, Function and Pathology. New York: M Dekker; 1985: Ch 7: 265-300. 61. Jaffe NS, Horwitz J. Lens Biophysics. In: In: Podos SM, Yanoff M Texbook of Ophthalmology, vol 3 (Lens and cataract). New York: Gower Medical Pub; 1992; Ch 2: 2.1-2.7. 62. Philipson B. Distribution of protein within the normal rat lens. Investig Opthal Vis Sci 1969; 8: 258-270. 63. Fagerholm PP, Philipson BT, Lindström B. Normal human lens: the distribution of protein. Exp Eye Res 1981; 33: 615-620. 64. Kuszak JR, Peterson KL, Sivak JG, Herbert KL. The interrelationship of lens anatomy and optical quality. II. Primate lenses. Exp Eye Res 1994; 59: 521-535. 65. Kuszak JR, Sivak JG, Weerheim JA. Lens optical quality is a direct function of lens sutural architecture. Invest Ophthalmol Vis Sci 1991; 32: 2119-2229. 66. Garland DL, Duglas-Tabor Y, Jimenez-Asensio J, Datiles MB, Magno B. The nucleus of the human lens: demonstration of a highly characteristic protein pattern by two-dimensional electrophoresis and introduction of a new method of lens dissection. Exp Eye Res 1996; 62: 285-291. 67. Brown NP, Bron AJ. Lens growth. In: Brown NP, Bron AJ, ed. Lens disorders. A Clinical Manual of Cataract Diagnosis. Glasgow: Butterworth-Heinemann; 1996; Ch 3: 17-31.