Tema 6. Diagramas de fase.
Anuncio

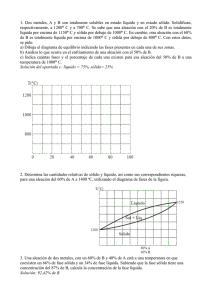
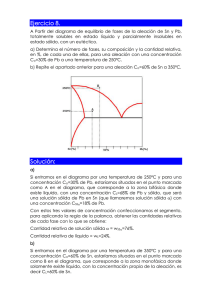
Tema 6 Diagramas de fase. Los materiales en estado sólido pueden estar formados por varias fases. La combinación de estas fases define muchas de las propiedades que tendrá el material. Por esa razón, se hace necesario tener una herramienta teórica que permita describir las fases que estarán presentes en el material. Esa herramienta teórica se llama Diagrama de fase. Las fases sólidas en un material tienen las siguientes características: • Los átomos que forman la fase tienen la misma estructura o arreglo atómico. • La fase tiene la misma composición química en todo su volumen. • Presenta las mismas propiedades físicas. • Posee una interfase definida con su entorno. Los materiales puros solamente poseen una fase. Las aleaciones pueden poseer dos o más fases presentes al mismo tiempo. Una aleación se define como una solución en estado sólido. Una solución no es más que la mezcla de dos o más elementos químicos. Un diagrama de fases es un “mapa” que describe las fases presentes en un material en función de variables termodinámicas. Cuando se mezclan dos o más elementos para formar una aleación, se pueden dar las siguientes situaciones: 1. Existe solubilidad ilimitada produciéndose una fase sólida. El ejemplo típico de este caso es cuando se mezclan agua y alcohol. Para el caso de dos metales, el cobre y el níquel tienen solubilidad ilimitada, formándose una sola fase en estado sólido. 2. Existe solubilidad limitada, lo cual significa que uno de los componentes puede disolverse hasta cierto límite en el otro. En este caso se producen dos o más fases en la solución. El ejemplo típico es mezclar sal con agua. En ciertas cantidades, la sal se disuelve completamente en el agua, creando una fase (agua salada). Después de cierto límite, la sal no se disuelve más, generándose dos fases (agua salada + sal no disuelta). Para el caso de los metales, el cobre y el zinc tienen solubilidad limitada generándose varias fases en estado sólido. En el presente curso, se estudiarán los diagramas de fase binarios. Una aleación binaria está formada únicamente por la mezcla de dos componentes. La cantidad en que cada componente está presente en la mezcla se cuantifica por medio del porcentaje en peso. Suponga que se fabrica una aleación mezclando el componente A con el componente B. Los porcentajes en peso serán los siguientes: 48 porcentaje en peso de A = masa de A x100 masa de A + masa de B porcentaje en peso de B = masa de B x100 masa de A + masa de B Un diagrama de fase es un gráfico en cuyo eje vertical se mide la temperatura y en el eje horizontal se mide el porcentaje en peso de los componentes que forman la aleación. A continuación se muestra el diagrama de fase de la aleación Cobre-Níquel. El diagrama de fases permite obtener la siguiente información: 1. Las fases presentes en la aleación en función de la temperatura y la composición química. Suponga que una aleación cobre-níquel se encuentra a una temperatura de 1300º C. Suponga que la aleación está formada por 20% Ni y 80% Cu. En el diagrama se traza una línea horizontal a 1300ºC y luego una línea vertical en 20% Ni. El punto donde se cruzan estas dos líneas representa a la aleación. El nombre de la zona donde queda ubicado el punto nos da el nombre de la fase o fases 49 presentes. Para este ejemplo, la aleación se encuentra en fase líquida a esa temperatura y composición química. 2. La composición química de las fases presentes. Aquí se tienen dos casos: • Si la aleación posee una fase, la composición de la fase es igual a la composición de la aleación. • Si la aleación tiene dos fases, la composición de cada una de ellas se encuentra según se ilustra en el diagrama. 50 3. La cantidad de cada fase, en fracción o porcentaje, con respecto a la masa total de la aleación. Para ello se utiliza la regla de la palanca. A B Sólido porcentaje de líquido = distancia B x100 distancia total (A + B) porcentaje de sólido = distancia A x100 distancia total (A + B) Durante la solidificación de las aleaciones ocurre la segregación. Este fenómeno consiste en que la composición química del sólido que se forma primero es diferente a la del sólido que se forma por último. Esto es consecuencia del diagrama de fases. La segregación causa que la composición química de la pieza sólida no sea uniforme. Esta falta de uniformidad causa que las propiedades mecánicas de la pieza tampoco 51 sean uniformes. Para ciertas aplicaciones, esta falta de uniformidad en las propiedades mecánicas puede resultar inconveniente. Cuando la solubilidad es limitada, el diagrama de fases es diferente. A continuación se muestra el diagrama de fases de una aleación de estaño y plomo. Punto eutéctico Línea de solubilidad. Indica cuando existe precipitación de uno de los componentes. En este caso, de α precipita β Este diagrama posee dos diferencias significativas con respecto al anterior: 1. Posee líneas de solubilidad. Estas líneas indican cuando un componente precipita de otro de manera similar a como precipitaría sal de una solución de agua salada a medida ésta se enfría. 2. Posee un punto eutéctico. En este punto todo el líquido se transforma instantáneamente en sólido. Debido a que la solidificación es rápida, no se da por nucleación y crecimiento por lo que el sólido que se forma resulta con una estructura diferente. A ese sólido se le llama sólido eutéctico. El sólido eutéctico se forma siempre a una misma temperatura, la cual se le llama temperatura eutéctica. La solidificación de una aleación binaria con solubilidad limitada puede darse de las siguientes maneras: 52 No hay precipitación ni eutéctico. La aleación solidifica igual a una aleación con solubilidad ilimitada. Al final del proceso se tiene la fase sólida α Durante el enfriamiento la aleación pasa por una línea de solubilidad, generándose la precipitación de un componente. Para el ejemplo, de la fase sólida α precipitan pequeñas partículas de sólido β. α y β son sólidos que difieren entre sí por su composición química. 53 La aleación tiene la composición eutéctica. Arriba de la temperatura eutéctica (183ºC para el ejemplo) toda la aleación es completamente líquida. Por debajo de dicha temperatura, todo es sólido eutéctico La aleación posee dos fases sólidas. Una de las fases (α en este caso) se forma arriba de la temperatura eutéctica. Por esa razón se llama α proeutéctico. La otra fase es el sólido eutéctico. Para cada uno de estos casos, la microestructura del sólido a temperatura ambiente es diferente (sólido α, sólido α + precipitado de β, sólido eutéctico, sólido α + sólido eutéctico). Además, a la derecha del punto eutéctico se forma sólido β + sólido eutéctico, sólido β + precipitado de α, y sólido β. Esta gama de combinaciones de fases trae como consecuencia que las propiedades de cada una de las aleaciones sean diferentes. La conclusión es que la mezcla de dos metales en cantidades diferentes produce aleaciones diferentes las cuales tienen propiedades diferentes entre sí. Esto valida una de las ideas centrales de la Ciencia de los Materiales: las propiedades de un material dependen de su estructura. 54 PROBLEMAS (1) La composición química de una aleación de cobre y zinc se desconoce. Sin embargo se sabe que a la temperatura de 500º C se tiene 35 % de fase γ mezclada con un porcentaje desconocido de fase β. (a) ¿Qué porcentaje de fase β existe en la aleación? (b) Encuentre la composición química de la aleación. (2) En la figura se muestra el diagrama de fases plomo (Pb) estaño (Sn). Se desea fabricar 400 gramos de una aleación que a 183º C, contenga 20% de fase α y 80% de sólido eutéctico. ¿Cuántos gramos de estaño deben mezclarse con cuántos gramos de plomo para lograr esta aleación? 55 (3) ¿Cuántos gramos de metal A deberán agregarse a 500 gramos de metal B para producir una aleación que contenga 50% en peso de α a 900º C? α β 56 (4) Una aleación Pb-Sn contiene 25% de α y 75% de β a 100º C. Determine la composición de la aleación. ¿Es la aleación hipoeutéctica o hipereutéctica? 57 (5) El diagrama de fases mostrado describe a una aleación estaño (Sn) - plomo (Pb). Se observa que a una temperatura de 183.1º C la aleación está compuesta por aproximadamente 32% de fase sólida β. Determine el % de estaño de la aleación. 58 (6) Suponga que un baño de 1200 lb de una aleación de Cu-20% en peso de Ni se mantiene a 1300º C. ¿Cuántas libras de níquel pueden agregarse a este baño antes que se forme algún sólido? ¿Cuántas libras de Cobre deben agregarse para que todo el baño sea sólido? 59