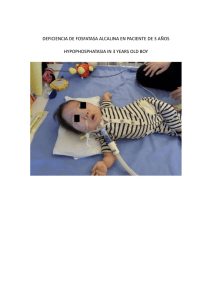
FOSFATASA ALCALINA
Anuncio

FOSFATASA ALCALINA USO DEL PRODUCTO Para la determinación de la actividad fosfatasa alcalina en suero o plasma. Método Cinético 405 nm según DGKC/SSCC Blanco Muestra 1 ml 1 ml Reactivo de Trabajo Incubar hasta que el reactivo alcance los 37°C FUNDAMENTO DEL MÉTODO El sustrato p-nitrofenilfosfato (p-NFF) es hidrolizado por la fosfatasa alcalina de la muestra, con producción de fosfato y pnitrofenol. El medio de reacción alcalino, el sustrato es incoloro, mientras que el p-nitrofenol producido es amarillo, con máximo de absorción a 405 nm. La cantidad formada de éste último para un determinado tiempo, se mide fotométricamente y es proporcional a la actividad de la Fosfatasa Alcalina de la muestra (1). Muestra - 100 µl Mezclar luego de cada agregado. Incubar 30 min exactos. NaOH 20 mmol/l 10 ml 10 ml Muestra 100 µl - Mezclar. Leer en espectofotómetro a 405 nm o colorímetro(390-420 nm). Llevar a cero con blanco de agua. Color estable 2 horas. REACTIVOS Buffer: Glicina 50 mmol/l, Mg++ 0,5 mmol/l pH 10,5. Listo para Usar. Sustrato: Viales con p-NFF para una concentración final de 6 mmol/l Estándar: Solución acuosa de p-nitrofenol 0,5 mmol/l Hidróxido de Sodio 5N: Solución concentrada para preparar 1000 ml de solución de 20 mmol/l (Nota 1) Conservación y Estabilidad de los Reactivos Conservar en refrigerador 2-8°C. La estabilidad alcanza la fecha de vencimiento indicada en la caja. Precauciones y Advertencias sobre el Uso de los Reactivos Los reactivos son para uso IN VITRO. Indicios de inestabilidad y deterioro de los Reactivos Coloración amarilla del Buffer. CALCULOS Previamente restar de la lectura de cada Muestra, la correspondiente lectura de su Blanco. Se obtiene así la Lectura Corregida (Nota 2). 1.Espectofotómetro (405 nm) Cubeta: 1cm de paso de luz. Fosfatasa Alcalina U/l=Lectura Corregidax200 2.Colorímetro (390-420 nm) MUESTRA Suero fresco ó plasma heparinizado. Las muestras dejadas a temperatura ambiente, almacenadas en refrigerador o congeladas, experimentan variaciones en la actividad de fosfatasa alcalina (2). Esto también sucede con los reconstituidos de sueros liofilizados. Por tales razones, para poder obtener máxima precisión en el ensayo, se recomienda trabajar con especímenes frescos. Sustancias Interferentes Los anticoagulantes son inhibidores de la fosfatasa alcalina. La hemólisis causa interferencias. Se han descrito algunas interferencias medicamentosas (3), por lo tanto, es útil conocer la medicación del paciente. En papel milimetrado graficar las lecturas de D.O. obtenidas para cada tubo (ordenada), contra los valores de la Actividad de las muestras, llevar el valor de la Lectura Corregida a la gráfica e interpolar (Nota 2). PREPARACION DEL REACTIVO DE TRABAJO Agregar en el frasco se Sustrato, el volúmen de Buffer que indica el rótulo. Agitar hasta la disolución total. Conservación y estabilidad Proteger de la luz directa Refrigerados (2-8°C)...........................................estable 30 días Temp.Amb (15-25°C)..........................................estable 4 días Indicios de deterioro Lecturas de Absorbancia a 405 nm superiores a 0,400 DO., indican deterioro. ENSAYO Procedimiento En tubos en baño a 37°C agregar: Tubo N° B 1 2 3 4 5 6 Estándar 0 0.1 ml 0.2 ml 0.4 ml 0.6 ml 0.8 ml 1,0 ml 10 ml 10 ml 10 ml 10 ml 10 ml 10 ml 10 ml NaOH 20 mmol/l Mezclar. Leer colorímetro 390-420 nm. Llevar a cero con el Blanco. Actividad U/l 0 18.3 36.3 71,2 105 137 168 VALORES DE REFERENCIA (Nota 3) Adultos: 20-50 U/l Niños: 38-140 U/l SISTEMA ANALÍTICO A. Linealidad: hasta 160 U/l. Valores superiores, repetir en ensayo con muestra diluída en solución fisiológica. Corregir el resultado por la disolución efectuada. B. Sensibilidad: Dependiendo del espectofotómetro, alcanza generalmente a 0,2 U/l. C. Precisión: Intraensayo Nivel Medio Rango D.S. C.V.% 70 U/l 67-79 U/l ± 3,0 U/l 4,2 120 U/l 94-126 U/l ± 5,o U/l 4,1 Nivel Medio Rango D.S. C.V.% 117 U/l 111-124 U/l ± 6,3 U/l 5,3 Interensayo NOTAS 1. Trasvasar el contenido del frasco de Hidróxido de sodio 5 N a un envase de 1000 ml de capacidad. Enjuagar el frasco. Completar a 1000 ml con agua desionizada. Mezclar. La solución obtenida es de NaOH 20 mmol/1. 2. Cuando las LECTURAS CORREGIDAS superan 0,800 D.O., debe repetirse la determinación con la muestra diluida adecuadamente con solución fisiológica. Corregir el resultado obtenido por la dilución efectuada. 3. Los valores de referencia para niños varían ampliamente según la edad. Los valores más elevados se observan en la pubertad. PRESENTACION Código 302005: 5 x 10 mI. BIBLIOGRAFIA 1.Bessey, O. y cols. J. Biol. Chem., 164,231 (1946) 2.Massion, O. y cols., Clin. Chem., 18-4 :366 (1972) 3.Young, O. Clin. Chem., 21-5 : 246 (1975) INDICACIONES AL CONSUMIDOR Garantía de Calidad del Producto GT Laboratorio elabora y comercializa productos para análisis uno IN VITRO siguiendo normas GMP, ISO 9001:2008 e ISO 13485: 2003. Los términos y condiciones de calidad son absolutos dentro de la competencia de responsabilidad, que corresponda a GT Laboratorio. Cualquier alteración en los productos elaborados por GT Lab serán reconocidos sin cargo de ningún tipo para el usuario. Todo reclamo de calidad deberá efectuarse por escrito debidamente firmado y sellado por el profesional responsable, con el detalle del desperfecto, acompañando el producto en cuestión para su exanimación técnica por el Departamento de Control de Calidad de Gt Lab. Los reclamos deberán ser enviados a través del Distribuidor que efectuó la venta. Las reposiciones y/o respuestas técnicas serán cursadas de forma fehaciente al Profesional usuario INFORMACION PARA CONTACTARSE GT Laboratorio s.r.l Necochea 3274 (S2001QXL) Rosario – Santa Fe – Argentina Tel / Fax: +54 (341) 481-1002 y rot. e-mail: [email protected] USO PROFESIONAL EXCLUSIVO. Autorizado por A.N.M.A.T. PM N°121-12 Elaborado por GT Laboratorio S.R.L. Establecimiento Inscripto y Habilitado por ANMAT Industria y Tecnología Argentina Dir. Tec: Daniel Gazzola. Bioquímico Elaborado por: GT Laboratorio s.r.l Industria y Tecnología Argentina Código y Fecha de Revisión: 30290000/13