Estadificación ganglionar axilar prequirúrgica en el cáncer de mama
Anuncio

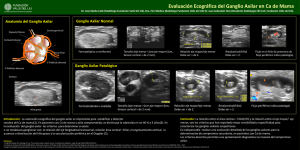
Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Radiología. 2011;53(6):544---551 www.elsevier.es/rx ORIGINAL Estadificación ganglionar axilar prequirúrgica en el cáncer de mama: parámetros ecográficos y biopsia con aguja gruesa ecoguiada M.Y. Torres Sousa ∗ , M.E. Banegas Illescas, M.L. Rozas Rodríguez, M. Arias Ortega, L.M. González López, J.J. Martín García y L. Ruiz Ortega Servicio de Radiodiagnóstico, Hospital General Universitario de Ciudad Real, Ciudad Real, España Recibido el 11 de agosto de 2010; aceptado el 21 de diciembre de 2010 Disponible en Internet el 11 de mayo de 2011 PALABRAS CLAVE Biopsia con aguja gruesa; Axila; Adenopatías; Ecografía ∗ Resumen Objetivo: Analizar el papel de la biopsia con aguja gruesa de adenopatías axilares con sospecha ecográfica de metástasis en pacientes con cáncer de mama, y la correlación radiopatológica. Material y métodos: Estudio retrospectivo de 74 pacientes diagnosticadas de cáncer de mama, a las que se realizó biopsia con aguja gruesa ecoguiada de adenopatías axilares con características ecográficas indicativas de metástasis. Consideramos hallazgos ecográficos sospechosos de metástasis: engrosamiento cortical, alteración de la grasa hiliar y/o flujo vascular cortical no hiliar. Las pacientes con biopsia axilar negativa se incluyeron en el protocolo de biopsia de ganglio centinela. Resultados: La biopsia con aguja gruesa confirmó metástasis ganglionar en 47 (63,5%) pacientes. Las 27 pacientes (36,5%) con biopsia negativa se incluyeron en el protocolo de biopsia de ganglio centinela y 3 (11%) presentaron ganglio centinela positivo, realizándose linfadenectomía axilar. De las 50 adenopatías con metástasis, 44 (88%) presentaron engrosamiento cortical, 20 (40%) alteración de la grasa hiliar y 29 (58%) flujo vascular cortical no hiliar. En todas las adenopatías con engrosamiento cortical y flujo vascular cortical no hiliar la biopsia fue positiva, indicando un valor predictivo positivo del 100% en esta serie. Conclusiones: La biopsia con aguja gruesa ecoguiada de adenopatías axilares con sospecha ecográfica de metástasis por cáncer de mama es un procedimiento con alta efectividad diagnóstica y baja morbilidad. La presencia de engrosamiento cortical y flujo vascular cortical no hiliar en la misma adenopatía mostró un valor predictivo positivo del 100% en esta serie. © 2010 SERAM. Publicado por Elsevier España, S.L. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: [email protected] (M.Y. Torres Sousa). 0033-8338/$ – see front matter © 2010 SERAM. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.rx.2010.12.007 Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estadificación ganglionar axilar prequirúrgica en el cáncer de mama KEYWORDS Core needle biopsy; Axillary; Lymph nodes; Ultrasonography 545 Preoperative staging of axillary lymph nodes in breast cancer: ultrasonographic parameters and ultrasound-guided core needle biopsy Abstract Objective: To analyze the role of core needle biopsy of axillary lymph nodes with suspected metastases from breast cancer and to correlate the imaging and histologic findings. Material and methods: We retrospectively studied 74 patients diagnosed with breast cancer who underwent ultrasound-guided core needle biopsy of axillary lymph nodes with characteristics suggestive of metastases on ultrasonography. The following ultrasonographic findings were considered suspicious for metastases: cortical thickening and changes in the hilar fat and/or non-hilar cortical vascular flow. Patients with negative findings after axillary biopsy underwent sentinel node biopsy. Results: Core needle biopsy confirmed lymph node metastases in 47 (63.5%) patients. The 27 patients (36.5%) with negative findings after lymph node biopsy underwent sentinel node biopsy; 3 (11%) of these had a positive sentinel lymph node and underwent axillary lymph node resection. Of the 50 lymph nodes with metastases, 44 (88%) had cortical thickening, 20 (40%) had changes in the hilar fat, and 29 (58%) had non-hilar cortical vascular flow. All biopsies of lymph nodes with both cortical thickening and non-hilar cortical vascular flow were positive, yielding a 100% positive predictive value in this series. Conclusions: Ultrasound-guided core needle biopsy of axillary lymph nodes that are suspicious for metastases from breast cancer at ultrasonography is a highly effective procedure that has low morbidity. Findings of cortical thickening and non-hilar cortical vascular flow in the same lymph node yield a positive predictive value of 100% in this series. © 2010 SERAM. Published by Elsevier España, S.L. All rights reserved. Introducción Material y métodos Tradicionalmente, la linfadenectomía axilar (LDA) ha formado parte del tratamiento quirúrgico del cáncer mama por su valor terapéutico y pronóstico1---3 . El desarrollo tecnológico y del cribado mamográfico ha posibilitado el diagnóstico frecuente de tumores en estadios precoces, con una probabilidad baja de enfermedad axilar4 , que se pueden tratar de forma más conservadora, y la biopsia selectiva del ganglio centinela (BSGC) surge como alternativa a la LDA5,6 . La BSGC es un procedimiento válido y ampliamente extendido en el cáncer de mama sin evidencia prequirúrgica de afectación ganglionar axilar7---11 . Requiere entrenamiento de los equipos multimodales, mayor tiempo de ocupación del quirófano y no es un procedimiento perfecto5,6,12,13 , siendo prioritario seleccionar las pacientes beneficiarias de la BSGC para evitar LDA innecesarias o BSGC no indicadas12 . La confirmación preoperatoria de metástasis axilares descarta la BSGC. Diversas técnicas de imagen tienen esta finalidad3,14,15 y la ecografía es la más empleada16---18 , siendo útil como guía de la punción aspiración con aguja fina (PAAF) y/o de la biopsia con aguja gruesa (BAG) de adenopatías con sospecha de metástasis12,19,20 . El objetivo de nuestro estudio ha sido analizar la utilidad de la BAG-ecoguiada en el diagnóstico preoperatorio de adenopatías axilares metastásicas en pacientes con cáncer de mama y las características ecográficas que permiten su identificación, siendo nuestro patrón de referencia el resultado histológico de la BSGC y/o la LDA. Mostramos nuestra experiencia en 74 pacientes. Entre 2008 y 2009 se diagnosticaron en nuestra unidad 197 nuevos cánceres de mama. Hemos estudiado retrospectivamente a 74 pacientes diagnosticadas de cáncer de mama en las que se efectúo BAG-ecoguiada de adenopatías axilares por presentar hallazgos ecográficos indicativos de metástasis. Revisamos las imágenes ecográficas y los resultados histológicos de la BAG axilar, de la BSGC y/o de la LDA. Todas las pacientes fueron estudiadas con mamografía digital (doble proyección) y ecografía mamaria y axilar bilateral. Las lesiones mamarias se caracterizaron histológicamente como malignas mediante BAG o con un sistema direccional asistido por vacío interno, guiados por ecografía o estereotaxia digital en mesa prona. Todos los tumores se encontraban en estadios T1 o T2, N0 y M0. Las pacientes fueron informadas del procedimiento de biopsia y de BSGC, firmaron el consentimiento informado y ninguna estaba en situación de gestación o lactancia. La BSGC se realizó siguiendo los criterios recomendados en la «reunión de expertos» desarrollada en Murcia en 2006. El estudio ecográfico se realizó con un ecógrafo de alta resolución modelo Antares (Siemens® , Erlangen, Alemania) y sonda lineal multifrecuencia de 10-5 MHz, con la paciente en decúbito supino o apoyada sobre el lado contralateral al que deseamos estudiar y ambos brazos elevados hacia la cabeza. La axila se estudió en sentido caudocraneal revisando los niveles I, II y III de Berg. Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 546 M.Y. Torres Sousa et al Figura 1 Ganglio con cortical > 3 mm. BAG: micrometástasis. Los parámetros ecográficos valorados han sido: grosor cortical, alteración morfológica de la grasa hiliar y características del flujo vascular cortical. Consideramos hallazgos sospechosos de metástasis los siguientes: grosor cortical focal o difuso igual o superior a 3 mm (fig. 1), ausencia, obliteración o situación excéntrica de la grasa hiliar (fig. 2), Figura 2 y/o presencia de flujo vascular cortical no hiliar (FVCNH) (fig. 3) en la ecografía Doppler-dúplex color con parámetros para flujos de baja velocidad: frecuencia de repetición de pulso de 488, escala de velocidad de 3 cm/s y ajuste individualizado del resto de parámetros. Efectuamos BAG de aquellas adenopatías con uno o más de estos hallazgos. Metástasis en ganglio axilar con ausencia de hilio graso. Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estadificación ganglionar axilar prequirúrgica en el cáncer de mama Figura 3 547 Ganglio con FVCNH y metástasis de CDI. Cuando en una paciente varios ganglios mostraron alteraciones ecográficas se practicó la biopsia del más sospechoso, considerando como tal aquel que reunía mayor número de parámetros indicativos de metástasis. A igualdad de parámetros, la ausencia de grasa hiliar fue el criterio que primó en la selección del ganglio, dado que tras revisar la literatura médica es el de mayor valor predictivo positivo (VPP)12,21,22 . No tuvimos ningún caso con varios ganglios sospechosos y un único hallazgo ecográfico diferente en cada uno. En ninguna paciente la accesibilidad fue un factor limitante para la BAG. A las pacientes con una BAG axilar positiva se les realizó LDA, y BSGC a las pacientes con resultado negativo, que se completó con LDA cuando el ganglio centinela fue positivo. Todas las biopsias axilares fueron realizadas por el mismo radiólogo, con técnica de «manos libres» (fig. 4). Se utilizó un sistema de biopsia desechable, con obtención de muestra en 2 tiempos, modelo Acecut (Leleman® , Hirayanagicho, Japón) y aguja de corte de 75 mm de longitud, 14 G de grosor y cunas de recogida del espécimen de 11 o 22 mm de longitud (fig. 5). El primer disparo se efectuó con la punta de la aguja situada en la periferia del ganglio, a una distancia segura de las estructuras vasculonerviosas, para posteriormente (con la cuna abierta) avanzar y colocar manualmente la aguja atravesando el ganglio; así, en el segundo disparo, el corte y recogida sólo afectará al tejido ganglionar ensartado previamente en la aguja. Se recogieron al menos 3 muestras de cada adenopatía, incluyendo material de la corteza y del mediastino ganglionar (fig. 6). Los cilindros se remitieron al servicio de anatomía patológica fijados en formol en un envase independiente e identificado. Se utilizaron diferentes envases y sistemas de biopsia para la lesión mamaria y las adenopatías, evitando posibles falsos positivos por contaminación de las muestras. El diagnóstico histológico se realizó procesando los especímenes con hematoxilina-eosina (HE) y pruebas de inmunohistoquímica (IH) cuando el resultado con HE fue negativo. En el análisis estadístico cotejamos los hallazgos ecográficos y los resultados histológicos de la BAG, considerando como patrón de referencia los resultados de la BSGC y/o la LDA. Creamos una base de recogida de datos incluyendo las variables: edad de la paciente, criterios ecográficos valorados en los ganglios axilares (grosor cortical, alteración de la grasa hiliar y presencia de FVCNH), resultado histológico de la BAG ganglionar, del GC y/o de la LDA, número de ganglios extraídos y tipo histológico y tamaño tumoral (en la pieza quirúrgica). Las BAG axilares positivas se consideraron verdaderos positivos, las negativas con BSGC negativa se consideraron verdaderos negativos y las BAG negativas con BSGC positiva se consideraron falsos negativos. Hemos calculado la sensibilidad, el valor predictivo negativo (VPN) de la biopsia axilar y el VPP de cada parámetro ecográfico estudiado. Resultados La edad media de las pacientes fue de 51 años (rango de 3283 años). El tipo histológico definitivo (pieza quirúrgica) del tumor primario de mama fue: carcinoma ductal infiltrante (CDI) en 53 pacientes (71,62%), CDI con extenso componente intraductal en 12 (16,22%), carcinoma ductal in situ extenso (más de 4 cm) en 3 casos (4,05%) y carcinoma lobulillar infiltrante en 6 (8,11%). El tamaño medio tumoral fue de 16,9 mm (rango de 4,7-43 mm). De las 74 pacientes, 47 (63,5%) presentaron metástasis ganglionares en la biopsia axilar. A las 27 (36,5%) pacientes con resultado negativo se les realizó BSGC: en 24 (89%) el GC fue negativo (uno con células tumorales aisladas) y en 3 (11%) fue positivo (micrometástasis), y en estas se completó con una LDA no resultando ningún ganglio positivo (se extrajeron: 11, 15 y 22 ganglios, media de 16). El VPN de la BAG Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 548 M.Y. Torres Sousa et al Figura 4 BAG-ecoguiada. Técnica de manos libres. axilar ha sido de 88,9% (24/27), con una sensibilidad del 94% (47/50). De las 27 pacientes con BAG axilar negativa, en 21 (78%) se identificó grosor cortical superior a 3 mm; 2 (7%) mostraron alteración morfológica de la grasa hiliar y 8 (30%) FVCNH, presentando algunas adenopatías 2 o más criterios ecográficos de metástasis. De las 50 pacientes con adenopatías positivas (BAG positiva o negativa con GC positivo): 44/50 (88%) presentaban engrosamiento cortical, 20/50 (40%) alteración de la grasa hiliar y 29/50 (58%) FVCNH. Figura 5 Individualmente la ausencia u obliteración de la grasa hiliar fue el indicador ecográfico con mayor VPP (90%) frente al FVCNH (78%) y el engrosamiento cortical (68%). La combinación «engrosamiento cortical y FVCNH» resultó positiva en todos los casos identificados en esta serie (VPP 100%) (tabla 1). En todas las biopsias obtuvimos material suficiente para el estudio histológico y no se produjo ninguna complicación mayor como infección, sangrado importante o lesión neurológica. Aguja gruesa 14 G: cuna de recogida de muestras abierta. Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estadificación ganglionar axilar prequirúrgica en el cáncer de mama Figura 6 549 BAG axilar: especímenes obtenidos. Discusión En todas las pacientes con BAG axilar positiva se evitó la BSGC. En los 3 falsos negativos de la BAG, el GC fue el único ganglio positivo tras realizar la LDA, y sólo se identificaron micrometástasis, depósitos menores de 2 mm que no suelen ser detectados mediante técnicas de rutina; los ecopotenciadores de segunda generación pueden aumentar la sensibilidad diagnóstica23 . El GC con células tumorales aisladas se consideró no metastásico (verdadero negativo)12 . La ecografía es la técnica más utilizada en el estudio preoperatorio de los ganglios axilares, con un rango de sensibilidad muy amplio (35-95%) relacionado con la experiencia del operador y la diversidad de parámetros considerados como posibles predictores de metástasis17,18,24---26 . La ausencia de grasa mediastínica se considera un parámetro ecográfico con elevado VPP y baja sensibilidad12,21,22 . Tabla 1 Correlación entre hallazgos ecográficos y resultado histopatológico Resultado histopatológico Hallazgos ecográficos Maligno Benigno VPP Engrosamiento cortical Alteración de la grasa hiliar FVCNH 44 20 21 2 68% (44/65) 90% (20/22) 29 8 78% (29/37) Los resultados obtenidos en nuestro estudio son acordes con esta consideración: con un VPP del 90% fue el hallazgo más infrecuente (40%). El hallazgo ecográfico más frecuente ha sido el grosor cortical superior a 3 mm, con un VPP del 68% y una sensibilidad del 88%, ligeramente inferior a la obtenida por Deurloo et al17 y Abe et al12 en sus series, si bien Deurloo et al consideraron un grosor cortical de al menos 2,3 mm. Abe et al12 en su trabajo obtuvieron una especificidad excesivamente baja para este parámetro (6%), proponiendo como posible predictor la «relación entre grosor cortical y diámetro corto del ganglio», frente al grosor cortical como valor absoluto. Abe et al12 señalan que la presencia de FVCNH puede ser un buen predictor de metástasis ganglionar, con un elevado VPP (78%) cuando se identifica en pacientes con cáncer de mama ipsolateral. En nuestra serie obtuvimos el mismo valor. Este aumento de FVCNH puede deberse a aumento de la vascularización periférica en relación con una disminución de la vascularización hiliar por la infiltración metastásica26 . En el trabajo de Abe et al, la ausencia de grasa hiliar fue la característica ecográfica con mayor valor predictivo seguida de la combinación de 2 parámetros: «engrosamiento cortical y presencia de FVCNH», con un VPP del 81%. En nuestro estudio, todos los ganglios con «grosor cortical aumentado y FVCNH» presentaron metástasis, indicando un alto VPP (100%). Esta diferencia puede deberse al menor tamaño de la muestra y a la minimización en nuestro trabajo de la dependencia del operador del estudio ecográfico y de la biopsia axilar. El trabajo de Abe et al incluye pacientes estudiadas en diversos centros sanitarios. Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 550 La sospecha ecográfica de afectación neoplásica de la axila debe confirmarse histológicamente. La PAAF es un procedimiento frecuente y algunos autores han publicado estudios con una alta sensibilidad (60-85%) y especificidad (100%)17,19,23 . Comparada con la BAG es una técnica poco invasiva, con bajo coste efectivo, baja morbilidad, sencilla y rápida, pero es muy dependiente del operador y requiere de la disponibilidad de un citólogo experto. La BAG es menos dependiente del operador y permite obtener mayor cantidad de muestra; su principal reto es evitar la afectación del paquete vasculonervioso. En nuestra serie no tuvimos ninguna complicación. La mayor dificultad se presentó con ganglios pequeños, en situación profunda y/o cercana a una estructura vascular principal y con axilas con morfología excavada (desprovistas de grasa). Para evitar en estas situaciones posibles complicaciones, utilizamos un sistema de biopsia de doble disparo, que además facilita obtener con mayor precisión la muestra de la zona seleccionada. Esta técnica o similar ha sido descrita por otros investigadores, con sistemas de biopsia automáticos y semiautomáticos y agujas de corte de calibre 14 G, sin ninguna complicación12,27---31 . Nuestro objetivo futuro es ampliar la población de la muestra incluyendo las pacientes no sometidas a BAG axilar. Esto posibilitará establecer la sensibilidad, especificidad, valores predictivos e índices de probabilidad de la técnica y el valor como predictor de metástasis ganglionares de los parámetros ecográficos examinados. En conclusión, creemos que la biopsia ecoguiada con agujas de corte de 14 G, de disparo en 2 tiempos, permite obtener resultados positivos sin complicaciones clínicas importantes, evitando realizar BSGC innecesarias, en pacientes con cáncer de mama. La combinación de los parámetros ecográficos, «aumento de grosor cortical y presencia de FVCNH», ha mostrado en nuestra serie un VPP del 100%. Autoría Responsable de la integridad del estudio: MYTS. Concepción del estudio: MYTS, MEBI y JJMG. Diseño del estudio: MYTS, MEBI y JJMG. Obtención de los datos: MYTS, MEBI, MAO, LMGL y LRO. Análisis e interpretación de los datos: MYTS, MLRR, MAO y LMGL. Tratamiento estadístico: JJMG. Búsqueda bibliográfica: M MYTS, MEBI y MAO. Redacción del trabajo: MYTS y MLRR. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MYTS, MEBI, MLRR, MAO, LMGL, JJMG y LRO. Aprobación de la versión final: MYTS, MEBI, MLRR, MAO, LMGL, JJMG y LRO. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Cianfrocca M, Goldstein LJ. Prognostic and predictive factors on early-stage breast cancer. Oncologist. 2004;9:606---16. M.Y. Torres Sousa et al 2. Banerjee M, George J, Song EY, Roy A, Hryniuk W. Treebased model for breast cancer prognostication. J Clin Oncol. 2004;22:2567---75. 3. Lovrics PJ, Chen V, Coates G, Cornacchi SD, Goldsmith CH, Law C, et al. A prospective evaluation of positron emission tomography scanning, sentinel lymph node biopsy, and standard axillary dissection for axillary staging in patients with early stage breast cancer. Ann Surg Oncol. 2004;11: 846---53. 4. Mincey BA, Bammer T, Atkinson EJ, Perez EA. Role of axillary node dissection in patients with T1a and T1b breast cancer: Mayo Clinic experience. Arch Surg. 2001;136:779---82. 5. Fraile M, Rull M, Julian FJ, Fusté F, Barnadas A, Llatjós M, et al. Sentinel node biopsy as a practical alternative to axillary lymph node dissection in breast cancer patients: an approach to its validity. Ann Oncol. 2000;11:701---5. 6. McMasters KM, Giuliano AE, Ross MI, Reintgen DS, Hunt KK, Byrd DR, et al. Sentinel-lymph node biopsy for breast cancer: not yet the standard of care. N Engl J Med. 1998;339:990---5. 7. Giuliano A, Dale P, Turner R, Morton DL, Evans SW, Krasne DL. Improved axillary staging of breast cancer with sentinel lymphadenectomy. Ann Surg. 1995;222:394---401. 8. Bass SS, Cox CE, Ku NN, Berman C, Reintgen DS. The role of sentinel lymph node biopsy in breast cancer. J Am Coll Surg. 1999;189:183---94. 9. Liberman L, Cody HS, Hill ADK, Rosen PP, Yeh SDJ, Akhurst T, et al. Sentinel lymph node biopsy after percutaneus diagnosis of nonpalpable breast cancer. Radiology. 1999;211:835---44. 10. Nwariaku F, Euhus D, Beitsch PD, Clifford E, Erdman W, Mathews D, et al. Sentinel lymph node biopsy, an alternative to elective axillary dissection for breast cancer. Am J Surg. 1998;176:529---31. 11. Rubio I, Korouian S, Cowan C, Krag DN, Colvert M, Klimberg VS. Sentinel lymph node biopsy for staging breast cancer. Am J Surg. 1998;176:532---7. 12. Abe H, Schmidt RA, Kulkarni K, Sennett CA, Mueller JS, Newstead GM. Axillary lymph nodes suspicious for breast cancer metastasis: sampling with US-guided 14- gauge coreneedle biopsy. Clinical experience in 100 patients. Radiology. 2009;250:41---9. 13. Kumar R, Jana S, Heiba SI, Dakhel M, Axelrod D, Siegel B, et al. Retrospective analysis of sentinel node localization in multifocal, multicentric, palpable or nonpalpable breast cancer. J Nucl Med. 2003;44:7---10. 14. Murray AD, Staff RT, Redpath TW, Gilbert FJ, Ah-See AK, Brookes JA, et al. Dynamic contrast enhanced MRI of the axilla in women with breast cancer: comparison with pathology of excised nodes. Br J Radiol. 2002;75:220---8. 15. Ohta M, Tokuda Y, Saitoh Y, Suzuki Y, Okumura A, Kubota M, et al. Comparative efficacy of positron emission tomography and ultrasonography in preoperative evaluation of axillary lymph node metastases in breast cancer. Breast Cancer. 2000;7:99---103. 16. de Freitas Jr R, Costa MV, Schneider SV, Nicolau MA, Marussi E. Accuracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases in breast cancer. Eur J Surg Oncol. 1991;17:240---4. 17. Deurloo EE, Tanis PJ, Gilhuijs KG, Muller SH, Kröger R, Peterse JL, et al. Reduction in the number of sentinel lymph node procedures by preoperative ultrasonography of the axilla in breast cancer. Eur J Cancer. 2003;39:1068---107. 18. Bedrosian I, Bedi D, Kuerer HM, Fornage BD, Harker L, Ross MI, et al. Impact of clinicopathological factors on sensitivity of axillary ultrasonography in the detection of axillary nodal metastases in patients with breast cancer. Ann Surg Oncol. 2003;10:1025---30. 19. Koelliker SL, Chung MA, Mainiero MB, Steinhoff MM, Cady B. Axillary lymph nodes: USguided fine-needle aspiration Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estadificación ganglionar axilar prequirúrgica en el cáncer de mama 20. 21. 22. 23. 24. for initial staging of breast cancer- correlation with primary tumor size. Radiology. 2008;246:81---9. Krishnamurthy S, Sneige N, Bedi DG, Edeiken BS, Fornage BD, Kuerer HM, et al. Role of US-guided fine-needle aspiration of indeterminate and suspicious axillary lymph nodes in the initial staging of breast carcinoma. Cancer. 2002;95: 982---8. Duchesne N, Jaffey J, Florack P, Duchesne S. Redefining ultrasound appearance criteria of positive axillary lymph nodes. Can Assoc Radiol J. 2005;56:289---96. Shin JH, Choi HY, Moon BI, Sung SH. In vitro sonographic evaluation of sentinel lymph nodes for detecting metastasis in breast cancer: comparison with histopathologic results. J Ultrasound Med. 2004;23:923---8. Martinez Galvez M, Álvarez Benito M. Cáncer de mama. En: Pallardó Calatayud Y, Revert Ventura AJ, Cervera Deval J, editores. Actualizaciones SERAM: Imagen en Oncología. 1.a ed. Madrid: Editorial Médica Panamericana; 2009. p. 35---44. De Kanter AY, Van Eijck CHJ, Van Geel AN, Kruijt RH, Henzen SC, Paul MA, et al. Multicentre study of ultrasonographically guided axillary node biopsy in patients with breast cancer. Br J Surg. 1999;86:1459---62. 551 25. Yang WT, Ahuja A, Tang A, Suen M, King W, Metreweli C. High resolution sonographic detection of axillary lymph node metastasis in breast cancer. J Ultrasound Med. 1996;15:241---6. 26. Yang WT, Chang J, Metreweli C. Patients with breast cancer: differences in colour Doppler flow and gray-scale US features of benign and malignant axillary lymph nodes. Radiology. 2000;215:568---73. 27. Abe H, Schmidt RA, Sennet CA, Shimauchi A, Newstead GM. Usguided core needle biopsy of axillary lymph nodes in patients with breast cancer: why and how to do it. Radiographics. 2007;27:891---9. 28. Topal U, Punar S, Tasdelen I, Adim SB. Role of US-guided core needle biopsy of axillary lymph nodes in the initial staging of breast carcinoma. Eur J Radiol. 2005;56:382---5. 29. Abdsaleh S, Azavedo E, Lindgen PG. Ultrasound-guided large needle core biopsy of the axilla. Acta Radiol. 2004;45:193---6. 30. Damera A, Evans AJ, Cornford EJ, Wilson AR, Burrell HC, James JJ, et al. Diagnosis of axillary nodal metastases by US-guided core biopsy in primary operable breast cancer. Br J Cancer. 2003;89:1310---3. 31. Kim KH, Son EJ, Kim EK, Ko KH, Kang H, Oh KK. The safety and efficiency of the ultrasound-guided large needle core biopsy of axilla lymph nodes. Radiology. 2009;250:41---9.