TP 03 Espectrofotometría de Mezclas
Anuncio

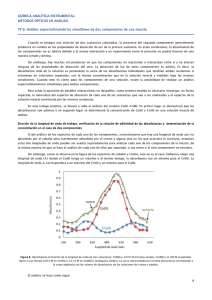
Universidad Nacional de La Plata Licenciatura en Química Química Analítica III TP 3 Espectrofotometría de Mezclas de Componentes Cuando se prepara una solución de dos sustancias coloreadas, la presencia del segundo componente a veces produce un cambio en las propiedades de absorción de luz de la primera sustancia. En estas condiciones, la absorbancia de los componentes no es aditiva debido a la mutua interacción y un experimento como el que se propone para el siguiente trabajo no podría realizarse de manera simple y directa. Sin embargo, hay muchas circunstancias en que los componentes no interactúan entre sí de ese modo la presencia de uno no afecta ninguna de las propiedades de absorción del otro. En tal caso la absorción de luz de estos componentes es aditiva, es decir, que la absorbancia total de la solución es la suma de las absorbancias individuales que tendrían ambas sustancias si estuvieran en soluciones separadas y fuesen medidas bajo las mismas condiciones. Cuando esto se cumple es posible realizar un análisis espectrofotométrico simultáneo para ambos componentes. Para descartar posibles interacciones es necesario previamente investigar, a) los espectros de absorción de cada una de las sustancias en soluciones separadas y b) el espectro de una solución mezcla y comprobar la condición de aditividad. En este trabajo práctico, se llevará a cabo el análisis del sistema Cr(III) - Co(II). En primer lugar se verificará con soluciones patrón que las absorbancias son aditivas, y en segundo lugar se determinará la concentración de Co(II) y Cr(III) en una solución-mezcla problema. Elección de las longitudes de onda de trabajo Si del análisis de los espectros de los componentes individuales encontráramos una longitud de onda en donde uno de los componentes absorbe y mientras que el otro no, y otra en que ocurriera lo contrario para el otro componente, entonces estas dos longitudes de onda pueden ser usadas separadamente para analizar cada uno de los componentes de la mezcla. En tal caso el análisis de cada uno de ellos sería como si el otro componente no existiera y se estuviera analizando por separado. Desafortunadamente como se observa en el gráfico de los espectros de Co y Cr este no es nuestro caso. 1 Universidad Nacional de La Plata Licenciatura en Química Química Analítica III TP 3 Mezcla cromo - cobalto 0.8 0.7 Absorbancia 0.6 0.5 0.4 suma cobalto 0.3 mezcla 0.2 0.1 cromo 0.0 350 400 450 500 550 600 650 700 λ [nm] Debemos elegir una longitud de onda (1) donde la absorbancia del Co(II) sea máxima respecto de la del Cr(III) a la misma longitud de onda. De la misma manera, deberemos elegir una 2 para Cr(III) en donde la absorbancia del Cr(III) sea máxima respecto a la de Co(II) a esa misma longitud de onda. El análisis se hace como sigue: si que cada componente cumple con la ley de Lambert-Beer, entonces: A=b C Utilizando la misma cubeta el factor b será siempre el mismo, entonces, agrupando y b en una constante única queda: A=k C En esta ecuación k es la constante de proporcionalidad que relaciona la absorbancia A y la concentración C para una sustancia particular a una determinada longitud de onda. Si preparamos una serie de soluciones de distinta concentración, medimos su absorbancia y graficamos A vs. C obtendremos una recta de pendiente k (gráficos de Beer). Para una solución que contiene n componentes que absorben la luz, cuyas absorbancias son aditivas, la absorbancia total de la solución a una determinada longitud de onda i, debe ser representada como la sumatoria de las absorbancias individuales: A i =∑ k ij C j i donde A es la absorbancia, C la concentración molar y k ij = b ( es la absortividad molar y b el camino óptico). El subíndice j hace referencia refiere al componente, y el subíndice i a la longitud de onda usada. Para un sistema de dos componentes y utilizando dos longitudes de onda diferentes las ecuaciones a emplear serán: A 1=k11 C1k22 C2 y A 2=k21 C1k22 C2 2 Universidad Nacional de La Plata Licenciatura en Química Química Analítica III TP 3 Resolviendo este sistema, se puede determinar simultáneamente la concentración de los dos componentes en la mezcla. Los kij se obtienen de las pendientes de los gráficos de Beer de las soluciones de las sustancias puras a cada una de las las longitudes de onda a utilizar. Experimental Equipos: Espectrofotómetro Spectronic 20 Espectrofotómetro doble haz Cintra Soluciones madres Nitrato de cobalto Co(NO3)2 0.1880M Nitrato de Cromo Cr(NO3)3 0.0750M Material necesario 5 Matraces de 25 ml pipetas de doble aforo de 5, 10 y 20 ml cubetas I. Demostrar la aditividad de las absorbancias de las soluciones de Cr(III) y Co(II) a) Preparar las siguientes soluciones: a) 25 ml de Cr(NO3)3 0.0150 M a partir de la solución 0.0750M llevando a volumen con A.D.. b) 25 ml de Co(NO3)2 0.0752 M a partir de la solución 0.1880 M llevando a volumen con A.D.. c) 25 ml de mezcla 0.0200 M en Cr(NO3)3 y 0.0752 M en Co(NO3)2. b) Determinar el espectro de absorción de las soluciones de Co y de Cr y el de la mezcla de ambos contra un blanco de AD. Si no es posible determinar en espectro completo leer punto a punto entre: 375 y 625nm. 3 Universidad Nacional de La Plata Licenciatura en Química Química Analítica III TP 3 c) En un mismo gráfico representar los tres espectros medidos y también en obtenido mediante la suma de las absorbancias medidas para las soluciones puras. Si el espectro-suma y el espectro de la mezcla coinciden entonces se cumple la condición de aditividad de absorbancias y, por tanto, no hay interacción entre los componentes. ¿Podría realizarse la determinación si la aditividad se cumple para algunas longitudes de onda pero para otras no? II. Determinación de las constantes “k” de las gráficas de la ley de Beer. a) Preparar las siguientes soluciones: b) 25 ml de Cr(NO3)3 0.0150 M (ésta solución fue preparada en el punto I) y 0.0300 M a partir de la solución de concentración 0.0750M llevando a volumen con A.D.. c) 25 ml de Co(NO3)2 0.0376M y 0.0752 M (ésta solución fue preparada en el punto I) a partir de la solución 0.1880 M llevando a volumen con A.D.. b) Seleccionar de los espectros de Cr y Co las longitudes de onda adecuadas para hacer las lecturas de absorbancia de las seis soluciones anteriores. c) Para cada longitud de onda medida, graficar absorbancia vs concentración para cada compuesto. De las pendientes determinar los valores de k. III. Determinación de la concentración de Cr y Co en una solución problema A las longitudes seleccionadas en el punto anterior medir la absorbancia de la muestra desconocida y resolviendo el sistema de ecuaciones calcular la concentración de Cr y Co en la muestra Bibliografía Reilly y Sawyer : Experimental for Instrumental Methods. 4