- Ninguna Categoria
Diapositiva 1 - Instituto de Neurologí
Anuncio
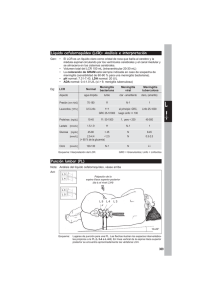
ANATOMÍA, FISIOLOGÍA Y COMPOSICIÓN DEL LCR Prof. Agdo Dr. Carlos Oehninger CÁTEDRA DE NEUROLOGÍA INSTITUTO DE NEUROLOGÍA SEMINARIO DE VERANO DIAGNÓSTICO DE LAS ENFERMEDADES NEUROLÓGICAS POR LCR COORDINADORES PROF. DR. R. SALAMANO y PROF. AGDO DR. C. OEHNINGER 17 Febrero 2011 1: posterior medullary velum 2: Choroid plexus 3: Cisterna cerebellodellaris of subarachnoid cavity 4: Central canal 5: Corpora quadrigemina 6: Cerebral peduncle 7: Anterior medullary velum 8: Ependymal lining of ventricle 9: Cisterna pontis of subarachnoid cavity : Flow of cerebrospinal fluid (CSF) through foramen of Magendie Human brain left - midsagitttal view closeup 1.Corpus callosum, Rostrum 2.Corpus callosum, Genu 3.Corpus callosum, Corpus 4.Corpus callosum, Splenium 5.Septum pellucidum 6.Epiphyse 7.Recessus pinealis 8.Plexus choroideus 9.Foramen intervetriculare 10.Comissura anterior 11.Recessus supraopticus 12.Recessus infundibuli 13.Infundibulum 14.Aqaeduct 15.Ventriculus quartus 16.Adhaesio interthalamica PRODUCCIÓN de LCR SISTEMA PLEXOS COROIDEOS-LCR CIRCULACIÓN LCR LCR .1ª denominación “brain water” (2700AC Imperio Antiguo, papiros quirúrgicos de Edwin) . A Versalius (1540) “waterlike fluid” 1/6 TBV . fact tróficos CP - CSF homeostasis desarrollo . fact angiogénicos . carriers . aminoácidos, proteínas, hormonas (leptina, prolactina) . nucleósidos, hexosas, etc reparación y neuroprotección PC - LCR .PC Formación 4º V Laterales 3º . secuencia uniforme en mamíferos . momento precoz en la gestación (1/2 del embarazo) . Tubo Neural se llena antes de que se formen los PC (¿síntesis pre PC?) . Síntesis de LCR aumenta con la ontogénesis . Genera y mantiene presión hidrostática intraventricular desarrollo del SNC . “Nourrishing” del cerebro en vías de desarrollo . “Nursery” del desarrollo y guía del axón en crecimiento LCR . Fluído dinámico . Activo metabólicamente . Invalorable en diagnóstico inflamación infección inmuno-reacción HSA (TAC (-)) metástasis leptomeníngeas . Transporta biomoléculas . Remueve metabolitos (CO2, Lactato) . 140-270 ml de fluido (CB, ESA, médula) . 0.35 ml/minuto/g . Removido “turn over” cada 5-7 hs (24 hs aprox.600ml) . Aspecto: límpido (agua de roca), incoloro . Presión < 18 cm H2O; < 15 mm Hg . Viscosidad: 1.020-1027 . pH: 7.3 . Acido láctico: 19 mg/dl (1.1 – 2.2 mmol/L) . pO2: 30 mm/Hg; pCO2: 46 mm Hg; Bicarbonato: 22 mEq/L) . Proteínas totales: 40 mg/100 ml . Gamaglobulinas: 2.1 mg/100ml . Mucoproteínas: 4.9 mg/100 ml . Glucosa: 2/3 de la Glicemia . Celularidad: 0 – 5 células / cm3 LCR deriva de Plexos coroideos Fluido intersticial Meninges Raíces dorsales LCR: en condiciones patológicas Células del LCR existen otras fuentes Células cerebrales Fluidos característicos con diferentes B CSF B(s) proteínas (s/t por tamaño) Luego se mezclan en función flujo LCR LCR se renueva 4 veces/día cada 6 hs Corazón se contrae 1 vez/segundo LCR 0.3ml/m ≠ 50ml/s flujo sanguíneo Flujo LCR lento Volumen LCR circulado <<< volumen sanguíneo casi estático en desplazado Aún más lento en lumbar relación al flujo LCR circula 500 veces más lento que Saco sangre (dead end) sanguíneo .en cerebro: proteínas LCR (a Proteinas partir SB) O, A y LCR M lumbar . en médula espinal: SB en superficie SG en profundidad Proteinorraquia es 300% más elevada en LCR lumbar que en LCR Ventricular Plexos Coroideos: fluido rico en preAb (transtiretina) Fluido Intersticial rico en Ab, IgG y otras proteínas LCR: su secreción disminuye con la edad LCR: la proteinorraquia y Albúmina aumentan con la edad Dramáticas diferencias entre Velocidad del flujo sanguíneo y la velocidad del flujo del LCR Recordar que: LCR nuevo se produce cada 6 horas mientras que la sangre es bombeada a través del cerébro a sólo 6 segundos o 6 latidos cardíacos Rango comparativo en orden de las ppales proteínas LCR/ n relación con el suero y en orden de cantidades decreciente Rango LCR Suero 1 Albúmina Albúmina 2 Beta trazadora IgG (3 veces menos) (10 veces menos) 3 IgG Beta lipoproteína 4 Prealbúmina Alfalipoproteína 5 Transferrina Fibrinógeno 6 Alfa-1-antitripsina Transferrina 7 Apo-E-lipoproteína Alfa-1-antitripsina 8 Gamma trazadora Alfa-2-macroglobulina teínas del LCR con el mayor % de transferencia desde el su oteínas Proteinas % transfer. Peso Mol (kD) Carga Beta-2-microglobulina (cerebro) 88 12 Neutra Lisozima (polimorfos) 7 14 Muy básica Prealbúmina (PC) 6 61 Muy ácida Albúmina (hígado) 0.5 69 Neutra Comparación % (menor transferencia ) (PM ↑) Beta lipoproteína 0.01 2200 Neutra IgM 0.02 800 Neutra Fibrinógeno 0.02 340 Neutra ínas del LCR agrupadas de acuerdo al % de transfer Beta trazadora 500% aprox Síntesis intratecal primaria Gama trazadora Proteína Tau (beta transf) Proteína Básica Mielina Proteína acídica glial fibrilar S100 100% aprox Síntesis intratecal similar a síntesis sistémica 10 – 1 % Síntesis intratecal parcial Beta-2-microglobulina Enolasa (gamma) Antígeno-D-2 (N-CAM proteína) Productos degradación fibrinógeno Prealbúmina (transtiretina) Lisozima Proteína Eosinofílica Catiónica Complemento C9 Lactoferrina Ferritina < 1% ppalmente filtración plasmática Apo-E-lipoproteína (resto de las proteínas) Composición proteica LCR 1. Relativamente exclusión selectiva de las moléculas más grandes (ò > P.M) durante la producción del LCR a partir del plasma 2. Liberación local de otras proteínas cerebrales en un compartimento del LCR mucho menor (o pool ≈ 125 – 140 ml) Se diluyen en el plasma (3000 ml) 25 veces * Ed Thompson 2005 teínas del LCR con un amplio rango de tamaño y ca * Ed Thompson 2005 oteínas del LCR que difieren de su contraparte séri Proteína Prealbúmina Tau IgG Variación Estímulo (“spur”) anormal Acido siálico removido Fragmentos y agregados IgM Haptoglobina > Nº de monómeros < Nº de polímeros Alfa-1-antitripsina Diferente patrón de punto isoeléctrico Diferente patrón de punto isoeléctrico No unida a prealbúmina Alfa-2-macroglobulina Globulina fijadora de retinol * Ed Thompson 2005 Proteínas del LCR – Rostro * Ed Thompson 2005 Proteínas del LCR – FUNCIÓN BIOLÓGICA * Ed Thompson 2005 Bases anatómicas para clasificacion: diferentes fuentes de proteínas de LCR * Ed Thompson 2005 Cadenas livianas Kappa y Lambda libres Valor Normal Cadenas livianas libres Kppa en sangre Cadenas livianas libres Lambda en sangre Cadenas livianas libres Kappa en LCR Cadenas livianas libres Lambda en LCR IgG LCR / Ab LCR Índice IgG =_______________________ Sensibilidad: 0.80 Especificidad: 0.77 IgG s / Ab s 200 – 400 mg/dl 100 – 200 mg/dl 60 ± 5 mg/dl 30 ± 5 mg/dl Media media 320 media 320 media 60 media 30 K LCR / Ab LCR Índice Kappa =_______________________ Sensibilidad: 0.96 Especificidad: 0.86 K s / Ab s Transporte de Glucosa . Cerebro : 18% de energía corporal total (2% peso corporal total) . No puede almacenar glucosa para síntesis de energía BBB rol fundamental en suplemento glucosa Transportadores específicos: 2 tipos: 1) SGLT sodio dependientes ó secundariamente activos 2) GLUT sodio independientes o facilitadores No requieren energía . Ubicados en polo basal y luminal de membrana de células endoteliales . No pueden movilizar glucosa en contra de gradiente de concentración . Flujo neto proporcional a la [c] > glucosa en plasma que en cerebro ó LCR ración transendotelial de leucocitos a través de la B (T --- B, monocitos, polimorfos) Moléculas que intervienen Etapas Adhiriendo y pegando (tethering/rolling) Adhesión firme Activación de Integrinas Degradación de la matriz extracelular PSGL-1/P-selectina LFA-1/ICAM-1, VLA-4/VCAM1 CCR2/CCL2, CXCR3/CXL10, CCR5/CCL5 MMP-9 ta transendotelial pore-like regions o ruta “parajunctional” lateral uta * CSF in Clinical practice. Irani D, 2009 PROTEINAS LCR Mayoría provienen del suero (80%) 20% derivadas del SNC (autóctonas no específicas): Plexos Coroideos (15%) Parénquima (5%) FI (extra-PC) . A través BBB = BHE BCB pinocitosis . En células de capilares endoteliales . A través de barrera epitelial PC . PLCR/PS Tamaño ≈ PM φ (carga eléctrica) . Abandonan LCR vellosidades aracnoideas - reabsorción- PROTEINAS LCR . [C] neta de proteínas en suero es 200 veces > LCR 7.0 g/dl versus 35 mg/dl ↓ V de eflujo 200 veces > que influjo o sea 0.5% del total de proteínas se transfiere del suero al LCR . Llega a un equilibrio estacionario luego de tiempo variable ↓ Proteínas que tienen [C] LCR > 0.5%a 1% de [C] sérica sufren cierto grado de síntesis local dentro del SNC LCR no es un ultrafiltrado del plasma sino un fluido “hijo” TRANSPORTE A TRAVES . Tamaño (P.Mol) . Liposolubilidad . Carga ( ) BBB = BHE BCB . P Fisicoquímicas . Presencia o ausencia de transportador específico . a) transcelular (agentes lipofílicos) . b) transporte carrier-mediado (AA neutros grandes y glucosa) . c) paracelular (agentes hidrosolubles) . d) endocitosis mediada por receptor específico (insulina y transferrina) . e) endocitosis adsortiva (proteínas catiónicas como albúmina) . f) bomba de eflujo para extraer drogas del LCR (“multidrug resistant proteins” MDRP) MECANISMOS DE TRANSPORTE a b . Difusión facilitada (shuttle) . Pasivo (independiente de energía) . A favor de gradiente [C] (Hexosas y AA) . Transporte activo . Req.energía . Acoplado a cotransporte - de > [C] a < [C] c . Endocitosis (Pinocitosis) . Bulk “captación no específica de fluido extracelular . RME (captación selectiva de macromoléculas) . AMT (absorptive mediated transport) . Atracción electrostática (péptidos y AA) d . Eflujo mediado por transportadores (“carriers”) Secreción del LCR . Se segrega en forma Lenta Continua – circadiana 0.27 ml/minuto/g Limitante: flujo vascular . Control autonómico (B2 adrenérgico) . inervación simpática de PC ↓ . inhibe en forma tónica la producción ↓ . independiente del φ sanguíneo Flujo y resorción (reabsorción) del LCR . PC fluye de manera uniforme desde CSupraV a ESA (cerebro y médula) para ser reabsorbido en las granulaciones aracnoidea . Flujo Pulsátil y bidireccional (más que laminar) . RMI Flujo pulsátil s/t en regiones estrechas (acueducto, foramen magnum, médula espinal) . Flujo depende de la secreción y motilidad de las cilias ependimarias . LCR no iría a un único sitio para su reabsorción Resorción (reabsorción) del LCR Reabsorción (simple, fisiológicamente controlado, no regulado) Vellosidades aracnoideas Rutas o vías alternativas de reabsorción ≠ Producción (complejo, controlado y especializado) Flujo del LCR hacia sangre venosa Sentido unidireccional Valvas unidireccionales Estímulo presión hidrostática . PC drenaje linfático . Pares craneanos (VIII, II, I) . Raíces espinales Funciones biológicas del LCR 1. Permite expansión del cerebro durante la ontogenia 2. Función de Protección .Cerebro “flota” en LCR y pasa de 1500g a 50g. .Protección mecánica: escudo y amortiguador contra trauma externo y de base de cráneo .Protección contra variaciones súbitas PIC: Munro-Kellie VIT = V Cerebro + Sangre I/C + V LCR 3. Remoción de Metabolitos 4. Distribución y transporte de sustancias biológicamente activas 5. Función inmune humoral y celular . CO2 lactato hidrogeniones, etc . Nutrientes a través del cerebro a. Amplificación de la respuesta inmune (Igs, complemento, interleukinas, kemoquinas, células inmunocompetentes) b. Interfase entre SN y SI Proteínas LCR . Proteinorraquia < 0.5 de proteinemia . . . . exclusivamente a partir del plasma (Albúmina) primariamente a partir del plasma (S-ICAM) primariamente a partir de PC (transtyretina o preAb) TTR primariamente a partir de Parénquima Cerebral (Tau) Fracción principal a partir del plasma (80%) . [CSF/plasma] = ↑ PD SNC (autóctonas) . [CSF/plasma] = ↓ PD del plasma * PD SNC: proteínas derivadas del Sistema Nervioso Centra Fracción intratecal (FI) . ↑ PD SNC (99%) . ↓ PD del plasma (<0.1%) Felgenhauer 1999, Rieckmann et al. 1997) Línea característica de la BHE según Felgenhauer. Se observan los índices de concentración de LCR/suero “inmóviles” en relación al radio molecular hidrodinámico (Felgenhauer & Beuche, 1999) Bases y mecanismos fisiopatológicos en LCR minución flujo LCR nución producción (alcoholismo - aumento Beta-2-Tau) .normal Obstrucción: ausente (Jakob-Creutzfeldt) aumento Tau (secundario degeneración sin comp Obstrucción: presente . Difusa (hidrocéfalo comunicante?) . Sitio determinado ente (prolapso discal) Aumento Tau (compresión produce degeneración?) ta por encima (hidrocéfalo no comunicante) (aumento de pre-albúmina coroide) por debajo (S Froin) ↓prealbúmina (fluido intersticial) rodegeneración – aumento Tau udado flamatoria (o mínimamente inflamatorio) Mínima (↑ Peso mol. Inflamac.local) Máxima: franca (Tau) matoria Ppalmente aguda: Aumento orosomucoide Ppalmente crónica: Gamma 4-5 difusa (policlonal) unogénico (oligoclonal) ariamente dentro SNC Gamma-4-gamma-5 (sero-negativa) mariamente fuera SNC: gamma-4-gamma-5 (sero-positiva) aproteína (monoclonal) mariamente dentro SNC: (sero-negativa) Linfoma SNC mariamente fuera SNC: (sero-positiva) ¿Mieloma o benigna? mariamente fuera pero 2ªriamente dentro(mieloma). Ej.LCR>suero = terapia intrat. mico (sin barrera) raumática: disminución número glóbulos rojos en tubos 1-3 oke: sin cambios de glóbulos rojos en tubos 1-3 nocítico: Proteína C-reactiva * Ed Thompson 2005 Muchas gracias
Anuncio
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados