Potenciales correspondientes a distintos agentes oxidantes
Anuncio
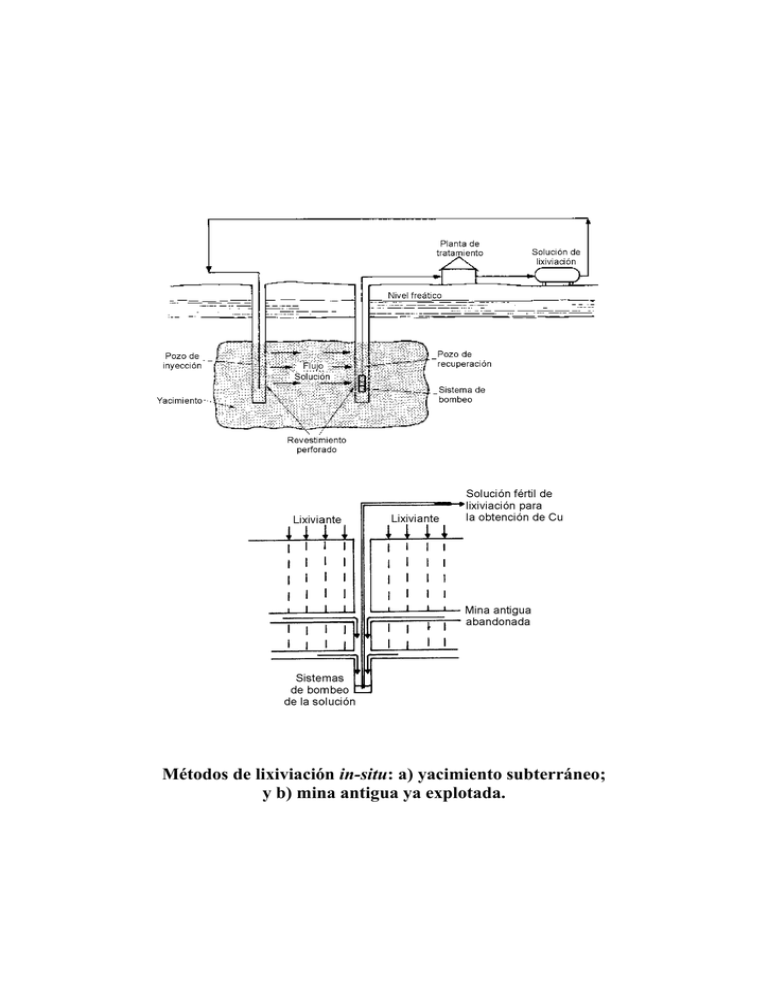
Métodos de lixiviación in-situ: a) yacimiento subterráneo; y b) mina antigua ya explotada. Lixiviación estática en montones, eras o pilas: a) Lixiviación en vertedero (lixiviación dump); b) Lixiviación heap. Lixiviación en estanques Tanque reactor Pachuca con agitación neumática Distintos tipos de agitadores: a) de hélice; y b) de paleta plana. Autoclave para la lixiviación a presión Mecanismo electroquímico de lixiviación de sulfuros Disolución de la esfalerita (ZnS)por formación de un par galvánico con la pirita (S2Fe) Potenciales de reposo de distintos sulfuros a pH 4 Mineral Pirita Marcasita Calcopirita Esfalerita Covelita Bornita Galena Argentita Estibnita Molibdenita Potencial de reposo (V) +0,66 +0,63 +0,56 +0,46 +0,45 +0,42 +0,40 +0,28 +0,12 +0,11 Potenciales correspondientes a distintos agentes oxidantes Oxidante CuCl2 Fe3+ Hg2+ HNO3 MnO2 O2 K2Cr2O7 Cl2 NaClO3 KMnO4 HClO H2O2 H2SO5 K2S2O8 O3 Semirreacción Cu + Cl − + e − → CuCl Fe 3+ + e − → Fe 2 + 2 Hg 2 + + 2e − → Hg 22 + NO3 − + 4 H + + 3e − → NO + 2H 2 O MnO2 + 4 H + + 2e − → Mn 2 + + 2H 2 O O2 + 4 H + + 4 e − → 2H 2 O Cr2 O7 2 − + 14 H + + 6e − → 2Cr 3+ + 7 H 2 O Cl 2 + 2e − → 2Cl − ClO3 − + 6H + + 6e − → Cl − + 4 H 2 O MnO4 − + 8H + + 5e − → Mn 2 + + 4 H 2 O 2 HClO + 2 H + + 2e − → Cl 2 + 2 H 2 O H 2 O2 + 2H + + 2e − → 2H 2 O SO5 2 − + 2H + + 2e − → SO4 2 − + H 2 O S 2 O8 2 − + 2e − → 2SO4 2 − O3 + 2H + + 2e − → O2 + H 2 O 2+ Potencial (V) +0,54 +0,77 +0,92 +0,96 +1,20 +1,23 +1,33 +1,35 +1,45 +1,49 +1,63 +1,77 +1,81 +2,00 +2,07 Microorganismos activos, o con un posible potencial de futuro, en la biolixiviación de minerales sulfurados Grupo Mesófilos Nombre Thiobacillus ferrooxidans Thiobacillus thiooxidans Termófilos moderados Termófilos extremos Leptospirilum ferrooxidans Sulfobacillus thermosulfidooxidans Sulfolobus acidocaldarius Acidianus brierleyi Sulfolobus solfataricus Características fisiológicas Oxida a Fe2+, S0, S2O32-, sulfuros metálicos, etc. Oxida a especies reducidas del azufre a a. sulfúrico; no oxida a sulfuros minerales Oxida a Fe2+ pero no a S Oxida a Fe2+ y S Oxida a Fe2+ y S; reduce el Fe3+ anaeróbicamente Oxida a Fe2+, S y CuFeS2 ¿? Actuación de las bacterias en el mecanismo electroquímico de disolución de sulfuros











