cinética y equilibrio químico
Anuncio

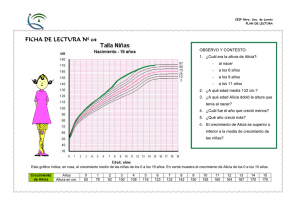
CINÉTICA Y EQUILIBRIO QUÍMICO M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 1 Cinética Química La cinética química es el área de la química que tiene que ver con la rapidez o velocidad con que ocurre una reacción. La velocidad de la reacción es el cambio en la concentración de un reactivo o de un producto con respecto al tiempo. Si A B k v= ∆[A] ∆t o v = ∆[B] ∆t La velocidad es proporcional a la concentración de los reactivos y a una constante de proporcionalidad llamada constante de velocidad (k). Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 2 La relación de la velocidad de una reacción con la constante de velocidad y la concentración de los reactivos elevada a alguna potencia se conoce como Ley de la velocidad. Si tenemos la ecuación: aA + bB cC + dD La ley de la velocidad dice: v = k [A]x [B]y Donde x y y son valores experimentales que hablan de las relaciones entre las concentraciones de A y B y la velocidad de la reacción. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 3 Cuando x y y se suman establecen el orden de la reacción. Las reacciones de primer orden son aquellas cuya velocidad depende de la concentración de un reactivo elevado a la primera potencia. Las reacciones de segundo orden son aquellas en las que la velocidad depende de la concentración de un reactivo elevado al cuadrado o de la concentración de dos reactivos. Las reacciones de orden cero son aquellas cuya velocidad es una constante. Las más comunes son las de primer y segundo órdenes. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 4 Velocidad de reacción y energía Generalmente, la velocidad de las reacciones aumenta en función de la temperatura. Esto último se debe a que al aumentar la temperatura, aumenta la energía cinética de las moléculas, provocando choques entre ellas. Para que se dé una reacción entre dos moléculas, éstas deben chocar con una cierta fuerza (energía) y dirección, a fin de que los choques sean efectivos. Esto conduce a las moléculas a un estado o complejo activado. La energía necesaria para que se inicie una reacción química se llama Energía de activación (Eact) . Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 5 Gráficas de energía de reacciones endergónicas (endotérmicas) y de reacciones exergónicas (exotérmicas) Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 6 La energía absorbida o liberada en una reacción se conoce como calor de reacción y la podemos medir en entalpía o en energía libre de Gibbs. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 7 FACTORES QUE AFECTAN LA VELOCIDAD DE LAS REACCIONES QUÍMICAS Existen algunos factores que afectan la velocidad de una reacción química, como: a) la naturaleza de los reactantes b) la concentración de los reactantes c) el área de superficie de un sólido d) la temperatura de la reacción Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 8 Concentración presión Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 9 Área de superficie de contacto Temperatura Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 10 Catalizadores Algunas reacciones son extremadamente lentas, debido a que su energía de activación es muy grande. La velocidad de estas reacciones se puede aumentar con la adición de sustancias que participan en la reacción, pero que no son consumidas en ella. Estas sustancias se conocen como catalizadores. Su acción es disminuir la energía de activación de la reacción porque “acomodan” a las moléculas, haciendo que sus choques sean efectivos. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 11 Los catalizadores pueden estar en la misma fase que los reactivos (catálisis homogénea) o en fases distintas (catálisis heterogénea). Algunos ejemplos son los convertidores catalíticos (oxidan el CO y los hidrocarburos que no se queman totalmente en los motores de un coche, produciendo CO2 y H2O, a la vez que reducen el NO –óxido nítrico- y al NO2 producidos en los motores a N2 y O2) 2CO + O2 = 2CO2 2CO + 2NO = N2 + 2CO2 2H2 + 2NO = N2 + 2H2O CmHn + O2 = CO2 + H2O CmHn + NO = N2 + H2O + CO2 Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 12 a) b) c) Los catalizadores biológicos se conocen como enzimas. Presentan algunas características que los definen: Son moléculas de origen proteico o ácidos nucleicos (RNA autocatalítico). Son altamente específicas de su sustrato y de la reacción que catalizan. Además son saturables. Son regulables por algunas sustancias. Actúan sólo cuando son necesarias. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 13 Equilibrio químico El equilibrio es un estado en el que no se observan cambios durante el tiempo transcurrido. Cuando una reacción química alcanza el equilibrio, las concentraciones de reactivos y productos permanecen constantes en el tiempo, sin que se produzcan cambios visibles en el sistema. Sin embargo, a nivel molecular, existe una gran actividad debido a que las moléculas de reactivos siguen formando moléculas de productos, y éstas a su vez, reaccionan para formar moléculas de reactivos. El equilibrio químico es un proceso dinámico. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 14 Para una reacción reversible, en el equilibrio y a una temperatura constante, existe una relación constante entre las concentraciones de reactivos y de productos. Esto es lo que conocemos como constante de equilibrio (Keq) y hace referencia a lo que conocemos como la ley de acción de masas. Si tenemos la ecuación: aA + bB cC + dD Keq = [C]c [D]d [A]a [B]b Si Keq >> 1, el equilibrio estará desplazado en la dirección de los productos, mientras que si Keq << 1, el equilibrio estará desplazado en la dirección de los reactivos. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 15 Existen algunas consideraciones a tomar en cuenta: a) La Keq es una cantidad adimensional que depende de que la ecuación esté balanceada y de la temperatura. b) Si una reacción representa la suma de dos o más reacciones, la constante de equilibrio para la reacción global está dada por el producto de las constantes de equilibrio de las reacciones individuales. Se puede predecir la dirección de una reacción dependiendo de los valores de la constante de equilibrio. Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 16 Factores que afectan el equilibrio químico Hay por lo menos 5 factores que afectan el equilibrio químico: la concentración, la presión, el volumen, la temperatura y la presencia de catalizadores. Hay una regla que ayuda a predecir la dirección en que se desplazará el equilibrio cuando cambia alguno de estos factores: el Principio de Le Chatelier: Si se aplica una tensión externa a un sistema en equilibrio, el sistema se ajusta de tal manera que se cancela parcialmente dicha tensión (cambio de concentración, de volumen, de presión o temperatura). Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 17 Los cambios en la concentración, la presión y el volumen pueden alterar el equilibrio pero no cambian Keq, pero esta constante sí cambia con la temperatura (recordemos que un aumento en la temperatura favorece las reacciones endotérmicas y una disminución de la temperatura favorece las reacciones exotérmicas). Los catalizadores aceleran las reacciones, pero no alteran la constante de equilibrio, ni las concentraciones en el equilibrio de las especies reaccionantes. Un ejemplo del principio de Le Chatelier es el aumento de la producción de hemoglobina cuando las personas viven a grandes alturas, como en la Cd. de México o en Cusco Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 18 Julio 2007 M. en C. Alicia Cea Bonilla Todos los derechos reservados 19