ESTUDIO DE LA CALIDAD DEL AIRE EN LAS ÁREAS
Anuncio

ESTUDIO DE LA CALIDAD DEL AIRE EN LAS ÁREAS INDUSTRIALES Y DE ALTA DENSIDAD DE CIRCULACIÓN DE SANTA CRUZ DE TENERIFE MEDIANTE BIOMONITORIZACIÓN ACTIVA CON MUSGO TERRESTRE Realizado por el Grupo de Ecotoxicología de la Universidad de Santiago de Compostela Santiago de Compostela a 7 de mayo de 2009 No debe reproducirse este informe, salvo su totalidad, sin la aprobación por escrito del Grupo de Investigación en Ecotoxicología de la USC. 1 2 Equipo Técnico: Investigador Principal: Dr. Alejo Carballeira Ocaña (Catedrático de Ecología) Investigadores: Dr. Jesús R. Aboal Viñas (Profesor Contratado Doctor) Dr. J. Ángel Fernández Escribano (Profesor Contratado Doctor) Dr. Carlos Real Rodríguez (Profesor Titular de Ecología) Técnicos: Dª. Ángela Ares Pita (Licenciada en Biología) Dª. Mercedes Noya Pardal (Licenciada en Química) Técnicos de Laboratorio: Dª. Johanna G. Romero Párraga Dª. María Dolores López Pedrouso 3 4 1. INTRODUCCIÓN Es habitual que a causa de un defecto de fondo en el modelo de crecimiento urbanístico múltiples focos de contaminación, ligados a procesos industriales, hayan sido incluidos en los núcleos urbanos. Posteriormente, esto obliga a realizar un control exhaustivo de la contaminación que producen los mismos porque pueden afectar la salud de la población expuesta a sus emisiones. Las técnicas habituales para la medición de las concentraciones de contaminantes en la atmósfera emplean métodos físicos y químicos; requiriendo a menudo técnicas sofisticadas y aparatos automáticos y semiautomáticos. Las medidas en continuo en puntos fijos (normalmente como parte de redes de control), así como las realizadas con equipos móviles permiten la valoración de los niveles y los flujos de los macro-contaminantes atmosféricos. Estas medidas se usan para detectar concentraciones de contaminantes y verificar la efectividad de las medidas adoptadas para reducir la contaminación atmosférica. La monitorización biológica ofrece una medida del impacto que pueden causar las acumulaciones de los contaminantes sobre los seres vivos, informando de las posibilidades de entrada en la cadena trófica y de sus efectos antagónicos y sinérgicos. Entre las ventajas de la biomonitorización está la posibilidad de realizar mediciones de múltiples elementos (micro y macrocontaminantes) y el diseño de redes con la densidad adecuada a cada tipo de entorno o estudio; mientras que las técnicas convencionales se ven limitadas por la falta de tecnología o por los costes que implicarían instalar redes similares. El empleo de musgos terrestres ha sido una herramienta empleada en numerosos estudios llevados a cabo desde que en 1968 comenzaran a utilizarse para el control de la calidad del aire (Rühling & Tyler, 1968). Su empleo como biomonitores se debe a una serie de características morfológicas, fisiológicas y ecológicas. En ausencia de musgo nativo puede emplearse la biomonitorización activa basada en trasplantes de musgos (técnica conocida como moss bags, Tyler, 1990). En los últimos años, la biomonitorización activa ha sido empleada con éxito en el control de la calidad del aire sobre todo en áreas urbanas e industriales. 5 2. OBJETIVOS El objetivo del presente trabajo es la caracterización de la estructura espacial -a la escala de estudio (>400 m) en un área de Santa Cruz de Tenerife próxima a su entorno industrial y su zona de mayor densidad de tráfico rodado- de la contaminación atmosférica debida a metales y metaloides (Ni, Cd, Pb, Hg, V y As) e hidrocarburos aromáticos policíclicos (PAH) a través de la bioconcentración de musgo utilizado como biomonitor activo. Como objetivos secundarios, ligados al anterior, se encuentran la construcción de mapas de contaminación en función de la bioconcentración obtenida para cada uno de los contaminantes, y el estudio del posible vínculo de esas concentraciones con las emisiones de la industria o el tráfico rodado. 3. MATERIAL Y MÉTODOS 3.1. Área de estudio y diseño experimental El área de estudio se encuentra en Santa Cruz de Tenerife (Islas Canarias), y se centra en la zona cercana al área industrial de la ciudad y la zona de mayor densidad de tráfico rodado; circunscrita en el rectángulo formado por las coordenadas: X=377800 Y=3149600, X=377800 Y=3147200, X=374600 Y=3147200, y X=374600 Y=3149600 (Mapa 1). El diseño del muestreo es regular con una luz de 400 m, partiendo de la coordenada: X=374600 Y=3147200 (malla teórica en el Mapa 1). En cada una de las coordenadas se buscó, para la ubicación de los trasplantes, la farola más cercana libre de cubierta vegetal (ver Red Urbana de Trasplantes en el Mapa 1). Las coordenadas de la red en la zona marina del rectángulo fueron desechadas salvo algunas que por su proximidad pudieron ser reubicadas en la costa. De esta forma se dispusieron en total de 50 puntos de biomonitorización para la evaluación de la calidad del aire urbano. 6 Mapa 1. Representación de la Red de Biomonitorización Activa de la contaminación atmosférica en Santa Cruz de Tenerife, realizada con trasplantes del musgo Pseudoscleropodium purum. 7 3.2. Preparación de los trasplantes La metodología empleada en el presente estudio es conocida como moss bag ideada por Tyler en 1969 (Tyler, 1990). De forma sencilla, la técnica consiste en la exposición en la zona de estudio de musgo procedente de una zona no contaminada, en el interior de una bolsa de malla (trasplante), durante un periodo determinado. El material trasplantado se trata del musgo terrestre Pseudoscleropodium purum (Hewd.) M. Fleisch., recolectado en una zona no contaminada (Aboal et al., 2004). Una vez en el laboratorio, con el objeto de homogeneizar el material trasplantado, a los briófitos recolectados se le separaron los segmentos apicales (3-4 cm), desechándose el resto de la planta. A continuación se realizó un tamizado mediante malla plástica (0.7 cm de luz) y un lavado en agua bidestilada en agitación durante 30 minutos buscando la eliminación de los restos vegetales, epifitos, partículas edáficas adheridas, etc. Este lavado superior a 30 segundos altera el equilibrio de los cationes unidos extracelularmente (Brown & Wells, 1990), de forma que el musgo se “activaría” aumentado su capacidad de bioconcentración catiónica. Tras el lavado se eliminó el exceso de humedad con papel de filtro y se pesaron 10 g de dicho material, para su posterior trasplante. Se confeccionaron bolsas de polietileno con una luz de malla de 1 mm, de 20 x 10 cm cosidas con sedal. Previamente el material es lavado en HNO3 para eliminar posibles trazas de contaminantes. Se introdujo el musgo de forma homogénea en el interior de las bolsas junto con una varilla rígida de polietileno en la diagonal de la bolsa, para evitar la deformación de la misma por acción del viento. La disposición del musgo y la varilla se fijó mediante cosido en zig-zag con sedal, cerrándose las bolsas de la misma forma. Finalmente cada una se colgó, con la ayuda de dos bridas de plástico, del mástil de dispuesto en cada farola. Se prepararon un total de 57 bolsas, 50 serían expuestas, 3 serían controles que sufrirían el mismo proceso que las bolsas expuestas salvo su exposición (i.e. desplazamientos) y 4 tiempos cero, que fueron durante el periodo de exposición sellados al vacío para evitar su posible contaminación. De esta forma 53 bolsas se introdujeron en una caja sellada tras realizar una pulverización de agua bidestilada sobre cada muestra; para preservar el correcto estado fisiológico del musgo. Trascurridos 3 días, los trasplantes fueron colgados en soportes de PVC, sujetos perpendicularmente a las farolas, entre 3 y 4 metros de altura, y expuestos del 18 de marzo al 20 8 de mayo de 2008. Tras el periodo de exposición los trasplantes se introdujeron en bolsas independientes y fueron reenviados en una caja sellada a los laboratorios del Grupo de Ecotoxicología de la Universidad de Santiago de Compostela. Una vez en el laboratorio las muestras fueron homogeneizadas en un molino ultracentrífugo (Restch ZM 200) asegurando un tamaño de partícula menor a 100 µm, se empleó N2 líquido para impedir el calentamiento del material. Para el análisis de metales y metaloides, el material homogeneizado fue secado hasta peso constante a una temperatura de 60º C en una estufa de tiro forzado, salvo para la determinación de Hg; en cuyo caso se optó por una temperatura de 40º C. 3.3. Análisis químico 3.3.1. Determinación de metales y metaloides La determinación de V, Pb, Cd, Ni y As se realizó en suspensión sólida mediante espectrofotometría de absorción atómica con cámara de grafito (Perkin Elmer AAnalyst 600). Para ello se pesaron 0.10 mg de material en un medio débilmente acidificado y con adición de Triton XL para romper la tensión superficial y mejorar la homogeneidad de la suspensión. En la medición de As se empleó el método de adición, dado que las concentraciones se encontraban por debajo del límite de detección de la técnica, añadiendo a cada una de las muestras 5 ng g-1 de este elemento. Para la determinación del Hg se empleó un analizador elemental de mercurio (Milestone DMA 80). Para asegurar la calidad analítica se realizaron réplicas analíticas, 1 cada 9 muestras, calculándose posteriormente la desviación estándar de acuerdo con Ceburnis & Steinnes (2000): n ∑(C1-C2) S= 2 i=1 2n Paralelamente se analizaba un material de referencia certificado M2 y M3 (Steinnes et al., 1997) correspondiente al musgo Pleurozium schreberi, 1 cada 9 muestras, Además la existencia de 9 contaminaciones de material durante el procesado se controló empleando blancos analíticos, 1 de cada 9 muestras analizadas. 3.3.2. Determinación de hidrocarburos aromáticos policíclicos La determinación de los PAH se realizó en el laboratorio del Instituto de Medio Ambiente de la Universidad de A Coruña. Para la extracción de PAH se pesaron entre 0.6 y 0.8 g de musgo a los que se añadieron, una disolución de patrones de PAH deuterados disueltos en acetona (naftaleno d-8, acenafteno d10, fenantreno d-10 y criseno d-12 (Supelco)). A continuación se añadieron 30 mL de una mezcla de hexano/acetona (1:1) (n-hexano para análisis orgánico de trazas (Merck) y acetona, super purity solvent (Romil)). Para la extracción las muestras se introdujeron en un horno microondas (ETHOS SEL, Milestone) durante 30 minutos a 130º C. Se filtraron los extractos con filtros de fibra de vidrio MN GF 6 (Macherey-Nagel, 5.5 cm de diámetro y 0.35 mm de espesor) junto con 9 mL de hexano/acetona (1:1) de lavado. Para la purificación de las muestras se rellenaron columnas de vidrio con de lana de vidrio silanizada (Supelco) y a continuación 12 g de Florisil® (60-100 mesh, Aldrich) y 4 g de gel de sílice (70-230 mesh, Sigma) (previamente desactivados con un 5% de agua). Por último se añadieron 0.5 g de sulfato sódico anhidro granulado para análisis orgánico de trazas (Merck). Los adsorbentes utilizados se lavaron previamente en Soxhlet con una mezcla diclorometano/metanol (2:1) (diclorometano, super purity solvent (Romil); metanol, super purity solvent (Romil)), durante 12 horas y a continuación otras 12 horas con una mezcla diclorometano/hexano (30:70). Una vez secos se activaron: el gel de sílice a 130º C, el florisil a 350º C y el sulfato sódico anhidro a 100º C, durante 12 horas. Los adsorbentes, después de lavados y activados, quedaron guardados en el desecador hasta su uso. Para la eliminación del disolvente se concentraron los extractos un rotavapor a 32º C hasta el volumen de una gota que se cargó en la columna y se eluyó con 45 mL de una mezcla de diclorometano/hexano (20:80). El eluato se concentró en rotavapor hasta una gota y se llevó a sequedad con corriente de N2 a un flujo de 60 mL min-1. 10 El análisis de los PAH se realizó con cromatografía de gases-espectrometría de masas analizándose en modo MS/MS (Columna: J&W, DB-XLB 60 m x 0.25 mm x 0.25 µm, Inyección: En modo PTV, con programa de temperatura. Inicial 50º C, velocidad de transferencia 3.3º C/s, temperatura final 300º C (20 min). Volumen de inyección = 7 µL, temperatura: 50º C (4 min), 6º C/min hasta 200º C, 4º C/min hasta 325º C (10 min). Los PAHs determinados fueron los siguientes: acenafteno, antraceno, benzo(a)antraceno, benzo(a)pireno, benzo(b)fluoranteno+benzo(j)fluoranteno, benzo(e)pireno, benzo(ghi)perileno, benzo(k)fluoranteno, criseno, dibenz(a,h)antraceno, fenantreno, fluoranteno, fluoreno, indopireno, naftaleno y pireno. Además del sumatorio de las concentraciones de todos los PAH para cada trasplante, se calcularon los factores de equivalencia tóxica (TEF) en función de la propuesta de Nisbet y LaGoy (1992) que, en base a trabajos anteriores, intentan resumir y cuantificar los datos relativos a la carcinogenicidad de los PAH (“clásica aproximación BaP”). En cualquier caso, algunos de estos PAH no han sido declarados carcinógenos por la USEPA. Los factores de toxicidad empleados fueron: 5 para dibenz(a,h)antraceno; 1 para benzo(a)pireno; 0.1 para benzo(a)antraceno, benzo(k)fluoranteno, benzo(b)fluoranteno+benzo(j)fluoranteno e indopireno; 0.01 para antraceno, benzo(ghi)perileno y criseno; y 0.001 para el resto de los compuestos. 3.4. Análisis de datos 3.4.1. Cálculo del Límite de cuantificación de la técnica Para el tratamiento de los controles de la técnica (moss bag) se utilizó el Límite de Cuantificación (LOQ - limit of quantification); que corresponde al valor para el cual las mediciones se hacen cuantitativamente significativas (promedio de los controles + 10 veces la desviación típica de los controles), de acuerdo con Couto et al. (2004). Con la aplicación de LOQ se persigue una interpretación rigurosa de los datos, porque el ruido analítico y el asociado con la metodología de la técnica de trasplante estarían incluidos. 3.4.2. Cálculo de los factores de enriquecimiento 11 Los factores de enriquecimiento se calcularon como la relación entre las concentraciones al final del período de exposición y al principio; tomando el promedio de los controles como concentración inicial (Couto et al. 2004). 3.4.3. Cálculo de las distribuciones de los contaminantes Se calcularon las distribuciones de densidad de núcleo kernel utilizando el paquete estadístico KerSmooth (Ripley, 2002) bajo R (R Development Core Team, 2002). Para la estimación se aplicó un kernel smoothing seleccionando un kernel gaussiano con un ancho optimizado para cada set de datos utilizando la técnica de introducción directa con dos niveles de estimación funcional (Wand & Jones, 1995). 3.4.4. Análisis multifactorial Para el tratamiento conjunto de los datos de metales, metaloides y PAH en todos los trasplantes se realizó un análisis de componentes principales (PCA), realizándose una normalización Varimax con Kaiser. Los cálculos se realizaron con el paquete estadístico SPSS 15.0. 3.4.5. Análisis de la estructura espacial Un primer paso en la búsqueda de posible estructura espacial (determinística de gran escala), en los datos, fue la realización de un semivariograma. En este caso se utilizó el semivariograma robusto (Cressie & Hawkins, 1980), dado que sus características lo hacen menos sensible a los datos extremos que los semivariogramas estándares. El semivariograma se calcula para todas las posibles distancias dadas en la malla de muestreo y es sensible a la existencia de estructura espacial en los datos; contiene los lags pertenecientes a la malla regular. Cuando los datos carezcan de estructura espacial se generará un variograma con varianza constante (sometido enteramente a efecto pepita), porque las diferencias entre los pares serán aleatorias tanto a pequeñas como a grandes distancias. Siguiendo esta hipótesis (“No existe estructura espacial en los datos”), se realizó un test aleatorizando las concentraciones determinadas en las muestras en las diferentes posiciones (repetido 10000 veces) (Aboal et al., 12 2006); de forma que si no hubiese estructura espacial, el semivariograma sería indistinguible del anterior. El cálculo de los semivariogramas y el proceso de aleatorización se realizaron mediante el software Variograma de Mallas 3.3., creado por el Grupo de Ecotoxicología de la USC. 3.4.6. Determinación de la superficie de respuesta Para la captación de la estructura espacial a gran escala se decidió aplicar un caso especial de regresión a los datos obtenidos, en el cual las variables independientes son las coordenadas de los puntos de muestreo en un plano y sus funciones potenciales y productos cruzados, siendo la variable dependiente la concentración determinada del contaminante. En nuestro caso se han aplicado como términos independientes los pertenecientes a un polinomio cúbico (x, y, x2, y2, xy, x2y, y2x, x3 e y3), describiendo la superficie de respuesta más ajustada a los datos obtenidos de la red de muestreo (Real et al., 2003). El primer paso para la asimilación de los datos al polinomio será referenciar todos los términos (x e y) del mismo al centro de la fuente de contaminación, para ello se transformaron las coordenadas UTM originales (pertenecientes a la malla de muestreo); a un nuevo sistema de coordenadas centrado en la zona industrial situada al sur de la ciudad (coordenadas: X=376126, Y=3148084). La dificultad del método radica en la selección de la mejor superficie de respuesta entre el conjunto de funciones polinómicas obtenidas. Para la realización de este último paso se optó por seleccionar aquellos modelos con todos sus términos significativos para un nivel de confianza mayor o igual al 95% y que al mismo tiempo absorbieran la mayor cantidad posible de la variabilidad de los datos (estructura determinística de gran escala). Se utilizó el programa Statgraphics 5.1 para la realización de la regresión y el análisis de los polinomios. Al mismo tiempo la superficie elegida no debe de poseer estructura espacial, por ello el paso final para la elección de la superficie de respuesta entre todas las posibles obtenidas (para cada elemento) fue el análisis de los residuos producidos por la misma (diferencia entre los datos obtenidos para las diferentes muestras y los predichos por las funciones polinómicas calculadas). En este análisis, se persigue que no quede estructura espacial remanente contenida en los datos pertenecientes a los residuos; para lo cual, se realiza un variograma de la forma anteriormente descrita y se comprueba si existe o no estructura espacial. 13 3.5. Elaboración de mapas Los mapas de localización de las muestras, así como la representación de las bioconcentraciones correspondientes a cada contaminante, se realizaron utilizando el programa ArcGis 9.0. 4. RESULTADOS 4.1. Calidad analítica En la Tabla 1 se muestran los resultados obtenidos para el control analítico para metales pesados y metaloides. Las recuperaciones obtenidas en el análisis del material de referencia son satisfactorias situándose en torno al 100%. Cabe destacar la recuperación obtenida en el análisis del As (del 198%) para el M3. En lo referente al error global asociado a todo el proceso (técnico y analítico) oscila entre el 14% para el As y el 4% para Hg. En cuanto a los PAH, los porcentajes de recuperación fueron superiores al 90% para todos los compuestos excepto para naftaleno que fue del 60%. Los límites de cuantificación analíticos para metales y metaloides se muestran en la Tabla 1. Para los PAH éstos variaron entre 9.1E-05 para benz(a)antraceno, benzo(a)pireno, benzo(b)fluoranteno + benzo(j)fluoranteno, benzo(e)pireno, benzo(k)fluoranteno, benzo(ghi)perileno, dibenz(ah)antraceno, criseno e indopireno y 0.014 ng g-1 para naftaleno. Los límites de cuantificación de la técnica para estos compuestos se muestran en la Tabla 2. Por lo que se refiere a los contaminantes inorgánicos, el límite de cuantificación de la técnica, realizado a los controles, se muestra adecuado para V, dado que todas las muestras los superan. En el caso de Cd, Hg, Pb y Ni algunas de las determinaciones se encontraban por debajo de sus respectivos límites. Por último, en las mediciones realizadas para As se encuentra que una mayoría está por debajo del límite de cuantificación de los controles, por lo que los resultados no deberían de ser empleados cuantitativamente (Tabla 3). 14 En relación a los PAH, excepto para fluoreno y pireno la mayoría de los compuestos presentaban un gran número de valores por debajo del límite de cuantificación de la técnica (Tabla 4). Tabla 1. Calidad analítica de las determinaciones de metales y metaloides. M2 y M3: materiales de referencia (ver detalles en el texto). As Cd Hg Ni Pb V Límite de cuantificación blancos analíticos (ng g-1) 0.82 0.31 3.28 9.62 3.04 12.12 Límite de cuantificación controles (ng g-1) 461 266 59 4784 2766 1484 Recuperación M2 (%) 113 104 95 80 106 106 Recuperación M3 (%) 198 97 132 110 113 98 Error global (%) 14 7 4 6 5 12 Tabla 2. Límite de cuantificación de la técnica (LOQ) para las determinaciones de PAH. Compuesto Naftaleno LOQ (ng g-1) 862 Acenafteno 25.42 Fluoreno 39.67 Fenantreno 186 Antraceno 17.59 Fluoranteno 20.46 Pireno 75.97 Benz(a)antraceno 5.09 Criseno 18.13 Benzo(b)fluoranteno+Benzo(j)fluoranteno 113 Benzo(k)fluoranteno 295 Benzo(e)pireno 66.1 Benzo(a)pireno 82.2 Benzo(ghi)perileno 189 Dibenz(a,h)antraceno 254 Indopireno 233 15 4.2. Concentraciones de metales y metaloides En la Tabla 3 se detallan las concentraciones elementales obtenidas para los trasplantes, los controles y los tiempos iniciales, así como los estadísticos descriptivos correspondientes. Se observa que V, Ni y Pb presentan las mayores varianzas y rango de datos. El elemento que presenta mayor asimetría es el Cd, seguido de Ni, Pb y V; todos los valores para la asimetría son positivos salvo para Hg. Las concentraciones obtenidas aparecen representadas en los Mapas 2-7 para As, Cd, Hg, Ni, Pb y V respectivamente. 4.3. Concentraciones de PAH En la Tabla 4 se presentan las concentraciones de los PAH analizados en los trasplantes, los controles y los tiempos iniciales, incluyéndose además varios estadísticos descriptivos para cada uno de los compuestos. La distribución espacial de las concentraciones de cada uno de los PAH se presenta en los Mapas 8-23 para naftaleno, acenafteno, fluoreno, fenantreno, antraceno, fluoranteno, pireno, benzo(a)antraceno, criseno, benzo(b)fluoranteno + benzo(j)fluoranteno, benzo(k)fluoranteno, benzo(e)pireno, benzo(a)pireno, benzo(ghi)perileno, dibenzo(a,h)antraceno e indopireno, respectivamente. El Mapa 24 muestra la distribución espacial del sumatorio de PAH expresado como Tóxicos Equivalentes. 16 Mapa 2. Concentraciones y Factores de enriquecimiento para Arsénico determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 3. Concentraciones y Factores de enriquecimiento para Cadmio determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 17 Mapa 4. Concentraciones y Factores de enriquecimiento para Mercurio determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 5. Concentraciones y Factores de enriquecimiento para Níquel determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 18 Mapa 6. Concentraciones y Factores de enriquecimiento para Plomo determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 7. Concentraciones y Factores de enriquecimiento para Vanadio determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 19 Tabla 3. Concentraciones de metaloides y metales determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Las concentraciones se expresan en µg g-1, salvo elementos marcados con * en ng g-1. Los datos subrayados se encuentran por debajo del límite de cuantificación de la técnica (ver detalles en el texto). I.D.: código de identificación del trasplante. Los controles de la técnica son C1-C3, y los tiempos iniciales C4C7. Desv. Típ.: desviación típica]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 X 374731 375004 375402 374545 374987 375287 375794 376177 374575 374960 375402 375758 376679 376935 377314 374574 375022 375382 375742 376149 376670 376954 377469 374647 374971 375398 375812 376181 376609 376973 377374 377707 374581 374961 375391 375795 376220 376622 377002 377409 377805 374618 374976 375382 375820 376211 376592 376989 377406 377825 Y 3147160 3147214 3147197 3147607 3147611 3147604 3147567 3147730 3147992 3148025 3148023 3148049 3148065 3148102 3148353 3148390 3148359 3148441 3148378 3148422 3148399 3148400 3148442 3148818 3148791 3148759 3148799 3148797 3148793 3148860 3148866 3148767 3149218 3149249 3149200 3149215 3149204 3149237 3149206 3149220 3149190 3149601 3149629 3149576 3149621 3149610 3149524 3149618 3149605 3149607 As * 615 179 97 202 345 199 784 507 101 219 304 430 553 107 332 207 248 225 367 514 315 271 499 362 383 380 479 376 394 395 587 601 279 531 251 78 317 441 318 332 567 491 645 553 529 706 521 515 340 598 Cd * 384 387 1544 709 695 423 544 518 388 439 286 377 470 1114 303 491 446 488 496 391 423 275 469 351 368 425 411 294 303 161 355 640 182 370 192 427 380 284 264 206 459 362 432 399 314 328 277 223 252 360 Hg* 99 95 117 92 89 101 88 85 83 111 115 103 90 82 87 69 121 81 82 78 80 73 117 76 90 80 118 70 84 51 89 113 46 79 61 61 58 82 58 67 72 107 83 91 100 104 81 62 60 63 Ni 7.3 18.3 12.0 11.9 8.7 11.6 18.0 23.8 5.6 7.5 9.7 15.0 20.4 12.1 8.3 4.1 7.8 8.0 8.1 8.9 5.7 5.3 9.6 4.2 6.2 7.4 7.5 5.1 7.1 3.5 5.3 7.8 2.7 10.6 3.7 4.6 3.9 5.3 4.5 3.4 4.9 7.2 5.7 4.3 5.5 6.2 5.2 4.1 4.2 6.1 Pb 4.9 7.7 5.4 17.7 9.7 8.2 10.2 12.4 4.7 5.4 7.2 8.6 12.8 5.9 8.5 4.0 4.4 4.6 6.4 9.7 6.9 3.9 13.5 4.2 4.5 4.4 4.8 4.6 5.0 3.3 5.7 16.3 2.6 4.3 2.9 3.5 3.0 5.5 4.1 4.0 6.9 4.7 4.2 3.4 4.1 4.5 4.7 4.0 2.9 3.8 V 11 14 16 17 13 19 13 20.1 7.3 11.9 13.0 13.9 12.9 13.9 11.0 4.4 11.5 7.6 8.4 9.4 6.4 6.3 16.4 7.1 7.3 9.1 8.1 4.4 6.9 2.7 6.5 11.8 2.0 8.7 2.7 3.0 2.9 4.7 2.8 3.0 6.9 8.6 6.1 4.6 9.1 8.7 5.3 3.8 2.2 6.2 20 I.D. C1 C2 C3 C4 C5 C6 C7 Media Desv. Típ. Asimetría Curtosis Máximo Mínimo X - Y - As * 231 273 241 166 169 20 131 392 167 0.08 -0.57 784 78 Cd * 120 88 106 106 97 110 94 422 225 3.19 13.4 1544 161 Hg* 37 40 35 31 30 32 39 85 19 0.10 -0.55 121 46 Ni 1.2 1.9 1.5 0.8 0.7 0.9 0.8 7.9 4.6 1.77 3.16 23.8 2.7 Pb 1.8 1.9 1.8 1.5 1.9 1.8 1.8 6.2 3.4 1.75 2.81 17.7 2.6 V 1.0 1.0 1.1 0.2 0.0 0.2 0.2 8.7 4.7 0.57 -0.41 20.1 2.00 Tabla 4 (I). Concentraciones de PAH determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Las concentraciones se expresan en ng g-1. Los datos subrayados se encuentran por debajo del límite de cuantificación de la técnica (ver detalles en el texto). I.D.: código de identificación del trasplante. Los controles de la técnica son C1-C3, y los tiempos iniciales C4-C7. Desv. Típ.: desviación típica. Naf: Naftaleno; Ace: Acenafteno; Fl: Fluoreno; Fen: Fenantreno; Ant: Antraceno; Flu: Fluoranteno; Pi: Pireno; BaA: Benzo(a)antraceno]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 Naf 341 293 209 235 457 348 155 202 217 207 172 201 27.0 213 347 270 56 438 277 526 404 591 274 296 194 248 23.6 361 200 44.5 212 220 224 Ace 21.4 16.3 18.7 11.8 13.1 12.5 10.8 11.8 11.7 9.29 5.82 12.6 16.1 12.3 13.5 12.7 14.7 12.9 13.5 24.1 16.6 17.5 14.5 12.4 9.75 10.7 12.3 10.3 9.41 11.6 10.4 11.6 9.37 Fl 14.4 13 15.3 11.8 14.9 14.9 12 10.9 9.8 7.66 6.9 9.35 12.2 9.85 10.5 12.8 13.2 14.7 11.6 25.5 18.2 17.6 13.9 12 9.36 8.64 12.2 11.3 9.06 9.95 8.51 10.7 8.67 Fen 69.7 64.4 60 49.8 88.9 78.3 109 105 53.2 47.2 67.3 61.1 103 41.5 74.5 59.8 70.1 46.9 49 102 82 44.1 106 37.1 41.2 44 44.7 70.3 44.3 55.3 37.5 84.9 28.1 Ant 8.96 6.11 8.87 5.03 9.52 10.7 10 9.91 6.88 5.67 7.07 6 9.82 5.76 8.41 6.38 7.11 5.1 6.11 7.31 3.37 5.13 10 4.68 4.29 4.28 3.83 7.76 4.87 5.79 4.83 8.3 3.65 Flu 69.1 55.1 58.5 41.1 85.7 47.5 148 98.4 50.6 48.9 81.7 54.1 112 33.8 94.7 53 49.7 30.8 43.1 86.1 51 23.2 144 23.2 38.3 35.6 45 76.5 44.3 44.3 37.2 130 19.8 Pir 159 105 153 72 1553 81.4 397 302 122 133 210 137 329 78.3 276 120 89.4 101 88.7 310 141 73 316 28 94.7 96.5 93.2 1954 141 112 108 405 33.8 BaA 7.16 3.32 3.86 3.71 3.65 20.9 3.73 3.39 4.06 3.65 5.67 4.52 7.67 2.63 8.16 2.52 3.46 3.14 2.76 7.84 5.56 2.09 13.3 1.52 5.41 3.78 1.22 5.1 3.29 4.83 3.73 18.9 2.03 21 I.D. 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 C1 C2 C3 C4 C5 C6 C7 Media Desv.Típ. Asimetría Curtosis Máximo Mínimo Naf 198 459 510 35.3 370 226 371 350 451 316 208 311 146 18.5 64 205 269 333 290 394 786 404 472 448 260 136 591 18.50 0.22 -0.11 Ace 20.7 39.8 11.6 11.1 10.2 11.1 7.18 11.6 7.5 9.39 8.71 13.8 11.5 106 10.7 12.6 12.3 12.6 13.4 10.8 16.0 14.4 13.8 15.2 15.0 14.1 106 5.82 5.79 36.8 Fl 16.2 27 12.1 15.9 11 9.45 12.5 9.9 10.5 9.32 7.88 17.1 17 132 15 17 14.9 17.0 18.9 21.1 23.7 16.1 18.5 17.1 15.1 17.3 132 6.90 6.51 44.5 Fen 65.2 66.8 44.1 36.1 66.8 58.5 76.7 61 71.2 41.8 31 42.3 39.8 48.1 42.4 40.1 63.7 41.5 50.3 67.6 69.9 31.8 49.9 27.4 60 20.9 109 28.1 0.79 -0.08 Ant 7.74 8.44 4.5 3.24 1.55 5.97 1.55 4.65 7.89 3.44 3.42 3.09 3.69 5.21 6.05 5.41 5.23 2.01 4.34 <LOQ 16.5 5.71 3.37 4.15 6.1 2.3 10.7 1.55 0.23 -0.63 Flu 54.6 28.4 34.7 32.5 39.1 63.8 40.8 69.5 26.8 42.2 29.1 35.6 42.8 57.2 44.2 55.8 113 15.3 15.9 14.9 25.1 23.0 26.9 22.0 57 30.7 148 19.8 1.46 1.69 Pir 120 69.6 77.5 69.8 101 186 94.3 226 39.1 96.5 71.5 94.5 96.3 162 125 224 206 31.5 38.3 38.4 37.4 31.0 43.1 37.6 209 333 1954 28.0 4.42 20.2 BaA 4.33 5.01 6.61 3.23 9.52 4.27 16.1 4.04 13.2 1.62 1.34 2.97 1.67 3.27 1.66 2.03 7.69 1.34 <LOQ <LOQ 7.71 1.79 12.0 5.76 5.3 4.3 20.9 1.22 2.13 4.54 Tabla 4 (II). Concentraciones de PAH determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Las concentraciones se expresan en ng g-1. Los datos subrayados se encuentran por debajo del límite de cuantificación de la técnica (utilizando los controles). I.D.: código de identificación del trasplante. Los controles de la técnica son C1-C3, y los tiempos iniciales C4-C7. Se incluyen estadísticos descriptivos; Desv. Típ.: desviación típica. Cr: Criseno; BbF+BjF: Benzo(b)fluoranteno+Benzo(j)fluoranteno; BkF: Benzo(k)fluoranteno; BeP: Benzo(e)pireno; BaP: Benzo(a)pireno; BghiPe: Benzo(ghi)perileno; DahA: Dibenzo(a,h)antraceno; InP: Indopireno]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 Cr 18.5 17.7 18 14.1 20 16 35.6 30.4 11.1 10.3 23.1 15.9 24.2 BbF+BjF 41.3 27.2 34.1 31 43.6 52.9 49.1 35.5 21.8 24.2 39.9 25.5 47.3 BkF 33.3 8.14 16.9 10.2 17.2 17.5 12.8 7.89 3.04 7.4 6.92 6.38 16 BeP 41.3 54.7 34.4 47.4 68.1 3.48 63.61 44.6 22.4 31.3 47.9 30.2 44.4 BaP 9.15 81.1 12.3 8.14 10.2 31.6 7.21 7.92 3.53 4.04 4.25 4.94 9.27 BghiPe 4.05 14.6 5.44 2.73 7.35 0.31 2.63 3.17 1.27 2.42 3.28 1.97 4.54 DahA 6.68 3.83 10.7 16.4 9.78 0.49 17.31 0.49 5.74 0.49 2.56 11.8 17.3 InP 58.4 104 61.1 84.1 124 1.18 91.7 89.3 39.3 35.5 56.7 43.1 98.6 22 I.D. 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 C1 C2 C3 C4 C5 C6 C7 Media Desv.Típ. Asimetría Curtosis Máximo Mínimo Cr 8.94 17.5 14.3 12.5 10.2 13.1 21.8 15.9 6.4 40.9 5.47 11.7 9.37 10.3 15.8 10.6 9.85 10.1 32.9 4.14 14 5.76 8.7 7.34 13.9 12.7 9.19 17.2 21.7 9.07 6.67 7.3 8.05 13.8 8.8 5.96 18.1 3.42 4.93 6.07 14.7 3.24 11.4 3.62 14.5 7.9 40.9 4.14 1.48 2.41 BbF+BjF 13.9 29.6 23.1 28.3 18.3 20.1 37.5 42.1 13.3 3.82 19.7 21.6 15 25.2 29 14.4 18.8 13 3.82 12.5 28.5 17.9 31.1 22.5 41.1 22.2 25.7 20 71.7 10.4 13.9 10.5 12.1 17.8 12.5 7.64 25.8 10.3 8.31 26.3 22.1 6.62 21.0 8.71 25.4 13.6 71.7 3.82 1.02 1.52 BkF 8.53 8.07 6.75 10.3 3.21 11.5 11.5 14.8 2.4 184 7.63 5 3.67 10.9 8.04 2.96 4.82 5.22 87.8 3.43 5.92 5.45 15.2 1.471 49.7 9.26 41.8 5.67 25.8 1.16 5.76 5.5 4.24 4.26 4.96 2.93 8.72 4.13 2.11 50.9 39.9 4.59 12.2 8.56 15.2 28.4 184 1.16 4.87 26.8 BeP 16.7 48.4 36.7 41.8 16.26 40 48.2 41.7 13.6 102 16.3 22.1 15.1 23.4 30.4 15.3 18.6 17.3 46.1 6.96 30 14.1 43.1 19.9 73.1 28.7 88.4 29 75.1 15.4 10.2 7.25 15.6 14.2 10.8 9.66 17.8 7.96 4.69 15.7 60.8 6.01 26.1 7.09 33.1 22.0 102 3.48 1.13 1.16 BaP 4.5 53.8 9.91 7.39 4.58 7.73 3.24 7.68 7.12 5.51 1.41 3.37 2.34 2.42 4.03 3.67 2.91 2.96 2.21 0.534 2.44 56.6 9.35 1.61 22.4 4.61 48.2 3.17 33.3 2.06 1.31 3.6 52.2 17.3 23 13.6 99.7 0.649 0.829 14.1 29.0 0.65 6.22 1.89 14.5 21.2 99.7 0.53 2.48 6.12 BghiPe DahA 2.91 6.49 1.99 21.9 6.46 6.05 8.44 8.95 0.85 1.31 3.38 16.7 2.31 0.981 9.54 40.6 2.75 2.04 9.71 54.4 2.69 5.45 1.1 6.22 1.66 4.72 2.34 5.27 2.84 3.54 2.34 2.05 3.26 3.24 1.26 5.86 3.82 20 0.994 1.89 2 6.24 1.78 3.92 6.37 6.3 1.37 3.63 24.7 31.2 1.78 7.41 28.8 49 2.61 2.51 37.9 27.5 1.14 2.43 0.629 1.6 2.2 2.66 5.62 6.9 2.92 2.83 1.71 1.4 2.19 2.17 1.44 9.87 1.99 0.525 0.820 3.22 32.1 43.1 <LOQ <LOQ 1.17 3.17 20.1 11.6 2.33 4.27 5.0 9.8 7.2 12.1 37.9 54.4 0.31 0.49 3.28 2.28 11.27 5.17 InP 25 92.1 42.3 49.8 21.5 65.3 85.9 50 14 273 11.4 33.9 15.1 13 48 15.3 19.2 24.4 107 4.22 35.2 17.4 53.9 24.9 62.8 41.7 101 37.4 49.7 24.7 9.75 2.36 16.8 18.5 15.8 8.47 18.4 5.23 3.57 41.9 32.4 1.53 18.5 7.36 49 45.6 273 1.18 2.64 10.92 23 Mapa 8. Concentraciones y Factores de enriquecimiento para Naftaleno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 9. Concentraciones y Factores de enriquecimiento para Acenafteno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 24 Mapa 10. Concentraciones y Factores de enriquecimiento para Fluoreno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 11. Concentraciones y Factores de enriquecimiento para Fenantreno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 25 Mapa 12. Concentraciones y Factores de enriquecimiento para Antraceno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 13. Concentraciones y Factores de enriquecimiento para Fluoranteno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 26 Mapa 14. Concentraciones y Factores de enriquecimiento para Pireno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 15. Concentraciones y Factores de enriquecimiento para Benzo(a)antraceno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 27 Mapa 16. Concentraciones y Factores de enriquecimiento para Criseno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 17. Concentraciones y Factores de enriquecimiento para Benzo(b)fluoranteno+Benzo(j)fluoranteno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 28 Mapa 18. Concentraciones y Factores de enriquecimiento para Benzo(k)fluoranteno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 19. Concentraciones y Factores de enriquecimiento para Benzo(e)pireno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 29 Mapa 20. Concentraciones y Factores de enriquecimiento para Benzo(a)pireno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 21. Concentraciones y Factores de enriquecimiento para Benzo(ghi)perileno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 30 Mapa 22. Concentraciones y Factores de enriquecimiento para Dibenzo(a,h)antraceno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. Mapa 23. Concentraciones y Factores de enriquecimiento para Indopireno determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 31 Mapa 23. Concentraciones y Factores de enriquecimiento para el sumatorio de PAH expresado en Tóxicos Equivalentes determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. 32 En la Fig. 2 se muestran las distribuciones de densidad obtenidas tras aplicar el kernel smoothing. Las distribuciones de Pb, Ni y Cd presentan valores atípicos con desviaciones de la moda principal de la distribución, siendo similares entre si y coincidiendo parte de los valores atípicos. Los datos correspondientes a Cd presentan un valor extremo 3 veces mayor que la moda de la distribución (i.e. 08). En el caso de Pb el valor atípico es 4 veces mayor que el valor modal (i.e. 08), y para Ni 5 veces mayor (i.e. 08). Todas las distribuciones presentan una fuerte asimetría salvo Hg y As; en este último caso se encuentra la distribución más simétrica (Tabla 3). La tendencia a la simetría podría ser el signo de una ausencia de contaminación; no obstante, ya se ha indicado que los datos obtenidos para As no se pueden emplear cuantitativamente (ver Sección 4.1.) La mayoría de las distribuciones se muestran polimodales, apareciendo como dos modas principales o en la forma de valores atípicos (i.e. Cd, Ni y Pb). Las mayores concentraciones obtenidas en la determinación de Cd correspondientes a los códigos de identificación 03 y 14, V 08, 02 y 06, Ni 08, 13 ,02 y 07 y en menor medida Pb 04, 32 y 23. Así para las primeras 10-15 muestras se muestran las mayores concentraciones de dichos elementos (Tabla 3). Atendiendo a la cercanía entre dichas muestras dentro de la malla de muestreo podría ser indicativo de la posible existencia de estructura espacial. En la Fig. 3 se presentan las distribuciones de densidad correspondientes a los PAH determinados. Se puede destacar que para algunos compuestos los valores extremos se repiten en el mismo orden (i.e. acenafteno y fluoreno; fenantreno y fluoranteno), siendo probablemente esta la causa de que en el análisis de componentes principales (ver Sección 4.4.) estos compuestos se agrupen en los mismos factores respectivamente. Por lo que se refiere a los trasplantes que aparecen como valores extremos destaca el caso del trasplante 23, que aparece en 10 de los compuestos, la mitad de ellas como valor máximo. En cuanto a su identificación como valores extremos le siguen los trasplantes 07, 32, 42, 06, 38 y 40, destacando la poca coincidencia con los trasplantes que se identificaron como valore extremos para metales y metaloides (con la excepción de Pb). 33 Fig. 2. Distribuciones de densidad obtenidas tras aplicar kernel smoothing a las concentraciones de metales y metaloides determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [En cada gráfica se indica el código de identificación de las muestras con las mayores concentraciones]. 34 Fig. 3 (I). Distribuciones de densidad obtenidas tras aplicar el kernel smoothing a las concentraciones de PAH determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [En cada gráfica se indica el código de identificación de las muestras con las mayores concentraciones]. 35 Fig. 3 (II). Distribuciones de densidad obtenidas tras aplicar el kernel smoothing a las concentraciones de PAH determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [En cada gráfica se indica el código de identificación de las muestras con las mayores concentraciones]. 36 Fig. 4. Distribuciones de densidad obtenidas tras aplicar el kernel smoothing a las concentraciones del sumatorio de PAH y factores de equivalencia tóxica (TEF) determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [En cada gráfica se indica el código de identificación de las muestras con las mayores concentraciones]. 37 4.4. Análisis multifactorial El PCA obtenido absorbió el 61% de la varianza total de los datos, correspondiéndole un 21% al primer factor, un 18% al segundo, un 13% al tercero y un 9% al cuarto. La matriz de componentes obtenida tras la rotación Varimax se muestra en la Tabla 5. Tabla. 5. Matriz de componentes rotada correspondiente al análisis de componentes principales (PCA) realizado para los 50 trasplantes y los metales, metaloides y PAH determinados. No se muestran valores absolutos menores a 0.4. Elemento/compuesto Factor 1 Factor 2 Factor 3 Factor 4 As Cd 0.628 Hg 0.746 Ni 0.822 Pb 0.725 V 0.932 Naftaleno Acenafteno 0.986 Fluoreno 0.977 Fenantreno 0.527 Antraceno Fluoranteno 0.634 0.432 0.469 0.716 0.659 Pireno 0.759 Benz(a)antraceno 0.613 Criseno 0.612 0.435 0.539 Benzo(b)fluoranteno + Benzo(j)fluoranteno Benzo(k)fluoranteno 0.917 Benzo(e)pireno 0.828 Benzo(a)pireno 38 4.5. Factores de enriquecimiento En la Tabla 6 se muestran los factores de enriquecimiento calculados para cada elemento en cada uno de los trasplantes. Cabe destacar que se muestran los correspondientes a As pese a que no serían cuantitativamente significativos según lo expuesto en el apartado de control de la calidad analítica. Vanadio presenta los mayores factores de enriquecimiento, alcanzando valores de 200, y además gran cantidad de muestras presentan factores de enriquecimiento superiores a 100. Los factores de enriquecimiento obtenidos aparecen representados espacialmente en los Mapas 2 a 7 para As, Cd, Hg, Ni, Pb y V, respectivamente. La Tabla 7 muestra los factores de enriquecimiento correspondientes a cada compuesto y trasplante. Mientras que su representación geográfica se presenta en los Mapas 8 a 23 para naftaleno, acenafteno, fluoreno, fenantreno, antraceno, fluoranteno, pireno, benzo(a)antraceno, criseno, benzo(b)fluoranteno + benzo(j)fluoranteno, benzo(k)fluoranteno, benzo(e)pireno, benzo(a)pireno, benzo(ghi)perileno, dibenzo(a,h)antraceno e indopireno, respectivamente. Cabe destacar que, en general y salvo en casos concretos, los factores de enriquecimiento son bajos, sobre todo comparados con los comentados en el caso de V. Tabla 6. Factores de enriquecimiento de metales y metaloides determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición y su localización geográfica. [I.D.: código de identificación del trasplante]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 As 4 1 1 1 2 1 5 3 1 1 2 3 4 1 2 1 2 2 2 Cd 4 4 15 7 7 4 5 5 4 4 3 4 5 11 3 5 4 5 5 Hg 3 3 4 3 3 3 3 3 3 4 4 3 3 3 3 2 4 3 3 Ni 9 23 15 15 11 15 23 30 7 10 12 19 26 15 11 5 10 10 10 Pb 3 4 3 10 5 5 6 7 3 3 4 5 7 3 5 2 2 3 4 V 106 144 162 172 131 185 131 200 73 119 129 138 128 139 109 44 115 75 84 39 I.D. 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 As 3 2 2 3 2 3 3 3 3 3 3 4 4 2 4 2 1 2 3 2 2 4 3 4 4 4 5 4 3 2 4 Cd 4 4 3 5 3 4 4 4 3 3 2 4 6 2 4 2 4 4 3 3 2 5 4 4 4 3 3 3 2 2 4 Hg 2 3 2 4 2 3 3 4 2 3 2 3 4 1 3 2 2 2 3 2 2 2 3 3 3 3 3 3 2 2 2 Ni 11 7 7 12 5 8 9 10 6 9 4 7 10 3 13 5 6 5 7 6 4 6 9 7 5 7 8 7 5 5 8 Pb 5 4 2 8 2 2 2 3 3 3 2 3 9 1 2 2 2 2 3 2 2 4 3 2 2 2 2 3 2 2 2 V 94 64 62 163 71 72 90 81 44 69 27 65 117 20 86 27 30 29 47 28 30 68 86 60 45 90 87 53 37 22 62 Tabla 7 (I). Factores de enriquecimiento de PAH determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición y su localización geográfica. [I.D.: código de identificación del trasplante. Naf: Naftaleno; Ace: Acenafteno; Fl: Fluoreno; Fen: Fenantreno; Ant: Antraceno; Flu: Fluoranteno; Pi: Pireno; BaA: Benzo(a)antraceno; <LOQ: concentración menor que el límite de cuantificación analítico]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Naf 1 1 0 1 1 1 0 0 0 0 0 0 0 0 1 1 Ace 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 Fl 1 1 1 1 1 1 1 1 1 0 0 1 1 1 1 1 Fen 2 2 1 1 2 2 3 3 1 1 2 1 3 1 2 1 Ant 2 1 2 1 2 2 2 2 1 1 1 1 2 1 2 1 Flu 3 2 2 2 4 2 6 4 2 2 3 2 5 1 4 2 Pir 4 3 4 2 41 2 11 8 3 4 6 4 9 2 7 3 BaA 1 0 1 1 1 3 1 1 1 1 1 1 1 0 1 0 40 I.D. 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 Naf 0 1 1 1 1 1 1 1 0 1 0 1 0 0 0 0 0 0 1 1 0 1 0 1 1 1 1 0 1 0 0 0 0 1 Ace 1 1 1 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 3 1 1 1 1 0 1 1 1 1 1 1 7 1 1 1 Fl 1 1 1 1 1 1 1 1 1 0 1 1 1 1 0 1 0 1 2 1 1 1 1 1 1 1 1 0 1 1 7 1 1 1 Fen 2 1 1 3 2 1 3 1 1 1 1 2 1 1 1 2 1 2 2 1 1 2 1 2 1 2 1 1 1 1 1 1 1 2 Ant 1 1 1 1 1 1 2 1 1 1 1 2 1 1 1 2 1 2 2 1 1 <LOQ 1 <LOQ 1 2 1 1 1 1 1 1 1 1 Flu 2 1 2 4 2 1 6 1 2 1 2 3 2 2 2 5 1 2 1 1 1 2 3 2 3 1 2 1 1 2 2 2 2 5 Pir 2 3 2 8 4 2 8 1 3 3 2 52 4 3 3 11 1 3 2 2 2 3 5 3 6 1 3 2 3 3 4 3 6 5 BaA 1 0 0 1 1 0 2 0 1 1 0 1 0 1 1 3 0 1 1 1 0 1 1 2 1 2 0 0 0 0 0 0 0 1 Tabla 7 (II). Factores de enriquecimiento de PAH determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición y su localización geográfica. [Cr: Criseno; BbF+BjF: Benzo(b)fluoranteno+Benzo(j)fluoranteno; BkF: Benzo(k)fluoranteno; BeP: Benzo(e)pireno; BaP: Benzo(a)pireno; BghiPe: Benzo(ghi)perileno; DahA: Dibenzo(a,h)antraceno; InP: Indopireno; <LOQ: concentración menor que el límite de cuantificación analítico]. I.D. 1 2 3 4 5 6 7 8 9 10 11 12 13 Cr 2 2 2 2 3 2 5 4 1 1 3 2 3 BbF+BjF 3 2 2 2 3 4 3 2 1 2 3 2 3 BkF 3 1 2 1 2 2 1 1 0 1 1 1 2 BeP 2 3 2 3 4 <LOQ 4 3 1 2 3 2 3 BaP 2 20 3 2 3 8 2 2 1 1 1 1 2 BghiPe 2 8 3 2 4 <LOQ 2 2 1 1 2 1 3 DahA InP 2 5 1 8 3 5 4 7 3 10 <LOQ <LOQ 5 7 <LOQ 7 2 3 <LOQ 3 1 4 3 3 5 8 41 I.D. 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 Cr 1 2 2 2 1 2 3 2 1 5 1 2 1 1 2 1 1 1 4 1 2 1 1 1 2 2 1 2 3 1 1 1 1 2 1 1 2 BbF+BjF 1 2 2 2 1 1 3 3 1 <LOQ 1 1 1 2 2 1 1 1 <LOQ 1 2 1 2 2 3 1 2 1 5 1 1 1 1 1 1 1 2 BkF 1 1 1 1 0 1 1 1 0 18 1 0 0 1 1 0 0 1 8 0 1 1 1 0 5 1 4 1 2 0 1 1 0 0 0 0 1 BeP 1 3 2 3 1 2 3 3 1 6 1 1 1 1 2 1 1 1 3 0 2 1 3 1 4 2 5 2 5 1 1 0 1 1 1 1 1 BaP 1 13 2 2 1 2 1 2 2 1 0 1 1 1 1 1 1 1 1 0 1 14 2 0 6 1 12 1 8 1 0 1 13 4 6 3 25 BghiPe DahA 2 2 1 6 4 2 5 2 0 0 2 4 1 0 5 11 2 1 6 15 2 1 1 2 1 1 1 1 2 1 1 1 2 1 1 2 2 5 1 1 1 2 1 1 4 2 1 1 14 8 1 2 16 13 1 1 22 7 1 1 0 0 1 1 3 2 2 1 1 0 1 1 1 3 InP 2 7 3 4 2 5 7 4 1 21 1 3 1 1 4 1 1 2 8 0 3 1 4 2 5 3 8 3 4 2 1 0 1 1 1 1 1 42 4.6. Estructura espacial En la Fig. 4 se muestran los semivariogramas robustos, obtenidos para los datos pertenecientes a los metales y metaloides. Todos los semivariogramas muestran sus primeros lags significativos lo que evidencia la posibilidad de que los datos tengan estructura espacial (lags por debajo del cuantil del 2.5%). En el caso de Ni, V y Pb este aspecto cobra relevancia al encontrarse los cuatro primeros lags para los tres elementos fuera de la región de aceptación de la hipótesis nula de inexistencia de estructura espacial. Las formas de los tres variogramas es aproximadamente lineal, el valor de la varianza se incrementa con la distancia del lag, indicando la presencia de un cambio de media dentro del área lo que nos hace pensar en la existencia de una superficie de respuesta más o menos similar a un plano inclinado. En el caso de As y Hg no estaría clara la existencia de estructura espacial dado que aunque tienen 2 primeros lags significativos el As y uno el Hg; sobre todo en caso de este último, los valores de los sucesivos lags se encuentran cercanos a la semivarianza mediana y no tienen lags por encima del cuantil del 97.5%, por lo que no podríamos sospechar la existencia del plano inclinado en estos casos. La Fig. 5 muestra los semivariogramas robustos correspondientes a los PAH determinados. Excepto en los casos de antraceno, criseno y benzo(b)fluoranteno + benzo(j)fluoranteno, no existe estructura espacial en las concentraciones de PAH. Tampoco el sumatorio de PAH ni el sumatorio de factores de equivalencia tóxica mostraron estructura espacial. Por último, se ha comprobado que de los factores extraídos por el análisis de componentes principales sólo el segundo muestra estructura espacial en la zona estudiada (Fig. 7). 43 Fig. 4. Semivariogramas robustos para los metales y metaloides determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%)]. 44 Fig. 5 (I). Semivariogramas robustos para los PAH determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%)]. 45 Fig. 5 (II). Semivariogramas robustos para los PAH determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%)]. 46 Fig. 6. Semivariogramas robustos para el sumatorio de PAHs y factores de equivalencia tóxica (TEF) determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%)]. Fig. 7. Semivariogramas robustos para los factores extraídos con el análisis de componentes principales realizado con los datos de metales, metaloides y PAH determinados en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%)]. 47 4.7. Superficies de respuesta En la Tabla 8 se muestran los datos correspondientes a los polinomios elegidos entre el conjunto de posibilidades que teniendo el máximo coeficiente de determinación ajustado (R2aj), cumplían con que todos los términos fueran significativos y que los residuos no tuviesen estructura espacial. Se presentan junto con este coeficiente el coeficiente de determinación y la significación de los términos que los constituyen. Respecto a metales y metaloides se puede destacar que el polinomio obtenido para Ni tiene todos sus términos significativos para un nivel de confianza del 99%; el resto lo son para el 95%. En cuanto al porcentaje de datos contenidos en las funciones, corresponden a V y Ni los mayores valores, 71 y 69%, respectivamente. Las superficies de respuesta aparecen representadas en los Mapas 8-12 para Cd, Hg, Ni, Pb y V respectivamente. No se representó la superficie obtenida para As dado el bajo porcentaje de datos que contenía y por lo expuesto en el apartado 4.1. En la Tabla 9 se detallan las expresiones obtenidas para las superficies de respuesta de cada elemento. Tabla 8. Significación de los términos de las superficies de respuesta (R2 y R2aj) obtenidas con las concentraciones determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [R2aj: R2 ajustado. Ant: Antraceno; Cr: Criseno; BbF+BjF: Benzo(b)fluoranteno+Benzo(j)fluoranteno; Fac 2: segundo factor extraído con el PCA]. As Cd Hg Ni Pb V Ant Cr BbF+BjF Fac 2 2 R 0.24 0.37 0.30 0.69 0.43 0.71 0.31 0.24 0.33 0.65 R2aj 0.21 0.31 0.25 0.65 0.37 0.68 0.29 0.21 0.27 0.61 x - - - 0.0000 0.0127 0.0133 - - - - y - 0.0000 0.0008 0.0000 0.0006 0.0000 0.0000 0.0004 0.0002 0.0000 x2 - - - - - - - - 0.0153 - y2 - 0.0288 - 0.0000 0.0295 0.0096 - - - - xy - 0.0446 - 0.0000 - - - - - 0.0003 x2y - - - - - - - 0.0273 0.0062 - y2x - - 0.0083 0.0007 - 0.0172 - - - - x3 0.0397 0.0266 0.0343 - - - - - 0.0217 0.0002 y3 0.0084 - - - 0.0295 0.0002 - - - 0.0003 48 Por lo que se refiere a los PAH, los valores de los coeficientes de determinación son más bajos que para metales y metaloides, pues en el mejor de los casos (i.e. para benzo(b)fluoranteno+benzo(j)fluoranteno) la variabilidad absorbida apenas supera el 30%. Las superficies de respuesta correspondientes aparecen representadas en los Mapas 30-32 para antraceno, criseno, y benzo(b)fluoranteno+benzo(j)fluoranteno respectivamente. Por último, el polinomio obtenido para el segundo factor extraído por el análisis de componentes principales absorbe el 65% de la variabilidad. En el Mapa 33 se muestra la representación de la superficie de respuesta correspondiente. Tabla 9. Superficies de respuesta obtenidas con las concentraciones de cada elemento (ng g-1, excepto el Factor 2) determinadas en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Ant: Antraceno; Cr: Criseno; BbF+BjF: Benzo(b)fluoranteno+Benzo(j)fluoranteno; Fac 2: segundo factor extraído con el PCA]. Polinomios As = 356.69 + 2.35E-08x3 + 4.40E-08y3 Cd = 523.43 + 5.01E-08y3 - 9.13E-05yy - 3.24E-01y + 1.25E-04y2 Hg = 92.31 + 3.84E-09x3 - 1.20E-02y - 7.50E-09y2x Ni = 12232.8 + 3.47x - 7.86E-03xy - 13.0013y + 5.61E-03y2 +3.63E-06y2x Pb = 9079.96 + 1.07x – 4.31y – 3.31E-03y2 + 2.63E-064y3 V = 13077.4 + 1.54x – 9.30y - 3.90E-03y2 - 1.15E-06y2x + 4.64E-06y3 Ant = 7.02733 - 0.00174614y Cr = 16.9956 + 2.6812E-9x2y - 0.00730502y BbF+BjF = 35.4704 - 0.0000069744x2 + 8.4404E-9x2y - 2.30336E-9x3 - 0.0151192y Fac 2 = 0.840785 + 2.9043E-10x3 - 5.64151E-7xy - 0.00211823y + 5.34369E-10y3 En la Fig. 5 se muestran los semivariogramas robustos de los residuos generados por cada superficie de respuesta. Se observa cómo en los casos de As, Hg, Ni y V no existe estructura espacial remanente en los residuos. Sin embargo, los semivariogramas de Cd y Pb sí que muestran que los residuos generan estructura espacial, lo que indicaría una menor calidad en las superficies de respuesta correspondientes. De forma análoga, la Fig. 6 presenta los semivariogramas correspondientes a los residuos de los PAH y del segundo factor del PCA. En todos los casos se comprueba que los residuos no muestran estructura espacial. 49 Fig. 5. Semivariogramas robustos realizados a los residuos generados por las superficie de respuesta, diferencia entre valor predicho por el polinomio y valor real medido en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Los semivariogramas se realizaron tras un test en el que se aleatorizaron (10000 veces) los residuos generados por el polinomio, para cada punto de la malla teórica, entre todas las posiciones posibles dentro de la misma. Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%) para la aleatorización.]. 50 Fig. 6. Semivariogramas robustos realizados a los residuos generados por las superficie de respuesta, diferencia entre valor predicho por el polinomio y valor real medido en trasplantes de Pseudoscleropodium purum tras dos meses de exposición. [Los semivariogramas se realizaron tras un test en el que se aleatorizaron (10000 veces) los residuos generados por el polinomio, para cada punto de la malla teórica, entre todas las posiciones posibles dentro de la misma. Se representan la varianza robusta, la mediana y los cuantiles (2.5 y 97.5%) para la aleatorización.]. 51 Mapa 25. Superficie de respuesta de la estructura espacial de Cadmio determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 52 Mapa 26. Superficie de respuesta de la estructura espacial de Mercurio determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 53 Mapa 27. Superficie de respuesta de la estructura espacial de Níquel determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 54 Mapa 28. Superficie de respuesta de la estructura espacial de Plomo determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 55 Mapa 29. Superficie de respuesta de la estructura espacial de Vanadio determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 56 Mapa 30. Superficie de respuesta de la estructura espacial de Antraceno determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 57 Mapa 31. Superficie de respuesta de la estructura espacial de Criseno determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 58 Mapa 32. Superficie de respuesta de la estructura espacial de Benzo(b)fluoranteno+Benzo(j)fluoranteno determinado en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 59 Mapa 33. Superficie de respuesta de la estructura espacial del Segundo Factor del PCA extraído a partir de las concentraciones de metales, metaloides y PAH determinadas en trasplantes de Pseudoscleropodium purum después de dos meses de exposición. 60 5. DISCUSIÓN Atendiendo a la calidad analítica de los datos obtenidos (Tabla 1), podemos afirmar que parece no existir contaminación por As en el área de estudio. Además el análisis de la posible estructura espacial y representación de la misma queda invalidada al encontrarse gran cantidad de las determinaciones por debajo del límite de cuantificación de la técnica, por lo que los resultados obtenidos para este elemento deben desecharse. Lo mismo sucede con los PAH excepto en los casos de fluoranteno y pireno. Diversos autores, en estudios similares, han realizado un análisis de componentes principales (PCA) como una herramienta que facilita la interpretación de relaciones entre variables y la identificación de grupos, pudiendo atribuir a un conjunto de elementos una fuente común (Barandovski et al., 2008; Szcezepaniak et al., 2006; Szcezepaniak et al., 2007; Shou-Qin Sun et al.. 2008). Los resultados del análisis de componentes principales realizado en el presente trabajo, agrupando en el segundo factor todos los metales junto con la mayoría de los PAH que mostraron estructura espacial (i.e. antraceno y criseno), nos hace suponer que existe una fuente común en la emisión de dichos contaminantes. En los casos concretos de Ni y V, la existencia de correlación entre ambos es habitual en estudios realizados con musgo en entornos industriales de similares características, es decir refinerías petrolíferas (Anicic et al., 2008; Ceburnis et al., 1997; Herpin et al., 1996; Tuba y Csintalan, 1993). Estos dos elementos se hayan igualmente altamente correlacionados en partículas PM10 y PM2.5 en la zona de estudio de acuerdo con los resultados presentados en el “PLAN DE CALIDAD DEL AIRE DE LA COMUNIDAD AUTÓNOMA DE CANARIAS” correspondientes a medidas realizadas entre julio 2005 y febrero 2007. En el mencionado estudio la fuente de ambos metales es atribuida a las emisiones industriales de la refinería de petróleo. Desafortunadamente en dicho Plan de Calidad no se incluyen datos de PAH. La representación gráfica de las superficies de respuesta obtenidas muestra, en todos los casos, la existencia de un gradiente de concentraciones creciente hacia el entorno de la zona industrial donde se encuentra la refinería, con cierto desplazamiento hacia el suroeste de la misma. Estas superficies de respuesta muestran el patrón de bioinmisión, es decir la inmisión determinada a través de los musgos, y por lo tanto representan cuál es el patrón general de las concentraciones alcanzadas en estos. En los mapas también se puede observar como el patrón detectado para cada elemento es muy similar, siendo prácticamente idéntico para Ni y V. Se han 61 obtenido resultados similares en las concentraciones de Ni y V en el estudio realizado por Tuba y Csintalan (1993), en una ciudad cercana a una refinería de petróleo y una planta de producción de electricidad que emplea fuel-oil como combustible, en el que los niveles de contaminación decrecen con la misma velocidad en función de la distancia mostrando además patrones de distribución espacial también muy similares. En los mapas del presente estudio también se observa una disminución muy brusca de las concentraciones metálicas al alejarnos de la refinería, especialmente para los dos elementos que alcanzaron un mayor enriquecimiento (i.e. Ni y V). Cuanto menor fueron los factores de enriquecimiento (p.e. Hg y PAH) menor fue el gradiente de concentración modelizado. Para casi todos los contaminantes podemos observar cómo además de la zona situada al sur de la refinería, existe un área al noroeste en donde parece existir una segunda zona de dispersión preferencial de los contaminantes. La razón podría radicar en las características orográficas del territorio y/o en el tipo de dispersión de los contaminantes que estaría afectado por los vientos dominantes y brisas cuya dirección y velocidad puede modificar el gradiente de contaminación alrededor del foco emisor (Galey et al., 1986; Castello et al., 2007). Tabla 10. Comparación de los factores de enriquecimiento (tomando la mediana) obtenidos en trasplantes de Pseudoscleropodium purum tras dos meses de exposición en Santa Cruz de Tenerife con datos procedentes de fuentes bibliográficas. Referencia Este estudio Adamo et al., 2002 Adamo et al., 2006 Anicic et al., 2009 Localización Sta. Cruz de Tenerife Nápoles Trieste Nápoles Belgrado Basile et al., 2008 Acerra (Italia) Culicov et al., 2005 Culicov et al., 2006 Castello et al., 2007 Baia Mare (Rumanía) Sofia Trieste Giordano et al., 2005 Nápoles Naszradi et al., 2007 Budapest Százhalombatta (Hungría) Vasconcelos et al.,1997 Oporto Tuba y Csintalan, 1993 Especie P. purum Sphagnum capillifolium Hypnum cupressiforme Hypnum cupressiforme Sphagnum girgensohnii Exposición 2 meses 17 semanas 6 semanas 6 semanas 3 meses 6 meses Scorpiurum circinatum 1 mes 2 meses 3 meses Sphagnum girgensohnii 4 meses Sphagnum girgensohnii 3 meses Hypnum cupressiforme 2 meses P. purum 2 meses Sphagnum capillifolium 2 meses 4 meses Tortula ruralis 2 meses (otoño) 2 meses (invierno) Cd Hg Ni Pb V 4 3 9 3 81 1 1 9 6 1 2 2 4 2 1 1 1 5 1 2 24 4 - 58 2 4 1 3 6 2 4 7 2 5 1 - 2 1 - 1 1 1 1 2 1 1 2 2 2 2 4 5 2 2 7 7 2 1 2 2 3 1 1 1 Tortula ruralis 3 meses 1 - 2 1 5 Shagnum auriculatum 2 meses - - 9 10 - 62 Los factores de enriquecimiento se muestran muy elevados para V, alcanzándose valores de 200 veces la concentración inicial en un trasplante concreto y en torno a 100 en una amplia mayoría de los puntos muestreados. En el caso de los PAH los enriquecimientos fueron, en términos generales, casi inexistentes. La Tabla 10 muestra una comparativa de los factores de enriquecimiento encontrados en Santa Cruz de Tenerife con los obtenidos en ciudades europeas y en focos de contaminación de origen industrial. A tenor de los resultados de V, con una mediana de los factores de enriquecimiento de 81, se podría decir que existe una contaminación grave para dicho metal en el área objeto de estudio. La afirmación es rotunda si comparamos estos datos con los obtenidos para Belgrado por Anicic et al. (2009), una ciudad de más de 1.700.000 habitantes, en la que se encontraron factores de enriquecimiento para V de 24 en tres meses y 58 en seis. Los factores de enriquecimiento encontrados en otras grandes ciudades como Nápoles, Sofía y Budapest se sitúan un orden de magnitud por debajo de los obtenidos en el presente estudio para este elemento. En el caso de Ni los factores de enriquecimiento encontrados en este estudio, tomando como referencia la mediana de los mismos, son similares a los registrados por Vasconcelos et al. (1997) en Oporto tras dos meses de exposición. Estos niveles triplican los obtenidos en otras ciudades como Nápoles y Trieste (con periodos de exposición similares) y como Belgrado (para un periodo de exposición de 6 meses). Los factores de enriquecimiento encontrados para el resto de las ciudades recogidas en la Tabla 10 son mucho menores. Para el Pb los factores de enriquecimiento son inferiores a los de V y Ni, y si se comparan con los encontrados en ciudades como Oporto, Nápoles y Acerra se observa que para Santa Cruz son claramente menores. La presencia de Pb se ha relacionado con una elevada densidad de tráfico de vehículos, algo que es un problema importante en ciudades como Nápoles por la que diariamente circulan unos 265.000 vehículos (Giordano et al., 2005). En el caso de Oporto, a pesar de observarse un factor de enriquecimiento de 9, los niveles obtenidos son mucho menores que a los de estudios realizados en años anteriores en la ciudad, disminución que se ha relacionado con el creciente uso de gasolinas sin Pb (Vasconcelos et al., 1997). En el caso del Hg los factores de enriquecimiento encontrados son relativamente bajos y no muy diferentes a los encontrados en estudios precedentes realizados en Trieste y Nápoles. 63 Por último, la mediana de los factores de enriquecimiento de Cd encontrados en Santa Cruz (4) es comparable a los observados en Acerra y Baia Mare. Para otras ciudades estudiadas previamente los factores de enriquecimiento de Cd son inferiores (Tabla 10). No obstante, esto no supone una situación tan grave como la detectada para Ni y V, dado que los factores de enriquecimiento son mucho menores que para estos elementos. Tabla 11. Comparación de los factores de enriquecimiento (valores mínimos y máximos) obtenidos en trasplantes de Pseudoscleropodium purum tras dos meses de exposición en Santa Cruz de Tenerife con datos procedentes de fuentes bibliográficas. Wegener et al., 1992 Planta de aluminio Naftaleno Acenafteno Fluoreno Fenantreno Antraceno Fluoranteno Pireno Benzo(a)antraceno Criseno Benzo(b+j)fluoranteno Benzo(a)pireno Benzo(ghi)perileno Dibenzo(ah)antraceno Indopireno 29 34-44 20-26 12-16 Viskari et al., 1997 Autopista 1-2 0-8 1-2 1-2 0-2 1-7 1-10 1-6 1-4 1-3 1-2 1-6 0-3 1-3 Rantalainen et al., 1999 Interior de viviendas 2-20 30-453 33-198 33-174 96-247 Orlinski, 2002 Centro urbano 0-4 0-4 1-3 1-3 0-3 1-3 1-3 1-4 0-4 1-6 0-4 1-3 1-3 Este estudio Urbano e industrial 0-1 0-7 0-7 1-3 0-2 1-6 1-52 0-3 1-5 0-5 0-25 0-22 0-15 0-21 La Tabla 11 muestra, para diferentes estudios, incluyendo este, y cada compuesto, el rango de factores de enriquecimiento calculados. El número de estudios realizados con transplantes de musgo para la biomonitorización de PAH es muy escaso y el principal problema, para realizar comparaciones, es que sólo se han determinado las concentraciones iniciales de las muestras en tres de ellos (Viskari et al., 1997; Viskari et al., 1999; Rantalainen et al., 1999). En la restante bibliografía (Wegener et al., 1992; Orlinski, 2002) no se han determinado dichas concentraciones iniciales dificultando el cálculo de los factores de enriquecimiento para los diferentes compuestos. En estos casos se utilizaron las concentraciones pertenecientes al musgo expuesto en zonas libres de contaminación como concentración inicial. El estudio de PAH con transplantes de musgo se ha llevado a cabo mediante un estudio intensivo con el fin de evaluar la contaminación de pequeños focos contaminantes, en ambos 64 estudios realizados por Viskari y colaboradores se estimó la contaminación entorno a carreteras principales, caracterizando el gradiente de la concentración corporal del musgo en función de la distancia al foco (Viskari et al., 1997), se encontró que la concentración decrece al aumentar la distancia de la carretera y a 60-100 m las concentraciones de PAH en las muestras de musgo eran similares a las concentraciones iniciales. Esta misma autora utilizo transplantes para comparar la contaminación de PAH en tres carreteras con diferente densidad de tráfico concluyendo que la concentración de PAH a lo largo de una autopista es significativamente mayor que las concentraciones iniciales de las muestras. En el estudio llevado a cabo por Rantalainen et al. (1999) se determinaron las concentraciones corporales de PAH en transplantes de musgo en el interior de 10 casas de Nepal, en las que usan carbón (smoky coal) para la cocina y calefacción, obteniendo factores de enriquecimiento muy elevados comparado con el resto de los estudios existentes. Los valores de los factores de enriquecimiento encontrados en el presente estudio estarían dentro del mismo rango que los encontrados en carreteras y centros urbanos, sin embargo cabe destacar la existencia en el presente estudio de valores extremos respecto a los de la bibliografía, y que además no parecen tener ninguna relación con la proximidad a la zona industrial estudiada. A la vista de lo comentado anteriormente, queda clara la existencia de un problema de contaminación de Ni y V, por lo que se incluye a continuación una breve reseña ecotoxicológica de ambos metales: 1) Níquel El Ni existe en una serie de especies que pueden clasificarse como Ni metálico, oxídico y sulfídico o como sales de Ni solubles. Los niveles actuales de Ni en el aire ambiente de emplazamientos rurales generalmente no suelen superar los 2 ng m-3, con unos valores mínimos de 0,4 ng m-3. Los niveles de emplazamientos en contexto urbano presentan una oscilación entre 1,4 y 13 ng m-3. Las concentraciones de Ni observadas cerca de instalaciones industriales pueden ser hasta de un orden de magnitud superior, dependiendo del tipo de instalación y de la distancia y posición de la estación de seguimiento. La predominancia de uno u otro compuesto de Ni en el aire ambiente depende de su origen. Aunque cerca del 50% del Ni procedente de fuentes de combustión puede ser soluble, esto se aplica a menos del 10% del Ni sulfídico. Las mediciones indicativas muestran que el Ni oxídico puede ser la principal fracción en el aire ambiente. Por lo que respecta a la distribución 65 por tamaños, el Ni en el aire ambiente presenta porcentajes importantes de partículas gruesas (<PM10). Algunas fuentes antropogénicas importantes de Ni son la combustión de fuentes fijas (55%) y de fuentes móviles y la maquinaria distinta del transporte por carretera (30%). Esta última cifra no está confirmada por los inventarios nacionales, que atribuyen un porcentaje reducido a esta fuente. Por lo que respecta a la calidad del aire, las fuentes relevantes son el refinado del petróleo y las emisiones fugitivas procedentes de la producción de acero en hornos eléctricos de arco. Entre las fuentes naturales importantes de Ni destacan las partículas de tierra arrastradas por el viento y los volcanes. En Europa las fuentes antropogénicas superan considerablemente a las fuentes naturales. En general, en Europa la población absorbe unos 500 mg día-1 (un cigarrillo contiene 2 ng). Según el compuesto, hasta el 35% de las partículas inhaladas pueden ser absorbidas en los pulmones. El Ni se asocia a la albúmina y se difunde fácilmente (el valor normal en sangre ronda los 2 µg L-1), siendo el riñón, hígado y pulmones donde se encuentran los valores más elevados. Los efectos dependen de la forma del Ni y los compuestos solubles de Ni son los que tienen mayor impacto. Los efectos no cancerosos para la salud humana del Ni en el aire ambiente se concentran en el tracto respiratorio, el sistema inmunológico y la regulación endocrina. En el caso de individuos expuestos (sobre todo en siderurgias) la respiración permanente de aerosoles con Ni puede entrañar manifestaciones displásicas epiteliales de las fosas nasales, asmatiforme así como neumoconiosis. Los primeros signos clínicos se observan en individuos con más de 100 µg L-1 en orina en el 10% de la población, sobre todo mujeres, la toxicidad del Ni se manifiesta en forma de reacciones alérgicas (hipersensibilidad con dermatitis alérgicas). No se conocen efectos teratogénicos en hombre, pero si mutagénicos y cancerígenos (VME: 1 mg m-3; MAKIII/I). La CIIC clasifica el Ni metálico como 2B y sus compuestos, como Ni-tetracarbonilo, Ni(CO)4, como 1 para el sistema respiratorio. 2) Vanadio El V proviene de diferentes operaciones industriales y artesanales. Entre las actividades con emisiones de V están la limpieza de cisternas de estaciones de servicio o de refinerías, tinturas y otras industrias químicas. Sin embargo, la contaminación atmosférica por este 66 elemento está ligada fundamentalmente con las emisiones de la industria de refinado de petróleo y la combustión de carbón y fuel (fundamentalmente fueles pesados). La absorción de V se realiza sobretodo por vía respiratoria. A nivel sanguíneo esta esencialmente presente en el plasma, parcialmente ligado a la globulina. Se bioacumula preferentemente en corazón, bazo, hígado, riñones y testículos y se excreta principalmente vía urinaria, secundariamente por las heces. Es considerado un metal esencial, pero también es un metal acumulativo que puede alterar sistemas enzimáticos, sobretodo a nivel de membrana (aumenta la actividad de la adenilciclasa e inhibe la ATPasa Na+ K+ a nivel renal, cerebral y cardíaco y, en consecuencia, inhibe la bomba de sodio). Disminuye la resistencia inmunológica y presenta cierta toxicidad respiratoria (irritación, rinitis, faringitis, bronquitis), digestiva, renal y neurológica (temblores, cuadros depresivos). El V no parece poseer potencialidades carcinógenas, pero si teratogénicas. La concentración de V en el ambiente varía considerablemente. En áreas rurales remotas la concentración es inferior a 1 ng m-3, pero la quema de combustibles fósiles puede incrementar esporádicamente los niveles locales hasta 75 ng m-3. La concentración típica en ambiente urbano varía en un amplio rango 0.25-300 ng m-3. En grandes ciudades se pueden alcanzar valores medios anuales entre 20 y 100 ng m-3, con marcadas diferencias entre el invierno (valores máximos) y verano. Asumiendo una concentración media en el aire de 50 ng m-3, puede entrar en el tracto respiratorio cerca de 1µg diario. La VME de polvos y humos, expresados en V2O5, es de 50 µg m-3. En aire la OMS exige respetar un valor límite de 1 µg m-3como media anual, un valor fácil de encontrar en el entorno de industrias metalúrgicas. En sangre y orina las concentraciones normales son, respectivamente: ≤ 0.5 µg L-1 y < 0.2-0.8 µg L-1. 67 6. CONCLUSIONES • La técnica de biomonitorización activa realizada con trasplantes de musgo ha demostrado ser muy adecuada para realizar una evaluación detallada de la calidad del aire en el entorno del área industrial y de alta densidad de circulación de Santa Cruz de Tenerife. • No se ha detectado contaminación de arsénico ni de la mayoría de los PAH estudiados. • El método utilizado se ha mostrado óptimo para la descripción de la estructura espacial de V y Ni; encontrándose también estructura espacial para Cd, Hg, Pb, y de forma más pobre para antraceno, criseno y benzo(b)fluoranteno + benzo(j)fluoranteno. • La representación de las superficies de respuesta obtenidas muestra en todos los casos una estructura espacial ligada a la refinería que CEPSA tiene instalada en Santa Cruz de Tenerife, y que está desplazada hacia el suroeste de la factoría. Esto se verifica por la existencia de estructura espacial y la superficie de respuesta correspondiente al segundo factor identificado por el análisis de componentes principales. • Los factores de enriquecimiento obtenidos indican la existencia de una grave y elevada contaminación de V y Ni, respectivamente, en el entorno de la refinería. • Se han encontrado concentraciones especialmente altas de Cd, Hg, Pb, criseno, benzo(b)fluoranteno+benzo(j)fluoranteno y de forma muy especial de V y Ni. 68 7. RECOMENDACIONES Y ACCIONES FUTURAS • Dadas las concentraciones registradas en algunos de los metales y metaloides estudiados, sería recomendable proceder a la determinación de otros posibles metales que se puedan encontrar como contaminantes atmosféricos: Ag, Al, Ba, Be, Cr, Co, Cu, Fe, Mn, Se, Sb, Sn, Sr, Tl y Zn. Del mismo modo y para evaluar el efecto del tráfico rodado en esta zona del núcleo urbano sería aconsejable la determinación en las muestras de Pd, Pt y Rh. • Para evaluar la representatividad del trabajo realizado, sería conveniente su repetición en otros años y otras épocas del año. • La información obtenida en el presente trabajo, al identificarse las zonas de mayor inmisión, podría servir para la ubicación o reubicación de estaciones de control de la contaminación atmosférica de esta área. • Al mismo tiempo, sería conveniente iniciar actuaciones relacionadas con la salud pública (i.e. estudios epidemiológicos) para descartar la existencia de daños a la población derivados de la contaminación del aire por los contaminantes estudiados. • A la vista de los resultados es necesario reducir las emisiones e inmisiones de Cd, Hg, Pb, criseno, benzo(b)fluoranteno+benzo(j)fluoranteno y de forma muy especial de V y Ni. 69 7. BIBLIOGRAFÍA Aboal, J.R., Fernández, J.A., Carballeira, A. 2004. Oak leaves and pine needles as biomonitors of airborne trace elements pollution. Environmental and Experimental Botany 51:215-225. Aboal, J.R., Real, C., Fernández, J.A., Carballeira. 2006. A. Mapping the results of extensive surveys: The case of atmospheric biomonitoring and terrestrial mosses. Science of the Total Environment 356: 256-274. Adamo, P., Giordano, S., Vingiani, S., Castaldo Cobianchi, R., Violante. 2003. Trace element accumulation by moss and lichen exposed in bags in the city of Naples (Italy). Environmental Pollution 122: 91103. Adamo, P., Crisafulli, P., Giordano, S., Minganti, V., Modenesi, P., Monaci, F., Pittao, E., Tretiach, M., Bargagli, R. 2007. Lichen and moss bags as monitoring devices in urbana reas. Part II: Trace element content in living and dead biomonitors and comparison with synthetic materials. Environmental Pollution 146: 392-399. Anicic, M., Tasic, M., Frontasyera, M.V., Tomasevic, M., Rajsic, S., Strelkova, L. P., Popovic, A., Steinnes, E. 2009. Active biomonitoring with wet and dry moss: a case of study in an urban area. Environmental Chemistry Letters 7 (1): 55-60. Barandovski, L., Cekova, M., Frontasyeva, V., Pavlov, S.S., Stafilov, T., Steinnes, E., Urumov, V. 2008. Atmospheric deposition of trace element pollutants in Macedonia studied by the moss biomonitoring technique. Environmental Monitoring and Assessment 138 (1-3): 107-118. Basile, A., Sorbo, S., Aprile, G., Conte, B. and Castaldo Cobianchi, R. 2008. Comparison of the heavy metal bioaccumulation capacity of an epiphytic moss and an epiphytic lichen. Environmental Pollution 151: 401-407. Brown, D.H., Wells, J.M. 1990. Ionic control of intracellular and extracelular Cd uptake by the moss Rhytidiadelphus squarrosus (Hedw.) Warnst. New Phytologist 116:541-553. Castello, M. 2007. A comparison between two moss species used as transplants for airborne trace element biomonitoring in NE Italy. Environmental Monitoring and Assessment 133 (1-3): 267-276. Ceburnis, D., Rühling, A., Kvietkus, K. 1997. Extended study of atmospheric heavy metal deposition in Lithuania based on moss analysis. Environmental Monitoring and Assessment 47:135-152. Ceburnis, D., Steinnes, E. 2000. Conifer needles as biomonitors of atmospheric heavy metal deposition: comparison with mosses and precipitation, role of the canopy. Atmospheric Envirment 34: 42654271. Couto, J.A.; Aboal, J.R.; Fernández, J.A., Carballeira, A. 2004. A new method for testing the sensitivity of active biomonitoring: an example of its application to a terrestrial moss. Chemosphere 57: 303-308. 70 Culicov, O.A., Mocanu, R., Frontasyeva, M.V., Yurukova, L., Steinnes, E. 2005. Active moss biomonitoring applied to an industrial site in Romania: Relative accumulation of 36 elements in moss-bags. Environmental Monitoring and Assessment 108(1-3): 229-240. Culicov, O. A., Yurukova, L. 2006. Comparison of element accumulation of different moss- and lichenbags, exposed in the city of Sofia (Bulgaria). Journal of Atmospheric Chemistry 55 (1): 1-12. Cressie, N.A.C., Hawkins, D.M. 1980. Robust estimation of the variogram. Journal of the International Association for Mathematical Geology 12: 115–25. Galey, F., Lloyd, O. 1986. Atmospheric metal pollution monitored by spherical moss bags: A case study of Armadale. Environmental Health Perspectives 68: 187-196. Giordano, S., Adamo, P., Sorbo, S., Vingiani, S. 2005. Atmospheric trace metal pollution in the Naples urban based on results from moss and lichen bags. Environmental Pollution 136: 431-442. Herpin, U. Berlekamp, J., Markert, B., Grodzinska, K. Siewers, U., Lieth., Weckert, V. 1996. The distribution of heavy metals in a transect of the three states: the Netherlands, Germany and Poland, determined with the aid of moss monitoring. Science of the Total Environment 187: 185-198. Naszradi, T., Badacsonyi, A., Keresztényi, I., Podar, D., Csintalan, Z. and Tuba, Z. 2007. Comparison of two metal surveys by moss Tortula ruralis in Budapest, Hungary. Environmental Monitoring and Assessment 134: 279-285. Nisbet, C., LaGoy, P. 1992. Toxic equivalency factors (TEFs) for policyclic aromatic hydrocarbons (PAHs). Regulatory Toxicology and Farmacology 16: 290-300. Orliński, R. 2002. Multipoint moss passive samplers assessment of urban airborne polycyclic aromatic hydrocarbons: concentrations profile and distribution along Warsaw main streets. Chemosphere 48, 181–186. Rantalainen, A., Hyötyläinen, T., Saramo, M., Niskanen, I., 1999. Passive sampling of PAHs in indoor air in Nepal. Toxicological and Environmental Chemistry 68, 335-348. Real, C., Aboal, J.R., Fernández J.A., Carballeira, A. 2003. The use of native mosses to monitor fluorine levels –and associated temporal variations- in the vicinity of an aluminium smelter. Atmospheric Environment 37: 3091-3102. Ripley, B. 2002. The KernSmooth package. S original by M. Wand & R Port. Rühling, A., Tyler, G. 1968. An ecological approach to the lead problem. Botaniska Notiser 122:248-342. Steinnes, E., Rühling, A., Lippo, H., Mäkinen. 1997. Reference materials for large-scale metal deposition surveys. Accreditation and Quality Assurance 2: 243-249. Sun, S.-Q., Wang, D.-Y., He, M., Zhang, C. Monitoring of atmospheric heavy metal deposition in Chongqing, China - Based on moss bag technique. Environmental Monitoring and Assessment 148 (1-4): 1-9 71 Szczepaniak, K., Astel , A., Bode,P., Sârbu, C., Biziuk, M., Raińska, E., Gos, K. 2006. Assessment of atmospheric inorganic pollution in the urban region of Gdańsk, Northern Poland. Journal of Radioanalytical and Nuclear Chemistry 270 (1): 35-42. Szczepaniak, K., Astel , A., Simeonov, V., Tsakovski, S., Biziuk, M., Bode,P.,Przyjazny, A. 2007. Comparison of dry and living Sphagnum palustre moss samples in determining their biocumulative capability as biomonitoring tools. Journal of Environmental Science and Health 42: 1101-1115. Tuba, Z., Csintalan, Z. 1993. The use of moss transplantation technique for bioindication of heavy metal pollution. In B. Markert (Ed.), Plants as Biomonitors- Indicators for Heavy Metals Pollution in the Terrestrial Environment. Weinheim New York: VHC-Publisher Inc. Tyler, G. 1990. Bryophytes and heavy metals. A literature review. Botanical Journal of the Linnean Society 104: 231-253. Vasconcelos, M. T. S. D., Tavares, H. M. F. 1998. Atmospheric metal pollution (Cr, Cu, Fe, Mn, Ni, Pb and Zn) in Oporto city derived from results for low-volume aerosol samplers and forthemoss Sphagnum auriculatum bioindicator. Science of the Total Environment 212 (1): 11-20. Viskari E.L., Rekilä R., Roy S., Lehto O., Ruuskanen J., Kärenlampi L. 1997. Airborne pollutants along a roadside: assessment using snow analyses and moss bags. Environmental Pollution 97, 153-160. Wand, M.P., Jones, M.C. 1995. Kernel smoothing. In: Cox, D.R., Hinkley, D.V., Reid, N., Rubin, D.B., Silverman, B.W., editors. Monographs on statistics and applied probability. London, Chapman and Hall. Wegener J.W.M., van Schaik M.J.M., Aiking,H. 1991. Active biomonitoring of polycyclic aromatic hydrocarbons by means of mosses. Environmental Pollution 76, 15-18. 72




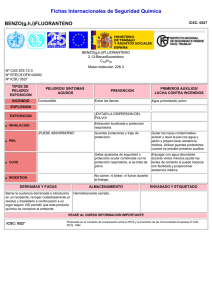
![[Ciudad, fecha exacta]. Sr. Director del IUPAC-UNITAR STP](http://s2.studylib.es/store/data/005278428_1-00f608da61abd5bc31a28743f0bbd593-300x300.png)
