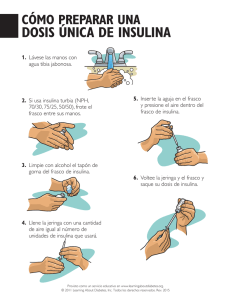
composicion basada en polipeptidos de carga opuesta..
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS 11 Número de publicación: 2 208 305 51 Int. Cl. : A61K 38/28 7 A61K 38/30 A61K 47/18 A61K 47/20 A61K 47/40 A61P 5/50 ESPAÑA 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00920012 .2 86 Fecha de presentación: 30.03.2000 87 Número de publicación de la solicitud: 1165119 87 Fecha de publicación de la solicitud: 02.01.2002 54 Título: Composición basada en polipéptidos de carga opuesta. 30 Prioridad: 08.04.1999 US 128392 P 73 Titular/es: Genentech, Inc. 1 Dna Way South San Francisco, California 94080-4990, US 45 Fecha de publicación de la mención BOPI: 16.06.2004 72 Inventor/es: Oeswein, James Q.; Smikahl, John R.; Wang, Sharon, X. y Yeung, Douglas, A. 45 Fecha de la publicación del folleto de la patente: 74 Agente: Ponti Sales, Adelaida ES 2 208 305 T3 16.06.2004 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid ES 2 208 305 T3 DESCRIPCIÓN Composición basada en polipéptidos de carga opuesta. 5 Antecedentes de la invención Campo de la invención 10 15 20 25 30 35 La presente invención se refiere a formulaciones que contienen mezclas de polipéptidos de carga opuesta, en concreto el factor de crecimiento similar a insulina (IGF-I) e insulina. En particular, esta invención trae consigo una formulación que contiene excipientes seleccionados que permiten la mezcla de proteínas con carga opuesta en la misma formulación, evitando, los excipientes, la interacción de las proteínas que, normalmente, harían que precipitaran en disolución. Descripción del estado de la técnica relacionada La IGF-I humana es un polipéptido de 7649 daltons (Rinderknecht and Humbel, Proc. Natl. Acad. Sci. USA, 73: 2365 (1976), Rinderknecht and Humbel, J. Biol. Chem., 253: 2769 (1978) que pertenece a una familia de somatomedinas con actividades biológicas similares a insulina y mitogénicas que modulan la acción de la hormona de crecimiento (GH). Van Wyck et al., Recent Prog. Horm. Res., 30: 259 (1974); Binoux, Ann. Endocrinol. 41: 157 (1980), Clemmons and Van Wyck, Handbook Exp. Pharmacol., 57: 161 (1981); Baxter, Adv. Clin. Chem., 25: 49 (1986); patente US Nº 4.988.675; WO 91/03253; y WO 93/23071. La IGF-I contiene tres enlaces disulfuro y tiene un pI de 8,65 una absortividad molar de 0,645 a 276 nm. La IGF-I se encuentra de manera natural en fluidos corporales humanos, por ejemplo sangre y fluido espinal cerebral humano. La mayoría de tejidos y , especialmente el hígado, producen IGFI junto con proteínas de unión específicas de IGF-I. Como la GH, la IGF-I es una proteína anabólica potente. Véase Tanner et al., Acta Endocrinol., 84: 681-696 (1977); Uthne et al., J. Clin. Endocrinol. Metab., 39: 548-554 (1974). Véase también Ross et al., Intensive Care Med., 19 Suppl. 2: S54-57 (1993), que es una revisión del papel crítico de la insulina, la hormona de crecimiento y la IGF-I como agentes anabólicos en una enfermedad. IGF-I se puede purificar de fuentes naturales, p.e. suero humano (Rinderknecht and Humbel, J. Biol. Chem., supra) o se puede preparar de manera recombinante (p.e. EP 123.228 y 128.733). Se han descrito varios procedimientos para la formulación del IGF-I. Estos incluyen, por ejemplo, EP 440.989, la cual describe un procedimiento de preparación de una composición seca de IGF-I, que comprende secar una disolución que contiene IGF-I junto con un ácido fuerte, WO 91/18621 donde se formula la IGF-I en un tampón citrato a pH 6, la patente US Nº 5.374.620 sobre una formulación de IGF-I y GH en una composición promotora del crecimiento, la patente US Nº 5.681.814 sobre una formulación de IGF-I en un tampón acetato, la PCT/SE94/00010 sobre una disolución estable que contiene la IGF-I en un tampón fosfato en una cantidad de 50 mmoles o menos, dando un pH de 5,5 a 6,5, que es isotónico y adecuado para la inyección y WO 95/34318 sobre una disolución que comprende la IGF-I en una disolución acuosa con una concentración reducida de oxígeno. 40 45 50 55 60 65 La IGF-I tiene efectos hipoglicémicos en los humanos, similares a la insulina, cuando se administra por inyección intravenosa de bolo, pero también promueve un balance positivo de nitrógeno. Underwood et al., Hormone Research, 24: 166 (1986). La IGF-I es conocida por ejercer efectos en la disminución de la glucosa en individuos tanto normales (Guler et al., N. Engl. J. Med., 317: 137-140 (1987)) como diabéticos (Schoenle et al., Diabetologia, 34: 675-679 (1991); Zenobi et al., J. Clin. Invest., 90: 2234-2241 (1992)) (véase también Sherwin et al., Hormone Research, 41 (Suppl. 2). 97-101 (1994); Takano et al., Endocrinol. Japan, 37: 309-317 (1990); Guler et al., Acta Paediatr. Scand. (Suppl.), 367: 52-54 (1990), con un curso de tiempo descrito como reensamblaje de la insulina regular. Véase también Kerr et al., “Effect of Insulin-like Growth factor 1 on the responses to and recognition of hypogycemia”, American Diabetes Association (ADA), 52nd Annual Meeting, San Antonio, Texas, Junio 20-23, 1992, que publica el conocimiento de una hipoglicemia aumentada después de la administración de rhIGF-I. Además, la administración única de rhIGF-I reduce los niveles de GH durante toda la noche y los requisitos de insulina en adolescentes con IDDM. Cheetham et al., Clin. Endocrinol., 40: 515-522 (1994); Cheetham et al., Diabetologia, 36: 678-681 (1993). La IGF-I humana recombinante administrada a diabéticos de tipo II, según publicaba Schalch et al., J. Clin. Endocrinol. Metab. 77: 1563-1568 (1993), demostraba un fallo tanto en la insulina en suero como en un decrecimiento paralelo en los niveles de péptido C que indicaban una reducción en la secreción de insulina pancreática después de 5 días de tratamiento con IGF-I. Este efecto ha sido confirmado, independientemente, por Froesch et al., Horm. Res., 42: 66-71 (1994). Estudios in vivo con ratas normales también ilustran que la infusión de IGF-I inhibe la liberación de insulina en el páncreas. Furnsinn et al., Endocrinology, 135: 2144-2149 (1994). Además, en preparaciones de perfusión de páncreas, la IGF-I también suprime la secreción de insulina. Leahy et al., Endocrinology, 126: 15931598 (1990). A pesar de estos claros efectos inhibidores in vivo de la IGF-I sobre la secreción de la insulina en humanos animales, los estudios in vitro no han conseguido tales resultados uniformes. Los estudios in vitro que utilizan concentraciones múltiples tanto de la IGF-I como de la glucosa han demostrado varios grados de inhibición en la secreción de insulina, p.e., desde ningún efecto (Sieradzeri et al., J. Endocrinol., 117: 59-62 (1988)) a una disminución del 30% en la liberación de insulina utilizando niveles fisiológicos de IGF-I. Van Schravendijk et al., Diabetologia, 33: 649-653 (1990). En un estudio reciente que utilizaba islotes pancreáticos humanos, Eizirik et al., Eur. J. Endocr., 133: 248-250 (1995) no se encontró un efecto de la IGF-I en la acumulación 2 ES 2 208 305 T3 media de insulina o en la liberación de insulina estimulada por glucosa. Los investigadores especulan con que el efecto de la IGF-I observado in vivo sobre la secreción de insulina puede ser secundario, por los efectos extrapancreáticos de la IGF-I más que por sus efectos directos sobre el páncreas. Por lo tanto, la manera y el lugar de acción de la IGF-I sobre la secreción de insulina no se entiende completamente. 5 10 15 20 25 En la literatura se describen una serie de cambios bioquímicos inducidos por la administración de rhIGF-I a corto plazo. Entre lo sobresaliente se ha publicado un efecto de disminución del fosfato y el potasio de la IGF-I recombinante humana en sujetos saludables durante una alerta euglicémica. Boulware et al., “Phosphate and potassium lowering effects of insulin-like growth factor I in humans: comparison with insulin” The Endocrine Society, 74th Annual Meeting, San Antonio, Texas, 1992, Junio 24-27. Véase también Guler et al., Acta Paediatr. Scand. (Suppl.), 367, supra. El IGF-I humana recombinante tiene la capacidad de mejorar la sensibilidad a la insulina. Por ejemplo, rhIGFI (70µg/kg dos veces al día (bid)) mejoraba la sensibilidad a la insulina en un paciente no diabético, en pacientes resistentes a insulina con distrofia miotónica. Vlachopapadopoulou et al., J. Clin. Endo. Metab., 80: 3715-3723 (1995). Saad et al., Diabetologia, 37. Abstract 40 (1994) publicaba las mejoras dependientes de dosis en la sensibilidad a la insulina en adultos con obesidad y tolerancia disminuida a glucosa después de 15 días de tratamiento con rhIGF-I (25 µg y 100 µg/kg bid). El rhIGF-I también mejoraba la sensibilidad a insulina y el control glicémico en algunos pacientes con resistencia a insulina severa de tipo A (Schoenle et al., Diabetologia, 34, 675-679 (1991); Morrow et al., Diabetes, 42 (Suppl.): 269 (1993) (resumen); Kuzuya et al. Diabetes, 42: 696-705 (1993)) u otros con diabetes mellitus no insulino dependientes. Schalch et al., “Short-term metabolic effects of recombinant human insulin-like growth factor I (rhIGF-I) in type II diabetes mellitus”, in. Spencer EM ed., Modern concepts of Insulin-like Growth factors (New York: Elsevier: 1991) pág. 705-713; Zenobi et al., J. Clin. Invest., 90: 2234-2241 (1992). A pesar de que la resistencia a insulina no se ha considerado una característica prominente de la diabetes de tipo I, está claramente presente en algunos individuos y puede ser la más importante, clínicamente, durante la adolescencia. Puesto que la GH tiene efectos anti-insulina bien conocidos, los niveles elevados de GH durante la adolescencia pueden mediar demasiado en la resistencia a insulina. Press et al., supra, Defeo et al., supra, Campbell et al., N. Eng. J. Med., supra, Campbell et al., Metabolism, supra; Arias et al., supra, Davidson et al., supra. 45 Se dan en diversas referencias un esquema general para la etiología de algunos fenotipos clínicos que pueden dar lugar a resistencia a insulina y a los posibles efectos de la administración de IGF-I en sujetos representativos seleccionados. Véase, por ejemplo, Elahi et al., “Hemodynamic and metabolic responses to human insulin-like growth factor I (IGF-I) in men”, en: Modern Concepts of Insulin-Like Growth Factors, (Spencer, EM ed.), Elsevier, New York, pág. 219-224 (1991); Quin et al., New Engl. J. Med., 323: 1425-1426 (1990), Schalch et al.,“Short-term metabolic effects of recombinant human insulin-like growth factor 1 (rhIGF-I) in type II diabetes mellitus”, en: Modern Concepts of Insulin-like Growth Factors, (Spencer, EM, ed), Elsevier, New York, pág. 705-713 (1991); Schoenle et al., Diabetologia, 34. 675-679 (1991), Usala et al., N. Engl. J. Med., 327: 853-857 (1992); Lieberman et al., J. Clin. Endo. Metab., 75: 30-36 (1992); Zenobi et al., J. Clin. Invest., 90: 2234-2241 (1992), Zenobi et al., J. Clin. Invest., 89: 1908-1913 (1992); Kerr et al., J. Clin. Invest., 91: 141-147 (1993). WO 94/16722 describe un procedimiento de modificación crónica de la propiedades de barrera celular mediante la exposición de una célula a una cantidad efectiva de IGF-I para la modificación durante al menos aproximadamente siete días y un procedimiento de mejora crónica o reversa de la resistencia a insulina. Sin embargo, cuando se utilizaba el IGF-I para tratar los pacientes con diabetes tipo II en el hospital con una dosis de 120-160 µg/kg dos veces al día, los efectos secundarios pesaban más que el beneficio del tratamiento. Jabri et al., Diabetes, 43: 369-374 (1994). Véase también Wilton, Acta Paediatr., 383: 137-141 (1992) que se refiere a los efectos secundarios observados en el tratamiento de pacientes con IGF-I. 50 La patente US Nº 4.988.675 describe un tratamiento para diabéticos de tipo II con IGF-I, la patente US Nº 5.466.670 describe un tratamiento para diabéticos de tipo I con IGF-I, WO 91/03253 publica la utilización de IGF-I para el tratamiento de diabéticos resistentes a insulina severos y WO 96/01124 describe la utilización de IGF-I para prevenir la diabetes, retrasar el inicio clínico de la diabetes y proporcionar un efecto protector contra la diabetes. 30 35 40 55 60 65 Los tratamientos de elección en la diabetes de tipo II han llegado a ser terapias de combinación. Estas combinaciones, históricamente, implicaban la utilización de múltiples formas de la insulina, insulina de acción corta, insulinas de acción intermedia y de acción larga. La revisión de artículos sobre las formulaciones de insulina incluyen Kissel and Volland, Deustche Apotheker-Zeitung, 134: 25 (1994) y Campbell, Pharmacy Times, 59: 40 (1993). Más recientemente, se han llegado a hacer común las combinaciones de insulina con otros fármacos antidiabéticos, los cuales se toman de manera oral, como sulfonilureas y las biguanidas. Como las combinaciones de IGF e insulina, Gunn et al., Biochem. Arch., 5: 53-59 (1989) describe el efecto anabólico de la insulina y el IGF-II. Jacob et al., Am. J. Physiol., 260: E262-E268 (1991) describe los efectos metabólicos del IGF-I y de la insulina en ratas BB/w espontáneamente diabéticas; véase también la patente US Nº 4.876.242. Además, la estimulación en la síntesis de proteínas cardíacas después del tratamiento con insulina y el IGF se describe en Fuller et al., Biochem. Soc. Trans., 19. 277S (1991). Los experimentos han sido llevados a cabo in vitro con miocitos cardíacos aislados de manera reciente. Los efectos sobre el metabolismo de proteínas después del tratamiento con insulina e IGF en perros que han padecido de hambre durante toda la noche se publican en Umpleby et al., Eur. J. Clin. Inves., 24: 337-344 (1994). Sholjaee-Moradie et al., describe una comparación de los efectos de IGF-I, insulina e infusiones combinadas de las mismas en el metabolismo de la glucosa en perros. Randazzo and Jarre, Exp. Cell Res., 190 (1): 31-39 (1990) describe la caracterización del crecimiento de fibroblastos de murino que expresan receptores 3 ES 2 208 305 T3 5 10 15 de insulina humanos y el efecto del IGF-I e insulina en la síntesis de DNA de los mismos. Tomas et al., Diabetes, 45: 170-177 (1996) describe los efectos de la infusión conjunta de IGF-I e insulina en ratas diabéticas. Dunger et al., Metabolism, 44: 119-123 (1995) sugiere que la IGF-I junto con la insulina puede proporcionar una aproximación adicional al control de la IDDM durante la adolescencia. Mathe, Biomedicine and Pharmacotherapy, 49: 221-224 (1995) describe el papel de los IGF en su relación con la insulina para el tratamiento de la diabetes mellitus. Como en la literatura de patentes, la patente US Nº 4.988.675 describe una combinación de IGF-I con una cantidad más baja de insulina de la normal para el tratamiento de la diabetes tipo II; WO 96/01125 publicada el 18 de enero de 1996 describe la utilización de una combinación de insulina y un IGF-I en la fabricación de un medicamento destinado a contrarrestar un descenso en el balance de nitrógeno y para contrarrestar un descenso en la síntesis de proteínas y que se puede utilizar para el tratamiento de un catabolismo proteico debido a un exceso de glucocorticoides. La patente US Nº 5.091.173 describe una composición adecuada para la aplicación tópica sobre la piel o el pelo de un mamífero que comprende un sobrenadante libre de células procedente de un cultivo de células de papilas dérmicas suficiente como para incrementar el crecimiento del pelo que comprende uno o más miembros de la familia IGF seleccionados de IGF-I, IGF-II e insulina. 30 Existen diversas formas de insulina humana en el mercado que difieren en la duración de la acción y en el inicio de la acción. Jens Brange, Galenics of Insulin. The Physico-Chemycal and Pharmaceutical Aspects of Insulin Preparations (Springer-Verlag, New York, 1987), páginas 17-40. La insulina Regular es una disolución transparente neutra que contiene insulina hexamérica. Es de acción corta, su inicio de acción sucede en 0,5 horas después de la inyección y la duración de la acción es aproximadamente de 6-8 horas. La insulina NPH (Neutral Protamine Hagedorn), también llamada insulina Isofano, es una suspensión cristalina de un complejo insulina-protamina. Estos cristales contienen aproximadamente, 0,9 moléculas de protamina y dos átomos de zinc por hexámero de insulina. Dodd et al., Pharmaceutical Research, 12: 60-68 (1995). La insulina NPH es una insulina de acción intermedia; su inicio de acción ocurre en 1,5 horas y su duración de acción es de 18-26 horas. La insulina 70/30 está compuesta por 70% de insulina NPH y 30% de insulina Regular. Existe también la insulina Semilente (precipitado amorfo de un complejo de insulina y zinc), insulina Ultralente (una suspensión de cristales de insulina y zinc), e insulina Lente (una mezcla 3:7 de partículas de insulina amorfas y cristalinas), así como la insulina Humalog (disolución de insulina monomérica de acción rápida, como resultado de una inversión de los aminoácidos Lys (B28) y Pro (B29) en la cadena B de la insulina) que fue introducido recientemente en el mercado por Eli Lili and Company. 35 La insulina NPH, 70/30 y Regular son las insulinas más ampliamente utilizadas, contando con un 36%, 28% y 15% respectivamente, de las prescripciones de insulina en 1996. Estas tres formas de insulina suman hasta un 79% de todas las prescripciones de insulina. Se determinó, de esa manera, que la formulación de IGF-I necesitaba poder ser mezclada con insulina Regular, NPH y 70/30. 20 25 40 45 50 55 Los pacientes con diabetes tipo I o II toman, normalmente, de dos a cuatro inyecciones subcutáneas de insulina, diariamente, para controlar su azúcar en sangre. La utilización de un fármaco inyectable diferente del de la insulina para tratar la diabetes, como la IGF-I, está limitada, de manera natural, debido al deseo de los diabéticos a administrarse el mínimo número de inyecciones. Añadir dos inyecciones subcutáneas más diariamente, para la administración de IGF-I, en regímenes que requieren prácticamente de varias inyecciones por día de insulina no es práctico. Además, cuando se combinan dos proteínas tales como el IGF-I y la insulina, sería necesario tener la formulación resultante estable y que fuera bien absorbida por el paciente, así como tener una insulina de acción intermedia. Una insulina de acción intermedia regulada, de una manera dependiente de un momento y en un tejido diana en respuesta al cambio en las demandas del medio metabólico se describe en Lewitt et al., Endocrinology, 129: 2254-2256 (1991). La patente US Nº 5.788.959 describe un dispositivo de liberación de un fármaco que comprende una disolución de una matriz de una fase única de polímeros solubles en agua de carga opuesta tales como los polipéptidos, en donde la disolución matriz ha dispersado, en la misma, un ingrediente farmacéuticamente activo diferente de los polímeros. Además, Burgess et al., J. Pharm. Pharmacol., 43: 232-236 (1991) describe un complejo de coacervación entre mezclas de albúmina y acacia de cargas opuestas, con una coacervación que es un procedimiento normal de microencapsulación. Mauk and Mauk, Biochemistry, 21: 4730-4734 (1982) describe la formación de un complejo entre methemoglobina humana purificada y el fragmento tríptico del citocromo b5 de hígado bovino y publican un modelo de interacción entre estas moléculas en las que cada subunidad de hemoglobina se une a un citocromo b5 por medio de interacciones de carga complementarias entre grupos de carga opuesta en las dos proteínas. Además, EP 615.444 describe una forma de administración peroral para medicamentos peptídicos que contienen el medicamento, como insulina, distribuido en una gelatina o una matriz derivada de gelatina de carga opuesta. EP 313.343 describe un procedimiento de purificación de una proteína cruda de sus impurezas mediante cromatografía de intercambio iónico a un pH tal que la proteína y las impurezas tienen carga opuesta de manera que se da una unión selectiva. 60 65 Actualmente, los diabéticos mezclan insulina NPH (insulina hagedom de una protamina neutra de acción intermedia) con insulina Regular. Sería deseable mezclar polipéptidos de carga opuesta tales como la insulina y el IGF-I, cada uno en viales separados en la misma jeringa u otro recipiente de liberación diferente e inyectar o liberar la mezcla inmediatamente de otra manera. La patente US Nº 5.783.556 describe una formulación de insulina NPH e IGF-I mezcladas. La patente US Nº 5.756.463 describe una combinación de IF-I e insulina y su utilización en contrarrestar un descenso en el balance de nitrógeno y un descenso en la síntesis proteica. La patente US Nº 4.608.364 describe una combinación de un compuesto activo de un derivado de insulina y una insulina no modificada o un análogo específico del mismo para el tratamiento de la diabetes. Sería deseable mezclar todos los tipos de insulina con IGF-I para 4 ES 2 208 305 T3 este propósito, así como mezclar otros polipéptidos como protamina e insulina que se venden habitualmente como complejo de precipitación. Resumen de la invención 5 10 En la mezcla, dos polipéptidos que están cargados de manera opuesta tienden a asociarse entre sí y formar un agregado o precipitado en la disolución. La utilización de determinados excipientes en la formulación pueden prevenir la agregación y la precipitación de dichos polipéptidos cuando se mezclan, incluyendo el IGF-I con la insulina. Muchos excipientes como sales, tampones, aminoácidos neutros, polioles, azúcares y detergentes no eran efectivos en la prevención de la precipitación. 15 De acuerdo con esto, la presente invención proporciona, en una realización, una composición según define en la reivindicación 1 que comprende una mezcla de IGF-I e insulina regular y un excipiente seleccionado del grupo que consiste en arginina, lisina, glutamato (ácido glutámico), dodecilsulfato sódico y una combinación de beta-hidroxi ciclodextrina y arginina, en donde los polipéptidos son solubles en la composición. En un aspecto preferido de esta realización, la composición puede comprender, además, un tampón como histidina, a un pH de aproximadamente 7 a 7,5. 20 En una realización adicional, la invención proporciona un dispositivo según se define en la reivindicación 18 que comprende: a) un envase que comprende la composición anterior que comprende cantidades efectivas de la insulina regular y el IGF-I; y 25 b) instrucciones para utilizar la composición anterior para tratar un desorden contra el cual la composición es efectiva. En una realización preferida, la alteración es, preferiblemente, una alteración hiperglicémica. 30 En todavía otro aspecto, la invención proporciona un procedimiento para preparar la composición anterior que comprende mezclar juntos como componente (a) el IGF-I en un excipiente seleccionado del grupo que consiste en arginina, lisina, ácido glutámico, dodecilsulfato sódico, beta-hidroxi ciclodextrina y beta-ciclodextrina sulfobutiléter y como componente (b) insulina regular. 35 En un aspecto preferido, el procedimiento puede comprender, además, la etapa de incubar la mezcla durante un periodo de tiempo a aproximadamente 30-40ºC, preferiblemente, durante aproximadamente 15 minutos a 37ºC, en donde la composición comprende, además, una disolución salina tamponada con fosfato. En todavía otra realización, la invención proporciona un dispositivo para preparar la composición anterior que comprende: 40 a) un envase que comprende IGF-I en un excipiente seleccionado del grupo que consiste en arginina, lisina, ácido glutámico, dodecilsulfato de sodio y una combinación de beta-hidroxi ciclodextrina y arginina; y b) un envase que comprende insulina regular; y 45 c) instrucciones para combinar los contenidos de los envases (a) y (b). preferiblemente, la mezcla resultante es una formulación farmacéuticamene aceptable. 50 En todavía un aspecto más, la invención proporciona la utilización de las composiciones anteriores para la fabricación de un medicamento destinado al tratamiento de una alteración hiperglicémica como la diabetes en un mamífero que comprende administrar al mamífero, preferiblemente, por inyección o infusión, una cantidad efectiva de la composición. 55 La mezcla de los dos polipéptidos de carga opuesta, llamados IGF-I e insulina, requiere las propiedades físicas y químicas de ambos polipéptidos para que permanezcan intactos después de mezclados. Además, se prefiere que la farmacocinética y los perfiles farmacocinéticos de la glucosa permanezcan iguales antes y después de la mezcla. 60 65 Se prefiere que la formulación tenga un mínimo de dos años de vida. Para poder mezclar con otro polipéptido, la formulación del primer polipéptido puede ser una formulación líquida transparente o una formulación en suspensión en la que el polipéptido (IGF-I) está en forma de cristales, precipitado amorfo, o polvo seco de proteína. Un ejemplo del presente documento describe el desarrollo de una formulación de IGF-I líquida transparente que se puede mezclar con insulina. Preferiblemente, en las composiciones y dispositivos de la presente invención, la dosificación objetivo de IGF-I será de 10, 20 ó 40 µg/Kg/inyección (o 1, 2 ó 4 µg/Kg/inyección para una formulación de 10 mg/mL de IGF-I). De la dosificación de la insulina utilizada para los pacientes Tipo I y Tipo II en la fase II de ensayos clínicos, se puede calcular que la relación de mezcla de potencia máxima puede alcanzar 6:1 (vol:vol) para insulina Regular:IGF-I. La 5 ES 2 208 305 T3 5 relación de mezcla de potencia mínima puede alcanzar 1:15 (vol:vol) para insulina NPH:IGF-I. Por lo tanto, en el Ejemplo del presente documento, se estudiaron las relaciones de mezcla que se encontraban en el rango de 1:6 a 6:1 (vol:vol) para mezclar insulina Regular con IGF-I; las relaciones de mezcla que se encontraban en el rango de 1:15 a 15:1 (vol:vol) se estudiaron para mezclar insulina NPH con IGF-I; las relaciones de mezcla que se encontraban en el rango 1:15 a 6:1 (vol:vol) se estudiaron para mezclar insulina 70/30 con IGF-I. Breve Descripción de los dibujos La Figura 1 muestra el cromatograma HPLC de fase reversa a pH acídico de una muestra del IGF-I. 10 La Figura 2 muestra el cromatograma HPLC de fase reversa a pH acídico de una muestra de la insulina Regular. La Figura 3 muestra el cromatograma HPLC de fase reversa a pH acídico para una mezcla de IGF-I e insulina. 15 La Figura 4 muestra una gráfica de una disolución transparente de insulina regular (triángulos) o IGF-I en una formulación tamponada con acetato utilizada como control en el presente documento (círculos) como función de una disolución de pH, que se ajustó mediante adición de HCl o NaOH 0,1 N. Descripción de las realizaciones preferidas 20 A. Definiciones 25 30 35 40 45 50 55 60 65 Tal como se utiliza aquí, “polipéptidos cargados de manera opuesta” o “polipéptidos de carga opuesta” significa que un polipéptido está cargado negativamente y el otro polipéptido está cargado positivamente a un pH determinado. Las cargas se pueden determinar, por ejemplo, basadas en los valores de pKa de los grupos ionizables del polipéptido, o por su punto isoeléctrico (pI), según se determina, por ejemplo por electroenfoque en gel. Generalmente, el polipéptido cargado negativamente tiene una carga neta negativa a aproximadamente un pH de 6 a 8, o tiene más de aproximadamente cinco residuos cargados negativamente. Para un polipéptido a ser utilizado como un polipéptido cargado negativamente, este debe de tener un número más alto de cargas negativas comparado con el número de cargas positivas. Recíprocamente, el polipéptido cargado positivamente tiene, en general, una carga neta positiva a un pH aproximadamente de 6 a 8 o tiene más de aproximadamente cinco residuos cargados positivamente. Para un polipéptido a ser utilizado como polipéptido cargado positivamente, este debe de tener un número más elevado de cargas positivas comparado con el número de cargas negativas. Por ejemplo, la IGF-I y la insulina tienen valores de pI de 8,7 y 5,4, respectivamente, en una disolución de pH 7,2 y, de esa manera, están cargados de manera opuesta. Las cargas en los dos polímeros cargados de manera opuesta son suficientes para que se dé una interacción electrostática. Los polipéptidos cargados de manera opuesta en el presente documento pueden ser polipéptidos nativos, o los que se derivan, o sintéticos, con la condición de que sean “farmacéuticamente activos”. Por “farmacéuticamente activos” se entiende un polipéptido que tiene eficacia en uno o más ensayos biológicos, incluyendo los ensayos inmunológicos y ensayos mitogénicos. Por ejemplo, los polipéptidos farmacéuticamente activos incluyen antígenos así como anticuerpos, y receptores así como ligandos, los cuales actúan en un sentido inmunológico o biológico. Tal y como se utiliza aquí, “IGF-I” se refiere al factor de crecimiento similar a insulina procedente de cualquier especie, incluyendo la bovina, ovina, porcina, equina, y, preferiblemente, humana, en una secuencia nativa o en una forma variante, y procedente de cualquier fuente, ya sea natural, sintética o recombinante. Para la utilización animal es preferida, en el presente documento, la forma de IGF-I de especies concretas a ser tratadas, como la IGF-I porcina para tratar a los cerdos, la IF-I ovina para tratar a las ovejas, la IGF-I bovina para tratar el ganado, etc. Para la utilización en humanos es preferida, en el presente documento, la secuencia nativa humana, la IGF-I madura, más preferiblemente sin una metionina N-terminal, preparada, por ejemplo, mediante el procedimiento descrito en EP 230.869 publicada el 5 de Agosto de 1987 la EP 128.733, publicada el 19 de Diciembre de 1984, o la EP 288.451 publicada el 26 de Ocubre de 1988. Más preferiblemente, esta secuencia nativa de IGF-I está producida de manera recombinante y se consigue de Genentech, Inc., South San Francisco, CA para investigaciones clínicas. Las variantes de IGF-I preferidas son las descritas en las patentes US Nº 5.077.276, 5.164.370, o 5.470.828; o en WO 87/01038, es decir aquellas en donde por lo menos el residuo de ácido glutámico está ausente en la posición 3 de la región N-terminal de la molécula madura o aquellas que tienen una deleción de hasta cinco aminoácidos en la región N-terminal. La variante más preferida tiene los tres primeros aminoácidos del extremo N-terminal delecionados (designados, de manera variable, como IGF-I de cerebro, tIGF-I, des(1-3)-IGF-I o des-IGF-I). Tal y como se utiliza aquí, “insulina” se refiere a cualquier tipo de insulina procedente de cualquier especie, incluyendo la bovina, ovina, porcina, equina, y, preferiblemente, humana, procedente de cualquier fuente, ya sea natural, sintética o recombinante. Todos los fármacos de insulina publicados, por ejemplo, en Diabetes MellitusTheory and Practice, cuarta edición, Harold Rifkin, MD, Ed. (Elsevier, New York, 1990), Capítulo 29, y U.S. Pharmacist, 18 (Nov. Suppl.) pág. 38-40 (1993) son apropiados en el presente documento. Todas las diversas formas de insulina humana en el mercado están incluidas, tales como las mencionadas en Jens Brange, Galenics of Insulin, The Physico-Chemical and Pharmaceutical Aspects of Insulin and Insulin Preparations (Springer-Verlag, New York, 1987), página 17-40. Estas incluyen la insulina Regular, la insulina NPH (Neutral Protamine Hagedorn), también llamada insulina Isofano e insulina 70/30, compuesta por un 70% de insulina NPH y un 30% de insulina Regular. Para la 6 ES 2 208 305 T3 utilización animal es preferida, en el presente documento, la forma de insulina procedente de la especie determinada a ser tratada, tal como la insulina humana para tratar humanos. 5 10 15 20 25 30 35 Tal y como se utiliza en el presente documento, el término “alteración” se refiere, en general, a cualquier condición que se beneficiaría de cualquier tratamiento con los ingredientes de polipéptidos cargados de manera opuesta en la composición del presente documento, incluyendo cualquier enfermedad o alteración que pueda ser tratada mediante cantidades efectivas de estos polipéptidos. Esto incluye las alteraciones crónicas y agudas, así como las condiciones patológicas que predisponen al mamífero a la alteración en cuestión. Ejemplos no limitativos de alteraciones a ser tratadas en el presente documento incluyen los tumores malignos y benignos; leucemias y malignidades linfoides; alteraciones neuronales, gliales, astrocitales, hipotalámicas y otras alteraciones glandulares, macrofágicas, epiteliales, estromales y blastocoélicas; alteraciones relacionadas con la hematopoyesis; alteraciones en el crecimiento de tejidos; alteraciones en la piel; desmoplasia, lesiones fibróticas; alteraciones hiperglicémicas; alteraciones del riñón; alteraciones relacionadas con la médula; traumas, tales como quemaduras, incisiones y otras heridas; estados catabólicos, alteraciones relacionadas con los testículos; y alteraciones inflamatorias, angiogénicas e inmunológicas, incluyendo la arteriosclerosis. Un ejemplo de una alteración que se puede beneficiar del tratamiento con IGF-I e insulina incluye la diabetes. Tal y como se utiliza aquí, el término “alteraciones hiperglicémicas” se refiere a todas las formas de diabetes, tales como la diabetes tipo I y tipo II, así como la hiperinsulinemia e hiperlipidemia, pe., sujetos obesos y con diabetes resistente a insulina, como el síndrome de Mendenhall, síndrome de Werner, leprecaunismo, diabetes lipoatrófica y otras lipoatrofias. La alteración hiperglicémica preferida es la diabetes, especialmente la diabetes tipo I y tipo II. La “diabetes” por sí misma se refiere a una alteración progresiva del metabolismo de carbohidratos que implica una producción o una utilización inadecuada de la insulina y se caracteriza por hiperglicemia y glicosuria. Tal y como se utiliza aquí, el término “tratar” se refiere a tanto un tratamiento terapéutico como a medidas profilácticas o preventivas. Aquellos con la necesidad de tratamiento incluyen aquellos que tengan la alteración así como aquellos que son propensos a tener la alteración o que son diagnosticados con una alteración o aquellos en los que la alteración ha de ser prevenida. Los tratamientos o administración consecutivas se refiere a un tratamiento con por lo menos una base diaria sin interrupción en el tratamiento por uno o más días. El tratamiento o administración intermitente o el tratamiento o administración de una manera intermitente, se refiere al tratamiento que no es consecutivo, sino cíclico en naturaleza. El régimen de tratamiento, en el presente documento, puede ser consecutivo o intermitente, pero preferiblemente es consecutivo cuando ambas proteínas se formulan y administran juntas. Tal y como se utiliza aquí, “mamífero” para los propósitos del tratamiento se refiere a cualquier animal clasificado como mamífero, incluyendo los humanos, los animales domésticos y de granja y los animales de zoo, de deportes o de compañía, como perros, caballos, gatos, ovejas, cerdos, vacas, etc. El mamífero preferido en el presente documento es un humano. El término “no adulto” se refiere a mamíferos que tienen una edad perinatal (como las criaturas de bajo peso en el nacimiento) hasta la edad de la pubertad, siendo la última aquella en la que todavía no se ha alcanzado el potencial de crecimiento completo. 40 45 Tal y como se utiliza aquí, “agente hipoglicémico” se refiere a secretagogas, preferiblemente agentes orales, excluyendo la insulina, que causan la secreción de insulina en el páncreas. Para la utilización en humanos, es más preferida en el presente documento la clase sulfonilureas de agentes hipoglicémicos orales. Los ejemplos incluyen gliburida, glipizida y gliclazida. Además, los agentes que intensifican la sensibilidad a insulina, como las biguanidas están dentro de la definición y también son preferidas. 50 Tal y como se utiliza aquí, “complejadas” en el contexto de los polipéptidos significa que están unidos de manera covalente o sino que tienen una afinidad de unión que es mayor a aproximadamente 1 (mµ)−1 . Ejemplos que incluirían un complejo de IGF-I y uno o más de sus proteínas de unión , o de un ligando y su receptor, o de methemoglobina y el fragmento tríptico de citocromo b de hígado bovino o coacervación del complejo, como son albúmina y acacia. 55 60 65 Tal y como se utiliza aquí, “soluble” se refiere a los polipéptidos que, cuando están en disolución acuosa, se disuelven completamente, resultando en una disolución de clara a ligeramente opalescente sin partículas visibles, cuando se examina por inspección visual. Un ensayo adicional de la turbidez de la disolución se puede realizar midiendo las absorbancias de UV de 320 nm a 360 nm con una celda de una longitud de trayectoria de 1 cm (Eckhardt et al., J. Phamaceutical Science and Technology, 48: 64-70 (1994)). Un “estabilizador” es cualquier compuesto que funciona para conservar los polipéptidos nativos en el formulación, p.e. la insulina y el IGF-I, de tal manera que no se degraden o se vuelvan inactivos de otra manera durante un periodo de tiempo razonable o el desarrollo de patógenos o toxinas que impida su utilización. Ejemplos de estabilizadores incluyen los conservantes que impidan la proliferación en la formulación de bacterias, virus y hongos, antioxidantes u otros compuestos que funcionan de diversas maneras para conservar la estabilidad de la formulación. Un “tampón”, tal y como se utiliza en el presente documento, es cualquier tampón adecuado que sea un GRAS y que confiera, generalmente, un pH de aproximadamente 4,8 a 8, preferiblemente de aproximadamente 7 a 7,5, más preferiblemente de aproximadamente 7,2, cuando los polipéptidos son IGF-I e insulina. Los ejemplos incluyen un tampón salino de ácido acético, que es cualquier sal de ácido acético, incluyendo el acetato de sodio y el acetato de 7 ES 2 208 305 T3 potasio, tampón succinato, tampón fosfato, tampón citrato, tampón histidina o cualquier otro conocido en la técnica que tiene el efecto deseado. El tampón más preferido es la histidina a un pH de aproximadamente 7 a 7,5. B. Modos de llevar a cabo la invención 5 10 15 20 25 30 35 Generalmente, las formulaciones se preparan mezclando los polipéptidos de carga opuesta, cada uno con el grado de pureza deseado, de manera uniforme e íntima con el otro y con uno o más de los siguientes excipientes: arginina, lisina, glutamato, o dodecilsulfato de sodio o con una combinación de los dos excipientes beta-hidroxi ciclodextrina y arginina. Opcionalmente, la composición puede contener, también, para la administración parenteral, un vehículo farmacéuticamente o parenteralmente aceptable, es decir, uno que no sea tóxico para los excipientes en las dosis y concentraciones utilizadas y que sea compatible con los otros ingredientes de la formulación. Por ejemplo, la formulación no incluye, preferiblemente, agentes de oxidación y otros compuestos que son conocidos por deteriorar los polipéptidos. Preferiblemente, el vehículo es un vehículo parenteral, más preferiblemente una disolución que es isotónica para la sangre del receptor. Ejemplos de tales vehículos incluyen agua, disolución salina o tamponada como la disolución salina tamponada con fosfato (PBS), disolución de Ringer y disolución de dextrosa. Más preferiblemente el vehículo es el PBS. Los excipientes preferidos dependen de la relación molar de los dos polipéptidos en la composición, la presencia, tipos y cantidades de otros ingredientes, etc. Por ejemplo, si los polipéptidos son IGF-I e insulina, el excipiente preferido es la arginina en una concentración de 100-200 mM, más preferiblemente de aproximadamente 160 mM para una relación vol/vol 1:1 de IGF-I e insulina. Además, si la insulina es insulina NPH, no puede tener la betaciclodextrina sulfobutiléter como excipiente, sólo o en combinación con arginina, ya que causa la resolubilización de la insulina en la parte de NPH, disociándose, de esta manera, el complejo NPH-insulina. La composición también contiene, preferiblemente, un tampón que lleva a un pH de aproximadamente 7-7,5, como la histidina, si los polipéptidos son insulina y IGF-I. La concentración del excipiente utilizado también depende del tipo I y de la relación de los polipéptidos. Por ejemplo, si el excipiente es arginina y los polipéptidos son insulina Regular e IGF-I, a una concentración de insulina de 3,8 mg/mL y la concentración de IGF-I de 10 mg/mL, la relación máxima de insulina con IGF-I es de 0,85:1 si la concentración de arginina es de 150 mM. Sin embargo, cuando se incrementa la concentración de arginina, la relación de insulina regular respecto IGF-I se incrementa, de tal manera que con arginina 230 mM, la relación máxima es 2,5:1. Cuando se utiliza como excipiente la lisina o el glutamato a 280 mM, la relación máxima es 1:1. Además, la relación de mezcla puede ser de 1:1 a 6:1 cuando se utiliza SDS al 0,5%. La mezcla se puede realizar con una relación inferior a 1,4:1 cuando se utiliza beta-hidroxi ciclodextrina al 5% y arginina 150 mM, inferior a 6:1 cuando se utilizan betahidroxi ciclodextrina al 5% y arginina 230 mM, menos de 0,25:1 si se utiliza beta-ciclodextrina sulfobutiléter a un 1%, menos de 1,2:1 si se utilizan un 1% de beta-ciclodextrina sulfobutiléter y arginina 150 mM, y menos de 10:1 si se utilizan un 5% de beta-ciclodextrina sulfobutiléter y arginina 230 mM o un 2,5% de dicho éter con arginina 230 mM o se utiliza un 2% de dicho éter con arginina 150 mM. 40 45 50 55 60 65 La relación volumen: volumen de los polipéptidos depende, principalmente, de la concentración de los polipéptidos, del(los) tipo(s) de excipiente(s) y de la(s) concentración(es) de excipiente(s). Para la insulina NPH, la relación de insulina:IGF-I está generalmente en el rango de aproximadamente 1:15 a 15:1 vol/vol., preferiblemente aproximadamente 1:1 a 15:1. Para la insulina Regular, la relación varía generalmente en el rango de aproximadamente 1:1 a 6:1, preferiblemente aproximadamente 1:1 a 1:6. Para la insulina 70/30, el rango de relación preferida es de aproximadamente 1:1 a aproximadamente 6:1. Los polipéptidos se formulan, típicamente, en dichos vehículos a un pH de aproximadamente 4,5 a 8, dependiendo, principalmente, del pI de los polipéptidos, preferiblemente en presencia de un tampón que mantenga el nivel del pH. Si los polipéptidos son el IGF-I y la insulina, el IGF-I se formula, preferiblemente, a aproximadamente un pH de 7 a 7,5, más preferiblemente aproximadamente 7,2, utilizando histidina como tampón, antes de mezclar con la insulina. La preparación final es un líquido estable. En una realización para el tratamiento de la diabetes, la composición comprende IGF-I e insulina NPH en una relación en volumen de insulina:IGF-I de aproximadamente 15:1 a 1:15 (v/v). Las cantidades más preferidas de IGFI e insulina en esta composición son de aproximadamente 1 a 10 mg de IGF-I y de aproximadamente 0,2 a 2 mg de insulina. La relación preferida en volumen de insulina:IGF-I es de aproximadamente 0,2:1 a aproximadamente 1:1. La composición del presente documento también puede contener un estabilizador. Por ejemplo, las sales de amonio cuaternarias son estabilizadores útiles en las que la estructura molecular incluye un átomo de nitrógeno central unido a cuatro grupos orgánicos (normalmente alquilo o arilo) y un radical ácido cargado negativamente. Estas sales son útiles como germicidas de superficie activos para muchos hongos y bacterias no esporulantes patogénicas y como estabilizadores. Ejemplos incluyen el cloruro de octadecildimetilbencilamonio, cloruro de hexametonio, cloruro de benzalconio (una mezcla de cloruros de alquilbencildimetilamonio en los que los grupos alquilo son compuestos de cadena larga) y cloruro de bencetonio. Otros tipos de estabilizadores incluyen los alcoholes aromáticos como el fenol y el alcohol bencílico, alquil parabenos como el metil o propil paraben y el m-cresol. El estabilizador preferido aquí es el fenol o el alcohol bencílico y el más preferido es el fenol. 8 ES 2 208 305 T3 El estabilizador está incluido en una forma de líquido estable de la formulación de insulina e IGF-I, pero no en una forma liofilizada de la formulación. En el último caso, el estabilizador está presente en el agua bacteriostática para inyección (BWFI) utilizada para la reconstitución. 5 10 15 Una composición preferida que contiene IGF-I y una insulina contiene por lo menos arginina así como un tampón que lleve a aproximadamente un pH de 7 a 7,5, más preferiblemente histidina, y un fenol, opcionalmente con PBS. Más preferiblemente, la arginina está presente en una concentración de aproximadamente 100 a 300 mM y la relación de insulina:IGF-I es de aproximadamente 0,1:1 a 10:1, más preferiblemente de aproximadamente 0,2:1 a aproximadamente 1:1. En otra realización preferida, esta formulación con 100 a 300 mM de arginina, así como el tampón como la histidina y un fenol también contiene beta-ciclodextrina sulfobutiléter como excipiente en una concentración de aproximadamente 1-10%. Una composición más preferida de este tipo comprende aproximadamente 5-20 mg/mL de IGF-I, aproximadamente 2-10 mg/mL de insulina, aproximadamente 100-200 mM de arginina, aproximadamente de 5-20 mM de histidina a un pH de aproximadamente 7-7,5 y aproximadamente de 1-5 mg/mL de fenol. La composición más preferida comprende aproximadamente 10 mg/mL de IGF-I, aproximadamente 3-4 mg/mL de insulina, arginina aproximadamente 160 mM, histidina aproximadamente 10 mM y fenol aproximadamente 3 mg/mL, a un pH alrededor de 7,2. Otra composición preferida que contiene IGF-I y una insulina contiene dodecilsulfato de sodio como excipiente en una concentración de aproximadamente 1-10% y tiene una relación de insulina:IGF-I de aproximadamente 1:1 a 6:1. 20 La formulación final, si es un líquido, se almacena preferiblemente a una temperatura de aproximadamente 2 a 8ºC durante un periodo de tiempo adecuado. De manera alternativa, la formulación se puede liofilizar y ser proporcionada como un polvo para la reconstitución con agua para la inyección que se almacena según se ha descrito para la formulación líquida. 25 30 35 40 45 50 55 60 Los polipéptidos a ser utilizados para la administración terapéutica deben ser estériles. La esterilidad se cumple fácilmente mediante filtración a través de membranas de filtración estériles (p.e. membranas de 0,2 micras). Las composiciones terapéuticas se colocan, generalmente, en un recipiente que tiene una entrada de acceso estéril, por ejemplo, una bolsa o vial de solución intravenosa que tiene un tapón que puede ser agujereado por una aguja de inyección hipodérmica. La composición de polipéptidos se almacenará, de manera ordinaria, en recipientes de una unidad o multidosis, por ejemplo, ampollas o viales sellados, como una disolución acuosa o como una formulación liofilizada para la reconstitución. Como ejemplo de una formulación liofilizada, viales de 10 mL se llenan con 5 mL de una disolución acuosa de IGF-I al 1% (p/v) estéril filtrada y la mezcla resultante se liofiliza. La disolución de inyección subcutánea se prepara mediante la reconstitución de la insulina liofilizada utilizando un agua bacteriostática para inyección. La disolución se mezcla, a continuación, con una disolución de insulina reconstituida, de manera similar, o una disolución de insulina líquida. La formulación que contiene tanto la IGF-I como la insulina se pueden preparar mediante muchos procedimientos diferentes. Un procedimiento comprende mezclar la insulina con una composición que contiene IGF-I (teniendo los ingredientes según se describe más abajo). La disolución que contiene la IGF-I útil para la administración con la disolución de insulina según se ha descrito más arriba, contiene, preferiblemente, arginina, más preferiblemente contiene arginina y un estabilizador y todavía más preferiblemente contiene arginina, un estabilizador y un tampón, y más preferiblemente es como sigue: unos 5-20 mg/mL de IGF-I; arginina aproximadamente 100-200 mM, un tampón aproximadamente 5-20 mM a un pH de un 77,5 y unos 1-5 mg/mL de fenol. La composición más preferida para este propósito comprende alrededor de 10 mg/mL de IGF-I, arginina aproximadamente 160 mM, histidina aproximadamente 10 mM, a un pH de alrededor de 7,2 y unos 3 mg/mL de fenol. Los equipos (“kits”) también se contemplan en esta invención. Un equipo típico comprendería un recipiente, preferiblemente un vial, para un primer polipéptido como la IGF-I en un excipiente, según se ha descrito más arriba; un recipiente, preferiblemente un vial, que comprenda un segundo polipéptido de carga opuesta, e instrucciones, como una introducción o etiqueta del producto que dirija al usuario a combinar los contenidos de los dos recipientes. preferiblemente, si los polipéptidos son insulina e IGF-I, la formulación farmacéutica será para tratar la diabetes. También, preferiblemente, el recipiente con IGF-I comprende, de manera adicional, un estabilizador como alcohol bencílico o fenol, o ambos, en el tampón a un pH de aproximadamente 7 a 7,5. Preferiblemente, el usuario será instruido para combinar los contenidos de los recipientes, es decir, las dos formulaciones, en una jeringa para la inyección inmediata. Otro equipo típico es uno en el que la composición está ya preparada de tal manera que está contenida en un recipiente y el equipo también tiene instrucciones para utilizar la composición en el tratamiento de una alteración determinada. 65 La composición de la presente invención está dirigida a ser administrada al mamífero mediante cualquier técnica adecuada, incluyendo la infusión, inyección y administración pulmonar o transdérmica. La ruta específica de administración dependerá, por ejemplo, del historial médico del paciente, incluyendo cualquier efecto secundario percibido 9 ES 2 208 305 T3 o anticipado utilizando cualquiera de los polipéptidos solos y la alteración determinada a ser corregida. Ejemplos de administración parenteral incluyen la administración de la composición subcutánea, intramuscular, intravenosa, intraarterial e intraperitoneal. 5 Un procedimiento preferido de liberación de fármacos que actúan de manera sistémica implica la administración mediante infusión continua (utilizando, p.e., dispositivos de liberación lenta o minibombas como las bombas osmóticas o parches adhesivos) o mediante inyección (utilizando, pe. medios intravenosos o subcutáneos, incluyendo la administración de bolo sencilla). Por ejemplo, si los polipéptidos son insulina IGF-I, será la forma preferida de administración para tratar la diabetes la liberación de la composición mediante inyección. 10 15 20 25 30 Otra ruta de administración preferida es la liberación transdérmica iontofotérica ya sea para terapia localizada o sistémica. La iontoforesis es un medio de potenciación del flujo de fármacos iónicos a través de la piel mediante la aplicación de un gradiente de potencial electroquímico. Los fármacos adecuados para ese procedimiento de liberación incluyen análogos de LHRH, insulina, hormona de crecimiento y análogos de la colecistokinin-8. Véase, por ejemplo, Srinivasan, et al., J. Pharm. Sci., 79: 588-591 (1990). La composición a ser utilizada en la terapia será formulada dosificada de una manera coherente con la práctica médica apropiada, teniendo en cuenta la condición clínica del paciente individual (especialmente los efectos secundarios del tratamiento con polipéptidos como agentes únicos), el lugar de liberación de la composición, el procedimiento de administración, el programa de administración y otros factores conocidos para los practicantes. Las “cantidades efectivas” de cada componente para los propósitos del presente documento se determinan, de esta manera, mediante dichas consideraciones deben ser cantidades que resulten en una biodisponibilidad de los fármacos en el mamífero. Como proposición general, la cantidad total farmacéuticamente efectiva de los polipéptidos a ser administrados de manera parenteral por dosis estará en el rango de aproximadamente 10 µg/kg/día a aproximadamente 1 mg/kg/día basado en Kg de peso corporal del paciente. Para la combinación de IGF-I e insulina, la cantidad parenteral por dosis está en el rango de aproximadamente 10 a 200 µg/kg/día de IGF-I basado en kg de peso corporal del paciente y de aproximadamente 0,5 a 500 unidades/día de insulina, aunque, como se ha indicado más arriba, esto estará muy sujeto a discreción terapéutica. Preferiblemente, para el tratamiento de la diabetes en humanos, la dosis de IGF-I es de aproximadamente 1 a 10 mg dos ves al día, más preferiblemente de aproximadamente 20 a 80 µg/kg/inyección (es decir, de aproximadamente 1,5 a 6 mg) dos veces al día de manera subcutánea y la dosis de insulina es de aproximadamente 5 a 50 unidades/inyección (es decir, de aproximadamente 0,2 a 2 mg) dos veces al día de manera subcutánea. La relación, en volumen, de insulina con IGF-I en esta formulación es la referida más arriba. 35 40 Aunque sea preferida la inyección, también se puede utilizar para las infusiones SC continuas un dispositivo de infusión. También se puede utilizar una disolución en bolsa intravenosa. El factor clave en la selección de una dosis apropiada es el resultado obtenido, por ejemplo, en el caso de la diabetes cuando se mida por los descensos de glucosa en sangre con el fin de aproximarse al rango normal o por otros criterios de medición del tratamiento de la diabetes según se define aquí puesto que se estiman apropiados para el practicante. Información adicional sobre la dosificación de insulina se puede encontrar en Diabetes Mellitus - Theory and Practice, supra, Capítulos 29 y 30. 50 También, la formulación del presente documento se administra de manera adecuada junto con otros agentes que producen el efecto farmacológico deseado, por ejemplo, en el caso del IGF-I y la insulina, una proteína de unión de IGF, por ejemplo una de las actualmente conocidas, es decir, IGFBP-1, IGFBP-2, IGFBP-3, IGFBP-4, IGFBP-5 o IGFBP-6 o con la ALS del complejo de unión a IGF. La proteína de unión preferida para la IGF-I en el presente documento es la IGFBP-3, que está descrita en la patente US nº 5.258.287 y por Martin y Baxer, J. Biol. Chem., 261:8754-8760 (1986). Esa proteína IGFBP-3 glicosilada es un componente ácido estable de unos 53 KDa en un gel SDS-PGE no reductor de un complejo de glicoproteína de 125-150 KDa encontrado en plasma humano que lleva la mayoría de las IGF endógenas y también está regulada por la GH. 55 La administración de la proteína de unión de IGF con el IGF-I y la insulina se puede llevar a cabo mediante el procedimiento descrito en la patente US Nº 5.187.151. Brevemente, el IGF-I y la IGFBP se administran en cantidades efectivas mediante inyección de bolo subcutánea en una relación molar de aproximadamente 0,5:1 a 3:1, preferiblemente de aproximadamente 1:1; la insulina ya está presente con la IGF-I. 45 60 65 Además, la formulación se administra de manera adecuada junto con una cantidad efectiva de un agente hipoglicémico como una sulfonilurea. El agente hipoglicémico se administra al mamífero mediante cualquier técnica apropiada incluyendo la vía parenteral, intranasal, oral o cualquier otra ruta efectiva. Más preferiblemente, la administración es por la ruta oral. Por ejemplo, los comprimidos MICRONASE™ (gliburido) puestos en el mercado por UpJohn en concentraciones de comprimido de 1,25; 2,5 y 5 mg son adecuados para la administración oral. La dosis de mantenimiento normal para los diabéticos de Tipo II, sometidos a terapia, está, generalmente, en el rango de aproximadamente unos 1,25 a 20 mg por día, los cuales se pueden dar como una dosis única o dividida a lo largo del día según se considere apropiado (Physician’s Desk Reference, 2563-2565 (1995)). Otros ejemplos de comprimidos basados en gliburido disponibles para la prescripción incluyen el fármaco de marca GYNASE™ (UpJohn) y el fármaco de marca DIABETA™ (Hoechst-Roussel). GLUCOTRO™ (Pratt) es la marca del comprimido de glipizida (1-ciclohexil-3-(p2-(5-metilpirazina carboxamida)etil)fenil)sulfonilurea) disponible en cantidades de 5 y 10 mg y también se prescribe a los diabéticos de Tipo II que requieran terapia hipoglicémica siguiendo un control de la dieta o en pacientes que 10 ES 2 208 305 T3 han dejado de responder a otras sulfonilureas (Physician’s Desk Reference, 1902-1903 (1995)). Se pueden utilizar otros agentes hipoglicémicos diferentes de las sulfonilureas, como las biguanidas (p.e. metformina y fenformina) o troglitozonas, u otros fármacos que afectan la acción de la insulina. 5 La invención será entendida más completamente mediante referencia a los siguientes ejemplos. Esos, sin embargo, no deberían de constituir una limitación del ámbito de la invención. Ejemplo 1 10 Materiales y procedimientos 15 Se obtuvo de Genentech, Inc. el IGF-I recombinante humana. La insulina Regular (HUMULINTM R) y la insulina 70/30 (HUMULINTM 70/30) se obtuvieron de Eli Lilly and Company. Las jeringas de insulina de 0,5 cc y de 1 cc se obtuvieron de Becton Dickinson y las columnas PD10 (SEPHADEXTM G25M) se obtuvieron de Pharmacia (catálogo #17-0851-01) La tabla 1 es una lista de las formas de dosificación de la formulación para insulina Regular, NPH y 70/30. TABLA 1 20 Formas de dosificación de la formulación de insulina HUMULINTM R (insulina regular neutra) 25 30 HUMULINTM NPH (neutral protamine Hegedorn) 35 40 HUMULINTM 70/30 (70% NPH, 30% insulina regular) 45 Zinc-insulina, 100 unidades USP, 3,8 mg/mL 10µg-40µg de zinc/100 USP unidades 2,5 mg/mL m-cresol 16 mg/mL glicerina pH 7,2 100 USP unidades/ml, 3,8 mg/mL 3-6 mg protamina 16 mg/mL glicerina 1,6 mg/mL m-cresol 10-40 µg zinc/100 USP 0,65 mg/mL fenol fosfato, pH 7,2 100 unidades USP/mL, 3,8 mg/mL aproximadamente 2,5 mg protamina fosfato, pH 7,2 m-cresol zinc fenol Preparación del IGF-I para la preparación de la formulación 50 Se utilizó como material de partida el IGF-I en citrato 0,2 M, 26 mg/mL. El citrato fue difícil de eliminar de las disoluciones de IGF-I. Por lo tanto, se diseñó un procedimiento de diafiltración de dos etapas para extraer el citrato y, al mismo tiempo, aumentar la concentración de IGF-I. Se llevó a cabo la diafiltración utilizando una unidad de filtración de flujo tangencial. Las etapas del procedimiento fueron como siguen. 55 (a) la disolución de IGF-I que contenía citrato 200 mM se diafiltró primero en NaCl 200 mM, arginina 230 mM y histidina 10 mM a un pH de 7,2; 60 65 (b) la disolución de IGF-I se diafiltró, a continuación, en arginina 230 mM, histidina 10 mM, pH 7,2. La IGF-I se concentró a 28,6 mg/mL. Se utilizó arginina en ambas etapas debido a su capacidad para mantener el IGF-I en disolución a concentraciones elevadas a un pH de 7,2. De esta manera, la extracción del citrato y la concentración del IGF-I se pudo llevar a cabo sin la precipitación del IGF-I. A la disolución de IGF-I anterior se le cambió el tampón en varias formulaciones de ensayo utilizando columnas PD-10TM . 11 ES 2 208 305 T3 Procedimientos de Ensayo (1) Inspección visual; apariencia y claridad; 5 (2) PH; (3) Concentración de IGF-I; determinada por absorbancia de UV a 276 nm utilizando una absortividad de 0,646 cm−1 (mg/ml)−1 , 10 (4) Turbidez de la disolución; determinada por absorbancia de UV de 340 a 360 nm; (5) Cuantificación de la IGF-I e insulina en disolución; determinada mediante el método de HPLC en fase reversa a pH ácido (rp-HPLC): 15 20 25 Columna Velocidad flujo Volumen de inyección Longitud de onda de detección Temperatura Disolvente A Disolvente B Gradiente 30 VYDACTM , C18, 300 Å, 25 cm 0,5 mL/minuto 25 µl/inyección 214 nm 50ºC 0,1% ácido trifluoroacético en H2 O 0,1% ácido trifluoroacético en acetonitrilo tiempo %A 0 72 20 72 25 70,5 40 61,5 50 40 51 72 60 72 35 La Figura 1 muestra la HPLC de fase reversa a pH ácido de una muestra de IGF-I. La Figura 2 muestra la HPLC de fase reversa acídica de la insulina Regular. La Figura 3 muestra la HPLC de fase reversa acídica de una mezcla 1:1 (vol:vol) de insulina Regular:IGF-I. 40 45 Es evidente de la comparación y revisión de estas Figuras que la IGF-I y la insulina Regular se separan bien mediante este procedimiento de HPLC. La cuantificación tanto del IGF-I como de la insulina se puede conseguir utilizando las áreas de los picos de los picos del IGF-I y de la insulina. Por ejemplo, el porcentaje de IGF-I restante en disolución se puede obtener comparando las áreas de los picos del IGF-I antes y después de que la IGF-I se mezcle con la insulina. Procedimiento para mezclar la IGF-I y la insulina 50 (1) Extaer aire en una jeringa de insulina igual a la dosis de IGF-I. Insertar la aguja en el vial de IGF-I e inyectar el aire en la botella. Extraer la aguja/jeringa del vial de IGF-I sin retirar la disolución de IGF-I. (2) Para insulina NPH y 70/30, invertir suavemente el vial de insulina varias veces antes de su uso. Se requiere que no mezcle para la insulina Regular. Inyectar aire en el vial de insulina. 55 (3) Con la aguja todavía en el vial de insulina, girar la botella de insulina y la jeringa del revés; (4) Asegurarse de que la punta de la aguja está en la disolución y retirar el volumen correcto de insulina en la jeringa; 60 65 (5) Antes de extraer la aguja del vial de insulina, comprobar la presencia de burbujas de aire en la jeringa. Si hay burbujas de aire, mantener la jeringa recta para arriba y dar golpecitos a su lado, hasta que las burbujas floten en la parte superior. Empujarlas a fuera con el émbolo y extraer la dosis de insulina correcta; (6) Extraer la jeringa del vial de insulina e insertarla en el vial de IGF-I. Girar la botella de IGF-I y la jeringa al revés. Asegurarse de que la punta de la aguja está en la disolución y extraer la cantidad deseada de IGF-I en la jeringa. (7) Extraer la aguja/jeringa del vial de IGF-I e inyectar la mezcla insulina/IGF-I en un tubo de centrífuga de vidrio transparente. 12 ES 2 208 305 T3 Procedimientos de Análisis para la mezcla insulina/IGF-I 5 La mezcla de IGF-I/insulina se ensayó para el contenido de IGF-I e insulina soluble ya sea después de la filtración a través de un filtro de 0,2 µm o después de la centrifugación a 2000 r.p.m. durante 10 minutos. En algunos casos, la mezcla de IGF-I e insulina se incubó primero con una disolución salina tamponada con fosfato a 37ºC durante 10 minutos antes de que la mezcla se filtre o centrifugue para el análisis. Resultados y discusión 10 15 20 Capacidad de mezcla de la formulación tamponada con acetato con insulina La formulación de IGF-I tamponada con acetato utilizada como estándar en el presente ejemplo es un líquido transparente y contiene 10 mg/mL de IGF-I, cloruro de sodio 100 mM, polisorbato 2 mg/mL, alcohol bencílico 20,9 mg/mL, acetato 50 mM, pH 5,4. Ese producto está pensado para propósitos multiuso para una utilización de hasta 28 días. La vida de duración se fijó en 60 meses a 2-8ºC de almacenamiento. Se evaluó, primero, La capacidad de mezcla de la formulación de IGF-I tamponada con acetato con la insulina. Sería más deseable si la formulación de IGF-I se pudiera utilizar con insulina durante la administración. La Tabla 2 muestra los resultados de mezclar la formulación de IGF-I tamponada con acetato con insulina Regular. A una relación de mezcla 1:1 (vol:vol), la disolución se vuelve muy oscura al mezclar. El 43% de la insulina y el 14% de IGF-I precipitaba en la disolución. TABLA 2 25 IGF-I en la formulación de acetato mezclada con insulina Regular Relación mezcla (Insulina Regular:IGF-I) (vol:vol) %IGF-I en solución % Insulina en solución 1:1 86% 57% 30 35 40 45 50 La apariencia de la insulina Regular y del IGF-I en la formulación de acetato se siguió en función del pH de estas disoluciones que se ajustó mediante adición de HCl o NaOH 0,1 N. La disolución se caracterizó como “transparente” o “turbia” y se representó en la Figura 4 la claridad de la disolución vs el pH. La insulina Regular a pH 7,2 es una disolución transparente y permanece transparente a un pH por encima de 6,4; la disolución de insulina Regular se vuelve oscura a pH 6,32 o inferior. La IGF-I en una formulación de acetato a pH 5,4 es una disolución transparente y permanece transparente a pH por debajo de 6,34. La disolución de IGF-I se vuelve oscura a un pH por encima de 6,39, y la subsiguiente precipitación de la IGF-I se vuelve en un gel transparente. Estas observaciones son coherentes con los conocimientos generales de que la solubilidad de una proteína disminuye cuando el pH se aproxima al punto isoeléctrico de la proteína (pI). Los puntos isoeléctricos del IGF-I y de la insulina son 8,7 y 5,4 respectivamente. Los datos mostrados en la Figura 4 sugieren que no existe un rango de pH adecuado en el cual tanto el IGF-I como la insulina Regular puedan estar en disolución. Por lo tanto, no es posible ajustar, simplemente, el pH de la formulación de IGF-I para producir una mezcla transparente de IGF-I/insulina. La Tabla 3 muestra el resultado de mezclar la formulación de IGF-I en acetato con insulina NPH en varias relaciones de mezcla. En las relaciones de mezcla de insulina NPH : IGF-I de 1:1 a 14:1 (vol:vol), tanto la insulina NPH como la IGF-I estaban inalteradas antes y después de la mezcla. Toda la IGF-I permanece en disolución y toda la insulina NPH permanecía como cristales de NPH con insulina no soluble en disolución. Sin embargo, cuando se mezcló NPH e IGF-I en una relación (vol:vol) 1:14, el 100% de la insulina se liberó de los cristales de NPH, aunque el IGF-I quedó inalterado. TABLA 3 55 IGF-I en la formulación de acetato mezclada con insulina NPH 60 Relación mezcla (Insulina NPH :IGF-I) (vol:vol) %IGF-I en solución % Insulina en solución 14:1 93% 0,64% 1:1 93% 0,8% 1:14 93% 100% 65 13 ES 2 208 305 T3 Desarrollo de la nueva formulación mezclable con insulina 5 10 Debido a la incapacidad de la formulación de IGF-I en acetato para mezclarse con insulina, se desarrolló una nueva formulación que sigue los siguientes criterios: (1) una disolución de IGF-I transparente formulada a un pH de 7,2. Esto sirve para prevenir los desplazamientos bruscos de pH cuando se mezclen la insulina y el IGF-I en rangos amplios de relaciones de mezcla. (2) Una formulación de IGF-I que prevenga la interacción entre insulina e IGF-I en la mezcla, evitando la precipitación de la insulina y/o dell IGF-I. (3) Una formulación de IGF-I que no se disociará la insulina de los cristales de NPH en la mezcla. Durante el desarrollo de dicha formulación de IGF-I, se probaron diversos excipientes como sales, tampones, iones metálicos, azúcares, aminoácidos, polioles, tensioactivos y ciclodextrinas, según se muestra en la Tabla 4. TABLA 4 15 20 Excipientes ensayados para el desarrollo de una formulación de IGF-I para mezclar con insulina Excipiente Concentración Excipiente Excipiente Concentración Excipiente Cloruro sódico 200 mM Glicina 140 mM–280 mM Sulfato sódico 200 mM Lisina 140 mM–280 mM Fosfato sódico 250 mM Histidina 140 mM–280 mM Citrato sódico 125-500 mM Glutamato 140 mM–280 mM Bicarbonato sódico 250 mM Arginina 140 mM–280 mM Ascorbato sódico 250-500 mM Aspartato 140 mM Succinato sódico 125-250 mM Hidrocloruro de guanidina 140 mM Alginato sódico 1% TWEEN 20(TM) 0,5%-2% Heparina sulfato 0,25% TWEEN 80(TM) 0,5% Cloruro de calcio 50-300 mM Triton X-100 0,5% Cloruro de magnesio 50-300 mM PLURONIC F-68-LF (TM) 0,5% EDTA 40 Mm Dodecilsulfato de sodio 0,05%-0,5% Glicerol 200 mM PEG 6000 5% Sacarosa 300 mM β-hidroxi Ciclodextrina 1%-17% Trehalosa 300 mM β-ciclodextrina sulfobutiléter 1%-30% Manitol 300 mM 25 30 35 40 45 50 55 60 65 El control de la formulación de IGF-I tamponada con acetato se volvió oscura cuando el pH se ajustó por encima de 6,4. Muchos de los excipientes de la lista en la Tabla 4 eran capaces de dar una disolución de IGF-I clara a un pH de 7,2. Estos excipientes incluían aminoácidos (glicina, lisina, arginina, histidina, glutamato, aspartato), sales (cloruro, fosfato, citrato, bicarbonato, ascorbato y succinato de sodio), derivados de ciclodextrina (β-hidroxi ciclodextrina y 14 ES 2 208 305 T3 β-ciclodextrina sulfobutiléter), SDS y glicerol. Sin embargo, en la mezcla de la IGF-I y la insulina Regular, la mayoría de los excipientes anteriores no fueron capaces de prevenir la precipitación de la insulina y la IGF-I. 5 10 Los excipientes que probaron ser efectivos en la prevención de la precipitación de la insulina Regular y el IGFI en la mezcla fueron arginina, lisina, glutamato, SDS, β-hidroxi ciclodextrina y β-ciclodextrina sulfobutiléter. Los resultados de mezcla utilizando estos excipientes se muestran en la Tabla 5. El SDS al 0,5% fue muy efectivo en conseguir una mezcla de insulina e IGF-I transparente. Sin embargo, cuando se añadió SDS al 0,5% a una relación de insulina NPH de un 1:1 (vol:vol), la disolución se clarificó, lo cual indicaba la disolución de los cristales de NPH. Cuando se utilizaron tanto la lisina como el glutamato a una concentración de 280 mM se previno la precipitación en una mezcla de IGF-I e insulina Regular 1:1 (vol:vol) TABLA 5 Efectos del excipiente en la apariencia de la mezcla de IGF-I/Insulina Regular (a) 15 20 25 30 35 40 45 50 55 60 65 (a) En suma a los excipientes de la Tabla, todas las formulaciones de IGF-I contienen 10 mg/mL de IGF-I e histidina 10 mM a un pH de 7,2. (b) La insulina Regular se añadió lentamente a 200 mL de IGF-I 10 mg/mL en arginina 150 mM, histidina 10 mM a un pH de 7,2. La disolución permaneció transparente hasta que se añadieron 170 mL de insulina Regular. La relación de mezcla 170 mL: 200 mL = 0,85: 1. (c) La mezcla se realizó de manera similar a la descrita en (b). (d) En estas condiciones, la insulina Regular se añadió lentamente a 200 mL de IGF-I. La disolución mezclada permaneció clara después incluso de que se añadieran 2 mL de insulina Regular. 15 ES 2 208 305 T3 5 10 15 20 25 30 35 40 La arginina fue más efectiva que la lisina o el glutamato a la hora de mantener tanto la insulina como el IGF-I en disolución. Según se muestra en la Tabla 5, a una concentración de arginina de 150 mM, la insulina Regular y el IGFI se pudieron mezclar en relaciones de mezcla de hasta 0,85:1 (vol:vol). Cuando las relaciones de mezcla excedían 0,85:1, tiene lugar la precipitación tanto del IGF-I como de la insulina. A una concentración de arginina de 230 mM, se podía mezclar más insulina Regular con IGF-I para formar una mezcla transparente, hasta una relación de mezcla de 2,5:1 (vol:vol). Sin que se limite a cualquier teoría, la protección contra la precipitación ofrecida por la arginina se cree que es debido al hecho de que a pH 7,2 las moléculas de insulina están cargadas de manera negativa y las moléculas de arginina cargadas de manera positiva interactúan con la insulina cargada negativamente, protegiendo, de esta manera, la interacción y la posterior precipitación entre la IGF-I cargada positivamente y la insulina cargada negativamente. Se requieren concentraciones elevadas de arginina para mezclar a una relación elevada de insulina:IGF-I. Como se muestra en la Tabla 5, el β-ciclodextrin sulfobutiléter al 1% permite mezclar insulina Regular e IGF-I en una relación de mezcla por debajo de 0,25:1. La utilización de la b-hidroxi ciclodextrina no permitía la mezcla a ninguna relación. La utilización tanto de la ciclodextrina como de la arginina es extremadamente efectiva en la prevención de la precipitación de la insulina y el IGF-I una vez mezcladas, el β-ciclodextrin sulfobutiléter utilizado a una concentración del 2% al 5% junto con la arginina, utilizada a una concentración de 150 mM a 230 mM permitían que se mezclaran la insulina Regular y el IGF-I en una rango amplio de relaciones de mezcla, hasta 10:1 (vol. de insulina:vol. de IGF-I). Sin que se limite a cualquier teoría, se cree que esto se debe al hecho de que a pH 7,2 la arginina cargada positivamente interacciona con la insulina cargada negativamente y el β-ciclodextrin sulfobutiléter cargado negativamente interacciona con el IGF-I cargado positivamente, previniendo, de esta manera, la interacción entre la insulina y el IGF-I y la consiguiente precipitación. Sin embargo, en presencia de β-ciclodextrin sulfobutiléter, se disolvían los cristales de insulina NPH. Sin limitar a cualquier teoría, esto se debe, presumiblemente, a la fuerte interacción del βciclodextrin sulfobutiléter con la protamina cargada positivamente, la cual rompe el complejo protamina-insulina. Por tanto, aunque la utilización tanto del β-ciclodextrin sulfobutiléter y/o SDS como de la arginina en la formulación del IGF-I, demuestra que siendo extremadamente efectiva en la mezcla de la insulina Regular, no se puede utilizar para mezclarla con la insulina NPH. Los resultados del estudio de cribado de excipientes anterior identificaron a la arginina como la elección preferida de excipiente para una formulación de IGF-I a ser mezclada con tanto la insulina Regular como con la insulina NPH. A continuación, se llevó a cabo un estudio para evaluar el efecto de la concentración de arginina en la capacidad de la IGF-I para mezclarse con la insulina. La formulación de IGF-I ensayada en este estudio contenía IGF-I 10 mg/mL, histidina 10 mM, pH 7,2 y fenol 3 mg/mL y cantidades variadas de arginina. La insulina y el IGF-I se mezclaron a varias relaciones de mezcla. Se determinó el porcentaje de IGF-I e insulina soluble mediante el procedimiento de HPLC de fase reversa. Los resultados de la Tabla 6 mostraban que para mezclarse con insulina Regular, se requiere una concentración elevada de arginina. A una concentración de arginina 80 mM, precipitaba el 39% de IGF-I y el 68% de insulina cuando se mezclaban en una relación 1:1 (vol:vol). A una concentración de arginina 230 mM, permanecía en disolución toda la insulina y todo el IGF-I cuando se mezclaban en una relación 1:1 (vol:vol). Sin embargo, a una concentración de arginina 230 mM, cuando se mezclaban en una relación 5:1 (vol:vol) IGF-I:NPH, cerca del 50% del NPH se disolvía en la insulina soluble. La arginina 160 mM parecía producir los mejores resultados para mezclarse tanto con la insulina Regular como con la insulina NPH. A una relación de mezcla (insulina-R:IGF-I) 1:1, prácticamente toda la insulina Regular y todo el IGF-I quedaban en disolución. A una relación de mezcla 1:1 (insulina NPH:IGF-I), casi el 100% de la insulina NPH estaba en disolución y todos los cristales de NPH quedaban intactos. 45 (Tabla pasa a página siguiente) 50 55 60 65 16 ES 2 208 305 T3 TABLA 6 5 10 15 20 25 30 45 (a) La formulación de IGF-I ensayada en este estudio contenía IGF-I 10 mg/mL, histidina 10 mM, pH 7,2, fenol 3 mg/mL y cantidades variadas de arginina. (b) Para estimular una condición de depósito subcutáneo, después de mezclar la IGF-I y la insulina Regular, se incubó primero 1 mL de la mezcla con 2 mL de una disolución salina tamponada con fosfato a 37ºC durante 15 minutos antes de que se analizaran las cantidades solubles de insulina y IGF-I. (c) Si la IGF-I y la insulina eran capaces de mezclarse totalmente, la mezcla resultante debería tener el 100% de IGF-I soluble y el 100% soluble de insulina. (d) Si la IGF-I y la insulina NPH son capaces de mezclarse totalmente, la mezcla resultante debería de tener el 100% de IGF-I soluble y el 0% de insulina soluble. 50 Una formulación de IGF-I preferida para mezclarse con insulina era, por lo tanto, la definida a ser IGF-I 10 mg/mL, arginina 160 mM, histidina 10 mM a pH 7,2 y fenol 3 mg/mL. Se ensayó la capacidad de mezcla de esta formulación con insulina Regular, NPH e insulina 70/30 a varias relaciones de mezcla y los resultados se tabulan en las Tablas 7, 8 y 9, respectivamente. 35 40 55 60 65 17 ES 2 208 305 T3 TABLA 7 Resultados de la mezcla de la nueva formulación de IGF-I mezclada con insulina Regular (a) 5 Relación mezcla (Insulina Regular :IGF-I) (vol:vol) %IGF-I en disolución (b) (c) % Insulina en disolución (b) (c) 1:2 96% 100% 1:1 95% 99% 2:1 89% 89% 6:1 91% 93% 10 15 20 25 (a) La nueva formulación de IGF-I contenía IGF-I 10 mg/mL, arginina 160 mM, histidina 10 mM a un pH 7,2 y fenol 3 mg/mL. (b) Para simular una condición de depósito subcutáneo, después de mezclar la IGF-I con la insulina Regular, se incubó primero 1 mL de la mezcla con 2 mL de una disolución salina tamponada con fosfato a 37ºC durante 15 minutos antes de que se analizara la cantidad de insulina e IGF-I soluble. (c) Si la IGF-I y la insulina Regular son capaces de mezclarse totalmente, la mezcla resultante debería de tener el 100% de IGF-I soluble y el 100% de insulina soluble. TABLA 8 30 35 40 Resultados de la mezcla para la nueva formulación de IGF-I mezclada con insulina NPH (a) Relación mezcla (Insulina NPH :IGF-I) (vol:vol) %IGF-I en disolución (b) % Insulina en disolución (b) 1:15 100% 24% 1:5 102% 11% 1:1 103% 0,5% 15:1 100% 0,5% 45 (a) La nueva formulación de IGF-I contenía IGF-I 10 mg/mL, arginina 160 mM, histidina 10 mM a un pH 7,2 y fenol 3 mg/mL. (b) Si la IGF-I y la insulina NPH son capaces de mezclarse totalmente, la mezcla resultante debería de tener el 100% de IGF-I soluble y el 0% de insulina soluble. 50 (Tabla pasa a página siguiente) 55 60 65 18 ES 2 208 305 T3 TABLA 9 Resultados de mezcla para la nueva formulación de IGF-I mezclada con insulina 70/30 (a) 5 Relación mezcla (Insulina 70/30 :IGF-I) (vol:vol) %IGF-I en disolución (b) % Insulina en disolución (b) 1:15 100% 58% 1:6 100% 44% 1:1 100% 26% 2:1 100% 21% 6:1 100% 22% 10 15 20 25 30 35 40 45 50 (a) La nueva formulación de IGF-I contenía IGF-I 10 mg/mL, arginina 160 mM, histidina 10 mM a un pH 7,2 y fenol 3 mg/mL. (b) Si la IGF-I y la insulina 70/30 son capaces de mezclarse totalmente, la mezcla resultante debería de tener el 100% de IGF-I soluble y del 22% al 30% de insulina soluble. La insulina 70/30 teóricamente debería de contener un 30% de insulina soluble. Sin embargo, debido a la adsorción de la insulina soluble en la insulina NPH, la cantidad actual de insulina soluble es del 22% por el procedimiento de HPLC de fase reversa. Cuando la formulación de IGF-I preferida se mezclaba con insulina Regular a una relación 1:1 (vol:vol), la disolución se volvía turbia. El 65% del IGF-I y el 93% de la insulina estaban en disolución cuando se ensayaba directamente después de mezclarse. Sin embargo, después de que esta mezcla se incubara en una disolución salina tamponada con fosfato a 37ºC durante 15 minutos para simular una condición de depósito subcutáneo, la disolución se clarificó y el 95% del IGF-I y el 99% de la insulina estaba en disolución. La Tabla 7 muestra los resultados de mezclar la IGF-I y la insulina Regular después de que las mezclas fueran incubadas con una disolución salina tamponada con fosfato a 37ºC durante 15 minutos. Cuando se mezclaban en relaciones 1:1, 2:1, 6:1 (insulina Regular:IGF-I), inicialmente tenía lugar la precipitación. Sin embargo, la mezcla clarificaba en la incubación con la disolución salina tamponada con fosfato, y el porcentaje de IGF-I e insulina soluble fue cercana al 90% o superior. Por lo tanto, los perfiles farmacocinéticos de la IGF-I y la insulina puede no resultar en un cambio mayor antes y después de la mezcla. Cuando la formulación preferida del IGF-I preferida se mezclaba con la insulina NPH en una relación de mezcla de 1:15 a 15:1 (vol:vol), la disolución permanecía turbia, indicando la presencia de insulina NPH intacta. Tal y como muestra la Tabla 8, a relaciones de mezcla entre 1:1 y 15:1 (NPH:IGF-I), toda la IGF-I estaba en disolución y toda la NPH permanecía como complejo insulina-protamina. A bajas relaciones de mezcla NPH:IGF-I, una cantidad suficiente de arginina en la formulación preferida iniciaba a disociar el NPH. La cantidad de disociación de NPH era relativamente baja (24%) incluso al extremo de una relación de mezcla 1:15. Por lo tanto, a la mayor de las relaciones de mezcla, los perfiles farmacocinéticos del IGF-I y de la insulina puede no resultar en un cambio mayor antes y después de mezclar. La Tabla 9 muestra el resultado de mezclar la formulación preferida de IGF-I con insulina 70/30. Teóricamente, la insulina 70/30 debería de contener el 30% de insulina soluble. Sin embargo, la insulina soluble tendía a ser adsorbida en los cristales de insulina NPH. La cantidad actual de insulina soluble en la insulina 70/30 era del 22% por el procedimiento HPLC de fase reversa. Si el IGF-I y la insulina 70/30 eran capaces de mezclarse totalmente, la mezcla resultante debería de tener el 100% de IGF-I soluble y del 22% al 30% de insulina soluble. Los resultados de la Tabla 9 muestran que el porcentaje de IGF-I e insulina soluble no cambiaba cuando se mezclaba 70/30 e IGF-I a unas relaciones de 1:1 a 6:1 (vol:vol). A relaciones de mezcla 70/30:IGF-I bajas, una parte de la NPH se disolvía en la insulina soluble. 55 En todos los estudios anteriores, no se observó como resultado de la mezcla por el procedimiento de HPLC de fase reversa degradación química de la IGF-I o de la insulina. Conclusiones 60 65 Para reducir la frecuencia de las inyecciones y mejorar la complacencia del paciente, es deseable mezclar polipéptidos de cargas opuestas y, a continuación, co-administrarlas. En este Ejemplo, se ensayó primero la compatibilidad del IGF-I en el control de la formulación tamponada con acetato y la insulina. Inmediatamente después de mezclar la insulina Regular con la IGF-I en la formulación de acetato, la mezcla pasó de una disolución transparente a una suspensión turbia, indicando la precipitación de tanto la insulina como del IGF-I. Cuando se mezclaba con insulina NPH, la formulación de IGF-I tamponada con acetato disociaba el complejo insulina NPH-protamina a relaciones de mezcla NPH/insulina bajas. 19 ES 2 208 305 T3 5 10 15 Los estudios de cribado de excipientes se llevaron a cabo para incrementar la compatibilidad entre la IGF-I y la insulina. Se desarrolló una formulación de IGF-I preferida para mezclar con la insulina. Esta contiene IGF-I 10 mg/mL, arginina 160 mM, histidina 10 mM a pH 7,2 y fenol 3 mg/mL. Se ensayó la capacidad de esta formulación de arginina para mezclarse con insulina Regular, NPH y 70/30 a varias relaciones de mezcla. Cuando esta formulación se mezclaba con insulina Regular, el porcentaje de IGF-I e insulina soluble era cercana al 90% o superior para todas las relaciones de mezcla potenciales. La mezcla de esta formulación de IGF-I e insulina NPH a la mayor de las relaciones de mezcla no resultó en un cambio en la IGF-I y la NPH antes y después de mezclarse. A relaciones NPH/IGF-I muy bajas, se disociaron partes del complejo insulina NPH-protamina. Excipientes tales como la arginina, lisina, glutamato, SDS y/o ciertas ciclodextrinas se mostraron ser efectivas en la prevención de la interacción electrostática del IGF-I y la insulina y la posterior precipitación al mezclarse. La utilización de SDS y β-ciclodextrin sulfobutiléter junto con la arginina en la formulación del IGF-I mostraron ser extremadamente efectivas en permitir que el IGF-I y la insulina Regular se mezclaran en un rango muy amplio de relaciones de mezcla. Sin embargo, no se pueden utilizar para mezclarse con la insulina NPH debido a la disociación de los complejos insulina NPH-protamina en presencia de SDS y β-ciclodextrin sulfobutiléter. 20 25 30 35 40 45 50 55 60 65 20 ES 2 208 305 T3 REIVINDICACIONES 5 1. Composición que comprende una mezcla de un factor de crecimiento similar a insulina I (IGF-I), insulina regular y un excipiente seleccionado del grupo que consiste en arginina, lisina, glutamato, dodecilsulfato de sodio y una combinación de beta-hidroxiciclodextrina y arginina, en donde el IGF-I y la insulina regular son solubles en la composición y en donde la insulina regular y el IGF-I están presentes en una relación volumen:volumen de 1:6 a 6:1. 2. Composición de la reivindicación 1 en donde el excipiente es arginina. 10 3. Composición de la reivindicación 1 en donde se utilizan dos o más de dichos excipientes. 4. Composición de la reivindicación 3 en donde los excipientes son arginina, dodecilsulfato de sodio y betaciclodextrin sulfobutiléter. 15 5. Composición de la reivindicación 1 en donde la relación volumen:volumen de insulina regular: IGF-I es de 0,2:1 a 1:1. 6. Composición de la reivindicación 1 que comprende además un tampón. 20 7. Composición de la reivindicación 6 en donde el tampón está a un pH de 7 a 7,5. 8. Composición de la reivindicación 7 en donde el tampón es histidina. 25 9. Composición de la reivindicación 1 que comprende además una disolución salina tamponada con fosfato. 10. Composición de la reivindicación 1 que comprende además un estabilizador. 30 11. Composición de la reivindicación 1 en donde el excipiente es arginina y adicionalmente comprende histidina y fenol. 12. Composición de la reivindicación 1 en donde el excipiente es arginina en una concentración de 100 a 300 mM y la relación de insulina: IGF-I es 0,1:1 a 10:1. 35 13. Composición de la reivindicación 12 que además comprende el beta-ciclodextrin sulfobutiléter como excipiente en una concentración de 1-10%. 14. Composición de la reivindicación 1 en donde el excipiente es dodecilsulfato de sodio en una concentración de 1-10% y la insulina regular y el IGF-I están presentes en una relación volumen:volumen de 1:1 a 6:1. 40 45 15. Composición de la reivindicación 1 que comprende 5-20 mg/mL de IGF-I, 2-10 mg/mL de insulina regular, arginina 100-200 mM, histidina 5-20 mM a un pH 7-7,5 y 1-5 mg/mL fenol. 16. Composición de la reivindicación 1 que comprende 10 mg/mL de IGF-I, 3-4 mg/mL de insulina regular, arginina 160 mM, histidina 10 mM a pH 7,2 y 3 mg/mL de fenol. 17. Composición de la reivindicación 1 en donde el IGF-I y la insulina regular no están complejadas. 50 55 18. Procedimiento de preparación de la composición de la reivindicación 1 que comprende mezclar juntos como componente (a) el IGF-I en un excipiente seleccionado del grupo que consiste en arginina, lisina, ácido glutámico, dodecilsulfato sódico, beta-hidroxi ciclodextrina y beta-ciclodextrin sulfobutiléter y como componente (b) la insulina regular. 19. Procedimiento de la reivindicación 18 que comprende, además, incubar la mezcla durante un periodo de tiempo a 30-40ºC, en donde la composición comprende, además, una disolución salina tamponada con fosfato. 20. Procedimiento de la reivindicación 19 en donde la mezcla se incuba durante 15 minutos a 37ºC. 21. Equipo para preparar la composición de la reivindicación 1 que comprende: 60 a) un envase que comprende el IGF-I en un excipiente seleccionado del grupo que consiste en arginina, lisina, ácido glutámico, dodecilsulfato sódico y una combinación de beta-hidroxiciclodextrina y arginina; b) un envase que comprende la insulina regular. 65 22. Equipo de la reivindicación 21 en donde cuando el IGF-I y la insulina regular están combinadas, la composición es una formulación farmacéuticamente aceptable. 21 ES 2 208 305 T3 23. Equipo de la reivindicación 22 en donde la formulación farmacéuticamente aceptable es para el tratamiento de una alteración hiperglicémica. 24. Equipo de la reivindicación 21 en donde el excipiente es arginina. 5 25. Equipo de la reivindicación 24 en donde el envase (a) comprende de 5-20 mg/mL de IGF-I, arginina 100-200 mM, histidina 5-20 mM a pH 7-7,5 y de 1-5 mg/mL de fenol. 10 26. Equipo de la reivindicación 25 en donde el envase (a) comprende 10 mg/ml de IGF-I, arginina 160 mM, histidina 10 mM a pH 7,2 y 3 mg/mL de fenol. 15 27. Composición que comprende una mezcla de factor de crecimiento similar a insulina I (IGF-I), insulina compuesta por un 70% de insulina NPH y un 30% de insulina regular (insulina 70/30), arginina, histidina y fenol, en donde el IGF-I y la insulina 70/30 son solubles en la composición, y en donde la insulina 70/30 y el IGF-I están presentes en una relación volumen:volumen de 1:1 a 6:1. 28. Composición de la reivindicación 27 que comprende 5-20 mg/mL de IGF-I, arginina 100-200 mM, histidina 5-20 mM a pH 7-7,5 y 1-5 mg/mL de fenol. 20 29. Composición de la reivindicación 27 que comprende 10 mg/mL de IGF-I, arginina 160 mM, histidina 10 mM a pH 7,2 y fenol 3 mg/mL 30. Utilización de una composición según cualquiera de las reivindicaciones 1 a 17 o 27 a 29 para la fabricación de un medicamento destinado al tratamiento de una alteración hiperglicémica. 25 31. Utilización de la reivindicación 30, en donde la alteración hiperglicémica es diabetes. 30 35 40 45 50 55 60 65 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos químicos y farmacéuticos como tales. Esta información no prejuzga que la patente esté o no incluida en la mencionada reserva. 22 ES 2 208 305 T3 23 ES 2 208 305 T3 24 ES 2 208 305 T3 25 ES 2 208 305 T3 26 ES 2 208 305 T3 LISTA DE SECUENCIAS 5 10 <110> Schering Corporation <120> Nuevas utilizaciones de la proteína OX2 de mamífero y reactivos relacionados <130> DX0936 <150> US 09/290825 <151> 1999-04-13 <160> 3 15 <170> Patentin Ver. 2.0 20 <210> 1 <211> 274 <212> PRT <213> primate <400> 1 25 30 35 40 45 50 55 60 65 1 ES 2 208 305 T3 5 10 15 20 <210> 2 <211> 278 <212> PRT <213> roedor <400> 2 25 30 35 40 45 50 55 60 65 2 ES 2 208 305 T3 5 10 15 20 25 <210> 3 <211> 278 <212> PRT <213> roedor <400> 3 30 35 40 45 50 55 60 65 3 ES 2 208 305 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 4