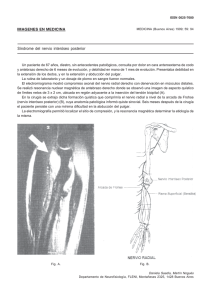
desarrollo, anatomía, vascularización, fisiología e histopatología del
Anuncio

CAPÍTULO 2 DESARROLLO, ANATOMÍA, VASCULARIZACIÓN, FISIOLOGÍA E HISTOPATOLOGÍA DEL NERVIO ÓPTICO DESARROLLO DEL NERVIO ÓPTICO José Ramón Mérida, José Francisco Rodríguez, Juan Jiménez ANATOMÍA DEL NERVIO ÓPTICO José Manuel Ramírez, Alberto Triviño, Juan José Salazar, Ana Isabel Ramírez, Rosa de Hoz, Blanca Rojas VASCULARIZACIÓN DEL NERVIO ÓPTICO Sohan Singh Hayreh FISIOLOGÍA DEL NERVIO ÓPTICO María Paz Villegas-Pérez, Jaime Miralles de Imperial, Manuel Vidal-Sanz HISTOPATOLOGÍA DE LAS NEUROPATÍAS ÓPTICAS Manuel Quintana Como preámbulo al estudio de las enfermedades del nervio óptico, de su fisiopatología y de su tratamiento, se estudiarán a lo largo del presente capítulo los fundamentos básicos sobre el desarrollo, la anatomía, la vascularización y la fisiología del nervio. Asimismo, se expondrán algunas nociones histopatológicas acerca de las neuropatías ópticas, todo ello con el propósito de facilitar una mejor comprensión de los procesos patológicos, cuya descripción será objeto de capítulos siguientes. DESARROLLO DEL NERVIO ÓPTICO El nervio óptico está constituido desde el punto de vista embriológico por los axones de las células ganglionares de la retina (CGR) y por las células gliales derivadas del pedículo óptico (neuroectodermo). El desarrollo del nervio óptico, al igual que sucede con el resto del organismo, está dividido en dos períodos: embrionario y fetal (tabla 2-1). Período Embrionario El ojo es un órgano complejo cuyos componentes están formados a partir de diversas estructuras embrionarias: • Neuroectodermo: dará origen, entre otras formaciones, a la vesícula óptica y al pedículo óptico. • Ectodermo de superficie (epiblasto): formará el cristalino. • Ectomesénquima o mesectodermo (mesénquima migratorio de la cresta neural): originará la mayoría de los elementos conjuntivos del ojo y estructuras anexas. Durante el desarrollo del ojo tienen lugar dos tipos de procesos básicos, a saber, la inducción de ciertos territorios, que da como resultado el esbozo inicial de los componentes principales del globo, y las múltiples interrelaciones coordinadas entre las diferentes estructuras oculares. Al comienzo del período somítico aparece en el neuroectodermo un engrosamiento a cada lado de la extremidad anterior de la placa neural (campo o área ocular) (fig. 2-1A). Los campos o áreas oculares expresan el gen Pax-6, y una inducción de la lámina precordal («Sonic hedgehog») reprime el gen Pax-6 en la línea media ventral, de forma que los campos oculares se mantienen separados. En cambio, cuando no existe esta inducción negativa, dichos campos convergen y el resultado es una ciclopía (fig. 21B). Se ha demostrado mediante inmunohistoquímica la expresión del gen Pax-6 en el ojo humano (1), a nivel del ectodermo de superficie (epiblasto), de la vesícula cristaliniana, de la cúpula óptica y del pedículo óptico en la 6.ª semana del desarrollo. Entre la 8.ª y la 22 semanas, se expresa en el epitelio corneal, la conjuntiva, el cristalino y el epitelio ciliar no pigmentado. A su vez, la retina es positiva entre las semanas 8.ª y 10, quedando la positividad restringida después de la 21 semana a la capa de células ganglionares y a la capa nuclear interna, en sus porciones interior y exterior. Cada campo ocular comienza a evaginarse, formándose el surco óptico, que aparece en los humanos durante la 4.ª semana del desarrollo, en la fase de 3 mm de longitud (2). Cuando se completa el cierre del neuroporo anterior, el esbozo óptico aparece como un divertículo lateral del prosencéfalo denominado vesícula óptica (fig. 2-1C). La vesícula óptica está unida a la pared pro- 10 Neuropatías ópticas: diagnóstico y tratamiento Tabla 2-1. Cronología del desarrollo embrionario y fetal del nervio óptico Período Embrionario Semana Longitud vértex-coxis Estructura 4.ª semana 3 mm 4 mm 5-6 mm Surco óptico Vesícula óptica Cúpula óptica, cristalino, hendidura embrionaria 6.ª semana 10 mm 16 mm Arteria hialoidea en hendidura embrionaria Aparecen fibras de nervio óptico en futura papila 7.ª semana 20 mm Hendidura embrionaria cerrada Aparece quiasma óptico Acúmulos de glioblastos 7,5.ª semana 23 mm 23-28 mm Limitante de glioblastos en trayecto intravítreo de arteria hialoidea Aumenta vascularización de región retroocular 8.ª semana 28-31 mm Aparecen columnas de glioblastos en porción intraocular de nervio óptico En región coroidea el nervio tiene limitante de glioblastos Esbozo de manto periférico glial de Greef Período Fetal Mes Estructura 3.er mes Condensación mesenquimal escleral alcanza nervio óptico Esbozo de cubiertas meníngeas Se incrementa notablemente número de axones Círculo arterial de Zinn-Haller evidente En región retroescleral penetran tejido conjuntivo y vasos piales 4.º mes Regresión de arteria hialoidea Cubiertas meníngeas claramente definidas Fondo de saco aracnoideo 5.º-6.º mes Se completa vascularización de nervio óptico 7.º mes Se forma porción fibrosa de lámina cribosa 9.º mes Se completa mielinización de nervio óptico hasta lámina cribosa sencefálica por el pedículo o tallo óptico, relativamente estrecho y corto, a través del cual la cavidad de las dos vesículas se comunica con el ventrículo prosencefálico. Los pedículos ópticos se encuentran rodeados por tejido mesenquimal laxo de origen cresto-neural. La vesícula óptica induce la formación de la placoda cristaliniana, un fenómeno conocido desde hace mucho tiempo (3), en el cual se ha podido comprobar recientemente la importancia del factor de crecimiento fibroblástico (FCF) (4). La placoda cristaliniana se invagina, constituyendo la vesícula cristaliniana (fig. 2-1D). De modo simultáneo la porción distal e inferior de la vesícula óptica se aplana y aparece una pequeña inflexión que se deprime de modo gradual, para formar así una invaginación de Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 11 Figura 2-1. (A): embrión humano de 21-22 días, en cuyo período se inicia el cierre del tubo neural, comenzando por la parte media del embrión y progresando hacia los dos extremos. La extremidad cefálica es más voluminosa que la caudal. (B): ciclopía. Al comienzo del período somítico, y por transtornos inductivo-genéticos de la línea media, se producen alteraciones craneales graves acompañadas de una convergencia de los campos ópticos. (C): embrión humano JL (4 mm de longitud). El corte histológico muestra la evaginación de la pared lateral del prosencéfalo [P] que constituye la vesícula óptica [VO], a la vez que la luz prosencefálica comunica con la de la vesícula. En el ángulo inferior derecho aparece una imagen panorámica de la sección histológica [EC: ectomesénquima]. (D): embrión humano OY-4 (6 mm de longitud). La cúpula óptica está constituida por dos paredes, la pared interna poliestratificada, que dará lugar a la retina neural [R] y la pared externa monoestratificada, que dará lugar a la lámina pigmentaria [L]. En este estadío se observan la vesícula cristaliniana [C] y el pedículo óptico [PE]. (E): corte histológico y representación esquemática del embrión humano PH (11 mm de longitud). La porción inferior de la cúpula y del pedículo ópticos se invaginan y forman la hendidura embrionaria, por donde penetran los vasos hialoideos rodeados de ectomesénquima. 12 Neuropatías ópticas: diagnóstico y tratamiento doble pared o capa, la cual configura la denominada cúpula óptica (5) (fig. 2-1D). Dicha invaginación, a partir de la cúpula recorre longitudinalmente el pedículo óptico formando una hendidura, conocida como hendidura embrionaria (fig. 2-1E). A la sección en la cúpula óptica se distinguen 2 hojas: • Interna, poliestratificada, que dará lugar a la retina neural. • Externa, monoestratificada, que es el esbozo de la lámina pigmentaria. La formación de la hendidura embrionaria conlleva que tanto la pared interna como la externa de la cúpula óptica se continúen con sus correspondientes del pedículo óptico en la fase de 6 mm, al final de la 4.ª semana del desarrollo (2). Esta continuidad crea un túnel de paredes superiores, a través del cual la arteria hialoidea, rama de la oftálmica, entra en la cúpula alcanzando el interior de la misma sin atravesar ninguna de sus capas. En nuestros especímenes esta arteria, después de un trayecto en bayoneta, penetra por la hendidura embrionaria durante la fase de 10 mm (inicio de la 6.ª semana del desarrollo; 37-38 días) (fig. 2-1E). Además, la hendidura sirve de vía directa a lo largo de la cual las fibras nerviosas procedentes de las CGR establecen conexión con el diencéfalo. Nervio Óptico La aparición de las fibras del nervio óptico en la futura papila, ha sido fijada por algunos autores entre las fases de 17 y 27 mm (2,6). Sin embargo, nosotros, al igual que otros autores (7), hemos podido observarlas en estadíos precedentes (fase de 16 mm; 6,5 semanas del desarrollo, 44 días) (fig. 2-2A). Las células del pedículo óptico (neuroectodermo) rodean cranealmente a estas fibras y a la arteria hialoidea, mientras que la luz del pedículo pone en comunicación la cavidad existente entre las capas pigmentaria y neural de la retina con la del III ventrículo (fig. 2-2B). La relación entre la arteria hialoidea y las fibras del nervio óptico ha sido subrayada por algunos autores (8,9,10), según los cuales la formación de la misma y de la hendidura embrionaria serían imprescindibles para el desarrollo del nervio. Es por ello que una aplasia de este último podría tener como causa un desarrollo vascular anómalo. Durante el 2.º mes comienza el cierre de la hendidura embrionaria, que se estrecha progresivamente debido al crecimiento de los bordes del pedículo óptico. Primero se fusiona la porción intermedia, y este proceso de fusión se extiende rápidamente en sentido proximal y distal, hasta que en la fase de 20 mm la hendidura queda totalmente obliterada (6). Algunas células de la región más interna del pedículo se vacuolizan y degeneran, lo que permite a las fibras de las CGR migrar a través de los espacios creados. En la fase de 20 mm (7.ª semana del desarrollo) aparece el esbozo del quiasma óptico. La región de la papila muestra por primera vez durante este estadío un acúmulo de glioblastos, esbozos de la membrana limitante de Elschnig y el menisco central de Kuhnt, que separan las fibras del nervio óptico a nivel de la papila, del vítreo secundario (fig. 2-2C). Estos acúmulos gliales, cuyo origen es neuroectodérmico (11), aparecen también a nivel de la retina y son el esbozo del tejido intermediario de Kuhnt. En la fase de 23 mm (51 días del desarrollo) la arteria hialoidea presenta, al inicio de su trayecto intravítreo, una lámina limitante de glioblastos (papila de Bergmeister) (fig. 2-2D). Entre las fases de 23 y 28 mm (53 días del desarrollo) la esclerótica se empieza a esbozar a partir de una condensación mesenquimal inducida por la coroides, que progresa de delante a atrás. Coincidiendo con este hecho, aumenta notablemente la vascularización de la región retroocular y aparecen 2 ó 3 arterias ciliares, algunas de cuyas ramas se disponen alrededor de la parte más ventral del nervio y constituyen el esbozo del círculo arterial de Zinn-Haller. Así pues, al final del período embrionario (fase de 28-30 mm; 8.ª semana del desarrollo), el nervio óptico presenta un trayecto que va desde la parte posterior del globo ocular hasta el quiasma. Los glioblastos se acumulan a nivel del nervio en la papila, en la región retiniana separando las fibras nerviosas, en la región coroidea formando una limitante precisa y en el trayecto intraorbitario, separándolo del mesénquima vecino (esbozo del manto periférico glial de Greef). Las funciones que tienen en el adulto los acúmulos gliales de la región prelaminar sobre los axones son de protección y soporte en su giro, de resistencia a las presiones con los movimientos y de organización de los haces a su paso por la lámina cribosa (12). Además, la porción orbitaria posterior del nervio óptico muestra la relación del nervio con el futuro anillo de Zinn, así como con los músculos rectos superior e interno. A nivel del canal óptico, constituido por cartílago, el nervio óptico se relaciona con la arteria oftálmica, rama de la carótida interna. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 13 Figura 2-2. (A): embrión humano CIV-2 (16 mm de longitud). La figura muestra la arteria hialoidea [H] en la región de la papila [PA]. [R: retina; L: lámina pigmentaria]. (B): representación esquemática de la disposición del nervio óptico en un especimen de alrededor de 6-7 semanas de desarrollo. El pedículo óptico está constituido por neuroectodermo y su luz se halla en continuidad con la cavidad del III ventrículo. (C): embrión humano CAS (20 mm de longitud). En la región de la papila aparecen acúmulos gliales (flecha). [R: retina; L: lámina pigmentaria]. (D): embrión humano BR-4 (28 mm de longitud). La arteria hialoidea [H] rodeada de una clara limitante glial comienza su trayecto intravítreo. (E): feto humano B-25 (75 mm de longitud). Obsérvese la condensación mesenquimal esbozo de la esclerótica [E]. El nervio óptico aparece envuelto por mesénquima, esbozo de las cubiertas [M] y la arteria hialoidea [H] comienza su regresión. [V: vasos del círculo de Zinn-Haller]. (F): corte parasagital a nivel de la órbita de un adulto humano. Se observa el trayecto intraorbitario del nervio óptico [NO], rodeado por la grasa retrobulbar y los músculos oculares extrínsecos. [E: esclerótica; ES: músculo elevador del párpado superior; RS: músculo recto superior; RI: músculo recto inferior; SM: seno maxilar; LF: lóbulo frontal]. 14 Neuropatías ópticas: diagnóstico y tratamiento Período Fetal La 9.ª semana del desarrollo se caracteriza por un hecho fundamental, ya que la condensación del mesénquima que constituye el esbozo de la esclerótica, alcanza la región del nervio óptico. La condensación mesenquimal que dará origen a las cubiertas meníngeas aparece alrededor del nervio durante la 10 semana, si bien algunos autores han situado este hecho en períodos precedentes del desarrollo (7.ª-8.ª semanas) (13,14). El número de axones del nervio óptico se incrementa primero rápidamente, desde 1,9 millones entre la 10 y la 12 semanas hasta 3,7 millones a las 16 semanas, para descender luego a 1,1 millones aproximadamente en la 33 semana (14). Durante la 11 semana el círculo de Zinn-Haller es evidente y la arteria hialoidea sigue siendo permeable. En la región posterior (retroscleral) del nervio aparecen numerosos vasos y tejido conjuntivo, que penetran desde la envoltura pial en la 12 semana (fig. 2-2E). A partir del 4.º mes comienza la regresión de la arteria hialoidea, un hecho que, mediante técnicas inmunohistoquímicas, túnel y microscopía electrónica, se ha fijado recientemente entre la 13 y la 15 semanas (15). Las vainas meníngeas están claramente definidas y la duramadre que rodea al nervio se continúa a nivel del globo ocular con la esclerótica. Utilizando fetos de 16-25 semanas de desarrollo y especímenes de 8 meses a 75 años de edad, se ha descrito la existencia de dos poblaciones de astrocitos tipo 1 en el nervio óptico. Los astrocitos tipo 1A expresan proteína gliofibrilar ácida (GFAP), se localizan en los bordes de la región laminar y en la porción mielinizada del nervio forman la membrana limitante glial (16). Por su parte, los astrocitos tipo 1B expresan GFAP y NHK-1/N-CAM, localizándose en las columnas gliales y en los orificios de la lámina cribosa. Además, durante este mes (13-14 semana) aparece definido el fondo de saco subaracnoideo a nivel escleral. Al 5.º-6.º mes del desarrollo se completa la vascularización del nervio óptico y los vasos que forman el círculo arterial de Zinn-Haller muestran anastomosis (17). Durante el 7.º mes se forma la porción fibrosa de la lámina cribosa (14), a la vez que comienzan a desarrollarse los vasos retinianos. En este estadío, el proceso de mielinización alcanza el quiasma y avanza en sentido distal hacia el globo ocular, hallándose al 9.º mes totalmente mielinizadas las fibras del nervio hasta la lámina cribosa. Según ha demostrado un estudio comparativo inmunohistoquímico reciente, la presencia de mielina es habitual en la papila de algunos mamíferos y aves (18). Una vez completado su desarrollo, podemos dividir el nervio óptico del adulto (fig. 2-2F) en las 4 porciones siguientes: porción intraocular, porción intraorbitaria, porción intracanalicular y porción intracraneal. De gran interés desde el punto de vista diagnóstico y terapéutico son las relaciones anatómicas que las diferentes porciones del nervio presentan respecto a otras estructuras orbitarias y craneales. Entre estas relaciones, las que poseen mayor implicación clínica se exponen en los capítulos 4 y 16. ANATOMÍA DEL NERVIO ÓPTICO Desde el punto de vista anatómico, el nervio óptico presenta unas características especiales dentro del SNC, ya que es el único tracto nervioso que abandona la cavidad craneal y, además, puede ser visualizado directamente por el clínico en su porción más anterior. Este nervio se encuentra subdividido en fascículos por tejido conectivo y tabiques piales, estando a su vez rodeado por las vainas meníngeas y por líquido cefalorraquídeo (LCR) (19). Como ya se ha dicho, el nervio óptico se forma por la reunión de los axones de las células ganglionares, que se distribuyen formando un patrón ordenado desde sus somas hasta el cuerpo geniculado lateral (CGL), en donde la mayor parte de las fibras realizan la sinapsis. Los puntos clave de su trayecto son la cabeza del nervio óptico (CNO), a cuyo nivel los axones salen del globo ocular, y el quiasma óptico, donde se produce la decusación de las fibras nerviosas (20). La longitud del nervio varía entre 35-55 mm y el número de sus axones se aproxima al millón, existiendo un amplio margen de variabilidad interindividual, por lo que este número oscila entre 770.000 y 1.700.000 (21,22). Cada axón tiene un diámetro de 0,5 µm, por lo que el diámetro total del nervio es de 1,5-2 mm en las proximidades de la retina y de 3-4 mm después de atravesar la lámina cribosa (20,23-25). Los componentes del nervio óptico son (26): • Axones de las células ganglionares. • Células gliales: astrocitos, oligodendrocitos y microglía. • Tejido conectivo que constituye la lámina cribosa y los tabiques que fasciculan el nervio. • Vasos sanguíneos derivados tanto del sistema de la arteria central de la retina como del sistema ciliar. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico Las longitudes respectivas de las 4 porciones en que se divide el nervio (fig. 2-2F) son: intraocular 0,5-1 mm; intraorbitaria 25 mm; intracanalicular 6-7,5 mm; e intracraneal 10-12 mm (23,24). La CNO constituye la parte más anterior del nervio óptico y comprende la porción intraocular junto con el sector más anterior de la porción intraorbitaria del mismo (26). A su vez, puede ser dividida en 4 partes (27): • Capa superficial de fibras nerviosas de la retina (CFNR). • Región prelaminar. • Región de la lámina cribosa. • Región retrolaminar (correspondiente a la parte más anterior de la porción intraorbitaria). La organización básica de la CNO es semejante en todas estas regiones, de modo que los axones de las CGR forman haces, de varios miles de axones cada uno, los cuales se encuentran rodeados por distintos tejidos. Estos últimos, en cambio, presentan variaciones, según las diferentes regiones del nervio. Capa Superficial de Fibras Nerviosas En la retina, los axones de las CGR convergen hacia el disco óptico siguiendo una trayectoria casi rectilínea, y constituyen de este modo las fibras nerviosas retinianas. Éstas van confluyendo en gran número a lo largo de su recorrido y se reúnen en hileras, formando haces que integran la CFNR. De este modo, cada haz, al alcanzar la CNO, contiene fibras procedentes de las CGR cuya localización varía desde la retina periférica hasta las proximidades de la papila (20). Otra característica de los mencionados axones es que son amielínicos, ya que no existen oligodendrocitos en esta capa, siendo el tipo glial predominante en la misma las células astrogliales (28) (fig. 2-3A). Los axones de las CGR siguen un patrón establecido, aunque la presencia de la fóvea en la retina humana influye sobre su disposición. Así, los procedentes de las células de la hemirretina nasal, tanto superior como inferior, no son afectados por la fóvea y se dirigen directamente al disco óptico. Lo mismo ocurre con las células de la hemirretina temporal nasales respecto a la fóvea, cuyas fibras forman el haz papilomacular en su trayecto hacia el disco óptico (20). En cambio, los axones de las CGR temporales 15 a la fóvea, no pueden atravesar a esta última para unirse al haz papilomacular, por lo que la rodean formando arcos por encima y por debajo de ella, en dirección al disco óptico. Existe una línea divisoria de situación temporal respecto a la fóvea (rafe medio), que separa las CGR cuyas fibras siguen un curso, respectivamente, superior e inferior en relación a la misma (20,23,29-31) (ver fig. 2-29). Con respecto a la organización de los axones en el espesor de la CFNR, existen diferentes teorías. Según algunas de ellas, los de localización más periférica se disponen más próximos a la capa de células ganglionares, en tanto que los más cercanos a la CNO atraviesan perpendicularmente la CFNR, para situarse en la vecindad de la superficie vítrea. De este modo, las fibras procedentes de la periferia girarían 90° en el mismo margen del disco óptico y las de procedencia más central efectuarían el giro a la altura del centro de la CNO (32,33). Otras teorías postulan que las CGR periféricas tienen los axones más superficiales, mientras que las centrales los disponen en situación más profunda. En este caso, al alcanzar la CNO, las fibras más periféricas girarían 90° a la altura del margen papilar, para atravesar la CFNR, y las originadas en células más centrales harían el giro en el mismo centro del disco (34). La opinión actual es que la organización de la CFNR en el espesor vítreo-escleral no depende de la excentricidad, y los axones procedentes de CGR de diferentes zonas se mezclan en una cuña que se extiende desde la periferia al centro del nervio. Según esto, no existiría una predeterminación por parte de las fibras nerviosas de esta región para establecer un orden retinotópico (35,36). Con respecto al otro constituyente principal del nervio óptico, los astrocitos de la CFNR presentan en general un cuerpo celular delgado y prolongaciones rectilíneas que siguen la trayectoria de los axones de las CGR (26,37,38) (fig. 2-3A). Las funciones de estas células a nivel de todo el SNC consisten en proporcionar soporte físico a las neuronas manteniendo su espacio perineuronal en condiciones estables. Asimismo, aislan las zonas sinápticas y el pericarion neuronal, protegen a las neuronas de posibles lesiones e inducen las propiedades de barrera hematoencefálica en los vasos sanguíneos. A nivel de nervio óptico los astrocitos de la CFNR tienen además a su cargo la fasciculación de las axones (12,39). En esta capa hay un segundo tipo morfológico de astrocitos de cuerpo celular robus- 16 Neuropatías ópticas: diagnóstico y tratamiento Figura 2-3. Capa superficial de fibras nerviosas. (A): astrocitos de la CFNR. Inmunofluorescencia con anti-GFAP. V: humor vítreo; MLI: membrana limitante interna; CFN: capa de fibras nerviosas; CCG: capa de células ganglionares. (B): capilares (cabezas de flecha) dependientes de las arteriolas retinianas principales (flechas) en el disco óptico [DO]. Diafanización y replección vascular con polímeros coloreados. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico to y prolongaciones no tan largas, cuya función consiste en aislar las fibras nerviosas del resto de los tejidos circundantes. Para ello forman, por un lado, la membrana limitante interna de Elsching, que las aísla de la superficie del vítreo, y por otro lado, el menisco central de Kuhnt, situado debajo de la anterior, ocupando la excavación central de la papila y rodeando a la arteria y a la vena centrales de la retina (ACR y VCR) (37,38). El principal papel atribuido a estas limitantes es el de constituir una barrera equivalente a la hematoencefálica, que impida el paso de moléculas entre el nervio óptico y los tejidos adyacentes, en este caso el humor vítreo (40,41). Los vasos que irrigan esta región dependen de las arteriolas principales de la retina, por lo que los capilares de esta zona están en continuidad con los peripapilares retinianos, y a veces existe una contribución adicional por vasos del sistema ciliar (31,39,42-46) (fig. 2-3B). Región Prelaminar Esta región, conocida también como la región coroidea de la lámina cribosa (39,47), se distingue por el cambio de trayectoria que realizan los axones de las CGR cuando se incurvan 90° para dirigirse al quiasma óptico. En ella se diferencian dos zonas, de acuerdo con la organización, disposición, densidad y morfología de los astrocitos, así como con el modo que estas células tienen de agrupar (fascicular) a los axones: la anterior y la posterior (26,37,38). La región prelaminar anterior contiene astrocitos de morfología estrellada con cuerpo celular delgado (fig. 2-4A) y su disposición está muy relacionada con el patrón de distribución que presenta el sistema vascular (38). La agrupación de los cuerpos celulares sobre los vasos y las prolongaciones primarias de los astrocitos forman estructuras que en los cortes transversales aparecen como celdillas, por cuyo interior se disponen las fibras nerviosas agrupadas en haces (37) (fig. 2-4B). La disposición espacial de las celdillas condiciona la estructura tridimensional del armazón glial de esta zona, semejante al de una cesta de mimbre. Dicha estructura refleja la función de soporte y protección que los astrocitos ejercen sobre las fibras no mielinizadas en el punto de su giro de 90° (38). La relativa elasticidad de la región prelaminar anterior, en contraste con la rigidez de la lámina cribosa, evita posibles com- 17 presiones y rozamientos entre los axones, y hay además una serie de datos que parecen apoyar esta función de cesta glial. Así, por un lado, los filamentos intermedios del citoesqueleto (GFAP y vimentina) son un componente elástico intracelular que ayuda a mantener la forma y plasticidad celulares (48), y proporcionarían fuerza tensional a las prolongaciones astrogliales (37,38,47) (fig. 2-4C). Por otro lado, la existencia de desmosomas (49) y uniones comunicantes (Gap) (50) jugaría un papel importante en el mantenimiento de la malla astroglial a través de la cual pasan los axones. En la región prelaminar posterior la estructura en cesta es reemplazada por tubos gliales (fig. 2-5A), de modo que, en lugar de los astrocitos delgados de la prelaminar anterior, aparecen aquí astrocitos de aspecto más robusto (figs. 2-5B,C,E,H). Éstos se organizan a modo de tubos cilíndricos por el interior de los cuales circulan las fibras nerviosas, y cuyas paredes las conforman gruesos tabiques, con los vasos sanguíneos dispuestos entre ellos (37,38) (fig. 25D). Los tubos gliales discurren en sentido rostrocaudal, en contacto unos con otros, y se sitúan de forma paralela entre sí y con respecto al eje del nervio óptico (fig. 2-5A,B). También envuelven a los axones a modo de fundas, observándose entre los astrocitos uniones comunicantes y desmosomas (fig. 2-5F). Ello permite especular sobre la función mecánica que desempeñan para soportar las tensiones originadas durante los movimientos oculares. Además, estos tubos organizan los fascículos de fibras nerviosas a su entrada en la región laminar (fig. 25D,E), lo que se aprecia porque quedan perfectamente confrontados con los poros cribosos en la zona de transición entre ambas regiones (12,37-39). Existen otras dos membranas limitantes gliales en la región prelaminar, el tejido intermediario de Kuhnt, que separa el nervio óptico de la retina, y la membrana limitante de Jacoby, que continúa por detrás a la anterior y aísla al nervio del tejido coroideo circundante (37,39,41,49,51). Ambas membranas están formadas por astrocitos de cuerpo celular grueso (fig. 2-5G) que se disponen en 4-5 capas densamente empaquetadas, constituyendo una barrera de separación entre el nervio óptico, la retina y la coroides (37). La función de barrera está respaldada por la existencia de uniones estrechas entre los astrocitos del tejido intermediario de Kuhnt y las células del epitelio pigmentario de la retina, así como por la presencia de desmosomas entre los astroci- 18 Neuropatías ópticas: diagnóstico y tratamiento Figura 2-4. Región prelaminar anterior. (A): astrocitos estrellados de cuerpo celular delgado (flecha). Anti-GFAP con la técnica de la peroxidasa anti-peroxidasa [PAP]. (B): astrocitos (flechas) dispuestos sobre los vasos sanguíneos (*) constituyendo celdillas. Corte transversal. AntiGFAP con PAP. (C): Microscopia electrónica de trasmisión [MET], que muestra el citoplasma con los filamentos intermedios gliales [C] y las prolongaciones de los astrocitos (flechas). Axones (ax). Núcleo [N]. (D): vascularización en la región prelaminar [RP] derivada de la precoriocapilar coroidea peripapilar (flecha). RL: región laminar. RR: región retrolaminar. Diafanización y replección vascular con polímeros coloreados. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 19 Figura 2-5. Región prelaminar posterior. (A): tubos gliales (cabezas de flecha) constituidos por astrocitos de cuerpo celular grueso (flecha). Luz del tubo (*). Sección longitudinal. Anti-GFAP con PAP. (B,C): tubos gliales constituidos por astrocitos de cuerpo celular grueso (cabezas de flecha). Microscopia electrónica de barrido [MEB]. (D): tubos gliales constituidos por astrocitos formando varias capas. Los vasos se disponen entre las paredes de los tubos (*). Los astrocitos emiten prolongaciones al interior de los tubos (flechas). Anti-GFAP con PAP. (E): los astrocitos muestran una apariencia de media luna. MEB. (F): astrocitos de cuerpo celular grueso con numerosos filamentos gliales [F] en sus prolongaciones. Uniones comunicantes (cabezas de flecha). (G): astrocito de cuerpo celular grueso. MEB. (H): astrocito de cuerpo celular grueso con forma de media luna (flecha). Anti-GFAP con PAP. 20 Neuropatías ópticas: diagnóstico y tratamiento tos y la membrana limitante externa (51). Esta función podría explicar la existencia de gran cantidad de fragmentos de mielina y cuerpos densos fagocitados y degradados por los astrocitos que forman las limitantes gliales (26,41). Otra función fundamental atribuida a los tejidos de Kuhnt y de Jacoby, es actuar como cojinetes que amortiguan los rozamientos consecutivos a los pequeños desplazamientos del nervio óptico durante los movimientos del globo ocular. Así se evita el sufrimiento de las fibras nerviosas que se introducen por la periferia del nervio (25), lo cual está corroborado por la disposición paralela de las ramificaciones astrogliales unidas entre sí por numerosos desmosomas, uniones en hendidura y uniones estrechas. Asimismo, existe en estas ramificaciones una gran cantidad de filamentos intermedios, que proporcionan cierta rigidez y fuerza tensional a las prolongaciones (37,38,47,48-51). Al igual que ocurre en el resto del nervio óptico se encuentran en esta región, además de los astrocitos, las células microgliales, un subtipo de glía del SNC que se activa como respuesta al daño neuronal (52,53). En el tejido normal dichas células están quiescentes y tienen forma estrellada, con un núcleo pequeño y un cuerpo celular que presenta varios procesos ramificados. A nivel de la CNO normal las células microgliales quiescentes (que son HLA-DR y CD-45 positivas, y GFAP negativas) se localizan en las paredes de los grandes vasos, rodeando a los capilares en las columnas gliales de la región prelaminar y a los poros cribiformes de la región laminar. Como consecuencia del daño moderado o severo de la CNO, la microglía se activa formando acúmulos de grandes células ameboides en la lámina cribosa, así como círculos celulares concéntricos alrededor de los vasos sanguíneos (54,55). Los vasos de la región prelaminar derivan del sistema ciliar a partir de la precoriocapilar coroidea peripapilar, con una posible contribución por parte del círculo de Zinn-Haller (31,39,44,56,57) (fig. 2-4D). Región Laminar La lámina cribosa la forman una serie de orificios redondo-ovales delimitados por tejido conectivo compacto (58) (fig. 2-6A), que son atravesados por las fibras nerviosas y cuyo número en ojos normales es de 550650. Se ha calculado por métodos histológicos que el diámetro de estos poros varía entre 10 y 100 µm y dis- minuye hacia la parte posterior de la lámina (59,60). El armazón principal de esta última es fibroelástico y se halla formado por expansiones esclerales de fibras colágenas densas (colágeno tipo I, II, V y VI), proteoglucanos (condroitín 4-sulfato y 6-sulfato) y tejido elástico, que dejan orificios destinados a los axones de las CGR (47,61-65). Los colágenos y las fibras elásticas actúan como amortiguadores de la tensión aplicada. Por su parte, los proteoglucanos determinan las propiedades biomecánicas de los tejidos, de manera que al ocupar un extenso volumen en relación con sus pesos moleculares, se pueden comprimir ante una carga y expandirse cuando desaparece la misma. Dado que en el nervio óptico existe un gradiente de presión hidrostática desde el disco óptico hasta la región retrolaminar (66), las propiedades de las moléculas citadas son importantes para amortiguar el gradiente de presión (54). Mediante técnicas de digestión para el tejido nervioso y microscopía electrónica de barrido, se pueden estudiar con precisión la estructura del núcleo de las placas cribiformes y las variaciones regionales existentes. Así, los elementos estructurales están más desarrollados en los cuadrantes nasal y temporal del disco óptico (fig. 2-6B), que en los sectores superior e inferior (59), (fig. 2-6C) a cuyo nivel los poros son más abundantes y también de mayor tamaño (67). La mayoría de las fibras nerviosas que atraviesan la lámina cribosa siguen un trayecto directo, si bien el 812% se desvían para atravesar los poros cribiformes en las zonas central y periférica del disco óptico, lo que las hace más vulnerables a las alteraciones de la lámina (68). Con respecto a la glioarquitectura de esta región, existe una disminución acusada del tejido glial, que recubre únicamente la cara interna de las laminillas cribosas (fig. 2-7A). Los astrocitos a este nivel poseen un cuerpo celular grueso semejante a los de la región prelaminar posterior, pero forman una única capa, recubriendo la pared interna del poro criboso. La función de los mismos consiste en proporcionar soporte funcional a los axones y sintetizar macromoléculas de la matriz extracelular. Además, son los encargados de soportar las fuerzas de cizallamiento y estiramiento generadas por el desplazamiento de las placas cribiformes en respuesta a las variaciones de la presión intraocular (PIO) (12,26,37-39). El núcleo de dichas placas está separado de los astrocitos por una capa continua y bien definida que contiene colágeno tipo IV (fig. 2-7B,C), laminina y proteoglucano heparán sulfato. Estas Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 21 Figura 2-6. Región laminar. (A): forma y tamaño de los poros de la lámina cribosa [S: superior; I: inferior; N: nasal; T: temporal; A: arteria; V: vena; Sc: esclerótica]. Técnica de digestión dejando intacto el colágeno y MEB. (B): poro nasal. Técnica de digestión dejando intacto el colágeno y MEB. (C): poro inferotemporal. Técnica de digestión dejando intacto el colágeno y MEB. 22 Neuropatías ópticas: diagnóstico y tratamiento Figura 2-7. Región laminar. (A): astrocito de cuerpo celular grueso [A] limitando los poros [P] de la lámina cribosa. Prolongaciones de astrocitos (flechas). Colágeno [C]. MEB. En la imagen insertada en la esquina derecha se observa un astrocito de cuerpo celular grueso (flecha) marcado con anti-GFAP con PAP. Colágeno (*). (B): sección longitudinal. Las flechas indican la región laminar [LR]. Región retrolaminar [RR]. Técnica de digestión dejando intacto el colágeno y MEB. (C): tejido colágeno [C] de la lámina cribosa. Fibroblasto (f). Núcleo de astrocito [N]. Axón [Ax]. Filamentos gliales (cabeza de flecha). MET. (D): vascularización de la LR. Círculo de Zinn-Haller [CZH] y ramas derivadas del mismo (flechas). Diafanización y replección vascular con polímeros coloreados. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico macromoléculas aportan un entramado de material filamentoso, formando parte de la membrana basal de los astrocitos, cuya función estructural proporciona un sustrato flexible para la unión celular. Asimismo, la laminina cumple una función importante en la regulación de la diferenciación celular y la proliferación de los tejidos neurales (54,69). Las células se unen a la membrana basal mediante glucoproteínas de membrana con propiedades adherentes, habiéndose indentificado en el nervio óptico uno de las principales tipos de moléculas de adhesión, las integrinas (54). Alrededor de la región laminar se encuentra una membrana limitante denominada tejido limitante de Elschnig, la cual está constituida por tejido conectivo y astrocitos con características generales semejantes a las existentes en las otras limitantes antes descritas (40,41). La vascularización en la región de la lámina cribosa depende de ramas centrípetas de las arterias ciliares posteriores (ACP) cortas, así como de arterias originadas directamente en el círculo de Zinn-Haller (31,39,42,46) (fig. 2-7D). Región Retrolaminar Se extiende desde el final de la lámina cribosa hasta el lugar donde la ACR y la VCR penetran en el nervio óptico y forma parte de la porción intraorbitaria del nervio, estando, como tal, rodeada por las vainas meníngeas, duramadre, aracnoides y piamadre. Dichas vainas delimitan entre sí dos espacios denominados subdural (entre duramadre y aracnoides) y subaracnoideo (entre aracnoides y piamadre) (70), el segundo de los cuales contiene el LCR (fig. 2-8A). La región retrolaminar se distingue por la aparición de los oligodendrocitos (fig. 2-9A), que son células gliales encargadas de la mielinización de los axones (71). Estos últimos se agrupan en haces, que se disponen de forma poligonal y están rodeados por tabiques de tejido conectivo (fig. 2-8B,C). Dichos tabiques se encuentran unidos a la piamadre (fig. 2-8A) en su periferia, a la lámina cribosa en su porción anterior y al tejido conectivo de la adventicia de la ACR, (fig. 2-8B) en su porción central, además de conducir los vasos al interior del nervio óptico (26). A nivel de esta región están presentes, así pues, tres tipos de células gliales. En primer lugar, los astrocitos contribuyen a fascicular los axones, separándolos de los vasos sanguíneos y del tejido conectivo, aunque 23 debe recordarse que dicha fasciculación la llevan a cabo aquí sobre todo los tabiques conectivos (fig. 29A,B). En segundo lugar, la microglía está integrada por células escasas, pero presentes en una proporción semejante a la de las restantes regiones del nervio óptico. En tercer lugar, los oligodendrocitos son los responsables de la formación de las vainas de mielina de los axones (fig. 2-9A). La aparición de mielina (fig. 2-9B) determina que el grosor del nervio óptico en esta zona aumente al doble del que se observaba a nivel de la lámina cribosa, pasando de 1,5 a 3 mm. La mielinización del nervio es necesaria para la conducción saltatoria del impulso nervioso, y la ausencia de mielina puede ser letal, como se ha demostrado en animales que presentan una mutación en sus integrantes, la proteína proteolipídica (PLP) y la proteína básica de la mielina (PBM). Además, la desmielinización de los axones origina disfunciones neurológicas como las observadas en la esclerosis múltiple (31). En cultivos celulares, se ha demostrado la existencia de un precursor común para los astrocitos denominados tipo-2 y para los oligodendrocitos, la célula bipotencial A2-B5 (+) (56-57 Miller 99), por lo que se le ha denominado progenitor de oligodendrocitos-astrocitos tipo-2 (O-2A) (72,73). La diferenciación de los progenitores O-2A hacia astrocitos tipo-2 requiere señales ambientales como la interacción del factor neurotrófico ciliar (CNTF) (74) con componentes de la matríz extracelular (75), mientras que la ausencia de estas señales da lugar a oligodendrocitos (38) (76). Estos últimos tienen precursores cuya maduración se lleva a cabo en una serie de estadíos reconocidos por la expresión de distintos antígenos de superficie, por características morfológicas y de motilidad, y por la respuesta a factores de crecimiento específicos (77). El precursor de los oligodendrocitos A2B5 (+) inmaduro es muy móvil, tiene una morfología bipolar característica y expresa antígenos de superficie, como son la glicoproteína NG2 y el gangliósido GD3 (78). A medida que madura, pierde movilidad, aparecen más prolongaciones y, aunque retiene su positividad para A2B5, empieza a expresar antígenos adicionales. Entre ellos se encuentra un antígeno pendiente de caracterización denominado POA (2), que es reconocido por el anticuerpo monoclonal O4 (68) (células O4+). En un estadío posterior de maduración, la capacidad de migración del precursor se reduce, se incrementa el número de prolongaciones y se expresan niveles altos 24 Neuropatías ópticas: diagnóstico y tratamiento Figura 2-8. Región retrolaminar. (A): sección transversal que muestra el tejido conectivo extendiéndose desde la piamadre [P]. [S: Superior; I: inferior; T: temporal; N: nasal]. Técnica de digestión dejando intacto el colágeno y MEB. (B): sección transversal que muestra el tejido conectivo extendiéndose desde los vasos sanguíneos centrales [V]. Técnica de digestión dejando intacto el colágeno y MEB. (C): sección longitudinal donde se observa que los tubos de colágeno son más grandes que los de la lámina cribosa. Técnica de digestión dejando intacto el colágeno y MEB. (D): vascularización derivada de la ACR para la porción central del nervio óptico (flechas). Diafanización y replección vascular con polímeros coloreados. (E): región retrolaminar (intraorbitaria posterior). Vascularización para la porción central del nervio mediante arteria recurrente (flecha) de la ACR. Diafanización y replección vascular con polímeros coloreados. de galactocerebrósido, que es el principal glicolípido de la mielina (73). La elaboración de las vainas de mielina se asocia con la expresión de componentes específicos de la misma, como son la PBM y la PLP (11,12,28) (79). La proliferación del precursor del oligo- dendrocito es inducida por distintos mitógenos en diferentes etapas del desarrollo. Así, el del oligodendrocito inmaduro A2B5 (+) prolifera sobre todo en respuesta al factor de crecimiento derivado de las plaquetas (FCDP) y, en menor grado, al factor de crecimiento de Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 25 Figura 2-9. Región retrolaminar. (A): astrocitos intrafasciculares [A], que envían prolongaciones interiores (flechas) hacia las paredes de los tabiques (flechas gruesas) y capilares (cabeza de flecha). Oligodendrocito [O]. Colágeno [C]. Anti-GFAP con PAP. (B): astrocito de cuerpo celular grueso [A] situado entre axones mielinizados (ax). En el citoplasma del astrocito se observan fragmentos de mielina que han sido fagocitados (flecha). MET. (C): vascularización periférica del nervio óptico mediante ramas derivadas del CZH (flechas). Diafanización y replección vascular con polímeros coloreados. (D): vascularización a través de ramas piales de la ACR (flechas) para la porción periférica del nervio. Diafanización y replección vascular con polímeros coloreados. (E): región retrolaminar (intraorbitaria posterior). Ramas de la arteria oftálmica y sus colaterales (flechas). Diafanización y replección vascular con polímeros coloreados. 26 Neuropatías ópticas: diagnóstico y tratamiento los fibroblastos tipo-II (bFCF) (80). En cambio, los oligodendrocitos más maduros O4 (+), tienen precursores que no responden al FCDP, pero retienen su respuesta proliferativa frente al bFCF. Estudios experimentales con colorantes lipofílicos han demostrado que el origen de los precursores del oligodendrocito del nervio óptico se encuentra en el suelo del III ventrículo, produciéndose una migración desde esta zona hacia el quiasma y después al nervio (81). La producción de tenascina C por los astrocitos es la encargada de regular la migración de dichos precursores a nivel de la lámina cribosa (82). Así pues, los oligodendrocitos formarían la banda de mielina, en tanto que los astrocitos tipo-2 serían los encargados del mantenimiento de los nódulos de Ranvier, controlando las concentraciones iónicas perinodales y aportando nutrientes al axón (31). Los nódulos de Ranvier son las zonas del axón en donde la mielina queda interrumpida, y su importancia estriba en que la propagación de los potenciales de acción tiene lugar mediante saltos de nódulo a nódulo, lo cual condiciona que la conducción nerviosa sea más eficaz. Los astrocitos envían prolongaciones perinodales que rodean a la membrana plasmática axonal amielínica, una asociación que puede tener un papel decisivo en la fisiología del nódulo. De esta forma se crearían las condiciones específicas para generar los potenciales de acción83, ya que los astrocitos perinodales podrían sintetizar y renovar canales iónicos de la membrana nodal. Además, los canales de sodio astrocitarios podrían estar implicados en la homeostasis del espacio perinodal, siendo el tamponamiento iónico de dicho espacio dependiente de la actividad eléctrica del nódulo (31). En la región retrolaminar, tal como ocurre en las otras regiones del nervio óptico, aparece un tejido glial constituído por prolongaciones y somas de astrocitos que separan la piamadre de los axones ganglionares, y se denomina manto glial periférico de Fuchs o de Greff. Las características de este manto son semejantes a las de las otras limitantes anteriormente descritas en el nervio (37,38,41). Asimismo, se ha descrito la existencia de invaginaciones en la membrana plasmática de los astrocitos subpiales, denominadas vesículas caveolares, así como microfilamentos contráctiles. Unos y otros tienen por función iniciar la contracción del manto limitante periférico como respuesta a las tensiones que puedan producirse en las vainas meníngeas del nervio (84). La irrigación sanguínea de la región retrolaminar varía según se trate de la zona más central o más periférica del nervio. Así, la zona axial o central se nutre fundamentalmente de los vasos procedentes de la ACR, (fig. 2-8D,E), mientras que la zona periférica recibe las ramas piales procedentes de la ACR (fig. 29D), o de vasos derivados del sistema ciliar desde el círculo de Zinn-Haller y la coroides peripapilar (fig. 29C). En las zonas más posteriores existe un aporte adicional desde las ramas de la arteria oftálmica y sus colaterales (31,39,42,46) (fig. 2-9E). VASCULARIZACIÓN DEL NERVIO ÓPTICO Durante el último cuarto de siglo, se han acumulado cada vez más evidencias acerca de los trastornos isquémicos de la CNO, como causas frecuentes de ceguera o de pérdida severa de la visión en los humanos (85). Por ejemplo, la NOIA constituye una afección visual frecuente, grave e incapacitante, sobre todo en las edades medias y avanzadas (85). Asimismo, existen numerosos datos a favor del importante papel que la insuficiencia vascular a nivel de la CNO juega en la patogenia de la neuropatía óptica glaucomatosa (86-88). Ello ha despertado un interés enorme hacia el tema de la circulación de la CNO, en condiciones tanto fisiológicas como patológicas, ya que la adecuada comprensión de su naturaleza altamente compleja in vivo es un requisito indispensable para entender la patogenia de todas estas afecciones. Se ha acumulado gran cantidad de literatura sobre este tema, que hemos investigado desde el punto de vista anatómico, histológico y experimental desde 1955, y que hemos revisado recientemente (89) (S. S. H.). A continuación presentamos un resumen sobre la irrigación sanguínea de la CNO, esencialmente basado en nuestros amplios estudios al respecto. Este tema ha sido desarrollado con extensión en otras ocasiones (44,89-95). De acuerdo con su irrigación arterial, el nervio óptico consta de dos porciones, una porción anterior, la CNO, y otra porción posterior. Irrigación Arterial de la Cabeza del Nervio Óptico (fig. 2-10) Con arreglo a la división anatómica de la CNO en las 4 partes previamente descritas, la vascularización se produce del modo siguiente (27,96) (fig. 2-10A): Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 27 Figura 2-10. Representación esquemática de la irrigación sanguínea de: (A) la CNO y (B) el resto del nervio óptico. (A reproducida de Hayreh (44); B modificada de Hayreh SS. Trans Am Acad Ophthalmol Otolaryngol 1974; 78: OP240-54). A = aracnoides; ACP = arteria ciliar posterior; ACR = arteria central de la retina; AR = arteriola retiniana; C = coroides; CFNR = capa de fibras nerviosas; D = duramadre; DO = disco óptico; E = esclerótica; ES = espacio subaracnoideo; LC = lámina cribosa; NO = nervio óptico; P = piamadre; R = retina; RC = ramas colaterales; RP = región prelaminar; VCR = vena central de la retina. 28 Neuropatías ópticas: diagnóstico y tratamiento 1. CFNR: irrigada sobre todo por las arteriolas retinianas, aunque en algunos ojos la región temporal recibe un aporte procedente del sistema ACP, de la región prelaminar profunda. Cuando existe una arteria ciliorretiniana (o más raramente una diminuta arteria ciliopapilar), irriga un sector correspondiente de esta capa. 2. Región prelaminar: irrigada por la circulación ACP, casi siempre a través de ramas centrípetas de la coroides peripapilar (44,89,92,95) (figs. 2-11, 2-12). La ACR no aporta ramas a esta región. 3. Región de la lámina cribosa: irrigada por ramas centrípetas de las ACPs cortas, ya sea directamente o a través del llamado círculo arterial de Zinn-Haller. Contrariamente a la creencia generalizada, el círculo de Zinn-Haller falta en algunos ojos y en otros está incompleto (89). La ACR tampoco aporta ramas a esta región. 4. Región retrolaminar: puede estar irrigada por dos sistemas vasculares: • Sistema periférico centrípeto: presente en todos los nervios ópticos, aporta la irrigación principal para esta región. Se halla formado por ramas piales recurrentes procedentes de la coroides peripapilar y del círculo de Zinn-Haller (o en su ausencia, de las ACPs cortas), con un aporte adicional de ramas piales de la ACR y de otras arterias orbitarias (91,97,98). Los vasos piales dan origen a ramas centrípetas, que recorren los tabiques conectivos del nervio. • Sistema axial centrífugo: presente en un 75% de los ojos y formado por ramas inconstantes procedentes de la porción intraneural de la ACR (90,97,98). A partir de la descripción precedente se hace evidente que el principal aporte sanguíneo para la porción intraocular del nervio óptico procede de la circulación ACP, a través de la coroides peripapilar y de las ACPs cortas (o bien del círculo de Zinn-Haller). Nuestros estudios con AGF han demostrado una irrigación sectorial de la CNO, en concordancia con la distribución segmentaria de la circulación ACP (89,99), lo cual permite explicar la pérdida visual también sectorial en la NOIA y en otras afecciones isquémicas de la CNO. Existe la impresión general de que la CNO posee un patrón de irrigación sanguínea virtualmente idéntico para todos los ojos, que ofrecería siempre una explicación para las posibles lesiones isquémicas. Se trata de un error fundamental, ya que los trabajos que hemos publicado desde 1955 (89,94,95) han demostrado claramente importantes variaciones interindividuales en la irrigación de la CNO. Por un lado, las variaciones sobre el patrón anatómico normal de la irrigación arterial, representado en la fig. 2-10, son sustanciales (44,89,95) y, de acuerdo con nuestro estudio anatómico sobre 100 muestras humanas, no existen dos patrones idénticos, ni siquiera entre los dos ojos de un mismo individuo (89,97,98). Por otro lado, las variaciones en el patrón de la circulación ACP, son también notables, condicionan una distribución muy variable de las mismas en la CNO y ejercen una influencia profunda sobre los trastornos isquémicos de la CNO y sus manifestaciones. Este conjunto de variaciones se puede resumir del modo siguiente(89,94,95): 1. Variaciones en el número de ACPs que irrigan un ojo: a partir de la arteria oftálmica se originan directamente entre 1 y 5 (generalmente 3) ACPs (89,93, 95,100), que reciben la denominación de mediales o laterales, según penetren el globo ocular por dentro o por fuera del nervio óptico. 2. Irrigación de las ACPs in vivo: nuestros estudios experimentales (93,95,99,101,102) y clínicos (94,103-108) han demostrado que las ACPs y sus ramas tienen una distribución segmentaria, tanto en la coroides como en la CNO. Las ACPs laterales y mediales irrigan las partes correspondientes de la coroides y de la CNO (figs. 2-13, 2-14), si bien presentan variaciones interindividuales significativas (89,94,95,102,103,106-108). Así, la ACP medial puede irrigar toda la CNO (figs. 2-13, 2-14E), o no tomar parte en su irrigación (fig. 2-15D), con numerosas posibilidades intermedias entre estos dos extremos Figura 2-11. AGF de un OD con NOIA-NA que muestra, durante la fase arteriovenosa retiniana precoz, una ausencia de llenado en la zona temporal de la coroides peripapilar y del disco óptico adyacente, así como de la mitad superior del territorio frontera coroideo. (Reproducida de Hayreh (94)). Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 29 (figs. 2-13, 2-14, 2-15), mientras que la ACP lateral irriga la zona de la CNO no irrigada por la ACP medial. Cuando hay más de una ACP medial o lateral, cada una de ellas puede irrigar sólo a un sector, y si existe una ACP superior, irriga a la zona superior correspondiente (fig. 2-16). 3. Territorios frontera en la distribución de las ACPs y su localización (89,94,108): cuando un tejido es irrigado por 2 ó más arterias terminales, el límite entre sus zonas de distribución se denomina «territorio frontera». La significación de este último se pone de relieve si desciende la presión de perfusión en el lecho vascular de una o más arterias terminales, ya que al ser un Figura 2-12. AGF de un OD con NOIA-A que muestra, durante la fase venosa retiniana, una ausencia total de llenado de la coroides peripapilar y del disco óptico. (Reproducida de Hayreh (103)). Figura 2-13. AGF de un OI con NOIA-A y oclusión arterial ciliorretiniana asociada que muestra, durante la fase arteriovenosa retiniana precoz, un llenado normal de la ACR y de la coroides irrigada por la ACP lateral, pero sin llenado de la coroides ni del disco óptico, irrigados por la ACP medial, así como de la arteria ciliorretiniana. (Reproducida de Hayreh (106)). Figura 2-14. AGFs de 5 ojos con NOIA, que muestran los patrones de distribución de las ACPs medial y lateral en la coroides y en la CNO. (A,B,C) Llenado normal en la ACP lateral y ausente en la ACP medial, del OD (A,B) y del OI (C). (D,E) Llenado normal en la ACP medial y ausente en la ACP lateral, del OD en ambos casos. (A,B,C,D reproducidas de Hayreh (94)). 30 Neuropatías ópticas: diagnóstico y tratamiento territorio comparativamente menos vascularizado, resulta más vulnerable a la isquemia. Dado que las ACPs y sus ramas son arterias terminales in vivo (99,101,102), hay territorios frontera entre ellas (108) (fig. 2-15), y cuando dichas arterias son 2, medial y lateral, la localización de los mismos presenta variaciones interindividuales notables, como ilustra la figura 2-17 (89,94,99,108). Si existen 3 ó más ACPs, la situa- Figura 2-15. Localizaciones del territorio frontera. AGFs de 4 ojos con NOIA, que muestran las diferentes localizaciones de dicho territorio (franjas oscuras verticales) en relación con el disco óptico. (A) OD con territorio frontera de situación temporal respecto al disco. (B) OD con territorio frontera que ocupa la parte temporal del disco y la coroides peripapilar adyacente. (C) OI con el disco óptico situado en el centro del territorio frontera; (D) OI con territorio frontera que ocupa la parte nasal del disco y la coroides peripapilar adyacente. (A reproducida de Hayreh (87) y las restantes de Hayreh (94)). Figura 2-16. AGF de un OD normal, que muestra durante la fase arterial retiniana precoz un llenado del sector superior del disco óptico, irrigado por la ACP superior. (Reproducida de Hayreh (94)). Figura 2-19. AGFs durante la fase arteriovenosa retiniana precoz. (A) En un OD con NOIA-A se observa una ausencia de llenado limitada a la mitad superior del territorio frontera y del disco óptico. (B) En un OD con glaucoma de baja tensión se constata una falta de llenado limitada a la mitad inferior del territorio frontera y del disco óptico (Reproducidas de Hayreh (94)). Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 31 Figura 2-17. Representación diagramática de algunas localizaciones de los territorios frontera (zonas sombreadas) entre las ACPs medial y lateral en ojos humanos. (Arriba e izquierda) La zona sombreada es aquélla dentro de la cual puede estar situado el territorio frontera. Los 5 diagramas restantes son ejemplos de variaciones en la localización. La fig. 2-15 muestra AGFs de algunas de estas localizaciones del territorio frontera. (Reproducidas de Hayreh SS. En Bernstein EF, ed. Amaurosis fugax. New York: Springer-Verlag 1988: 1-23). Figura 2-18. Representaciones diagramáticas sobre posibles localizaciones de los límites entre los territorios de diversas ACPs. (A) Con 2 ACPs, una medial y la otra lateral. (B-D) Con 3 ACPs en diferentes combinaciones: (B,C) tienen 1 ACP medial y 2 laterales; (D) tiene 1 ACP lateral y 2 mediales; (E) tiene 4 ACPs, 2 mediales y 2 laterales. (Reproducidas de Hayreh SS. En Lambrou GN, Greve EL, eds. Ocular blood flow in glaucoma: means, methods and measurements. Amstelveen. Kugler & Ghedini 1989: 3-54. 32 Neuropatías ópticas: diagnóstico y tratamiento ción de estos territorios varía según el número y la distribución de las ACPs, como muestran el diagrama de la figura 2-18, y las AGF de la figura 2-19A,B. La localización de un territorio frontera es un tema de importancia extrema para la interpretación de los trastornos isquémicos de la CNO. Ello se debe a la especial vulnerabilidad de la parte de CNO localizada en el mismo si desciende la presión de perfusión en las ACPs, tal como hemos demostrado (89,94,108). 4. Diferencia de flujo sanguíneo en las distintas ACPs y ACPs cortas: nuestras investigaciones clínicas y experimentales han revelado que la presión arterial media en las diversas ACPs puede variar en los individuos tanto sanos como enfermos (94). Cuando se produce un descenso en la presión de perfusión, el lecho vascular dependiente de una arteria se puede afectar de modo más precoz e intenso que el de las restantes. Irrigación Arterial de la Parte Posterior (fig. 2-10B) Esta parte del nervio óptico posee un sistema vascular periférico y axial. 1. Sistema periférico centrípeto: se halla siempre presente y está formado por los vasos piales, que a su vez proceden de arterias colaterales originadas en la arteria oftálmica y en algunas de sus ramas intraorbitarias (44,91,93). 2. Sistema axial centrífugo: está formado por unas ramas, observadas en el 75% de los casos (90,91,97,98), y procedentes de la ACR, cuya contribución se puede extender 1-4 mm por detrás de su lugar de penetración en el nervio óptico. Drenaje Venoso Las porciones intraocular e intraorbitaria del nervio óptico son drenadas sobre todo por la VCR (fig. 2-10B). El drenaje de la región prelaminar se efectúa también hacia las venas coroideas peripapilares, a cuyo nivel la VCR presenta una comunicación potencial con la circulación coroidea. Dicha comunicación adquiere relevancia en las oclusiones de la VCR posteriores respecto a la lámina cribosa, por la apertura y dilatación de canales colaterales denominados vasos óptico-ciliares, que ayudan a drenar la sangre retiniana. No existe homónimo venoso para el círculo de Zinn-Haller. FISIOLOGÍA DEL NERVIO ÓPTICO. TRANSPORTE AXONAL Los axones y sus arborizaciones terminales carecen de ribosomas, las organelas celulares en donde se producen las proteínas, por lo que deben obtener su aporte proteico a partir del soma neuronal. Además, los terminales axonales requieren mitocondrias y vesículas sinápticas, ya que las neuronas son células secretoras. Las proteínas, las vesículas sinápticas y las mitocondrias se forman en el soma celular y se transportan a lo largo del axón hacia los terminales axonales mediante el transporte axonal anterógrado. Por otro lado, algunos componentes de los terminales axonales, como organelas, vesículas y otras sustancias, son enviados al soma celular para ser reciclados después de su uso. Estos componentes son transportados por los axones hasta el soma neuronal a través del transporte axonal retrógrado. El transporte axonal es necesario, no sólo para el mantenimiento de una fisiología axonal normal, sino también durante el proceso del desarrollo nervioso o después de que se produzca un daño axonal. Ello posibilita la llegada de las moléculas necesarias para la supervivencia neuronal, a fin de regular la respuesta neuronal al microambiente y para la elongación y regeneración neuronales. Así, los axones neoformados requieren la presencia en el extremo final del axón de elementos estructurales, tales como membranas, microtúbulos y neurofilamentos. En contrapartida, el transporte axonal puede favorecer también la patología neuronal, ya que algunos virus infectan a las neuronas y algunas toxinas neurotropas producen sus efectos sobre las neuronas mediante su incorporación al transporte axonal. El transporte anterógrado y retrógrado no es exclusivo de los axones, ya que las dendritas reciben también sustancias procedentes del soma neuronal y envían sustancias destinadas al mismo (109). Sin embargo, el transporte dendrítico ha sido menos estudiado que el transporte axonal debido a dificultades técnicas, al ser las dendritas mucho más pequeñas y menos accesibles que los axones. Aunque la existencia del transporte axonal se conoce desde comienzos del siglo XX (110), no fue demostrada hasta 1948, gracias al trabajo publicado por Weiss y Hiscoe. Según documentaron estos autores, cuando se ligan los axones, se produce en el segmento proximal de la ligadura un engrosamiento, que inter- Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico pretaron como la acumulación del material transportado desde el soma al terminal axonal (111). Sin embargo, las técnicas para el estudio de este transporte no se desarrollaron hasta finales de la década de los 60, cuando la utilización de aminoácidos radioactivos y su visualización con técnicas de autorradiografía permitió investigar el transporte anterógrado. Así, los aminoácidos inyectados cerca del soma neuronal son incorporados a las proteínas del mismo y, con las mencionadas técnicas, es posible observar el desplazamiento de las proteínas hacia los terminales axonales (112). Esta técnica se puede utilizar para medir la velocidad del transporte, pero también para documentar las proyecciones de diferentes grupos neuronales. Con el fin de estudiar el transporte axonal en las CGR, se pueden inyectar aminoácidos radioactivos en el vítreo, un procedimiento que practicó Grafstein en 1967 en el carpín dorado. La autora constató que dichos aminoácidos se incorporaban a proteínas en el soma de las mencionadas células y eran después transportados a lo largo del axón. Ello le llevó a descubrir que existían dos tipos de transporte axonal anterógrado: uno lento, que se conocía hasta entonces, y otro rápido, que se desplazaba a velocidad mucho mayor (112). El transporte retrógrado se documentó más tarde, aunque desde 1941 se sabía que el virus de la polio es transportado por los axones neuronales desde el músculo al soma neuronal (113). Fue en 1971 cuando Kristensson y Olsson constataron que la peroxidasa de rábano era transportada de forma retrógrada desde el lugar de su inyección en un músculo hasta el soma de las motoneuronas que lo inervaban en la médula espinal (114). En la actualidad se conocen dos tipos de transporte axonal anterógrado: el lento y el rápido, así como un tipo de transporte axonal retrógrado, que es rápido (115,116). El transporte es, en cualquier caso, activo y requiere energía (ATP, adenosina trifosfato), que debe ser suministrada a lo largo de todo el axón (115). 33 dos por una proteína denominada quinesina (109). Existen evidencias de que el transporte anterógrado rápido requiere varios tipos de quinesinas y no depende sólo de éstas, sino también de otras moléculas, como la actina y la miosina (109). Este tipo de transporte axonal se observa para otros trazadores neuronales y sustancias, aparte de los aminoácidos radiactivos, como son la toxina colérica B (118) o el virus del herpes simple (119). Transporte Axonal Anterógrado Lento Esta variante, también denominada flujo axoplásmico, transporta los componentes del citoesqueleto y proteínas solubles (109). Es posiblemente un transporte más complicado que el rápido, ya que tiene al menos dos componentes (lento y rápido) que se distinguen, no solamente por la velocidad a la que se realizan, sino también por la naturaleza de las sustancias transportadas. El componente lento, llamado también SCa, tiene una velocidad de 0,3 a 3 mm/día y 3/4 partes de las sustancias que transporta son las subunidades de los neurofilamentos y dos subunidades de los microtúbulos neuronales (109,115,116). El componente rápido, llamado también SCb, dobla en velocidad al componente lento (2-8 mm/día (116)) y transporta materiales muy variados. Así, la sustancia más abundante en este componente, que es la actina (integrante de los microfilamentos) representa solamente entre un 2 y un 4% de las proteínas contenidas en él (115). El componente rápido también transporta otras proteínas, como la clatrina y la calmodulina, y asimismo enzimas del metabolismo intermediario (109,115). Los mecanismos moleculares responsables del transporte axonal lento son todavía desconocidos (116). Transporte Axonal Retrógrado Transporte Axonal Anterógrado Rápido Sirve para transportar organelas citoplásmicas membranosas, sobre todo vesículas sinápticas y mitocondrias (115), aminoácidos, proteínas, glicoproteínas y lípidos (117), y su velocidad media en los mamíferos es de 50 a 400 mm/día (115,116). Estas organelas se desplazan a lo largo de los microtúbulos del axón empujadas por unos brazos que presentan dichos microtúbulos, forma- No se conoce con exactitud su composición, pero hasta el momento, se sabe que al menos transporta mitocondrias, vesículas sinápticas, algunas proteínas, virus y factores neurotróficos (109). Este transporte tiene una velocidad similar al transporte anterógrado rápido y se realiza por una proteína que también forma unos brazos en los microtúbulos, denominada dineína (109,112). Existen distintos tipos de dineínas en las neuronas, pero no está claro si se utilizan varios de 34 Neuropatías ópticas: diagnóstico y tratamiento ellos para el transporte o si diferentes neuronas utilizan diferentes dineínas (109). Hay también evidencias a favor de una posible implicación de la quinesina, junto con la dineína, en el transporte retrógrado (109). Diversas sustancias, puestas en contacto con los axones o con los terminales axonales, son captadas por éstos mediante endocitosis y transportadas retrógradamente. Entre ellas están algunos trazadores neuronales, virus neurotropos (herpes, polio y rabia), toxinas bacterianas (botulínica, tetánica y colérica), neurotoxinas y factores de crecimiento, como el de crecimiento nervioso (NGF) (112,115). Por este motivo, las sustancias mencionadas son muy utilizadas en Neurobiología para determinar el origen celular de las proyecciones axonales. Identificacion de Grupos Neuronales y sus Proyecciones: Trazadores Neuronales Cuando se aplican diversos tipos de sustancias cerca de los cuerpos neuronales, éstas son incorporadas al soma celular y, por medio del transporte axonal anterógrado, alcanzan los terminales nerviosos, marcando de esta forma la proyección axonal (fig. 2-20). De forma recíproca, otras sustancias aplicadas en los terminales axonales o en los axones lesionados, se transportan retrógradamente hacia el soma neuronal, lo que permite identificar el origen celular de la proyección axonal (fig. 2-21). En la actualidad se conocen muchas sustancias con las propiedades descritas, por lo que se denominan trazadores neuronales o neurotrazadores, y se utilizan para investigar el transporte axonal y la anatomía de vías nerviosas en condiciones normales o experimentales. La elección del trazador neuronal, anterógrado o retrógrado, que se va a utilizar en una determinada situación experimental depende del objetivo que persigamos. El tejido puede examinarse a microscopía óptica o electrónica, si bien ésta última sólo permite observar determinados marcadores. Además, hay trazadores que son capaces de atravesar las sinapsis y otros que no lo son. También es necesario combinar a veces las técnicas de marcaje neuronal y las de inmunocitoquímica, con las cuales no todos los trazadores son compatibles (120). Si la inmunocitoquímica se va a realizar con anticuerpos marcados con fluorescencia, es preferible utilizar un trazador fluorescente, para poder observar ambos marcajes a la vez en el microscopio de fluorescencia (121). Los trazadores neu- ronales fluorescentes fueron introducidos en la década de los 70, son en la actualidad muy numerosos (121) y se utilizan para estudios de transporte tanto anterógrado como retrógrado. No obstante, actualmente prevalece su uso para identificar de forma retrógrada el origen de las poblaciones neuronales que inervan un fascículo nervioso o una región cerebral en concreto. Transporte Axonal en la Regeneración Neuronal El transporte axonal adquiere una importancia capital durante el desarrollo y los procesos de regeneración axonal (ver capítulo 17), de modo que las dos variantes de transporte son imprescindibles a fin de que se produzca la elongación de los axones. Así, el transporte anterógrado es necesario para hacer llegar al cono de crecimiento los materiales que la citoarquitectura de los nuevos axones precisa. Por su parte, el transporte retrógrado se requiere a fin de hacer llegar al soma neuronal sustancias procedentes del lugar de crecimiento axonal esenciales para la supervivencia neuronal o para modificar la respuesta neuronal a su microambiente. Gracias al transporte axonal retrógrado numerosos factores neurotróficos llegan desde los terminales axonales hasta el soma neuronal, con el fin de ejercer sus funciones neurotróficas a nivel del núcleo neuronal (122,123). Diversas investigaciones han documentado que estas sustancias se producen normalmente en los territorios de inervación y se transportan hacia el soma neuronal a lo largo de toda la vida, posiblemente porque contribuyen así a la funcionalidad y la supervivencia de las neuronas (122,124). Se ha postulado que cualquier lesión en el SNC que interrumpa el transporte axonal causa la muerte de las neuronas origen de los axones lesionados porque interrumpe el transporte axonal retrógrado de factores neurotróficos desde los territorios de proyección axonal al soma neuronal. Existen varias familias de factores neurotróficos y, entre éstos, se considera que las neurotrofinas son las más importantes para las CGR de los mamíferos (ver capítulo 17). De esta familia cabe destacar el NGF, el factor neurotrófico derivado del cerebro (BDNF), la neurotrofina 3 (NT-3) y la neurotrofina 4/5 (NT-4/5) (123). Las neurotrofinas tienen dos receptores en la membrana neuronal: el de baja afinidad, también llamado p75, y el de alta afinidad, también llamado Trk, por ser una tirosin-quinasa. Para que una neurotrofina sea transportada de forma retrógrada, es Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 35 Figura 2-20. Transporte anterógrado de la subunidad B de la toxina colérica (CTB) por las células ganglionares de la retina de la rata adulta. Cuatro días después de inyectar la toxina en el vítreo del ojo izquierdo, se obtuvieron cortes seriados del mesencéfalo, que se procesaron con técnicas inmunohistoquímicas para identificar la CTB, y en la micrografía aparece una sección frontal. Se observa la típica distribución de los terminales axonales de la retina del ojo izquierdo en el colículo superior: una intensa inmunorreactividad en las capas visuales del colículo contralateral (derecho) y la presencia de algunas fibras en las capas visuales del colículo ipsilateral (izquierdo). Figura 2-21. Transporte retrógrado de Fluorogold® (FG) en el sistema visual de la rata adulta, demostrado mediante una micrografía de un montaje global de una retina 7 días después de aplicar FG en ambos colículos superiores. Por toda la retina se encuentran distribuidas células ganglionares marcadas con FG. La micrografía se obtuvo en microscopio de fluorescencia equipado con una platina motorizada, una cámara de alta resolución y un sistema de análisis de imagen. El polo superior de la retina se encuentra entre la una y las dos horas. Figura 2-22. Compresión de los axones de las células ganglionares en la retina de la rata Royal College of Surgeons (RCS) por vasos sanguíneos. Los axones se encuentran marcados en verde con un anticuerpo contra los neurofilamentos y un anticuerpo secundario unido a fluoresceína y los vasos sanguíneos en negro, mediante la inyección de peroxidasa de rábano en la vena femoral. Puede observarse la alteración del transporte axonal que provoca una distensión de los axones en las zonas de compresión. 36 Neuropatías ópticas: diagnóstico y tratamiento necesario que se una a sus receptores de alta afinidad en la membrana neuronal. Tras esta unión, se piensa que ambos son secuestrados por un proceso de endocitosis y transportados al soma neuronal, donde la neurotrofina, y quizás el receptor, ejercen sus funciones (109,122,123). Sin embargo, existe evidencia de que las neuronas responden a las neurotrofinas ya antes de que el complejo Trkneurotrofina haya llegado al soma neuronal, por lo que se ha propuesto que la señal neurotrófica puede tener dos fases. La primera, más rápida, sería independiente del transporte axonal retrógrado, y la segunda, más tardía, estaría mediada por dicho transporte (109). Recientemente se ha documentado también la posibilidad de un transporte anterógrado para las neurotrofinas en los axones (125). La gran importancia del transporte axonal para la regeneración neuronal se debe a que el crecimiento del axón depende de la llegada de sustancias metabólicas y estructurales imprescindibles al cono de crecimiento, y quizás también de sustancias que regulan esta regeneración. Para el estudio del transporte axonal en la regeneración neuronal se ha utilizado ampliamente el sistema visual, pues presenta múltiples ventajas de tipo técnico para la realización de este tipo de investigaciones. Por ejemplo, una simple inyección de aminoácidos radioactivos en el vítreo produce el marcaje selectivo en etapas sucesivas de las proteínas transportadas por los axones de las CGR, y de los terminales retinianos en el cerebro (fig. 2-20). La capacidad de regeneración de las CGR varía mucho de unas especies animales a otras. Así, la sección del nervio óptico, en los peces y en anfibios no produce la muerte de dichas células (126,127), las cuales regeneran sus axones, restableciendo las conexiones sinápticas y la función visual del animal, mientras que en los mamíferos acarrea la muerte masiva de las mismas (128,129). En los mamíferos, la aposición experimental de un injerto de nervio periférico al munón del nervio óptico seccionado, ha documentado que las CGR son capaces de regenerar sus axones dentro de los injertos a largas distancias. Además, si el extremo distal del injerto del nervio periférico se coloca en contacto con los territorios de inervación normales de dichas células, los axones regenerados pueden extenderse entre ellos y establecer conexiones sinápticas (130), mediando incluso comportamientos visuales simples, como el reflejo fotomotor (131). Debido a la superior capacidad de regeneración del sistema visual en los peces con respecto a los mamíferos, muchos de los estudios de transporte axonal en regeneración neuronal se han realizado con el pez dorado (126). En este animal, se ha documentado un aumento, tanto de la cantidad de sustancias que son objeto de transporte axonal anterógrado lento y rápido, como de la velocidad de éstos durante la regeneración de las CGR (126). Una de las proteínas cuyo transporte aumenta más durante la regeneración del sistema visual del pez dorado y del sapo recibe la denominación de «proteína asociada al crecimiento-43» (GAP-43). Esta proteína se vehiculiza por el transporte anterógrado rápido y es posible que forme parte del retículo endoplasmático liso, estructura muy abundante en los conos de crecimiento, y que puede jugar una función específica para la iniciación o regulación de la regeneración axonal (126,132). También se cree que es importante en la regeneración neuronal el transporte anterógrado lento, ya que su velocidad se asemeja mucho a la velocidad de regeneración axonal en varios modelos experimentales (126,133,134). Además, mediante esta modalidad se transporta actina y tubulina, proteínas necesarias para la remodelación de los conos de crecimiento. En mamíferos, el transporte axonal anterógrado lento está relacionado con la regeneración, y se ha documentado que cuando se secciona el nervio óptico, dicha modalidad de transporte disminuye (135). En cambio, si una vez seccionado el nervio se sustituye su porción distal por un injerto de nervio periférico y los axones de las CGR regeneran a lo largo de estos injertos, aumenta la velocidad de transporte de neurofilamentos y tubulina (136). Transporte Axonal en las Enfermedades Oculares Se han documentado alteraciones del transporte axonal en los microinfartos retinianos y en varias enfermedades de la retina y del nervio óptico, tales como obstrucciones arteriales y venosas, papiledema, hipotonía ocular, neuropatías ópticas diversas y glaucoma (137,138). Los microinfartos («exudados algodonosos») aparecen en varias afecciones retinianas, como la retinopatía hipertensiva, y en las neuropatías ópticas anteriores. Son consecuencia de una obstrucción arteriolar (138-140) y corresponden histológicamente a axones de las CGR que se encuentran engrosados debido a una detención del transporte axonal en la zona infartada. La obstrucción de la ACR, de sus ramas o de una arteria ciliorretiniana produce una detención del transporte axonal en los axones de las CGR que se encuen- Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico tran en la zona del infarto (138). En la obstrucción de la VCR se observa también a veces un edema del disco óptico, que se ha atribuido a una obstrucción simultánea de una arteria retiniana con la consiguiente interrupción del transporte axonal (138, 141). En el papiledema por hipertensión intracraneal (HTI) y en todas las enfermedades que cursan con edema de papila, como la papilitis, la NOIA y la hipotonía ocular, existe una interrupción del transporte axonal (137). Sin embargo, su mecanismo es todavía debatido en el caso del papiledema (ver capítulo 8). Así, mientras Hayreh (142) postula que la interrupción del transporte axonal se debe a una compresión mecánica de los axones, otros autores han atribuído dicha interrupción a una isquemia de la CNO secundaria al papiledema (143,144). La elevación aguda o crónica de la PIO en el glaucoma, tanto humano como animal, se traduce por una detención del transporte axonal retrógrado y anterógrado (145147). Se ha documentado también que existe una alteración del transporte a nivel de la lámina cribosa en animales y humanos con presiones intraoculares normales, por lo que se ha sugerido su posible implicación en la patogenia del glaucoma de baja tensión (148). Sin embargo, no se conoce todavía la causa de la interrupción del transporte axonal en todos estos casos, por lo que las dos teorías, mecánica y vascular, acerca del daño axonal de origen glaucomatoso permanecen vigentes (145,149). Otras enfermedades oculares en las que se produce una afectación del transporte axonal son las neuropatías ópticas, de naturaleza compresiva y desmielinizante (137,138), así como las hereditarias (150), nutricionales (150), metabólicas (150,151) e isquémicas posteriores. Las afecciones oftalmológicas antes mencionadas, que cursan con alteraciones del transporte axonal producen a largo plazo una degeneración secundaria hasta la muerte de las CGR (149). Posiblemente, esta degeneración retrógrada sea la consecuencia de una interrupción del transporte axonal retrógrado que, como hemos visto, vehiculiza factores de crecimiento necesarios para la supervivencia neuronal (122-124,149). En el caso del BDNF, un factor neurotrófico que aumenta la supervivencia de las CGR de las ratas adultas tras la sección del nervio óptico (152,153), esta forma de transporte queda bloqueada cuando se les incrementa la PIO (147). Sin embargo, todavía no se ha documentado una relación directa entre el bloqueo del transporte axonal y la muerte de dichas células en ninguna de las mencionadas afecciones. Reciente- 37 mente se ha comprobado que en ratas y ratones con degeneración hereditaria de los fotorreceptores retinianos se produce una compresión intrarretiniana de los axones de las CGR (fig. 2-22), causante de una detención del transporte axonal y muerte celular (154156). Dicha detención sería puramente mecánica, como la que sobreviene en algunas neuropatías periféricas compresivas y en la estenosis medular. Por ello, se ha establecido una distinción entre dos clases de muerte neuronal, la axogénica y la somagénica, según cual sea el lugar de la neurona en donde se inicia el daño letal (157). Las enfermedades que alteran el transporte axonal serían causantes de muerte axogénica, aunque no se sabe con certeza si son capaces con el tiempo de producir, además de dicha alteración, una sección axonal responable en última instancia de la muerte celular (154-157). Por otra parte, estas enfermedades podrían conllevar además alteraciones del microambiente neuronal, tales como producción de radicales libres, aminoácidos excitotóxicos, o de otros compuestos, con capacidad de causar directamente la muerte somagénica de las CGR (149). Por último, existen afecciones en las que se produce un bloqueo del transporte axonal y, al menos durante cierto tiempo, no hay pérdida de la visión ni muerte de CGR, como es el caso del papiledema por HTI. Ello es debido a que la afectación del transporte axonal no influye sobre la conducción de los impulsos nerviosos. Sin embargo, existe evidencia de que el bloqueo del transporte axonal, no solamente produce la muerte neuronal a largo plazo, sino que también altera la funcionalidad de las neuronas a corto plazo. Así, cuando se aplica colchicina (sustancia bloqueante del transporte axonal) en los axones de neuronas del sistema nervioso periférico, se observan cambios degenerativos en los somas neuronales y una disminución de sus aferencias sinápticas, con depresión de la conducción nerviosa (158). Estos cambios se han comparado con los que se producen tras la sección de los axones e ilustran la importancia que para la funcionalidad neuronal tiene el transporte axonal. Además, se ha documentado recientemente que este último puede ser necesario para el transporte a través de canales iónicos en neuronas normales (159), con posible implicación en la apertura de los mismos del citoesqueleto neuronal (160). Todo ello permite entrever la trascendencia que el transporte axonal tiene también para la actividad eléctrica de las neuronas. 38 Neuropatías ópticas: diagnóstico y tratamiento HISTOPATOLOGÍA DE LAS NEUROPATÍAS ÓPTICAS Las características histológicas de los procesos patológicos específicos que afectan al nervio óptico (v. gr.: arteritis temporal, infiltraciones, tumores, etc.) se estudiarán en los capítulos correspondientes. En el presente apartado se describirán, a modo de introducción, los hallazgos anatomopatológicos que se pueden correlacionar con tres categorías generales de alteraciones oftal- Figura 2-23. Histopatología de un nervio óptico hipoplásico. Sección longitudinal, en la que se observa el anillo externo, determinado por el límite normal entre la esclerótica y la lámina cribosa. El anillo interno lo produce la extensión anormal de la retina y el epitelio pigmentario sobre la mencionada lámina. (Caso del Dr. W. Spencer. California). Figura 2-24. Elevación nasal del disco óptico en un ojo miope (A). La papila presenta un aspecto elevado y borroso en su sector nasal, que puede ser confundido con una elevación adquirida. Disco óptico pequeño y repleto en un ojo hipermétrope (B). La papila, de pequeño tamaño, presenta una borrosidad difusa de sus márgenes, que puede ser confundida con un edema adquirido. moscópicas del disco óptico, a saber, las malformaciones papilares, el edema de la papila y la atrofia óptica. Malformaciones Papilares Las diversas formas de hipoplasia del nervio óptico se caracterizan desde el punto de vista histológico por una disminución del número de CGR y de sus axones, las fibras nerviosas retinianas (161), sin evidencia de degeneración axonal (162). Existe, en consecuencia, una reducción del diámetro de la sustancia del nervio, lo que motiva una estructura en doble anillo, por el doble contorno, papilar y peripapilar (fig. 2-23). Tanto los elementos mesodérmicos y del tejido glial de sostén, como la ACR y la VCR se hallan íntegros (ver capítulo 6). En la miopía se produce una elevación nasal del disco óptico (fig. 2-24A), debido a la protrusión de las fibras nerviosas a este nivel, que condiciona la dirección oblicua experimentada por el nervio al atravesar el canal escleral. Es posible asimismo observar una ausencia de epitelio pigmentario retiniano y de coroides en una zona semilunar temporal al disco («cono miópico»). En la hipermetropía el disco óptico es pequeño y repleto, es decir, de dimensiones reducidas y con borrosidad de sus márgenes (163) (fig. 2-24B), debido a la aglomeración de las fibras nerviosas en un canal escleral de diámetro inferior al normal. Una situación opuesta es la que se produce en la megalopapila, con aumento del tamaño del disco óptico y de la excavación papilar (fig. 2-25). La elevación nasal de la papila y el disco óptico pequeño y repleto están incluidas, junto a los cuerpos hialinos intrapapilares, en el conjunto de alteraciones oftalmoscópicas que reciben la denominación de seudopapiledema (ver capítulo 6). Ello se debe a la posibilidad que tienen todas ellas de ser confundidas con el edema papilar verdadero. Por su parte, la megalopapila y otras excavaciones papilares colobomatosas son designadas como seudoglaucoma, ya que deben ser diferenciadas de la excavación papilar producida por el glaucoma crónico (ver capítulo 5). Edema de la Papila Se denomina edema papilar a la elevación adquirida del disco óptico consecutiva a una interrupción del transporte axonal en el nervio, cualquiera que sea Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico su causa (isquemia, compresión, hipotonía ocular, etc.). El término papiledema se reserva para los casos de edema papilar secundario a un aumento de la presión intracraneal. Por su parte, se designan como papilitis aquellas elevaciones adquiridas del disco óptico producidas a consecuencia de procesos inflamatorios. El edema agudo de la papila se caracteriza desde el punto de vista anatomopatológico por un aumento de volumen del tejido nervioso a nivel de la región prelaminar con alteraciones secundarias en la retina peripapilar (164) (fig. 2-26). Los estudios de Tso, por medio de la microscopía electrónica, demostraron que estas modificaciones se deben sobre todo a una tumefacción de los axones de la CFNR y en menor grado al edema intersticial (165). Cuando el cuadro evoluciona hacia el edema crónico de la papila se puede producir una degeneración axonal a partir de la lámina cribosa, desde donde se extiende en sentido anterógrado y retrógrado. En los casos de elevación papilar asociada a neuritis óptica se observa además la presencia de linfocitos a nivel de las leptomeninges que rodean al nervio óptico y de los espacios perivasculares, así como focos de desmielinización en el nervio. Atrofia Óptica La atrofia del nervio óptico es un proceso caracterizado desde el punto de vista clínico por una palidez del disco óptico al examen oftalmoscópico, asociada a defectos irreversibles de la visión. La afectación de esta última es muy variable y, de hecho, grados similares de palidez papilar pueden acompañarse de niveles muy diferentes de agudeza visual. El proceso de atrofia viene determinado por la degeneración axonal consecutiva a cualquier lesión que afecte a las CGR o a los propios axones, en su trayecto hasta el CGL. A partir de la zona lesionada, la degeneración axonal experimenta una progresión en sentido proximal (descendente) y en sentido distal (ascendente) (166), con respecto al cuerpo celular. De acuerdo con su etiopatogenia distinguimos las variedades anterógrada, retrógrada y transináptica. La atrofia óptica anterógrada, walleriana o ascendente es consecutiva a lesiones primarias de la retina o del disco óptico (v. gr.: glaucoma, retinopatía pigmentaria, oclusión de la ACR, papiledema, neuropatías ópticas tóxicas). La atrofia óptica 39 Figura 2-25. Megalopapila. Papila de gran tamaño con excavación fisiológica también grande, cuyo sustrato anatómico corresponde a un aumento del diámetro de la porción del nervio óptico que atraviesa el canal escleral. retrógrada o descendente es causada por neuropatías ópticas retrobulbares o por lesiones cerebrales (v. gr.: tumores, traumatismos, afecciones genéticamente determinadas). La atrofia óptica transináptica o transneuronal se produce secundariamente a lesiones de la neurona integrada en las radiaciones ópticas. Los casos más evidentes de esta última han afectado a pacientes durante el desarrollo embrionario o en la infancia temprana. En pacientes adultos existe la comprobación anatomopatológica de degeneración transináptica del nervio óptico tras lesiones retrogeniculadas de larga evolución (167), pero con muy escasa repercusión clínica. Figura 2-26. Histopatología de un edema de la papila. Sección longitudinal, que muestra una gran tumefacción del tejido nervioso papilar, acompañada de dilatación de los vasos y extensa infiltración del parénquima del nervio óptico por células metastásicas de un carcinoma de la mama. (Caso del Dr. A. Henríquez. Barcelona). 40 Neuropatías ópticas: diagnóstico y tratamiento Según los estudios experimentales de Anderson (168), la atrofia óptica anterógrada se evidencia en los casos agudos a las 2 semanas de producirse la lesión primaria, para completarse hacia la 4.ª semana. En cambio, la atrofia óptica retrógrada es evidente a las 4 semanas y se completa alrededor del 3.er mes, con independencia de que la lesión asiente en el nervio óptico, en el quiasma o en la cintilla óptica (166). La anatomía patológica en la atrofia óptica demuestra un estrechamiento por degeneración de los cilindroejes que integran el nervio óptico (162), hasta una desaparición de los mismos y de la mielina que los rodea, así como una proliferación de los astrocitos (gliosis) (fig. 2-27). De acuerdo con el aspecto del fondo ocular, la mayor parte de los casos se corresponden con la primera variedad de atrofia óptica, designada clásicamente como primaria (fig. 2-28A), caracterizada por una palidez del disco óptico, con bordes nítidos y detalles bien visibles. Otros casos, evolucionados a partir de un papiledema u otra forma de edema papilar severo, muestran signos oftalmoscópicos de la segunda variedad, llamada atrofia óptica secundaria (fig. 2-28B). Dichos signos consisten en una borrosidad de los márgenes de la papila con envainamiento vascular, además de la palidez, y se deben a la extensión del proceso de gliosis por la superficie y sobre los márgenes de la papila. Finalmente, la tercera variedad de atrofia óptica, que se denomina cavernosa, es la forma típica del glaucoma crónico (ver capítulo 5), y en ella la palidez del disco va acompañada de un aumento de tamaño de la excavación central y de un desplazamiento nasal de los vasos centrales (fig. 2-28C). En este caso se añade a los hallazgos de atrofia óptica la presencia de espacios quísticos retrolaminares que contienen acúmulos de mucopolisacáridos, sin proliferación glial ni conectiva (169). La distribución de las fibras nerviosas procedentes de las dos mitades de la retina (170) (fig. 2-29) condi- Figura 2-28. Tres variantes de atrofia óptica. Atrofia óptica «primaria» (A): palidez del disco óptico en un caso de neuropatía óptica heredodegenerativa. Atrofia óptica «secundaria» (B): borrosidad de las estructuras papilares, en un paciente con un tumor cerebral (B). Atrofia óptica «cavernosa» (C): agrandamiento de la excavación papilar consecutiva a un glaucoma. Figura 2-29. Distribución de los axones de la CFNR a su entrada en el nervio óptico. Las fibras procedentes de la hemirretina temporal (A) siguen un trayecto arqueado y entran en la papila sobre todo por sus polos superior e inferior, mientras que las fibras de la hemirretina nasal (B) hacen lo propio por la mitad nasal del disco óptico. Figura 2-27. Histopatología de una atrofia óptica. Sección longitudinal, que muestra una intensa infiltración inflamatoria de las meninges y una atrofia del nervio óptico caracterizada por la reducción de los haces de fibras nerviosas y el aumento de los espacios fibrovasculares de la piamadre entre los mismos, en un caso de neurosífilis. (Caso del Dr. A. Henríquez. Barcelona). Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 41 Figura 2-31. Palidez papilar acompañada de una reducción marcada en el calibre de las arteriolas retinianas, en un caso de retinopatía pigmentaria. Figura 2-30. Histopatología de una atrofia óptica en banda por compresión quiasmática debida a un adenoma hipofisario. Sección transversal del nervio óptico, que muestra una atrofia de los axones y una gliosis, limitadas a una franja horizontal central, lo que se traduce en el fondo ocular por la correspondiente franja de palidez papilar. (Caso del Dr. W.F. Hoyt. California). ciona variedades de atrofia retrógrada características, que se pueden observar en las lesiones posteriores a la decusación quiasmática. Así, las afecciones centrales del quiasma producen una atrofia óptica en banda (fig. 2-30), consistente en una palidez centrada, que adopta la forma de banda horizontal a nivel de ambas papilas. Las afecciones de la cintilla óptica o del CGL causan, en cambio, una palidez en banda del disco óptico contralateral y una palidez temporal del disco ipsilateral (ver capítulo 11). Los experimentos de Quigley sugieren que la palidez papilar, común a todas las variedades de atrofia óptica, no es debida a una ausencia de capilares ni a una proliferación astroglial a nivel del disco óptico. Esta pérdida de la coloración es atribuida por el autor a la disminución de la trasmisión luminosa a través de la citoarquitectura de la papila en estado atrófico (171). La palidez del disco se asocia a la evidencia oftalmoscópica de defectos localizados de las fibras nerviosas retinianas como parte del proceso atrófico (ver capítulos 5 y 9). Un método indirecto propuesto para la evaluación de la CFNR es la observación del reflejo anu- lar parafoveal, menos detectable en casos de atrofia óptica que en condiciones normales (172). Por lo que se refiere a las arteriolas retinianas, algunos autores han descrito un adelgazamiento localizado de las mismas próximo a la papila en casos de glaucoma con tensión normal y de NOIA no arterítica (173). No obstante, es más característico un adelgazamiento arteriolar generalizado en las atrofias ópticas de otras causas, sobre todo en casos consecutivos a retinopatías (fig. 2-31). Se cree que este fenómeno es debido a una reducción en las necesidades de aporte sanguíneo, motivada por la pérdida de CGR y de sus axones. BIBLIOGRAFÍA 1. Nishina S, Kohsaka S, Yamaguchi Y et al. Pax6 expression in the developing human eye. Br J Ophthalmol 1999; 83: 723-7. 2. O’Rahilly R, Müller F. Human embryology and teratology. 2nd ed. New York: Wiley-Liss, 1996: p. 417-31. 3. Génis Gálvez JM. Biología del desarrollo. Barcelona: Espaxs, 1970: p. 205-17 4. Pittack C, Grunwald GB, Reh TA. Fibroblast growth factors are necessary for neural retina but not pigmented epithelium differentiattion in chick embryos. Development 1997; 124: 805-16. 5. Streeter GL. Developmental horizons in human embryos. Contributions Embryol Carneg Inst 1951; 34: 161-96. 6. Rhodes RH. Development of the optic nerve. En: Jakobiec JA (ed.). Ocular anatomy, embryology and teratology. Philadelphia: Harper & Row, 1982: p. 601-38. 7. Zhang J, Rubin RM, Rao NA. Anatomy and Embryology of the optic nerve. En: Tasman W, Jaeger EA (eds.). Duanes’s Ophthalmology on CD-ROM. Philadelphia: Lippincott-Raven Press, 2000. 42 Neuropatías ópticas: diagnóstico y tratamiento 8. Clavert A. Étude de la formation et de l’évolution normale et pathologique de l’ébauche neuroectodermique de l’oeil. Arch Anat Hist Embr Norm Exp 1978; 61: 89142. 9. Storm RL, Pe Benito R. Bilateral optic nerve aplasia associated with hydranencephaly. Ann Ophthalmol 1984; 16: 988-92. 10. Pisaturo C, Dolci A, Pessagno A et al. Aplasia e ipoplasia del nervo ottico. Minerva Pediatr 1996; 48: 465-9. 11. Sturrock RR. A light and electron microscopic study of proliferation and maturation of fibrous astrocytes in the optic nerve of the human embryo. J Anat 1975; 119: 223-34. 12. Salazar JJ, Ramírez AI, Ramírez JM et al. Papel funcional de los astrocitos del nervio óptico en la fasciculación axonal. Arch Soc Esp Oftalmol 1998; 73: 81-6. 13. Sturrock RR. Fluorescent granular perithelial cells in the meninges and optic nerve of the human embryo. Anat Anz 1988; 166: 323-9. 14. Tripathi RC, Chalam KV, Cibis GW et al. Fundamentals and principles of Ophthalmology. En: Weingeist TA, Liesegang TJ, Grand MG (eds.). Basic and Clinical Science Course. San Francisco: The Foundation of the American Academy of Ophthalmology, 2000: p. 128-58. 15. Meidong Z, Madigan MC, Van Driel D et al. The human hyaloid system: cell death and vascular regression. Exp Eye Res 2000; 70: 767-76. 16. Ye H, Hernandez MR. Heterogeneity of astrocytes in human optic nerve head. J Comp Neurol 1995; 362: 441-52. 17. Orgül S, Cioffi GA Embryology, anatomy, and histology of the optic nerve vasculature. J Glaucoma 1996; 5: 285-94. 18. Fujita Y, Imagawa T, Uehara M et al. Comparative study of the lamina cribrosa and the pial septa in the vertebrate optic nerve and their relationship to the myelinated axons. Tissue Cell 2000; 32: 293-301. 19. Forrester JF, Dick A, McMenamin P (eds.). The Eye. Basic sciences in practique. London: Saunders, 1996. 20. Oyster CW (ed.). The human eye. Structure and function. Sunderland: Sinauer, 1999. 21. Jonas JB, Schmidt AM, Müller-Bergh JA et al. Human optic nerve fiber count and optic disc size. Invest Ophthalmol Vis Sci 1992; 33: 2012-8. 22. Mikelberg FS, Drance SM, Schulzer M et al. The normal human optic nerve. Axon count and axon diameter distribution. Ophthalmology 1989; 96: 1325-8. 23. Bron AJ, Tripathi RC, Tripathi BJ (eds.). Wolff’s anatomy of the eye and orbit. 8th ed. London: Chapman & Hall Medical, 1997. 24. Hogan MJ, Alvarado JA, Weddell JE (eds.). Histology of the human eye. Philadelphia: Saunders, 1971. 25. Raynaud C, Milin-Cioni AV. La cellule retino-thalamique. En: Solé P, Dalens C, Gentou C (eds.). Biophtalmologie. Libro VI. Le Systeme Nerveux. Paris: Masson, 1992: p. 135-72. 26. Salazar JJ. Glioarquitectura de la cabeza del nervio óptico humano: estudio inmunohistoquímico con anti-PGFA. Madrid: Universidad Complutense de Madrid. Tesis Doctoral, 1994. 27. Hayreh SS. Anatomy and physiology of the optic nerve head. Trans Am Acad Ophthalmol Otolaryngol 1974; 78: 240-74. 28. Morrison JC. The microanatomy of the optic nerve. En: Drance SM (ed.) Optic nerve in glaucoma. Amsterdam: Kugler, 1995: p. 57-78 29. Anderson DR, Quigley HA. El nervio óptico. En: Hart WW. (ed.). Adler, Fisiología del ojo. Madrid: Mosby/Doyma, 1994: p. 619-43. 30. Radius RL, Anderson DR. The course of axons through the retina and optic nerve head. Arch Ophthalmol 1979; 97: 1154-8. 31. Ramírez JM, Triviño A, Salazar JJ et al. Conceptos actuales sobre la organización anatómica del nervio óptico. En: Piñero A, Quevedo JA, Flores CM. (eds.). Neuritis Óptica. Madrid: Tecnomedia, 1997: p. 9-28. 32. Minckler DS. The organization of nerve fibre bundles in the primate optic nerve head. Arch Ophthalmol 1980; 98: 1630-6. 33. Quigley HA, Addicks EM. Quantitative studies of retinal nerve fiber layer defects. Arch Ophthalmol 1982; 100: 807-14. 34. Ogden TE. Nerve fiber layer of the macaque retina: retinotopic organization. Invest Ophthalmol Vis Sci 1983; 24: 85-98. 35. Fitzgibbon T, Taylor SF. Retinotopy of the human retinal nerve fibre layer and optic nerve head. J Comp Neurol 1996; 375: 238-51. 36. Fitzgibbon T. The human fetal retina nerve fiber layer and optic nerve head: A DiI and DiA tracing study. Visual Neurosci 1997; 14: 433-47. 37. Triviño A, Ramírez JM, Salazar JJ et al. Immunohistochemical study of human optic nerve head astroglia. Vision Res 1996; 36: 2015-28. 38. Triviño A, Ramírez JM, Salazar JJ et al. Astroglial architecture of the human optic nerve: functional role of astrocytes. En: Castellano B, González B, Nieto-Sampedro M (eds.). Understanding glial cells. Boston: Kluwer Academic, 1998: p. 63-77. 39. Ramírez JM, Triviño A, Salazar JJ et al. Organización microscópica de la cabeza del nervio óptico. En: Honrubia FM, García-Sánchez J, Pastor JC. (eds.). Diagnóstico precoz del glaucoma. Zaragoza: Edelvives, 1997: p. 145-79. 40. Ramírez JM, Salazar JJ, Triviño A et al. Membranas limitantes gliales y fasciculación axonal en la cabeza del nervio óptico en el conejo. Glaucoma 1989; 3: 111-9. 41. Ramírez AI, Salazar JJ, Triviño A et al. Las células astrogliales como constituyentes de las barreras limitantes de la cabeza del nervio óptico humano. Arch Soc Esp Oftalmol 1998; 73: 11-6. 42. Ramírez JM, Triviño A. Anatomofisiología del nervio óptico. En: Gómez-Ulla F, Marín JM, Ramírez JM et al. (eds.). La circulación coroidea. Barcelona: Edika-Med, 1989: p. 31-41. 43. Cioffi GA, van Buskirk EM. Vasculature of the anterior optic nerve and peripapillary choroid. En: Ritch R, Shields MB, Krupin T. (eds.). The Glaucomas 2nd ed. St. Louis: Mosby, 1996: p. 177-88. Capítulo 2. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico 44. Hayreh SS. Structure and blood supply of the optic nerve. En: Heilmann K, Richardson KT (eds.). Glaucoma. Conceptions of a disease. Pathogenesis, diagnosis and therapy. Stuttgart: Thieme, 1978: p. 78-96. 45. Ramírez JM. Estudio de la vascularización de la papila del nervio óptico por el método de diafanización y relleno con polímeros de baja densidad. Universidad Complutense de Madrid. Tesis Doctoral, 1983. 46. Ramírez JM, Triviño A, García-Sánchez J. Vascularización de la cabeza del nervio óptico en el hombre. Arch Soc Esp Oftalmol 1984; 46: 413-26. 47. Elkington AR, Inman CB, Steart PV et al. The structure of the lamina cribrosa of the human eye: an immunocytochemical and electron microscopical study. Eye 1990; 4: 42-57. 48. Ko MK, Kim DS, Ahn YK. Morphological variations of the peripapillary circle of Zinn-Haller by flat section. Br J Ophthalmol 1999; 83: 862-6. 49. Onda E, Cioffi GA, Bacon DR et al. Microvasculature of the human optic nerve. Am J Ophthalmol 1995; 120: 92-102. 50. Galou M, Gao J, Humbert J et al. The importance of intermediate filaments in the adaptation of tissues to mechanical stress: evidence from gene knockout studies. Biol Cell 1997; 89: 85-97. 51. Anderson DR. Fine structure and function of ocular tissues: The optic nerve. Int Ophthalmol Clin 1973; 13: 77183. 52. Quigley HA. Gap junctions between optic nerve head astrocytes. Invest Ophthalmol Vis Science 1977; 16: 582-5. 53. Okinami S, Ohkuma M, Tsukahara T. Kuhnt intermediate tissue as a barrier between the optic nerve and retina. Graefe’s Arch Clin Exp Ophthalmol 1976; 201: 57-67. 54. Perry VH, Bell MD, Brown HC et al. Inflammation in the nervous system. Curr Opin Neurobiol 1995; 5: 636-41. 55. Streit KM, Walter SA, Pennell NA. Reactive microgliosis. Prog Neurobiol 1999; 57: 563-81. 56. Hernández MR. The optic nerve head in glaucoma: role of astrocytes in tissue remodeling. Prog Ret Eye Res 2000; 19: 297-321. 57. Neufeld AH. Microglia in the optic nerve head and the region of parapapillary chorioretinal atrophy in glaucoma. Arch Ophthalmol 1999; 117: 1050-6. 58. Fujita Y, Imagawa T, Uehara M. Comparative study of the lamina cribrosa and the pial septa in the vertebrate optic nerve and their relationship to the myelinated axons. Tissue Cell 2000; 32: 293-301. 59. Dandona L, Quigley HA, Brown AE et al. Quantitative regional structure of the normal human lamina cribrosa. Arch Ophthalmol 1990; 108: 393-8. 60. Maeda H, Nakamura M, Yamamoto M. Morphometric features of laminar pores in lamina cribrosa observed by Scanning Laser Opthalmoscopy. Jpn J Ophthalmol 1999; 43: 415-21. 61. Clark AF, Browder S, Steely HT et al. Cell biology of the human lamina cribrosa. En: Drance SM. (ed.). Optic nerve in glaucoma. Amsterdam: Kugler Publications, 1995: p. 79-105. 43 62. Sawaguchi S, Yue BYJT, Furuchi T et al. Sulfated proteoglycans in the human lamina cribrosa. Invest Ophthalmol Vis Sci 1992; 33: 2388-98. 63. Thale A, Tillmann B. The collagen architecture of the sclera SEM and immunohistochemical studies. Ann Anat 1993; 175: 215-20. 64. Hernández MR, Wang N, Hanley NM et al. Localization of collagen types I and mRNAs in human optic nerve head by in situ hybridization. Invest Ophthalmol Vis Sci 1991; 32: 2169-77. 65. Hernández MR. Extracellular matrix of the human optic nerve head: Age-related and glaucomatous changes. En: Lütjen-Drecoll E, Rohen JW. (eds.). Basic aspects of glaucoma research III. Stuttgart: Schattauer, 1993: p.179-89. 66. Morgan WH, Yu DY, Cooper RL et al. The influence of cerebrospinal fluid pressure on the lamina cribrosa tissue pressure gradient. Invest Ophthalmol Vis Sci 1995; 36: 1163-72. 67. Jonas JB, Mardin CY, Schlötzer-Schrehardt UM et al. Morphometry of the human lamina cribrosa surface. Invest Ophthalmol Vis Sci 1991; 32: 401-5. 68. Morgan JE, Jeffery G, Foss AJE. Axon deviation in the human lamina cribrosa. Br J Ophthalmol 1998; 82: 680-3. 69. Morgan JE. Optic nerve head structure in glaucoma: astrocytes as mediators of axonal damage. Eye 2000; 14: 437-44. 70. Hayreh SS. The sheath of the optic nerve. Ophthalmologica 1984; 189: 54-63. 71. Pinazo-Durán MD, Renau-Piqueras J, Lindo L et al. Estudio ultraestructural de la gliogénesis, mielinización y desarrollo axonal en el nervio óptico de la rata. Arch Soc Esp Oftalmol 1994; 67: 13-9. 72. Raff MC. Glial cell diversification in the rat optic nerve. Science 1989; 243: 1450-5. 73. Miller RH, Hayes JE, Dyer KL et al. Mechanisms of oligodendrocyte commitment in the vertebrate CNS. Int J Dev Neurosci 1999; 17: 753-63. 74. Hughes SM, Lillien LE, Raff MC et al. Ciliary neurotrophic factor induces type-2 astrocyte differentiation in culture. Nature 1988; 335: 70-3. 75. Lillien LE, Raff MC. Analysis of the cell-cell interactions that control type-2 astrocyte development in vitro. Neuron 1990; 4: 525-34. 76. Miller RH, ffrench-Constant C, Raff MC. The macroglial cells of the rat optic nerve. Ann Rev Neurosci 1989; 12: 517-34. 77. Pfeiffer SE, Warrington AE, Bansal R. The oligodendrocyte and its many cellular processes. Trends Cell Biol 1993; 3: 191-7. 78. Nishiyama A, Lin XH, Giese N et al. Interaction between NG2 proteoglycan and PDGF in Receptor on O2A progenitor cells is required for optimal response to PDGF. J Neurosci Res 1996; 43: 315-30. 79. Kettenmann H, Ransom BR (eds.). Molecular biology of myelination. New York: Oxford University, 1995. 80. Gard AL, Pfeiffer SE. Glial cell mitogens by bFGF and PDGF differentially regulate development of O4+ GalColigodendrocyte progenitors. Dev Biol 1993; 159: 618-30. 44 Neuropatías ópticas: diagnóstico y tratamiento 81. Ono K, Yasui Y, Rtishauser U et al. Focal ventricular origin and migration of oligodendrocyte precursors into the chick optic nerve. Neuron 1997; 19: 1-20. 82. Morcos Y, Chan-Ling T. Concentration of astrocytic filaments at the retinal optic nerve junctions is coincident with the absence of intra-retinal myelination: comparative and developmental evidence. J Neurocytol 2000; 29: 665-78. 83. Hidelbrand C, Waxman SG. Postnatal differentiation of rat optic nerve fibers: electron microscopic observations on the development of nodes of Ranvier and axoglial relations. J Neurosci Res 1984; 224: 25-37. 84. Massa PT. Plasmalemmal vesicles (caveolae) of fibrous astrocytes of the cat optic nerve. Am J Anat 1982; 165: 69-81. 85. Hayreh SS. Acute ischemic disorders of the optic nerve: Pathogenesis, clinical manifestations and management. Ophthalmol Clin North Am 1996; 9: 407-42. 86. Hayreh SS. Pathogenesis of optic nerve damage and visual field defects. En: Heilmann K, Richardson KT. (eds.). Glaucoma. Conceptions of a disease. Pathogenesis, diagnosis and therapy. Stuttgart: Thieme, 1978: p. 104-37. 87. Hayreh SS. Progress in the understanding of the vascular etiology of glaucoma. Curr Opin Ophthalmol 1994; 5: 26-35. 88. Hayreh SS. The role of age and cardiovascular disease in glaucomatous optic neuropathy. Surv Ophthalmol 1999; 43: S27-42. 89. Hayreh SS. The blood supply of the optic nerve head and the evaluation of it - myth and reality. Prog Retina Eye Res 2001; 20: 563-93. 90. Hayreh SS. The central artery of the retina - its role in the blood supply of the optic nerve. Br J Ophthalmol 1963; 47: 651-63. 91. Hayreh SS. Blood supply and vascular disorders of the optic nerve. An Inst Barraquer 1963; 4: 7-l09. 92. Hayreh SS. Blood supply of the optic nerve head and its role in optic atrophy, glaucoma, and oedema of the optic disc. Br J Ophthalmol 1969; 53: 721-48. 93. Hayreh SS. Pathogenesis of visual field defects. Role of the ciliary circulation. Br J Ophthalmol 1970; 54: 289-311. 94. Hayreh SS. Inter-individual variation in blood supply of the optic nerve head. Its importance in various ischemic disorders of the optic nerve head, and glaucoma, low-tension glaucoma and allied disorders. Doc Ophthalmol 1985; 59: 217-46. 95. Hayreh SS. The optic nerve head circulation in health and disease. Exp Eye Res 1995; 61: 259-72. 96. Hayreh SS. Optic disc changes in glaucoma. Br J Ophthalmol 1972; 56: 175-85. 97. Hayreh SS. A study of the central artery of the retina in human beings in its intra-orbital and intra- neural course. Universidad Panjab: India. Tesis Doctoral, 1958. 98. Singh S, Dass R. The central artery of the retina. II. Distribution and anastomoses. Br J Ophthalmol 1960; 44: 280-99. 99. Hayreh SS: Segmental nature of choroidal vasculature. Br J Ophthalmol 1975; 59: 631-48. 100. Hayreh SS. The ophthalmic artery III. Branches. Br J Ophthalmol 1962; 46: 212-47. 101. Hayreh SS, Baines JAB. Occlusion of the posterior ciliary artery. I. Effects on choroidal circulation. Br J Ophthalmol 1972; 56: 7l9-35. 102. Hayreh SS. Physiological anatomy of the choroidal vascular bed. Int Ophthalmol 1983; 6: 85-93. 103. Hayreh SS. Anterior ischaemic optic neuropathy - I. Terminology and pathogenesis. Br J Ophthalmol 1974; 58: 955-63. 104. Hayreh SS. Anterior ischaemic optic neuropathy. II. Fundus on ophthalmoscopy and fluorescein angiography. Br J Ophthalmol 1974; 58: 964-80. 105. Hayreh SS (ed.). Anterior ischemic optic neuropathy. New York: Springer-Verlag, l975. 106. Hayreh SS. Anterior ischemic optic neuropathy. Arch Neurol 1981; 38: 675-8. 107. Hayreh SS. Anterior ischaemic optic neuropathy: differentiation of arteritic from non-arteritic type and its management. Eye 1990; 4: 25-41. 108. Hayreh SS. In vivo choroidal circulation and its watershed zones. Eye 1990; 4: 273-89. 109. Goldstein LSB, Yang Z. Microtubule-based transport systems in neurons: the roles of kinesins and dyneins. Ann Rev Neurosci 2000; 23: 39-71. 110. Thoenen H, Schwab M. Physiological and pathophysiological implications of the retrograde axonal transport of molecules. En: Dumont. (ed). Advances in Pharmacology and Therapeutics, Neuropsychopharmacology. Oxford: Pergamon Press, 1978: p. 37-59. 111. Weiss P, Hiscoe HB. Experiments on the mechanism of nerve growth. J Exp Zool 1948; 107: 315-95. 112. Bear MF, Connors BW, Paradiso MA (eds.). Neuroscience: Exploring the brain. Baltimore: Williams & Wilkins, 1996: p. 36-8. 113. Bodian D, Howe HA. Experimental studies on intraneuronal spread of poliomyelitis virus. Bull Johns Hopkins Hosp 1941; 68: 248-67. 114. Kristensson K, Olsson Y. Retrograde axonal transport of protein. Brain Res 1971; 29: 363-5. 115. Kandel ER, Schwartz JH, Jessell TM.(eds.) Essentials of neural science and behavior. Norwalk: Appleton & Lange, 1995: p. 62-5. 116. Brown A. Slow axonal transport: stop and go traffic in the axon. Mol Cell Biol 2000; 1: 153-6. 117. Grafstein B, Forman DS. Intracellular transport in neurons. Rev Physiol 1980; 4: 1167-283. 118. Wu CC, Russel RM, Karten HJ. The transport rate of cholera toxin B subunit in the retinofugal pathways of the chick. Neurosci 1999; 92: 665-76. 119. Garner JA, LaVail JH. Differential anterograde transport of HSV type 1 viral strains in murine optic pathway. J Neurovirol 1999; 5: 140-50. 120. Smith Y, Bolam JP. Combined approaches to experimental neuroanatomy: combined tracing and immunocytochemical techniques for the study of neuronal microcircuits. Capítulo 2. 121. 122. 123. 124. 125. 126. 127. 128. 129. 130. 131. 132. 133. 134. Desarrollo, anatomía, vascularización, fisiología e histopatología del nervio óptico En: Bolam JP (ed.). Experimental Neuroanatomy: a practical approach. New York: Oxford University Press, 1992: p. 31-59. Skirboll LR, Thor K, Helke C et al. Use of retrograde fluorescent tracers in combination with immunocytochemical methods. En: Heimer L, Zaborsky L (eds.). Neuroanatomical tract-tracing methods 2: Recent progress. New York: Plenum Press, 1989: p. 5-18. Oppenheim RW. The concept of uptake and retrograde transport of neurotrophic molecules during development: history and present status. Neurochem Res 1996; 21: 769-77. Mufson EJ, Kroin JS, Sendera TJ et al. (eds.). Distribution and retrograde transport of trophic factors in the central nervous system: functional implications for the treatment of neurodegenerative diseases. En: Progress in Neurobiology. London: Elsevier Science, 1999; p. 451-84. Oppenheim RW. Cell death during development of the nervous system. Ann Rev Neurosci 1991; 14: 453-501. Von Bartheld CS, Bulowi R. Expression of neurotrophin-3 (NT-3) and anterograde axonal transport of endogenous NT-3 by retinal ganglion cells in chick embryos. J Neurosci 2000; 20: 736-48. Grafstein B. The retina as a regenerating organ. En: Adler R, Farber D (eds.). The retina: a model for Cell Biology studies. London: Academic Press, 1986; p. 275-335. Salvador M, Vidal-Sanz M, Villegas-Pérez MP. Microglial cell in the retina of Carassius auratus: effects of optic nerve crush. J Comp Neurol 2000; 417: 431-47. Villegas-Pérez MP, Vidal-Sanz M, Bray et al. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci 1988; 8: 265-80. Villegas-Pérez MP, Vidal-Sanz M, Bray GM et al. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol 1993; 24: 23-36. Vidal-Sanz M, Bray GM, Villegas-Pérez MP et al. Axonal regeneration and synapse formation in the superior colliculus by retinal ganglion cells in the adult rat. J Neurosci 1987; 7: 2894-907. Whiteley SJO, Avilés M, Sauvé Y et al. Extent and duration of recovered pupillary light reflex following retinal ganglion cell axon regeneration through peripheral nerve grafts directed to the pretectum in adult rats. Exp Neurol 1998; 154: 560-72. Fournier AE, Beer J, Arregui CO et al. Brain-derived neurotrophic factor modulates GAP-43, but not T alpha 1 expression in injured retinal ganglion cells of adult rats. J Neurosci Res 1997; 47: 561-72. Trecarten MJ, Villegas-Pérez MP, Vidal-Sanz M et al. Growth of retinal axons along peripheral nerve system grafts inserted into the retina of adult rats. Society of Neuroscience abstracts 1986; 12: 701. Hoffman PN. Axonal damage. En: Drance SM (ed.). Optic nerve in glaucoma. Amsterdam: Kugler, 1995: p. 123-34. 45 135. McKerracher L, Vidal-Sanz M, Essagian C et al. Selective impairment of slow axonal transport after optic nerve injury in adult rats. J Neurosci 1990; 10: 2834-41. 136. McKerracher L, Vidal-Sanz M, Aguayo AJ. Slow transport rates of cytoskeletal proteins change during regeneration of axotomized retinal neurons in adult rats. J Neurosci 1990; 10: 641-8. 137. Hayreh SS. Fluids in the anterior part of the optic nerve in health and disease. Surv Ophthalmol 1978 ; 23: 1-25. 138. Hamard H, Chevaleraud J, Rondot P (eds.). Transport axonal et autres méchanismes. En: Neuropathies optiques. Paris: Societé Française d’Ophtalmologie/Masson, 1986: p. 95-132. 139. Ashton N. The eye in malignant hypertension. Trans Am Acad Ophthalmol Otolaryngol 1972; 76: 17-40. 140. McLeod D, Marshall J, Kohner EM. Role of the axoplasmic transport in the pathophysiology of ischaemic disc swelling. Br J Ophthalmol 1980; 64: 247-61. 141. Hayreh SS. Pathogenesis of occlusion of the central retinal vessels. Am J Ophthalmol 1971; 72: 998. 142. Hayreh SS. Optic disc edema in raised intracranial pressure: V. Pathogenesis. Arch. Ophthalmol 1977; 95: 1553-65. 143. Primrose J. Pathogenesis of papilledema. Doc Ophthalmol 1976; 40: 391-408. 144. Miller NR. Papilledema. En: Miller NR, Newman NJ (eds.). Walsh and Hoyt’s Clinical Neuro-Ophthalmology. 5th ed. Baltimore: Williams & Wilkins, 1998: p. 485-548. 145. Quigley HA. Mechanisms of glaucomatous optic neuropathy. En: Van Buskirk EM, Shields MB (eds.). 100 years of progress in glaucoma. Philadelphia: Lippincott-Raven, 1997: p. 79-98. 146. Quigley HA, Anderson DR. The dynamics and location of axonal transport blockade by acute intraocular pressure elevation in the primate optic nerve. Invest Ophthalmol Vis Sci 1976; 15: 606-16. 147. Quigley HA, McKinnon SJ, Zack DJ et al. Retrograde axonal transport of BDNF in retinal ganglion cells is blocked by acute IOP elevation in rats. Invest Ophthalmol Vis Sci 2000; 41: 3460-6. 148. Hollander H, Makarov F, Stefani FH et al. Evidence of constriction of optic nerve axons at the lamina cribrosa in normotensive eyes in humans and other mammals. Ophthalmic Res 1995; 27: 296-309. 149. Osborne NN, Ugarte M, Chao M et al. Neuroprotection in relation to retinal ischemia and relevance to glaucoma. Surv Ophthalmol 1999; 43: S102-28. 150. Sadun A. Acquired mitochondrial impairment as a cause of optic nerve disease. Trans Am Ophthalmol Soc 1998; 96: 881-923. 151. Zhang L, Inoue M, Dong K et al. Retrograde axonal transport impairment of large- and medium-sized retinal ganglion cells in diabetic rats. Curr Eye Res 2000; 20: 131-6. 152. Berkelaar M, Clarke DB, Wang YC et al. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci 1994; 14: 4368-74. 46 Neuropatías ópticas: diagnóstico y tratamiento 153. Peinado P, Salvador M, Villegas-Pérez MP et al. Effects of axotomy and intraocular administration of BDNF, NT-3 and NT-4 on the survival of adult rat retinal ganglion cells: a quantitative in vivo study. Invest Ophthalmol Vis Sci 1996; 37: 489-500. 154. Villegas-Pérez, MP, Vidal-Sanz M, Lund RD. Mechanisms of retinal ganglion cell loss in inherited retinal dystrophy. Neuroreport 1996; 7: 1995-9. 155. Villegas-Pérez MP, Lawrence JM, Vidal-Sanz M et al. Ganglion cell loss in RCS rat retina: a result of compression of axons by contracting intraretinal vessels linked to the pigment epithelium. J Comp Neurol 1998; 392: 58-77. 156. Wang S, Villegas-Pérez MP, Vidal-Sanz M et al. Progressive optic axon dystrophy and vascular changes in red mice. Invest Ophthalmol Vis Sci 2000; 41: 537-45. 157. Schwartz M, Yoles E, Levin LA. Axogenic and somagenic neurodegenerative diseases: definitions and therapeutic implications. Mol Med Today 1999; 5: 470-3. 158. Purves D. Functional and structural changes in mammalian sympathetic neurons following colchicine application to post-ganglionic nerves. J Physiol 1976; 259: 159-75. 159. Proske UY, Luff AR. Mechanical sensitivity of muscle afferents in a nerve treated with colchicine. Exp Brain Res 1998; 119: 391-8. 160. Mironov SL, Richter DW. Cytoskeleton mediates inhibition of the fast Na+ currents in respiratory brainstem neurons during hypoxia. Eur J Neurosci 1999; 11: 1831-4. 161. Mosier MA, Lieberman MF, Green WR et al. Hypoplasia of the optic nerve. Arch Ophthalmol 1978; 96: 1437-42. 162. Saadati HG, Hsu HY, Heller KB et al. A histopathologic and morphometric differentiation of nerves in optic nerve hypoplasia and Leber hereditary optic neuropathy. Arch Ophthalmol 1998; 116: 911-6. 163. Brodsky MC, Baker RS, Hamed LM (eds.) The swollen optic disc in childhood. En: Pediatric Neuro-Ophthalmology. New York. Springer 1996: p. 106-24. 164. Sanders MD. The Bowman lecture. Papilloedema: «The pendulum of progress». Eye 1997; 11: 267-94. 165. Tso MOM, Fine BS. Electron microscopic study of human papilledema. Am J Ophthalmol 1976; 82: 424-34. 166. Miller NR, Newman NJ (eds.). Topical diagnosis of lesions in the visual sensory pathway. En: Walsh & Hoyt’s Clinical Neuro-Ophthalmology. 5th ed. Baltimore: Williams & Wilkins, 1998: p. 274-92. 167. Beatty RM, Sadun AA, Smith LEH et al. Direct demonstration of transsynaptic degeneration in the human visual system: a comparison of retrograde and anterograde changes. J Neurol Neurosurg Psychiatry 1982; 45: 143-6. 168. Anderson DR. Ascending and descending optic atrophy produced experimentally in squirrel monkeys. Am J Ophthalmol 1973; 76: 693-711. 169. Giarelli L, Melato M, Campos E. 14 cases of cavernous degeneration of the optic nerve. Ophthalmologica 1977; 174: 316-21. 170. Hoyt WF, Kommerell G. Der Fundus oculi bei Homonymer Hemianopie. Klin Monatsbl Augenheilkd 1973; 162: 456-64. 171. Quigley HA, Anderson DR. The histologic basis of optic disk pallor in experimental optic atrophy. Am J Ophthalmol 1977; 83: 709-17. 172. Hayreh SS, Jonas JB. Ophthalmoscopic detectability of the parafoveal annular reflex in the evaluation of the optic nerve. An experimental study in Rhesus monkeys. Ophthalmology 2000; 107: 1009-14. 173. Rader J, Feuer WJ, Anderson DR. Peripapillary vasoconstriction in glaucomas and the anterior ischemic optic neuropathies. Am J Ophthalmol 1994; 117: 72-80.