∆ G º = - N* F* ∆ E o ∆ G º =
Anuncio

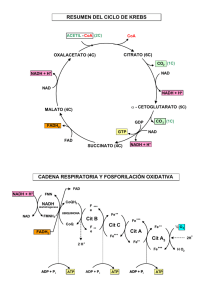
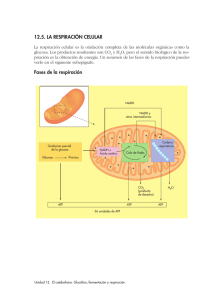
Bioquímica-2º F (2010-11) -T 17-1 Tema 17: Oxidorreducción biológica. Potencial redox y energía libre. Cadena respiratoria: organización y localización subcelular. Fosforilación oxidativa: Acoplamiento energético para la formación de ATP. Estudio de la ATPasa. 3 horas (30 noviem. ,2 y 3 -dic). Objetivos del aprendizaje: Entender que la oxidación biológica de sustratos transcurre por rutas catabólicas que generan NADH y que éste se oxida en la CTEM por varios transportadores red-ox situados en complejos proteicos de membrana. 2. Conocer que la Coenzima Q y el citocromo c son transportadores móviles de e- entre los complejos. 3. Entender que los H+ son traslocados a través de la membrana mitocondrial por los complejo I, III y IV. 4. Interpretar que la reducción de cada molécula de O2 por 2 NADH hasta 2 H2O requiere 4 e- y produce la translocación de 20 H+ desde la matriz mitocondrial al espacio intermembranoso. GLOBAL: Comprender como la ∆G º de la oxidación de la coenzima NADH se conserva como un gradiente electroquímico de H+ en la membrana interna mitocondrial. 1. Oxidorreducción biológica Las células vivas requieren energía para ejercer sus funciones. Las células usan la energía química almacenada en las moléculas orgánicas (nutrientes) para generar ATP, molécula que necesitan para desarrollar trabajo útil (biosíntesis, contracción, transporte, etc) Para generar ATP, las moléculas orgánicas nutrientes (carbohidratos, ácidos grasos, proteínas, etc.) se degradan por las rutas catabólicas y esta degradación oxidativa es exergónica. La oxidación de estos nutrientes va a generar cofactores reducidos: NADH, FADH2, etc.; y éstos ceden sus equivalentes de reducción al O2 molecular a través de la cadena transportadora mitocondrial, donde se va a generar la mayor parte del ATP celular. Potencial de oxido-reducción y energía libre. Las reacciones bioquímicas en los organismos vivos son de transferencia de energía. Frecuentemente ocurren acopladas unas a otras para que puedan ser favorables termodinámicamente. Acopladas son también las reacciones de oxido-reducción (redox). La reducción se puede definir como la ganancia de un electrón o de un equivalente de reducción [H]; mientras que la oxidación es la perdida de un electrón o de un equivalente de reducción [H]. [H] = 1 e- + 1 H+ El ión ferroso (Fe+2 ) se oxida a ión férrico ( Fe+3 ) por perdida de un electrón.: Fe+2 - eFe+3 Así mismo, el ión férrico se reduce a ión ferroso por ganancia de un electrón: Fe+3 + eFe+2 En las reacciones bioquímicas, un metabolito reducido (AH2 ) se oxida a (A), mediante la reacción redox con NAD+ (ox) que en el proceso se reduce a NADH + H+: AH2 (reductor) + NAD+(oxidante) A(oxidado) + NADH (reducido). En el metabolismo celular se producen muchas reacciones redox donde la transferencia de electrones desde el NADH hasta el O2 está acoplada a la síntesis de ATP en la respiración mitocondrial. LA ECUACIÓN DE NERNST La relación que existe entre la energía libre y la energía eléctrica o red-ox es: ∆ G º = - N* F* ∆ E o N = Número de e- transferidos en la reacción de oxidorreducción. E = Potencial eléctrico en voltios F = una constante de proporcionalidad = 23.060 cal / voltios = 96. 487 coulomb * equiv -1 Deducción: ∆ E0 = R*T * ln K Ecuación de Nernst N*F N * F * ∆ E o = R * T * ln K ∆ G o = -R * T * ln K Sustituyendo ∆ G º = -N * F * ∆ E o ∆ G º = - N* F* ∆ E o ' Para los sistemas biológicos es normal expresar el potencial redox (E0 ) a pH 7,0, en el cual el potencial de electrodo de hidrógeno es de - 0,42 voltios. Como regla general los compuestos reductores transfieren electrones a los oxidantes. Un reductor fuerte tiene un potencial eléctrico en voltios muy negativo, mientras que un oxidante lo tiene positivo. El potencial de reducción estándar de los sistemas de oxidorreducción nos permite predecir la dirección del flujo de electrones de un sistema a otro, bajo condiciones estándar. NADH y FADH2 En las reacciones metabólicas el poder reductor de los nutrientes pasará a las coenzimas de oxidoreducción (NAD+/NADH + H+ y FAD/ FADH2), que en varios pasos ceden los e- al O2. La energía se recupera en un gradiente de H+, que a su vez promueve la fosforilación del ADP a ATP (fosforilación oxidativa) Bioquímica-2º F (2010-11) -T 17-2 Cadena respiratoria: Transporte Electrónico mitocondrial Una célula típica contiene aproximadamente 2 000 mitocondrias, cada una del tamaño aproximado de una bacteria. La membrana mitocondrial interna está muy invaginada y contiene un sistema complejo de enzimas y cofactores que producen ATP, la molécula-moneda de energía celular usada por todas las formas de vida. ¿De donde viene la energía y como es canalizada hacia la síntesis de ATP? La fuente de la mayor parte de la energía utilizada para la síntesis del ATP es la oxidación del NADH, cuya oxidación libera 218 kJ /mol en condiciones estándar. Para maximizar la recuperación de esta energía libre en forma aprovechable, la oxidación de NADH se produce en varias etapas que están mediadas por una serie de transportadores de e- situados en la membrana interna mitocondrial. Algunos de estos transportadores (centros red-ox) son móviles, y otros son componentes de complejos proteicos (I, III y IVII). La reducción se va produciendo a favor de potencial de red-ox ∆E. La ∆Gº desprendida en estas reacciones red-ox se almacena en forma de gradiente electro-químico de H+ en la membrana interna. Este gradiente es aprovechado por la ATP sintasa para sintetizar ATP. Estructura de la cadena respiratoria: composición y localización subcelular Hay tres complejos proteicos transmembrana (I, III y IV), otro periférico (II) y dos transportadores móviles (Co Q, cyt c) formando parte de la cadena de transporte electrónico mitocondrial (ver figuras de arriba y abajo). Complejo I:NADH deshidrogenasa (FMN y Fe-S) El complejo I tiene proteínas, un mononucleotido de flavina (FMN) y centros Fe-S. El NADH transfiere 2 e- al FMN para formar FMNH2 reducido. FMNH2 pasa sus e- a una serie de 6 ó 7 clusters Fe-azufre y éstos los pasan al transportador móvil ubiquinona o CoQ . Cuando la transferencia de e- es completa, CoQH2, molécula no polar, difunde dentro de la membrana. Durante la transferencia de e-, el complejo I bombea 4 H+ al espacio intermembranoso. Complejo II: sucinato deshidrogenasa y otras deshidrogenadas (FAD y Fe-S) Como Complejo II hay varias flavoproteínas (FAD), que reciben edesde sustratos diversos para formar FADH2, y el FADH2 transfiere el par de electrones a la CoQ, igual que el Complejo I. Los e- que reducen al FAD hasta FADH2 provienen de la oxidación del succinato, metabolito del ciclo del ácido cítrico. También pueden originarse en la oxidación de un ácido graso o del Glicerol-3-P. Complejos II (ver figura a la izquierda) Ya que el potencial estandar de reducción del FADH2 es solo ligeramente menor que el de la CoQ, el complejo II no bombea ningún H+ fuera de la matriz. Bioquímica-2º F (2010-11) -T 17-3 Complejo III: CoQH2-Cit c reductasa (transportadores: Cyt c1, Fe-S, Cyt b y Cyt b1) Los dos e- ,que entraron en la cadena por el C. I o por el C. II, y que lleva la CoQH2 son transportados hasta el Complejo III. Y éste los ha de llevar hasta el C. IV, a través del cyt c. CICLO Q: Puesto que el siguiente portador móvil de e-, el citocromo c, solo puede transportar 1 e-, uno de los e- de la CoQH2 reducida entrará en la ruta conocida como el ciclo Q, en el complejo III. La CoQH2 transfiere 1º un e-, a través de un cluster de Fe-azufre y de un citocromo c1, a un citocromo c situado en la cara del espacio intermembranoso del Complejo III. En este proceso, un H+ liberado por CoQH2 pasa hacia el espacio intermembranoso. La transferencia del segundo e- también libera un H+ al espacio intermembrana. Este e- pasa a través de un par de Cytos tipo b dentro del complejo para realizar el ciclo Q. La CoQ oxidada difunde a su lugar de unión sobre el formando el radical complejo III junto a la cara de la matriz, donde retorna el e- secuestrado por Cyt b, produciendo la forma radical CoQH¥. Un segundo citocromo c recibe su e- desde otra molécula de CoQH2. Como antes, un e- va al citocromo c, mientras el otro e- pasa al radical anterior CoQH¥, reduciéndolo a CoQH2 esto es el ciclo Q. Complejo IV: Cyt c oxidasa (transportadores: 2Cu, Cyt a-Cyt a3-Cu) El citocromo c reducido pasa sus e- al Complejo IV. Y éste pasa los e- al O2 molecular, para reducirlo a dos moléculas de H2O. La reducción del O2 require 4 e- y por tanto son necesarios dos ciclos totales de toda la cadena para completar la reducción de 1 molécula de O2. Dos e- pasan por un centro de Cu binuclear, cercano a la superficie citosólica, hasta un par de citocromos tipo-a situados en el interior del complejo, reduciéndolo. Por cada uno de los e- transferido, un H+ se transfiere desde la matriz al espacio intermembranoso. El oxígeno diatómico se une al complejo binuclear reducido. (La redistribución interna de e- alrededor del complejo binuclear y una TYR esencial escinde rápidamente el enlace O-O, generando un hidróxido de Cu, un complejo oxiférrico y un radical tirosilo. El tercer e- del citocromo c se une a dos H+ de la matriz, convierte el hidroxido a agua mientras se regenera la TYR. Con la adquisición del cuarto e- y un cuarto H+ de la matriz, el grupo oxiferrilo es reducido a hidróxido férrico en estado de reposo, y así se completa el ciclo). Fosforilación oxidativa: teoría quimiosmótica. Por cada molécula de oxígeno reducido: - Cuatro e- son transportados a través de la cadena desde 2 moléculas de NADH - 20 H+ se transfieren desde la matriz al espacio intermembranoso. Además, 4 H+ de la matriz se usan para formar 2 H2O por cada O2. La energía libre liberada por las reacciones redox se almacena en el gradiente de H+ acumulado en el espacio intermembranoso. Los 20 H+ serán de nuevo transferidos hacia la matriz a través de una proteína ATP-sintasa, que conduce la síntesis de 6 moléculas de ATP, un proceso conocido como fosforilación oxidativa. La oxidación de 2 moléculas de FADH2 iniciada por el complejo II también rinde los cuatro enecesarios para reducir el oxígeno a agua pero bombea sólo 12 H+ hacia fuera de la matriz y por tanto rinde solo 4 moléculas de ATP. Bioquímica-2º F (2010-11) -T 17-4 Acoplamiento de la fosforilación oxidativa al transporte electrónico mitocondrial: rendimiento energético en la formación de ATP. Se dan dos situaciones: 1) los e- entran a través del complejo I, y 2) entran por el complejo II 1) 2NADH 4e- O2 H2O 20 H+ 6 ATP, 1 NADH 10 H+ 3 ATP El cambio de energía libre estandard cuando un par de electrones de NADH pasan al oxígeno molecular se puede calcular: Eo’ para NAD/NADH+H+ = -0,32V ∆G´´o = - n F ∆E´´o Eo’ para 1/2 O2 + 2H+/H2O = +0,82V ∆E´´o = 0,82 – (-0,32) = 1,14 V ∆ G o = - 52,7 Kcal * mol-¹ = - 220,286 KJ / mol Rendimiento < 1.- El paso de dos electrones del NADH al oxígeno va acompañado por una gran disminución en la energía libre, que podría hacer factible la síntesis de 7,5 moles de ATP, si se asume una energía libre de hidrólisis para el ATP de 7,3 Kcal*mol-1 o 30,5 KJ / mol ( 52,7/7,0 =7,5 ATP) o 220,286 / 30,5 = 7,3 ATP Sin embargo, el rendimiento de la fosforilación oxidativa será sólo de aproximadamente un 41 %, puesto que se sintetizan de hecho 3 ATP (aproximadamente). 2) 2 FADH2 4 e- O2 H2O 12 H+ 4 ATP 1 FADH2 2 ATP TEORÍA QUIMIOSMÓTICA: La energía del transporte electrónico impulsa un sistema de transporte activo que bombea protones fuera de la matriz mitocondrial, lo cual genera un gradiente de H+ con un potencial electroquímico que posibilita la síntesis de ATP mediante la activación de la ATP-sintasa. Esta hipótesis se basa en: i) la existencia de una fuerza protón-motriz con dos componentes electro-químico: Se genera una diferencia de potencial (voltaje) transmembrana y un gradiente de pH, pHmatriz > pHintermembrana ii) un sistema de membrana interna intacta. El uso experimental de los agentes desacoplantes, de los inhibidores y/o de los ionóforos fueron apoyos adicionales para comprobar esta hipótesis formulada por P. Mitchell en 1961. AGENTES DESACOPLANTES.- Son aquellas sustancias que disminuyen la fuerza protón-motriz, disminuyendo el gradiente de H+ en la membrana interna mitocondrial. Por ejemplo: Dinitrofenol y los compuestos ionóforos (permiten el paso de iones a través de membranas) Estudio de la ATPasa.La ATP sintasa es un complejo proteíco formado por muchas subunidades organizadas en dos estructuras con forma diferenciada: posee una zona esférica, llamada factor F1 dirigida hacia la matriz mitocondrial, y otra parte canal, el factor F0, integrado en la membrana interna mitocondrial. Las subunidades que componen cada parte: F0= a b2 c12 y F1= α3 β3 γ δ ε Mecanismo de acción Las 3 unidades β de la ATP sintasa no son equivalentes, la rotación de γ−ε las cambia la conformación. Según va girando el complejo F0 por el paso de 3 H+ las unidades β cambian de conformación: L, T y O. L: une ADP y Pi y es catalíticamente inactiva T: sintetiza ATP, es catalíticamente activa O: libera ATP Bioquímica-2º F (2010-11) -T 17-5 Lanzaderas Lanzaderas o transportadores de equivalentes de reducción [H] = 1e- + 1 H+, desde el citosol al interior mitocondrial. La glucolisis y otras vías metabólicas oxidativas, catabólicas, generan en el citosol cofactores reducidos, NADH, EFADH2, que allí no pueden oxidarse a NAD+ y FAD para seguir actuando como coenzimas en las oxidaciones metabólicas de las nutrientes, catalizadas por las deshidrogenadas. El traspaso de este poder reductor [H] desde el citosol hacia la mitocondria para convertirlo en energía, ATP, se efectúa con reacciones soportadas en dos sistemas de lanzaderas: la del glicerol-3-P y la de malato-aspartato. 1.-LANZADERA DEL GLICEROL-3-P Se basa fundamentalmente en la enzima glicerol-P deshidrogenasa La glicerol-3-P deshidrogenasa es una flavo-proteína de membrana tipo complejo II Esta proteína enzimática toma los e- del NADH citoplasmático, regenerando allí el NAD+ necesario para metabolismo citosólico y los pasa a la CoQ, transportador móvil en la membrana interna mitocondrial. La glicerol-P deshidrogenasa es una flavoproteína, su cofactor redox es el FAD FADH2 el Estos 2e- en su paso por los complejos III y IV bombearán sólo 6H+ y por tanto la fuerza H+-motriz generada servirá para sintetizar 2 ATP. 2.- LANZADERA MALATO-ASPARTATO La lanzadera malato-aspartato se basa en la función de varias proteínas: transportadoras de membrana y proteínas enzimas solubles Transportadores: Sistemas de transporte de compuestos iónicos a través de la membrana interna mitocondrial. Enzimas: Malato deshidrogenasa, MDH y glutamato oxalacetato transaminasa, GOT Los NADH citosólicos ceden sus e- al oxalacetato, que se reduce a malato y entra a la mitocondria. Los 2e- del NADH citosólico que entran con el malato acaban como NADH mitocondriales; que descargan en la cadena de transporte electrónico y bombearán protones, 10 H+ y rendirán el potencial suficiente para sintetizar 3 ATP. El resto de reacciones reequilibra el sistema. REDUCCIÓN INCOMPLETA DEL OXÍGENO MOLECULAR.Si el O2 acepta menos de cuatro electrones se reducirá parcialmente: a radical superóxido (O2-) si sólo acepta un electrón; o a peróxido de hidrógeno (H2O2) si acepta sólo dos. Esto genera especies reactivas de oxígeno (ROS) causantes del estrés oxidativo.