9. la energía reticular
Anuncio
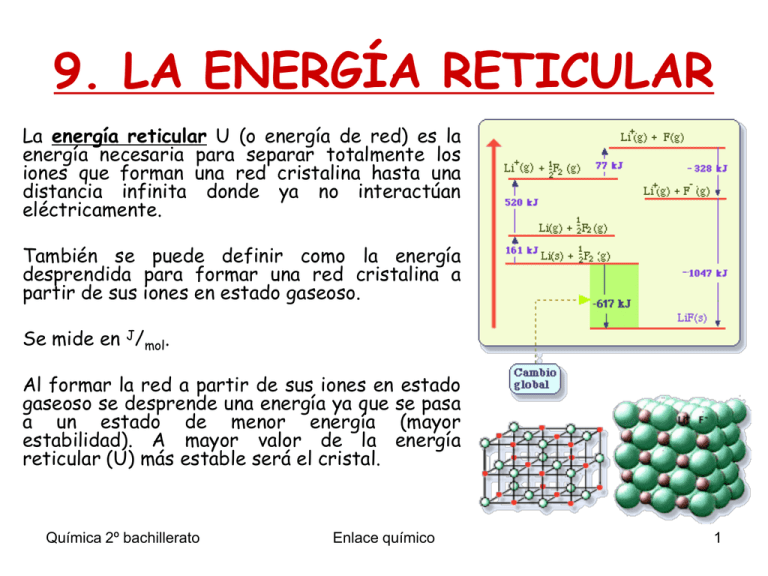
9. LA ENERGÍA RETICULAR La energía reticular U (o energía de red) es la energía necesaria para separar totalmente los iones que forman una red cristalina hasta una distancia infinita donde ya no interactúan eléctricamente. También se puede definir como la energía desprendida para formar una red cristalina a partir de sus iones en estado gaseoso. Se mide en J/mol. Al formar la red a partir de sus iones en estado gaseoso se desprende una energía ya que se pasa a un estado de menor energía (mayor estabilidad). A mayor valor de la energía reticular (U) más estable será el cristal. Química 2º bachillerato Enlace químico 1 9. LA ENERGÍA RETICULAR El ciclo de Born-Haber muestra todas las energías implicadas en la formación de la red cristalina. NaCl (cristal) Cl-+ Na+ (gas) Procesos parciales Proceso directo Energía de Disociación D 1/2 Cl2 (g) + 1/2 D Cl (g) Energía de sublimación S Na (s) + S Na (g) Energía de ionización EI Afinidad electrónica EA Na (g) + EI Na+ (g) + eCl (g) + e- Cl-(g) + EA Energía reticular U Na+ (g) + Cl- (g) Na+ + Cl-(cristal) + U Q Na (s) + 1/2 Cl2 (g) NaCl (cristal) La energía total se conserva Q = S+ 1/2 D + EI + EA + U Ley de Hess Química 2º bachillerato Q = Entalpía de formación Enlace químico 2 9. LA ENERGÍA RETICULAR El ciclo de Born-Haber describe el proceso de formación de una red iónica desde un punto de vista termodinámico. Ej: ciclo de Born-Haber aplicado al NaCl: • • • • • • Entalpía de disociación: energía que hay que suministrar para separar la molécula de cloro en estado gaseoso (solo necesito la mitad). Entalpía de sublimación: energía que hay que suministrar para pasar el sodio de estado sólido a estado gaseoso. Energía de ionización: energía que hay que suministrar para ionizar el átomo de sodio en estado gaseoso. Afinidad electrónica: energía que se desprende al ionizar un átomo de cloro. Energía reticular: energía que se desprende al formar la red cristalina (más estable). Entalpía de formación: la suma de todos los procesos anteriores. Química 2º bachillerato Enlace químico 3 9. LA ENERGÍA RETICULAR Química 2º bachillerato Enlace químico 4 9. LA ENERGÍA RETICULAR Las energías absorbidas se consideran positivas y las energías desprendidas negativas. El compuesto iónico con menor distancia internuclear (y mayor densidad de carga) tendrá una mayor energía reticular. 1 H f H s H d EI AE U 2 La entalpía de formación permite predecir la estabilidad del cristal hipotético, un valor negativo implica que la formación se corresponde con un mínimo de energía y el cristal se forma (en caso contrario no se forma). Química 2º bachillerato Enlace químico 5 9. LA ENERGÍA RETICULAR La energía de red es una medida de la estabilidad del cristal iónico, y cuanto mayor sea más difícil será romper el cristal. En un compuesto iónico no se establece un único enlace entre un ion positivo y un ion negativo, sino que se forma un cristal en el que existen muchos iones positivos y negativos colocados de forma ordenada. La fortaleza del enlace iónico dependerá de los estable y compacta que sea la red cristalina. Los factores que influyen en la estabilidad del enlace iónico son: Cargas iónicas. Un compuesto iónico es más estable cuanto menor sea la carga de sus iones. Tamaño de los iones. Un compuesto iónico es más estable cuanto más compacta sea la red cristalina y, por tanto, cuanto más parecidos sean el tamaño del anión y del catión. Diferencia de electronegatividades. Un compuesto iónico será más estable cuanto mayor sea la diferencia de electronegatividades entre los átomos de partida. Química 2º bachillerato Enlace químico 6 EJERCICIO-EJEMPLO Calcular la afinidad electrónica del bromo conociendo los siguientes datos: Potencial de ionización del potasio = 100 kcal/mol. Energía de formación del KBr = -93,7 kcal/mol. C C Energía de sublimación del potasio = 21,5 kcal/mol. Energía de disociación del bromo = 53,4 kcal/mol. Energía reticular del KBr = -161,2 kcal/mol. Representar el ciclo de Born-Haber del proceso. Realizar su diagrama de energía correspondiente. Química 2º bachillerato Enlace químico 7 EJERCICIO-EJEMPLO Buscar los valores del siguiente ciclo y comprobar, describiéndolo, que es correcto: Química 2º bachillerato Enlace químico 8 EJERCICIOEJEMPLO Explica el siguiente diagrama. Extrae toda la información de la siguiente representación del ciclo de Born-Haber de la formación del yoduro de potasio (sólido) a partir de sus elementos. Determina su energía reticular. Química 2º bachillerato Enlace químico 9 RELACIÓN DE EJERCICIOS ENERGÍA RETICULAR Química 2º bachillerato Enlace químico 10





