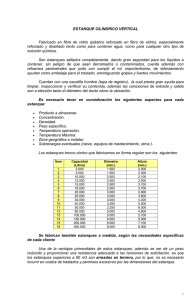
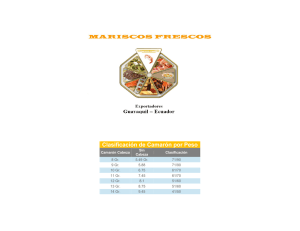
Descarga aquí
Anuncio

CESASIN Instituto de Ciencias del Mar y Limnología, U.N.A.M. EL FITOPLANCTON EN LA CAMARONICULTURA Y LARVICULTURA: IMPORTANCIA DE UN BUEN MANEJO Rosalba Alonso-Rodríguez Federico Páez-Osuna e Ismael Gárate-Lizárraga CESASIN Instituto de Ciencias del Mar Instituto de Ciencias y Limnología, U.N.A.M.del Mar y Limnología, U.N.A.M. EL FITOPLANCTON EN LA CAMARONICULTURA Y LARVICULTURA: IMPORTANCIA DE UN BUEN MANEJO Edición técnica y diseño de portada: Germán Ramírez Reséndiz. D.R. 2004. Instituto de Ciencias del Mar y Limnología. Derechos exclusivos de edición reservados para todos los países. Prohibida la reproducción total o parcial porcualquier medio sin autorización previa del editor. Publicado por el Instituto de Ciencias del Mar y Limnología de la Universidad NacionalAutónoma de México y el Comité de SanidadAcuícola de Sinaloa,. E-mail: [email protected] ISBN: XXX-XX-XXXX-X Impreso en México / Printed in Mexico TABLA DE CONTENIDO 1 El fitoplancton en la camaronicultura ..................................................1 1.1 Introducción...................................................................................1 1.2 Importancia dietética del fitoplancton para el camarón en el medio natural..............................................................................3 1.3 Importancia dietética del fitoplancton para el camarón en estanques de cultivo ...................................................................7 1.4 Abastecimiento de agua y su relación con el fitoplancton...........19 1.5 Mareas rojas en estanques y sus efectos......................................35 1.6 Condiciones para un buen desarrollo del camarón en un ciclo de cultivo .........................................................................47 1.7 Factores críticos para la producción de especies benéficas .........52 1.8 Recomendaciones para un buen manejo y la producción de microalgas útiles......................................................................60 2. El fitoplancton y la larvicultura.........................................................63 2.1 Introducción .................................................................................63 2.2. Mareas rojas en la zona costera ..................................................65 2.3 Estructura química de las biotoxinas: ..........................................69 i 2.4 Mareas rojas en el noroeste de México .......................................72 2.5 Mareas rojas nocivas para la larvicultura....................................75 2.6 Mortalidad de larvas en laboratorios de producción de Sinaloa .85 2.7 Normas para evitar los riesgos derivados de la presencia de mareas rojas y biotoxinas ........................................................89 2.8 Recomendaciones para prevenir y contrarrestar los efectos del fitoplancton nocivo en la larvicultura .................................94 3 Prevención, mitigación y remediación de problemas de fitoplancton asociado a la camaronicultura..................................97 Agradecimientos..................................................................................111 Referencias ..........................................................................................112 ii 1 El fitoplancton en la camaronicultura 1.1 Introducción Para un gran número de organismos en cultivo, la introducción de determinadas especies de fitoplancton produce mejores resultados en términos de sobrevivencia, crecimiento y factor de conversión que cultivándolas en aguas claras, sin fitoplancton. La razón de este papel positivo de las microalgas en los estanques de cultivo no ha sido completamente comprendida, pero no hay duda de que la calidad del agua se mejora y se estabiliza debido a la producción de oxígeno, la estabilización del pH, la disponibilidad de sustancias esenciales para la cadena trófica, la asimilación de productos excretados por los organismos en cultivo que son potencialmente tóxicos, la inducción de la actividad de captura de presas, la regulación de las poblaciones bacterianas, la estimulación de la inmunidad y otros factores que aún no son suficientemente entendidos. Bajo ciertas condiciones, y siendo los estanques de cultivo un ambiente típicamente eutrófico o hipertrófico, el 1 enriquecimiento de nutrientes comúnmente promueve un incremento excesivo de la cantidad y tipo de microalgas que pueden provocar problemas de anoxia, tanto en los estanques de cultivo como en el agua de abastecimiento afectando así al camarón. En estos casos, la industria acuícola puede verse afectada por tales florecimientos algales nocivos como ha ocurrido en numerosos países y recientemente en Sinaloa provocando a los productores, daños económicos considerables. Esta contribución pretende dar un panorama de las causas y condiciones que dan lugar a la proliferación de especies de fitoplancton inocuas, nocivas o tóxicas para el camarón en cultivo. Se presentan algunas medidas de prevención y manejo para mejorar la calidad y abundancia de fitoplancton que permitan obtener una buena producción, y por último, se exponen las experiencias de otros países en cuanto a las medidas de mitigación que se han implementado para enfrentar la presencia de especies de fitoplancton tóxico o nocivo en sistemas de cultivo. 2 1.2 Importancia dietética del fitoplancton para el camarón en el medio natural. Hay dos categorías de vegetales que potencialmente pueden ser consumidos por los peneidos (Dall et al., 1990); primero, las plantas terrestres emergentes (plantas terrestres, manglar y pastos) junto con las macrofitas sumergidas (pastos marinos); y secundariamente, a las algas, incluyendo a las de vida libre y a las epífitas. El detritus definido como el material biogénico en diferentes estadios de descomposición microbiana, representa una fuente potencial de energía para especies como el camarón. Se ha encontrado hasta 50% de detritus en el tracto digestivo de Metapenaeus macleayi (Ruello, 1973). Robertson (1988) encontró grandes cantidades (74%) de material detrítico en P. merguiensis de 7-10 µm. Este último autor señala que es muy difícil evaluar el papel nutricional del detritus debido a que está constituído por un complejo material de partículas derivadas de las plantas, heces fecales de peces y crustáceos, donde la fracción orgánica está unida dentro de una matriz con partículas de diatomeas y bacterias. Hasta donde se conoce, los peneidos se describen como ”omnívoros 3 oportunistas” y experimentalmente se ha observado que estos organismos muestran preferencias cuando tienen la oportunidad de escoger el alimento. Chamberlain y Lawrence (1981) encontraron que L. vannamei crece más rápido cuando se alimenta de una dieta compuesta de peneidos, calamar, poliquetos y almeja que cuando se alimentan solamente de uno de estos organismos. Por otra parte, se ha observado que la dieta de muchas especies de camarón cambia significativamente con el tamaño y/o la edad (Dall et al., 1990). Parece haber dos razones para esto, primero, debido a un cambio en el hábitat conforme crecen y segundo, por un cambio de la dieta al pasar a juveniles que incorporan vegetales, a una dieta de adultos que puede ser exclusivamente carnívora. Ejemplo de esto se ha evidenciado en especies de importancia comercial como P. monodon, que cuando es juvenil es herbívoro y se alimenta de algas verdes y material vegetal no identificado, mientras cuando es adulto es omnívoro con una dieta a base de crustáceos, anélidos y algas (El Hag, 1984). En el medio natural, la vida larval del camarón dura menos de 3 semanas y comprende tres etapas, nauplio, protozoea y mysis, antes de ser una 4 postlarva. Cada etapa larval comprende de 3 a 6 subetapas en las cuales hay cambios en la morfología, capacidad natatoria y en el comportamiento alimenticio. Las larvas nauplio se alimentan de la reserva alimenticia depositada en los huevos. A partir del estadio larvario de protozoea 1, el camarón, necesita de un alimento para satisfacer sus requerimientos nutritivos y energéticos, la protozoea es generalmente herbívora y las etapas mysis y postlarva tienden gradualmente a ser carnívoras. Al llegar a la etapa de postlarvas, son transportadas por las las corrientes, acercándolas a la costa facilitando así su penetración en los cuerpos lagunares donde sus hábitos son bentónicos y ayudadas por la disponibilidad de alimento, pasan a ser juveniles. Se considera que las postlarvas son oportunistas, si las diatomeas dominan en el medio, se alimentan principalmente de diatomeas. La manera en que diversas diatomeas influyen sobre el crecimiento y sobrevivencia del camarón es debido a las diferencias en los nutrientes que contienen, más que al tamaño o forma de las mismas. La dieta natural en camarones juveniles y adultos consiste en consumir una amplia variedad de micro invertebrados (moluscos, crustáceos y poliquetos) y 5 material vegetal, por eso se consideran omnívoros. La dieta cambia estacionalmente, de acuerdo a la disponibilidad de la presa. Se ha observado en juveniles de camarón que la proporción de detritus consumidos, proveniente de la descomposición del mangle, depende de la cercanía a la costa, llegando a ser de hasta 84% en la cabeza de los esteros (Chong et al., 2001). En cuanto a la nutrición, se sabe que la composición de las presas de Penaeus sculentus varía de 70 a 80% en el contenido de proteína, 11% en el de carbohidratos y una proporción muy baja de lípidos 12%. La dieta para camarón de 15 a 25 g en P. sculentus cambia durante el período de muda, consume 2.7 g/día durante la mayor parte del ciclo de muda y solamente 1.2 g/día dos días antes de que esta se realiza, prefiriendo los moluscos como fuente de alimento (Rothlisberg, 1998). Los hábitos de alimentación pueden ser nocturnos y la sensibilidad a la luz determina el ascenso y la actividad alimenticia, por lo cual dicha sensibilidad debe considerarse para la elección de los regímenes de alimentación. La hora del día y la densidad fitoplanctónica afectan la intensidad luminosa modificando la hora de ascenso, el momento y duración del período de alimentación (Chong et al., 2001). 6 1.3 Importancia dietética del fitoplancton para el camarón en estanques de cultivo. En los sistemas de cultivo, a las larvas de camarón se les alimenta con una combinación de microalgas como Skeletonema, Chaetoceros, Tetraselmis, Chlorella, Isochysis, etc. y crustáceos, como pueden ser Artemia sp., y copépodos, complementándose la dieta con alimento formulado. El alimento contiene proporciones variables de proteínas, carbohidratos, fibra, calcio, fósforo, vitaminas y aminoácidos, etc. A partir de un estudio con isótopos estables de nitrógeno para identificar las fuentes de alimento en postlarvas y juveniles de P. monodon, se encontró que durante los dos primeros meses, la fuente de alimento es planctónica, la postlarva se alimenta básicamente de zooplancton, el cual es consumido directamente (Focken et al., 1998). Al avanzar el ciclo de cultivo, la fuente de alimento se centra en el alimento suministrado, aunque una parte significativa de este, no es asimilado por los camarones. A las 6 semanas, la composición bioquímica de P. monodon refleja el origen de material asimilado en sus tejidos: 28.90% de alimento artificial 7 y 42.3% de materiales vegetales, 1.8% de crustáceos y 27% de detritus (materia orgánica y mineral). En la semana 11 son 47, 21.1, 22.8, 8.5 y para la semana 16, 21.7, 34.3, 31.7, 12.9, respectivamente. La preferencia de alimento no cambia con la hora del día, los hábitos alimenticios en la semana 6 son nocturnos y después son diurnos. A menos de 4 mg/L de oxígeno, se observa una reducción en el contenido intestinal y cuando los niveles de oxígeno son altos, se alimenta de día (Focken et al., 1998). En P. japonicus se encontró que el 30% del incremento en biomasa del camarón se derivó de la ingestión directa o indirecta de fuentes naturales de alimento. Para el caso de L. vannamei adulto en cultivo semi-intensivo, el 40-60% de los tejidos proviene de la biota (Focken et al., 1998). Diversos autores han investigado si el consumo de microalgas es incidental, porque el material detrital (material orgánica y mineral) del cual se alimenta el camarón se encuentra en el fondo del estanque, o bien, adherido a él, ya que se encuentra una infinidad de microalgas que son consumidas por el camarón (Gómez-Aguirre y Martínez-Córdoba, 1998) Sin embargo, hay observaciones que muestran que la composición del material encontrado en el intestino del camarón contiene mayor cantidad 8 de tejido vegetal que el material encontrado en el fondo por lo tanto puede suponerse una ingestión selectiva (Focken et al., 1998). Otra fuente importante de proteínas y energía para el camarón en cultivo son los crustáceos y los restos de éstos, incluido el propio camarón. El alimento artificial difícilmente ocupa el 50% del contenido intestinal. Las preferencias por los materiales no cambian durante el día pero sí a lo largo del ciclo de cultivo debido al desarrollo. El alimento artificial es importante para complementar el alimento natural y por su valor nutricional (Focken et al., 1998). En un estudio sobre el contenido nutricional de 40 especies de microalgas pertenecientes a 7 clases, se encontró que las microalgas proporcionan una mezcla balanceada de sustancias nutritivas para alimentar a los crustáceos durante sus primeras etapas larvales y alimentan al zooplancton que forma parte de la cadena alimenticia en sistemas acuaculturales. La cantidad de proteínas que proveen es variable y puede llegar a constituir el 50%, y de carbohidratos y lípidos hasta el 23% de cada uno (Brown, 1997). Todas las microalgas son ricas en aminoácidos esenciales. El contenido de polisacáridos es variable pero la glucosa llega a ser de hasta 87%. Las 9 diatomeas y algunas fitoflageladas son ricas en ácidos grasos poliinsaturados (PUFAs), conteniendo hasta 10%, otras como las clorofitas son deficientes en estos, y solamente contienen hasta 3%. Todas las microalgas analizadas poseen altas concentraciones de ácido ascórbico (vitamina C) y riboflavina (vitamina B2) (Brown et al., 1997). En Sonora se han realizado estudios sobre la optimización y estrategias de alimentación a nivel experimental y comercial (Martínez-Córdoba et al., 2002). Se ha encontrado que los carotenoides y astaxantinas son componentes naturales del fitoplancton y pueden ser añadidos en la dieta, mejorando su crecimiento y sobrevivencia. Los carotenos son pigmentos fotosintéticos, la astaxantina es muy apreciada por dar color rosado al músculo del salmón pero también es un factor importante en el sistema inmunológico y hace que los organismos sean más resistentes al estrés (Fig. 1). Una serie de experimentos realizados por Martínez-Córdoba et al. (2002) en estanques revelan que L. vannamei en presencia de fitoplancton crece igual con alimento balanceado con diferente proporción de proteínas (2540%), mientras que L. stylirostris crece adecuadamente en un régimen 10 CH3 CH3 CH3 CH3 CH CH C CH CH CH C CH3 CH CH CH CH C CH CH3 CH CH -Caroteno C CH3 CH CH3 CH3 CH CH3 Astaxantina Fig. 1. Fórmula química del caroteno y de la astaxantina 11 con bajo suministro proteico ajustado a la abundancia de alimento natural, esto es, considerando la aportación del fitoplancton a la dieta. Además, agregando PUFAs al alimento de L. vannamei, es posible reducir la cantidad de proteína suministrada en un 5%. Algunas de las cianobacterias más comunes en estanques de cultivo pertenecen al género Oscillatoria y tienen bajo contenido nutricional (proteínas, aminoácidos esenciales, lípidos y ácidos grasos poliinsaturados) en comparación con las diatomeas y algas verdes. Las algas que crecen en un medio con alto contenido de nitrógeno promueven el crecimiento de camarón mientras que cuando crecen en bajo contenido de nitrógeno tienen menor contenido de proteínas y lípidos y alto contenido de carbohidratos, lo cual puede dificultar la digestión en las primeras etapas larvarias del ciclo de vida del camarón, provocando que no se produzca con suficiente éxito la metamorfosis a la segunda etapa de protozoea. El fitoplancton es el principal productor de oxígeno dentro del estanque durante el día pero durante la noche al igual que el resto de los organismos, respiran, consumiendo gran parte del oxígeno disponible 12 (Yao et al., 2001). El oxígeno es el principal elemento para el desarrollo y la sobrevivencia de cualquier organismo vivo, especialmente en el medio acuático. El oxígeno disuelto en el agua influye directamente en los estanques de cultivo afectando el crecimiento del organismo cultivado y eficiencia de conversión alimenticia. En el manejo de la calidad del agua de estanques de cultivo de peces y/o camarones, el oxígeno disuelto es expresado en términos de miligramos por litro o partes por millón y generalmente, está presente en cantidades de 4 a 14 mg/L. Una disminución o falta de oxígeno disuelto provoca estrés o muerte en los organismos acuáticos, cuando la exposición es prolongada a niveles menores de 1 mg/L. Tres son los factores que generalmente provocan las pérdidas de oxígeno en un estanque (Boyd, 1992): (a) respiración del sedimento (50-55%); (b) respiración del fitoplancton (40-45%); y (c) respiración del organismo cultivado, en este caso, camarón (5%). El oxígeno es una variable clave que determina el éxito en el sistema de producción de post-larvas, los LC50 oscilan entre 1.4 a 3.3. mg/L para larvas y de 1 a 2.2 mg/L para postlarvas (Miller et al., 2002). Una alta producción de fitoplancton trae como consecuencia una 13 1 + NH3 NH4 + NH4 NH3 0.8 pK = 9.302 T = 25 ºC S = 20.3 ‰ 0.5 pK = 8.999 T = 35 ºC S = 20.3 ‰ 0.2 0 5 6 7 8 9 10 11 12 5 6 7 8 9 10 11 12 1 + NH3 NH4 + NH4 NH3 0.8 pK = 9.058 T = 35 ºC S = 35 ‰ pK = 9.354 T = 25 ºC S = 35 ‰ 0.5 0.3 0 5 6 7 8 9 10 11 12 5 6 7 8 9 10 11 12 1 + NH4 + NH3 NH3 NH4 0.8 pK = 9.374 T = 25 ºC S = 44.5 ‰ 0.5 pK = 9.076 T = 35 ºC S = 44.5 ‰ 0.3 0 5 6 7 8 9 10 11 12 pH 5 6 7 8 9 10 11 12 pH Fig. 2. Proporción de amonio (Cτ=1, es 100%) en las formas no-ionizada NH3 (especie más tóxica, zona sombreada) y la forma ionizada NH4 (especie menos tóxica) en las aguas salobres (S=20.3‰), marinas (S=35.3‰) e hipersalinas (S=44.5‰). 14 disminución de la penetración de la luz, lo cual puede provocar disminución de la producción fotosintética en el fondo del estanque. Por las noches, disminuye el oxígeno disuelto debido a la respiración de todos los organismos, incluyendo el fitoplancton. Durante el día, el fitoplancton produce sombra, creando condiciones para que el camarón tenga un ambiente adecuado mientras permanece en el fondo y evita el crecimiento de algas filamentosas. La turbidez es producida por la materia orgánica, sustancias húmicas, material inorgánico como arcillas y por el fitoplancton. La turbidez no fitoplanctónica en estanques fertilizados y no fertilizados, medida como visibilidad del disco de Secchi, puede ser más importante que la originada solamente por el fitoplancton. Por ello, Jamu y Piedrahita (1999) recomiendan el uso del disco de Secchi como indicador de abundancia fitoplanctónica en los casos en los que la concentración fitoplanctónica sea la principal fuente de turbidez en el estanque o cuando la turbidez no algal se mantenga constante. El fitoplancton es la base de la cadena alimenticia en los estanques semiintensivos, la cual comprende a las algas, zooplancton y camarón. Las 15 bacterias, protistas e invertebrados también participan en la dinámica del estanque pero son secundarios en comparación a las actividades realizadas por las microalgas en la producción fotosintética mediante la fijación de carbono, producción de material vivo y la generación de oxígeno. En los estanques intensivos la producción se realiza por bacterias heterotróficas combinada con producción autotrófica. Los restos de alimento y excreciones del camarón son digeridos por bacterias y forman la base de la cadena alimenticia. La respiración del camarón y de los otros organismos de la cadena alimenticia en el estanque, a las altas densidades típicas, requieren obligadamente de aireación mecánica para proveer de suficiente oxígeno para compensar la respiración bacteriana y mantener el equilibrio aeróbico. Los largos periodos de calma y estabilidad física de la columna de agua en el estanque favorecen los florecimientos de cianobacterias, la aireación mecánica disminuye las posibilidades de estos florecimientos y puede servir para suprimir los ya formados. En un sistema eutrófico bien mezclado como lo son los estanques, el carbono inorgánico es repuesto por el CO2 liberado desde los productos de oxidación en la columna de 16 agua y en los sedimentos y por la difusión del CO2 desde el aire al agua, proceso que se ve favorecido por el viento. Los sistemas mezclados raramente tienen limitaciones de carbono inorgánico y florecimientos algales peligrosos. A menudo estos estanques tienen una comunidad fitoplanctónica más diversa incluyendo varios géneros de diatomeas, algas verdes, cianobacterias, dinoflagelados y euglenoides. Las microalgas son capaces de absorber directamente los productos metabólicos producidos en el estanque como son el dióxido de carbono y el amoníaco que pueden ser factores de riesgo para la salud del camarón ya que el bióxido de carbono en exceso provoca disminución de pH y además el amonio es un metabolito que, dependiendo del pH también puede estar en forma de amoníaco (especie más tóxica) o de ión amonio (especie menos tóxica) (Fig. 2). La constante de disociación del amonio K= [NH3] [H+]/ [NH4+] puede ser determinada a partir de ecuaciones empíricas (e.g., Solderberg y Meade, 1991; Millero, 1996) o bien experimentalmente (Whitfield, 1978). En los gráficos de la Fig. 2 se ilustra la proporción de amoníaco y el radical amonio en seis casos que permiten representar las condiciones de 17 salinidad y temperatura típicas para los meses fríos y cálidos en los estanques de cultivo en Sinaloa. En estos gráficos se muestra claramente como la proporción de amonio no ionizado (especie más tóxica), varía en función del pH en los estanques. La excreción de amonio por el camarón es mayor cuanto más elevada es la cantidad de alimento administrado ya que el 60% del nitrógeno adquirido es excretado como amonio, el resto son pequeñas cantidades de urea y ácido úrico. Tanto el camarón como la post-larva excretan una mayor proporción de amonio cuando se les alimenta con alimento balanceado y se reduce cuando su dieta contiene microalgas (Shishehchian et al., 1999). Se sabe que el alimento artificial promueve y mejora la alimentación natural del camarón en cultivos semi-intensivos (Nunes et al., 1996). En la mayoría de las especies cultivadas en granjas semi-intensivas el manejo en cuanto a la alimentación balanceada se basa en el crecimiento y sobrevivencia pero no considera el comportamiento alimenticio del camarón lo cual provoca acumulación y desperdicio de alimento y deterioro de las condiciones del fondo del estanque. En el estanque, la descomposición de la materia orgánica produce amonio, 18 nitrato y nitrito. El camarón responde a un ciclo circadiano, en condiciones naturales y de laboratorio, bajo un ciclo de luz-oscuridad en el cual la actividad sobre el fondo del estanque se lleva a cabo durante el día y emerge a la superficie al oscurecer. El período de alimentación varía de una especie a otra y del ciclo de muda, que determina los ritmos de alimentación (Nunes et al., 1996). 1.4 Abastecimiento de agua y su relación con el fitoplancton La mayor parte de la actividad camaronícola en el mundo se lleva acabo en la zona costera, en instalaciones externas y en estanques de tierra. En Asia, se practica principalmente el cultivo intensivo en estanques de 0.5 a 2 ha con un rendimiento de 3-10 ton/ciclo (Schur, 2002). El cultivo intensivo incluye sistemas de aireación mecánica donde la producción y la tasa de alimentación son altas y proporcionales a la potencia de aireación. En América, la modalidad de cultivo más practicada es el cultivo semiintensivo con rendimientos de 0.25-2 ton/ha/cosecha en estanques sin aireación con dimensiones de 3 a 25 ha. En ambos sistemas, el porcentaje 19 de aereación es de 2-15% (Schur, 2002). Cuando se hace una comparación con estanques de la ecorregión del Golfo de California, se muestra gran similitud con las condiciones descritas anteriormente, tanto en las dimensiones de los estanques, como en la producción (Tabla 1). En los sistemas semi-intensivos se puede llegar a tener un recambio del 2-15% del volumen del estanque por día, representando así sistemas conservativos y de alto uso de agua. Aunque en el noroeste de México se han hecho estudios y se ha observado que recambios menores al 5% afectan negativamente la sobrevivencia y el rendimiento del cultivo, la situación mejora aumentando a 15% el recambio y mediante la aplicación de aireación por 6 horas (Martínez-Córdova et al., 1998). Los sistemas intensivos utilizan menos agua por unidad de cosecha, son conservativos e implican tratamiento de aireación en el mantenimiento de la calidad del agua en lugar del recambio utilizado en el sistema semi-intensivo. Actualmente, hay una tendencia hacia la disminución en el recambio de agua e incluso recambio cero o cero descarga, compensado con el aumento de sistemas de aireación, con buenos resultados. La mayoría de las granjas camaronícolas en la ecorregión Golfo de 20 21 California son de tipo semi-intensivo (89%), siendo en menor proporción las de tipo intensivo (2%) y extensivo (9%), con una densidad media de siembra de 13, 58 y 7 Pl m-2, respectivamente. En los años 2001 y 2002 la tendencia fue a operar solo un ciclo por año, en primavera-verano y la duración del ciclo fluctuó de 120 a 140 días (Páez-Osuna et al., 2003). La gran mayoría de las granjas de tipo semi-intensivo y extensivo, se abastecen de agua de los esteros y lagunas costeras a través de canales naturales o artificiales, o bien directamente. Los esteros y lagunas costeras son de los ecosistemas más productivos y en ellos se desarrollan numerosas actividades pesqueras. Las fuentes de agua estuarina cuyo origen son las lagunas costeras tienden a utilizarse cada vez menos debido a que estas aguas frecuentemente se asocian con ciertos problemas derivados del alto contenido de nutrientes y otros componentes que pueden favorecer procesos de anoxia dentro del estanque. El fitoplancton estuarino está representado por microalgas marinas y de agua salobre. En Sinaloa, se ha encontrado una composición taxonómica similar a la encontrada para aguas estuarinas que abastecen a 42 granjas de camarón en La India (Jing et al., 2000) donde dominan 22 diatomeas, dinoflagelados, cianobacterias, clorofitas y silicoflagelados (Alonso-Rodríguez y Páez Osuna, 2001). Páez-Osuna (2002) menciona que hay una tendencia mayor a la utilización de las aguas de las lagunas costeras como fuente de agua, y que el manejo inadecuado de las descargas de las granjas puede provocar problemas de sustentabilidad de la actividad camaronícola -a mediano y largo plazo- al ser las lagunas costeras el sitio de recarga y descarga de agua. Menciona además que, los efluentes de los estanques camaronícolas deben considerarse potencialmente riesgosos para las aguas receptoras, debido a que generalmente cuentan con un alto contenido de nutrientes, fitoplancton y material sedimentable, que pueden provocar una elevada demanda bioquímica de oxígeno. Además, debido a que las aguas de los estanques generalmente son eutróficas y ricas en biomasa fitoplanctónica, las descargas de los efluentes de los estanques, son motivo de preocupación como fuentes puntuales de polución localizada, aunque se desconoce aún con certeza qué tan significativo puede llegar a ser su efecto en el ambiente. No es difícil presuponer que dada la vulnerabilidad de los ecosistemas que reciben las descargas de los efluentes de la 23 camaronicultura, estos son fuentes de polución potenciales. El crecimiento excesivo de fitoplancton en los estanques puede ser provocado por el exceso de fertilización y alimentación, además de la liberación de los nutrientes provenientes de los sedimentos del fondo. Cuando los estanques son inadecuadamente manejados y/o viejos, los nutrientes que van quedando atrapados en la columna sedimentaria pueden ser liberados y provocar florecimientos algales excesivos, aún sin adicionar fertilizantes, esto luego puede provocar caídas bruscas en el contenido de oxígeno disuelto. Las condiciones meteorológicas (nublados, neblina, calmas) y el régimen de mareas de cuadratura o “muertas” comúnmente se conjugan provocando episodios de hipoxias o anoxias durante las noches y especialmente en las madrugadas (Páez-Osuna et al., 1997). El fitoplancton que proviene de las fuentes de abastecimiento, es modificado dentro del estanque, tanto en composición como en abundancia. El fitoplancton se desarrolla debido a la influencia de factores naturales (luz, temperatura, salinidad, nutrientes) y se promueve su crecimiento mediante la fertilización inorgánica. La composición del fitoplancton, en varias granjas de Sinaloa analizadas, 24 muestra una gran abundancia de cianobacterias (c.a. 90%) sobre los dinoflagelados y las diatomeas, coincidiendo con otras áreas subtropicales del mundo. Las bajas salinidades favorecen las cianobacterias, representantes de los géneros Synechocystis, Oscillatoria y Spirulina; de las diatomeas como Nitzschia, Navicula, Amphora, y Achnantes, y dinoflagelados, representantes de los géneros Gyrodinium, Gymnodinium, Scrippsiella, Prorocentrum y Amphidinium (Cortés-Altamirano et al., 1994; Alonso-Rodríguez y Páez-Osuna, 2001). En estanques de baja salinidad se observó diferente composición en la abundancia por grupos, una alta abundancia y biomasa en orden de importancia correspondiente a clorofitas, diatomeas, cianobacterias y dinoflagelados (McIntosh et al., 2001). En un estudio experimental de cianobacterias bentónicas en estanques de cultivo de camarón realizado por López-Cortés (1999), se analizaron los cambios en las comunidades en correspondencia con el manejo en un ciclo de cultivo. Con la preparación de los estanques, mediante el encalamiento, los agregados de cianobacterias son cubiertos e impiden la captación de luz, y hay cambios drásticos de pH que provocan la 25 desintegración de los agregados, que durante el enjuague se refleja en un aumento de células ya que se rompen los filamentos. Posteriormente, cuando se llenan los estanques mejoran las condiciones de pH y humedad y la comunidad de cianobacterias empieza a regenerarse y a mantenerse a cierta distancia del fondo del estanque respondiendo al movimiento fototáctico; los primeros pobladores del fondo fueron Lyngbia aestuarii y Oscillatoria margaritifera. La fertilización promueve la producción de fitoplancton y afecta las comunidades de cianobacterias en el fondo del estanque, a los dos meses, sin aireación se alcanzan valores altos de oxígeno disuelto durante el día. En las orillas de los estanques se encontraron las cianobacterias Microcoleus chtonoplastes y Oscillatoria limnetica y las bacterias Beggiatoa y Chromatium, lejos de los aireadores, sobre suelo sulfuro-oxidantes (López-Cortés, 1999). La abundancia fitoplanctónica en los estanques de camarón es muy variable. En un estudio de 20 estanques intensivos de camarón en Tailandia se encontró que la abundancia fitoplanctónica en muestras recolectadas con una malla de 60 micras, estuvo entre 1.8 x103 y 72.5 x103 cél/L, y tanto la calidad de agua como la producción fue 26 Tabla 2. Intervalos y abundancia máxima de microalgas en diferentes cuerpos de agua y estanques de cultivo de camarón. Cuerpo de agua Concentración (cél/L) Referencia Océano superficial 1 x 108 Raymont (1980) Estanques fertilizados Alabama, EEUU 2 x 107 Boyd (1990) Lagunas costeras Golfo de California 1 x 103 – 13 x 106 Santoyo (1994) Estanques semi-Intensivos, Sinaloa 2.9 x 108-3 x 109 Cortés-Altamirano et al. (1994) Laguna Costera (Urías) 72 x 106 Pastén-Miranda (1983) Estanques intensivos, Sinaloa 2 x 108-3.4 x 10 9 Cortés-Altamirano et al. (1994) Estanques intensivos Tailandia 1.8 x 103-7.2 x 104 Tookwinas y Songsangjinda (1999) Estanques semi-intensivos Colombia 1 x 108-3.5 x 10 8 Gautier et al. (2001) Estanques de baja salinidad Arizona 1 x 107-5.2 x 107 McIntosh et al. (2001) Estanques extensivos Vietnam 8.6 x 106 Johnston et al. (2002) 27 razonablemente buena (Tookwinas y Songsangjinda, 1999). En los estanques de Sinaloa, se han registrado abundancias cercanas a tres millones de células por litro en condiciones de operación normal y más de 15 mil millones durante los florecimientos (Tabla 2). El sostenimiento de la producción dentro de los intervalos adecuados en un ciclo de cultivo es clave para lograr tener éxito en esta actividad. Las fluctuaciones de nutrientes permiten que se establezcan especies de fitoplancton para las cuales hay un nutriente limitante, el cual en condiciones de cultivo, puede encontrarse en exceso, permitiendo su desarrollo. En términos generales, el fitoplancton requiere de nutrientes inorgánicos disueltos en una relación molar N:P de 16:1. Si esta relación se reduce por debajo de 10:1, el desarrollo de la biomasa puede ser limitado por el nitrógeno. Si, en cambio, esta relación se presenta con una proporción >20:1, la biomasa estará limitada por el fósforo (Boynton et al. 1982). La constante de saturación media es la concentración en la cual la captura del nutriente es la mitad de su valor máximo, y las concentraciones debajo de estos valores pueden limitar las tasas de crecimiento algal (Fisher et al. 28 1992). Los valores típicos de saturación media para el nitrógeno inorgánico disuelto son de 1 a 2 µM (1.5 a 30 µg N/L), para el fósforo inorgánico disuelto de 0.1 a 0.5 µM (3 a 16 µg P/L), y para los silicatos es de 1 a 5 µM (90 a 460 µg SiO4/L) (Eyre, 2000); sin embargo, no se ha establecido que tan válido es esto para las aguas en los ambientes subtropicales costeros como es la zona costera del noroeste de México. El otro punto es que se ha puesto énfasis especial en la relación Si:N o Si:P como los elementos potencialmente limitantes para las diatomeas, debido a que las actividades humanas han influido significativamente en el aporte de N y P pero no del Si en las aguas costeras. Las diatomeas requieren de Si y N en una relación molar de aproximadamente 1 (Redfield et al., 1963; Dortch y Whitledge, 1992). En la medida en que esta relación pasa de >1 a <1, el ambiente químico pasa de un estado que permite a las diatomeas competir efectivamente con otra clase de algas, a un estado diferente, que le da ventajas a los taxa de los flagelados y dinoflagelados que tienen requerimientos pequeños de Si (Conley, 1993). Normalmente, los estanques camaronícolas reciben grandes cantidades de alimento, del cual una fracción es asimilada como biomasa del camarón, 29 pero otra alcanza el agua y los fondos del estanque como desperdicio metabólico que poco a poco, al acumularse, enriquece el agua, fomentando el crecimiento de distintas poblaciones del fitoplancton, además del aumento de material orgánico suspendidos en la columna de agua que a veces provoca problemas de la calidad del agua, los cuales se hacen más complejos cuando la densidad de los organismos de cultivo es elevada. Los desechos metabólicos incluyen entre otros, al CO2, amonio (NH4 y NH3), fósforo y otros componentes que estimulan el crecimiento del fitoplancton. Estos cambios en la calidad del agua que ocurren durante el cultivo de camarón también están influenciados directa o indirectamente por las condiciones climáticas, y por otro lado, por el manejo del cultivo, es decir, las tasas de alimentación y consumo de alimento, tasas de fertilización y las tasas de recambio, que eventualmente, se ajustan con el fin de tener una calidad de agua aceptable. Si la calidad del agua se deteriora, la calidad de los sedimentos disminuye, evitando así que el camarón se alimente adecuadamente y no va a asimilar el alimento eficientemente, siendo susceptible a las enfermedades y finalmente, 30 Tabla 3. Niveles tóxicos de algunos compuestos nitrogenados. Especie 48 hr LC 50 (mg/L-N NH3 ) 96 hr Referencia Amonio Litopenaeus vannamei (postlarvas PL6) 17.2 15 Harfush-Meléndez et al. (1994) L. vannamei (PL12) 12.5 12.2 Frías-Espericueta et al. (2000) L. vannamei (juvenil, 0.99 g) 92.5 65.2 Frías-Espericueta et al. (1999) L. vannamei (juvenil, 1 g) 95 58 Harfush-Meléndez et al. (1994) L. vannamei (juvenil, 3 g) 102 61 Harfush-Meléndez et al. (1994) L.vannamei (juvenil, 3.8 g) 110.6 70.9 Frías-Espericueta et al. (1999) Metapenaeus ensis (PL1) 16.7 - Chen et al. (1991) M. macleayi (juvenil, 2g) - 26.3 Allan et al. (1990) Penaeus chinensis (juvenil, 0.36 g) 51.1 35.1 Chen et al. (1990) P. japonicus (PL12) 33.8 28.9 Chen et al. (1989) P. mono don (PL6) 27.7 11.5 Chin y Chen (1987) P. monodon (juvenil, 0.17g) - 26.6 Huang (1979) P. monodon (juvenil, 0.070.19g) 11.81 - Lai y Ting (1984) P. monodon (juvenil, 2.2 g) - 37.7 Allan et al. (1990) P. monodon (juvenil, 4.9g) 88 42.6 Chen et al. (1990) P. paulensis (PL1) 8.6 5.5 Ostrensky y Wasielesky (1995) continua 31 Tabla 3. continuación Especie 48 hr LC 50 (mg/L-N NH3 ) 96 hr P. paulensis (juvenil, 5.4 g) 43.1 38.7 P. setiferus (PL25) 9.4 - P. semisulcatus (juvenil, 0.3-2.4 g) - 23.7 Referencia Ostrensky y Wasielesky (1995) Alcaráz et al. (1999) Wajsbrot et al. (1990) Nitrito Metapenaes. ensis (PL1) 33.8 28.9 Chen y Nan (1991) M. ensis (mysis) 20.67 - Chen y Nan (1991) - 37.7 Chen et al. (1990a) 15.37 - P. japonicus (PL2) - 23.7 Chen y Tu (1990) P. monodon (PL6) 51.1 35.1 Chen y Chin (1988) P. japonicus (PL12) 92.5 65.2 Lin et al. (1993) 88 42.6 Chen et al. (1990b) P. setiferus (PL25) - 26.3 Alcaráz et al. (1999b) P. paulensis (PL1) 9.4 - Penaeus chinensis (juvenil) P. indicus (zoea) P. monodon (adolescentes) Jayasankar y Muthu (1983) Ostrensky y Poersch (1992) Nitrato Penaeus monodon (juvenil) P. paulensis (adultos) 3525 2316 Tsai y Chen (2002) - 2172 Cavalli et al. (1996) Modificada de Frías-Espericueta y Páez-Osuna (2001). 32 dando lugar a una baja sobrevivencia y con ello a una pobre cosecha. Como es de suponer, esta acumulación de material orgánico a través de los ciclos de cultivo, provoca que los estanques más antiguos muestren una mayor biomasa fitoplanctónica que los nuevos (Cortés-Altamirano et al., 1994), debido a esto hay que hacer ajustes en el programa de fertilización considerando el tiempo que lleva operando cada estanque y reduciendo las dosis de fertilizantes necesarios para promover el crecimiento fitoplanctónico. La vida útil de un estanque de cultivo es variable, depende de muchos factores, entre los cuales está el manejo, la calidad del agua y las características del sedimento, se estima que tienen una viabilidad de 7-15 años. Después de este período se presenta el problema de estanquería abandonada ya que la rehabilitación es compleja (Páez-Osuna, 2001). Debido a lo anterior, los estanques de camarón son típicamente eutróficos o hipereutróficos (Tabla 4). Los términos oligotrófico, mesotrófico y eutrófico corresponden a sistemas que reciben aportes o suministros bajos, intermedios y altos de nutrientes. Hipertrófico o hipereutrófico es el término utilizado para sistemas que reciben excesivos aportes de 33 nutrientes (Smith et al,. 1999). Estas condiciones provocan que con frecuencia se generen problemas de exceso de biomasa fitoplanctónica que a su vez provoca disminución de oxígeno disuelto durante la noche. Estos sistemas de cultivo por sus características también pueden ser promotores de crecimiento de microalgas peligrosas que no han sido previamente detectadas en la fuente de suministro de agua (Glibert y Terlizzi, 1999) y algunos de los nutrientes, dependiendo de su forma química y concentración, pueden llegar a ser tóxicos para el camarón; tal es el caso del NH3, NH4+, NO2- y NO3-. En general, a partir de la Tabla 3, se observa que el amonio es la especie química más tóxica, el nitrato la menos tóxica y que entre los peneidos, los estadíos más tempranos son los más vulnerables. Es importante señalar que cuando han sido evaluadas las concentraciones letales medias (LC50) a diferentes tiempos de exposición y a diferentes salinidades se ha observado una misma tendencia en la variación de la toxicidad de los diferentes compuestos nitrogenados; La toxicidad de los tres compuestos nitrogenados tiende a incrementarse (menores LC50) conforme se incrementa el tiempo de exposición, esto es que a cuando los 34 camarones se exponen a tiempos de 96 horas se tienen siempre LC50 más bajos que cuando se exponen por períodos de 24 o 48 horas. Por su parte, en casos como el nitrato, se ha observado que la tolerancia es mayor conforme se incrementa la salinidad, o sea los LC50 son más altas en salinidades elevadas que a salinidades bajas. No hay muchos estudios sobre la productividad primaria en estanques de cultivo de camarón, sin embargo, los que se han realizado en Sinaloa (Tabla 3), muestran que la productividad primaria estimada en estanques es comparable con la cuantificada en las lagunas costeras más productivas de Sinaloa y en las aguas costeras más productivas del Océano Pacífico tropical y subtropical (Alonso-Rodríguez y Páez-Osuna, 2003). En aguas naturales del golfo de Ecuador, donde confluyen las aguas oceánicas y de río, se forman mareas rojas dominadas por el dinoflagelado desnudo Gymnodinium instriatum (=Gyrodinium instriatum), especie que provocó la mortalidad de camarón en los estanques de cultivo debido a la anoxia, en esas manchas se midió una productividad primaria de 5 a 15 g C m2 día1 (Jiménez, 1993), similar a la observada en estanques con recambio cero en Belice (Tabla 4). 35 Tabla 4. Productividad primaria en estanques de cultivo de camarón Localidad Tipo de cultivo Fitoplancton dominante Productividad (g Cm-2día-1)a Estado tróficob 1.5 AlonsoRodríguez Hipertrófico y PáezOsuna (2001) 3.4 a 12.3 Hipertrófico Referencia Sinaloa, México Semiintensivo Belice Intensivo- Dinoflagelados, recambio nanoflagelados y cero cianobacterias Vietnam Extensivo Fitoplancton, bacterioplancton 0-1.1 Oligotrófico Alongi et a Eutrófico al. (1999) China Semiintensivo - 1.7 Xiwu y Hipertrófico Zhihui (1997) China Semiintensivo Diatomeas 0.5 a 2.1c Mesotrófico Guoying y a Junmin, Hipertrófico (1992) Australia Intensivo Cianobacterias y flagelados verdes 2.4 Hipertrófico a b Cianobacterias Burford et al. (2003) Burford (1997) g Cm-2día-1, conversión de O2 a C (0.313), el día es considerado 8.6 horas-luz. Pitta et al. (1999) señalan el estado trófico de acuerdo a la productividad (g Cm-2día-1): Hipertrófico >1.36, Eutrófico 0.82-1.36, Mesotrófico 0.27-0.82 y Oligotrófico <0.27. - no presentado 36 1.5 Mareas rojas en estanques y sus efectos Se considera una marea roja o un florecimiento algal a la acumulación masiva de una o dos especies que coexisten con densidades de 104 a 106 cél/mL y forman el 95-99% de la biomasa total fitoplanctónica (Paerl, 1988). Este tipo de florecimiento es más fácil que se colapse, en comparación con los florecimientos formados por varias especies (Smith, 1985). Otro criterio para determinar si se trata de una marea roja es, dependiendo del cuerpo de agua, por medio de la percepción de cambios de color. Si se presentan efectos adversos sobre el ecosistema u organismos, se puede considerar como una marea roja o como Florecimientos Algales Nocivos (FANs), también pueden llamarse Proliferaciones Microalgales Nocivas (PMN) o en inglés Harmful Algal Blooms (HABs) (Ochoa et al., 2003). En términos de biomasa, se considera marea rojas cuando excede 100 mg clorofila a/m-3 (Tett, 1987). Otros criterios son: si las células miden más de 30 µm y su abundancia es mayor a 1,000 cél/mL (1,000,000 cél/L) (Kim et al., 1993). Cuando se trata de florecimientos algales compuestos por diatomeas también se consideran como mareas rojas (Sournia, 1995). 37 Como se mencionó previamente, los florecimientos algales son comunes en los estanques de cultivo de camarón y generalmente son benéficos (Tabla 5), pero cuando éstos decaen provocan varios problemas de calidad del agua como es la disminución de la transparencia del agua, abatimiento del oxígeno disuelto en la capa de fondo, y la acumulación de compuestos tóxicos (amoniaco, nitrito, ácido sulfhídrico), a estos últimos se les conoce como mareas rojas nocivas (Tabla 6). Los efectos provocados por las mareas rojas nocivas pueden ser desde una disminución del crecimiento del camarón debido al estrés impuesto por cierta clase y abundancia de microalgas, hasta una disminución de las defensas y el consecuente aumento en la susceptibilidad a las enfermedades virales. Debido a que se agota el nitrógeno a causa del crecimiento acelerado de la especie dominante o a la infestación de microorganismos, los florecimientos superficiales se transforman rápidamente en agregados indeseables en descomposición. La acumulación de microalgas en el estanque puede llegar a representar el 95-99% de la biomasa total fitoplanctónica. Los crustáceos en general no son buenos acumuladores de toxinas pero es 38 39 40 41 42 posible que se contaminen durante la cocción. Los crustáceos acumulan las toxinas en el hepatopáncreas y éstas pueden afectar al hombre al consumir el producto contenido en las vísceras. En granjas camaronícolas de Baja California Sur, se han registrado proliferaciones de algunas especies de dinoflagelados como, Gymnodinium spirale, Scrippsiella sp., S. trochoidea y la prasínofícea Nephroselmis sp. (Gárate-Lizárraga et al., 1999a,b; Gárate-Lizárraga, 2001). Debido a que las especies responsables de dichos florecimientos no son tóxicas, los efectos observados fueron positivos al observarse un mayor crecimiento de los camarones que durante las condiciones de operación normal del cultivo. La biomasa fitoplanctónica observada, en términos de clorofila a durante estos florecimientos fue alta, variando entre 9 y 250 mg /m3. Algunas especies como Cochlodinium polykrikoides que han causado estragos en sistemas de cultivo en otros países como en Japón y Canadá, empezaron a proliferar desde el año 1999 en algunos de los principales puertos pesqueros del Pacífico Mexicano. En la zona de Bahía de La Paz, B. C. S. (Gárate-Lizárraga, et al., 2000; 2004) y en 43 otras áreas al sur del Golfo de California como en las costas de Sinaloa, donde provocó la mortalidad de peces en la Paz y Mazatlán y de pulpos en Isla Venados en la bahía Mazatlán y en El Verde, en las cercanías de Mazatlán. En el estado de Nayarit, Jalisco y Colima también provocó daños estéticos a la zona costera (Morales Blake et al,. 2001; Cortés-Lara, 2002a). En Japón, tales proliferaciones han provocado mortandades masivas de peces en cultivo (Yuki y Yoshimatsu, 1989; Kim, 1997a); Las mareas rojas formadas por Cochlodinium sp. en Canadá causaron una gran mortandad de salmón en cultivo, provocando pérdidas económicas de casi 2 millones de dólares (Whyte et al., 2001), por lo que es importante monitorear las aguas costeras de la región del Golfo de California respecto a estos organismos. Se tienen reportes de que algunos bañistas han sufrido de hiperpigmentación de la piel, después de nadar en la playa durante dos eventos de marea roja, tanto en Mazatlán (observaciones personales, Cochlodinium polykrikoides; otoño de 2000) como en Colima (Gymnodinium catenatum; Blanco-Blanco et al., 1999) dichos efectos fueron tratados en el sector salud como quemaduras de sol. El aumento de la población, el desarrollo de la industria y de la 44 acuacultura intensiva han contribuido grandemente a la eutrofización de algunas zonas costeras del Mar del Este, en Corea. Estos ambientes eutróficos resultan muy favorables para la proliferación de especies tóxicas como Alexandrium tamarense, Gymnodinium catenatum y Dinophysis spp., Pseudonitzschia pungens e ictiotóxicas, como Cochlodinium polykrikoides, Gymnodinium mikimotoi y Noctiluca scintillans, provocando pérdidas económicas significativas a la industria del cultivo de peces. Esta situación hizo necesario desde 1995, tomar medidas de control de los desechos y se han reforzado las políticas nacionales sobre medidas legislativas y administrativas que deben llevarse a cabo para proteger el ecosistema costero en ese país, además de iniciar la práctica de medidas de mitigación como el uso de la arcillas para controlar dichos eventos tóxicos (Kim, 1997b). En México, se han manifestado por primera vez los problemas con la especie mencionada, en estanques de cultivo de peces y camarón durante la proliferación de Cochlodinium polykrikoides en Ensenada de La Paz, donde se registró la mortalidad de peces en cautiverio (Gárate-Lizárraga et al., 2000a). 45 46 En un evento de marea roja en estanques de camarón L. vannamei, en noviembre de 1998, en La Paz, B.C., se hicieron análisis para determinar la concentración de toxinas PSP en camarones durante una marea roja encontrándose valores de 10 g/SAXeq/100g, aunque en las muestras de fitoplancton no se observaron especies toxicas. Es posible que la ingestión de especies tóxicas haya sido anterior a la recolección de las muestras de camarón para el análisis de toxinas. El perfil de toxinas paralíticas estuvo conformado principalmente por derivados de decarbamoil y de Nsulfocarbamoil: dcGTX2, dcGTX3, C1 y C3, sin embargo no se estableció la especie responsable de dicha toxicidad. Las mareas rojas producidas en estanques camaronícolas del noroeste de México por la cianobacteria Schizothrix calcicola mostró una clara reducción en el crecimiento del camarón en granjas de Sinaloa (CortésAltamirano, 1994; Ochoa et al., 2002). Schizotrix calcicola y otras cianobacterias producen metabolitos que resultan tóxicos para la postlarva de L. vanname i tales como oscillariotoxinas, aplysiatoxinas, debromoapysiatoxinas, lingbyastatantina-1, dolastantina-2 e ypaomida. La posibilidad de una marea roja de esta especie, puede afectar el 47 crecimiento del camarón, producir bajo rendimiento o prolongar el ciclo de cultivo hasta alcanzar la talla comercial además de aumentar el riesgo de infecciones provocando mortalidad del camarón (Pérez-Linares et al., 2003). 1.6 Condiciones para un buen desarrollo del camarón en un ciclo de cultivo. Los grupos de fitoplancton deseables en los estanques de camarón son las diatomeas y las algas verdes, se consideran benéficos y son parte de la cadena alimenticia que incluye a la mayoría de los invertebrados acuáticos y las larvas de peces. Por el contrario, los dinoflagelados y las cianobacterias se asocian a una pobre calidad del agua y a eutrofización. Las proporciones entre los nutrientes ejercen un efecto selectivo sobre las comunidades de fitoplancton natural. En cuerpos de agua someros como son los estanques, una fuente adicional de nitrógeno y fósforo procede del agua intersticial de los sedimentos y puede llegar a ser más importante que la cantidad de nutrientes que proceden del agua y ser buenos indicadores del estado trófico del cuerpo de agua (Yussoff, et al., 2002). Durante el curso de la eutrofización, las poblaciones de diatomeas 48 decrecen y otros grupos persisten como los dinoflagelados o las cianobacterias. Las diatomeas centrales se reconocen como el grupo de microalgas que contiene las especies más deseables como parte del fitoplancton costero por ser alimento de consumidores superiores y generalmente no forman florecimientos algales nocivos, no producen toxinas y además, las diatomeas se consideran el mejor alimento para el camarón por encima de otro tipo de microalgas (Jory, 1995). Las cianobacterias son consideradas como peligrosas y no forman parte importante de la cadena alimenticia en los ecosistemas acuáticos, además producen malos sabores al agua y generan sustancias tóxicas para los animales acuáticos. Las cianobacterias crean condiciones de pH elevado debido a la disminución de carbono inorgánico lo cual a su vez, favorece su desarrollo sobre otras especies deseables. A lo largo del día, el camarón cambia sus hábitos alimenticios de nocturnos a diurnos, la menor actividad se da a concentraciones de oxígeno disuelto menores a 4 mg/L. Esto debe considerarse para la dosificación del alimento en sistemas semiintensivos sin aireación. 49 Cuando se observan concentraciones de oxígeno menores a 3 mg/L por la noche, será necesario disminuir la alimentación balanceada hasta alcanzar mayores niveles (Focken et al., 1998). Los acuacultores requieren que los florecimientos fitoplanctónicos promovidos por la fertilización sean estables y las especies beneficien el desarrollo de la especie en cultivo; en la actualidad se está desarrollando la investigación sobre las sucesiones fitoplanctónicas dentro del estanque por medio de la administración de bacterias benéficas (Yussoff et al., 2002). Se ha observado que las diatomeas crecen rápidamente con adiciones frecuentes de nitrato, los flagelados se relacionan con una alta disponibilidad de amonio o de nitrógeno orgánico disuelto el cual puede modificar la sucesión de especies y provocar florecimientos algales nocivos que pueden afectar el sabor, la sobrevivencia y el precio de las especies cultivadas. En aguas con alto contenido de fósforo y nitrógeno, las cianobacterias tienden a dominar la comunidad fitoplanctónica. Las altas temperaturas y el alto suministro de nutrientes le dan ventaja a las cianobacterias para formar florecimientos sobre el fitoplancton eucariota. En estanques de 50 cultivo, Yussoff et al. (2002) encontraron una dominancia de algas azulverde cercanas al 90% cuando la fuente de agua estuvo enriquecida en nutrientes y dominada por cianobacterias. Las partículas sólidas de tamaño entre 0.5 y 5 micras, cuando consisten de microalgas y agregados microbio-detritales (material orgánico y mineral), incrementan la tasa de crecimiento de Litopennaeus vannamei en un 53% (Martínez-Córdoba et al., 1998). Los nutrientes que se encuentran en el agua intersticial de los suelos de los estanques, pueden ser potencialmente liberados a la columna de agua y quedar disponible para ser utilizados por el fitoplancton. En la zona costera los nutrientes provenientes del nitrógeno total pueden proveer del 30-100 % del nitrógeno utilizado por el fitoplancton en la columna de agua en condiciones de turbulencia, por su parte, el fosfato es liberado bajo condiciones anaeróbicas del sedimento por difusión (Berner, 1980). Los estanques reciben alta cantidad de materia orgánica en forma de fertilizantes, alimento y desechos metabólicos que bajo condiciones aerobias soportan una gran variedad de la vida bentónica y que a su vez, son una fuente importante de alimento para el camarón. Por lo tanto, es 51 necesario conocer la condición del fondo del estanque en una profundidad de al menos 5 cm y analizar su contenido de materia orgánica, acidez, fosfato, hierro disponible y pH. El pasar el sedimento por una malla de 500 micras y analizar el material retenido, también proporcionará información sobre los agregados algales que son fuentes potenciales de alimento natural; los agregados de cianobacterias, diatomeas y fauna asociada que crece en el fondo y más tarde flota hacia la superficie son parte de este alimento natural además de otros agregados formados por algas filamentosas unidas a masas de organismos. 1.7 Factores críticos para la producción de especies benéficas. Luz Uno de los factores que pueden ser limitantes para el crecimiento de fitoplancton en los estanques de cultivo es la luz, en estos casos, la profundidad y la turbidez pueden ser los factores que determinen el crecimiento algal (Burford, 1997). En lugares donde la temperatura y la luz no son limitantes, las concentraciones de nutrientes y las proporciones entre ellos, son los factores que determinan la dominancia de los grupos 52 taxonómicos de fitoplancton. Temperatura La luz y la temperatura son consideradas como los factores más importantes que afectan a todos los procesos dentro del estanque, esto se ha determinado en estudios experimentales bajo condiciones de temperatura controlada (Xuemei y Zhinan, 1999). Las mejores cosechas en Sinaloa, parecen obtenerse durante la época de primavera-verano y a altas temperaturas (Guerrero-Galván et al., 1999). Salinidad La baja salinidad favorece a las cianobacterias y si la salinidad es mayor a 10, las cianobacterias son raras o ausentes. Los florecimientos de cianobacterias se presentan generalmente cuando hay una disminución de la salinidad aunque a altas salinidades y con condiciones adecuadas de nutrientes, se puede mantener la dominancia de cianobacterias sin llegar a desarrollar florecimientos. Exceso de nutrientes y la relación N:P Los elementos más importantes que regulan el crecimiento y la composición de especies del fitoplancton marino son el fósforo y el 53 nitrógeno, y para las diatomeas también el silicio (Haraldsson y Granéli, 1995). El enriquecimiento de silicio y fósforo promueve la dominancia de diatomeas, mientras los niveles de nitrógeno son bajos. Cuando los nutrientes son abundantes, otros factores como la luz, vitaminas o elementos “traza” pueden controlar la dinámica del fitoplancton. Se ha observado que las aguas de los ríos en las que se descargan aguas con fertilizantes de los suelos agrícolas, ricos en N y P inorgánico, estos estimulan el crecimiento de las diatomeas, mientras que las aguas de los ríos de las áreas boscosas, ricas en sustancias húmicas, incrementan el crecimiento de los dinoflagelados (Granéli y Moreira, 1990). Los valores de N:P bajos (<10) promueven la dominancia de cianobacterias, se ha observado que las cianobacterias son raras o ausentes cuando la proporción en peso de nitrógeno y fósforo total es mayor a 29 en la columna de agua (Smith, 1983). En cultivos intensivos, la adición de nitrógeno solo o con silicato al estanque produce un aumento en la tasa de crecimiento de diatomeas, pero cuando se añade al estanque una combinación de nitrógeno, fósforo y carbono, las cianobacterias crecen significativamente más. El 54 crecimiento de las diatomeas en estos sistemas pudiera llegar a cesar cuando el abastecimiento de sílice se agota y entonces otras clases de fitoplancton (las cuales son en su mayoría tóxicas) pueden continuar proliferando utilizando el ''exceso'' de nitrógeno y fósforo (Radach et al., 1990). El silicato puede provocar el aumento en la tasa de crecimiento de las diatomeas y sacar de competencia a otros grupos algales. La adición de silicato en el estanque hace que disminuya la tasa de crecimiento de las cianobacterias. El enriquecimiento de nutrientes puede minimizarse, en particular, reduciendo los niveles de fósforo y con la adición de nitrógeno y silicato pueden promover el crecimiento de fitoplancton benéfico en estos sistemas (Yussoff et al., 2002). En la tabla 8 se muestran las concentraciones y proporciones estequiométricas de nitrógeno: fósforo en las aguas de estanques de cultivo de camarón y el fitoplancton dominante en cada caso. En general, se observa que a bajas concentraciones de fósforo se tienen valores elevados de N:P y dominan las cianobacterias y diatomeas. Igualmente, se señala de mortalidades de camarón y/o baja cosecha cuando se presentan altas concentraciones de amonio. 55 Tabla 8. Fitoplancton dominante de acuerdo a las concentraciones medias y proporciones de nutrientes medias en estanques de cultivo de camarón. Lugar Amonio (µM) Nitrato (µM) Estanques intensivos en Australia 21.4 Estanques intensivos en Malasia - 5 Estanques en Taiwan 226-358 Estanques semiintensivos, Bangladesh Nitrito (µM) Fosfato (µM) Silicato (µM) N:P 1.6 0-53.5 60 11 0.1 7 1.9 35-66 3.313.0 <1 - - 128 92.8 1.8 11.4 - - Estanques de cultivo en Bohai, China 1.9-2.8 11.547.4 2.6-3.8 0.5-1.0 17.430.7 Estanques intensivos en Tailandia 13.6 - 1.6 15 27 - Estanques cero recambio en Belice 0.7-10 - - - - - 5.7 continuación de las columnas en la siguiente pàgina 56 Fitoplancton dominante Efectos/Producción (kg/ha) Referencia Cianobacterias, clorofitas, diatomeas y flagelados cafés - Buford (1997) Diatomeas, cianobacterias y dinoflagelados 5101 Yus soff et al. (2002) Alexandrium tamarense Clorofitas Diatomeas Mortalidad de camarón y efectos sobre peces Huei-Meei et al. (1993) Diatomeas, cianobacterias clorofilas y euglenofitas 532-697 Islam et al. (2004) Skeletonema, Coscinodiscus, Thalassionema, Peridinium 1130 Mingyuan y Jiasheng (1993) Trichodesmium, Chlorococcum, Coscinosira Nitzschia, Lyngbya 4,119 Tookwinas y Songsangjinda (1999) Clorofitas, dinoflagelados y fitoflagelados 15000 Burford et al. (2004) continua 57 Tabla 8. continuación Lugar Amonio (µM) Estanques experimentales en La Paz, B.C.S., México Nitrato (µM) Nitrito (µM) 0.111.5 Fosfato (µM) - Silicato (µM) 0.1-4.1 N:P - - Efluentes de estanques 164 semi-intensivos en Sonora, México 142 - - - - <0.1 Estanques semiintensivos, 2 ciclos de cultivo (O-I y P-V) en Sinaloa, México 0.2-1.4 0.3-0.5 0.7-2.2 - 1.167 <0.1Estanques semiintensivos en Sinaloa, 24.7 México (variación diurna) <0.2-4 <0.251.9 <0.1-0.3 - 80* * (NH4+NO3+NO2)/PO4 (estimado de Páez-Osuna et al., 1994). - no presentado continuación de las columnas en la siguiente pàgina 58 Fitoplancton dominante Efectos/Producción (kg/ha) Referencia - Gárate-Lizárraga et al. (1999c; 1999d) Bustillos-Guzmán et al. (2004) Diatomeas Nitzschia, Navicula; Cianobacterias Microcoleus, Spirulina, Oscillatoria, Schizotrix, Calothrix y Phormidium; Clorofitas Clorella y Dunaliella - Paniagua-Michel y García (2003) Cianobacterias y diatomeas. Proliferaciones de dinoflagelados y cianobacterias 1822-2125 Guerrero-Galván et al. (1999); AlonsoRodríguez y Páez-Osuna (2003) Synechocystis diplococcus, Oscillatoria limnetica, Prorocentrum minimum, Scrippsiella trochoidea, Cyclotella y Nitzschia. 800-2100 Cortés-Altamirano et al. (1995; Páez-Osuna et al. 1994); Ruiz-Fernández y Páez-Osuna (2004) Dinoflagelado Scrippsiella; Diatomea Amphora; Prasinofísea Nephroselmis 59 Hidrodinámica Los sistemas eutróficos como son los estanques, que se mantienen mezclados, ya sea por viento o por sistemas de aireación muestran una condición deseable, tienen mayor variedad de fitoplancton, incluyendo varios géneros de diatomeas, algas verdes, cianobacterias, dinoflagelados y euglenoides (Paerl, 1988). Se han registrado buenos rendimientos en estanques de tipo intensivo en Sinaloa donde había mayor diversidad y menor abundancia fitoplanctónica contra el tipo semi-intensivo donde dominaron las cianobacterias y se observaron algunos florecimientos de cianobacterias y dinoflagelados (Cortés-Altamirano, 1994). Condición del sedimento Las condiciones recomendables para el sedimento en el estanque de cultivo de camarón son las siguientes: pH >7, concentración de materia orgánica <1% y nutrientes 20-30 ppm de NO3- y 2.5 ppm de PO4-3 (Cabrera-Toledo y Rodríguez, com. pers.). Estos autores mencionan que los manejadores de estanques tienden a encalar rutinariamente los fondos de los estanques entre cosechas. Esta práctica puede no ser es necesaria, a no ser que el suelo del estanque este por debajo de 7. l. 60 1.8 Recomendaciones para un buen manejo y la producción de microalgas útiles. El manejo ideal de un estanque semi-intensivo consiste en controlar la densidad de microalgas y su relación con la cadena alimenticia tal como el equilibrio entre la concentración mínima de oxígeno y el buen desarrollo del camarón, regulando el agua de intercambio y la tasa de alimentación hasta su cosecha. Es deseable controlar la densidad de especies de fitoplancton benéfico para mantener una adecuada calidad del agua y proveer de una fuente de alimento nutritiva ya sea directa o a través de la cadena alimenticia para el camarón. Es importante identificar las variables clave que determinan la dominancia algal y los factores que controlan las comunidades fitoplanctónicas en el sitio de cultivo en particular, de acuerdo a las condiciones geográficas y de ubicación con relación a las fuentes de abastecimiento y de descarga del efluente. Las siguientes recomendaciones pueden ser de utilizadas como guía en la producción de fitoplancton benéfico en los estanques de cultivo de camarón: 61 (1) Es necesario conocer los niveles naturales de los macro nutrientes tanto en agua como en el sedimento, considerando que éstos últimos pueden estar siendo suministrados a la columna de agua por su liberación de los sedimentos. (2) Es de gran utilidad conocer la composición de especies que dominan las comunidades microalgales dentro del estanque y en la fuente de abastecimiento en las diferentes épocas del año para saber que modificaciones se observan dentro de los estanques y su relación con las condiciones fisicoquímicas del mismo durante los ciclos de cultivo. (3) Es recomendable aplicar la fertilización en dosis bajas y frecuentes, considerando la importancia no solo de la concentración de los nutrientes sino de la proporción entre ellos, tratando de mantener una adecuada concentración de los nutrientes en la columna de agua y atendiendo particularmente los niveles de concentración del silicio que sean suficientes para promover la presencia de diatomeas. (4) El monitoreo de las variables fisicoquímicas y del fitoplancton, así como la observación del color del agua y la condición del camarón 62 proveerá información sobre cuáles son las variables más importantes para mantener una adecuada producción de fitoplancton que contribuya al buen desarrollo del cultivo que podrá ser aplicada a los programas de operación de los estanques de esa granja o zona de granjas en particular. 63 2. El fitoplancton y la larvicultura 2.1 Introducción Un buen manejo del fitoplancton en la larvicultura, ejerce beneficios en la condición y salud de la postlarva producida en laboratorio. Uno de estos beneficios es la reducción en la cantidad de amonio y nitrito producido por las post-larva mediante una combinación de dieta natural y artificial ( Chaetoceros , alimento balanceado y larvas de chironómidos) (Shishehchian et al., 1999). Los géneros de microalgas más utilizados en la producción de larvas son Skeletonema, Chaetoceros, Tetraselmis, Chlorella e Isochrysis y hay una tendencia a sustituir parte del suministro de microalgas por alimento formulado. Actualmente se utilizan en el mundo una cantidad estimada de 146 toneladas (peso húmedo) de microalgas por año para producir 530,784 toneladas de camarón adulto por año (Muller-Feuga, 2000). Otros aspectos a considerar en larvicultura son la sobrevivencia, el ciclo de muda, y el peso seco, los cuales son mayores mediante una dieta que incluye a las microalgas de los géneros Chaetoceros y Tetraselmis 65 (Villamar y Landgdon, 1992). Se ha probado también que la alimentación de larvas en cultivo de especies como P. aztecus, P. setiferus, L. vannamei y L. stylirostris es mejor a base de diatomeas que de fitoflagelados y que la complementación con Artemia al inicio de la segunda etapa de protozoea, mejora la condición de las larvas (Kuban et al., 1985). Los requisitos que deben reunir las microalgas que se administren como alimento a los penaeidos son los siguientes (Báez-Dueñas et al., 1993): 1.- Deben de ser fácilmente reconocibles por la larva de un tamaño que le permita su deglución 2.- Pertenecer a la flora pelágica y poseer un movimiento suave 3.- Ser digeribles y altamente nutritivas 4.- Ser fáciles de cultivar A pesar de que las diatomeas promueven un buen crecimiento en larvas de camarón, existen varias que son tóxicas, como es el caso de algunas especies de los géneros Navicula y Coscinodiscus para las larvas de Penaeus japonicus (Shigueno, 1975), otras diatomeas producen ácido domoico, toxina cuyo síndrome es el ASP (Envenenamiento amnésico por consumo de mariscos) como Amphora coffaeformis, Nitzschia-navis 66 varingica y Pseudo-nitzschia spp. (Davidovich y Bates, 2001). 2.2. Mareas rojas en la zona costera Las mareas rojas o florecimientos algales son la manifestación visual de la proliferación de microalgas en el agua, se producen manchas que son visibles y están relacionadas con la presencia de nutrientes disueltos, dióxido de carbono y luz, entre otros factores. Cuando llegan a ser millones de células por litro es cuando es posible percibirlos visualmente. En la mayoría de los casos estos florecimientos algales son benéficos para la acuacultura ya que forman parte de la alimentación directa o indirecta de las especies en cultivo. El color varía de tonalidades café a rojizo y de amarillo a azul, dependiendo del organismo dominante. La alta rapidez de reproducción y la agregación provocan altas densidades de microalgas en el agua que pueden provocar problemas por varias razones (Hallegraeff, 2002): (a) Consumo de oxígeno disuelto durante la respiración, la cual se lleva a cabo por la noche o en días nublados ya que se consume pero no se produce oxígeno. 67 (b) Consumo de oxígeno por respiración bacteriana durante la descomposición al decaer el florecimiento. (c) Asfixia de la especie cultivada debido al taponamiento de sus estructuras de respiración. (d) Daño físico a las especies en cultivo debido a que algunas microalgas tienen estructuras duras que provocan ulceraciones o producción excesiva de mucus debido a la irritación en partes vitales del organismo en cuestión, como son las branquias y los apéndices. (e) Algunas especies de microalgas producen mucus o masas gelatinosas que provocan taponamiento de branquias y consumo de oxígeno por su degradación. (f) Producción de especies de oxígeno reactivo (peróxidos de hidrógeno) que provoca la producción de mucus, el cual taponea las branquias (g) Producción de toxinas y envenenamiento del organismo cultivado en cuyo caso no es necesaria una alta densidad de organismos para provocar mortalidad o daño al organismo, ya sea directamente o a través de la cadena alimenticia cuyo eslabón final puede ser el hombre. 68 Actualmente se está realizando una extensa investigación sobre los metabolitos producidos por las microalgas y que pueden afectar a otros organismos, entre ellos están las sustancias alelopáticas, toxinas y los desechos metabólicos. Algunas de las toxinas producidas por microalgas se investigan por la posibilidad de elaborar fármacos utilizados en tratamientos contra el cáncer y otras enfermedades crónicas. También se trabaja en el descubrimiento de metabolitos, aún desconocidos. Dentro de las toxinas que produce el fitoplancton y que han causado problemas en la acuacultura en Australia, se encuentran los síndromes que abarcan síntomas desde malestares gastrointestinales, neurológicos, que pueden producir daños al ecosistema, pueden provocar la muerte de la especie en cultivo, o llegan, incluso a producir la muerte en el hombre (Tabla 9). 69 Tabla 9. Microalgas dañinas en la acuacultura según Hallegraeff (2002). Síndrome*Desde Toxinas asociadas Microalga Saxitoxinas Alexandrium spp. G. catenatum Pbc** cianobacterias Vector Organismo Efectos intermediario afectado Aves, moluscos o mamíferos Parálisis peces y hombre, respiratoria, planctívoros peces y muerte camarón PSP 1793 DSP Ácido Dinophysis spp. 1978 okadaiko Prorocentrum moluscos Pectenotoxinas lima ASP 1987 Ácido domoico NSP 1970 Karenia spp. Brevetoxinas K. brevis, gymnodimina K. mikimotoi AZP 1995 Aspirazida CFP 1500 Gambierdiscus Ciguatoxinas toxicus FAT 1983 Hemolisinas EAS 1988 No se conocen camarón en cultivo Diarrea y y el tumores hombre moluscos, Aves y Pérdida de Pseudonitzschia aves, peces mamíferos memoria spp. planctívoros marinos reciente peces y Peces y moluscos, hombre brisa marina Protoperidinium moluscos crassipes Dificultad respiratoria y problemas de locomoción Mamíferos Síntomas de y hombre DSP y NSP peces tropicales Hombre Desequilibrio y muerte por falla respiratoria Prorocentrum rhathymum ostión Ostión Hemólisis en ostión Pfiesteria piscicida peces Peces y hombre Neurológico, respiratorio y dermatológico *Nomenclatura y estructura en Fig. 3. **Pyrodinium bahamense var. compressum 70 2.3 Estructura química de las biotoxinas: Las biotoxinas marinas comprenden un amplio espectro de sustancias activas y difieren en origen, composición química, estructura, solubilidad y mecanismos de acción. En esta sección se ilustran la estructuras de las principales biotoxinas que producen los síndromes mencionados en la Tabla 9. X1 R1 HNCOO H NH HN + H2N + NH2 N NH OH OH R2 R3 Saxitoxinas que producen PSP (Paralytic Shellfish Poisoning) Fig. 3. Estructura de las principales biotoxinas que afectan a la acuacultura. continua 71 Fig. 3. continuaciòn R COOH HN COOH Ácido Domóico que produce ASP (Amnesic Shellfish Poisoning) Ácido Okadáico que produce DSP (Diarrhetic Shellfish Poisoning) Brevetoxinas que producen NSP (Neurotoxic Shellfish Poisoning) continua 72 Fig. 3. continuaciòn R1 O O HO H O H H O H H NH H O HO O OH R2 O O O H Azpirazida que provoca AZP (Azaspiracide Poisoning) Ciguatoxinas que provocan CFP (Ciguatera Fish Poisoning) 73 2.4 Mareas rojas en el noroeste de México A escala mundial, el número de especies formadoras de mareas rojas se está incrementando rápidamente. En México este incremento también ha sido observado, no sólo en número, sino también en días de permanencia de los florecimientos (Cortés-Altamirano et al., 1999; Gárate-Lizárraga et al., 2001). Las mareas rojas registradas en las costas de Baja California Sur han sido provocadas por especies que no producen toxinas, destacando las formadas por el protozoario Mesodinium rubrum, los dinoflagelados Noctiluca scintillans, Scrippsiella trochoidea, Akasiwo sanguinea y más recientemente Alexandrium affine, y Cochlodinium polykrikoides, los cuales han ocurrido por primera vez en el otoño de 2000 en Bahía de La Paz y Bahía Concepción. Del grupo de las diatomeas destacan los florecimientos de Proboscia alata y Pseudo-nitzschia pungens en Bahía Magdalena y Rhizosolenia debyana y Chaetoceros debilis en la Bahía de La Paz (Gárate-Lizárraga y Siqueiros-Beltrones, 1998; Gárate-Lizárraga et al., 2003). También han sido reportadas especies productoras de toxinas PSP tales como G. catenatum, Alexandrium monilatum y A. catenella 74 (Gárate-Lizárraga et al., 2001; Morquecho y Lechuga, 2001). Estos mismos autores, también han mencionado la presencia de especies productoras de toxinas diarreicas tales como Dinophysis fortii y D. acuminata. El registro de mareas rojas en Sonora se ha llevado a cabo durante 25 años en Bahía de Bacochibampo, Guaymas, Sonora y se encontró que 43 de tales eventos estuvieron formados por tres especies, Noctiluca scintillans , Gymnodinium catenatum, Gonyaulax cf. polyedra y Mesodinium rubrum sin provocar efectos adversos en el ecosistema. Los meses de mayor incidencia de mareas rojas fueron noviembre, diciembre y enero, en coincidencia con la época de surgencias. Las mareas rojas guardaron una relación con la fertilidad provocada por las surgencias e inversa con las condiciones de “El Niño” (Manrique y Molina, 1997). Una marea roja en abril de 2003 provocó la mortalidad de peces, moluscos y otros invertebrados en Kun Kaay, Sonora, las especies responsables fueron Chatonella marina y Chatonella cf. ovata, esta marea roja provocó de hasta el 40% de mortalidad de postlarvas en los laboratorios de producción en la zona (Barraza-Guardado et al. 2004). 75 En Sinaloa, en particular en Mazatlán se tiene un registro de especies formadoras de mareas rojas desde hace más de 20 años en la cual se han agregado más de 10 especies en la última década (Cortés-Altamirano, 2003). Las microalgas consideradas tienen una amplia gama en el tipo de metabolismo, desde ser fotosintéticas (autótrofas), pasando por mixotrofía (realizan fotosíntesis y/o ingieren material) y heterotrofía, esto es, organismos considerados como microalgas que consumen a otros organismos para obtener la la energía necesaria para realizar sus funciones vitales. Durante el invierno de 1998 se registraron importantes florecimientos de Mesodinium rubrum en el norte de Sinaloa (GárateLizárraga et al., 2002). Los florecimientos de esta especie son muy importantes desde el punto de vista de la fertilidad de la zona costera. Las mareas rojas en las costas Nayarit han sido documentadas desde 1997 con la presencia de Mesodinium rubrum (Cortés-Altamirano et al., 1997b), posteriormente y al igual que en el resto del Golfo de California, se presentaron desde el año 2000, dominadas por Cochlodinium polykrikoides (Cortés-Lara, 2002a) y Gymnodinium catenatum (Cortés- 76 Lara, 2002b) y en el 2003 se presentó el primer florecimiento de una rafidofícea, Fibrocapasa japonica sin registrarse efectos sobre otros organismos y se sospecha que otra rafidofícea, Chatonella cf. antiqua ha provocado mortalidad de peces en esa zona (Cortés-Lara et al., 2003). Se sabe que ha habido efectos sobre la camaronicultura en el norte del estado pero no han sido documentados. Las rafidofíceas Fibrocapsa japonica, Heterosigma akashiwo y Chattonella marina se consideran especies ictiotóxicas, formadoras de florecimientos, estas especies se han localizado en el Pacífico Mexicano en Baja California Sur, Sinaloa y Guerrero (Band-Schmidt et al., 2004). La información discutida en esta última sección es presentada en las Tablas 10 y 11 y se añaden los efectos en las costas de los estados del noroeste o en otros sitios donde se han presentado dichas especies. 2.5 Mareas rojas nocivas para la larvicultura Las cianobacterias del género Trichodesmium forman grandes florecimientos en áreas oceánicas y costeras en regiones tropicales y subtropicales durante la época de calma, contribuyen con una proporción 77 78 79 80 81 82 83 84 85 Tabla 12. Mareas rojas potencialmente nocivas o tóxicas para la larvicultura (Lámina 3). Localidad Especie afectada Época del Microalga año Efectos Contenido intestinal Impide desarrollo a P. Trichodesmium Australia merguiensis V-O No protozoea, spp. baja sobrevivencia Baja Oscillatoria Guayas, sobrevivencia Si I -P brevisEcuador sabor a lodo Mortalidad Nitzschia Do Son, V-O navis-varingica de postlarvas Vietnam en cultivo Mortalidad Disminución L. de nauplio, de la vannamei Gymnodinium zoea y PL en cantidad de Sinaloa, laboratorio material en I-P catenatum México L. y camarón el tracto stylirostris adulto en digestivo estanques La Paz, L. México vannamei I-P Schizothrix calcicola Mortalidad y disminución Si de crecimiento en PL Referencia Preston et al. (1998) Massaut y Ortiz (2003) Kotaki et al. (2000) AlonsoRodríguez y PáezOsuna (2003; Páez Osuna et al. (2003); este estudio PérezLinares et al. (2003) - no presentado importante de productividad primaria en el océano e introducen nitrógeno molecular a la productividad primaria ya que son capaces de fijarlo para realizar la fotosíntesis. En Sinaloa, durante 1981, se detectaron grandes 86 manchas formadas por la cianobacteria Trichodesmium erythraeum (Oscillatoria erythraea), esto ocurrió durante los efectos de “El Niño”. Trichodesmium, aparentemente, no es tóxica pero no es nutritiva, si está presente, el hepatopáncreas puede estar lleno de cianobacterias pero la larva no crece (Yusoff et al., 2002). Estudios de laboratorio realizados en México observaron una disminución en el crecimiento de la postlarva PL30 expuesta a la cianobacteria Schizothrix calcicola, además de serios daños en el tejido gastrointestinal, este tipo de lesiones puede interferir con la absorción de alimento lo cual explica la disminución de tamaño observado en las granjas del sur de Sinaloa. La mortalidad no se modificó por la exposición a la cianobacteria pero si se observó una disminución en la actividad alimenticia y la coloración azul-verde del intestino (Pérez-Linares et al., 2003). 2.6 Mortalidad de larvas en laboratorios de producción de Sinaloa El establecimiento de la actividad camaronícola en Sinaloa inició en 1980, desde ese entonces, varios eventos de mortalidad han afectado a esta industria, particularmente en los meses de febrero a mayo en los 87 siguientes años; 1979, 1985, 1997, 2001 y 2003, eventos de mortalidad de peces, camarón adulto en granjas y en el medio natural, y larvas en laboratorios de producción en Sinaloa (Mee et al., 1986; AlonsoRodríguez y Páez-Osuna, 2003). Estos eventos coinciden con la presencia de mareas rojas en la zona costera de donde se abastecen de agua los laboratorios y granjas (Tabla 13). Los eventos de mortalidad masiva de larvas de camarón en laboratorios de Sinaloa que se han presentado en los años 1997, 2001 y 2003 en el período de transición invierno-primavera, se ha tratado de investigar la Tabla 13. Eventos recientes de mortalidad de larvas en la zona costera de Sinaloa. Sur, 1997 Toxicidad LP=80 µg % Presencia de G. catenatum STX/100g tejido mortalidad ostión 29* 100 Si a bajas densidades Sur, 2001 100 Si a bajas densidades Sur, 2003 100 Si a bajas densidades Positivo (no publicado) Centro y Norte, 2003 70-100 Si a altas densidades Positivo (no publicado) Región /año 88 40** causa de dichos eventos. Como resultado de la investigación y por la experiencia de los productores, se ha establecido que en los casos mencionados, la toxicidad está en el agua de abastecimiento cuando hay mareas rojas, y más aún, se ha encontrado que invariablemente está presente el dinoflagelado Gymnodiniun catenatum que produce toxinas del tipo PSP (=Paralytic Shellfish Poisoning), las cuales tienen la característica de producirse y contenerse dentro de la célula y de ser hidrosolubles. Ya que no se han encontrado células de fitoplancton en el agua bombeada de la playa, y siendo la toxina hidrosoluble, por lo tanto es muy probable que la toxina esté pasando a través del filtro del agua de bombeo hacia los laboratorios. En Mazatlán se ha detectado toxicidad del tipo PSP debajo del límite permisible en al menos 2 ocasiones (1997 y 2001) y en una ocasión toxicidad 30 veces arriba del límite permisible, en abril de 2003 en la concha-joyero Chama buddiana (Alonso-Rodríguez et al., 2004). Gárate-Lizárraga et al. (2002b) han señalado que el perfil de toxinas en muestras de G. catenatum recolectadas en Bahía Concepción está compuesto por neoSTX, dcSTX, dcGTX2, dcGTX3, B1, B2 y C2, 89 mientras que el de muestras de G. catenatum de Mazatlán solo estuvieron presentes las toxinas C2, dcGTX2, y dcGTX3 (Gárate-Lizárraga et al., 2004b). Los análisis de toxicidad en fitoplancton y ostión de piedra (Striostrea prismatica=Ostrea iridescens=Crassostrea iridescens) en 1997 (Cortés-Altamirano y Alonso-Rodríguez, 1997), en 2001 (GárateLizárraga et al. 2002b; Alonso-Rodríguez y Páez-Osuna, 2003; PáezOsuna et al., 2003) y en el año 2003 (datos no publicados) han resultado positivos para toxinas de tipo PSP y negativos para las larvas de camarón que resultaron muertas durante las mareas rojas en la zona de playa de donde se abastecen los laboratorios. Este problema sigue bajo investigación y se intenta conocer la causa de mortalidad de las postlarvas en cultivo bajo condiciones de marea roja dominada por G. catenatum. Las larvas pueden ser afectadas por la producción de mucus por G. catenatum, observado sobre todo en la temporada invierno-primavera de 2003 ya que el mucus impide el libre movimiento de los apéndices de la larva y se advierte así, una disminución en su alimentación y en su movimiento o porque el mismo mucus demanda oxígeno para oxidarse y por lo tanto disminuye los 90 niveles de oxígeno. Todos estos factores disminuyen el oxígeno disponible para mantener saludable a la larva. Otra causa es el envenenamiento, y aunque los resultados de toxicidad han resultado negativos para toxinas de tipo PSP en las larvas de camarón, puede ser debido a la presencia de otros metabolitos que no son detectados mediante la técnica de HPLC (High Performance Liquid Chromatography ) utilizada (Yu et al., 1998). La toxicidad del tipo PSP producida por Gymnodinium catenatum, en otros países se ha visto involucrada con la presencia de bacterias asociadas, por lo que la inactivación bacteriana por métodos de tratamiento de agua (UV, ozonación), puede ayudar a prevenir los efectos sobre la larva. Por este motivo es necesario realizar investigaciones con objeto de resolver este problema y poder diseñar un plan de acción en casos de contingencia en larvicultura. Sogawa et al. (1998) encontraron que el mucus en Gymnodinium sp. está compuesto de un polisacárido que es liberado al medio y se manifiesta como un aumento en la viscosidad pero también puede ser citotóxico, esto es, tóxico para las células humanas y provoca procesos anticoagulantes y antivirales también. 91 2.7 Normas para evitar los riesgos derivados de la presencia de mareas rojas y biotoxinas Existen normas internacionales y nacionales para evitar los riesgos derivados de la presencia de mareas rojas producidas por microalgas peligrosas. La Norma Oficial Mexicana de Emergencia NOM-EM-005SSA1-2001 sobre salud ambiental, contiene especificaciones sanitarias para el control de los moluscos bivalvos y otros moluscos expuestos a la marea roja, también contiene los criterios para proteger la salud de la Tabla 14. La fase de precontingencia inicia cuando al menos una muestra rebasa los niveles de concentración indicados. En el caso del fitoplancton se deben tener al menos 3 muestras diferentes que rebasen los niveles de concentración indicados. Toxina o Plancton Concentración Ácido domoico 100 ppm en tejido Brevetoxina 10 UR/100 g de tejido Saxitoxina 40 µg/100 g de tejido Fitoplancton de agua de mar 2,500 cel/L (de Karenia brevis ) en agua 92 Tabla 15. Fase de contingencia se presenta al rebasar los niveles máximos permisibles para cada tipo de toxina o plancton para las especies de moluscos bivalvos (ostión, almeja, mejillón y escalopas) en sus diferentes variedades, así como de otros moluscos. Toxina o plancton Límite máximo permisible Ácido domoico 200 ppm en tejido Brevetoxina 20 UR/100 g de tejido Saxitoxina Fitoplancton de agua de mar 80 µg/100 g de tejido 5,000 cel/L (de Karenia brevis ) en agua población, las cuales incluyen medidas de pre-contingencia (Tabla 14) y de contingencia (Tabla 15). La toxicidad es detectada en moluscos contaminados con biotoxinas en la zona afectada por estos eventos. Las normas internacionales para la importación y exportación de mariscos para consumo humano se aplican ya en algunos países como es el caso de los que conforman la Comunidad Económica Europea, por ejemplo en España (Tabla 16). En México, la Secretaría de Salud emitió un Proyecto de Norma Oficial Mexicana PROY-NOM-214-SSA1-2002 sobre productos y servicios; se 93 Tabla 16. Guía de importación de productos marinos, naturales o cultivados (España, 2003). Toxina Límite permisible PSP 80 µg eq. STX/100 g= 400 MU/100 g de tejido DSP 160 µg eq. Ac. Okadaico/kg= 40 MU/kg de tejido (incluye Ac.Okadaiko+dinofisistoxina+pectenotoxina ) ASP 20 µg Ac. Domóico/g de tejido AZP 160 µg eq. Azaspirácido/kg de tejido Yesotoxinas 1 µg eq. Yesotoxina/kg CFP Ausencia de Ciguatoxina CTX en tejido de tejido MU= Unidades ratón, eq.= equivalente refiere a productos de la pesca frescos, refrigerados y congelados, especificaciones sanitarias y métodos de prueba y límites máximos para biotoxinas en productos pesqueros (Tabla 17). En la actualidad se están desarrollando algunas técnicas para detectar nuevas toxinas producidas por fitoplancton, las cuales son perfeccionadas y modificadas con el objeto de estandarizarlas en el ámbito mundial, 94 Tabla 17. Biotoxinas marinas en productos pesqueros. Especificación * Especies Límite máximo Toxina amnésica de moluscos (Acido Moluscos domoico) 20µg /g de carne Toxina neurotóxica de moluscos (Brevitoxina) Moluscos Negativa Toxina paralizante de moluscos (Saxitoxina) Moluscos 80µg /100 g de carne Toxina diarreica de moluscos (Acido Moluscos okadaico) 0,2µg /g de carne Ver fórmulas en sección 2.3 mejorar su eficiencia y disminuír su costo. La tendencia a nivel nacional e internacional es la aplicación de normas que permitan proteger la salud del consumidor, lo cual exige que los productores tanto de productos pesqueros extraídos o cultivados sometan sus productos a análisis en laboratorios certificados, analizando el contenido de biotoxinas producidas ya sea en el medio natural o en sistemas de cultivo, por lo tanto este tipo de sustancias pronto serán parte de los requerimientos para 95 la emisión de permisos de exportación/importación, y por la importancia de los volúmenes e ingresos por el cultivo de crustáceos como es el caso del camarón, lo cual habrá que considerar desde ahora. 2.8 Recomendaciones para prevenir y contrarrestar los efectos del fitoplancton nocivo en la larvicultura Entre las medidas o acciones que se pueden implementar para prevenir y contrarrestar los efectos del fitoplancton nocivo en la actividad camaronícola están: (a) Observación rutinaria del color del mar y análisis metódico del fitoplancton de la playa y la fuente de abastecimiento de agua al sistema de larvicultura. (b) Capacidad de almacenamiento de agua suficiente para sortear emergencias durante al menos una semana de duración del evento. (c) En particular, es recomendable no bombear durante la noche debido a que la mayoría de los organismos formadores de marea roja realizan migración vertical y permanecen en el fondo durante la noche, respirando y asimilando nutrientes. Durante el día ascienden para captar la luz y 96 realizar la fotosíntesis. (d) Implementación de bioensayos con el agua de abastecimiento para prevenir efectos de toxicidad como resultado del bombeo durante eventos de marea roja, especialmente en presencia de Gymnodinium catenatum. (e) Instalación de filtros más profundos en la playa ya que esto ha dado buenos resultados en Sinaloa durante los eventos de mortalidad mencionados. Esto se debe a que el suelo tiene la capacidad de absorber parte de las toxinas disueltas en el agua. (f) Contar con un sistema eficiente para eliminar bacterias y fitoplancton indeseable mediante el tratamiento del agua con lámparas de luz ultravioleta (UV), optimizando el tiempo de exposición, el cual está relacionado con la velocidad de bombeo. (g) Aplicación de ozono al nivel mínimo para no afectar el buen desarrollo de la larva ya que la actividad bacteriana de especies útiles, queda anulada y esto provoca un bajo rendimiento o mortalidad de la larva. (h) Es recomendable realizar también, rutinariamente análisis de oxígeno disuelto y de amonio en el agua. 97 (i) En el caso de la presencia de marea roja, o de los efectos del fitoplancton sobre la larva: se recomienda efectuar el análisis cuantitativo y cualitativo de fitoplancton y análisis de biotoxinas o efectos de biotoxinas en el fitoplancton, en el agua de bombeo, en moluscos, y en larvas o camarón adulto que haya muerto o enfermado por efecto de la marea roja. Finalmente, es necesario subrayar la necesidad de investigación a fondo sobre este problema ya que ha provocado grandes pérdidas económicas al sector y se deberá buscar la raíz del problema para implementar medidas para prevenir, resolver o mitigar los efectos y disminuír daños económicos a la industria del cultivo de camarón. 98 3. Prevención, mitigación y remediación de problemas de fitoplancton asociado a la camaronicultura Para prevenir los problemas en la camaronicultura, asociados al fitoplancton, deben considerarse las siguientes medidas: (a) La aplicación de fertilizantes al estanque deberá hacerse de acuerdo al contenido de nutrientes en el agua y sedimentos. (b) La cantidad del alimento suministrado deberá administrarse de acuerdo al comportamiento alimenticio, hábitos y metabolismo del camarón así como la búsqueda de correspondencia entre el alimento suministrado y el alimento consumido para evitar pérdidas económicas y el consecuente aumento de materia orgánica en el estanque en el transcurso del ciclo de cultivo. (c) Mejoramiento del diseño del estanque, construcción de estanques amortiguadores y reducción o eliminación del recambio de agua de manera tal que se disminuya o se evite el impacto de los efluentes en la zona costera. (d) Considerar la utilización de la aireación mecánica como una medida para mejorar la diversidad y controlar la abundancia del fitoplancton. 99 (e) La ozonación se usa como tratamiento de desinfección por medio de la desactivación de bacterias patógenas y virus, puede aplicarse también para eliminar microalgas dañinas y degradar a la materia orgánica. Actualmente, se esta estudiando la factibilidad de proyectos para el establecimiento de sistemas de ozonación a gran escala en sistemas de cultivo intensivos con el objeto de proteger a la industria de enfermedades. Se ha aplicado la ozonación en granjas del Ecuador con problemas graves de síndrome de Taura (TSV Taura Syndrome Virus), en un área de 760 ha, obteniendo una producción semejante a la cosechada antes de la infección, la sobrevivencia aumentó de 10% al 60% con el tratamiento de ozonación en el agua de abastecimiento (Schuur, 2002). Los graves y variados efectos que dañan tanto a las especies en cultivo como a la salud humana han estimulado la investigación en métodos de mitigación de mareas rojas nocivas y tóxicas. Entre los conocimientos básicos demandados está el entender los factores que regulan las poblaciones de microalgas que forman esas mareas rojas y el diseño de acciones que modifiquen esas condiciones. El control de florecimientos 100 tóxicos está aplicándose a nivel experimental, y para ello se utilizan métodos químicos, físicos y biológicos. Una de las técnicas de mitigación más usada en la acuacultura para controlar eventos nocivos o tóxicos tanto en sitios semicerrados costeros como en estanques de cultivo en Japón, es la aplicación de arcillas ecológicamente inertes. Las arcillas no son muy costosas y actúan como floculantes, en laboratorio, esta técnica provoca la agregación de las células, acelerando la sedimentación de las microalgas y se puede alcanzar una eficiencia del 100%, cuando se ayuda con un flujo de baja velocidad, clarifica el agua, precipitando la totalidad de las células en 48 horas, durante una marea roja formada por una especie en particular. Los efectos adversos inmediatos son para los moluscos los cuales pueden verse afectados por la cantidad de partículas que precipitan, otro de los posibles efectos tiene que ver con el destino de las células precipitadas, las cuales pueden formar quistes y eclosionar cuando las condiciones del estanque o del área semicerrada se restablecen y por último, es necesario conocer los efectos que ejercen las arcillas sobre la especie en cultivo, ya que es determinante en la búsqueda de este tipo de técnicas de mitigación. En 101 Japón son frecuentes las mareas rojas monoespecíficas formadas por Cochlodinium polykrikoides, se han aplicado 60,000 ton de arcillas sobre un área afectada de 260 km2 a razón de 400 g m-2 por vía aérea logrando limpiar una columna de agua de 2 metros sin sufrir pérdidas de los peces en cultivo (Archambault et al., 2003). Entre otros métodos químicos, se han experimentado con la aplicación de carbonato de sodio (Na2CO3/H2O2) 3:2 y de formalina diluída, esta última en estanques de cultivo de peces o camarón. Es necesario hacer pruebas de laboratorio para conocer los efectos de dichas sustancias químicas a corto y largo plazo sobre el ambiente y los organismos en cuestión antes de aplicar estas técnicas de control de mareas rojas. El control biológico se lleva a cabo mediante la exposición de la especie formadora a depredadores naturales, en el caso de los tintínidos y copépodos que son los mayores consumidores del fitoplancton se pueden hacer experimentos conducentes a establecer en cuerpos de agua cerrados la eficiencia de pastoreo y la factibilidad de su cultivo. El control físico de los florecimientos se puede efectuar mediante la aplicación de aireación mecánica la cual aumenta la turbulencia y provoca 102 daño físico a las células, dependiendo de las adaptaciones de la especie a la agitación mecánica. La turbulencia afecta la fisiología de las células, la asimilación de nutrientes, la depredación, etc. (Kiorboe, 1997). Los factores a considerar en la aplicación de estos métodos de remediación son: el tipo, talla y número de células que forman la marea roja, el grado de toxicidad y peligrosidad, el tipo de cuerpo de agua afectado, si tiene o no comunicación con el mar y su hidrodinámica. Por otro lado, se deben considerar también las características de la especie en cultivo y los posibles daños que puede provocar la cantidad de arcillas administrada. Por último debe conocerse el destino que tendrán las células si forman quistes que provocan mareas rojas recurrentes o si se debe considerar solamente el consumo de oxígeno que necesitará durante la descomposición de la materia orgánica. La aplicación de arcillas es un método prometedor en la reducción de los impactos de las mareas rojas en la acuacultura sobre todo en sistemas de baja energía. Es necesario investigar los diferentes factores que intervienen en una buena eficiencia de este tipo de técnicas a nivel laboratorio, previo a su aplicación en el ambiente de manera experimental, y desde luego, antes de implementarla 103 como una medida de remediación a una mayor escala, en los casos en los que la técnica resulte útil. 104 Heterocapsa niei Cochlodinium polykrikoides Prorocentrum minimum Cylindrotheca closterium =Nitzschia closterium Marea roja formada por Cochlodinium polykrikoides. en los estanques de cultivo de camarón en el CIBNOR, La Paz, B.C.S., Septiembre, 2000. Lámina 1. Especies formadoras de mareas rojas en la costa y en estanques de cultivo de camarón en La Paz. B.C.S. 105 A B F E I D C J K G H L M (1) Dinoflagelados tecados; (A) Alexandrium sp., (B) Alexandrium monilatum, (C) Ceratium balechii, (D) Ceratium furca, (E) Dinophysis caudata, (F) Dinophysis fortii, (G) Ensiculifera sp., (H) Gonyaulax digitalis, (I) Prorocentrum compressum, (J) Prorocentrum minimum, (K) Prorocentrum rhathymum, (L) Scrippsiella trochoidea (WEB), (M) Protoperidinium conicum. Lámina 2. Especies formadoras de mareas rojas en la zona costera de B.C.S. continua 106 N O P S Q T U R V W X (2) Dinoflagelados desnudos; (N) Akashiwo sanguinea (WEB), (O) Cochlodinium polykrikoides (P) Gymnodinium catenatum. (3) Ciliados fotosintéticos; (Q) Mesodinium rubrum. (4) Diatomeas; (R) Biddulphia alternans, (S) Chaetoceros debilis, (T) Cylindrotheca closterium, (U) Pseudonitzschia pungens, (V) Proboscia alata, (W) Rhizosolenia debyana. (5) Cianobacterias; (X) Trichodesmium erythraeum. Lámina 2. continuación 107 Cianobacterias Anabaena aequalis Oscillatoria limnetica Anabaenopsis elenkinii Schizothrix calcicola Dinoflagelados desnudos Gymnodinium incoloratum Diatomea pennada Anabaena flos-aquae Dinoflagelado tecado Prorocentrum minimum Gyrodinium spirale Cylindrotheca closterium a) Especies nocivas y/o tóxicas en estanques de cultivo en el noroeste de México escala 10 mm.Modificados de Alonso-Rodríguez y Páez-Osuna (2003). Lámina 3. Especies formadoras de mareas rojas en estanques de cultivo. continua 108 Dinoflagelados desnudos Cianobacterias Gymnodinium simplex Trichodesmium thiebautii Gymnodinium pulchellum Diatomea pennada Spirulina subsalsa Nitzschia navis-varingica Dinoflagelados tecados Alexandrium tamarense Protoperidinium balechi Pyrodinium bahamense var. compresumm b) Especies nocivas y/o tóxicas para el camarón adulto o en estadios larvarios en el mundo. Detalles en el texto. Re-dibujado de la literatura citada en el texto. Lámina 3. continuación 109 fijado en vivo Amylax triacantha= Gonyaulax triacantha 35-45 micras largo y 17-30 micras ancho Ceratium dens= C. balechi solo o en cadenas 140-206 micras de largo en vivo en vivo Ceratium furca 125-230 micras de largo, 28-38 micras de ancho en vivo Gymnodinium sanguineum (=Akashiwo sanguinea) 40-70 micras de largo y 38-53 micras de ancho en vivo Cochlodinium polykrikoides 30-40 micras largo y 20-30 micras de ancho cadenas de hasta 16 células. en vivo Gyrodinium instriatum= Gymnodinium instriatum 30-75 micras de largo y 20-57 micras de ancho Lámina 4. Especies formadoras de mareas rojas en la costa de Sonora, Sinaloa y Nayarit. (Modificado deAlonso-Rodríguez, 2003). continua 110 Fibrocapsa japonica= Chatonella japonica 30 x 25 micras de ancho en vivo en vivo en vivo Mesodinium rubrum 20-50 micras de diámetro Pseudo-nitzschia spp. 33-160 micras largo y 4 a 8 micras de ancho. fijado en vivo Noctiluca scintillans 200-1000 micras de diámetro Gymnodinium catenatum 40-63 de diámetro forma cadenas de hasta de 64 células. fijado Prorocentrum balticum 14-20 micras de diámetro en vivo en vivo Oscillatoria erythraea=Trichodesmium erythaeum las células miden de 11 a 19 micras de ancho y forman largos filamentos de apariencia granulosa. Peridinium quinquecorne 23-40 micras de largo y 20-36 micras de ancho Lámina 4. continuación continua 111 en vivo WEB Prorocentrum mexicanum 39 micras de largo y 29 micras de ancho Porocentrum dentatum 17-20 micras de largo en vivo en vivo Prorocentrum micans 35-70 micras de largo y 20-50 micras de ancho Prorocentrum minimum 14-19 micras de largo WEB en vivo Prorocentrum triestinum 18-22 micras de largo y 6-11 micras de ancho Scrippsiella trochoidea 21-29 micras de largo y 18 a 22 micras de ancho Fotos: A. sanguinea cortesía de Lourdes Morquecho, P. dentatum y P. triestinum obtenidas del Web, el resto son de los autores. Lámina 4. continuación 112 Agradecimientos Este trabajo fue realizado en las instalaciones de la Unidad Académica Mazatlán, ICML-UNAM y fue financiado parcialmente por el proyecto SEMARNAT-2002-C01-0161. El primer autor es ex-becario CONACyT No. 86906. Agradecemos a Germán Ramírez Reséndiz por el trabajo de diseño y edición del manuscrito. A Clara Ramírez-Jáuregui por la provisión del acervo bibliográfico. IGL es becario COFFA, EDI (P-DEGEPI 200203333) y ex-becario CONACyT (138138). AAída Martínez (CICIMAR) y a Samuel Gómez Noguera (UA-Mazatlán) por las facilidades en el uso del procesador de imágenes. Gracias a CESASIN, ISAy a los productores por su confianza y apoyo en la investigación de la problemática tratada. 113 114 Anexo 1 Problemas en la observación, identificación, fijación y recuento de microalgas benéficas o dañinas. El monitoreo de especies benéficas, tóxicas o formadoras de florecimientos algales se lleva a cabo mediante los recuentos fitoplanctónicos y la identificación de las especies en muestras naturales o de cultivo (agua de abastecimiento y estanques). Para varias especies que forman florecimientos, la observación del material vivo sigue siendo indispensable para una identificación confiable al utilizar microscopio de luz. No hay un fijador universal, que sea adecuado para todos los tipos de microalgas y todos los propósitos. Algunas especies se pueden fijar sin perder la mayoría de sus atributos de estructura, volumen y color como son la mayoría de las diatomeas. Los fijadores más comunes para el fitoplancton son el acetato lugol o solución de lugol y el formol o formalina. Los métodos de recuento, identificación y fijación se encuentran ampliamente tratados en CortésAltamirano (1998) yAlveal et al. (1995). 115 tratados en Cortés-Altamirano (1998) yAlveal et al. (1995). El lugol puede resultar un buen fijador para flagelados en general, solo que obscurece las estructuras internas de la célula y en ocasiones resulta difícil hacer una correcta identificación ya que el material necesita ser clareado. Es importante vigilar la concentración final del lugol aplicado a la muestra, reflejado por el tono ámbar que resulta cuidando que el tono no sea demasiado obscuro ya que puede ser que no se obtengan los resultados deseados para el tipo de microalga que se trata, este fijador es ideal para células pequeñas y para conservar flagelos o estructuras muy finas. El formaldehído (2-4%) resulta un fijador fuerte para muchas especies de flagelados, tales como las prasinofiseas, dinoflagelados desnudos, este fijador puede blanquear los pigmentos fotosintéticos que pueden ser importantes para la identificación de una especie (Throndsen, 1993). Algunos dinoflagelados como Gymnodinium spirale, G. catenatum y la prasinofícea Nephoselmis sp, se ven severamente dañados con este fijador. Este fijador es ideal para fijar dinoflagelados. A las rafidofíceas es necesario identificarlas en vivo, ya que no se pueden reconocer si son fijadas (Band et al., 2004). Una ligera cantidad de lugol permitirá su fijación con fines de recuento. Un ejemplo de casos que se deforman con los fijadores en aguas mexicanas 116 Algunos dinoflagelados como Gymnodinium spirale, G. catenatum y la prasinofícea Nephoselmis sp., se ven severamente dañados con este fijador. Este fijador es ideal para fijar dinoflagelados. A las rafidofíceas es necesario identificarlas en vivo, ya que no se pueden reconocer si son fijadas (Band et al., 2004). Una ligera cantidad de lugol permitirá su fijación con fines de recuento. Un ejemplo de casos que se deforman con los fijadores en aguas mexicanas es el de Cochlodinium polykrikoides, del cual no se tienen muchos registros en el Golfo de California pero muy probablemente es debido a la fijación. Cuando las células de esta especie se fijan con formol se destruyen completamente, sin embargo cuando se fijan con unas pocas gotas de lugol, se dañan solo ligeramente (Osorio-Tafall 1943, Figueroa-Torres y ZepedaEsquivel 2001; Gárate-Lizárraga et al. 2004). El lugol no es un buen fijador para los cocolitofóridos ya que disuelve las estructuras formadas de carbonato de calcio. Estas son algunas de las razones por las cuales es necesario realizar observaciones en vivo de las muestras para su apropiada identificación. La comparación morfológica se puede hacer mediante bibliografía general y especializada. Dentro de la literatura general y mundial se cuenta con guías taxonómicas para identificar diatomeas, dinoflagelados, fitoflagelados, 117 El lugol no es un buen fijador para los cocolitofóridos ya que disuelve las estructuras formadas de carbonato de calcio. Los cocolitofóridos son muy exigentes en el pH para su conservación por lo cual se realiza sin preservativo, solamente llevando el pH a 8.5-9 con una solución de amonio. Estas son algunas de las razones por las cuales es necesario realizar observaciones en vivo de las muestras para su apropiada identificación. La comparación morfológica se puede hacer mediante bibliografía general y especializada. Dentro de la literatura general y mundial se cuenta con guías taxonómicas para identificar diatomeas, dinoflagelados, fitoflagelados, cianobacterias, clorofíceas, etc. (Cupp, 1943; Tomas, 1996; Faust y Gulledge, 2002). Debido a que el fitoplancton de estanques de cultivo de camarón se compone de especies de microalgas dulceacuícolas, salobres y marinas, residentes principalmente de las zonas costeras, es necesario contar con literatura de apoyo de estos tipos de agua. En la actualidad se cuenta con guías para identificación de dinoflagelados y diatomeas del Golfo de California (Licea et al., 1995; Moreno et al., 1996). Se cuenta también, con una basta bibliografía especializada, desarrollada por investigadores de los centros de educación e investigación en el noroeste de México. Actualmente se está desarrollando por los autores un catálogo de identificación de las microalgas de las lagunas de Sinaloa para el apoyo en estas tareas. 118 Referencias Alcaráz, G., Chiapa-Carrara, X., Espinoza, V. y Vanegas, C. 1999a. Acute toxicity of ammonia and nitrite on respiration of Penaeus setiferus postlarvae under different oxygen levels. Journal of the World Aquaculture Society, 31: 98-106. Alcaráz, G., Chiapa-Carrara, X., Espinoza, V. y Vanegas, C. 1999b. Acute toxicity of ammonia and nitrite to white shrimp Penaeus setiferus postlarvae. Journal of the World Aquaculture Society, 31: 90-97. Allan, G.F., G.B. Maguire y Hopkins, S.J. 1990. Acute and chronic toxicity of ammonia to juvenile Metapenaeus macleayi and Penaeus monodon and the influence of low dissolved oxygen levels. Aquaculture 91: 263280. Alongi, M.D., Dixon, P., Johnston, D.J., Van-Tien, D. y Thanh-Xuan, T. 1999. Pelagic process in extensive shrimp ponds of the Mekong delta, Vietnam. Aquaculture, 175(1-2): 121-141. Alonso-Rodríguez, R. 2003. Breve guía de identificación de especies formadoras de mareas rojas en la zona costera de Sinaloa. CESASIN-UNAM (Eds). Díptico 4 pp. Mayo de 2003. 119 Alonso-Rodríguez, R. y Páez-Osuna, F. 2001. La presencia de fitoplancton en los estanques de cultivo de camarón: composición, abundancia y variación: pp. 137-155. En: Federico Páez-Osuna (ed). Camaronicultura y Medio Ambiente. México: Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de Sinaloa, Colegio de Sinaloa y Programa Universitario deAlimentos, 450 p. Alonso-Rodríguez R. y Páez-Osuna, F. 2003. Nutrients, phytoplankton and harmful algal blooms in shrimp ponds: a review with special reference to the situation in the Gulf of California.Aquaculture, 219(1-4): 317-336. Alonso-Rodríguez, R., Gárate-Lizárraga, I., Luckas, B., Reinhardt, K. y BustillosGuzmán, J. 2004. Mortalidad de larvas y camarón en cultivo en Sinaloa, México, asociado a mareas rojas de Gymnodinium catenatum. pp. 54-55. En: XIII Reunión Nacional de la Sociedad Mexicana de Planctología, A. C. VI Reunión Internacional de Planctología, del 25 al 28 de abril del 2004 en Nuevo Vallarta, Nayarit, México. Archambault, M.C., Grant, J. y Bricelj, B.M. 2003. Removal efficiency of dinoflagellate Heterocapsa triquetra by phosphatic clay, and implications for the mitigation of harmful algal blooms. Marine Ecology Progress Series, 253: 120 97-109. Báez-Dueñas, M.C., López-Elías, J.A., Bringas-Alvarado, L. y Galavíz-Moreno, S. . 1992. Nutrición. pp. 119-159. En : Martínez-Córdova (ed.) Camaronicultura: Bases técnicas y científicas para el cultivo de penaeidos. México:A.G.T. Editor, S.A., 233 p. Band-Schmidt, C.J., L. Morquecho, D.U. Hernández-Becerril, A. Reyes-Salinas y Bravo-Sierra, E. 2004. Raphidophyceans on the coasts of Mexico. Hidrobiología. 515: 79-89. Blanco-Blanco, M. Aguilar-Olguin, S. y Morales-Blake, A. 1999. Caracterización de una marea roja en la bahía de Manzanillo, Colima, México. pp. 338-339. En: Tresierra-Aguilar, A.E. y Culquichón-Malpica, Z.G. (Eds.). Memorias del VII Congreso Latinoamericano sobre Ciencias del Mar, 17-21 de octubre de 1999. Trujillo, Perú. Boyd, C.E. 1990. Aquatic Plants. pp. 100-130. En: Water quality in ponds for aquaculture. Alabama: Agriculture Experiment Station. Auburn University 482 p. Boynton, W.R., Kemp, W.M. y Keefe, C.W. 1982. A comparative analysis of nutrients and other factors influencing estuarine phytoplankton production. 121 En: Kennedy, V.S. (ed.). Estuarine comparisons.Academic Press, New York, p. 69-90. Brown, R.M., Jeffrey, J.K. y Dunstan, G.A. 1997. Nutritional properties of microalgae for mariculture.Aquaculture, 151(1-4): 315-331. Burford, M. 1997. Phytoplankton dynamics in shrimp ponds. Aquaculture Research, 28(5): 351-360. Burford, M.A., Thompson, P.J., McIntosh, R.P., Bauman, R.H. y D.Pearson, D.C. 2003. Nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize.Aquaculture, 219(1-4): 393-411. Cavalli, R.O., W.J. Wasielesky, C.S. Franco y K. F. Miranda. 1996. Evaluation of the short-term toxicity of ammonia, nitrite and nitrate to Penaeus paulensis (Crustacea, Decapada) broodstock. Arquivos de Biologia e Tecnologia 39: 567-575. CEDIA 1988. Manual de cría de camarones penaeidos en estanques de agua salobre. Centro de Documentación e Información de Acuicultura, CEDIASantiago de Veraguas, Dirección Nacional deAcuicultura, Panamá 54 pp. Chen, J.C. y Tu, C.C. 1990. Acute toxicity of nitrite to larval Penaeus japonicus. Journal of Fisheries Society of Taiwan. 17: 227-237. 122 Chen, J.C., Tu, C.C. y Yang, W.S. 1989. Acute toxicity of ammonia to larval Penaeus japonicus. Journal of Fisheries Society of Taiwan 16: 261-270. Conley, D.J., Schelske, C.L. y Stoermer, E.F. 1993. Modification of the biogeochemical cycle of silica with eutrophication. Marine Ecology Progress Series 101. 179-192. Cortés-Altamirano, R. 1994. Microalgas dañinas en estanques de cultivo de camarón. En: Páez-Osuna, F., Hendrickx-Reners, M. y CortésAltamirano, R. (Coordinadores). Efecto de la calidad del agua y composición biológica sobre la producción en granjas camaronícolas. Informe Final, Proyecto CONACYT 0625-N9110, p. 219-230. Cortés-Altamirano, R. 1998. Las mareas rojas. AGT (Ed.). México, D.F. 161. Cortés-Altamirano, R. y Núñez-Pastén, A. 1992. Doce años (1979-1990) de registros de mareas rojas en la bahía de Mazatlán, Sinaloa, México. Anales de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México, 19(1): 113-121. Cortés-Altamirano, R. y Agraz, H.C.M. 1994. Presencia de Prorocentrum minimum (Pav.) Schiller in shrimp culture ponds. Ciencias del Mar, 123 UAS, 13: 11-16. Cortés-Altamirano, R. y Alonso-Rodríguez, R. 1997. Mareas rojas durante 1997 en la bahía de Mazatlán, Sinaloa, México. Ciencias del Mar, UAS, 15: 29-35. Cortés-Altamirano, R. y Licea-Durán, S. 1999. Florecimientos de microalgas nocivas en estanques para cultivo semi-intensivo de camarón en México. Revista Latinoamericana de Microbiología, 41: 157-166 Cortés-Altamirano, R., Nuñez-Pastén, A., Esparza-Leal, H.M. y BarrazaGuzmán, I. 1994. Variación y abundancia del fitoplancton de estanques semi-intensivos para cultivo de camarón en Sinaloa, México. Efecto de la calidad del agua y composición biológica sobre la producción en granjas camaronícolas. Informe final Proyecto CONACYT 0625N9110, p. 177-245. Cortés-Altamirano, R., Manrique A.F. y Luna Soria, R. 1997a. Harmful phytoplankton blooms in shrimp farms from Sinaloa Mexico. p. 56. En: VIIIth International Conference on Harmful Algae. Vigo, España, June 2529 (1997) Abstract Book, Xunta de Galicia, Spain-IOC-UNESCO. p. 56. 124 Cortés Altamirano, R. Alonso-Rodríguez, R. y Peña-Ramírez, I. 1997b. Primer registro de marea roja debida a Mesodinium rubrum (Protozooa: Ciliata) en Bahía Banderas, México. 44(3): 675-676. Cortés-Altamirano, R. S. Licea, S. y Gómez-Aguirre, S. 1999. Evidencias del aumento de microalgas nocivas en la Bahía de Mazatlán, Sin., México. pp. 343-345. En: Tresierra-Aguilar, A.E. y CulquichónMalpica, Z.G. (Eds.). Memorias del VII Congreso Latinoamericano sobre Ciencias del Mar, 17-21 de octubre de 1999. Trujillo, Perú. Cortés-Lara, M.C. 2002a. Informe del fenómeno de marea roja en bahía de Banderas, Jalisco-Nayarit, octubre-noviembre de 2001. Revista Biomédica, 13. 73-75. Cortés-Lara, M.C. 2002b. Primer registro de marea roja del 2002. Bahía de Banderas, Jalisco-Nayarit (Enero de 2002). Revista Biomédica, 13: 229230. Cortés-Lara, M. C. Cortés-Altamirano, R. y Cupul-Magaña, A. 2003. First record of Fibrocapsa cf. japonica in Matanchen Bay, Nayarit, Mexican Pacific Coast. HarmfulAlgae News, 24: 1-4. Chamberlain, G.W. y Lawrence, A. L. 1981. Maturation, reproduction and 125 growth of penaeus vannameia and P. stylirostris fed natual duietas. Journal of the World Marine Socyety 12: 208-224. Chen, J.C. y Chin, T.S. 1988. Acute toxicity of nitrite to tiger prawn Penaeus monodon larvae.Aquaculture, 69: 253-262. Chen, J.C. y Nan, F.H. 1991. Lethal effects of nitrite on Metapenaeus ensis larvae. Journal of the WorldAquaculture Society, 22: 51-55. Chen, J.C., Liu, P.C. y Lei, S.C. 1990b. Toxicity of ammonia and nitrite to Penaeus monodon adolescents.Aquaculture, 89: 127-137. Chen, J.C., Liu, P.C. y Nan, F.H. 1991. Acute toxicity of ammonia o larval Metapenaeus ensis.Asian Fisheries Science, 4: 41-51. Chen, J.C., Ting, Y.Y., Lin, J.N. y Lin, M.N. 1990a. Lethal effects of ammonia and ntirite on Penaeus chinensis juveniles. Marine Biology, 107: 427-431. Chen, Y. Q. y Gu, X. G. 1993. An ecological study of red tides in the East China Sea. , pp. 217-222. En: Toxic Phytoplankton Blooms in the Sea. Smayda, T. and Y. Shimizu (Eds.). Amsterdam, Elsevier, 952 p. Chin, T.S. y Chen, J.C. 1987. Acute toxicity of ammonia to larvae of the tiger prawn, Penaeus monodon, Aquaculture, 66: 247-253. 126 Chong, V.C., Low, C.B. y Ichikawa, T. 2001. Contribution of mangrove detritus to juvenile prawn nutrition: a dual stable isotope study in Malaysian mangrove forest. Marine Biology, 138: 77-86. Dall, W., Hill, B.J., Rothlisberg, P.C. y Sharples, D.J. 1990. The biology of the Penaidae. Vol. 27, Advances in Marine Biology. Series (Eds.) J. H. S. Blaxter y A.J. Blaxter y A. J. Southard, Academic Southward. Academic Press, San Diego, CA, USA, 489 pp. Davidovich, N.A. y Bates, S.S.. 2002. Pseudo-nitzschia life cycle and the sexual diversity of clones in diatom populations, p. 31-36, 201. En: E. Garcés, A. Zingone, B. Dale, M. Montresor, and B. Reguera (Eds.) Proceedings of the LIFEHAB Workshop: Life history of microalgal species causing harmful algal blooms. Commission of the European Community. Delgado, G., Arencibia, G., De-La Paz, L. y Nodar, R.E. 1996. Marea roja en un estanque de cultivo de camarón en Cuba. Revista Cubana de Investigaciones Pesqueras, 20(1): 23-24. Dortch, Q. y Whitledge, T.E. 1982. Does nitrogen or silicon limit phytoplankton production in the Mississippi river plume and nearby 127 regimes?. Continental Shelf Research 12:1293-1309. El Hag, E.A. 1984. Food and food selection of the penaeid prawn Penaeus monodon. (Fabricius). Hydrologia, 110:213-217. Eyre, B.P. 2000. Regional evolution of nutrient transformation and phytoplankton growth in nine river-dominated subtropical East Australian estuaries. Marine Ecology Progress Series 205:61-83. Faust, A. M. y Gulledge, R.A. 2002. Identifying Harmful Marine Dinoflagellates. Contributions from the United States National Herbarium Smithsonian Institution, Washington, D.C. 42: 1-144. Feng, G. Lingfeng, H., Junmin, L. y Guoying, S. 2001. A survey on a Gymnodinium simplex Lohmann red tide in a shrimp pond in Pantu, Xiamen J. Xiamen Univ. Xiamen Daxue Xuebao. 40, 1: 98-102. Fisher, T. R. Peele, E.R. Ammerman, J.W. y Harding, L.W. 1992. Nutrient limitation of phytoplankton in Chesapeake Bay. Marine Ecology Progress Series 82:51-63. Focken, U., Groth, A., Coloso, R.M y Becker, K. 1998. Contribution of natural food and supplemental feed to the gut content of Penaeus monodon Fabricius in a semi-intensive pond systems in the Philippines. 128 Aquaculture, 164(1-4): 105-116. Frías-Espericueta, M.G. y Páez-Osuna, F. 2001. Toxicidad de los Compuestos del Nitrógeno en camarones. pp. 224-242. En: Federico Páez-Osuna (Ed.). Camaronicultura y Medio Ambiente. México: Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de Sinaloa, Colegio de Sinaloa y Programa Universitario deAlimentos, 450 p. Frías-Espericueta, M.G., Harfush-Meléndez, M. y Páez-Osuna, F. 2000. Effects of ammonia on mortality and feeding of postlarvae shrimp Litopenaeus vannamei. Bulletin of Environmental Contamination and Toxicology, 65: 98-103. Frías-Espericueta, M.G., Harfush-Melendez, M., Osuna-Lopez, J.I. y Páez-Osuna, F. 1999. Acute toxicity of ammonia to juvenile shrimp Penaeus vannamei Boone. Bulletin of Environmental Contamination and Toxicology, 62: 646-652. Gárate-Lizárraga, I. y Siqueiros-Beltrones, D. A.. 1998. Time Variation in Phytoplankton Assemblages in a Subtropical Lagoon System after the 1982-83 "El Niño" event (1984 to 86). Pacific Science 1:79-97. 129 Gárate-Lizárraga, I., Band-Schmith, C.J.., Bustillos-Guzmán, J.J. y ReyesCaballero, H. 1999a. Dinámica de las huellas pigmentarias del fitoplancton durante una marea roja ocurrida en un estanque de cultivo de camarón. En: Resúmenes del III Congreso Mexicano de Ficología, Sociedad Ficológica Mexicana, La Paz, B.C.S., 25-29 de Octubre de 1999. p.24. Gárate-Lizárraga, I., Bustillos-Guzmán, J.J. y Band-Schmith, C.J. 1999b. Características morfológicas y pigmentarias de las células causantes de una marea verde en un estanque de cultivo de camarón. En: Resúmenes del III Congreso Mexicano de Ficología, Sociedad Ficológica Mexicana, La Paz, B.C.S., 25-29 de Octubre de 1999. p. 47 Gárate-Lizárraga, I., Bustillos-Guzmán, J.J., Morquecho, L.M. y LechugaDeveze, C.H. 2000. First Outbreak of Cochlodinium polykrikoides in the Gulf of California. Harmful Algae News, (21): 7. Gárate-Lizárraga, I., Hernández-Orozco, M.L., Band-Schmidt, C.J. y Serrano-Casillas, G. 2001. Red tides along the coasts of Baja California Sur, México (1984 to 2001). Oceánides, 16: 127-134. Gárate-Lizárraga, I. Bustillos-Guzmán, J.J. y Alonso-Rodríguez, R. 2002a. 130 Gymnodinium catenatum Graham, in a coastal waters of México. Harmful Algae News, 23: 1-2. Gárate-Lizárraga, I. Band-Schmidt, C., Cervantes-Duarte, R., y EscobedoUrías, D. 2002b. Mareas rojas de Mesodinium rubrum (Lohmann) Hamburger y Buddenbrock en el Golfo de California (Invierno de 1998). Hidrobiológica 12(1): 15-20. Gárate-Lizárraga, I., Bustillos-Guzmán, J.J., Hummert, B.L. y LópezCortés, D. 2002c. Seasonal variation of PSP toxins in the catarina scallop (Argopecten ventricosus) from Bahía Concepción, Gulf of California. p. 101. En: Xth International Conference on Harmful Algae, St. Pete Beach, Florida, October 21-25, 2002. Gárate-Lizárraga, I., D.A. Siqueiros-Beltrones y V. Maldonado-López. 2003. First record of a Rhizosolenia debyana bloom in the Gulf of California, México. Pacific Science, 57(2):141-145. Gárate-Lizárraga, I., D.J. López-Cortes, J.J., Bustillos-Guzmán, y Hernández-Sandoval, F. 2004. Blooms of Cochlodinium polykrikoides Margalef in the Gulf of California, México. Revista de Biología Tropical. 52(Supl.1): 51-58. 131 Gárate-Lizárraga, I., Bustillos-Guzmán, J.J, Alonso-Rodríguez, R., y Luckas, B. 2004b. Comparative paralytic shellfish toxin profiles in two marine bivalves during outbreaks of Gymnodinium catenatum (Dinophyceae) in the Gulf of California. Marine Pollution Bulletin, 48, 397-402. Gautier, D. Bastidas, M. Aragón, L. Urango, W, Ramos, C. García, S, Pastrana, J.A. y Newmark, F. 2001. The relative importance of natural food and pelleted feed on the gut content of Litopenaeus vannamei raised in semi-intensive ponds. Aquaculture 2001. Book of Abstracts, World Aquaculture Society, 143. J. M. Parker Coliseum Louisiana State University Baton Rouge L.A. USA, 247 p. Glibert , P.M. y Terlizzi, D.E. 1999. Cooccurrence of elevated urea levels and dinoflagellate blooms in temperate estuarine aquaculture ponds. Applied and Environmental Microbiology, 65(12): 5594-5596. Gómez-Aguirre, S. y Martínez-Córdova, L.R. 1998. El Fitoplancton. En: Martínez- Córdova, L.R. (Ed.). Ecología de los sistemas acuícolas. AGT Editor, S.A., México, D.F. p. 77-94. Granéli, E. y Moreira, M.O. 1990. Effects of river water of different origin 132 on the growth of marine dinoflagellates and diatoms in laboratory cultures. Journal of Experimental Marine Biology and Ecology, 136(2): 89-106. Guerrero-Galván, S.R., Páez-Osuna, F. y Ruiz-Fernández, A.C. 1999. Seasonal variation in the water quality and chlorophyll a of semiintensive shrimp ponds in a subtropical environment. Hydrobiologia, 391(1-3): 33-45. Guoying, S. y Junmin, L. 1992. On the primary productivity and it's significance in prawn ponds during the early cultural stage. Journal of Xiamen University. Natural Science/Xiamen Daxue Kuebao, 31(2): 188-193. Hallegraeff, M.G. 2002. Aquaculturist´s Guide to harmful Australian Microalgae. Hobart, Tasmania, Australia. School of Plant Science, University of Tasmania. 136 pp. Haraldson, C. y Granéli, E. 1995. Trace metal as nutrients. pp. 269-275. En: Hallegraeff, G.M., Anderson, D.M., Cembella, A.D. (Eds.). Manual on Harmful Marine Microalgae. IOC Manuals and Guides 33. France. UNESCO, 551 p. 133 Harfush-Meléndez, M.R., M.G. Frías-Espericueta y Páez-Osuna, F. 1994. Estudio sobre la toxicidad del amonio en postlarvas y juveniles de Penaeus vannamei. En: Efecto de la calidad del agua y composición biológica sobre la producción en granjas camaronícolas. Informe final proyecto CONACYT 0625-N9110. Págs. 104-115. Huei-Meei, Su, I-Chiu, L. y Young-Men, C. (1993). Mass mortality of prawn caused by Alexandrium tamarense blooming in a culture pond in southern Taiwan. En: Smayda, T.J. y Shimizu, Y. (Eds.). Toxic Phytoplankton Blooms in the Sea. Elsevier Science Publications, New York, p. 329-333. Jamu, M.D., Lu, Z. y Piedrahita H.R. 1999. Relationship between Secchi disk visibility and chlorophyll a in acuaculture ponds. Aquaculture, 170: 205-214. Jayasankar, P. y M.S. Muthu. 1983. Toxicity of nitrite to the larvae of Penaeus indicus H. Milne Edwards. Indian Journal of Fisheries 30: 231240. Jiménez, R. 1993. Ecological factors related to Gyrodinium instriatum bloom in the inner estuary of Gulf of Guayaquil. pp. 257-262. En: 134 Smayda, T.J. y Shimizu, Y. (Eds). Toxic Phytoplankton Blooms in the Sea. New York, Elsevier Science Publications. 952 p. Jing, L., Deshang, L. y Shualing, D. 2000. The impact of stocking density on plankton community in shrimp pond. Journal of Fisheries of China Shuichan Xuebao. Shangai 24(3): 240-246. Johnston, D., Lourney, M. Van tien, D. Luu, T.T. y Xuan, T.T. 2002. Water quality and plankton densities in mixed shrimp-mangrove forestry farming systems in Vietnam.Aquaculture Research, 33: 785-798. Jory, E.D. 1995. Feed Management practices for healthy pond environment. pp. 118-143 pp. En: Proceedings of special session on shrimp farming. C.L. Browdy y J.S. Hopkins (Eds). Aquaculture'95. World Aquaculture Society, Baton Rouge, Louisiana, USA, Kiefer, D. y Lasker, R. 1975. Two blooms of Gymnodinium splendens an unarmored dinoflagellate. Fishery Bulletin, 73(1): 675-678. Kim, H. G., Park, J. S., Lee, S. G. y An. K. H. 1993. Toxic Phytoplankton Blooms in the sea. Amsterdam, Holanda, pp. 769-774, Dev. Mar. Biol., Vol. 3 Kim, H.G. 1997a. Recent harmful algal blooms and mitigation strategies in 135 Korea. Ocean Res. (Seoul) 19 (1997), pp. 185192. Kim, H.G. 1997b. Cochlodinium polykrikoides blooms in Korean coastal waters and their mitigation. p. 227-228. En: Reguera B., Blanco J., Fernández T., & Wyatt (Eds.). Harmful Algae. VIII International Conference. Vigo 1997. Xunta de Galicia. UNESCO. Intergovernmental Oceanographic Commission. 635 p. Kiorboe, T. 1997. Small-scale turbulence, marine show formation, and planktivorous feeding. Sientia Marina 61 Suppl. 1:141-158. Kotaki, Y., Koike, K, Yoshida, M., Van, T.C., Thi, M.H.N., Chu, H.N., Fukuyo, Y. y Kodama, M. 2000. Domoic acid production in Nitzschia sp. (Bacilliarophyceae) isolated from a shrimp-culture pond in Do Son, Vietnam. Journal of Phycology, 36(6): 1057-1060. Kuban, D.F., Lawrence, A.L. y Wilkenfeld, J.S. 1985. Survival, metamorphosis and growth of larvae from four penaeid species fed six food combinations. Aquaculture, 47(2-3): 151-162. Lam, N.N., y Hai, D.N., 1996. Harmful Marine Phytoplankton in Vietnam Waters. pp. 45-48. En: T. Yasumoto, Y. Oshima e Y. Fukuyo (Eds.) Harmful and Toxic Algal Blooms. Japan. UNESCO. Intergovernmental 136 Oceanographic Commission, 586 p. Lightner,D.V. 1978. Possible toxic effects of the marine blue-green alga, Spirulina subsalsa, on the blue shrimp, Penaeus stylirostris J. Invertebr. Pathol., 32(2), 139-150. Lin, H., P. Thuet, J.P. Trilles, R. Mounet-Guillaume y G. Charmantier, G. 1993. Effects of ammonia on survival and osmoregulation of various developmental stages of the shrimp Penaeus japonicus. Marine Biology 117: 591-598. López-Cortés., A. 1999. Population changes of benthic cianobacteria during a shrimp production operation.Algological Studies, 94: 245-248. Manrique, A.F. y Molina, R.E.. 1997. Presencia de mareas rojas en la bahía de Bacochibampo, Guaymas, Sonora, México. Hidrobiológica 7: 81-85. Martínez-Córdoba, L.R., Ezquerra-Brauer, M., Bringas-Alvarado, L., Aguirre-Hinojosa, E. y Garza-Aguirre, M.C., 2002. Optimización de alimentos y prácticas de alimentación en el cultivo de camarón en el Noroeste de México. En: L. E. Cruz-Suárez, D. Ricque-Marie, M. TapiaSalazar, M.G. Gaxiola-Cortés y N. Simopes (Eds). Avances en nutrición acuícola VI. Memorias del VI Simposium Internacional de Nutrición 137 Acuícola, del 3 al 6 de septiembre de 2002. Cancún, Quintana, Roo, México. Martínez-Córdoba, L.R., Porchas-Cornejo, M.A. Villareal-Colmenares, H., Calderón-Pérez, J.A. y Naranjo-Páramo, J. 1998. Evaluation of three feeding strategies on the culture of white shrimp Penaeus vannamei Boone 1931 in low water exchange ponds.Aquacultural Engineering, 17: 21-28. Massaut, L. Y Ortiz, J. 2003. Aislamiento y cultivo de cianobacterias con potencial toxicidad sobre postlarvas de Litopenaeus vannamei. El MundoAcuícola, 9(1):15-18. Matsuyama, Y. 1999. Harmful effect of dinoflagellate Heterocapsa on shellfish aquaculture in Japan. Japan Agriculture Research Quartely, 33. 283-293. McIntosh, D. Collins, C., McKeon, C. y Huntsinger, C. 2001. Phytoplankton biomass and community progression in an inland, low-salinity shrimp pond. Aquaculture 2001. Book of Abstracts, World Aquaculture Society, 143. J. M. Parker Coliseum Louisiana State University Baton rouge L.A. USA, 422 p. 138 Millán-Núñez, E., 1988. Marea roja en Bahía de Los Angeles. Ciencias Marinas 14(1): 51-55. Miller, D.C., Poucher, S.L. y Coiro, L. 2002. Determination of lethal dissolved oxygen levels for selected marine and estuarine fishes, crustaceans and bivalve. Marine Biology, 140: 287-296. Millero, F. J. 1996. Chemical Ocenaography. CRC, Boca Ratón, Florida, USA, 469 pp. Morales-Blake, A. y Hernández-Becerrill, D., 2001. Unusual HABs Manzanillo Bay, Colima, Mexico. Harmful Algae News, Intergovernmental Oceanographic Commission of UNESCO, 22, 6 pp. Morquecho, E. L. y Lechuga, D. C.H. 2001. Sinergismo de procesos ambientales relacionados con la presencia de eventos algales nocivos. En: K. Alveal y T. Antesana (Eds.). Sustentabilidad de la Biodiversidad Universidad de Concepción-Chile, 281-292. Muller-Feuga, A. 2000. The role of microalgae in aquaculture: situation and trends. Journal ofApplied Phycology 12: 527-534. Nunes,A.J.P., Goddard, S. y Gesteira, T.C.V. 1996. Feeding activity patterns of the Southern brown shrimp Penaeus subtilis under semi-intensive 139 culture in NE Brazil.Aquaculture 144: 371-386. Ochoa, J.L.; Sánchez-Paz, A., Cruz-Villacorta, A., Nuñez-Vázquez, E. y Sierra-Beltrán,A. 1997. Toxic events in the northwest Pacific coastline of Mexico during 1992-1995: origin and impact. Hydrobiologia, 352:195200. Ochoa, J.L., Hernández-Becerril, D.U., Lluch-Cota, S. Arredondo-Vega, B.O. Núñez-Vázquez, E, Heredia Tapia, A., Pérez-Linares, J. y AlonsoRodríguez, R. 2002. Marine Biotoxins and harmful algal blooms in Mexico's Pacific litoral. pp. 119-128. En: Harmful Algal Blooms in the PICES region of the North Pacific. F.J.R. “Max” Taylor y Vera L. Trainer (Eds.). Canada North Pacific Marine Science Organization (PICES). 152 p. Ochoa, J.L., Núñez-Váquez, E. y Saad, J. 2003. Diferentes términos utilizados para describir las “mareas rojas”. Revista de Biología Tropical 5(3-4):621-628. Ostrensky, A. y L.H. Poersh. 1992. Toxicidade aguda do nitrito na larviculturado camarao-rosa Penaeus paulensis Pérez-Farfante. 1967. Nerítica Curitibe7: 101-107. 140 Ostrensky, A. y Wasielesky, W. 1995. Acute toxicity of ammonia to various life stages of the Sao Paulo shrimp Penaeus paulensis Perez-Farfante, 1967.Aquaculture, 132: 339-347. Paerl, H.W. 1988. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnology and Oceanography, 33(4, Pt. 2): 823-847. Páez-Osuna, F. 2001. The environmental impact of shrimp aquaculture: causes, effects and mitigating alternatives. Environmental Management, 28(1): 131-140. Páez-Osuna, F. 2001. The environmental impact of shrimp aquaculture: a global perspective. Environmental Pollution, 112: 229-231. Páez-Osuna, F., S.R. Guerrero-Galván, A.C. Ruiz-Fernández y R. EspinozaAngulo. 1997. Fluxes and mass balances of nutrients in a semi-intensive shrimp farm in Northwestern Mexico. Marine Pollution Bulletin. 34(5): 290-297. Páez-Osuna, F. Gracia, A., Flores-Verdugo, F. Lyle-Fritch, L.P., AlonsoRodríguez, R. Roque, A. y Ruiz-Fernández, A.C. 2003. Shrimp aquaculture development and the environment in the Gulf of California ecoregion. Marine Pollution Bulletin, 46: 806-815. 141 Pastén-Miranda, N., 1983. Composición, abundancia y variación del fitoplancton del estero de Urías, Sinaloa, México (1980-1981). Tesis Profesional. UniversidadAutónoma del Estado de Morelos. 70 p. Pérez-Linares, J. Cadena, M., Rangel, C., Unzueta-Bustamante, M. y Ochoa, J.L. 2003. Effects of Schizothrix calcicola on white shrimp Litopenaeus vannamei (Penaeus vannamei) postlarvae. Aquaculture, 218(1-4): 55-65. Pearl, H. W. 1988. Nuisance phytoplankton blooms in coastal, estuarine and inland waters. Limnology and Oceanography 33: 823-847. Pitta, P., Karakassis, I. Tsapakis, M. y Zivanovic, S. 1999. Natural vs mariculture induced variability in nutrients and plankton in the eastern Mediterranean. Hydrobiologia, 391; 181-194. Preston, N.P., Burford, M.A. y Stenzel. D. J. 1998. Effects of Trichodesmium spp. blooms on penaeid prawn larvae. Marine Biology, 131: 671-679. Qi, D., Huang, Y. y Wang, X. 1993. Toxic dinoflagellate red tide by a Cochlodinium sp. along the coast Fujian, China pp. 235-238. En: Toxic Phytoplankton Blooms in the Sea. Smayda, T.J. y Y. Shimizu, (Eds.) 142 Amsterdam, Elsevier, 952 p. Raymont, E.G.J. 1980. The algae of the phytoplankton. p. 133-201. En: Raymont, J.E.G. (Ed.). Plankton and productivity in the oceans. 2nd Edition Vol. 1 Phytoplankton. Oxford. Pergamon International Library. 489 p. Redfield, A.C., Ketchum, B.H. y Richards, F.A. 1963. The influence of organisms on the composition of sea-water. En: Hill, M. N. (Ed.). The Sea. Vol 2. The composition of sea-water comparative and descriptive Oceanography. Interscience Publishers, New Cork, p. 26-77. Robertson, A.I. 1988. Abundant, diet and predatores de of juvenil banana prawns Penaeus, Penaesus merguiensis in a tropical mangrove estuary, Australian of Marine and Freshwater Research 39:467-478. Rothlisberg, P. 1998. Aspects of penaeid biology and ecology of relevante to aquaculture: a review.Aquaculture 164:49-65. Ruello, N. V. 1973. Burrowin, feeding, and spatial distribution of school prawn Metapenaeus macleayi (Haswell) in the Hunter river region, Australia. Journal of Experimental Marine Biology and Ecology 13: 189-206. 143 Ruiz-Fernández, A.C. y Páez-Osuna, F. 2004. Comparative survey of influent and effluent water quality of shrimp ponds on Mexican farms. Water Environment Research, 76(1): 5-14. Santoyo, R.H. 1994. Fitoplancton y productividad. pp. 222-245. En: de La Lanza, G. y Cáceres-Martínez (Eds.). Lagunas Costeras y el litoral Mexicano. México: Universidad Autónoma de Baja California Sur, 525 p. Schuur, M.A. 2003. Evaluation of biosecurity applications for intensive shrimp farming.Aquaculture Engineering, 28: 3-20. Shigueno, K. 1975. Shrimp culture in Japan. Association for International Technical Promotion. 15-17: 38-39. Shimizu, Y. 2003. Microalgal metabolites. Current Opinion in Microbiology 6: 236-243. Shishehchian, F., Yusoff, F.M., Omar, H. y Kamarudin, M.S. 1999. Nitrogenous excretion on Penaeus monodon postlarvae fed with different diets. Marine Pollution Bulletin (1-2): 224-227. Smith, D.W. 1985. Biological control excessive phytoplankton growth and enhancement of aquacultural production. Canadian Journal of Fisheries 144 andAquatic Science, 42: 1940-1945. Smith, P. T. 1996. Toxic effects of blooms of marine species of Oscillatoriales on farmed prawns (Penaeus monodon, Penaeus japonicus) and brine shrimp (Artemia salina) Toxicon, 34: 857-869. Smith, V. H. 1983. Low nitrogen to phosphorous ratio favors dominance by blue-green algae in lake phytoplankton. Science, 221: 669-671. Smith, V.H., Tilman, G. D. y Nekola, J.C. 1999. Eutrophication: impact of exceso nutrient inputs on freshwater, marine and terrestrial ecosystems. Environmental Pollution 100:179-196. Soderberg, R. W. y Meade J. W. 1991. The effects of ionic strength on unionized ammonia concentration. The Progresive Fish culturis 53: 118120. Sogawa, K. Kodama, E., Matsuda, M., Shigeta, S. y Okutani, K. 1998. Marine microalgal polissacaride induces apoptosis in human linphoid cells. Journal of Marine Biotechnology, 6: 35-38. Sournia, 1995. Red tide and toxic marine phytoplankton of the world ocean: an inquiry into biodiversity. En: Harmful Marine Algal Blooms. Lassus, P., G. Arzul, E. Erard-Le Denn, P. Gentien y C. Marcaillou-Le Baut. 145 (Eds.). France: Lavoisier Publishing. 878 p. Steidinger, K.A., Landsberg, J.H., Truby, E.W. y Roberts, B.S., 1998. First report of Gymnodinium pulchellum (Dinophyceace) in North America and associated fish kills in the Indian River, Florida. Journal of Phycology, 34(3): 431-437. Tett, P. 1987. The ecophysiology of exceptional blooms. Rapport et ProcésVerbaux des Reunions, Conseil International pour l´Exploration de la Mer, 187, 47-60. Tookwinas, S. y Songsangjinda, P. 1999. Water quality and phytoplankton communities in intensive shrimp culture ponds in Kung Krabaen Bay, Eastern Thailand. Journal of the World Aquaculture Society, 30(1): 3645. Tsai, S. y Chen, J. 2002. Acute toxicity of nitrate on Penaeus monodon juveniles at different salinity levels.Aquaculture 213: 163-170. UNESCO, 2001. Potentially harmful microalgae of the Western Indian Ocean-A guide based on preliminary survey. Manual Guides 41, Paris, France UNESCO. Intergovernmental Oceanographic Commission, 105 pp. 146 Villamar, D.F. y Landgdon, C.J. 1992. Complex microparticles for penaeid shrimp larvae. Aquaculture'92. Growing toward the 21st Century, p. 224. Whitfield, M. 1978. The hydrolysis of ammonium ions in seawaterexperimental confirmation of predicted constants at one atmosphere pressure. Journal Marine and Biological Assessment, U.K. 58: 781-787. Whyte, J.N.C., Haigh, N., Ginther N.G. y Keddy, L.J. 2001. First record of blooms of Cochlodinium sp. (Gymnodiniales, Dinophyceae) causing mortality of net-pen reared salmon on the west coast of Canada. Phycologia, 40(3): 298-304. Xiwu, Y. y Zhihui, H. 1997. Studies on primary production of phytoplankton in shrimp ponds. Journal of Fisheries of China/Suchian Xuebao, 21(3): 288-295 Xuemei, Z. y Zhinan, Z. 1999. The pelagic submodel of shrimp pond ecosystem. Journal of Ocean University of Quingdao, 29(1): 94-100. Yao, S. Shufang, Z, Jufa, C. y Yunli, S. 2001. Supplement and consumption od dissolved oxygen and their seasonal variations in shrimp pond. Marine Science Bulletin, 3(2): 89-96. Yoshida, M., Ogata, T. Thuoc, C.V., Matsuoka, K. Fukuyo, Y. Hoy, N.C. y 147