Grupo XVI: Halógenos
Anuncio
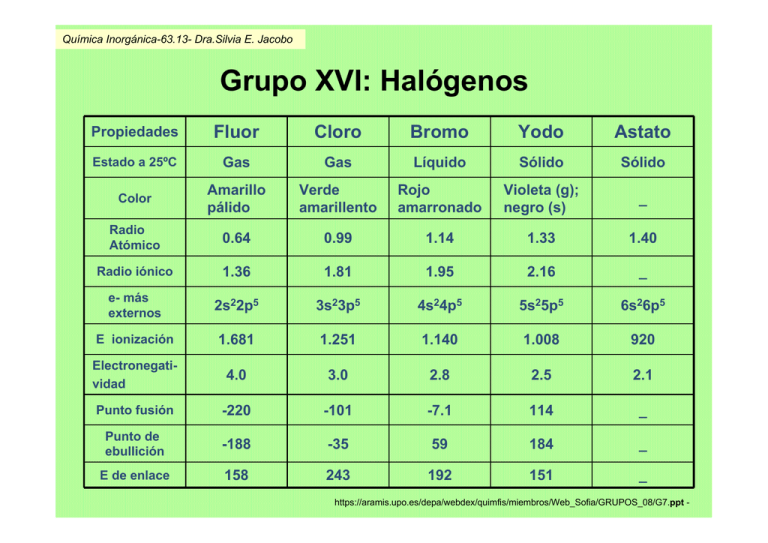
Química Inorgánica-63.13- Dra.Silvia E. Jacobo Grupo XVI: Halógenos Propiedades Fluor Cloro Bromo Yodo Astato Estado a 25ºC Gas Gas Líquido Sólido Sólido Color Amarillo pálido Verde amarillento Rojo amarronado Violeta (g); negro (s) _ Radio Atómico 0.64 0.99 1.14 1.33 1.40 Radio iónico 1.36 1.81 1.95 2.16 _ e- más externos 2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 E ionización 1.681 1.251 1.140 1.008 920 Electronegatividad 4.0 3.0 2.8 2.5 2.1 Punto fusión -220 -101 -7.1 114 _ Punto de ebullición -188 -35 59 184 _ E de enlace 158 243 192 151 _ https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Química Inorgánica-63.13- Dra.Silvia E. Jacobo Flúor El flúor es más abundante en la corteza terrestre (0.065%) que el cloro (0.055%), ocupando el 17º lugar en orden de abundancia en la misma. El flúor se presenta en la naturaleza en forma combinada como fluorita (CaF2), criolita (Na3AlF6) y fluorapatita (Ca5(PO4)3F). Cloro Es el 20º elemento en orden de abundancia de la corteza terrestre. Además de los grandes depósitos naturales de sal común, NaCl, existen reservas ingentes de cloro en el océano, con un 3.4% en peso de sales, de las cuales, el 1.9% son sales de iones cloruros. Bromo El bromo es sustancialmente menos abundante que el cloro o el flúor en la corteza terrestre. Como el cloro, la mayor fuente natural del bromo está en los océanos (en concentraciones de 65 mg/ml). La relación de masas del Cl:Br en el agua del mar es de 300:1. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Yodo El yodo es considerablemente menos abundante que los halógenos anteriores, tanto en la corteza terrestre como en la hidrosfera. Se encuentra en forma de yodatos, como los depósitos naturales de laurita (Ca(IO3)2) y dietzeita (7Ca(IO3)2x8CaCrO4). También se encuentra como yodo elemental en los yacimientos de nitrato de Chile. Astato El astato recibe su nombre del griego "inestable". De hecho, es un elemento radioactivo. El astato se origina en la serie radioactiva del 235U, pero de una manera colateral: No se conocen bien propiedades físicas del elemento debido a que los isótopos del At poseen vidas medias de sólo horas. Química Inorgánica-63.13- Dra.Silvia E. Jacobo CARACTERÍSTICAS • Todos los elementos del grupo XVII son monovalentes. • En su estado elemental forman moléculas biatómicas, X2. • En la naturaleza, por su gran reactividad, rara vez aparecen libres. Se encuentran principalmente en forma de sales disueltas en el agua de mar o en extensos depósitos marinos. • En propiedades físicas como el punto de fusión, de ebullición, la densidad y el radio; varían en orden creciente del flúor al yodo. Mientras que el calor específico disminuye en la misma relación. • La característica química fundamental de los halógenos es su capacidad oxidante. https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Estructura electrónica de los dihalógenos Color en fase gaseosa F2 Cl2 Br2 I2 https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Diagrama de Látimer a ) En solución ácida ClO4 - 1,19 ClO3- 1,21 HClO2 1,63 Cl2 1,36 Cl - 1,46 b ) En solución básica ClO4- 0,37 ClO3- 0,33 ClO2- 0,66 0,50 ClO - 0,40 Cl2 0,89 1,36 Cl- Química Inorgánica-63.13- Dra.Silvia E. Jacobo Diagrama de Frost 10 HClO4 pH= 0 8 pH= 14 HClO3 6 nEV HClO2 4 - HClO 2 - ClO3 - ClO2 Cl2 0 ClO4 - ClO - Cl -2 -1 0 1 2 3 4 n° oxidación 5 6 7 Química Inorgánica-63.13- Dra.Silvia E. Jacobo ESTADOS DE OXIDACION +7 Cl2O7 Heptoxido de dicloro +6 ClO3 Trióxido de cloro +5 HClO3 Clorato (V) de hidrogeno +4 ClO2 Dióxido de cloro +3 HClO4 Clorato (VII) de hidrogeno HIO4 Iodato (VII) de hidrogeno. HBrO3 Bromato (V) de hidrógeno BrO2 Dióxido de bromo I 2O 5 Pentoxido de diiodo I 2O 4 Tetroxido de diiodo HClO2 Clorato (III) de hidrogeno H5IO6 HIO3 iodato (V) de hidrogeno IO2 Dióxido de yodo HBrO2 Bromato (III) de hidrogeno +2 +1 Cl2O Monoxido de Dicloro F2 0 -1 HF HClO Clorato(I) de hidrogeno Br2O Monoxido de dibromo Cl2 F- HCl HBrO Bromato (I) de hidrogeno Br2 Cl- HBr HIO Iodato(I) de hidrógeno I2 Br-- HI I- Química Inorgánica-63.13- Dra.Silvia E. Jacobo FLUOR CARACTERÍSTICAS GENERALES • • • • • • • • • • • Símbolo: Número Atómico: Periodo: Peso molecular: Configuración electrónica: Estado de oxidación: Forma molecular: Apariencia: Densidad: Isótopos más estables: Descubrimiento F 9 2 18.9984032 g/mol [He]2s2 2p5 -1 F2 (moléculas diatómicas) gas amarillo pálido 1,696 Kg/m3 19F 1529,Georgius Agricola Química Inorgánica-63.13- Dra.Silvia E. Jacobo • Es el miembro más ligero y pequeño del grupo. • Es el elemento más reactivo del grupo (Eº= 2,866 V) • Es el que muestra mayor tendencia a ganar electrones, y por consiguiente, el que se reduce más fácilmente. • En la naturaleza aparece en combinación con otros elementos, y solamente en disolución acuosa, el flúor se presenta en forma de ión fluoruro, F-. Química Inorgánica-63.13- Dra.Silvia E. Jacobo • Los minerales más importantes en los que está presente son: - la fluorita, CaF2 - el fluorapatito, Ca5(PO4)3F - la criolita, Na3AlF6 https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Obtención de Fluor: método de Moisson (con mezcla fundida de HF+KF) 2HF (electrolisis KF 2HF) → H2 (g) + F2 (g) Consistente en las reacciones de electrodos: - Ánodo: 2F→ F2 (g) + 2 e- Cátodo: 2 H+ + 2 e-→ H2 (g) Se produce la oxidación de los fluoruros. En el cátodo se descarga hidrógeno, por lo que es necesario evitar que entren en contacto estos dos gases para que no haya riesgo de explosión. Química Inorgánica-63.13- Dra.Silvia E. Jacobo El éxito de Moissan fue consecuencia de utilizar platino, un metal muy inerte, y trabajar a bajas temperaturas reduciendo de esta manera la actividad del flúor. Un siglo después se consigue la síntesis química del flúor Química Inorgánica-63.13- Dra.Silvia E. Jacobo COMPUESTOS PRINCIPALES • El flúor al ser un elemento tan electronegativo tiene tendencia a captar electrones y a formar compuesto con casi todo, incluyendo los gases nobles como el radón y el xenón (XeF2), para tener la configuración de gas noble. • Los enlaces iónicos entre el flúor y los iones metálicos y la mayor parte de los enlaces covalentes entre el flúor y otros átomos no metálicos son fuertes. Química Inorgánica-63.13- Dra.Silvia E. Jacobo • Los compuestos principales que forma son: CaF2 : con el que se obtiene el HF ¾ HF: con el se obtiene otros compuestos importantes como: 9 F2 9 AlF3, 9 Na3AlF6 (criolita) 9 fluorocarbonos BF3 ,LiF ,SF6 ,SnF2 UF6, CFCs, NaF politetrafluoroetileno (PTFE) Química Inorgánica-63.13- Dra.Silvia E. Jacobo • Los CFCs como refrigerantes, propelentes, agentes espumantes, aislantes, etc., pero debido a que contribuyen a la destrucción de la capa de ozono se han ido sustituyendo por otros compuestos químicos, como los HCFs. • El politetrafluoroetileno (PTFE), es un polímero denominado comúnmente teflón. Material aislante muy resistente al calor y a la corrosión, usado para articulaciones y revestimientos así como en la fabricación de ollas y sartenes. https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Oxoácidos: ¾ Forma el HOF, el cual no tiene cargas formales , pero solo existen en los estados sólido y líquido. En agua, el HOF se descompone en HF, H2 O2 y O2 (g) Óxidos: ¾ OF2 : es muy inestable ¾ O2F2 : es muy inestable https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo CLORO Obtención y abundancia • El cloro se obtiene principalmente (más del 95% de la producción) mediante la electrólisis de cloruro de sodio, NaCl, en disolución acuosa, denominado proceso del cloro-álcali. • Se emplean tres métodos: electrolisis con celda de amalgama de mercurio, electrolisis con celda de diafragma y electrolisis con celda de membrana. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Características generales • • • • • • • Símbolo: Cl Nº atómico: 17 Periodo: 3 Peso molecular: 35,45u Configuración electrónica: [Ne]3s2 3p5 Estados de oxidación: ±1, +3, +5, +7 Forma molecular: Cl2 Química Inorgánica-63.13- Dra.Silvia E. Jacobo Compuestos Principales del cloro • • • • • Algunos cloruros metálicos se emplean como catalizadores. Por ejemplo, FeCl2, FeCl3, AlCl3. Ácido hipocloroso, HClO. Se emplea en la depuración de aguas y alguna de sus sales como agente blanqueante. Ácido cloroso, HClO2. La sal de sodio correspondiente, NaClO2, se emplea para producir dióxido de cloro, ClO2, el cual se usa como desinfectante. Ácido clórico(HClO3). El clorato de sodio, NaClO3, también se puede emplear para producir dióxido de cloro, empleado en el blanqueo de papel, así como para obtener perclorato. Ácido perclórico (HClO4). Es un ácido oxidante y se emplea en la industria de explosivos. El perclorato de sodio, NaClO4, se emplea como oxidante y en la industria textil y papelera. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Compuestos orgánicos del cloro • • • Algunos compuestos orgánicos de cloro se emplean como pesticidas. Por ejemplo, el hexaclorobenceno (HCB), el paradiclorodifeniltricloroetano (DDT), el toxafeno, etcétera. Muchos compuestos organoclorados presentan problemas ambientales debido a su toxicidad, por ejemplo los pesticidas anteriores, los bifenilos policlorados (PCBs), o las dioxinas. Compuestos de cloro como los clorofluorocarburos (CFCs) contribuyen a la destrucción de la capa de ozono. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Obtención y abundancia • Principalmente el cloro se encuentra, en la naturaleza, en forma de NaCl, como Silvina, KCl, o la karnalita, KMgCl3x6H2O. • Es el halógeno más abundante en el agua marina con una concentración de unos 18000 ppm. • Es prácticamente imposible encontrarlo sin combinar con otros elementos, debido a su alta reactividad. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de amalgama de mercurio • Se emplea un cátodo de mercurio y un ánodo de titanio recubierto de platino u óxido de platino. El cátodo está depositado en el fondo de la celda de electrolisis y el ánodo sobre éste, a poca distancia. • La celda se alimenta con cloruro de sodio y, con la diferencia de potencial adecuada, se produce la electrolisis: – 2Cl– – 2e- → Cl2 – Hg + 2Na+ + 2e– → NaHg Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de amalgama de mercurio • A continuación se procede a la descomposición de la amalgama formada para recuperar el mercurio. La base sobre la que está la amalgama está ligeramente inclinada y de esta forma va saliendo de la celda de electrolisis y se pasa a una torre en donde se añade agua a contracorriente, produciéndose las reacciones: H2O + 1e– → 1/2H2 + OH– NaHg – 1e– → Na+ + Hg • De esta forma el mercurio se reutiliza. • Con este método se consigue una sosa (NaOH) muy concentrada y un cloro muy puro, sin embargo consume más energía que otros métodos y existe el problema de contaminación por mercurio. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de amalgama de mercurio https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de diafragma • Se emplea un cátodo perforado de acero o hierro y un ánodo de titanio recubierto de platino u óxido de platino. Al cátodo se el adhiere un diafragma poroso de fibras de asbesto y mezclado con otras fibras (por ejemplo con politetrafluoroetileno). Este diafragma separa al ánodo del cátodo evitando la recombinación de los gases generados en estos. • Se alimenta el sistema continuamente con salmuera que circula desde el ánodo hasta el cátodo. Las reacciones que se producen son las siguientes: – 2Cl– – 2e– → Cl2 (en el ánodo) – 2H+ + 2e– → H2 (en el cátodo) Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de diafragma • En la disolución queda una mezcla de NaOH y NaCl. El NaCl se reutiliza y el NaOH tiene interés comercial. • Este método tiene la ventaja de consumir menos energía que el que emplea amalgama de mercurio, pero el inconveniente de que el NaOH obtenido es de menor pureza, por lo que generalmente se concentra. También existe un riesgo asociado al uso de asbestos. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de diafragma https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de membrana • Este método es el que se suele implantar en las nuevas plantas de producción de cloro. Supone aproximadamente el 30% de la producción mundial de cloro. • Es similar al método que emplea celda de diafragma: se sustituye el diafragma por una membrana sintética selectiva que deja pasar iones Na+, pero no iones OH– o Cl–. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de membrana • El NaOH que se obtiene es más puro y más concentrado que el obtenido con el método de celda de diafragma, y al igual que ese método se consume menos energía que en las de amalgama mercurio, aunque la concentración de NaOH sigue siendo inferior, se obtienen concentraciones del 32% a 35%, y es necesario concentrarlo. Por otra parte, el cloro obtenido por el método de amalgama de mercurio es algo más puro. La tercera generación de membranas ya supera en pureza de cloro a las celdas de mercurio. Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de membrana https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Electrolisis con celda de membrana Típica celda de membrana cloro - alcali https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo Produccion industrial de Cloro Comparación (Tomado de Buchner et al, Industrial Inorganic Chemistry, VCH 1985) Catodo Hg: ↑ NaOH 50% pura (sin evap) ↑ Cl2 (g) puro ↓ Voltaje 15% superior a los otros ↓ Requisitos de purificacion mas exigentes ↓ Requisitos exigentes para evitar contaminacion por Hg Diafragma: Membrana: ↑ salmuera menos pura ↑ NaOH puro ↑ voltaje moderado ↑ voltaje moderado ↓ NaOH diluido y c/Cl- ↑ No usa contaminantes ↓ Cl2 c/O2 ↓ NaOH diluido (33%) ↓ Requisitos exigentes para evitar contaminacion por amianto ↓ Cl2 c/O2 ↓ Requierer salmuera pura ↓ Membrana costosa y de corta duracion Química Inorgánica-63.13- Dra.Silvia E. Jacobo BROMO CARACTERÍSTICAS GENERALES • Símbolo: Br • Número atómico: 35 • Peso atómico: 79.904 uma • Periodo: 4 • Densidad: 3.12 g/ml • Apariencia: estado líquido a temperatura ambiente. Es de color pardo rojizo, volátil y muy peligroso. Su vapor rojizo es muy irritante y desprende un desagradable olor. • Estado de oxidación: -1, +1 (con Cl), +3 (con F), +5 (con O) • Configuración electrónica: 4s2 4p5 • Descubierto por Antoine-J. Balard (Francia 1826) • Isótopos más estables: 79Br, 81Br Química Inorgánica-63.13- Dra.Silvia E. Jacobo CARACTERÍSTICAS GENERALES • Soluble en disolventes orgánicos comunes, poco soluble en agua. • Estructura cristalina ortorrómbico. Química Inorgánica-63.13- Dra.Silvia E. Jacobo OBTENCIÓN Y ABUNDANCIA La mayor parte del bromo se encuentra como bromuro Br- en el mar. Su concentración es de 65µg/g. Se obtiene a partir de las salmueras, mediante la oxidación del ClBr una vez obtenido este. 2Br- + Cl2 → Br2 + 2Cl330000 toneladas al año aproximadamente Los mayores productores son Estados Unidos e Israel. https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo APLICACIONES Y USOS • • • • • • • • Blanqueador. Purificación de aguas. Disolvente. Fluido extintor de incendios. Retardador de incendio de plásticos. Colorantes. Productos farmacéuticos, insecticidas. Fotografía (AgBr): utilizados para hacer películas fotográficas. • Baterías de bromo/ zinc. Química Inorgánica-63.13- Dra.Silvia E. Jacobo REACTIVIDAD: COMPUESTOS PRINCIPALES Ataca a la mayoría de los metales. Con el aluminio reacciona vigorosamente y con el potasio explosivamente. Los estados de oxidación +1 y +3 (BrO- y BrO2-) son muy inestables en disolución acuosa. La valencia +5 es muy estable. Ej: ión bromato es muy oxidante y reactivo, también es carcinógeno. https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo BROMOBENCENO • Líquido incoloro, pesado, móvil, y de olor picante. • Miscible con la mayoría de disolventes orgánicos e insoluble en agua. • Obtención por bromación en presencia de hierro. • Usos: disolventes, combustibles para motores, disolventes cristalizante. https://aramis.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/GRUPOS_08/G7.ppt - Química Inorgánica-63.13- Dra.Silvia E. Jacobo DIBROMURO DE ETILENO Se emplea como aditivo en las gasolinas que tenían como antidetonante tetraetilo de plomo Limpia el motor de los depósitos de plomo que se forman al añadir dichos detonantes. VERDE DE BROMOCRESOL Indicador ácido base. Cambia de color del amarillo al azul en el intervalo de pH de 3.8 a 5.4


