ADHESIÓN Y COMUNICACIÓN CELULAR
Anuncio

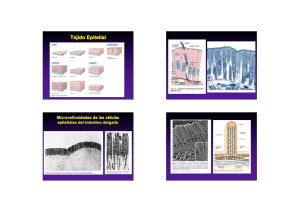
ADHESIÓN Y COMUNICACIÓN CELULAR célula ligando extracelular La adhesión celular involucra la unión de proteínas de transmembrana o receptores (en verde) a un ligando extracelular inmobilizado (en azul) y al citoesqueleto (en rojo) Alberts et al MBC 2002 Los receptores de adhesión median interacciones de diferentes tipos Las moléculas de adhesión de una célula pueden unirse directamente a moléculas del mismo tipo (unión homofílica) o a moléculas diferentes (unión heterofílica) en una célula adyacente. uniones homofílicas Ej. caderinas, N-CAM uniones heterofílicas Ej. integrinas, selectinas, I-CAMs uniones a través de una molécula extracelular puente. Ej. integrinas, proteoglicanos Alberts et al MBC 2002 Los receptores de adhesión se agrupan en cuatro familias principales Lodish et al MBC 2004 La deleción de genes involucrados en la adhesión provoca letalidad o severos defectos el funcionamiento de los tejidos KNOCKen OUT INTEGRINSy&estructura CADHERINS die at time of implantation E-cad E10, neurulation/somito N-cad genesis defects, heart does not form Los receptores de adhesión se anclan al citoesqueleto mediante proteínas adaptadoras y de “scaffold” Lodish et al MBC 2004 Los receptores de adhesión activan vías de señalización intracelulares Las integrinas activan vías de señalización que sinergizan con vías activadas por factores de crecimiento. Esta señalización regula procesos citoplasmáticos (ej. polimerización de la actina) y nucleares (transcripción). receptor de factor de crecimiento ↑proliferación integrinas Parsons, JCS 2003 Los receptores de adhesión transmiten información en los dos sentidos: extracelular Æ intracelular e intracelular Æ extracelular estructura de la matriz La unión de talina al dominio citosólico de la β-integrina aumenta la afinidad del dominio extracelular por el ligando (ECM). Este es un ejemplo de señalización “inside-out”.La competencia de talina para unirse a la integrinia es regulada por proteasas como las calpainas, y por la unión a PIP2. integrina activa integrina inactiva receptores de adhesión señ señalizació alización integrina activa membrana plasmática anclaje citoesqueleto funcionamiento y estructura celular adaptado de Calderwood, JCS 2004 Las adhesiones son esenciales para la integridad y función de los epitelios O C C L U D IN G J U N C T IO N S (UNIONES OCLUYENTES O DE BARRERA) 1. (uniones sellantes) tig h t ju n c tio n s ( v e r te b r a te s o n ly ) 2. s e p ta te ju n c tio n s ( in v e r te b r a te s m a in ly ) A N C H O R IN G J U N C T IO N S (UNIONES DE ANCLAJE) A c tin fila m e n t a tta c h m e n t s ite s 1. 2. (uniones adherentes) c e ll- c e ll ju n c tio n s ( a d h e r e n s ju n c tio n s ) (adhesiones focales) c e ll- m a tr ix ju n c tio n s ( fo c a l a d h e s io n s ) In te r m e d ia te fila m e n t a tta c h m e n t s ite s 1. c e ll- c e ll ju n c tio n s ( d e s m o s o m e s ) 2. c e ll- m a tr ix ju n c tio n s ( h e m id e s m o s o m e s ) C O M M U N IC A T IN G J U N C T IO N S (UNIONES DE COMUNICACION) 1. (uniones en hendidura) g a p ju n c tio n s 2. c h e m ic a l s y n a p s e s 3. p la s m o d e s m a ta ( p la n ts o n ly ) Las uniones intercelulares de los epitelios cumplen distintas funciones Las células epiteliales maduras se polarizan formando un dominio apical (= luminal) y uno basolateral. cara apical Uniones estrechas: Constituyen una barrera al pasaje de moléculas entre la cara apical y basolateral. Uniones adherentes: Asocian los citoesqueletos contráctiles y son esenciales durante la morfogénesis. Desmosomas: Asocian los citoesqueletos no contráctiles y son esenciales para mantener la estructura del epitelio. Hemidesmosomas: Asocian las células, mediante un citoesqueleto no contráctil, a la membrana basal que limita con el tejido subyacente. Adhesiones focales: Asocian las células, mediante un citoesqueleto contráctil, a la membrana basal. Uniones en hendidura: Permiten el pasaje de iones, segundos mensajeros, y otras moléculas pequeñas. Contribuyen a la coordinación funcional del epitelio. cara basolateral UNIONES OCLUYENTES O ESTRECHAS (TIGHT/OCCLUDING JUNCTIONS) Las uniones estrechas restringen la libre difusión de moléculas a través del epitelio transporte vectorial de glucosa Microscopía electrónica que ilustra la barrera formada por las uniones estrechas. En este experimento se incubó un epitelio con hidróxido de lantanio (opaco a los electrones). Note que el lantanio no pasa las uniones estrechas lantanio lantanio Al microscopio electrónico las uniones estrechas se visualizan como una costura en la porción apical de las células epiteliales Visualización de uniones estrechas por microscopía electrónica. Técnica de congelación y fractura Alberts et al MBC 2002 Claudinas, ocludinas y JAMs son las principales proteínas de transmembrana de las uniones estrechas Claudinas, ocludinas y JAMs (Junction Adhesion Molecules) son mmiembros de la superfamilia de las IgG. actin ZO PAR Las proteínas de scaffold ZO poseen dominios PDZ que se unen al terminal carboxilo de las ocludinas, claudinas y JAMs. célula 1 célula 2 Los dominios extracelulares de claudinas, ocludinas y JAMs median interacciones homofílicas independientes de calcio. Los dominios intracelulares se anclan al citoesqueleto de actina a través de proteínas adaptadoras denominadas ZO ("Zonula Occludens"). Las JAMs también interaccionan con proteínas PAR requeridas para establecer la polaridad de las células. UNIONES EN HENDIDURA (GAP JUNCTIONS) La mayoría de las células poseen uniones en hendidura. Al microscopio electrónico las membranas conectadas por uniones en hendidura se separan unos 2-4 nm (panel de la izquierda). En una vista frontal las uniones en hendidura se ven como agregados de estructuras cilíndricas (panel de la derecha). Lodish et al MBC 2004 Las conexinas son las proteínas de transmembrana que forman las uniones en hendidura microscopía electrónica La asociación lateral de seis conexinas forman un canal o conexon que se acopla a otro idéntico en una célula adyacente. Los conexones permiten el pasaje de iones y otras moléculas pequeñas (ej. segundos mensajeros, aminoácidos, Ca++); facilitando el acoplamiento metabólico y eléctrico de las células. La apertura de los conexones es regulada por calcio y otras moléculas de señalización Las uniones en hendidura son requeridas para el desarrollo normal de los folículos ováricos. Las células granulosas se acoplan entre si y con el oocito a través de diferentes conexones La inyección de un trazador fluorescente que pasa por las uniones en hendidura permite visualizar la conectividad funcional entre neuronas de la retina La descarga del neurotransmisor dopamina disminuye la permeabilidad de las uniones en hendidura. UNIONES DE ANCLAJE (ANCHORING JUNCTIONS) En las uniones de anclaje proteínas de transmembrana interaccionan en trans a través de sus ectodominios, y se acoplan al citoesqueleto mediante sus dominios citosólicos. Alberts et al MBC 2002 UNIONES ADHERENTES (ADHERENS JUNCTIONS) Las uniones adherentes forman bandas adhesivas cerca del extremo apical de las células epiteliales. Las proteínas de transmembrana de las uniones adherentes son las caderinas. Los dominios extracelulares de las caderinas de células adyacentes interaccionan entre si en presencia de calcio. Los dominios intracelulares de las caderinas se anclan a los filamentos de actina. ~ 20 nm Alberts et al MBC 2002 Diversos eventos morfogenéticos dependen de la contracción de los anillos apicales de actina anclados a las uniones adherentes Alberts et al MBC 2002 La contracción de los anillos contráctiles en el neuroectodermo contribuye a la formación del tubo neural Alberts et al MBC 2002 ADHESIONES FOCALES (FOCAL ADHESIONS) inmunofluorescencia de fibroblastos que muestran las integrinas (verde) ancladas a las fibras de actina (rojo) Las adhesiones focales anclan el citoesqueleto de actina a la matriz extracelular. Las proteínas de transmembrana de las adhesiones focales son las integrinas. Las integrinas se unen a moléculas de la matriz extracelular y a los filamentos de actina. DESMOSOMAS Y HEMIDESMOSOMAS Los desmosomas y hemidesmosomas son uniones de anclaje especializadas de las células epiteliales. En estas estructuras las proteínas de transmembrana se anclan a los filamentos intermedios. Los desmosomas anclan células epiteliales adyacentes. Los hemidesmosomas anclan la cara basal de las células epiteliales a la lámina basal. Alberts et al MBC 2002 Visualización de desmosomas al microscopio electrónico filamentos de queratina Alberts et al MBC 2002 Componentes moleculares de los desmosomas proteínas de transmembrana proteínas de anclaje Las proteínas de transmembrana de los desmosomas son las desmogleínas y desmocolinas, proteínas que pertenecen a la superfamilia de las caderinas. Los dominios extracelulares de desmogleínas y desmocolinas de células adyacentes interaccionan entre sí en una manera dependiente de calcio. Sus dominios intracelulares se unen a placoglobulinas y desmoplaquinas, proteínas que anclan los receptores al citoesqueleto de filamentos intermedios. Las uniones de anclaje y estrechas son esenciales para la polarización de las células epiteliales Las células MDCK se polarizan cuando se cultivan confluentes sobre soportes porosos cubiertos con una lámina basal sintética. Microscopía de fluorescencia y electrónica revelan que las células adquieren una forma columnar, y diferencian un dominio apical con microvellosidades, y un dominio basolateral. Lodish et al MBC 2004 Cohen et al., JCB 2004 Las caderinas constituyen una superfamilia numerosa y diversa de moléculas de adhesión Las caderinas clásicas son proteínas de membrana tipo I. El dominio extracelular se caracteriza por la presencia de cinco motivos repetidos de ~110 aminoácidos (cadherin repeats). El dominio citoplasmático interacciona con proteínas citosólicas denominadas cateninas. A esta clase pertenecen las caderinas tipo E, P y N. Molecule Predominant Cellular Distribution E-cadherin P-cadherin N-cadherin Preimplantation embryos, non-neural epithelial tissue Trophoblast Nervous system, lens, cardiac and skeletal muscle Las caderinas median interacciones homofílicas dependientes de Ca2+ cadherin repeat interacción en trans Los dominios denominados "cadherin repeats“ (CR) son homólogos a los motivos de inmunoglobulinas, Entre CR adyacentes se encuentran residuos que unen Ca2+. La unión del Ca2+ estabiliza la conformación extendida del dominio extracelular lo cual es esencial para la interacción de los dímeros en trans. Las uniones de caderinas son reguladas por diversos mecanismos La unión en trans de los dominios extracelulares de las caderinas requiere de calcio. La incubación de una monocapa de células confluentes con un quelante de calcio (EGTA) inhibe reversiblemente la adhesión (panel A). La unión de los dominios citosólicos de las caderinas al citoesqueleto es regulado por fosforilación. La incubación de las células con in inhibidor de fosfatasas (PAO) provoca la pérdida de la adhesión (panel B). A B células unidas separadas unidas unidas separadas Balzac et al., JCS 2005 Las caderinas clásicas se unen al citoesqueleto de actina a través de proteínas denominadas cateninas Las caderinas clásicas E, P y N poseen un dominio citosólico conservado que se asocia al citoesqueleto de actina a través de proteínas denominadas cateninas. La β-catenina y la p120 se unen directamente a la caderina. La β-catenina ancla el receptor al citoesqueleto de actina mediante interacciones con α-catenina y otras proteínas (vinculina, α-actinina). La unión de β-catenina y p120 estabilizan la expresión de las caderinas en la superficie celular. El reconocimiento homofílico de las caderinas permite la separación de grupos o poblaciones celulares células sin caderinas células transfectadas con caderinas e incubadas en presencia y en ausencia de Ca2+ células transfectadas con E-caderinas (azul) y N-caderinas (naranja) mezcla de células que expresan diferentes niveles del mismo tipo de caderina estado inicial incubación con agitación +Ca2+ estado final resultado: no adhesión resultado: adhesión resultado: no adhesión conclusión: la adhesión requiere de caderinas y calcio. resultado: las células que expresan las mismas caderinas se segregan. conclusión: la adhesión es homotípica. resultado: células que expresan diferentes niveles del mismo tipo de caderina se segregan. conclusión: diferencias cuantitativas en la expresión de caderinas juegan un rol en la organización de los tejidos La expresión diferencial de caderinas permite la diferenciación de estructuras durante el desarrollo del sistema nervioso El neuroectodermo expresa E-caderinas. Durante la formación del tubo neural el neuroepitelio cambia la expresión de E-caderinas por N-caderinas. E-cad ectodermo N-cad tubo neural Expresión de diferentes caderinas en el cerebro de un embrión de ratón Cada caderina se expresa en segmentos o áreas especificas Las integrinas son una familia de moléculas de adhesión que median interacciones heterofílicas dependientes de Mn2+ y Mg2+ Las integrinas son receptores de moléculas de la matriz extracelular. El receptor es un heterodímero formado por una subunidad α y una β de una familia de subunidades α y β. collagen receptors (+ I domain) α1 α2 (+ I domain) α10 α11 Hynes. Cell 2002 Las subunidades alfa de los heterodímeros determinan en parte la especificidad de unión por el ligando Modelo de activación de las integrinas Las integrinas existen en dos conformaciones alostéricas: inactiva (= baja afinidad por el ligando) y activa (= alta afinidad por el ligando). La conformación inactiva es estabilizada por interacciones citoplasmáticas entre las cadenas α y β, adyacentes al dominio de transmembrana. La unión de la proteína talina al dominio citoplasmático de la beta integrina, induce un cambio conformacional que se propaga a lo largo de la estructura y favorece la forma activa de alta afinidad. low affinity high affinity microscopía electrónica Giancotti, DevCell 2003 Las integrinas estimuladas se agregan y forman complejos de adhesión focales Las agregación de las integrinas incrementa la avidez por el ligando extracelular. La agregación es facilitada por la unión al citoesqueleto de actina a través de proteínas tales como talina (ta), alfa actinina (α) y tensina (te). Algunas proteínas asociadas a los complejos tienen una función reguladora, ej. FAK (F) Marcación fluorescente de β1-integrina y actina: complejos de adhesión Representación esquemática de un complejo de adhesión Zamir & Geiger, 2001 Las CAMs pertenecen a la superfamilia de las inmunoglobulinas y median adhesión homofílica independiente de Ca2+ N-CAM140 N-CAM180 N-CAM120 motivo homólogo al de las inmunoglobulinas Las N-CAMs fueron las primeras CAMs (Cell Adhesion Molecules) caracterizadas. Existen ~ 20 isoformas de N-CAM generadas por corte y empalme del RNA de un único gen. Todas las CAMs comparten motivos homólogos a los encontrados en inmunoglobulinas . puentes disulfuro motivos de FN III Alberts et al MBC 2002 El agregado post-traducción de ácido siálico en algunas isoformas de N-CAM modula su función adhesiva Las selectinas median interacciones heterofílicas dependientes de Ca2+ extravasación de leucocitos Las selectinas poseen un dominio de lectina en el extremo distal de la región extracelular. Este dominio se une a oligosacáridos específicos en glicolípidos y glicoproteínas en un modo dependiente de calcio. El dominio intracelular se asocia al citoesqueleto de actina. Las selectinas median adhesiones de baja afinidad entre leucocitos y las células endoteliales en etapas tempranas de la extravasación de leucocitos. Función coordinada de selectinas, integrinas y caderinas durante la extravasación de leucocitos (inactiva) (activa) expresión de selectina P y PAF unión de αLβ 2 y ICAM-1/2 (↓VE-caderins, ↓PECAM) Estímulos inflamatorios inducen la expresión de selectinas P y el lípido PAF (Platelet- Activating Factor) en la superficie de las células endoteliales (2). Las selectinas P se unen con baja afinidad a ligandos (P-Selectin Glycoprotein Ligand o PSGL) expresados en la membrana de leucocitos provocando su detención (3). PAF estimula a un receptor de los leucocitos que induce la activación de la integrina αLβ2 (3). Interacciones de αLβ2 con ICAM-1/2 (4) y la inactivación de VE-caderinas y PECAM (Platelet Endothelial Cell Adhesion Molecule) facilitan el pasaje trans-endotelial (5). La función de linfocitos es orquestada por una diversidad de moléculas de adhesión α2/β1 α4/β1 PECAM y VCAM-1 pertenecen a la superfamilia de las inmunoglobulinas. α6/β1 α4/β1 Sixt et al COCB2006 La transición epitelio-mesénquima (TEM) involucra cambios coordinados de la adhesión TEM consiste en el cambio de fenotipo epitelial a uno mesenquimático. Las células epiteliales polarizadas se convierten en células fibroblastoides, áltamente migratorias. Este proceso requiere de la inhibición de la expresión de las caderinas-E, la expresión de caderina-N y de una variedad de integrinas involucradas en migración, por ejemplo, αvβ6, α5β1, etc. transición epitelio-mesénquima en células de carcinoma En proceso de TEM células neoplásicas degradan la membrana basal e invaden el estroma normal carcinoma epitelio membrana basal tejido conectivo La flecha en (F) indica células invasivas que han atravesado la membrana basal y se diseminan por el tejido subyacente Durante el desarrollo embrionario TEM permite la formación de estructuras nuevas a partir de los epitelios Las células de la cresta neural se originan por una transición epitelio-mesénquima Inmunofluorescencia doble que muestra la expresión de caderina-7 en las células de la cresta neural desprendidas del tubo neural (C, flechas). Estas células no expresan caderinas-N (A, flechas). ↓ N-caderina ↑ caderina-7 ↑ integrinas ↑ N-caderina ↑ N-caderina Nakagawa &Takeichi, 1998 La expresión de genes involucrados enTEM son regulados por señales externas cytokines La activación/expresión de factores de transcripción como Twist, Snail y SIP1 reprimen la expresión de E-caderina y cateninas y estimulan la expresión de proteínas involucradas en motilidad. Kang & Masagué, Cell 2004 Las VE caderinas del endotelio se desacoplan del citoesqueleto durante la extravasación de leucocitos Visualización de la transmigración de leucocitos por time lapse. Células endoteliales cultivadas fueron transfectadas con VE caderina-GFP y activadas con TNFα. Leucocitos polimorfonucleares marcados con Cell Tracker orange (rojo) se sembraron sobre la monocapa y se filmaron. Note el pasaje de los leucocitos entre dos células endoteliales adyacentes (flecha en 3:00). 0 0:45 3:00 3:15 3:30 3:45 4:00 4:15 4:30 9:15 video disponible Shaw et al, J. Immunol. 2001 SEÑALIZACIÓN MEDIADA POR LA ADHESIÓN La mayoría de las células dependen del anclaje a la matriz extracelular para su crecimiento, proliferación y supervivencia La estimulación y agregación de integrinas y caderinas activan vías de señalización que regulan el crecimiento, la proliferación y la supervivencia de las células. sobrevivencia, crecimiento y proliferación sobrevivencia y crecimiento La extensión de la célula sobre el substrato es un factor crítico para el crecimiento y la supervivencia. caderinas Growth = área total de fibronectina integrinas apoptosis diferenciación .... .... .... .... Las células epiteliales requieren del contacto con la matriz para su diferenciación. Durante la involución de la glándula mamaria y de la próstata, la lámina basal se degrada y las células mueren por apoptosis. fibronectina extendida extendida Chen et al., Science 1997 La unión de las integrinas a la matriz extracelular (ME) y su agregación forma complejos de adhesión que reclutan y activan tirosín kinasas Fibroblastos adheridos sobre fibronectina activan la fosforilación de numerosas proteínas en los complejos de adhesión. Esto puede apreciarse por inmunofluorescencia con un anticuerpo anti-fosfotirosina. Las flechas señalan los focos de adhesión teñidos con el anticuerpo. FAK es una tirosina-kinasa que se activa en respuesta a la adhesión a la ME y que estimula la vía de señalización de la MAP Kinasa integrinas Æ FAK Æ Cas Æ Crk Æ JNK integrinas Æ FAK Æ Grb2 Æ Sos Æ Ras Æ Erk (MAP kinasa) (MAP kinasa) expresión de ciclinas D; proliferación Algunas integrinas se localizan en rafts lipídicos y activan la MAPK por una vía dependiente de caveolina y Fyn e independiente de FAK PTK adaptor adaptor GEF GTPase MAP integrina Æ caveolina Æ Fyn Æ Shc Æ Grb2 Æ Sos Æ Ras Æ Erk La máxima velocidad de migración celular se alcanza a estados de adhesión intermedios Una adhesión al substrato débil o extremadamente fuerte inhiben la migración celular. Holly et al., Exp. Cell Res. 2000 Las integrinas regulan la adhesión y la motilidad a través de señales dependientes de la activación de Src y FAK Las células normales producen focos de adhesión alargados (flechas en (A). Las células deficientes en FAK (B) producen múltiples focos pequeños. E-cadherin A + Src-FAK B + Rac maduración de los contactos adhesivos (Schlaepfer, PBMB 1999) + polimerización de actina y extensión de lamelas Las células deficientes en FAK exhiben defectos en la migración Las células normales se polarizan formando una lamela de avance en la dirección de la migración (flechas en A). Las células deficientes en FAK exhiben defectos en la polarización y producen múltiples lamelas (cabezas de flecha en B). videos disponibles (Tilghman et al JCS2005) La expresión desregulada de la tirosina kinasa Src provoca la desorganización del citoesqueleto de actina y altera la adhesión Fibroblastos transfectados con el cDNA que codifica un mutante termosensible de v-Src constitutivamente activa. A la temperatura no permisiva v-Src no se expresa y la célula exhibe un fenotipo normal (a). A la temperatura permisiva la kinasa mutante es funcional y la célula exhibe un fenotipo transformado (b). adhesiones normales adhesiones aberrantes Frame et al., Nature MCB 2002 La estimulación de las integrinas activa vías de señalización anti-apoptóticas mediadas por las kinasas PI-3K y AKT integrina ECM FAK La estimulación de integrinas y receptores de factores de crecimiento genera señales que estimulan la proliferación e inhiben la apoptosis matriz extracelular integrinas caveolina factores de crecimiento factores de crecimiento RTKs FAK/Src/ p130Cas RTKs Fyn/Shc Grb2 Ras PI-3k Rac Rho Raf/MEK Akt JNK Bad Erk caspasa 9 p53 cki ciclina D apoptosis ciclo celular activación sostenida Las E-caderinas inhiben la proliferación reteniendo β-catenina en las adhesiones y promoviendo la expresión de p27 cki matriz extracelular integrinas caveolina factores de crecimiento factores de crecimiento RTKs FAK/Src/ p130Cas RTKs Fyn/Shc Grb2 Ras PI-3k Rac Rho Raf/MEK E-caderina Akt JNK Bad Erk β-catenina caspasa 9 p53 cki ciclina D apoptosis ciclo celular cki Las E-caderinas inhiben la actividad transcripcional de la beta catenina Solo cuando las células se estimulan con el factor Wnt, la beta catenina es estabilizada en el citosol y puede translocarse al núcleo para promover la transcripción de genes pro-invasivos y mitogénicos. Esta actividad requiere de la asociación con los factores de transcripción TCF y LEF. cyclin D, matrylisin, fibronectin, myc. Integración de señales que regulan la proliferación. Moléculas de adhesión y factores de crecimiento Wnt El reclutamiento de β-catenina en los complejos de caderinas impide su rol promotor de la proliferación. factores de matriz extracelular crecimiento E-caderinas integrinas RTKs uniones estrechas Frizzled retención fosforilación, inactivación activación ZO-1 retención estabilización β-catenina cki Zona B Erk El reclutamiento de Zona B-Cdk4 en el citoplasma impide su rol promotor de la proliferación. síntesis ciclina D ciclo celular Cdk4 síntesis núcleo La interacción de los epitelios con la membrana basal es crucial para su diferenciación Estructura de un acino de glándula mamaria polarización normal La inhibición del ensamble de la lamina basal produce una polarización invertida lumen lamina basal En rojo se muestra un marcador del dominio apical O’Brien et al, NCB 2001; Bissell et al, COCB 2003 MATRIZ EXTRACELULAR ¾ proteoglicanos ¾ colágenos ¾ fibronectina ¾ laminina Los proteoglicanos consisten de uno o varios glicosaminoglicanos (GAGs) unidos a proteínas Los GAGs consisten en repeticiones de un disacárido que contiene usualmente un ácido urónico (D-glucourónico o L-idurónico) o galactosa y una N-acetil glucosamina o N-acetil galactosamina. Uno o ambos residuos estan sulfatados. (ej. agrina, sindecano) Los proteoglicanos difieren en el tipo y número de GAGs proteoglicanos glicoproteína El agrecano posee mas de 100 GAGs. Decorina es el único PG con un solo GAG. Los PGs poseen una mayor proporción de carbohidratos que las glicoproteínas. La unión de GAGs a proteínas ocurre en serina, treonina, o asparagina, dependiendo del PG. Condroitin, dermatan, y heparan sulfatos se unen mediante un tetrasacárido a la proteína. La xilosa es adicionada a una serina en la secuencia Ser-Gly-X-Gly. Cada residuo es agregado por una enzima distinta. La elongación y modificación de los azúcares de los GAGs se realiza en el Golgi. Serina Los keratan sulfatos se unen a la proteina por oligosacaridos cortos distintos al tetrasacarido de CS, DS y HS. Ser/Thr GalNAc o Man Keratan sulfatos Asn GlcNAc Función estructural de los PGs: Agrina es un heparan sulfato PG esencial para organizar las sinapsis en las uniones neuromusculares Agrina es secretado por las motoneuronas. Comparación del desarrollo de las sinapsis en las uniones neuromusculares de ratones controles y knockout para agrina. En ausencia de agrina los receptores de acetilcolina en las fibras musculares no se agregan (puntos rojos). Terminales axonales de motoneuronas (verde) y agregación de receptores de acetilcolina (rojo) en las placas terminales de las uniones neuromusculares. (Lichtman & Sanes, 2003) Scaffolding y señalización: PGs de la matriz extracelular se unen a factores de crecimiento y modulan su actividad Los PGs sindecano y perlecano actúan como reservorios de FGF, uniendo moléculas de FGF y evitando su degradación por proteasas extracelulares. Estos PGs además presentan el FGF a sus receptores; en su ausencia, las células no responden al FGF. Otro PG, decorina, se une al TGF-β y lo presenta a sus receptores. Algunos proteoglicanos en la superficie celular median adhesión a componentes de la matriz extracelular Las cadenas de heparan sulfato de sindecano se unen a diversos colágenos, fibronectina y laminina región que se une a colágenos I, III, IV, fibronectina y laminina Los colágenos son proteínas fibrosas que proveen resistencia mecánica Las moléculas de colágeno son homo o teterotrímeros formados a partir de tres subunidades o cadenas alfa. Type Molecule Composition Fibrillar Collagens I [α1(I)]2[α2(I)] II [α1(II)]3 III [α1(III)]3 V [α1(V)]3 Fibril-Associated Collagens VI [α1(VI)][α2(VI)] Structural Features Representative Tissues 300-nm-long fibrils Skin, tendon, bone, ligaments, dentin, interstitial tissues 300-nm-long fibrils Cartilage, vitreous humor 300-nm-long fibrils; often with Skin, muscle, blood type I vessels 390-nm-long fibrils with globular Similar to type I; also N-terminal domain; often with cell cultures, fetal type I tissues Lateral association with type I; periodic globular domains IX [α1(IX)][α2(IX)][α3(IX)] Lateral association with type II; N-terminal globular domain; bound glycosaminoglycan Sheet-Forming Collagens Two-dimensional network IV [α1(IV)]2[α2(IV)] Most interstitial tissues Cartilage, vitreous humor; All basal laminaes SOURCE: K. Kuhn, 1987, in R. Mayne and R. Burgeson, eds., Structure and Function of Collagen Types, Academic Press, p. 2; M. van der Rest and R. Garrone, 1991, FASEB J. 5:2814. Los fibroblastos del tejido conectivo secretan colágeno y otros componentes de la matriz extracelular Microscopía electrónica de barrido. Fibroblastos de tejido conectivo entre fibras de colágeno Microscopía electrónica de transmisión. Fibras de colágeno con distintas orientaciones envuelven un fibroblasto microscopía electrónica Síntesis de las fibras de colágeno hidroxilasas procolágeno peptidasas lisil oxidasa La fibronectina es una proteína modular multiadhesiva que interacciona con proteoglicanos y otras proteínas de la matriz microscopía electrónica módulo tipo III Los fibroblastos secretan y organizan la matriz La secreción de fibronectina por los bibroblasts les permite adherirse y migrar. fibras de fibronectina fibras de actina (extracelular) (intracelular) Observe la co-distribución de la actina (intracelular) y las fibras de fibronectina (extracelular). Las integrinas en la superficie de los fibroblastos ligan las fibras de matriz extracelular con el citoesqueleto de actina. La contracción del citoesqueleto contribuye al ensamble y organización de las fibras. La laminina es una de las principales moléculas multiadhesivas de las membranas basales microscopía electrónica binds integrins La molécula de laminina es un heterotrímero con forma de cruz que interacciona con diversos componentes de la matriz extracelular y con receptores de la superficie celular (integrinas, proteoglicanos). Laminina, colágeno IV y PGs forman una lámina basal asociada a epitelios y otros tejidos La lámina basal es una malla fibrosa de entre 40-120 nm de espesor, compuesta principalmente por colágeno tipo IV, laminina, nidógeno y el proteoglicano perlecano. Cumple una función de soporte y es requerida para la diferenciación de los epitelios y otras células. Microscopía electrónica de barrido de una lámina basal célula epitelial lámina basal fibras de colágeno La lámina basal cumple diferentes funciones en los distintos tejidos La lámina basal provee un substrato para el anclaje de los epitelios, envuelve individualmente a las células musculares y adiposas y sirve de filtro en el glomérulo renal, donde las células epiteliales permiten el pasaje paracelular de substancias de los capilares sanguíneos. La interacción de los epitelios con la membrana basal es crucial para su diferenciación Estructura de un acino de glándula mamaria polarización normal La inhibición del ensamble de la lamina basal produce una polarización invertida lumen lamina basal O’Brien et al, NCB 2001; Bissell et al, COCB 2003 La lámina basal es esencial para organizar las sinapsis neuromusculares Experimentos de regeneración demuestran que tanto los axones de las motoneuronas como las fibras musculares detectan componentes de la lámina basal que contribuyen a su diferenciación. daño al músculo y al nervio degeneración; la lámina basal persiste agrina produce la agregación de los receptores de acetilcolina en la membrana de la célula muscular. En ratones knockout para agrina los AchR no se agregan. La matriz es remodelada por la acción de proteasas extracelulares colagenasas instersticiales Æ degradan colágenos fibrilares (1) Metaloproteinasas de la matriz (MMP) estromelisinas Æ degradan fibronectina, proteoglicanos, col IV gelatinasas (colagenasas tipo IV) Æ degradan col IV, fibronectina, elastina su actividad depende de iones zinc o calcio Las tres clases de metaloproteinasas poseen inhibidores endógenos (tissue inhibitors of metalloproteinasas = TIMPs). En condiciones normales las actividades de MMP y TIMPs están balanceadas. (2) Serine proteases Activadores del plasminógeno (PAs). Hay 2 tipos: uPA: urokinase-plasminogen activator Æ asociada a receptores de superficie (uPAR) tPA: tissue-type plasminogen activator Æ secretada - laminina - fibronectina uPA o tPA Æ plasminógeno Æ plasmina activa la plasmina degrada - colágeno IV - vitronectina las serpinas son inhibidores de las serine proteases