Mecanismos de la formación de regiones en el cerebro anterior
Anuncio

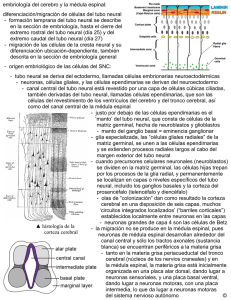
G. ÁLVAREZ-BOLADO REVISIONES EN NEUROCIENCIA. EDITOR: J.V. SÁNCHEZ-ANDRÉS Mecanismos de la formación de regiones en el cerebro anterior G. Álvarez-Bolado FOREBRAIN REGIONALIZATION MECHANISMS Summary. Where do the regions of the forebrain come from? The paradigm that has come to light in the last ten years is that of a neural plate subdivided by soluble factors which (through the formation of gradients or of a molecular framework) transmits positional information to the neural stem cells. Some of those soluble factors are Fgf8, Sonic hedgehog and proteins of the BMP family. The neural stem cells interpret positional information in terms of the expression of combinations of certain transcription factors. Such combinations would finally be responsible for the formation of specific neural lineages (cortical, thalamic, etc.) from specific neuroepitelial regions. In addition, this ‘primary’ positional information can make certain regions of the neural primordium (secondary organizers) secrete new soluble factors. These would in turn give rise to new positional information, spatially more restricted, so that the whole process would repeat itself to confer ‘detail’ to a certain area. This wealth of new knowledge is already helping us to understand the cause of some brain malformations, and maybe we will soon be able to apply it to the early diagnosis and the prevention of such conditions. [REV NEUROL 2002; 34: 490-5] Key words. Ciclopia. Forebrain. Holoprosencephaly. Organizer. Patterning. Regionalization. Stem cell. INTRODUCCIÓN El cerebro anterior (forebrain) está formado por el telencéfalo (bulbo olfatorio, corteza, ganglios basales) y el diencéfalo (epitálamo, tálamo e hipotálamo). En los últimos 10 años, se han hecho grandes progresos en la búsqueda de la respuesta a la pregunta: ¿de dónde vienen las regiones del cerebro anterior?, dándonos una cantidad de información al respecto antes insospechada por su cantidad y calidad. Las primeras aplicaciones prácticas (por ejemplo en términos de la comprensión del mecanismo de malformaciones cerebrales) están empezando a aparecer. Una influyente revisión del desarrollo del cerebro [1] representaba este proceso dividido en siete etapas: 1 .Proliferación celular; 2 . Migración; 3 . Formación de núcleos; 4 .Diferenciación neuronal; 5 . Extensión de axones; 6 .M uerte celular, y 7. Relación entre el sistema nervioso central y el periférico. Esa clasificación sobrevive y suele ser la base para la división por capítulos de los textos sobre la materia. Sin embargo, hoy añadimos dos etapas más, que son previas. La primera es la inducción de la placa neural (un tema que Cowan no trató en 1978 por encontrarlo ‘todavía bastante opaco’). La segunda, que se desgaja de la ‘proliferación celular’ de Cowan, es la regionalización del primordio neural. Intentaré resumir aquí la visión que se tiene actualmente de la regionalización, subrayando los conceptos más que los detalles. Qué es la regionalización La regionalización o especificación regional(regionalization, patterning) del primordio neural (es decir, de la placa neural y más tarde del tubo neural) es el proceso mediante el cual las células madre neurales se comprometen a dar lugar a determi- Recibido: 22.02.02. Aceptado tras revisión externa sin modificaciones:26.02.02. Max-Planck-Institut für experimentelle Endokrinologie. Hannover, Alemania. Correspondencia: Dr. Gonzalo Álvarez-Bolado. Max-Planck-Institut für experimentelle Endokrinologie. Feodor-Lynen-Stra§e 7. D-30625 Hannover, Alemania. Fax: +49 511 5359 186. E-mail: gonzalo.alvarez-bolado@ mpihan.mpg.de. 2002, REVISTA DE NEUROLOGÍA 490 nados tipos de neuronas dependiendo de su posición dentro del primordio (p. ej.,las células de una parcela determinada darán lugar a neuronas de la corteza, las de otra más caudal y medial darán lugar a neuronas de la retina, etc.).Es decir, mediante la regionalización, el primordio neural queda dividido en regiones, que se corresponden con las regiones que tendrá el cerebro adulto. PRIMERA FASE: INDUCCIÓN NEURAL Tras la implantación del ovocito fecundado el embrión comienza la fase de gastrulación. Durante ésta se establece el plan básico del cuerpo (eje anteroposterior, eje transversal) y aparecen los tres tejidos primordiales (ectodermo, endodermo y mesodermo). Después, una amplia región del ectodermo recibe la información de que va a transformarse en el sistema nervioso central. El proceso mediante el cual esa parcela ectodérmica se transforma en el primordio del sistema nervioso (ectodermo neural o placa neural) se llama ‘inducción neural’. El primordio neural es inducido y recibe información ‘rostral’ Basándose en los resultados de sus experimentos con embriones de anfibios, Nieuwkoop propuso hace ya medio siglo que la placa neural anterior recibe en el momento de la inducción la información de que su posición es rostral. El resto de la placa neural recibiría instrucciones para ser ‘posterior’ más tarde [2]. Hoy sabemos que, en primer lugar, una pequeña parte del endodermo informa a la región más anterior del ectodermo suprayacente de dos cosas: que va a ser parte del sistema nervioso (inducción neural), y que va a ser la parte anterior (regionalización) [3,4]. La señal enviada por el ectodermo es, al menos en el caso del embrión de rana (Xenopus laevis), una proteína segregada que recibe el nombre de cerberus [5,6]. Otras proteínas solubles implicadas en el proceso son folistatin, noggin y chordin [7]. Al final de la inducción, el primordio neural se convierte en una gran parcela de epitelio no estratificado. Algunas de sus células (tal vez todas [8]) son ahora las células madre neurales (CMN) (neural stem cells). REV NEUROL 2002; 34 (5): 490-495 REGIONES DEL CEREBRO ANTERIOR Células madre neurales regionalizadas B. Factores solubles Anterior SEP Gradientes Mesencéfalo Entramado molecular Figura. Cómo surgen las regiones del cerebro anterior. A) Inducción neural. Parte del ectodermo recibe la instrucción de convertirse en primordio neural; al mismo tiempo recibe ‘orientación’ anteroposterior. B) Más tarde, distintos grupos celulares segregan factores solubles (proteínas segregadas solubles) que imparten información posicional, tal vez mediante gradiente de concentración (B1), tal vez mediante ‘entramados moleculares’ (B2), o una combinación de ambos mecanismos. B1) Grupos celulares fuera del primordio neural o formando parte de éste (organizadores) segregan factores solubles que se difunden por el ectodermo neural en concentraciones decrecientes. El número ‘1’ (patrón de líneas horizontales) representa el gradiente de concentración del Fgf8 segregado por el organizador del reborde neural anterior. El número ‘2’ (patrón gris) representa el gradiente de concentración del Fgf8 segregado por el organizador ístmico. El número ‘3’ (patrón de líneas verticales) representa el gradiente de concentración de proteínas BMP segregadas por células ectodérmicas laterales al primordio neural. El número ‘4’ (patrón de puntos) representa el gradiente de concentración de la proteína Sonic hedgehog segregada por la notocorda y la placa precordal. En cada caso, las flechas indican la dirección del posible gradiente (mayor a menor concentración). B2) L os distintos f actores solubles podrían difundir en el primordio neural dando lugar a zonas ‘bañadas’ por un factor u otro. Las células recibirían información posicional codificada en las combinaciones de factores que se cruzan en una cierta zona. Un ejemplo de este mecanismo está señalado por el número ‘5’, que representa la zona donde se forman las células dopaminérgicas del mesencéfalo, en el lugar en que Sonic hedgehog (zona anteroposterior, gris claro) y Fgf8 (zona transversal, gris oscuro) se cruzan [32]. C) Tras interpretar la información posicional recibida en B, las células madre se regionalizan y comienzan a dar lugar a los linajes correspondientes a las distintas regiones del cerebro anterior (representadas aquí como ilustración hipotética, y no de manera dogmática). Los números ‘6’ y ‘7’ representan dos posibles ejemplos de grupos de células del primordio neural que se diferencian formando nuevos organizadores (organizadores secundarios) y segregan factores solubles que añaden detalle a la regionalización de ciertas partes del primordio. El número ‘6’ representa el organizador secundario de la placa del techo telencefálico [33]. El número ‘7’ representa el organizador secundario de la zona limitante [30]. Las flechas representan factores solubles segregados por estos nuevos organizadores. Abreviaturas: AMI: amígdala; CTX: corteza cerebral (córtex); HIP: hipocampo; PR: pálido; SEP: septum; SR: estriado; TÁLAMO-D: tálamo dorsal; TÁLAMO-V: tálamo ventral. 1 Hoy se piensa que las células madre son responsables del crecimiento de los tejidos, de la homeostasis tisular (algunas células mueren y se ven sustituidas por otras nuevas del mismo tipo) y de la reparación tisular, y que llevan a cabo estas funciones en mayor o menor grado también en el adulto. Las células madre dan lugar tal vez a otras células indiferenciadas, llamadas células progenitoras, cuya capacidad para producir distintos tipos de neurona estaría ya más restringida. La nomenclatura no está completamente clara ahora mismo, y hay cierta confusión en la literatura sobre qué tipos de célula deben recibir el nombre de ‘progenitoras’ o de ‘madre’ (compárense por ejemplo [8] con [9]). Por eso voy a evitar usar la denominación ‘células progenitoras’ en esta revisión. REV NEUROL 2002; 34 (5): 490-495 C. Regiones Posterior Veamos algunas consecuencias prácticas del hecho de que las células madre se regionalicen. Tanto las células madre embrionarias del blastocisto como las que se encuentran más tarde en el embrión y en el adulto pueden en principio ser cultivadas in vitro al objeto de obtener sus preciados productos (las células diferenciadas) para usarlos en el tratamiento de enfermedades [10]. Por ejemplo, la sintomatología de la enfermedad de Parkinson se ve muy aliviada 2 PR SR C T AMI X HIP Tálam oV Tálamo D Hipotálamo Células madre neurales Las células madre (stem cells) son células indiferenciadas que pueden dividirse para dar lugar a otras células semejantes (es decir, tienen la propiedad de la regeneración o self-renewal) o bien dar lugar a un linaje celular diferenciado. Estas células pueden encontrarse en tejidos y órganos embrionarios y también en el adulto. Su origen naturalmente está en las células que forman la masa celular interna (inner cell mass) del blastocisto, es decir, las células madre embrionarias (embryonic stem cells).Éstas forman las tres capas germinales del embrión (ectodermo, mesodermo y endodermo), y los linajes celulares a que dan lugar van comprometiéndose (committing) con destinos de diferenciación cada vez más concretos (células madre de un cierto órgano, células madre de un cierto tejido dentro de ese órgano)1 . En el caso concreto de la placa neural, distinguimos dos tipos de proliferación: horizontal y vertical. Las CMN pueden dividirse para dar lugar a otras células similares o a determinados tipos de células diferenciadas [9]. Cuando las CMN se dividen para dar lugar a más CMN, decimos que se dividen ‘horizontalmente’. Es decir, las dos células resultantes de la división permanecen en el epitelio monocapa del ectodermo neural de manera que éste crece en superficie, pero no en grosor2. Más tarde, como veremos, a este proceso se suma el de división celular ‘vertical’, mediante el cual se forman las llamadas ‘neuronas jóvenes’, que ya no son capaces de mitosis; abandonan el epitelio monocapa e incrementan con ello el grosor del primordio neural. tras el trasplante de células dopaminérgicas embrionarias humanas, pero harían falta las neuronas dopaminérgicas de dos fetos humanos (es decir, dos abortos) por cada paciente. Si se pudieran cultivar CMN humanas en condiciones tales que su descendencia estuviera formada sobre todo por neuronas dopaminérgicas, tendríamos a nuestro alcance un suministro inagotable de estas neuronas, y una terapia para el Parkinson (un razonamiento similar puede aplicarse a las células beta del páncreas y la diabetes, por ejemplo). El estudio de la regionalización ofrece, en primer lugar, pistas sobre las condiciones en las que hay que cultivar las CMN para que den lugar a neuronas dopaminérgicas. Otra enseñanzaque podemos sacar es que, dado que las CMN se regionalizan progresivamente, el obtener in vitro un cierto tipo de neuronas se hace menos complicado cuando se parte de CMN de la región que normalmente da lugar al tipo de neurona deseado. 491 G. ÁLVAREZ-BOLADO SEGUNDA FASE: INFORMACIÓN POSICIONAL El siguiente paso es la subdivisión del primordio en las zonas que, por división celular, generarán las distintas regiones del cerebro (corteza, ganglios basales, etc.). Ahora entran en juego procesos que informarán a las células madre de la placa neural (que mientras tanto siguen dividiéndose) acerca de su posición mediolateral y de su posición anteroposterior. ¿Gradiente o entramado? Así, las CMN dan lugar a determinados tipos de neurona de forma estereotipada: las CMN de cierta parte de la placa neural dan siempre lugar a cierto tipo de neurona. Para ello necesitan información acerca de su posición en la placa neural (información posicional). La información posicional y las distintas formas en que, en teoría, se puede transmitir tal información empezaron a discutirse teóricamente ya durante el siglo pasado [11,12]. ¿De dónde les viene tal información a las CMN? De señales externas en forma de factores solubles (a veces llamados morfógenos), generalmente proteínas. Éstas se distribuyen preferentemente a lo largo de dos ejes, el anteroposterior y el transversal, formando una especie de cuadrícula. Los factores solubles son segregados por algunos grupos de células. Cuando estos grupos de células se hallan en el primordio neural, reciben el nombre de ‘organizadores’. ¿Cómo dan lugar los factores solubles a esos ejes de coordenadas? Tradicionalmente se han propuesto dos soluciones: los gradientes y el entramado molecular (molecular framework) [13] (Figura). En el caso de los gradientes, los factores solubles estarían distribuidos en gradiente de concentración a lo largo (o a lo ancho) de la placa neural; las CMN serían capaces de medir las concentraciones de al menos dos factores solubles (uno para cada eje) e interpretar esos valores en términos de situación (algo similar al modo en que el par de valores ( x, y) determina la situación de un punto en un sistema de coordenadas cartesianas). La información posicional por medio de gradientes tiene una larga historia teórica y experimental. Se sabe que los gradientes son muy importantes en el desarrollo de los invertebrados [14], y su funcionamiento en elpatterning del embrión de Drosophila se ha estudiado teóricamente y por medio de la genética molecular [15,16]. Un sistema de información posicional por gradientes se observó por primera vez en vertebrados al estudiar la aparición de patrón en el esbozo de los miembros [18]. Más tarde han aparecido ejemplos en el sistema nervioso, donde se han visto, por ejemplo, gradientes de ciertas moléculas en la retina [19,20]. Ventajas de un sistema de coordenadas basado en gradientes: con dos moléculas se especifica todo. Inconvenientes: no está muy claro aún cómo puede una célula medir el diminuto diferencial de concentración que puede establecerse a lo largo de su soma. A diferencia de los ejes de coordenadas formados por gradientes, los formados por un entramado molecular necesitan de muchos más factores solubles. Su funcionamiento teórico, sin embargo, es más fácil de entender (Figura). Determinados factores solubles estarían distribuidos en bandas estrechas anteroposteriores o transversales. En el punto en que se intersectasen dos de ellos, las CMN quedarían especificadas en una cierta dirección. El primordio neural recibe información ‘medial (ventral)’ Sea como sea, el caso es que conocemos ya algunas de las proteínas (los famosos factores solubles) que proveen la información posicional. Tras la etapa de inducción neural, llega el turno de dos estructuras del mesodermo subyacente a la placa neural: la notocorda y el proceso cefálico. Ambas segregan la proteína llamada Sonic hedgehog (Shh) [21], que actúa sobre una región central longitudinal de la placa, llevando la información a las correspondientes CMN que darán lugar a regiones ventrales del cerebro: estas células quedan especificadas ventralmente, o ‘ventralizadas’ [22-24]3 .La secreción de Shh es el primer eslabón de una ‘cadena señalizadora’. Este proceso de comunicación entre células implica varios pasos cuidadosamente regulados y culmina cuando el mensaje comunicado es traducido por la célula receptora a expresión específica de factores de la transcripción. Para reconocer la Shh y escuchar su mensaje son necesarias dos proteínas de membrana llamadas patched y smoothened [25,26]. Éstas a su vez activan los factores de la transcripción de la familia Gli (Gli1, 2 y 3), que finalmente entran en el núcleo celular y activan la expresión de otros factores de la transcripción como los de la familia Nkx (Nkx2.1, 2.2 y 6.1), entre otros [27]. La alteración (mediante teratógenos, por ejemplo) de cualquiera de los pasos de esta cadena señalizadora puede causar malformaciones cerebrales mayores, como la holoprosencefalia (ciclopia), de la que hablaremos más adelante. El primordio neural recibe información ‘lateral (dorsal)’ Las CMN de la placa neural están sometidas también a la acción de proteínas segregadas desde estructuras laterales, que imparten información sobre destinos laterales/dorsales (recordemos que la parte lateral de la placa acabará siendo dorsal en el en tubo neural). Parece lo más probable que algunas de estas proteínas lateralizadoras pertenezcan a la familia de las BMP (Bone Morphogenetic Proteins), segregadas por células que se hallan en el límite entre el ectodermo de la placa neural y el ectodermo que no es neural [28]. Un ‘organizador’ genera la información ‘anteroposterior’ Un organizador cuyo funcionamiento se conoce en profundidad es el organizador ístmico. Éste no se halla en el cerebro anterior, sino en la zona del istmo, es decir, entre el cerebro medio (mesencéfalo) y el cerebro posterior (romboencéfalo). Tomando este organizador como ejemplo se ha propuesto que existen al menos otros dos organizadores: el reborde anterior de la placa neural (anterior neural ridge) [29] y la zona limitante [30], que se halla en el diencéfalo, entre el tálamo dorsal y el ventral. La confirmación de ambos como organizadores, y el estudio detallado de su mecanismo, están aún en mantillas. Lo que sí se sabe es que el reborde neural anterior es el origen de la señal anteroposterior más importante que conocemos, la proteína segregada Fgf8(Fibroblast Growth Factor8). Así, las CMN reciben no sólo información sobre su posición mediolateral (Shh y BMP), sino sobre su posición anteroposterior [29]. TERCERA FASE: CÓMO INTERPRETAR LA INFORMACIÓN POSICIONAL Las CMN ‘entienden’ los gradientes o entramados a los que están sometidas como información sobre su posición en el primordio 3 No olvidemos que, al avanzar el desarrollo, la placa neural se curva formando el tubo neural. El centro de la placa formará entonces la porción ventral del tubo, y los bordes laterales de la placa, que se fusionan por encima, formarán la porción dorsal. 492 4 El mecanismo por el cual la célula interpreta la información posicional no se conoce; es lo que se llama ‘el problema de la interpretación’, y sigue siendo un problema central en biología del desarrollo [12,17,31]. REV NEUROL 2002; 34 (5): 490-495 REGIONES DEL CEREBRO ANTERIOR neural, y traducen tal información posicional al lenguaje de la expresión genética4 . Digamos aquí que, por supuesto, otra información importante es también el linaje de una CMN en concreto, es decir, de qué otra CMN procede. La forma en que ambos tipos de información (linaje y posición) interaccionan, y la importancia relativa de cada uno no están aún claras. Así, el destino de la CMN viene dado por su linaje y por su situación en el primordio neural. Tras interpretar la información recibida, y de acuerdo con ella, cada CMN expresa una cierta combinación de aquellos genes que codifican proteínas capaces de regular la expresión de otros genes. Éstas reciben el nombre de factores de la transcripción. Cada combinación específica de factores de la transcripción determina a su vez lo que va a hacer una CMN: seguir dividiéndose horizontalmente (dando lugar a otras CMN) o dividirse verticalmente. La división vertical da lugar a las neuronas jóvenes: incapaces ya de dividirse, pero aún no diferenciadas. Las neuronas jóvenes abandonan el neuroepitelio y migran hacia su posición final, donde se diferenciarán 5 . De este modo, las combinaciones de factores de la transcripción en las CMN también determinan (al menos hasta cierto punto) a qué tipo de neurona van a dar lugar (por ejemplo, si van a originar neuronas dopaminérgicas). El entramado molecular de Shh y Fgf8 especifica células dopaminérgicas Contamos al menos con un ejemplo de la manera en que un entramado molecular puede especificar los ejes de coordenadas (anteroposterior y lateromedial) que informan a las CMN del linaje al que van a dar lugar. Las proteínas segregadas Shh y Fgf8 dan lugar a dos cadenas señalizadoras distintas. Shh es segregada por una larga estructura mesodérmica (placa precordal más notocorda) orientada anteroposteriormente y en el centro del embrión. Shh marcaría por tanto el eje de coordenadas anteroposterior en la placa neural. Fgf8 es segregada por dos organizadores: por el reborde neural anterior y por el organizador ístmico, ambos son grupos de células de la placa neural orientados transversalmente (marcarían coordenadas transversales). En el lugar en que ambos se encuentran, las CMN dan lugar a neuronas dopaminérgicas. El punto de cruce rostral da lugar a los progenitores de las células dopaminérgicas del telencéfalo basal; el punto de cruce posterior se halla en la porción rostral y basal del mesencéfalo, y el núcleo cerebral dopaminérgico al que da lugar es naturalmente la sustancia negra [32]. Organizadores secundarios Además, algunas CMN responden a los factores solubles segregando a su vez más factores solubles que actúan sólo en su vecindad. Se forman así ‘organizadores secundarios’ que contribuyen a añadir ‘detalle’ a la regionalización de una cierta zona del neuroepitelio. Al menos un ejemplo de organizador secundario se conoce ya. La placa del techo (roofplate) en el telencéfalo segrega factores del tipo BMP para regionalizar la futura corteza cerebral [33]. Una vez más, el mecanismo básico se reproduce: al recibir estas proteínas BMP, algunas células responden expresando el factor de la transcripción Lhx2, y en consecuencia dando lugar a ciertos tipos de progenitores corticales y de neuronas de la corteza cerebral [33]. CUARTA FASE: FORMACIÓN DE LAS REGIONES DEL CEREBRO ANTERIOR Restricción progresiva y mapa cambiante Al dividirse horizontalmente, el destino de las CMN se va restringiendo. Es decir, las primeras pueden dar lugar a la mayor parte REV NEUROL 2002; 34 (5): 490-495 de las neuronas del sistema nervioso, las siguientes sólo a las neuronas de cierta parte de éste, y así sucesivamente hasta que todas las CMN están ‘regionalizadas’, es decir, ya ‘saben’ a qué tipo (o tipos) de neuronas van a dar lugar. Podemos imaginar que, en este momento, el neuroepitelio contiene un ‘mapa’ de las regiones del cerebro, ‘pintado’ por las combinaciones de factores de la transcripción que expresan distintas CMN. De cada una de las regiones de dicho mapa surgirán las neuronas de tal región cerebral del adulto.No olvidemos, sin embargo, que tales regiones o parcelas tienen bordes dinámicos, con algunas zonas de solapamiento y sin fronteras nítidas o permanentes [34]. Además, la restricción progresiva de la capacidad diferenciadora de las células proliferantes hace que el mapa cambie y se subdivida a su vez rápidamente, produciendo nuevas combinaciones de factores de la transcripción en áreas cada vez más pequeñas. Este fenómeno puede observarse cuando se traza con precisión el mapa de varios factores de la transcripción a lo largo de todas las etapas del desarrollo [35]. Regionalización definitiva Probablemente, la regionalización del primordio neural no es definitiva, es decir, las neuronas jóvenes (recién acabada la última mitosis) no contienen toda la información acerca de su diferenciación final (es decir, ‘no saben’ hasta el último detalle qué genes habrán de expresar para diferenciarse). Es probable que, en la mayor parte de las estructuras cerebrales, la información final sobre conectividad, etc., sea recibida por la célula solamente cuando ésta llega a su destino en el cerebro. La contribución relativa de la información que ya traen las neuronas jóvenes (linaje) y de la información que reciben al llegar ha de ser determinada experimentalmente para cada caso concreto. Parcelas marcadas y corrientes migratorias marcadas Probablemente como reflejo de la información que las neuronas jóvenes llevan ‘de casa’, es decir, de la región neuroepitelial de la que proceden, en algunos casos dichas neuronas jóvenes expresan uno o varios de los factores de la transcripción que caracterizan a la parcela de neuroepitelio que las ha generado. Así se forman ‘corrientes migratorias’ de neuronas marcadas, que proceden de parcelas neuroepiteliales igualmente marcadas. Este fenómeno se observa particularmente en regiones como el hipotálamo o los ganglios basales, que son grandes y complejas pero carecen de estructura en capas. Este bagaje informativo podría permitirles identificar las pistas moleculares necesarias para migrar correctamente a través de la compleja capa del manto en desarrollo. Los factores de la trascripción de la familia POU-III son esenciales para conferir a las células del ectodermo neural sus características de CMN [36]. Muchas regiones del neuroepitelio expresan combinaciones características de uno o varios de los cuatro miembros de esta familia (Brain1, Brain2, Brain4 y Testes1). En algunos casos al menos, de las parcelas neuroepiteliales así definidas surgen más tarde grupos de neuronas jóvenes que expresan la misma combinación de genes POU-III mientras migran hacia su lugar de dife5 La capa de células así formada, que aumenta el grosor del tubo neural, recibe el nombre de ‘capa del manto’ (mantle layer), y en el adulto resulta ser el parénquima cerebral. Las etapas de división horizontal y vertical coinciden al principio en el tiempo. Más tarde el número de CMN ya no aumenta más (o muy poco), y todas las CMN que se dividen lo hacen para dar lugar a neuronas o células gliales. Al acercarse el fin de la gestación, también este tipo de división disminuye mucho. 493 G. ÁLVAREZ-BOLADO renciación [35]. La coexpresión de marcadores por una parcela de neuroepitelio y por las neuronas allí generadas refleja el hecho de que tales neuronas han sido especificadas regionalmente en el neuroepitelio, es decir, llevan consigo una cierta combinación de determinantes moleculares (que incluye algunos factores POU-III) que codifica información acerca del tipo de neurona en el que se han de convertir. En el caso de Brain2 esto se ha podido confirmar experimentalmente. En embriones de ratón con una mutación inducida del factor de la transcripción Brain2, las neuronas jóvenes que proceden de la parcela neuroepitelial que expresaría Brain2 se originan y migran de modo en apariencia normal; más tarde, sin embargo, no pueden diferenciarse correctamente [37]. Un caso similar es el de Foxb1, factor de la transcripción expresado en una cierta parcela neuroepitelial así como en las neuronas jóvenes que proceden de ella y finalmente en el núcleo al que dan lugar (núcleo mamilar medial, hipotálamo) [38]. En embriones de ratón con una mutación inducida del factor de la transcripción Foxb1 se forma el núcleo mamilar medial, pero no se diferencia correctamente y acaba desapareciendo [39,40]. Migración transregional Finalmente, confesemos que hasta aquí hemos expuesto la regionalización de una forma un tanto dogmática y simplificada. Uno de los fenómenos que complican la cosa es el de la migración ‘transregional’. Resulta que algunas neuronas, tras salir del neuroepitelio que las ha dado origen, no migran de manera simplemente ‘vertical’ para ir a la región correspondiente, sino que migran ‘tangencialmente’ para ir a terminar en otras regiones. Un excelente ejemplo es el de algunas neuronas de la región de los ganglios basales, que migran para formar parte de la corteza cerebral [41]. Holoprosencefalia (ciclopia): una alteración de la regionalización del cerebro anterior La alteración de los mecanismos de regionalización puede dar lugar a que una determinada ‘parcela’ (patch) de neuroepitelio no sea regionalizada correctamente. El resultado final sería una malformación. Un caso bien conocido es el de la holoprosencefalia, que es la malformación cerebral congénita más frecuente en el ser humano (la padece 1 de cada 10.000 o 20.000 fetos nacidos vivos [42]). Esta malformación comprende una vasta gama de alteraciones morfológicas cerebrales, originadas por la deficiencia (o la ausencia completa) en estructuras mediales ventrales. Los casos extremos presentan un cerebro formado por una sola vesícula, sin separación entre hemisferios. La holoprosencefalia se acompaña de malformaciones faciales. La más extrema de ellas es la ciclopia: el rostro presenta un solo ojo (sin retina neural, situado en posición central y debajo del apéndice nasal, también muy alterado). ¿Por qué consideramos a la holoprosencefalia como una alteración de la regionalización cerebral? Una de las regiones primitivas del neuroepitelio es la región óptica (eyefield). Se trata de una parcela central y rostral, que se divide en dos (derecha e izquierda, una para cada ojo) cuando llega la información (ventralizadora que lleva la proteína soluble Shh) [43]. Las alteraciones en la cadena señalizadora de Shh pueden tener como consecuencia que no se especifiquen esas estructuras ventrales, y por lo tanto que no se divida la región óptica, y por lo tanto que el feto presente un solo ojo situado centralmente. En animales de experimentación se puede provocar holoprosencefalia dañando quirúrgicamente la placa precordal (estructura mesodérmica que segrega Shh), o también utilizando cualquiera de una larga serie de sustancias químicas teratógenas (alcoholes, alcaloides, disolventes, vitamina A). Algunos de estos agentes actúan muy probablemente interfiriendo con el colesterol (para funcionar correctamente, la proteína Shh ha de ser modificada mediante la adición de colesterol). Naturalmente, la mutación artificial (en ratones) o natural de los genes que actúan en la cadena señalizadora de Shh tiene la misma consecuencia [44-47]. Digamos de paso que el ojo del cíclope holoprosencefálico es ciego, ya que no tiene retina neural: Shh desempeña probablemente también un papel en la especificación de las células retinales [45]. Los procesos moleculares y celulares que culminan en la formación de las regiones del cerebro anterior (corteza, ganglios basales, etc.) han dejado recientemente de ser un completo misterio. La información obtenida hasta ahora permite ya explicar el mecanismo de algunas de las alteraciones de estos procesos. Es de esperar que pronto se descubra cómo aplicar estos conocimientos a la prevención y el diagnóstico precoz de las malformaciones consiguientes. BIBLIOGRAFÍA 1. Cowan WM. Aspects of neural development. Int Rev Physiol 1978; 17: 149-191. 2. Nieuwkoop PD. The neural induction process; its morphogenetic aspects. Int J Dev Biol 1999; 43: 615-23. 3. Withington S, Beddington R, Cooke J. Foregut endoderm is required at head process stages for anterior most neural patterning in chick. Development 2001; 128: 309-20. 4. Thomas P, Beddington R. Anterior primitive endoderm may be responsible for patterning the anterior neural plate in the mouse embryo. Curr Biol 1996; 6: 1487-96. 5. Bouwmeester T, Kim S, Sasai Y, Lu B, De Robertis EM. Cerberus is a head-inducing secreted factor expressed in the anterior endoderm of Spemannis organizer. Nature 1996; 382: 595-601. 6. Piccolo S, Agius E, Leyns L, Bhattachariyya S, Grunz H, Bouwmeester T, et al. The head inducer Cerberus is a multifunctional antagonist of Nodal, BMP and Wnt signals. Nature 1999; 397: 70710. 7. Lumsden A, Krumlauf R. Patterning the vertebrate neuraxis. Science 1996; 274: 1109-15. 8. Temple S. The development of neural stem cells. Nature 2001; 414: 112-7. 9. Álvarez-Buylla A, García-Verdugo JM, Tramontin AD. A unified hypothesis on the lineage of neural stem cells. Nat Rev Neurosci 2001; 2: 287-93. 494 10. Cassidy R, Frisen J. Neurobiology. Stem cells on the brain. Nature 2001; 412: 690-1. 11. Wolpert L. Positional information and the spatial pattern of cell differentiation. J Theor Biol 1969; 25: 1-47. 12. Wolpert L. Positional information revisited. Development 1989; 107: 3-12. 13. Chandebois R. Cell sociology and the problem of position effect: pattern formation, origin and role of gradients. Acta Biotheor 1977; 26: 203-38. 14. Lawrence PA, Crick FH, Munro M. A gradient of positional information in an insect, Rhodnius. J Cell Sci 1972; 11: 815-53. 15. Nusslein-Volhard C. Determination of the embryonic axes of Drosophila. Dev Suppl 1991; 1: 1-10. 16. Kauffman SA. Pattern formation in the Drosophila embryo. Philos Trans R Soc Lond B Biol Sci 1981; 295: 567-94. 17. Kauffman S. Control circuits for determination and transdetermination: interpreting positional information in a binary epigenetic code. Ciba Found Symp 1975: 201-21. 18. Tickle C, Summerbell D, Wolpert L. Positional signalling and specification of digits in chick limb morphogenesis. Nature 1975; 254: 199-202. 19. Trisler D. Cell recognition and pattern formation in the developing nervous system. J Exp Biol 1990; 153: 11-27. 20. Sefton M, Araujo M, Nieto MA. Novel expression gradients of Eph- REV NEUROL 2002; 34 (5): 490-495 REGIONES DEL CEREBRO ANTERIOR like receptor tyrosine kinases in the developing chick retina. Dev Biol 1997; 188: 363-8. 21. Echelard Y, Epstein DJ, St-Jacques B, Shen L, Mohler J, McMahon JA, et al. Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity. Cell 1993; 75: 1417-30. 22. Ericson J, Muhr J, Placzek M, Lints T, Jessell TM, Edlund T. Sonic hedgehog induces the differentiation of ventral forebrain neurons: a common signal for ventral patterning within the neural tube. Cell 1995; 81: 747-56. 23. Roelink H, Augsburger A, Heemskerk J, Korzh V, Norlin S, RuizAltaba A, et al. Floor plate and motor neuron induction by vhh-1, a vertebrate homolog of hedgehog expressed by the notochord. Cell 1994; 76: 761-75. 24. Roelink H, Porter JA, Chiang C, Tanabe Y, Chang DT, Beachy PA, et al. Floor plate and motor neuron induction by different concentrations of the amino-terminal cleavage product of sonic hedgehog autoproteolysis. Cell 1995; 81: 445-55. 25. Stone DM, Hynes M, Armanini M, Swanson TA, Gu Q, Johnson RL, et al. The tumour-suppressor gene patched encodes a candidate receptor for Sonic hedgehog. Nature 1996; 384: 129-34. 26. Alcedo J, Ayzenzon M, von Ohlen T, Noll M, Hooper JE. The Drosophila smoothened gene encodes a seven-pass membrane protein, a putative receptor for the hedgehog signal. Cell 1996; 86: 221-232. 27. Hammerschmidt M, Brook A, McMahon AP. The world according to hedgehog. Trends Genet 1997; 13: 14-21. 28. Furuta Y, Piston DW, Hogan BL. Bone morphogenetic proteins (BMPs) as regulators of dorsal forebrain development. Development 1997; 124: 2203-12. 29. Shimamura K, Rubenstein JL. Inductive interactions direct early regionalization of the mouse forebrain. Development 1997; 124: 270918. 30. Zeltser LM, Larsen CW, Lumsden A. A new developmental compartment in the forebrain regulated by Lunatic fringe. Nat Neurosci 2001; 4: 683-4. 31. Papageorgiou S. A physical force may expose Hox genes to express in a morphogenetic density gradient. Bull Math Biol 2001; 63: 185200. 32. Ye W, Shimamura K, Rubenstein JL, Hynes MA, Rosenthal A. FGF and Shh signals control dopaminergic and serotonergic cell fate in the anterior neural plate. Cell 1998; 93: 755-66. 33. Monuki ES, Porter FD, Walsh CA. Patterning of the dorsal telencephalon and cerebral cortex by a roof plate-lhx2 pathway. Neuron 2001; 32: 591-604. 34. Bell E, Ensini M, Gulisano M, Lumsden A. Dynamic domains of gene expression in the early avian forebrain. Dev Biol 2001; 236: 76-88. 35. Álvarez-Bolado G, Rosenfeld MG, Swanson LW. Model of forebrain regionalization based on spatiotemporal patterns of POU-III homeobox gene expression, birthdates, and morphological features. J Comp Neurol 1995; 355: 237-95. 36. Josephson R, Muller T, Pickel J, Okabe S, Reynolds K, Turner PA, et al. POU transcription factors control expression of CNS stem cellspecific genes. Development 1998; 125: 3087-100. 37. Schonemann MD, Ryan AK, McEvilly RJ, O’Connell SM, Arias CA, Kalla KA, et al. Development and survival of the endocrine hypothalamus and posterior pituitary gland requires the neuronal POU domain factor Brn-2. Genes Dev 1995; 9: 3122-35. 38. Álvarez-Bolado G, Zhou X, Cecconi F, Gruss P. Expression of Foxb1 reveals two strategies for the formation of nuclei in the developing ventral diencephalon. Dev Neurosci 2000; 22: 197-206. 39. Wehr R, Mansouri A, de Maeyer T, Gruss P. Fkh5-deficient mice show dysgenesis in the caudal midbrain and hypothalamic mammillary body. Development 1997; 124: 4447-56. 40. Álvarez-Bolado G, Zhou X, Voss AK, Thomas T, Gruss P. Winged helix transcription factor Foxb1 is essential for access of mammillothalamic axons to the thalamus. Development 2000; 127: 102938. 41. de Carlos JA, López-Mascaraque L, Valverde F. Dynamics of cell migration from the lateral ganglionic eminence in the rat. J Neurosci 1996; 16: 6146-56. 42. Muenke M, Beachy PA. Genetics of ventral forebrain development and holoprosencephaly. Curr Opin Genet Dev 2000; 10: 262-9. 43. Li H, Tierney C, Wen L, Wu JY, Rao Y. A single morphogenetic field gives rise to two retina primordia under the influence of the prechordal plate. Development 1997; 124: 603-15. 44. Belloni E, Muenke M, Roessler E, Traverso G, Siegel-Bartelt J, Frumkin A, et al. Identification of Sonic hedgehog as a candidate gene responsible for holoprosencephaly. Nat Genet 1996; 14: 353-6. 45. Chiang C, Litingtung Y, Lee E, Young KE, Corden JL, Westphal H, et al. Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature 1996; 383: 407-13. 46. Roessler E, Belloni E, Gaudenz K, Jay P, Berta P, Scherer SW, et al. Mutations in the human Sonic Hedgehog gene cause holoprosencephaly. Nat Genet 1996; 14: 357-60. 47. Wallis DE, Roessler E, Hehr U, Nanni L, Wiltshire T, Richieri-Costa A, et al. Mutations in the homeodomain of the human SIX3 gene cause holoprosencephaly. Nat Genet 1999; 22: 196-8. MECANISMOS DE LA FORMACIÓN DE REGIONES EN EL CEREBRO ANTERIOR Resumen. ¿De dónde vienen las regiones del cerebro anterior? El paradigma que va saliendo a la luz en los últimos diez años es el de una placa neural subdivida por factores solubles que (a través de gradientes o de un entramado molecular) transmiten información posicional a las células madre neurales. Algunos de esos factores solubles son Fgf8, Sonic hedgehog y proteínas de la familia BMP. Las células madre neurales interpretan la información posicional en términos de expresión de combinaciones de factores de la transcripción. Tales combinaciones serían finalmente responsables de la formación de linajes neuronales específicos (corticales, talámicos, etc.) a partir de regiones neuroepiteliales específicas. Además, la información posicional ‘primaria’ puede hacer que determinadas regiones del primordio neural (organizadores secundarios) segreguen nuevos factores solubles. Éstos darían a su vez lugar a nueva información posicional, de influencia más restringida, y así se repetiría el proceso localmente, añadiendo ‘detalle’ a una cierta región. El torrente de nuevos conocimientos adquiridos mediante genética molecular nos está ayudando a comprender la causa de algunas malformaciones congénitas cerebrales, y tal vez pronto se pueda aplicar también a su diagnóstico precoz y a su prevención. [REV NEUROL 2002; 34: 490-5] Palabras clave. Células madre. Cerebro anterior. Ciclopia. Especificación. Holoprosencefalia. Organizador. Regionalización. MECANISMOS DE FORMAÇÃO DAS REGIÕES DO CÉREBRO ANTERIOR Resumo. De onde vêm as regiões do cérebro anterior? O paradigma que se vai desvelando nos últimos dez anos é o de uma placa neural subdividida por factores solúveis que, através de gradientes e de uma grelha molecular, transmitem informação posicional às células-mãe neuronais. Alguns desses factores solúveis são Fgf8, Sonic hedgehog e proteínas da família BMP. As células-mãe neuronais interpretam a informação posicional em termos de expressão de combinações de factores da transcrição. Tais combinações seriam finalmente responsáveis pela formação de linhagens neuronais específicas (corticais, talámicas, etc.) a partir de regiões neuroepiteliais específicas. Além disso, a informação posicional ‘primária’ pode fazer com que determinadas regiões do primórdio neural (organizadores secundários) segreguem novos factores solúveis. Estes dariam por sua vez lugar a uma nova informação posicional, de influência mais restrita, e assim repetir-se-ia o processo localmente, acrescentando ‘pormenor’ a uma certa região. O fluxo de novos conhecimentos adquiridos por genética molecular está a ajudar-nos a compreender a causa de algumas malformações cerebrais congénitas, e talvez cedo se possa aplicar também ao seu diagnóstico precoce e à sua prevenção. [REV NEUROL 2002; 34: 490-5] Palavras chave. Células-mãe. Cérebro anterior. Ciclopia. Especificação. Holoprosencefalia. Organizador. Regionalização. REV NEUROL 2002; 34 (5): 490-495 495