Espectros Atómicos - Departamento de Química General
Anuncio

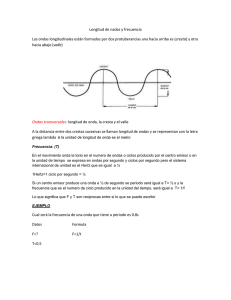
Espectros Atómicos Química General I 2012 Estudios de las ondas • ¿Que es una onda? Es una alteración vibracional a través de la cual se transmite energía. • Existen muchos tipos de ondas, por ejemplo, las del agua, de la luz o del sonido. Propiedades características de las ondas. • Longitud de onda λ (lambda): es la distancia entre puntos iguales de ondas sucesivas. • Frecuencia v (nu): es el número de ondas que pasan por un punto en particular en un segundo. • Amplitud: Es la distancia vertical de la línea media de una onda a su cresta o a su valle. Propiedades de las ondas Propiedades de las ondas Longitud de onda La frecuencia (n) es el número de ondas que pasan por un determinado punto en un intervalo de 1 segundo. (Hertz = 1 ciclo/seg). Velocidad = l x n 7.1 Radiación electromagnética • Es energía que se propaga a través de ondas electromagnéticas. • Estas ondas electromagnéticas no son comunes, tienen un componente de campo eléctrico y un componente de campo magnético. • Ambos componentes tienen la misma longitud de onda y frecuencia, y por tanto igual velocidad, pero viajan en planos perpendiculares entre sí. Maxwell (1873), estableció que la luz está formada por ondas electromagnéticas Radiación electromagnética Emisión y transmisión de energía por medio de ondas electromagnéticas. Velocidad de la luz (en el vacío) = 3.00 x 108 m/s Toda radiación electromagnética lxn=c 7.1 7.1 Un fotón tiene una frecuencia de 6.0 x 104 Hz. Determine la longitud de onda del fotón. ¿Se encuentra esta frecuencia dentro de la región visible? l n 7.1 Energía asociada a las ondas. La energía y la luz son emitidas o absorbidas en múltiples unidades llamadas “quantum”. E=hxn Constante de Plank (h) h = 6.63 x 10-34 J•s E=h c l 7.1 Cuando una muestra de cobre es bombardeada con electrones, se producen rayos X. Calcule la energía que contienen los electrones si se sabe que la longitud de onda de los rayos X es 0.154 nm. Ejercicios • Cuál es la frecuencia de la luz verde con una longitud de onda de 500 nm? R/ 6.0 x 1014 /s o Hz • Determinar la energía de los fotones a esos 500 nm. R/ 3.978x10-19 J Ejercicios • Determinar la energía de los fotones que corresponde a una luz con frecuencia de 3.0 x 1015 Hz R/ 1.989 x 10-18 J • Cuál es la energía de los fotones que corresponde a una luz de longitud de onda de 0.05 nm? R/ 3.978 x 10-15 J Estados del electrón • El electrón se puede encontrar en dos estados: – Estado Basal – Estado de Excitación • El estado basal, es cuando el electrón está en el orbital que le corresponde, es un estado estable y es el estado menos energético posible. • El estado excitado, es cuando el electrón absorbe energía y sube a un orbital de mayor energía (mas externo). La energía que absorbe, es en “paquetes” que se denominan “cuantos”. – Este estado es inestable y el electrón tiende a regresar a su estado basal devolviendo la energía que absorbió como un fotón con energía, longitud de onda y frecuencia características. E = hn E = hn 7.3 Espectro atómico de una sustancia • Es el registro de todas las longitudes de onda que son absorbidas o emitidas por una sustancia. • Cada longitud de onda del espectro corresponde a un cambio energético definido de los electrones. • Cada elemento tienen un espectro característico. – Son las huellas digitales de los elementos. Espectros de emisión – Pueden ser de dos tipos: • Continuos • De líneas (discontinuos) – Espectro continuo: Todas las longitudes de onda de la luz visible están representadas en ellos. • Estos espectros usualmente se observan cuando un material sólido (usualmente metálico) se calienta al “rojo vivo” o al “blanco incandescente”. • Si la luz se descompone con un prisma, sería posible ver todos los colores del espectro visible (similar al arcoiris). Espectros de emisión • Espectro discontinuo o de líneas: corresponde a la emisión de la luz sólo a ciertas longitudes de onda. – Se obtienen cuando los átomos del elemento en fase gaseosa son excitados con una llama o con un arco eléctrico. – Uno percibe un color característico, pero si esa luz se descompone con un prisma, sólo se ven líneas a determinadas longitudes de onda. Espectro de los átomos de hidrógeno 7.3 7.3 Colores visibles de los espectros de emisión • Muchos elementos en disolución, dan cierto color al calentarse que resulta de la mezcla de radiación visible a las longitudes características de su espectro de emisión. – Espectros de llama: Litio Potasio Bario Cesio Sodio Calcio Estroncio Rojo Violeta Verde Azul Amarillo Rojo naranja Rojo ladrillo Espectros de absorción • Son espectros (registros) de cómo un sustancia en particular absorbe en mayor o menor grados la energía de la radiación que se le aplica. • El procedimiento para obtenerlos consiste en “irradiar” la muestra con luz de distintas longitudes de onda y registrar aquellas longitudes de onda donde se “absorbió” mayor cantidad de esa radiación. • Suelen ser espectros continuos. Espectro de absorción 393 nm Luz Detector Atención • Leer del libro de Chang 10ma edición: – Págs. 276 a 287 – Atención a los ejemplos 7.1, 7.2. – En la 9na edición son las págs. 268 a 276, los ejemplos son los mismos. – Resolver hoja de trabajo no. 5