SIMETRÍA
Anuncio

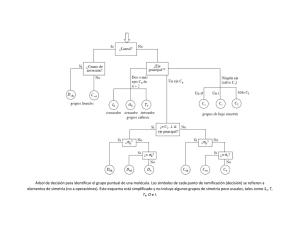
Juan 30/01/2005 SIMETRÍA Elementos y operaciones de simetría Grupos puntuales de simetría Modelo de repulsión de pares de electrones de la capa de valencia (VSEPR) Simetría de las moléculas Tablas de caracteres http://www.chem.ox.ac.uk/courses/Molecular_Symmetry/part2.html http://www.chem.ox.ac.uk/vrchemistry/sym/splash.html Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Simetría: (Gr. συµµετρια) Proporción adecuada de las partes de un todo entre sí y con el todo mismo. Regularidad en la disposición de las partes o puntos de un cuerpo o figura, de modo que posea un centro, un eje o un plano de simetría. Clasificar las estructuras de las moléculas Clasificar los orbitales moleculares Predecir el desdoblamiento de los niveles electrónicos Construir orbitales híbridos Clasificar los estados electrónicos de las moléculas Clasificar los modos normales de vibración Predecir las transiciones permitidas en los espectros Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 1 Juan 30/01/2005 Simetría Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Simetría y arte Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 2 Juan 30/01/2005 Simetría en química Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Elementos y operaciones de simetría Operación de simetría Es un movimiento que, realizado sobre un cuerpo cualquiera, conduce a una configuración equivalente a la inicial. Por equivalente se entiende indistinguible, pero no necesariamente idéntica. Elemento de simetría Son las entidades geométricas (puntos, líneas y planos) respecto de las cuales se realizan las operaciones de simetría. La posibilidad de realizar una operación de simetría con un objeto pone de manifiesto que ese objeto posee el correspondiente elemento de simetría. Operación Elemento Identidad nada Inversión Centro de inversión Rotación Eje de rotación Reflexión Plano de simetría Rotación impropia Eje de rotación impropia http://www.hull.ac.uk/php/chsajb/symmetry/symops.html Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 3 Juan 30/01/2005 Operaciones de simetría (1) Identidad: E 1 0 0 0 1 0 0 0 1 Es una operación equivalente a no hacer nada, deja cualquier objeto inalterado (es necesaria por razones matemáticas). Inversión: i −1 0 0 0 −1 0 0 0 −1 Es una operación que traslada un punto en una línea a través del origen (centro de inversión) a una distancia igual al otro lado del origen, de modo que transforma un punto con coordenadas (x, y, z) en otro con coordenadas (-x, -y, -z). 2π cos n −sen 2π n 0 Rotación: Cn α=2π/n Realiza una rotación de 360°/n alrededor de un eje. 0 0 1 2π n 2π cos n 0 sen Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Operaciones de simetría (2) Reflexión: σ Esta operación se lleva a cabo a través de un plano (plano de simetría) que produce una imagen reflejada coincidente con el objeto original. σ xy 1 0 = 0 1 0 0 0 0 −1 Rotación impropia: Sn Esta operación consiste en una rotación de 360°/n alrededor de un eje Cn seguida de una reflexión a través del plano perpendicular a dicho eje de rotación. 2π cos n 2π (Sn ) z = −sen n 0 2π n 2π cos n 0 sen 0 1 0 0 0 0 1 0 = 1 0 0 −1 2π cos n −sen 2π n 0 2π n 2π cos n 0 sen 0 0 −1 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 4 Juan 30/01/2005 Elementos de simetría (1) Eje de rotación Es una línea imaginaria, una rotación (en el sentido de las agujas del reloj) alrededor de él relaciona dos o más posiciones equivalentes de un objeto. Cuando existen dos o más ejes de rotación, uno de ellos suele ser el de mayor orden y se dispone perpendicular al resto, recibe el nombre de eje de rotación principal (conviene alinearlo de tal manera que coincida con el eje de coordenadas z) ángulo de giro símbolo Binario 2 180 C2 Ternario 3 120 C3 240 C3 90 C4 Cuaternario Eje de rotación n Orden 5 Senario 4 5 6 Cnn = C1 2 2 180 C 4 = C2 270 C4 3 72 C5 144 C5 216 C 35 288 C5 60 C6 2 4 2 120 C6 = C3 180 C6 = C2 240 4 2 C6 = C3 300 C6 3 5 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Elementos de simetría (2) Planos de simetría Es un plano imaginario a través del cual se realiza la operación de reflexión. σh Plano de simetría horizontal: Se sitúa perpendicular al eje de rotación propia principal. σv Plano de simetría vertical: Plano que contiene al eje de rotación principal σd Plano de simetría diédrico: Plano que biseca el ángulo diédrico determinado por el eje de rotación principal y dos ejes binarios perpendiculares adyacentes perpendiculares al eje principal. Cn σv σd C2 σh C2 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 5 Juan 30/01/2005 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Teoría de grupos Cada molécula posee un conjunto de operaciones de simetría. El conjunto de operaciones de simetría recibe el nombre de grupo puntual de simetría de la molécula. Varias propiedades de las moléculas se pueden predecir empleando la teoría de grupos. En sentido matemático, un grupo es un conjunto de operaciones que cumplen las siguientes reglas: 1. El producto de dos operaciones cualquiera debe ser una operación del grupo. (Se dice que un grupo es cerrado respecto a la multiplicación). 2. Cada grupo debe tener la operación identidad, E, ya que el producto de una operación y su inversa es la identidad. 3. Cada operación debe tener su inversa. 4. Todas las operaciones del grupo deben ser asociativas (AB)C = A(BC). 5. Si presentan la propiedad conmutativa se dice que el grupo es abeliano. Grupos puntuales de simetría Cada grupo puntual de simetría que presentan las moléculas tiene una designación particular y viene descrito mediante un símbolo que consta de: • Una letra mayúscula: C, D, T, I, O, S • Subíndice: número, letra minúscula o una combinación alfanumérica Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 6 Juan 30/01/2005 Grupos puntuales de simetría Axiales Diédricos No axiales C1 Cs Ci Cn C2 C3 C4 C5 C6 C7 C8 Cnv C2v C3v C4v C5v C6v C7v C8v Cnh C2h C3h C4h C5h C6h Dn D2 D3 D4 D5 D6 D7 D8 Dnh D2h D3h D4h D5h D6h D7h D8h Dnd D2d D3d D4d D5d D6d D7d D8d Sn S2 S4 S6 S8 S10 S12 Platónicos T Th Td O Oh I Lineales C∞v D∞h Ih http://www.mpip-mainz.mpg.de/~gelessus/group.html Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Topología molecular. Estructura de Lewis 1. Determinar el número total de electrones de valencia (NT). 2. Dibujar un esquema estructural de la molécula y determinar el número de electrones disponibles (ND). 3. Calcular cuantos electrones necesita cada átomo para completar un octeto de electrones y sumar todos los necesarios (NN). 4. Si ND = NN, sólo serán necesarios pares de electrones solitarios para completar los octetos de cada átomo. Si ND < NN, será necesario dibujar enlaces múltiples. Se añadirá una línea extra por cada par de electrones que falten, tienen preferencia para formar enlaces múltiples O, S, N, C (nunca H). Después completar los octetos de cada átomo, (H requiere sólo 2 electrones). Si ND > NN, los electrones extra se colocarán sobre el átomo central, que podrá violar la regla del octeto si pertenece a los periodos 3 ó superiores de la tabla periódica. 5. Determinar la estructura más estable en función de la carga formal. 6. Comprobar la respuesta. El número de electrones dibujados debe ser igual al calculado en el paso 1 (NT). Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 7 Juan 30/01/2005 Teoría de las repulsiones entre los pares de electrones de la capa de valencia. VSEPR Esta teoría se aplica sólo a moléculas covalentes discretas (*) y sirve para determinar la geometría de las mismas. Se han de seguir las reglas siguientes para determinar la geometría más estable: 1. Las moléculas covalentes tienen sus pares de electrones, enlazantes y solitarios, orientados de tal manera que las repulsiones electrón-electrón queden minimizadas. 2. El orden en las repulsiones entre los pares de electrones es: ps-ps > ps-pe > pe-pe 3. Las repulsiones depende notablemente del ángulo entre los pares. Son fuerte a 90° o menos, son más débiles a 120° y muchísimo más débiles a 180°. Dibujar la estructura de Lewis para hallar el número de pares de electrones alrededor del átomo central y calcular el número estérico: Nº e − enlazantes + Nº e − solitarios − Nº e −p 2 Nº estérico = Nº átomos periféricos + Nº pares solitarios Nº estérico = (*) molécula constituida por un átomo central unido covalentemente a varios átomos periféricos http://www.shef.ac.uk/chemistry/chemputer/vsepr.html http://www.molecules.org/VSEPR_table.html http://library.thinkquest.org/3659/structures/predict.html Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 8 Juan 30/01/2005 VSEPR Nº estérico Geometria de los pares Nº átomos periféricos Geometría molecular 2 Lineal (180°) 2 Lineal 3 Trigonal plana (120°) 3 Trigonal 2 Angular 4 Tetraédrica (109.5°) 4 Tetraédrica 3 Piramidal 2 Angular 5 Bipirámide trigonal 4 Pirámide distorsionada 3 Forma de T 5 6 Bipirámide trigonal (90°, 120°) Octaédrico (90°) 2 Lineal 6 Octaédrico 5 Pirámide cuadrada 4 Plano cuadrada Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Determinación del grupo puntual de una molécula Shriver and Atkins, Inorganic Chemistry, OUP, London,1999 Title goes here Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 9 Juan 30/01/2005 Tabla de caracteres Una tabla de caracteres contiene, de una forma altamente simbólica, información sobre como algo que nos interese (un orbital, un enlace,...) se ve afectado por las operaciones de un grupo puntual determinado. Cada grupo puntual viene descrito por una única tabla de caracteres que tiene forma de matriz. Símbolo del grupo puntual Símbolos Mulliken Clases y operaciones de simetría C3v E 2C3 3σv A1 1 1 1 A2 1 1 -1 E 2 -1 0 Bases para las representaciones Funciones lineales, Funciones rotaciones cuadráticas z x2 + y2, z2 Rz (x, y) (Rx, Ry) (x2 - y2, xy) (xz, yz) Caracteres de las representaciones irreducibles http://www.chemistry.nmsu.edu/studntres/chem639/cgi-bin/group1.cgi http://www-theory.mpip-mainz.mpg.de/~gelessus/group.html Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Propiedades de las representaciones irreducibles 1. El número total de operaciones de simetría en un grupo se llama orden (h). Para determinar el orden de un grupo basta simplemente sumar el número total de operaciones indicadas en la parte superior de la tabla de caracteres. 2. Las operaciones de simetría se ordenan en clases de simetría. Todas las operaciones de una clase tienen idénticos caracteres para sus matrices de transformación y vienen agrupados en la misma columna de la tabla de caracteres. 3. El número de representaciones irreducibles es igual al número de clases de simetría. Esto significa que la tabla de caracteres es cuadrada. 4. La suma de los cuadrados de las dimensiones (caracteres debajo de E) de las representaciones irreducibles es igual al orden del grupo. h= 5. Para cualquier representación irreducible, la suma de los cuadrados de los caracteres es igual al orden del grupo. h= 6. Las representaciones irreducibles son ortogonales. ∑ χ i (R ) χj (R ) • nR 2 ∑ [χi (E )] i 2 ∑ [χi (R)] • nR R La suma de los productos de sus caracteres para cada operación de cualquier par de representaciones irreducibles es cero. =0 R i≠ j 7. Una representación totalmente simétrica aparece en todos los grupos. Se caracteriza por tener todos los caracteres igual a 1. Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 10 Juan 30/01/2005 Propiedades de la tabla de caracteres C3v Propiedad C3v 1 Orden 6 (6 operaciones de simetría) 2 Clases 3 clases: E 2 C3 3 σv 3 Número de representaciones irreducibles 3 (A1, A2, E) 4 Suma de los cuadrados (caracteres bajo E) 12 + 12 + 22 = 6 5 Suma de los cuadrados A1: A 2: E: 3 σv E 2 C3 12 + 12 + 22 + 2(12) + 3(12) = 6 2(12) + 3(-12) = 6 2(-12) + 3(02) = 6 6 Representaciones ortogonales La suma de los productos de dos representaciones cualquiera es igual a 0: A2xE: (1)(2) + 2(1)(-1) + 3(-1)(0) = 0 7 Representación totalmente simétrica A1 con todos los caracteres igual a 1 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Símbolos Mulliken Todas las representaciones monodimensionales se designan por A o B; las bidimensionales por E y las tridimensionales por T (a veces por F). A, B: χ(E) = 1 E: χ(E) = 2 T: χ(E) = 3 Las representaciones monodimensionales que son simétricas con respecto a la rotación 2π/n alrededor del eje principal Cn [ simétrica significa: χ(Cn) = 1] se designan A, mientras que las antisimétricas [χ(Cn) = -1] se designan B. Los subíndices 1 y 2 se emplean generalmente junto con A y B para designar aquellas repesentaciones que son, respectivamente, simétricas o antisimétricas con respecto a un C2 perpendicular al eje de rotación principal, si faltara tal eje C2, a un plano vertical de simetría. Las primas y dobles primas se unen a todas las letras, cuando convenga, para indicar aquellas que son, respectivamente, simétrica y antisimétrica con respecto a σh. En los grupos con centro de inversión, el subíndice g (del alemán gerade) se coloca a las representaciones que son simétricas con respecto a la inversión y el subíndice u (del alemán ungerade) se coloca a las representaciones antisimétricas con respecto a la inversión. Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 11 Juan 30/01/2005 Símbolos Mulliken (2) Dimensiones de la representación 1 2 3 E Cn 1 1 2 3 1 -1 Caracteres bajo: i σh C2(⊥) / σv Símbolos A B E T 1 A g B g E g Tg -1 A u B u E u Tu 1 A' B' -1 A" B" 1 A1 B1 -1 A2 B2 Juan M. Gutiérrez-Zorrilla. Química Inorgánica 2005 Title goes here 12