Cáncer de recto. - Página Oficial Sociedad Argentina de Cirugía
Anuncio

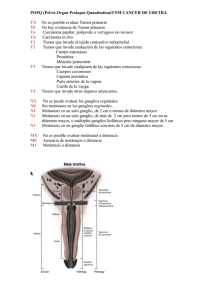
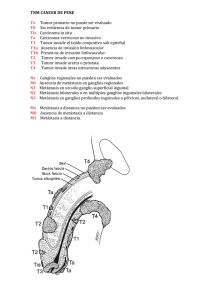
C áNCER III-370 DE RECto fERNANDo A. BoNADEo LASSALLE1 CARLoS A. VACCARo Sector de Coloproctología - Servicio de cirugía Genera l- Hospital Italiano de Buenos Aires (Argentina), 1Jefe 1. GENERALIDADES nocarcinomas corresponden a esta variedad, esta proporción es mayor en los pacientes jóvenes, llegando al 30% en los menores de 45 años. Se considera que el pronóstico del adenocarcinoma mucinoso es peor, especialmente por su mayor tendencia a dar metástasis. El tratamiento del cáncer de recto representa un desafío especial para los cirujanos. Las desbastadoras consecuencias de la recurrencia local hacen mandatorio que el tratamiento oncológico inicial sea adecuado. Por otra parte los resultados funcionales tienen gran importancia tanto en pacientes operados con intención curativa como paliativa. Los tumores de recto inferior representan un desafío aún mayor por asociarse a mayores dificultades operatorias y peores resultados oncológicos y funcionales. Numerosos trabajos han demostrado que la especialización en el manejo de estos pacientes se asocia a una mayor proporción de conservación esfinteriana y menor índice de recidiva local. En el presente capítulo se desarrollaran los aspectos más importantes para el correcto manejo de esta afección. VíAS DE DISEmINACIóN LINfátICA y máRGENES DE LA RESECCIóN Clásicamente el recto ha sido dividido en tercios, considerándose que la lesión asienta en el tercio superior cuando su borde inferior está a más de 11 y hasta 15 cm del margen anal, en el tercio medio cuando está entre 7 y 11 cm y en el tercio inferior cuando está a 7 cm o menos. El drenaje linfático difiere para cada localización. En el tercio superior se da en sentido proximal siguiendo a los vasos hemorroidales superiores hacia el pedículo mesentérico inferior. En el tercio medio, el drenaje proximal sigue siendo preponderante y se le agrega el drenaje lateral siguiendo los vasos hemorroidales medios y de allí a los vasos ilíacos internos. En el tercio inferior a las dos vías mencionadas se agrega (cuando la lesión asienta a nivel del anillo ano-rectal o más abajo) la posibilidad de drenaje linfático distal siguiendo los vasos hemorroidales inferiores. En base a estas características el vértice proximal de la resección linfática para cualquier localización del tumor en el recto, debe situarse a nivel del origen de la mesentérica inferior o inmediatamente por debajo del nacimiento de la cólica izquierda. Ello implica la resección de la mayor parte del sigma o aun del colon descendente para lograr un cabo proximal adecuadamente irrigado. Los vaciamientos ganglionares extramesentéricos (pre-cavo-aórtico y pelviano), no for man parte de las resecciones convencionales por su mayor morbilidad y por no haber demostrado claros beneficios en los resultados oncológicos. Un factor fundamental por su influencia en el tipo de resección, es conocer cual es el margen distal mínimo (extensión de pared rectal distal al borde macroscópico del tumor), que debe incluirse en la resección, para evitar el riesgo de una resección incompleta. Durante muchos EpIDEmIoLoGíA E HIStopAtoLoGíA Los aspectos epidemiológicos del cáncer del recto son muy similares a los del colon. Se estima que en los países occidentales el riesgo de cáncer colorrectal a lo largo de la vida es del 5-6% representando la localización rectal a un 30% del total de las lesiones. Los aspectos moleculares de la carcinogénesis son detallados en el capítulo "Síndrome de Lynch". El 95 a 98 % de los tumores colorrectales son adenocarcinomas (en su mayoría bien o moderadamente diferenciados). El 2 a 5 % restante lo conforman los linfomas, sarcomas, carcinoides, el carcinoma escamoso y el carcinoma adenoescamoso. Una característica frecuente de los adenocarcinomas de recto es la sobreproducción de moco. Cuando este es intracelular da lugar a las células en anillo de sello, factor este que se asocia a un pésimo pronóstico. La sobreproducción de moco extracelular es mucho mas frecuente y su resultado es el adenocarcinoma mucinoso, coloide o mucosecretor (denominaciones que sólo se deben utilizar cuando más del 50 % del área total del tumor tiene dichas características). Entre un 15 y un 18 % de los adeBONADEO LASSALLE F y VACCARO C; Cáncer de recto. Cirugía Digestiva, F. Galindo. www.sacd.org.ar, 2009; III-370, pág. 1-11. 1 III-370 años rigió la “regla de los 5 cm”. Posteriormente quedó demostrado que la diseminación intramural microscópica distal superior a 1 cm es sumamente infrecuente, y que si supera los 2 cm, el paciente es incurable cualquiera sea el procedimiento quirúrgico que se utilice25. Existe ahora evidencia de que 2 cm de margen son suficientes que solo cuando el margen distal es inferior a 0.8 cm se reducen los índices de sobrevida30. La presencia de ganglios metastásicos en el mesorrecto distal al tumor se produce por drenaje retrógrado cuando los linfáticos proximales se encuentran totalmente bloqueados por metástasis. Se ha descripto sin embargo la presencia de micrometástasis en el mesorrecto hasta varios centímetros por debajo del tumor7, por lo que se sugiere que en los tumores de los tercios medio e inferior del recto, se efectue la resección completa del mesorrecto. Quirke y cols. (1986)26, destacaron la importancia del “margen lateral”, término que definen como la distancia entre la superficie circunferencial de la pieza de resección y el punto donde la invasión tumoral es más profunda. En 27% de las piezas resecadas con criterio curativo encontraron invasión microscópica a nivel del margen lateral y el 85% de esos pacientes presentaron recurrencia local. En los casos con margen negativo el índice de recidiva local solo fue del 3%. Las características óseas de las paredes pelvianas, impiden la obtención de márgenes laterales mayores y explican la mayor frecuencia de recidivas locales en los tumores del recto extraperitoneal, que en las otras localizaciones. La ecografía endorrectal per mite objetivar la penetración parietal con una confiabilidad del 79-91% aunque no es tan efectiva para la deter minación de ganglios metastásicos (61-83%) dado a que el 50% de ellos tienen menos de 5 mm de diámetro. La tomografía axial computada per mite también deter minar si hay invasión de la grasa, y de planos o estructuras vecinas (sacro, próstata, vesículas seminales, vejiga, etc.). Adicionalmente evalúa el eventual compromiso hepático y del árbol urinario. Si bien es ideal contar con este estudio en todos los pacientes, por razones de costo se suele indicar sólo cuando se sospecha compromiso de órganos o estructuras vecinas. Lo mismo ocurre con la resonancia magnética nuclear, especialmente útil para evaluar el compromiso de la fascia propia del recto1-2. Si la evaluación sugiere compromiso del árbol urinario o vesical, la cistoscopia tiene indicación precisa. EVALuACIóN ENDoSCópICA Idealmente los pacientes deben tener evaluado la totalidad del colon para descartar lesiones sincrónicas (eventualidad presente en el 3% de los casos) y que en ocasiones pueden determinar un cambio en la estrategia quirúrgica. La colonoscopia tiene mayor sensibilidad que el colon por enema y es el estudio ideal, sin embargo cuando el grado de estenosis impide la progresión del endoscopio el estudio radiográfico es mandatorio. Debido a que por su flexibilidad el colonoscopio no es fiable para establecer con certeza la distancia desde el tumor al margen del ano es importante determinar la localización de la lesión con la rectosigmoideoscopia rígida. 2. CLíNICA y EStADIfICACIóN EVALuACIóN DE LA fuNCIóN ESfINtERIANA Los síntomas más típicos son proctorragia, pujos o tenesmo y la alteración del ritmo evacuatorio. La oclusión, el dolor, la pérdida de peso y la presencia de alteraciones de la micción son síntomas tardíos habitualmente asociados a invasión de órganos vecinos y a veces asociados a irresecabilidad. Se establece en general sólo por el interrogatorio dirigido y el tacto digital. Si existen dudas y la opción quirúrgica es una resección con anastomosis ultrabaja, puede complementarse con manometría anal. EVALuACIóN DE mEtáStASIS A DIStANCIA EVALuACIóN LoCoRREGIoNAL Las localizaciones más frecuentes son la hepática y la pulmonar. Para la evaluación de metástasis hepáticas y deter minar el compromiso del árbol urinario (dilatación ureteral o pielocalicial), la ecografía ha demostrado tener una sensibilidad igual o superior a la de la TAC. En razón de su menor costo y complejidad se la considera el estudio de elección, reser vándose la TAC para casos de hallazgos ecográficos patológicos. La radiografía de tórax es habitualmente el estudio de elección para descartar metástasis pulmonares. Sin embargo la sensibilidad de una TAC es muy superior y se la debe solicitar cuando la radiografía simple deja dudas, o si se planean Es fundamental para la elección del tratamiento quirúrgico y la estrategia de adyuvancia. Las lesiones ubicadas a menos de 10 cm. (aproximadamente el 50% del total de casos) son pasibles de evaluación a través del tacto rectal y la ecografía endorrectal. El tacto rectal efectuado por cirujanos entrenados ha demostrado tener igual o mayor seguridad para evaluar la distancia al margen anal, el grado de movilidad, el patrón de crecimiento, el tamaño y la ubicación. En la mujer el tacto vaginal per mite evaluar el compromiso de la pared posterior de vagina. 2 III-370 cirugías ampliadas o resección de otras metástasis. El dosaje de los marcadores tumorales CEA y CA 19-9 complementan la rutina pre-opertatoria. tumor primario TX tumor primario no evaluado T0 sin evidencia de tumor primario Tis carcinoma in situ: intraepitelial o invasión de la lámina propia T1 tumor invade la submucosa T2 tumor invade la muscular propia T3 tumor invade hasta la subserosa, o hasta grasa pericólica o perirrectal no peritonizadas T4 tumor invade otros órganos o estructuras, y/o perfora el peritoneo visceral EStADIfICACIóN poSt-opERAtoRIA La correcta estadificación histopatológica post-operatoria permite establecer las estrategias de manejo de los pacientes así como comparar diferentes tratamientos. Lamentablemente no existe un sistema utilizado universalmente. Mientras en la Argentina los sistemas más utilizados son los de Dukes y de Astler y Coller el sistema exigido por las revistas internacionales es el denominado TNM propuesto por la de la American Joint Committee on Cancer (AJCC) y la Union Internationale Contre Cancer (UICC). En una reciente revisión de nuestra casuística se detallan los diferentes sistemas y sus características28. En modo resumido se debe recordar que durante muchos años se le asignó importancia a la localización de las metástasis. Así la clasificación de Dukes (1935) estratifica los casos en C1 (metástasis en ganglios peri-rectales) y C2 (metástasis en ganglios apicales). Si bien numerosas series demostraron una clara diferencia en el devenir de estos grupos, más recientemente se acumuló evidencia de que es el número total de ganglios comprometidos más que la localización la variable asociada al pronóstico (los casos C2 tiene un promedio de ganglios positivos superior al C1) observándose que los pacientes con más de 3 ganglios metastásico tienen similar pronóstico que aquellos con compromiso del ganglio apical28. De acuerdo a la actual versión del sistema TNM publicada en el año 2002, el estadio III se estratifica sólo en base al número de ganglios afectados (Tabla 1) Ganglios linfáticos Nx ganglios regionales no evaluables N0 ganglios regionales sin metástasis N1 metástasis en 1 a 3 ganglios N2 metástasis en 4 ó mas ganglios metástasis a distancia Mx metástasis a distancia no evaluables M0 sin metástasis a distancia M1 metástasis a distancia Estadios tNm 0 Tis I T1-T2 II T3-T4 III cualquier T IV cualquier T Dukes N0 N0 N0 N1-N2 cualquier N Mo M0 M0 M0 M1 A B C D Tabla 1: Sistema TNM y su correspondiente correlación con la clasificación de Dukes. tRAtAmIENto LoCALES 3. CoNDuCtA y tRAtAmIENto Las opciones incluyen la resección local transanal, la resección por rectotomía posterior, la electrocoagulación o fulguración, la radioterapia intracavitaria, la resección endoscópica con rectoscopio urológico y con instrumental microquirúrgico, la recanalización con laser y la colocación de stent. De todas estas modalidades, la de mayor aceptación es la resección local por vía transanal. A diferencia de las otras técnicas permite estudiar la totalidad de la pieza de resección y estadificar más correctamente el tumor. La mayor desventaja en relación a las resecciones mayores es la falta de linfadenectomía. La probabilidad de que existan metástasis ganglionares cuando la penetración en profundidad del tumor alcanza sólo a la submucosa (T1) varia entre el 0 y 12% y cuando llega a la capa muscular propia sin traspasarla (T2) entre el 12 y 28%20-9. Si la lesión es poco diferenciada, de tipo mucosecretor, o invade canales linfáticos la probabilidad de metástasis ganglionares llega al 27%5. Por estas razones, la selección de los casos es cru- Generalidades: las opciones terapéuticas van desde procedimientos menores como la resección local hasta las resecciones abdominales extendidas a otros órgano. Si bien en casos seleccionados es posible efectuar resecciones locales con fines curativos, la gran mayoría de los tumores rectales deben ser abordados por vía abdominal con la finalidad de realizar una linfadenectomía adecuada. El advenimiento de las suturas mecánicas así como la evidencia sobre la seguridad con márgenes distales menores redujeron la indicación de la amputación abdominoperineal a favor de la resección anterior. Diversas modalidades de terapia radiante y de quimioterapia, pueden contribuir en diversas fases del tratamiento, aumentando los índices de resecabilidad, incrementando los índices de sobrevida alejada, o reduciendo las posibilidades de recidiva loco-regional. 3 III-370 cial para obtener resultados adecuados. La lesiones deben cumplimentar los siguientes criterios: a) tamaño no mayor de 3 ó 4 cm, b) crecimiento exofítico, c) T1 o T2 superficial, d) ausencia ecográfica de adenopatías, e) biopsia de adenocarcinoma bien o moderadamente diferenciado, sin parámetros histológicos adversos (invasión vasculolinfática, mucosecresión) y f) borde inferior de la lesión a 7 ó menos cm del margen anal. La preparación mecánica y la antibiótico profilaxis es la misma que la utilizada en resecciones abdominales. El cateterismo vesical es de rutina. En relación a los aspectos técnicos la posición del paciente depende de la ubicación de la lesión (decubito prono para lesiones anteriores y supino para las posteriores). Debe contarse con una variedad de separadores anales a fin de lograr el campo mas óptimo en cada caso. La resección debe incluir un margen circunferencial de por lo menos 1 cm y en profundidad debe extirparse todo el espesor de la pared rectal con su grasa perirrectal. La brecha se sutura en forma contínua o discontínua con material reabsorbible 2/0 o 3/0 con la precaución de no estenosar la luz. La pieza de resección debe montarse sobre una plancha de tergopor o similar fijando sus márgenes con alfileres o agujas. Esto es imprescindible para el estudio de los márgenes de resección y para determinar el grado de penetración parietal. El post-operatorio cursa con molestias mínimas y el paciente puede ser dado de alta a las 24 hs. No es necesario indicar medicación para retardar la evacuación. El seguimiento posterior debe ser mensual durante el primer año, a fin de detectar tempranamente una recidiva pasible de ser resecada nuevamente en for ma local. En relación a los resultados a largo plazo, si bien Morson (1997) reportó que en los tumores T1-T2 N0 la resección local ofrece los mismos resultados que una resección mayor, más recientemente, se han publicado índices de recurrencia de hasta el 47 % cuando existe compromiso de la muscular propia6. En la actualidad la tendencia es considerar a la resección local como tratamiento suficiente en tumores T1 y se sugiere tratamiento complementario con radioquimioterapia postoperatoria en el caso de los T2. Por su parte en los tumores muy avanzados o localmente irresecables, las opciones son una colostomía proximal o la colocación de un stent. Si bien esta última alternativa es atrayente, su alto costo así como complicaciones tales como migración, perforación rectal y oclusión han limitado su uso. Fig. 1. Sección de la arteria mesentérica inferior y del colon. Fig. 2. Disección posterior del recto. Conservación de plexos autonomos. Observe los nervios presacros y el ureter izquierdo. tomosis colorrectal mecánica y facilita el posicionamiento del segundo ayudante. La incisión mediana extendida hasta al pubis es la que ofrece mejor vía de acceso. Finalizada la exploración abdominal, se comienza por la movilización del colon izquierdo por sus planos de coalescencia. Cuando el sigma o el colon descendente son redundantes puede obviarse la movilización del ángulo esplénico. En caso de anastomosis muy bajas o coloanales dicha movilización fue necesaria en el 75 % de los casos de nuestra serie. Una vez identificado el uréter se procede a ligar la arteria mesentérica inferior. La ligadura por debajo del nacimiento de la cólica izquierda superior es suficiente para los fines oncológicos, sin embargo a veces es necesario RESECCIoNES ABDomINALES CoN ExCISIóN DEL mESoRRECto Es la técnica standard en el tratamiento del cáncer de recto. La posición de Lloyd Davis per mite el acceso transanal en general necesario para efectuar una anas4 III-370 Fig. 3. Tecnica de la disección pelviana. Presenta una superficie lisa y brillante. 1) Lipoma bilobulado. 2) Fascie propia. Fig. 4. Resección total del mesorecto. realizarla a nivel de su nacimiento para per mitir el descenso del colon a la pelvis. Ya a este nivel es preciso identificar los filetes autónomos que mas abajo van a confluir en el plexo hipogástrico superior y respetarlos siempre que no se encuentren infiltrados por el tumor, esto contribuye a mantener la disección en el plano adecuado. Una vez ligado el pedículo vascular principal se debe seleccionar el punto donde se seccionará proximalmente el colon, se procede entonces a seccionar la arcada marginal y a verificar su sangrado arterial activo (Fig. 1). Consideramos de extrema utilidad seccionar (entre clamps de De Martel o similares) el colon a resecar en este momento, lo que facilita la posterior movilización rectal. Para asegurarse de que el colon proximal va a llegar sin tensión hasta el nivel del ano, basta con extender el colon movilizado sobre el campo operatorio y comprobar que sobrepasa el extremo inferior del pubis. La posición de Trendelenburg per mite desplazar las asas delgadas y el cabo proximal hacia arriba y exponer la pelvis. El peritoneo pelviano debe ser incidido a ambos lados de la unión rectosigmoidea prosiguiendo hasta el fondo de saco de Douglas. A ese nivel la sección del peritoneo debe realizarse en la vertiente vesical del fondo de saco de Douglas para entrar correctamente en el plano de disección. Por detrás, el mesosigma y el mesorrecto son separados de sus fijaciones posteriores en un plano inmediatamente superficial al de los ner vios presacros, los que deben ser identificados y respetados (Figs. 2 y 3). La tracción divergente per mite progresar distal y lateralmente en este plano movilizando el recto y su meso envueltos en su fascia propia (o fascia visceral), y dejando indemne la fascia parietal (o endopelviana) y los ner vios autónomos que transcurren con a la misma. Toda esta disección debe ser realizada bajo estric- to control visual lo que exige iluminación adecuada y su ejecución a tijeras o electrobisturí evitando la disección roma manual que habitualmente resulta en la disrupción del mesorrecto y en la violación de los planos oncológicamente adecuados. El plano de la disección sólo debe modificarse si en algún cuadrante la extensión tumoral va mas allá del mesorrecto. Cuando la disección posterior y lateral ha avanzado hasta por debajo del promontorio, se pasa al plano anterior. En el hombre se identifican y se dejan hacia delante las vesículas seminales apareciendo por debajo y atrás la fascia de Denonvilliers. Si el tumor asienta en la cara anterior del recto extraperitoneal conviene progresar con la disección por delante de dicha fascia, entre ella y la próstata. La disección debe progresar hasta el nivel de la uretra membranosa la que puede ser identificada por la palpación de la sonda de Foley por debajo de la próstata. Si el tumor no asienta en la cara anterior del recto, la fascia de Denonvilliers es seccionada inmediatamente por debajo del nivel de las vesículas seminales y la disección se progresa entre dicha fascia y la cara anterior del recto. En la mujer se identifica la cara posterior de la vagina inmediatamente por debajo del cuello uterino, la fascia de Denonvilliers es más delgada y cubre la cara posterior de la vagina. El plano de disección se continúa por delante o detrás de la fascia de Denonvilliers de acuerdo a que el tumor se localice en la cara anterior o no. Para completar la disección posterior se debe seccionar el ligamento rectosacro, con lo que se llega al plano del elevador. La sección de los alerones laterales completa la movilización hasta el plano del elevador. Debe tenerse en cuenta que no en todos los tumores de recto se requiere una movilización completa del recto extraperitoneal. Esto depende de la localización 5 III-370 Fig. 5. Lavado transanal del recto. del tumor y de la confor mación de la pelvis. En los tumores del tercio superior y particular mente en la mujer es posible seccionar el mesorrecto 5 cm por debajo del tumor disecando apenas por debajo de la plica peritoneal. En el hombre por el contrario para poder seccionar el mesorrecto 5 cm por debajo del tumor aun en tumores del tercio superior se hace necesario a veces movilizar el recto en su totalidad, pero habitualmente no es preciso ligar los alerones laterales. En tumores del recto medio e inferior la disección habitualmente requiere la sección de los alerones para resecar la totalidad del mesorrecto (Fig. 3). Una vez completada la movilización y antes de seccionar el recto es conveniente colocar un clamp en L por debajo del tumor y efectuar una irrigación a través de un anoscopio para arrastrar posibles restos de tumor que se hayan desprendido hacia la luz. Este lavado puede realizarse con agua corriente, agua destilada, solución fisiológica o con soluciones citolíticas (Fig. 5) Fig. 6. Tecnica de doble sutura mecánica que altura se ha realizado el ajuste, pues con la fuerte tracción hacia proximal del cabo distal, el cierre puede haber quedado excesivamente bajo impidiendo realizar una anastomosis adecuada. Alternativamente al cierre mecánico puede realizarse una jareta distal con nylon monofilamento cero en forma transabdominal cuando la anastomosis es alta o por vía transanal cuando es baja (Fig. 7). En los últimos años en todas las anastomosis coloanales de nuestra serie se utilizó la técnica de doble sutura mecánica con resultados muy satisfactorios. ANAStomoSIS DIRECtA o CoN RESERVoRIo Las anastomosis ultrabajas y las colo-anales se acompañan con frecuencia del llamado “síndrome de la resección anterior baja” caracterizado por evacuaciones fraccionadas y por urgencia evacuatoria. Esto ha sido atribuido fundamentalmente a la pérdida de la capacidad de reser vorio rectal. Para contrarrestar este problema Lazorthes15 y Parc22 describen en 1986 en forma independiente, los resultados obtenidos con la confección de un reser vorio colónico en J (Fig. 8). A partir de entonces los reportes con el uso de reser vorios han demostrado sus ventajas sobre la anastomosis directa14. El número de deposiciones tanto diurnas como nocturnas, así como la urgencia evacuatoria resultaron ser significativamente menores en los pacientes con reser vorio. La calidad de la continencia también fue mejor en los casos con reser vorio. Sin embargo todas estas diferencias son más acentuadas durante el primer año del postoperatorio y desaparecen casi por completo después del segundo año. Un problema que se presenta en el 10 a 15 % de los pacientes con reser vorio es la dificultad para iniciar la evacuación, la que obliga a la colocación de una enema o supositorio para tal fin. tÉCNICAS CoN CoNSERVACIóN DEL ANo Anastomosis manual o mecánica: las condiciones para efectuar una anastomosis son lograr un margen oncológico suficiente y que la función esfinteriana sea adecuada. Las anastomosis a 10 o más cm del margen y las colo-anales pueden realizarse con similares resultados en forma manual o mecánica. Sin embargo esta última opción es siempre preferible (e indispensables en las anastomosis ultrabajas) por su mayor rapidez y menor contaminación. Cuando se realizan en forma mecánica lo ideal es el cierre del muñón rectal con sutura mecánica lineal y luego la reconstrucción con sutura circular (técnica de doble sutura mecánica) (Fig. 6). De esta forma no se abre el recto y se resuelve la eventual desigualdad de cabos. La única desventaja es que al tener que desmontar el yunque del aparato circular la introducción anal y la progresión en el recto puede ser más traumática. Antes de efectuarse el disparo lineal es necesario controlar mediante un tacto rectal a 6 III-370 Fig. 7. Anastomosis coloanal manual. Ciertos aspectos que se discuten respecto a la confección de los reser vorios son el tamaño que deben tener y hasta que distancia del margen anal la reconstrucción con reser vorio brinda mejores resultados funcionales que los de las anastomosis directas. Con relación al tamaño, en general se aconseja el reser vorio de 6 a 8 cm de lado. Sin embargo Banerjee1 y Parc21, proponen como medida optima la de 8 a 10 cm, lo que le otorga al reser vorio una capacidad de 60 a 105 sin distensión. Hida y cols.11, comparan los resultados de reser vorios de 5 cm y de 10 cm y concluyen que la dificultad para expulsar un balón fue significativamente mayor en los reser vorios de 10 cm y que en el test de expulsión de una solución salina la eliminación del líquido inyectado fue mas completa con los reser vorios de 5 cm. En nuestra serie, con reser vorios de 8 a 10 cm, solo uno de 15 casos tuvo dificultades para iniciar la evacuación. Para decidir el tamaño del reser vorio tomamos en cuenta las características del colon a descender. Si el mismo tiene paredes algo engrosadas y escaso calibre, lo confeccionamos de 8 cm, mientras que en un colon de paredes delgadas y bien distendibles preferimos hacerlo de solo 5 cm. El otro aspecto en debate es hasta que nivel de anastomosis los resultados de la reconstrucción con reser vorio superan a los de una anastomosis directa. La distancia al margen anal de las anastomosis con reser vorio reportadas en la literatura varía entre 1 y 8 cm. Un nuevo estudio de Hida y cols.12 deter mina que las ventajas funcionales de las anastomosis con reser vorio persisten hasta los 8 cm del margen anal. En las uniones mas proximales el reser vorio no otorgó beneficios sobre los obtenidos con las uniones directas. Cabe consignar que en dicho estudio todos los reser vorios se confeccionaron de 5 cm. Las reconstrucciones con reser vorio de nuestra serie se limitaron a las anastomosis coloanales o ultrabajas (hasta 5 cm del margen anal como máximo) (Fig. 9). Fig. 8. Anastomosis colocanal con reservorio colónico oStomíAS DERIVAtIVAS Las anastomosis que quedan a menos de 6 cm del margen anal o presentan dificultades en sus confección tienen una incidencia significativamente mayor de dehiscencias y de complicaciones sépticas severas. Por esta razón nuestra conducta en estos casos es realizar la desfuncionalización sistemática. Si bien la colostomía transversa y la ileostomia en asa son igualmente efectivas, tanto la confección como el cierre de una ileostomía son más sencillos y salvo en los casos donde la preparación del colon es inadecuada, es de nuestra preferencia. AmputACIóN ABDomINopERINEAL (opERACIóN DE mILES) El tiempo abdominal es idéntico al descripto para la resección anterior. Si bien la disección del recto inferior puede ser realizada desde el periné el abordaje pelviano suele ser más confiable. Así una vez completada la movilización del recto hasta el plano de los elevadores existen dos posibilidades: confeccionar la colostomia ter minal, realizar la síntesis parietal y colocar al paciente en decúbito prono o realizar el abordaje perineal modificando solamente la posición de las pierneras. De una u otra for ma se procede a incidir la piel perineal a 2 cm del ano (previo cierre del mismo con una o dos jaretas) y profundizar la disección con el cuidado de realizar la misma por detrás del coxis y de no lesionar el plano presacro. Una vez extraída la pieza se aproximan los planos perneales con suturas discontínua. 7 III-370 4. RESuLtADoS A LARGo pLAZo Los índices globales de resecabilidad oscilan entre el 85 y 95% estimándose que del 50 al 80% de las resecciones se efectúa con intención curativa y que aproximadamente en el 50 % de estos casos se alcanza la curación. Como fuera mencionado los resultados oncológicos tienen una estrecha relación con la técnica quirúrgica. Phillips y cols (1984)24, encuentran una variación de entre el 5 y el 20% de recidivas locales entre 20 cirujanos que participaron en el Large Bowel Cancer Project. Similares resultados son reportados por McArdle y Hole (1991)16. Her manek (1995)10, al analizar los datos de un estudio prospectivo y multicéntrico sobre 1121 pacientes con cáncer de recto, tratados en 7 centros alemanes de alto nivel, encuentra que la variabilidad entre los diversos centros y entre los cirujanos actuantes resultó tan importante, que ciertos pacientes a pesar de tener estadios semejantes, tenían 10 veces más riesgo de tener una recidiva local y la mitad de posibilidades de lograr la curación definitiva. Concluye que tanto la institución como el cirujano actuante constituyen por si mismos 'factores pronósticos' independientes y que los mismos deben ser tenidos en cuenta cuando se hacen estudios multicéntricos. Estima que con una óptima técnica se podría lograr una mejoría global de los resultados 4 veces superior a la que brindan las terapias adyuvantes y a un costo muy inferior. El índice más bajo de recidiva local reportados en la literatura (2.6%) fue publicado por Heald 19928 a quien se le atribuye la estandarización de la técnica de resección total de mesorrecto. En la revisión de Mc Call (1995)17, sobre 1033 pacientes tratados con esta técnica sin terapia adyuvante, el índice de recidiva local varió entre el 4 y 10 % con un promedio de 7.1%. Por el contrario en 9607 casos operados con la técnica convencional (es decir con disección roma manual para separar el recto y su meso de sus fijaciones pelvianas), el índice de recidivas fue del 17%. Por su parte, Quirke y cols. (1986)26, destacaron la importancia del “margen lateral”, tér mino que definen como la distancia entre la superficie circunferencial de la pieza de resección y el punto donde la invasión tumoral es mas profunda. En promedio dicho margen fue de 10 mm en las piezas de resección anterior y de 7 mm en las de AAP. En 27% de las piezas resecadas encontraron invasión microscópica a nivel del margen lateral y el 85% de esos pacientes presentaron recurrencia local. El índice de recidiva fue sólo del 3% cuando dicho margen fue negativo. Además de los márgenes distales y circunferenciales un factor técnico que guarda íntima relación con la aparición de la recidiva local es la apertura accidental del tumor o del recto durante la disección. Esta variable puede presentarse ocurrir por tratarse de un tumor tan avan- Fig. 9. Control radiológico de una anstomosis coloanal con reservorio colónico. y conservación esfinteriana. opERACIóN DE HARtmANN Su indicación es solo de necesidad en circunstancias tales como mala irrigación del colon a anastomosar, tensión por mesos cortos o descompensación del paciente. También puede utilizarse cuando la hipotonía esfinteriana contraindica una anastomosis. En estos casos si no hay necesidad oncológica de realizar el tiempo perineal evitar la extirpación del complejo esfinteriano disminuye la morbimortalidad. Por último si la resección es paliativa por la extensión local del tumor, puede ser preferible evitar la anastomosis para prevenir una recidiva anastomótica temprana. tRAtAmIENto QuIRúRGICo DEL RECto BAjo El abordaje de las lesiones a menos de 8 cm del margen implica una complejidad adicional por múltiples razones (dificultad de disección pelviana, confección anastomótica, mayor índices de morbimortalidad temprana y alejada). Para definir la estrategia de tratamiento (protocolo de adyuvancia, técnica quirúrgica, etc.) uno de los factores de mayor importancia es la distancia del tumor al margen anal. Si esta supera los 5 cm es prácticamente seguro que se podrá realizar una resección con conser vación esfinteriana, que preferentemente será una resección anterior con anastomosis mecánica. En esta situación, los resultados oncológicos son idénticos a los de una amputación abdomino-pelviana. En los tumores más bajos que no comprometen el elevador puede realizarse una anastomosis cuando se lograr obtener un margen distal de 2 cm. De lo contrario se debe efectuar una amputación abdóminoperineal. Muchas veces la decisión sólo puede tomarse una vez finalizada la movilización total del recto hasta el nivel del elevador. 8 III-370 zado que al movilizarlo inevitablemente se abre, o lo que es mas habitual se produce al realizar maniobras intempestivas de disección roma manual en los intentos de movilizar el tumor. Patel (1977)23 encuentra que sobre 57 casos en que se perforó el tumor, 34 (60%), desarrollaron recidiva local. Phillips (1984)24 refiere 28% de recidivas locales cuando hubo perforación tumoral y 11% cuando no la hubo. Zringibl (1990)32 reporta 51% de recidivas locales (46/91) en presencia de perforación tumoral y 20.6% (219/1062) en su ausencia. Porter (1996), en 178 amputaciones abdominopelvianas encuentra 42 casos de aperturas accidentales con un índice de recidivas del 54% versus 17% en ausencia de este factor. En nuestra serie detectamos 12 casos con apertura accidental sobre un total de 330 resecciones con intención curativa (3.6%). En 6 de los 12 casos (50%) se presentó una recidiva pelviana. Destacamos que de estos 6 pacientes, 1 pertenecía al estadío 'A' de Dukes ( fue la única recidiva local obser vada en el estadío 'A') y 3 correspondieron al estadío 'B' comprendiendo 3 de las 7 recidivas locales obser vadas en este estadío. ciente 7 a 10 días más tarde o en un largo plazo (42-50 Gy en 4-6 semanas) y programando la cirugía 4-6 semanas luego de finalizado. En este último caso se asocia la administración de 5 fluoruracilo que puede combinarse con leucovorina. Si bien los mayores beneficios de los esquemas de radioterapia se ven en series con alto índice de recidiva local (20-25%) en los que no se efectúan resecciones totales de mesorrecto, un importante estudio holandés demostró que el esquema de radioterapia corta redujo la recidiva local del 8.2% al 2.4%13. Sin embargo, cuando los índices basales son tan bajos debe considerarse la proporción de pacientes que deben someterse a los riesgo de las complicaciones tempranas y tardías de la radioterapia para evitar una recidiva. En el mencionado estudio holandés la estimación es que se requirió irradiar 17 casos para evitar 1 recurrencia. Es por eso que cada grupo quirúrgico debiera establecer sus resultados y seleccionar apropiadamente los caos de alto riesgo para recidiva. En nuestro grupo2 el índice de recidiva local actuarial a 5 años alcanzó al 9.3% en un análisis de 417 resecciones por cáncer de recto, realizadas con criterio curativo y sin el uso de radioterapia pre o post-operatoria. En los estadios I II y III los índices de recidiva local fueron: 3.1%, 4.1% y 24% (p< 0.01). Los factores que mostraron mayor correlación con la presentación de recidiva local fueron el estadio ganglionar: N0: 4.1%, N1: 12.6%, N2: 32.1% y N3: 59.3%, y la localización del tumor: recto superior: 5.1%, recto medio: 7.1% y recto inferior 17.9% (p<0.01). Ajustada por estadio esta diferencia sólo se mantuvo para los pacientes con ganglios positivos. En base a estos índices limitamos la indicación del tratamiento combinado preoperatoria para casos localmente avanzados resecabilidad dudosa4-21 y post-opoeratorio para los tumores con metástasis ganglionares u otro factor de riesgo (bajo grado de diferenciación, invasión vascular o perineural, apertura accidental intraoperatoria). En casos seleccionados utilizamos el protocolo de radiación pre-operatoria corta. tRAtAmIENtoS ADyuVANtE y NEo-ADyuVANtE A pesar de los numerosos estudios publicados no hay evidencia concluyente sobre cual es el mejor protocolo a implementar. Las opciones son múltiples. Durante muchos años el esquema más utilizado fue el propuesto por el Instituto Nacional de la Salud Americano fundamentado en estudios randomizados que demostraron la eficacia de la combinación de radioterapia (45 50 Gy en 5 semanas en fracciones diarias de 180 - 200 rads) y quimioterapia postoperatoria (5 fluorouracilo por infusión continúa) en pacientes con tumores en estadios TNM II y III. Posterior mente se acumuló evidencia a favor de irradiación preoperatoria27. Independientemente de la for ma de fraccionamiento y del índice de recurrencia, varios autores publicaron mejoras de hasta un 50% en el índice de recidiva y aumentos significativos en los índices de resecabilidad y conser vación esfinteriana. La principal ventaja de la radiación preoperatoria respecto a la postoperatoria es que actúa sobre tejidos bien oxigenados y por lo tantos mas sensibles a su acción y que el intestino delgado se mantiene alejado de su campo de acción por lo que las enteritis actínica resulta menos frecuente. Sus mayores desventajas es la dificultad para seleccionar adecuadamente los casos a fin de evitar irradiar a pacientes que no se van a beneficiar con el tratamiento y el aumento de complicaciones tales como dehiscencia anastomótica y falta de cicatrización perineal. La administración pre-operatoria se puede realizar en un corto plazo (25 Gy en 1 semana) operando al pa- SEGuImIENto ALEjADo y tRAtAmIENto DE LAS RECIDIVAS De los pacientes que presentan recurrencia de la enfer medad solo una pequeña proporción puede alcanzar la curación mediante nuevos tratamientos. Surge por ello el interrogante sobre la conveniencia o no del seguimiento alejado; si bien las opiniones son disidentes, la mayoría considera que se lo debe realizar y especialmente en los pacientes que han sido sometidos a cirugía con intención curativa. Su objetivo principal es la detección en etapa mas precoz de: a) recidivas locales, b) metástasis, c) lesiones metacrónicas y d) neoplasias en otros órganos. Objetivos adicionales y no menos im9 III-370 portantes son: e) evaluar los resultados obtenidos para control propio y para compararlos con otras series y f) brindar apoyo psicológico al paciente. Hay distintos programas en lo referente al tipo y la frecuencia de los estudios a realizar, pero todos concuerdan en que los controles deben ser mas estrictos durante los tres primeros años. Se sabe que el 50% de las recurrencias ocurren antes de los 18 meses y el 90% antes de los tres años. La mayor parte de los esquemas de seguimiento incluye controles cada tres o cuatro meses en los primeros tres años, cada 6 meses durante el cuarto y quinto años y anualmente de allí en adelante. Cada control debe incluir el interrogatorio, el examen físico y una deter minación de antígeno carcinoembrionario (CEA), agregando un tacto rectal y endoscopía rígida. Otros marcadores tumorales como el CA 19-9 y el TPA (antígeno polipéptido tisular) no han demostrado ventajas sobre el CEA. Las elevaciones mas marcadas de CEA corresponden habitualmente a la presencia de metástasis hepáticas, la recurrencia local por el contrario, puede cursar con cifras nor males. El CA 19-9 parece ser algo mas específico para la detección de recidiva local. Ante toda elevación del CEA, o del CA 19-9 confir mada al menos por una segunda deter minación, el enfer mo debe ser reevaluado agresivamente, si aun asi no puede demostrarse una recidiva, esta indicada su reexploración quirúrgica. Otros estudios incluidos en los controles de seguimiento son la ecografia hepática, la tomografía de abdomen y pelvis y la radiología de tórax, se los solicita en general cada 6 a 12 meses. La ecografía endorrectal, a demostrando valor como método auxiliar en la detección precoz de recidivas locales, luego de resecciones por cáncer de recto. En mujeres sometidas a una AAP puede realizarse este estudio por vía vaginal. 4. tumoRES mENoS fRECuENtES Carcinoides: después del íleon y el apéndice, el recto es la tercer localización mas frecuente de estos tumores, también se lo puede encontrar en colon pero mucho mas ocasionalmente. La mayor parte de los carcinoides del recto se presentan como un nódulo submucoso de color amarillento. Cuando su tamaño es inferior a 2 cm, el tratamiento mas apropiado es la resección local, por la escasa frecuencia de metástasis. Los de mayor tamaño requieren una resección radical. Linfomas: comprenden menos del 0.5 % de todos los tumores colorrectales malignos. Se los considera como una localización mas de una enfer medad sistémica. Aunque la estadificación del paciente muestre que la única localización es la colorrectal, si el linfoma es de bajo grado, la radioterapia es la primer linea de tratamiento, en los de grado inter medio o alto, esta indicada la terapia quimioradiante. El tratamiento quirúrgico quedaría para las complicaciones como la hemorragia y la perforación. Sarcomas: Su frecuencia es aun menor a la del linfoma, estimandose que es inferior al 0.1 %. El mas frecuente es el leiomiosarcoma. Su tratamiento es la resección oncológica, con los criterios utilizados en los adenocarcinomas. Su pronóstico depende fundamentalmente del grado de malignidad. Las for mas de diseminación mas frecuentes son las metástasis hepáticas y la recidiva local. No hay quimioterápicos de utilidad conocida y la radioterapia parece ser poco efectiva. 10 III-370 BIBLIoGRAfíA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. local excisionfor early cancer of the colorectum. Gut. 1977; 18: 1045-1050. 20. MORSON BC. Histological criteria for local excision. Br J Surg.1985; 72 (Suppl): S53-S54. 21. NICHOLLS RJ, HALL C.Treatment of non-disseminated cancer of the lower rectum. Br J Surg. 1996; 83:15-18. 22. PARC R, TIRET E, FRILEUX P. Resection and colo-anal anastomosis with colonic reservoir for rectal carcinoma. Br J Surg 1986; 73:139-41 23. PATEL SC, TOVEE EB, LANGER B. Twenty-five years experience with radical surgical treatment of carcinoma of the extraperitoneal rectum. Surgery. 1977; 82:460-465. 24. PHILLIPS RKS, HITTINGER R, BLESOVSKY L. Local recurrence following 'curative'surgery for large-bowel cancer The rectum and rectosigmoid. Br J Surg. 1988; 71:17-20. 25. POLLET WG, NICHOLLS RJ. The relationship between the extent of distal clearence and survival and local recurrence rates after curative anterior resction for carcinoma of the rectum. Ann Surg.1983; 198: 159-163. 26. QUIRKE P, DURDEY P, DIXON MF, WILLIAMS NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection: histopathological study of lateral tumor spread and surgical excision, Lancet 1986; 2: 996-999 27. Swedish Rectal Cancer Trial. Improved survival with preoperative raditherapy in resectable rectal cancer. N Engl J Med. 1997; 336:980-7. 28. VACCARO C, BONADEO F, BENATI M, ET AL. Colorectal cancer staging reappraisal of N/PN classification. Dis Colon Rectum (en prensa). 29.- VACCARO C, BONADEO F, BENATI M. ET AL. 2002.Cáncer Colorrectal: estratificación de los pacientes con metástasis ganglionares operados con intensión curativa. Rev Argetnina Coloproct. 2002; 13 (1ª 4): 28-31 29. VERNAVA-AM ; MORAN-M; ROTHENBERGER-DA; WONG WD. A prospective evaluation of distal margins in carcinoma of the rectum. Surg-Gynecol-Obstet.1992; 175: 333-336. 30. WOLMARK N, ROCKETTE H, FISHER B, ET AL. The benefit of leucovorin-modulated fluoruracil as postoperative adjuvant therapy for primary colon cancer: Results from National Surgical Adjuvant Breast and Bowel Project protocol C-03. J Clin Oncol. 1993; 11:1879-1887. 31. ZRINGIBL H, HUSEMANN B, HERMANEK P. Intra-operative spillage of tumor cells in surgery for rectal cancer. Dis Colon Rectum. 1990; 33:610-614 BANERJEE A, PARC R. Prediction of the optimum dimensions of colonic pouch reservoir. Dis Colon Rectum 1996; 39:1293-95. BISSET I, FERNANDO C, HOUGH D. Identification of the fascia propria by magnetic resonance imaging and its relevance to preoperative assessment of rectal cancer, Dis Colon Rectum. 2001; 44:259-265 BONADEO F, VACCARO C, BENATI M, OJEA QUINTANA G. Rectal cancer: local recurrence after surgery without radiotherapy. Dis Colon Rectum. 2001; 44:374-379. ENKER-WE; THALER-HT; CRANOR-ML; POLYAKT.Total mesorectal excision in the operative treatment of carcinoma of the rectum. J-Am-Coll-Surg. 1995; 181: 335-346. FAZIO VW. Curative local therapy of rectal cancer. Int J Colorectal Dis. 1991; 6:66-73. GARCIA AGUILAR J, MELLGREN A, SIRIVONGS P y col. Local escisión of rectal cancer without adjuvant therapy. Ann Surg. 2000, 3:345-351 HEALD RJ, HUSBAND EM, RYALL RDH. The mesorectum in rectal cancer surgery - the clue to pelvic recurrence ? Br J Surg. 1982; 69: 613. HEALD RJ; KARANJIA ND. Results of radical surgery for rectal cancer. World-J-Surg. 1992; 16 :848-857. HERMANEK P, GALL FP. Early (microinvasive) colorectal carcinoma: Pathology, diagnosis and surgical treatment. Int J Colo-rectal Dis. 1986; 1: 79. HERMANEK P, WIEBELT H, STAIMMER D, RIEDL S. Prognostic factors of rectum carcinoma - experience of the German Multicentre Study SGCRC. German Study Group colo-rectal carcinoma. Tumori 1995;1 (3 Suppl): 60-64. HIDA J, YASUTOMI M, FUJIMOTO K. Functional outcome after low anterior resection with low anastomosis for rectal cancer using the colonic J pouch: prospective randomized study for determination of optimal pouch size. Dis Colon Rectum. 1996; 39:986-91 HIDA J, YASUTOMI M, MARUYAMA T. Indications for colonic J-pouch reconstruction after anterior resection for rectal cancer: determining the optimum level of anastomosis. Dis Colon Rectum. 1998;41:558-63. Kapiteijn E, Marijnen C, Nagtegaal I et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345:638-46. JOO J, LATULIPPE J, ALABAZ O, WEIS E, NOGUERAS J, WEXNER S. Long term functional evaluation of straight coloanal anastomosis and colonic J-pouch: is the functional superiority of colonic J-pouch sustained? Dis Colon Rectum. 1998; 41:740-46 LAZORTHES F, FAGES P, CHIOTASSO P, ET AL. Resection of the rectum with construction of a colonic reservoir and colo-anal anastomosis for carcinoma of the rectum. Br J Surg. 1986; 73: 136. MCARDLE CS, HOLE D. Impact of variability among surgeons on postoperative morbidity and mortality and ultimate survival. Br M J. 1991; 302:1501-1505. MCCALL-JL; COX-MR; WATTCHOW-DA. Analysis of local recurrence rates after surgery alone for rectal cancer Int-JColorectal-Dis. 1995; 10(3): 126-32 MOERTEL CG, FLEMING TR, MACDONALD JS ET AL. Levamisol and fluoruracil for adyuvant therapy of resected colon carcinoma. N Engl J Med. 1990; 322:352-358. MORSON BC, BUSSEY HJR, SAMOORIAN S. Policy of 11